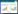扩展功能
文章信息
- 闻金萱, 杨倩玲, 陈燕, 孙萌, 王浩
- WEN Jinxuan, YANG Qianling, CHEN Yan, SUN Meng, WANG Hao
- 实时荧光重组酶聚合酶扩增技术(RPA)快速检测Ⅱ型鲤疱疹病毒
- A real-time recombinase polymerase amplification assay for the rapid detection of CyHV2
- 微生物学通报, 2021, 48(2): 676-685
- Microbiology China, 2021, 48(2): 676-685
- DOI: 10.13344/j.microbiol.china.200260
-
文章历史
- 收稿日期: 2020-03-18
- 接受日期: 2020-05-10
- 网络首发日期: 2020-08-06
2. 上海海洋大学农业部淡水水产种质资源重点实验室 上海 201306;
3. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306;
4. 上海科技大学 上海 201210
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Tech University, Shanghai 201210, China
Ⅱ型鲤疱疹病毒(Cyprinid Herpesvirus 2,CyHV2)于1995年首次在日本观赏金鱼(Carassius auratus)中发现[1]。CyHV2是一种具有囊膜的双链DNA病毒,该病毒隶属于疱疹病毒目(Herpesvirales)鱼蛙疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus),主要引起鱼类病毒性造血器官坏死病(Herpes Viral Haematopoietic Necrosis,HVHN)[2]。鲤疱疹病毒属还包括2种感染鲤科鱼类的病毒,分别为Ⅰ型鲤疱疹病毒(Cyprinid Herpesvirus 1,CyHV1)和Ⅲ型鲤疱疹病毒(Cyprinid Herpesvirus 3,CyHV3,又称锦鲤疱疹病毒KHV)[3]。3种病毒按照发现的先后顺序分别编号为CyHV1、CyHV2和CyHV3[4],且3种病毒的宿主谱具有一定的差异,CyHV1主要对鲤、圆腹雅罗鱼、鲫与金鱼杂交种敏感,CyHV3主要感染鲤、锦鲤和鲫的杂交后代、锦鲤和金鱼的杂交后代,相对于CyHV1和CyHV3的宿主谱CyHV2相对较窄,主要感染金鱼和鲫及其普通变种[5]。Davison等分析了3种病毒的代表毒株基因组情况,发现CyHV1、CyHV2和CyHV3的基因组全长分别为291 144、290 304和295 146 bp,分别具有137、150和155个开放阅读框,基因组结构和基因功能具有一定的差异性[6]。CyHV2能感染生长在不同阶段的鲫或金鱼,发病后死亡率最高可达100%,目前尚无有效的商品化防控药物[7]。另外,现有研究证实CyHV2感染宿主可引起急性感染和可持续性感染,可持续性感染在特定条件下可以转化为急性感染[8-9]。在可持续感染模式下病毒以较低的拷贝数在鱼体内复制增殖,但致死率较低且症状不明显,不易于辨识,使得该病毒极易传播。因此,建立CyHV2的分子生物学诊断技术应用于鲫和金鱼苗种养殖、流通运输和成鱼精养等环节,及时预警病毒暴发的风险,进而采取相应的措施是控制CyHV2发病和传播的有效手段。
已经报道的CyHV2的诊断方法主要包括聚合酶链式反应(Polymerase Chain Reaction,PCR)、实时荧光聚合酶链式反应(Quantitative Real-Time Polymerase Chain Reaction,qPCR)、环介导等温扩增技术(Loop-Mediated Isothermal Amplification,LAMP)、免疫组织化学染色法和血液涂片法等[10-11]。重组酶聚合酶扩增技术(Recombinase Polymerase Amplification,RPA)是一种新型的核酸扩增技术,具有反应温度恒定、反应时间短、无需昂贵精密的变温定量的PCR扩增设备等优势[12]。RPA利用3种核心酶:重组酶、单链DNA结合蛋白(Single-Stranded DNA-Binding Protein,SSB)和单链置换DNA聚合酶,其中重组酶与寡核苷酸引物形成复合物,将引物与双链DNA中的同源序列配对,从而启动链交换反应,解开的单链由单链DNA结合蛋白稳定,单链置换DNA聚合酶从引物的3′端延伸,完成DNA复制[13]。实时荧光RPA反应将Twist扩增技术与荧光TwistAmp™® Exo探针结合使用[14],应用配套的便携式核酸恒温扩增仪(T8-ISO Instrument)或参数类似的相应仪器,可在30 min内完成检测实验。RPA技术已经被应用于多种水生动物病毒检测方法的构建中,如:Xia等[15]建立了检测对虾白斑综合征病毒(White Spot Baculovirus,WSSV)的实时恒温RPA扩增技术;田城城等[16]建立了鲤春病毒血症病毒(Spring Viremia of Carp Virus,SVCV)的RPA检测方法,灵敏度可达4×103 PFU/mL。在前期的研究中,本团队应用恒温RPA结合侧向流动试纸条方案构建了一种CyHV2的试纸条诊断技术[17]。在此基础上,为开发更加快速、稳定和方便的CyHV2诊断方法,本研究基于RPA技术的荧光探针检测方案开发了一套针对CyHV2的RPA荧光检测方法。
1 材料与方法 1.1 材料 1.1.1 样品CyHV2病毒YC-01毒株(MN593216)分离自江苏省盐城市一发病的鲫养殖场。白斑综合征病毒(White Spot Baculovirus,WSSV)、草鱼呼肠孤病毒GCRV-JX01毒株(Grass Carp Reovirus JX01,GCRV-JX01)、鲤春病毒血症病毒(Spring Viremia of Carp Virus,SVCV)和锦鲤疱疹病毒(Koi Herpesvirus,KHV)感染的临床样本由上海海洋大学国家水生动物病原库提供。
1.1.2 主要试剂和仪器TIANamp Genomic DNA提取试剂盒,天根生化科技(北京)有限公司;PrimeScript™逆转录试剂盒,TaKaRa公司;TwistAmp™® Exo试剂盒,TwistDx公司;引物和探针由生工生物工程(上海)股份有限公司合成。荧光定量PCR仪,Bio-Rad公司。
1.2 实时荧光RPA模板的制备临床样本中CyHV2、WSSV和KHV的DNA用TIANamp Genomic DNA提取试剂盒提取。临床样本中GCRV-JX01和SVC的总RNA采用Trizol法提取,用PrimeScript™逆转录试剂盒将总RNA反转录得到cDNA,保存在−80 ℃备用。
1.3 实时荧光RPA引物和探针的设计利用PhyloSuite (V1.1.15)[18]和DNAMAN (V10.0)[19]对本实验室CyHV2 YC-01毒株(MN593216)和GenBank上CyHV2的代表毒株SY-C1 (KM200722)、ST-J1 (NC019495)、YZ-01 (MK260012)和SY (KT387800)的orf72基因进行核酸序列分析,同时构建系统发育树。结合前期研究筛选到的CyHV2的RPA反应引物[17],根据TwistDx引物和探针设计原则(https://www.TwistDx.co.uk/en/support/rpa-assay-design-2),利用线上和线下引物分析软件Primer-BLAST (http://www.ncbi.nlm.nih.gov/tools/Primer BLAST/)和Primer PREMIER V5.0[20]进行RPA反应探针的设计。实时荧光RPA探针在5′端(30 nt)携带抗原标记物FAM,通过四氢呋喃碱基位点THF连接至3′端,3′端(15 nt)用聚合酶延伸阻断基团(C3-Spacer)修饰,cactctggcgacgcgtttgtggttgaaccgcca(BHQ1-dt)c(THF)g(FAM-dT)ggaggcttcaaaggc(C3-spacer)。
1.4 实时荧光RPA反应条件的优化实时荧光RPA反应体系:上、下游引物(10 μmol/L)各2.1 μL,TwistAmp™® Exo探针(10 μmol/L) 0.6 μL,RNase抑制剂和ddH2O 12.2 μL,Rehydration Buffer 29.5 μL,加入DNA或者cDNA模板至47.5 μL,将上述混合物添加至含酶冻干粉中,最后加入MgOAc (280 mmol/L) 2.5 μL。将RPA预混物分别在33.1、33.8、34.8、37.0和37.8 ℃下反应20 min,用荧光定量PCR仪每隔20 s采集一次荧光信号,用Bio-Rad-CFX Manager (V3.1)[8]和GraphPad Prism (V7.0)[21]统计软件分析原始荧光数据。
1.5 实时荧光RPA的特异性实验该实验在实时荧光RPA反应最优条件下,选取临床样本CyHV2阳性DNA、WSSV阳性DNA、GCRV-JX01阳性cDNA、SVCV阳性cDNA和KHV阳性DNA为扩增模板,以无核酸酶水为阴性对照,评价引物和探针的特异性。临床样本分别参照下述国家检测标准进行检测验证:《GB/T 28630.2-2012白斑综合征(WSD)诊断规程:第2部分套式PCR检测法》[22],《GB/T 15805.5-2018鲤春病毒血症诊断规程》[23],《SN/T 3584-2013草鱼出血病检疫技术规范》[24],《SC/T 7212.1-2011鲤疱疹病毒检测方法第1部分:锦鲤疱疹病毒》[25]和《GB/T 36194-2018金鱼造血器官坏死病毒检测方法》[26]进行。表 1列出了CyHV2、GCRV-JX01、SVCV、KHV和WSSV的PCR引物和产物的大小。
1.6 实时荧光RPA和qPCR的灵敏性比较取感染CyHV2病毒临床样本的DNA进行梯度稀释(106−101 copies/mL)为实时荧光RPA和qPCR的模板。qPCR反应体系[8]:正、反向引物(10 μmol/L)各1 μL,SYBR Premix ExTaq 12.5 μL,CyHV2 DNA 2 μL,无核酸酶水8.5 μL。qPCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。
2 结果与分析 2.1 实时荧光RPA引物和探针的筛选利用PhyloSuite和DNAMAN软件结合GenBank在线BLAST数据库分析orf72在5个CyHV2代表性全基因组测序的毒株(MN593216、KM200722、MK260012、NC019495和KT387800)间的同源性。如图 1A所示,选取orf72相对保守区间范围设计实时荧光RPA反应的引物和探针,引物和探针序列在5个代表性毒株中均为100%一致。利用orf72阅读框表达的氨基酸序列进行系统发育树分析,如图 1B所示,CyHV1、CyHV2和CyHV3的ORF72蛋白均分别自然聚类,不同种毒株间具有一定的差异,同一种毒株不同分离株间高度保守。因此,orf72适合作为区分不同种毒株的靶向序列应用于诊断方法的构建。
|
| 图 1 实时荧光RPA引物与探针设计 Figure 1 Real-time RPA primer and probe design 注:A:orf72多序列比对:用DNAMAN软件对CyHV2的ST-J1、YZ-01、YC-01、SY和SY-C1毒株的orf72基因进行序列比对,引物和探针已在图中标出;B:系统发育树:基于鲤疱疹病毒属的10株病毒的orf72基因的氨基酸序列进行系统发育分析。Bootstrap验证次数为1 000,分支上的数值为验证可信度。比例尺表示氨基酸置换频率 Note: A: orf72 multiple sequence alignment: The orf72 genes of ST-J1, YZ-01, YC-01, SY and SY-C1 strains of CyHV2 were sequence aligned using DNAMAN software. Primer and probe sequences have been marked; B: phylogenetic tree: phylogenetic analysis based on the amino acid sequence of the orf72 gene of 10 strains of the Cyprinivirus. Bootstrap verification times are 1 000, and the value on the nodes are the verification credibility. The scale bar indicates the frequency of amino acid substitution |
|
|
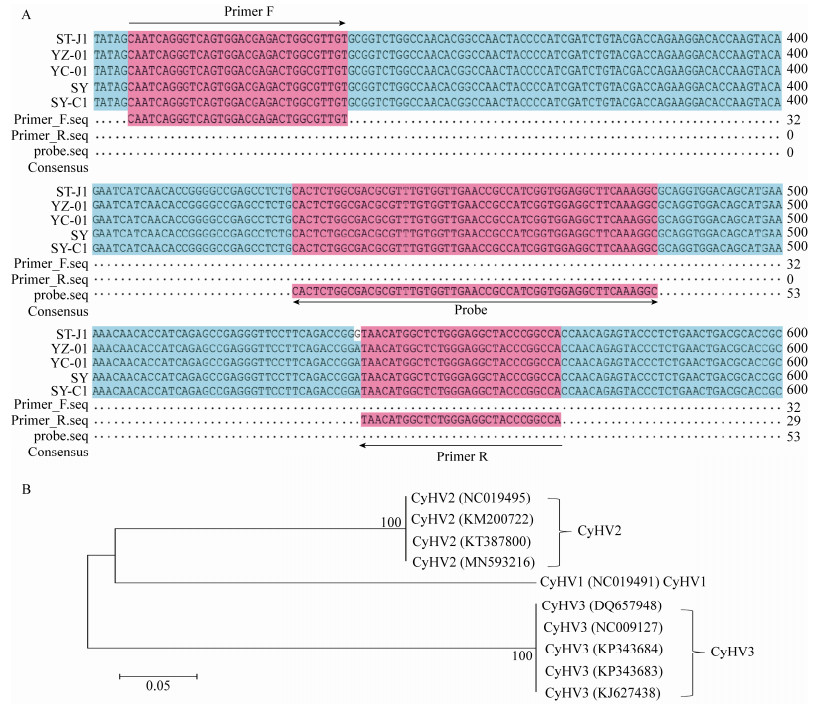
为了确定实时荧光RPA反应的最佳温度,结合仪器梯度温度设置参数区间范围,实验设定了5种不同的反应温度(33.1、33.8、34.8、37.0、37.8 ℃)。结果显示所有测试温度在高于荧光阈值的位置均有荧光信号,在33.1−7.8 ℃之间,反应于5个循环内产生了荧光信号,所有对应的阴性对照均未显示荧光信号(图 2)。37.8 ℃这2个重复组间曲线稳定性最好,而且在5个测试温度中阳性信号出峰时间最短。
|
| 图 2 实时荧光RPA反应条件的优化 Figure 2 Optimization of real-time RPA reaction conditions 注:1−5:RPA反应温度分别为37.8、37.0、34.8、33.8、33.1 ℃;NC:每个反应温度下的阴性对照;反应所需引物和探针见表 1 Note: 1−5: RPA reaction temperature is 37.8, 37.0, 34.8, 33.8, 33.1 ℃, respectively. NC: Negative control at each reaction temperature; primer and probe required for the reaction are shown in table 1 |
|
|
| Primers and probes | Sequence (5′→3′) | Size (bp) | Function |
| Real-time RPA-F | CAATCAGGGTCAGTGGACGAGACTGGCGTTGT | 252 | Real-timeRPA for CyHV-2 |
| Real-time RPA-R | CCTCCCAGAGCCATGTTACCCGGTCTGAAGGA | ||
| Real-time RPA probe | cactctggcgacgcgtttgtggttgaaccgcca(BHQ1-dt)c(THF)g(FAM-dT)ggaggcttcaaaggc(C3-spacer) | ||
| qPCR-F | CTTCACAGCCCAGCAGACA | 230 | qPCR for CyHV2 |
| qPCR-R | CATCGGCTACAGCGACTTG | ||
| Random 6 mers | (P)NNNNNN | Used in the PrimeScript reverse-transcription system | |
| GV873S10F | CGCGTTCGCTGATGTAAGG | 697 | PCR for GCRV-JX01 |
| GV873S10R | CCCCGATCATCACCACGAT | ||
| SVC-F1 | TCTTGGAGCCAAATAGCTCARRTC | 606 | PCR for SVCV |
| SVC-R4 | CTGGGGTTTCCNCCTCAAAGYTGY | ||
| CyHV-2Hel-F | GGACTTGCGAAGAGTTTGATTTCTAC | 366 | PCR for CyHV2 |
| CyHV-2Hel-R | CCATAGTCACCATCGTCTCATC | ||
| BTK-F(KHV) | GGGTTACCTGTACGAG | 409 | PCR for KHV |
| BTK-R(KHV) | CACCCAGTAGATTATGC | ||
| WSSV-F | ACTACTAACTTCAGCCTATCTAG | 1 447 | PCR for WSSV |
| WSSV-R | TAATGCGGGTGTAATGTTCTTACGA |
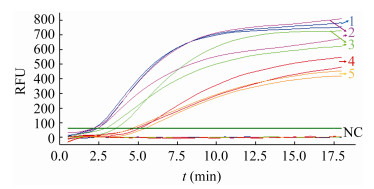
为了进一步测试反应的特异性,以鲤科鱼类常见的流行病毒以及一个虾类流行病毒株CyHV2、KHV、GCRV-JX01、SVCV和WSSV的阳性DNA或cDNA为模板,评价37.8 ℃下实时荧光RPA检测CyHV2的特异性。结果表明,荧光信号仅在含CyHV2的临床样本中观察到,而在其他临床样本和阴性对照中没有观察到荧光信号(图 3A),从而说明实时荧光RPA检测CyHV2的特异性。所有临床阳性样本均已参照国标检测步骤进行验证,阳性样品均扩增出与预期一致的阳性条带(图 3B)。
|
| 图 3 实时荧光RPA的特异性实验 Figure 3 Real-time RPA specific experiments 注:A:特异性实验:1_CyHV2阳性DNA,2_WSSV阳性DNA,3_GCRV-JX01阳性cDNA,4_SVC阳性cDNA,5_KHV阳性DNA和6_阴性对照(无核酸酶水);B:PCR验证:CyHV2,WSSV和KHV是含有相应病毒阳性DNA的临床样本,GCRV-JX01和SVC分别是含有相应病毒阳性cDNA的临床样本,NC为以无核酸酶水为模板的阴性对照,PCR扩增所用引物见表 1 Note: A: Interspecies specific experiment: 1_CyHV2 positive DNA, 2_WSSV positive DNA, 3_ GCRV-JX01 positive cDNA, 4_SVC positive cDNA, 5_KHV positive DNA and 6_negative control (nuclease-free water). B: PCR verification: CyHV2, WSSV and KHV were clinical samples containing corresponding virus positive DNA, and GCRV-JX01 and SVC were clinical samples containing corresponding virus positive cDNA, respectively. NC was the negative control with nuclease-free water as template. The primers used for PCR amplification are shown in table 1 |
|
|
为进一步评价所建立检测方法的灵敏性,以梯度稀释(106−101 copies/mL)的CyHV2阳性DNA为模板,比较所建立的实时荧光RPA和常规qPCR检测方法的灵敏度,每个阳性DNA稀释样本设置2个平行实验组。实时荧光RPA的检测限(102 copies/mL)与qPCR相同(图 4)。在第5个循环(约3 min),实时荧光RPA法就能检测到102 copies/mL的阳性DNA样本,在第10个循环(约10 min)观察到显著的结果(图 4A)。qPCR每个循环约为1 min,在20 min内未见明显阳性信号,在25 min左右出现高于阈值的稳定阳性信号,各稀释度模板间具有较好的倍性扩增关系(图 4B)。
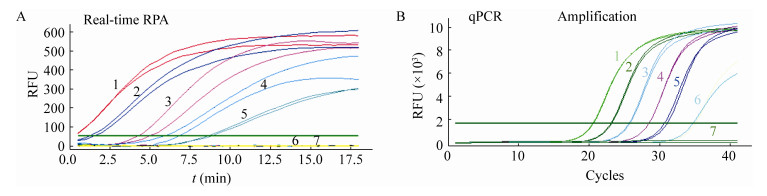
|
| 图 4 实时荧光RPA灵敏性检测 Figure 4 Real-time RPA sensitivity detection 注:1−6:CyHV2病毒阳性DNA稀释度分别为106、105、104、103、102、101 copies/mL;7:阴性对照 Note: 1−6 in A and B: CyHV2 positive DNA dilution were 106, 105, 104, 103, 102, 101 copies/mL, respectively; 7: Negative control |
|
|
近年来,对CyHV2病毒基因组学和蛋白功能的研究开展,为病毒诊断技术的开发提供了更全面的理论基础。截至目前已经公布了7株CyHV2毒株的全基因组序列,它们具有共同保守基因或同源序列,均含有12个核心基因,在核心基因表达的蛋白中ORF72为CyHV2的衣壳蛋白,其核酸在病毒粒子中稳定存在,适合作为病毒检测的靶向扩增序列[27-28]。在CyHV2实时荧光RPA引物和探针设计方面,本研究选取的5个CyHV2经典毒株orf72序列几乎完全一致,而且与CyHV1和CyHV3无任何同源序列作为引物和探针位点(图 1),保证了扩增反应的特异性。另外,CyHV2与CyHV1和CyHV3虽同为鲤疱疹病毒属成员,但基因组大小、基因组两端有无直接重复序列和基因功能等方面有显著差异[7]。在流行病学方面,2008年修订的《一、二、三类动物疫病病种名录》[29]中CyHV3归为二类动物疫病,2017年农业农村部将CyHV2和CyHV3纳入了《国家水生动物疫病监测计划》[30]方案。2011年以来中国鲫主要养殖区域CyHV2呈流行感染趋势,值得注意的是2015-2018年全国CyHV2监测数据显示,国家级原良种场、省级原良种场和重点苗种场在不同程度上出现阳性样本,平均阳性率为2.5% (4/157)[31]。CyHV2具有垂直传播的现象,原良种场和苗种场的亲本或苗种带毒将促进该病毒的扩散传播[32]。因此,开发稳定性强、灵敏度高和所需设备简单便于基层养殖场使用的CyHV2检测方法将有助于该病毒的防控。
实时荧光RPA是一种基于重组酶聚合酶的新型恒温核酸扩增技术,在RPA探针上设计淬灭基团和荧光基团,通过反应过程中释放的荧光信号,结合仪器配套的软件对检测结果进行判读[33]。普通qPCR反应需要变性、退火和延伸多个反应温度交替循环,对仪器设备控温芯片精度要求较高,短期内很难降低仪器成本。相比于qPCR扩增技术,恒温的RPA反应对仪器要求较低,而且通常在15 min左右就可以完成反应(图 2),相较于qPCR的45 min左右的反应时间提高了检测效率。但是qPCR反应中等比例稀释后的模板具有准确的梯度倍性关系可进行稳定的定量运算,而实时荧光RPA反应是基于多种聚合酶完成扩增反应,因此还不能够像qPCR一样准确地进行定量计算,所以目前RPA主要广泛应用于定性检测(图 4)。实时荧光RPA反应相较于侧向流动试纸条RPA检测方案,在结果的判读过程中结合了仪器的运算软件,样品放入仪器后全过程自动读取结果提高了结果判读的准确性,也避免了试纸条检测方案中不同技术人员对同一反应结果的人为判读误差。目前实时荧光RPA技术应用于鱼传染性造血器官坏死病毒(Infectious Hematopoietic Necrosis Virus,IHNV)[34]、鲤春病毒血症病毒(Spring Viremia of Carp Virus,SVCV)[16]、病毒性出血败血症病毒(Viral Hemorrhagic Septicemia Virus,VHSV)[35]取得了良好的检测效果,检测结果与灵敏度和qPCR相当,但检测时间缩短。另外,RPA技术与CRISPR/Cas13a相结合应用于建立分子检测平台称为“SHERLOCK”检测技术(Specific High- Sensitivity Enzymatic Reporter Unlocking),可快速灵敏地区分类似的病毒核酸,目前已应用于寨卡和登革热病毒的检测[36]。近年来,越来越多的商用便携式实时荧光RPA检测设备问世(例如T8-ISO和T16-ISO仪器),给未来实时荧光RPA检测技术的推广提供了设备支持。综上,本研究开发了一种灵敏度高、恒温和反应时间短的实时荧光RPA检测CyHV2的技术,该技术将为鱼类原良种场和成鱼养殖场、海关出入境动物疫病检疫实验室、水生动物疫病检测等机构有效实施CyHV2病毒的检测和监控以及疾病的预防提供更加简便、稳定和可靠的检测技术,同时对水生动物疫病检测技术的开发提供参考和借鉴。
| [1] |
Jung S, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.)[J]. Journal of Fish Diseases, 1995, 18(3): 211-220. DOI:10.1111/j.1365-2761.1995.tb00296.x |
| [2] |
Jeffery KR, Bateman K, Bayley A, Feist SW, Hulland J, Longshaw C, Stone D, Woolford G, Way K. Isolation of a cyprinid herpesvirus 2 from goldfish, Carassius auratus (L.), in the UK[J]. Journal of Fish Diseases, 2007, 30(11): 649-656. DOI:10.1111/j.1365-2761.2007.00847.x |
| [3] |
Zhang QY, Gui JF. Virus genomes and virus-host interactions in aquaculture animals[J]. Science China Life Sciences, 2015, 58(2): 156-169. DOI:10.1007/s11427-015-4802-y |
| [4] |
Waltzek TB, Kelley GO, Alfaro ME, Kurobe T, Davison AJ, Hedrick RP. Phylogenetic relationships in the family Alloherpesviridae[J]. Diseases of Aquatic Organisms, 2009, 84(3): 179-194. |
| [5] |
Bergmann SM, Sadowski J, Kiełpiński M, Bartłomiejczyk M, Fichtner D, Riebe R, Lenk M, Kempter J. Susceptibility of koi x crucian carp and koi x goldfish hybrids to koi herpesvirus (KHV) and the development of KHV disease (KHVD)[J]. Journal of Fish Diseases, 2010, 33(3): 267-272. DOI:10.1111/j.1365-2761.2009.01127.x |
| [6] |
Davison AJ, Kurobe T, Gatherer D, Cunningham C, Korf I, Fukuda H, Hedrick RP, Waltzek TB. Comparative genomics of carp herpesviruses[J]. Journal of Virology, 2013, 87(5): 2908-2922. DOI:10.1128/JVI.03206-12 |
| [7] |
Gui L, Zhang QY. A brief review of aquatic animal virology researches in China[J]. Journal of Fisheries of China, 2019, 43(1): 168-187. (in Chinese) 桂朗, 张奇亚. 中国水产动物病毒学研究概述[J]. 水产学报, 2019, 43(1): 168-187. |
| [8] |
Wang H, Xu LJ, Lu LQ. Detection of cyprinid herpesvirus 2 in peripheral blood cells of silver crucian carp, Carassius auratus gibelio (Bloch), suggests its potential in viral diagnosis[J]. Journal of Fish Diseases, 2016, 39(2): 155-162. DOI:10.1111/jfd.12340 |
| [9] |
Wei C, Iida H, Chuah Q, Tanaka M, Kato G, Sano M. Persistence of cyprinid herpesvirus 2 in asymptomatic goldfish Carassius auratus (L.) that survived an experimental infection[J]. Journal of Fish Diseases, 2019, 42(6): 913-921. DOI:10.1111/jfd.12996 |
| [10] |
Park YR, Kim HR, Kim SH, Lee KK, Lyoo YS, Yeo SG, Park CK. Loop-mediated isothermal amplification assay for the rapid and visual detection of novel porcine circovirus 3[J]. Journal of Virological Methods, 2018, 253: 26-30. DOI:10.1016/j.jviromet.2017.12.006 |
| [11] |
Kong SY, Jiang YS, Wang Q, Lu JF, Xu D, Lu LQ. Detection methods of Cyprinid herpesvirus 2 infection in silver crucian carp (Carassius auratus gibelio) via a pORF72 monoclonal antibody[J]. Journal of Fish Diseases, 2017, 40(12): 1791-1798. DOI:10.1111/jfd.12648 |
| [12] |
Piepenburg O, Williams CH, Stemple DL, Armes NA. DNA detection using recombination proteins[J]. PLoS Biology, 2006, 4(7): e204. DOI:10.1371/journal.pbio.0040204 |
| [13] |
Li J, Macdonald J, Von Stetten F. Review: a comprehensive summary of a decade development of the recombinase polymerase amplification[J]. Analyst, 2019, 144(1): 31-67. DOI:10.1039/C8AN01621F |
| [14] |
Daher RK, Stewart G, Boissinot M, Bergeron MG. Recombinase polymerase amplification for diagnostic applications[J]. Clinical Chemistry, 2016, 62(7): 947-958. DOI:10.1373/clinchem.2015.245829 |
| [15] |
Xia XM, Yu YX, Weidmann M, Pan YJ, Yan SL, Wang YJ. Rapid detection of shrimp white spot syndrome virus by real time, isothermal recombinase polymerase amplification assay[J]. PLoS One, 2014, 9(8): e104667. DOI:10.1371/journal.pone.0104667 |
| [16] |
Tian CC, Lan WS, Ye SG. Establishment and evaluation of a nucleic acid detection technique for spring Viraemia of carp virus based on RPA[J]. China Animal Health Inspection, 2020, 37(2): 99-106. (in Chinese) 田城城, 兰文升, 叶仕根. 基于RPA的鲤春病毒血症病毒核酸检测技术的建立与评价[J]. 中国动物检疫, 2020, 37(2): 99-106. DOI:10.3969/j.issn.1005-944X.2020.02.021 |
| [17] |
Wang H, Sun M, Xu D, Podok P, Xie J, Jiang YS, Lu LQ. Rapid visual detection of cyprinid herpesvirus 2 by recombinase polymerase amplification combined with a lateral flow dipstick[J]. Journal of Fish Diseases, 2018, 41(8): 1201-1206. DOI:10.1111/jfd.12808 |
| [18] |
Zhang D, Gao FL, Jakovlić I, Zou H, Zhang J, Li WX, Wang GT. PhyloSuite: An integrated and scalable desktop platform for streamlined molecular sequence data management and evolutionary phylogenetics studies[J]. Molecular Ecology Resources, 2020, 20(1): 348-355. DOI:10.1111/1755-0998.13096 |
| [19] |
Ji LY, Zhou AP, Yu XY, Dong ZH, Zhao HP, Xue H, Wu WJ. Differential expression analysis of the SRB1 gene in fluconazole-resistant and susceptible strains of Candida albicans[J]. Journal of Antibiotics (Tokyo), 2020, 73(5): 309-313. DOI:10.1038/s41429-020-0283-8 |
| [20] |
Qin PZ, Niu CG, Ruan M, Zeng GM, Wang XY. A novel bifunctional europium complex as a potential fluorescent label for DNA detection[J]. Analyst, 2010, 135(8): 2144-2149. DOI:10.1039/c0an00072h |
| [21] |
Wang H, Zhou ST, Wen JX, Sun M, Jiang YS, Lu LQ, Xie J. A real-time reverse-transcription isothermal recombinase polymerase amplification assay for the rapid detection of genotype Ⅲ grass carp (Ctenopharyngodon idella) reovirus[J]. Journal of Virological Methods, 2020, 277: 113802. DOI:10.1016/j.jviromet.2019.113802 |
| [22] |
The Ministry of Agriculture of the People's Republic of China. GB/T 28630.2-2012 Diagnostic protocols for white spot disease-Part 2: Nested PCR method[S]. Beijing: China Standard Press, 2012 (in Chinese) 中华人民共和国农业部. GB/T 28630.2-2012白斑综合征(WSD)诊断规程第2部分: 套式PCR检测法[S]. 北京: 中国标准出版社, 2012 |
| [23] |
The Ministry of Agriculture of the People's Republic of China. GB/T 15805.5-2018 Protocol of diagnosis for spring viraemia of carp[S]. Beijing: China Standard Press, 2018 (in Chinese) 中华人民共和国农业部. GB/T 15805.5-2018鲤春病毒血症诊断规程[S]. 北京: 中国标准出版社, 2018 |
| [24] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3584-2013 Quarantine protocol for hemorrhagic disease of grass carp[S]. Beijing: China Standard Press, 2014 (in Chinese) 中华人民共和国国家质量监督检验检疫总局. SN/T 3584-2013草鱼出血病检疫技术规范[S]. 北京: 中国标准出版社, 2014 |
| [25] |
The Ministry of Agriculture of the People's Republic of China. SC/T 7212.1-2011 Detection methods of cyprinid herpesvirus(CyHv)-Part 1: Koi herpesvirus[S]. Beijing: China Agriculture Press, 2011 (in Chinese) 中华人民共和国农业部. SC/T 7212.1-2011鲤疱疹病毒检测方法第1部分: 锦鲤疱疹病毒[S]. 北京: 中国农业出版社, 2011 |
| [26] |
Ministry of Agriculture and Rural Affairs of the People's Republic of China. GB/T 36194-2018 Detection method of goldfish haematopoietic necrosis virus[S]. Beijing: China Standard Press, 2018 (in Chinese) 中华人民共和国农业农村部. GB/T 36194-2018金鱼造血器官坏死病毒检测方法[S]. 北京: 中国标准出版社, 2018 |
| [27] |
Liu B, Zhou Y, Li K, Hu XL, Wang CL, Cao GL, Xue RY, Gong CL. The complete genome of Cyprinid herpesvirus 2, a new strain isolated from Allogynogenetic crucian carp[J]. Virus Research, 2018, 256: 6-10. DOI:10.1016/j.virusres.2018.07.016 |
| [28] |
Gao W, Wen H, Wang H, Lu JQ, Lu LQ, Jiang YS. Identification of structure proteins of cyprinid herpesvirus 2[J]. Aquaculture, 2020, 523: 735184. DOI:10.1016/j.aquaculture.2020.735184 |
Lists A, B and C diseases[J]. Chinese Journal of Animal Health Inspection, 2009, 26(2): 1 (in Chinese) 一、二、三类动物疫病病种名录[J]. 中国动物检疫, 2009, 26(2): 1 | |
| [30] |
Ministry of Agriculture and Rural Affairs of the People's Republic of China. Notice of the Ministry of Agriculture on Issuing "2017 National Aquatic Animal Disease Surveillance Plan"[Z]. 2017 (in Chinese) 农业部. 农业部关于印发《2017年国家水生动物疫病监测计划》的通知[Z]. 2017 |
| [31] |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. 2019 Analysis of Major Aquatic Animal Diseases in China[M]. Beijing: China Agricultural Press, 2019: 45. (in Chinese) 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2019我国水生动物重要疫病状况分析[M]. 北京: 中国农业出版社, 2019: 45. |
| [32] |
Goodwin AE, Sadler J, Merry GE, Marecaux EN. Herpesviral haematopoietic necrosis virus (CyHV-2) infection: case studies from commercial goldfish farms[J]. Journal of Fish Diseases, 2009, 32(3): 271-278. DOI:10.1111/j.1365-2761.2008.00988.x |
| [33] |
Yan L, Zhou J, Zheng Y, Gamson AS, Roembke BT, Nakayama S, Sintim HO. Isothermal amplified detection of DNA and RNA[J]. Molecular BioSystems, 2014, 10(5): 970-1003. |
| [34] |
Liang JN, Yin WL, Liu P, Ma XL, Duan XH, Lin S. Establishment and preliminary application of recombinase polymerase amplification method for detecting infectious hematopoietic necrosis virus[J]. Progress in Veterinary Medicine, 2020, 41(2): 14-17. (in Chinese) 梁君妮, 尹伟力, 刘鹏, 马晓玲, 段效辉, 林森. 检测鱼传染性造血器官坏死病毒重组酶聚合酶扩增方法的建立及初步应用[J]. 动物医学进展, 2020, 41(2): 14-17. |
| [35] |
Chen Y, Zheng XC, Wen ZQ, Jia P, Sun J, Mao MG, Tian CC, Huang QJ, Qin ZF, Liu H. Development of a real-time fluorescent reverse transcription recombinase polymerase amplification assay for rapid detection of viral hemorrhagic septicemia virus[J]. Veterinary Science in China, 2020, 50(4): 417-422. (in Chinese) 陈雨, 郑晓聪, 温智清, 贾鹏, 孙洁, 毛明光, 田城城, 黄倩君, 秦智锋, 刘荭. 病毒性出血败血症病毒实时荧光RT-RPA恒温检测方法的建立[J]. 中国兽医科学, 2020, 50(4): 417-422. |
| [36] |
Gootenberg JS, Abudayyeh OO, Lee JW, Essletzbichler P, Dy AJ, Joung J, Verdine V, Donghia N, Daringer NM, Freije CA, et al. Nucleic acid detection with CRISPR-Cas13a/C2c2[J]. Science, 2017, 356(6336): 438-442. DOI:10.1126/science.aam9321 |
 2021, Vol. 48
2021, Vol. 48