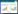扩展功能
文章信息
- 李超, 吴冕, 高鑫, 朱张亮, 路福平, 秦慧民
- LI Chao, WU Mian, GAO Xin, ZHU Zhangliang, LU Fuping, QIN Huimin
- 酶法生产稀少糖的研究进展
- Advances in enzymatic approaches to rare sugar production
- 微生物学通报, 2021, 48(2): 606-619
- Microbiology China, 2021, 48(2): 606-619
- DOI: 10.13344/j.microbiol.china.200272
-
文章历史
- 收稿日期: 2020-03-21
- 接受日期: 2020-09-02
- 网络首发日期: 2020-10-14
2. 天津科技大学生物工程学院 天津 300457;
3. 工业酶国家工程实验室 天津 300457
2. College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China;
3. National Engineering Laboratory for Industrial Enzymes, Tianjin 300457, China
在世界范围内,肥胖、高血脂、高血压、糖尿病等疾病是当今世界人类健康大敌,其发生率居高不下。这类疾病增长的主要原因是人们摄入了过多的高脂肪和高糖食物。蔗糖作为传统的食品甜味剂具有高热量和高血糖反应等缺陷,因此,低热量稀少糖因其独特的功能引起了研究者的广泛关注。根据国际稀少糖协会(International Society of Rare Sugars,ISRS)的定义,稀少糖是指自然界中存在稀少的单糖及其衍生物[1]。已知自然界中大量存在的单糖只有7种,包括D-葡萄糖、D-果糖、D-半乳糖、D-甘露糖、D-核糖、D-木糖及L-阿拉伯糖[2],而自然界中大约有50种稀少糖。虽然稀少糖在自然界中的含量很少,但其具有多种生物学功能和多方面应用价值,例如D-塔格糖是一种潜在的新型抗糖尿病和控制肥胖的药物[3]。D-阿洛酮糖的药理作用已被广泛研究,发现其具有抗肿瘤、抗炎、抗高血压和免疫抑制作用[4-5]。此外,许多糖醇,如木糖醇、甘露醇和赤藓糖醇也被广泛用作低热量的保健甜味剂[6]。这些富有前景的低热量的蔗糖替代物将有可能改变未来的甜味剂市场。
稀少糖在自然界含量极为稀少,这大大限制了其大规模的应用。传统的通过化学途径生产稀少糖涉及多步反应,涉及官能团的保护或去保护操作,而且产物纯化过程烦琐[7]。值得注意的是,利用酶技术合成稀少糖不仅具有反应条件温和、特异性强、效率高、可持续性强等优点,同时在区域选择性和立体选择性方面都具有独特的优势[8]。香川大学稀少糖研究中心(Kagawa University Rare Sugar Research Centre)的Ken Izumori教授开发了一种新颖而有效的“Izumori”策略,创造性地建立了一种新的合成稀少糖的完整策略,该策略包括醛糖-酮糖异构化、酮糖C-3异构化和单糖氧化还原[9-10]。受到“Izumori”策略的影响,许多D/L-糖如D-阿洛酮糖和L-果糖,现在已经采用各种酶生物转化过程实现了生物合成。同时,一些非“Izumori”策略的稀少糖酶法合成手段也不断涌现,主要包括醛糖差向异构化作用、磷酸化-去磷酸化级联反应、脱羧反应以及通过蔗糖磷酸化酶生物合成稀少二糖等方法策略[11-13]。本文将详细介绍稀少糖,包括D-阿洛酮糖、D-塔格糖、D-山梨糖、L-果糖、D-阿洛糖等其他稀少糖的生物学功能及应用、稀少糖相关酶的研究以及稀少糖的酶法生产。
1 D-阿洛酮糖的生物学功能、生物酶法合成及生产 1.1 D-阿洛酮糖的生物学功能及应用D-阿洛酮糖(C6H12O6)是一种低热量的单糖,是D-果糖在C-3位的差向异构体,在天然产物中几乎不存在。D-阿洛酮糖与D-果糖从肝脏中摄取葡萄糖的行为相似,因此D-阿洛酮糖能明显降低健康成年人的血糖水平[14]。同时,在食物成分中添加D-阿洛酮糖可以提高胰岛素对糖类的敏感性和葡萄糖耐量,从而降低血糖反应[15]。此外,D-阿洛酮糖还可以抑制肝脂酶活性,减少腹腔内脂肪堆积[16]。同时,其清除活性氧(Reactive Oxygen Species,ROS)的能力优于其他稀少糖[17]。
D-阿洛酮糖在抗肥胖、抗高血压、抗高脂血症、抗动脉粥样硬化等方面具有重要的临床医学应用前景[18]。不仅如此,由于其独特的物理化学性质(甜度高、溶解度高、低热量以及低的血糖反应),D-阿洛酮糖将是一种食品工业中理想的很有市场潜力的蔗糖替代品。更重要的是,D-阿洛酮糖已被美国食品和药品管理局(Food and Drug Administration,FDA)认证为普遍公认安全食品(Generally Recognized as Safe,GRAS),并被批准为膳食补充剂和食品配料[4]。
1.2 酮糖3-差向异构酶(Ketose 3-epimerase) (KEase)许多稀少糖现已通过“Izumori”策略实现了酶法生产,“Izumori”策略是利用D-塔格糖3-差向异构酶(D-Tagatose 3-Epimerase,DTE)、醛糖异构酶和多元醇脱氢酶(Poly Dehydrogenase,PHD)等进行所有单糖及糖醇之间的相互转化来制备各种稀有糖的方法。KEase是“Izumori”策略的关键,已被系统地用于稀少糖的生物合成。此外,酮糖3-差向异构酶在D-阿洛酮糖的生物合成中起着不可替代的作用,其在D-果糖和D-阿洛酮糖之间催化C3位可逆的差向异构化反应[19]。截至目前,已经筛选并鉴定了至少18种酮糖3-差向异构酶,它们对D-塔格糖、D-阿洛酮糖、D-果糖、L-核酮糖具有较高的底物特异性。基于最适底物的不同,可以将酮糖3-差向异构酶分为D-塔格糖3-差向异构酶(D-Tagatose 3-Epimerase) (DTEase,EC 5.1.3.-)、D-阿洛酮糖3-差向异构酶(D-Psicose 3-Epimerase) (DPEase,EC 5.1.3.-)和L-核酮糖3-差向异构酶(L-Ribulose 3-Epimerase) (LREase)[4]。
1.2.1 酮糖3-差向异构酶的酶学性质为了提高KEase的催化效率,研究人员对其反应条件进行了优化,主要包括反应温度、pH值和金属离子。表 1对上述18种KEase的生物化学特性以及催化效率进行了总结。
| 微生物来源 Microbial source |
最适pH Optimum pH |
最适温度 Optimum temperature (℃) |
金属离子 Required metal ion |
催化效率 kcat/Km(L/(mmol·min)) |
参考文献 References |
|
| D-allulose | D-fructose | |||||
| Mesorhizobium loti MAFF303099 | 8.0 | 60 | Mn2+ | 5.4 | - | [20] |
| Agrobacterium tumefaciens | 8.0 | 50 | Mn2+ | 205.0 | 85.0 | [21] |
| Clostridium cellulolyticum H10 | 8.0 | 55 | Co2+ | 186.4 | 62.7 | [22] |
| Ruminococcus sp. 5_1_39BFAA | 7.5-8.0 | 60 | Mn2+ | 51.0 | 16.0 | [23] |
| Clostridium scindens ATCC 35704 | 7.5 | 60 | Mn2+ | 64.5 | 8.72 | [24] |
| Clostridium sp. BNL1100 | 8.0 | 65 | Co2+ | 141.0 | 58.7 | [25] |
| Desmospora sp. 8437 | 7.5 | 60 | Co2+ | 327.0 | 116.0 | [26] |
| Clostridium bolteae ATCC BAA-613 | 7.0 | 55 | Co2+ | 107.0 | 59.0 | [27] |
| Treponema primitia ZAS-1 | 8.0 | 70 | Co2+ | 144.0 | 63.0 | [28] |
| Dorea sp. CAG317 | 6.0 | 70 | Co2+ | 412.0 | 199.0 | [29] |
| Pseudomonas cichorii ST-24 | 7.5 | 60 | - | - | - | [30] |
| Rhodobacter sphaeroides | 9.0 | 40 | Mn2+ | - | - | [31] |
| Paenibacillus senegalensis | 8.0 | 55 | Mn2+ | 39.0 | 6.7 | [32] |
| Caballeronia fortuita | 7.5 | 65 | Co2+ | - | - | [33] |
| Sinorhizobium sp. | 8.0 | 50 | Mn2+ | 118.2 | 54.6 | [34] |
| Arthrobacter globiformis M30 | 7.0-8.0 | 70 | Mn2+ | 182.7 | 66.9 | [35] |
| Flavonifractor plautii | 7.0 | 65 | Co2+ | 156.0 | 64.0 | [36] |
| Staphylococcus aureus | 7.5 | 70 | Mg2+ | 66.0 | 23.4 | [37] |
| 注:-:未报道 Note: -: Not evaluated |
||||||
在反应温度方面,各种KEase的最适催化温度在40-70 ℃之间。热稳定性是KEase实现D-阿洛酮糖实际生产的重要性能,然而所有报道的KEase都表现出较差的热稳定性。除了Mesorhizobium loti来源的LREase外,大多数KEase在温度高于50 ℃时就会快速失活[20]。在pH方面,大多数报道的KEase在弱碱性条件下(pH 7.5-9.0)表现出最佳的活性;此外,金属离子在KEase异构化中起着关键作用,不同类型的金属离子对KEase活性有不同程度的影响[20-37]。有些KEase严格依赖于金属离子,在没有金属离子的情况下酶活性为零,这可能因为酶的热稳定性和结构稳定性与金属离子密切相关[4]。在表 1中对上述KEase的催化效率(kcat/Km)进行了总结。其中,Dorea sp. CAG317来源的KEase对D-阿洛酮糖和D-果糖的催化效率最高,分别为412 L/(mmol·min)和199 L/(mmol·min)。
1.2.2 酮糖3-差向异构酶的晶体结构和分子改造(1) 酮糖3-差向异构酶的晶体结构
虽然上述KEase都可以催化将D-果糖转化为D-阿洛酮糖,但它们之间的氨基酸序列同源性存在很大差异,在23.9%-94.2%之间[4]。目前至少4种KEase的晶体结构已经得到了解析,包括来源于A. tumefaciens的DPEase (PDB: 2HK0)[38]、来源于P. cichorii的DTEase (PDB: 2QUL)[39]、来源于C. cellulolyticum的DPEase (PDB: 3VNI)[40]及来源于M. loti的LREase (PDB: 3VYL)[41]。其中,来源于A. tumefaciens和C. cellulolyticum的DPEase以及来源于M. loti的LREase被证实为四聚体结构,而来源于P. cichorii的DTEase属于二聚体结构。这4个酶结构的单体结构非常相似,每一个亚基由8个α-螺旋和β-折叠构成,α-螺旋环绕在β-折叠簇周围形成明显的TIM桶状模体。每个单体还包含着一个结合金属离子的活性位点,此位点被2个水分子以及4个完全保守的氨基酸残基(Glu150、Asp183、His209、Glu244)环绕,形成八面体结构(图 1)。其中来源于M. loti的LREase其α8螺旋和C-端比其他KEase要长很多,这也是其热稳定性较高的重要原因[41]。根据DTEase晶体结构,研究人员提出了C3-O3质子交换的催化机制:首先,一个Glu残基与Mn2+配位,使底物在C-3位置去质子化,形成cis-Enediolate中间体;然后,另一个Glu残基立即以相反方向使中间体恢复质子[39]。
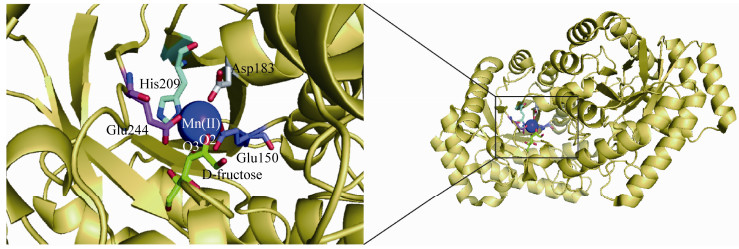
我们实验室对Rhodobacter sphaeroides来源的DTEase (RsDTE)在大肠杆菌中进行了异源表达和纯化并获得了其结晶化条件。通过模拟其三维结构模型分析发现:RsDTE具有典型的TIM桶状模体,4个相对保守的催化残基Glu156、Asp189、Gln215、Glu250与活性中心的金属离子(锰离子)结合,这些残基可能构成RsDTE的催化四分体;Arg118与D-果糖O4形成了唯一的氢键,从而使RsDTE能特异性地识别果糖,对其表现出最高的催化效率(图 2);获得的Rhodobacter sphaeroides来源的DTEase是以果糖为唯一最适底物的差向异构酶,可用于功能性D-阿洛酮糖的合成[42]。
|
| 图 2 RsDTE同源结构的带状表示(A)和活性位点(B) [42] Figure 2 Ribbon representation of the RsDTE homology structure (A) and overview of the active site (B) [42] 注:TIM桶状模体中心的β链和α螺旋分别为红色和黄色,其他的α螺旋为绿色,Loop环为白色 Note: The central β-strands and α-helices of TIM barrel-fold are shown in red and yellow, respectively. The additional α-helices are colored as green. The loops are colored as white |
|
|
(2) 酮糖3-差向异构酶的分子改造
近年来,基于基因工程和蛋白质工程的分子改造技术已广泛应用于L-阿拉伯糖异构酶和D-葡萄糖异构酶的研究当中,并已经获得了一些性能优良的突变体。然而,关于酮糖3-差向异构酶分子改造的研究还很少。Choi等(2011年)[43]利用随机定点诱变技术获得了A. tumefaciens DPEase双位点I33L/S213C突变体,突变体酶最适温度、半衰期(t1/2)和解链温度(Tm)得到了很好的改善,与野生型酶相比,I33L/S213C突变体在50 ℃时半衰期增加了29.9倍,解链温度增加了7.6 ℃。Zhang等(2016年)[44]在C. bolteae DPEase的活性口袋周围进行定点突变,得到双点突变体Y68I/G109P,显著提高了酶的催化活性和热稳定性,与野生型酶相比,Km值下降了17.9%,kcat/Km增加了1.2倍,半衰期从156 min增加到260 min,解链温度提高了2.4 ℃。以P. cichorii DTEase的耐热突变体(Var8)为模板,Bosshart等(2015年)[45]进一步研究了酶与底物结合位点周围氨基酸的随机迭代饱和突变,得到的突变体显著地提高了对D-果糖和L-山梨糖的底物特异性识别能力。2019年,我们实验室根据已有的蛋白晶体结构信息,对不同来源的DPEase进行了理性设计和定向改造,获得了对D-果糖具有较高催化效率的突变体和温度稳定性提高的突变体;通过对来源于Staphylococcus aureus的DPEase进行定点突变,获得了高催化活性的突变体V105A,其对D-果糖的相对活性提高了68%,之后将105位置的氨基酸进行饱和突变,同时获得了较高催化活性的V105G突变体[46]。同时,对该DPEase热稳定性进行改造,通过定点突变,最终获得了该DPEase的三位突变体S209C/S188D/ M190F,该突变体表现出了更高的热稳定性,其半衰期提高了2.29倍,Tm值提高了7.6 ℃[37]。同时,作者通过对来源于Rhodopirellula baltica的DPEase进行定点突变,最终得到突变体L144F,相对于野生型,该突变体在表现出更高的热稳定性的同时将D-阿洛酮糖的转化率从23.1%提到了28.6%[46]。通过对来源于Rhodobacter sphaeroides的DTEase进行定点突变获得了突变体R118W,该突变体提高了对D-果糖的底物识别能力,进而提高了对D-果糖的催化活性[42]。
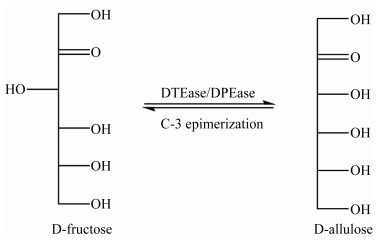
1.3 D-阿洛酮糖的酶法生产D-阿洛酮糖可以通过DTEase或DPEase在D-果糖C-3上的酶催化的差向异构化来制备(图 3),利用酶法生产D-阿洛酮糖具有商业化吸引力。
|
| 图 3 DTEase/DPEase催化的D -果糖生成D -阿洛酮糖 Figure 3 Synthesis of D-allulose from D-fructose using DTEase/DPEase |
|
|
KEase催化酮糖在C-3位置的差向异构化反应存在热力学平衡。大多数酶催化D-果糖转化为D-阿洛酮糖的最大平衡比在30:70左右。温度可能改变KEase催化的异构化过程中底物与产物的平衡比。例如,在30 ℃和60 ℃的催化条件下,C. bolteae DPEase催化D-果糖转化为D-阿洛酮糖的最大平衡比分别为23:77和32:68[27],但温度对Dorea sp. KEase的影响却不是很明显[29]。值得注意的是,因为硼酸盐与D-阿洛酮糖的结合亲和力比D-果糖强,因此在反应体系中加入硼酸盐可大大提高D-阿洛酮糖的转化率[8]。
众所周知,固定化游离酶是一种有效的酶回收和提高效率的方法。Itoh等(1995年)[47]首次报道了使用Chltopearl颗粒作为载体的BCW 2503流化床进行P. cichorii DTEase的固定化,通过该方法,在pH 7.5和45 ℃条件下连续反应10 d,可以从500 g的D-果糖转化生成90 g的D-阿洛酮糖。Tseng等(2014年)[48]将C. cellulolyticum DPEase固定在人造油体(Artificial Oil Bodies,AOB)上,反应5个循环后,酶活仍保持在酶初始活性的50%以上。孙帆等(2018年)[49]将来源于Clostridium cellulolyticum H10的DPEase基因在Bacillus subtilis中实现了异源表达,通过硅藻土-海藻酸钠(吸附包埋法)对重组细胞进行固定化,连续反应7个批次后转化率仍然为28%,仍保持81%的残余酶活,具有很高的工业应用价值。
根据“Izumoring”策略,D-阿洛酮糖可以由D-葡萄糖通过D-葡萄糖异构酶(GIase)偶联DPEase产生。Li等(2015年)[50]将Thermus thermophilus GIase和A. tumefaciens DPEase突变体(I33L/S213C)固定在酿酒酵母(Saccharomyces cerevisiaespore)孢子壁上,实现由D-葡萄糖到D-阿洛酮糖的生物合成,D-阿洛酮糖转化率达到12%。Zhu等通过将Sinorhizobium sp. DTEase基因导入到大肠杆菌中,实现了DTEase在大肠杆菌中的异源表达;利用该工程菌进行全细胞催化D-果糖,通过采用分批补料式培养方式,使得D-果糖的转化率达到了42.5%,最终生成了476 g/L的D-阿洛酮糖,与其他来源相比,这是对D-果糖转化生成D-阿洛酮糖的最大转化率[34]。
2 D-塔格糖的生物学功能以及酶法合成与生产 2.1 D-塔格糖的生物学功能及应用D-塔格糖是一种在C-4位上的果糖差向异构体,是一种含有低热量的甜味剂。其甜度是蔗糖的92%,但热量却不到蔗糖的一半(仅占新陈代谢能量的25%)[3]。2002年D-塔格糖被美国FDA认证为普遍公认安全食品(GRAS),其后D-塔格糖就被应用到糖果、饮料、营养补充剂和饮食产品中[51]。D-塔格糖在调节餐后血糖水平、控制牙病和食物饮料中的高能量摄入方面起着关键作用[3]。D-塔格糖具有低吸收率并且还抑制葡萄糖和其他物质的肠道吸收[52]。此外,D-塔格糖的摄入并不会引起健康人及I型糖尿病患者血糖变化[53]和胰岛素水平变化,其降血糖的效果明显。由于D-塔格糖是一种弱的铁螯合剂,可以拮抗肝细胞内氧化应激的铁依赖毒性作用,因此D-塔格糖也具有隔离活性氧化还原铁的抗氧化和低温保护特性[54]。
2.2 D-塔格糖的酶法合成以半乳糖醇为底物,利用半乳糖醇脱氢酶(Galactitol 2-Dehydrogenase)生产D-塔格糖是众所周知的方法。尽管该方法的转化率很高,但是由于半乳糖醇作为底物的成本太高,因此以半乳糖醇作为D-塔格糖商业化生产底物的潜力很低。值得注意的是,D-塔格糖3-差向异构酶和L-醛糖异构酶(L-Aldose Isomerases)可用于D-塔格糖的生产。另外,采用L-阿拉伯糖异构酶(L-Arabinose Isomerase,EC5.3.1.4) (L-AI)从D-半乳糖生产D-Tagatose已经得到了广泛的研究。
2.2.1 L-阿拉伯糖异构酶性质L-AI因其在稀少糖生产中的应用而受到了世界范围内研究者的广泛关注。L-AI是一种胞内酶,催化L-阿拉伯糖向L-核酮糖的聚合,将D-半乳糖转化为D-塔格糖;虽然L-阿拉伯糖是L-阿拉伯糖异构酶的天然底物,但其也可以催化D-半乳糖异构化生成D-塔格糖(图 4),这是因为它们在结构上的相似性[55]。应用L-AI将D-半乳糖生物转化为D-塔格糖是一个可行的方法,因为D-半乳糖是奶酪工业的副产品,因而成本问题可以得到很好的解决[56]。在过去的几十年里,研究人员利用了不同来源的L-AI来生产D-塔格糖,这些来源主要包括E. coli、Lactobacillus fermentum、Bacillus coagulans、Geobacillus thermodenitrificans、G. sterothermophilus、Thermotoga neapolitana、T. maritime、Anoxybacillus flavithermus等[2]。
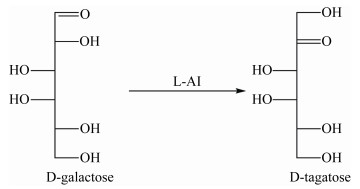
|
| 图 4 L-AI催化的D -半乳糖生成D-塔格糖 Figure 4 Synthesis of D-tagatose from D-galactose using L-AI |
|
|
目前,来源于E. coli、Lactobacillus fermentum和Geobacillus kaustophilus的L-AI的晶体结构已经得到了解析,上述3种L-AI的晶体结构都表明了L-AI均为六聚体[57-59] (图 5)。对L-AI晶体结构的解析为应用蛋白质工程工具(定向进化和位点定向诱变)来修饰酶的性质打开了大门,比如底物特异性、温度最优性、热稳定性、pH最优性和与D-塔格糖生产有关的酶活性等。研究人员对来源于G. thermodenitrificans、B. stearothermophilus和L. fermentum的L-AI进行定点突变,进一步提高了酶的催化效率和底物亲和力,而且改变了酶的最适pH[60-62]。
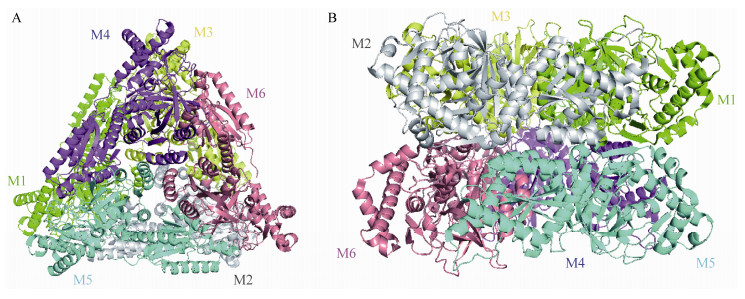
|
| 图 5 来源于Geobacillus kaustophilus的L-AI的蛋白结构 Figure 5 Overall structure of L-AI from Geobacillus kaustophilus 注:L-AI的顶视图(A)和侧视图(B)。六聚体的每个亚基的颜色分别为绿色(M1)、灰色(M2)、黄色(M3)、紫色(M4)、海蓝色(M5)和粉红色(M6) Note: Top view (A) and side view (B) of the L-AI. The six subunits are colored in green (M1), gray (M2), yellow (M3), violet (M4), aquamarine (M5), and pink (M6) |
|
|
L-AI在催化D-半乳糖转化生成D-塔格糖之间的相互转化存在热力学平衡,而且在较高温度下具有平衡向D-塔格糖的转化发生的趋势,因此,具有较好热稳定性的L-阿拉伯糖异构酶成为了首选。同时,在利用L-AI生产D-塔格糖的基础上,改进化学物质的应用、酶的固定化和蛋白质工程的应用也可以促进D-塔格糖生产。例如来源于Geobacillus thermodenitrificans的L-AI在硼酸存在的情况下可以提高D-塔格糖的产量,因为硼酸对酮糖有更高的亲和力[63]。Kim等(2003年)[64]通过将来源于G. stearothermophilus的L-AI固定化,可催化500 g/L D-半乳糖生产出230 g/L的D-塔格糖。Zhang等(2020年)[65]利用Lactobacillus plantarum来源的L-AI采用两步法催化牛奶乳清粉中的乳糖转化为D-塔格糖,最终将含有140 g/L乳糖的牛奶乳清粉转化生成了51.5 g/L的D-塔格糖,产率达到0.54 g/(L·h)。孙志军等[66] (2019年)利用Lactobacillus plantarum WU14来源的L-AI生产D-塔格糖,通过优化发酵条件,最终D-塔格糖的转化率达到69.6%。
3 D-阿洛糖(D-Allose)的生物学功能以及酶法合成及生产 3.1 D-阿洛糖的生物学功能及应用近年来,研究人员发现D-阿洛糖(D-Allose)具有多种药理活性,如抗癌、抗肿瘤、抗炎、抗氧化、降压药、低温保护剂、免疫抑制剂等功能,因此,越来越多的学者对其产生了广泛的研究兴趣[67]。D-Allose是一种低热量的单糖,具有80%的蔗糖的甜度,同时也是一种无毒单糖[67-68]。这些有益的生理特性和安全特性使其有可能应用于食品领域。此外,研究表明,D-阿洛糖可以阻止癌细胞吸收葡萄糖[69]。D-阿洛糖可与放疗结合,已证明是一种有效的癌症治疗剂;同时,D-阿洛糖联合奥沙利铂具有协同抗肿瘤作用[70]。有研究表明,D-阿洛糖具有显著降低脑前炎性细胞因子的功能,有助于在脑I/R损伤中提供神经保护[71]。有研究发现,D-阿洛糖还具有抑制秀丽隐杆线虫生长的功效[72]。
3.2 用于D-阿洛糖生产的相关酶 3.2.1 L-鼠李糖异构酶(L-Rhamnose Isomerase)L-鼠李糖异构酶(L-Rhamnose Isomerase,L-RI,EC 5.3.1.14)具有广泛的底物特异性,不仅能可逆地催化L-鼠李糖(L-Rhamnose)和L-鼠李树胶糖(L-Rhamnulose)之间的异构化反应,同时还可以催化D-阿洛酮糖和D-阿洛糖之间的异构化反应[55],在D-阿洛糖的生物生产中得到了广泛研究。L-RI是金属依赖性酶,Mn2+和Co2+对其活性具有显著激活作用。L-RI的催化反应温度较高,要求为60-85 ℃,其最佳pH为弱碱性或中性(pH 7.0-9.0)[73]。大部分L-RIs具有良好的热稳定性,有利于D-阿洛糖的生产[74]。
3.2.2 D-核糖-5-磷酸异构酶(D-Ribose- 5- Phosphate Isomerase)D-核糖-5-磷酸异构酶(D-Ribose-5-Phosphate Isomerase,RPI,EC 5.3.1.6)普遍存在于几乎所有的微生物中,参与卡尔文循环和戊糖磷酸途径。Park等(2007年)[75]首次报道了利用Clostridium thermocellum来源的RPI催化生产D-阿洛糖。之后,不断从其他微生物菌株中分离和鉴定出RPI。其中,来源于T. maritima ATCC 43589D-5的RPI对D-阿洛酮糖表现出显著的热稳定性和较高的催化活性[76],因此,利用RPI生产D-阿洛糖也是一个工业化生产的理想选择。
3.2.3 用于D-阿洛糖生产的其他酶D-半乳糖-6-磷酸异构酶(D-Galactose-6- Phosphate Isomerase) (GaPI,EC 5.3.1.26)能可逆地催化D-半乳糖-6-磷酸(D-Galactose-6-Phosphate)和D-塔格糖-6-磷酸(D-Tagatose-6-Phosphate)的异构化反应,参与D-塔格糖的代谢途径;其中,L. lactis GaPI对D-阿洛糖表现出较低的最适温度和催化效率[77]。葡萄糖-6-磷酸异构酶(Glucose-6-Phosphate Isomerase) (GlPI,EC 5.3.1.9)对D-阿洛酮糖具有较高的最适温度及温度稳定性,相对于其他已报道D-阿洛糖生产的其他酶,GlPI可成为生产D-阿洛糖的理想候选者[78]。
3.3 D-阿洛糖的酶法生产由于合成D-阿洛糖的前体D-阿洛酮糖是一种昂贵的稀少糖,考虑到生产成本,最经济的方法是使用廉价的糖,如D-葡萄糖或D-果糖作为起始原料,通过D-葡萄糖异构酶(D-Glucose Isomerase)、DTEase/DPEase和L-RI等一系列转换步骤来生产D-阿洛糖(图 6)。Menavuvu等(2006年)[79]利用固定化的P. stutzeri L-RI催化100 g/L D-阿洛酮糖转化生产D-阿洛糖,可实现25%转化率,但是有8%的D-阿卓糖(D-Altrose)副产品产生。之后将该L-RI固定在壳伯爵珠(Chitopearl)上用于大规模生产D-阿洛糖,在连续反应体系中,其转化率约为30%,生产水平达到1.65 kg的D-阿洛糖(100%纯度)[80]。B. subtilis WB600来源的L-RI对D-阿洛酮糖转化为D-阿洛糖表现出最高的转化率,其转化率达到37.5%[81]。近些年,从C. stercorarium ATCC 35414和T. composti KWC4菌株中分离纯化和鉴定出2种新的L-RI,利用这2种新酶,分别实现了33%和23%的转化率,并达到199 g/L和23 g/L的D-阿洛糖生产水平[82]。
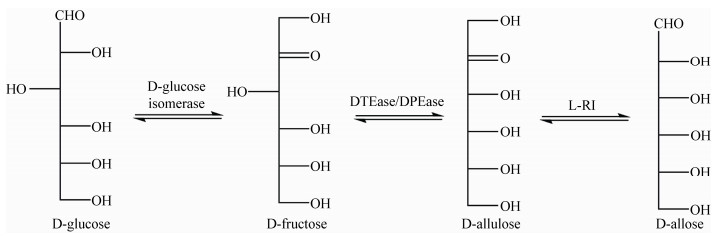
|
| 图 6 利用多种酶将D-葡萄糖转化为D-阿洛糖的酶法转化路线 Figure 6 Enzymatic route for the conversion of D-glucose to D-allose using various enzymes |
|
|
Park等(2007年)[77]利用L. lactis来源的GaPI催化100 g/L D-阿洛酮糖作用12 h生成25 g/L D-阿洛糖以及13 g/L D-阿卓糖。Park等(2007年)[75]利用C. thermocellum来源的RPI催化D-阿洛酮糖生成D-阿洛糖,转化率达33%,生产水平达到165 g/L。随后,Yeom等(2011年)[83]利用该RPI的进行定点突变体,良性突变体的转化率提高了7%。利用RPIs催化D-阿洛酮糖向D-阿洛糖的转化过程中没有副产物的产生,因此,该RPIs突变体可用于D-阿洛糖工业生产[77]。
4 D-山梨糖(D-Sorbose)和L-果糖(L-Fructose)的生物学功能以及酶法合成与生产 4.1 D-山梨糖和L-果糖的生物学功能及应用D-山梨糖(C6H12O6)是一种高水溶性的D-塔格糖衍生单糖,具有重要的工业和商业应用价值。其可以作为一种低热量的甜味剂和害虫控制剂,以及其他有用产品的基本组成物质[55]。L-果糖是一种非天然的单糖,具有多种用途。同D-山梨糖一样,L-果糖也是一种低热量甜味剂,同时可作为各种糖苷酶的抑制剂以及蚂蚁和家蝇的杀虫剂[55]。其次,L-果糖也是生产生物活性化合物的原料。
4.2 D-山梨糖和L-果糖的酶法生产通过Izumori策略,Itoh等(1995年)[84]利用固定化的Pseudomonas sp. ST-24 DTEase可直接催化D-塔格糖转化为D-山梨糖,其转化率为66%。Itoh等(1996年)[85]通过来源于Pseudomonas sp. ST-24的DTEase催化L-阿洛酮糖转化生成为L-果糖,其产率为65%。Franke等(2003年)[86]报道了磷酸二羟基丙酮(Dihydroxyacetone Phosphate)依赖性醛缩酶L-鼠甘露糖-1-磷酸醛缩酶(RhaD),其可以选择性地从外消旋甘油醛中利用L-甘油醛生产L-果糖,其产率达到55%,不过该过程需要消耗昂贵的DHAP。Sugiyama等(2006年)[87]进一步研究发现,在硼酸缓冲液存在的情况下,RhaD可以代替DHAP以二羟基丙酮(DHA)作为供体底物。基于这一发现,以DHA和外消旋甘油醛为底物建立了一种实用的L-果糖一步合成方法,其产率高达92%[70]。
5 其他稀少糖除了上述研究较多的稀少糖,还有其他稀少糖也得到了相应的研究报道。例如,同许多其他稀少糖一样,L-塔格糖(L-Tagatose)具有成为功能性甜味剂和治疗用途的潜力,但由于生物合成路线研究不充分,加上工艺成本高和原材料价格昂贵,L-塔格糖还没有得到广泛研究或商业化利用[88]。D-古洛糖(D-Gulose)和L-塔罗糖(L-Talose)是醛己糖单糖,由于它们的天然稀缺性,这2种稀少糖及其衍生物的价格非常昂贵,但它们在许多工业领域具有潜在的应用前景。比如,D-古洛糖的结晶形态可作为药物形成剂和食品添加剂;L-塔罗糖的衍生物L-Talofuranosyladenine为小牛肠腺苷脱氨酶(CIAD)的慢反应底物,因此可能被用来抑制白血病L1210细胞的体外生长[89]。Bhuiyan等(1999年)[90]报道了一种通过固定化Pseudomonas sp. strain LL172来源的L-RI来生产L-塔罗糖和D-古洛糖酶的方法。此外,L-半乳糖(L-Galactose)作为稀少糖是L-抗坏血酸生物合成的合适前体[91]。同时,L-半乳糖也是存在于血细胞上的抗原组成部分,在ABO血型系统中决定血型[92]。L-岩藻糖(L-Fucose)是一种属于脱氧糖家族天然稀有糖,在哺乳动物细胞表面和多种碳水化合物抗原中作为重要的核心部分被发现[93]。
6 展望稀少糖因其在各领域中具有十分突出和潜在的应用价值,因此,关于其制备和功能的研究已成为人们关注的热点。稀少糖利用受限的一个重要因素是其可利用性有限,这主要是由于合成生产方法有限造成的。与化学合成法比较,生物催化法更有优势,因为由酶催化的反应通常具有高度对映选择性和区域选择性。此外,酶的反应通常是在温和的条件下进行,具有环境友好的特点。然而,稀少糖的酶法生产仍存在两大挑战:(1)目前应用于稀少糖合成的微生物和相关酶来源微生物通常不满足GRAS,针对这一问题,可能会促进将相关酶引入到满足GRAS的微生物,例如枯草杆菌、乳杆菌、酿酒酵母和巴斯德毕赤酵母,用来解决稀少糖生产的安全问题;(2)许多生物酶合成方法涉及2个或多个糖之间的化学平衡(同分异构化和差向异构化),这可能导致目标产物产量低下和下游产物分离困难的问题。针对这一难题,一方面可以通过优化生产工艺来促使平衡向稀少糖方向移动,例如在催化反应系统中通过不断分离出产物的方式来打破原有平衡,促使底物向产物转化,进而提高稀少糖产量;另一方面,通过基因组学和生物工程改善现有酶的性质(活性、热稳定性或底物结合亲和力)或发现用于工业规模应用的新系统和强大的生物酶催化剂来解决这一问题。
| [1] |
Izumori K. Bioproduction strategies for rare hexose sugars[J]. Naturwissenschaften, 2002, 89(3): 120-124. DOI:10.1007/s00114-002-0297-z |
| [2] |
Zhang WL, Zhang T, Jiang B, Mu WM. Enzymatic approaches to rare sugar production[J]. Biotechnology Advances, 2017, 35(2): 267-274. DOI:10.1016/j.biotechadv.2017.01.004 |
| [3] |
Roy S, Chikkerur J, Roy SC, Dhali A, Kolte AP, Sridhar M, Samanta AK. Tagatose as a potential nutraceutical: production, properties, biological roles, and applications[J]. Journal of Food Science, 2018, 83(11): 2699-2709. DOI:10.1111/1750-3841.14358 |
| [4] |
Zhang WL, Yu SH, Zhang T, Jiang B, Mu WM. Recent advances in D-allulose: physiological functionalities, applications, and biological production[J]. Trends in Food Science & Technology, 2016, 54: 127-137. |
| [5] |
Sui L, Dong YY, Watanabe Y, Yamaguchi F, Hatano N, Tsukamoto I, Izumori K, Tokuda M. The inhibitory effect and possible mechanisms of D-allose on cancer cell proliferation[J]. International Journal of Oncology, 2005, 27(4): 907-912. |
| [6] |
Park YC, Oh EJ, Jo JH, Jin YS, Seo JH. Recent advances in biological production of sugar alcohols[J]. Current Opinion in Biotechnology, 2016, 37: 105-113. DOI:10.1016/j.copbio.2015.11.006 |
| [7] |
Emmadi M, Kulkarni SS. Recent advances in synthesis of bacterial rare sugar building blocks and their applications[J]. Natural Product Reports, 2014, 31(7): 870-879. DOI:10.1039/C4NP00003J |
| [8] |
Beerens K, Desmet T, Soetaert W. Enzymes for the biocatalytic production of rare sugars[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(6): 823-834. |
| [9] |
Granström TB, Takata G, Tokuda M, Izumori K. Izumoring: a novel and complete strategy for bioproduction of rare sugars[J]. Journal of Bioscience and Bioengineering, 2004, 97(2): 89-94. DOI:10.1016/S1389-1723(04)70173-5 |
| [10] |
Izumori K. Izumoring: a strategy for bioproduction of all hexoses[J]. Journal of Biotechnology, 2006, 124(4): 717-722. DOI:10.1016/j.jbiotec.2006.04.016 |
| [11] |
Wen LQ, Huang K, Wei MH, Meisner J, Liu YP, Garner K, Zang LL, Wang X, Li X, Fang JQ, et al. Facile enzymatic synthesis of ketoses[J]. Angewandte Chemie International Edition, 2015, 127(43): 12845-12849. |
| [12] |
Bao WL, Solheim LP, Stoddard SF. Enzymatic decarboxylation of 2-keto-L-gulonic acid to produce xylose: US 7247458[P]. 2007-07-24
|
| [13] |
Morimoto K, Yoshihara A, Furumoto T, Takata G. Production and application of a rare disaccharide using sucrose phosphorylase from Leuconostoc mesenteroides[J]. Journal of Bioscience and Bioengineering, 2015, 119(6): 652-656. DOI:10.1016/j.jbiosc.2014.11.011 |
| [14] |
Iida T, Kishimoto Y, Yoshikawa Y, Hayashi N, Okuma K, Tohi M, Yagi K, Matsuo T, Izumori K. Acute D-psicose administration decreases the glycemic responses to an oral maltodextrin tolerance test in normal adults[J]. Journal of Nutritional Science and Vitaminology, 2008, 54(6): 511-514. DOI:10.3177/jnsv.54.511 |
| [15] |
Hossain MA, Kitagaki S, Nakano D, Nishiyama A, Funamoto Y, Matsunaga T, Tsukamoto I, Yamaguchi F, Kamitori K, Dong YY, et al. Rare sugar D-psicose improves insulin sensitivity and glucose tolerance in type 2 diabetes Otsuka Long-Evans Tokushima Fatty (OLETF) rats[J]. Biochemical and Biophysical Research Communications, 2011, 405(1): 7-12. DOI:10.1016/j.bbrc.2010.12.091 |
| [16] |
Matsuo T, Izumori K. Retraction: D-psicose inhibits intestinal α-glucosidase and suppresses the glycemic response after ingestion of carbohydrate in rats[J]. Journal of Clinical Biochemistry and Nutrition, 2014, 54(3): 219. DOI:10.3164/jcbn.54-3-R1 |
| [17] |
Murata A, Sekiya K, Watanabe Y, Yamaguchi F, Hatano N, Izumori K, Tokuda M. A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils[J]. Journal of Bioscience and Bioengineering, 2003, 96(1): 89-91. DOI:10.1016/S1389-1723(03)90104-6 |
| [18] |
Kawakami K, Hasegawa Y, Zhang SL, Yoshihashi Y, Yonemochi E, Terada K. Low-density microparticles with petaloid surface structure for pulmonary drug delivery[J]. Journal of Pharmaceutical Sciences, 2014, 103(4): 1309-1313. DOI:10.1002/jps.23899 |
| [19] |
Mu WM, Yu LN, Zhang WL, Zhang T, Jiang B. Isomerases for biotransformation of D-hexoses[J]. Applied Microbiology and Biotechnology, 2015, 99(16): 6571-6584. DOI:10.1007/s00253-015-6788-6 |
| [20] |
Uechi K, Takata G, Fukai Y, Yoshihara A, Morimoto K. Gene cloning and characterization of L-ribulose 3-epimerase from Mesorhizobium loti and its application to rare sugar production[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(3): 511-515. DOI:10.1271/bbb.120745 |
| [21] |
Kim HJ, Hyun EK, Kim YS, Lee YJ, Oh DK. Characterization of an Agrobacterium tumefaciens D-psicose 3-epimerase that converts D-fructose to D-psicose[J]. Applied and Environmental Microbiology, 2006, 72(2): 981-985. DOI:10.1128/AEM.72.2.981-985.2006 |
| [22] |
Mu WM, Chu FF, Xing QC, Yu SH, Zhou L, Jiang B. Cloning, expression, and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J]. Journal of Agricultural and Food Chemistry, 2011, 59(14): 7785-7792. DOI:10.1021/jf201356q |
| [23] |
Zhu YM, Men Y, Bai W, Li XB, Zhang LL, Sun YX, Ma YH. Overexpression of D-psicose 3-epimerase from Ruminococcus sp. in Escherichia coli and its potential application in D-psicose production[J]. Biotechnology Letters, 2012, 34(10): 1901-1906. DOI:10.1007/s10529-012-0986-4 |
| [24] |
Zhang WL, Fang D, Xing QC, Zhou L, Jiang B, Mu WM. Characterization of a novel metal-dependent D-psicose 3-epimerase from Clostridium scindens 35704[J]. PLoS One, 2013, 8(4): e62987. DOI:10.1371/journal.pone.0062987 |
| [25] |
Mu WM, Zhang WL, Fang D, Zhou L, Jiang B, Zhang T. Characterization of a D-psicose-producing enzyme, D-psicose 3-epimerase, from Clostridium sp.[J]. Biotechnology Letters, 2013, 35(9): 1481-1486. DOI:10.1007/s10529-013-1230-6 |
| [26] |
Zhang WL, Fang D, Zhang T, Zhou L, Jiang B, Mu WM. Characterization of a metal-dependent D-psicose 3-epimerase from a novel strain, Desmospora sp. 8437[J]. Journal of Agricultural and Food Chemistry, 2013, 61(47): 11468-11476. DOI:10.1021/jf4035817 |
| [27] |
Jia M, Mu WM, Chu FF, Zhang XM, Jiang B, Zhou LL, Zhang T. A D-psicose 3-epimerase with neutral pH optimum from Clostridium bolteae for D-psicose production: cloning, expression, purification, and characterization[J]. Applied Microbiology and Biotechnology, 2014, 98(2): 717-725. DOI:10.1007/s00253-013-4924-8 |
| [28] |
Zhang WL, Zhang T, Jiang B, Mu WM. Biochemical characterization of a D-psicose 3-epimerase from Treponema primitia ZAS-1 and its application on enzymatic production of D-psicose[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 49-56. DOI:10.1002/jsfa.7187 |
| [29] |
Zhang WL, Li H, Zhang T, Jiang B, Zhou L, Mu WM. Characterization of a D-psicose 3-epimerase from Dorea sp. CAG317 with an acidic pH optimum and a high specific activity[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 120: 68-74. DOI:10.1016/j.molcatb.2015.05.018 |
| [30] |
Izumori K, Khan AR, Okaya H, Tsumura T. A new enzyme, D-ketohexose 3-epimerase, from Pseudomonas sp. ST-24[J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(6): 1037-1039. DOI:10.1271/bbb.57.1037 |
| [31] |
Zhang LT, Mu WM, Jiang B, Zhang T. Characterization of D-tagatose 3-epimerase from Rhodobacter sphaeroides that converts D-fructose into D-psicose[J]. Biotechnology Letters, 2009, 31(6): 857-862. DOI:10.1007/s10529-009-9942-3 |
| [32] |
Yang JG, Tian CY, Zhang T, Ren CX, Zhu YM, Zeng Y, Men Y, Sun YX, Ma YH. Development of food-grade expression system for D-allulose 3-epimerase preparation with tandem isoenzyme genes in Corynebacterium glutamicum and its application in conversion of cane molasses to D-allulose[J]. Biotechnology and Bioengineering, 2019, 116(4): 745-756. DOI:10.1002/bit.26909 |
| [33] |
Li SN, Chen ZW, Zhang WL, Guang CE, Mu WM. Characterization of a D-tagatose 3-epimerase from Caballeronia fortuita and its application in rare sugar production[J]. International Journal of Biological Macromolecules, 2019, 138: 536-545. DOI:10.1016/j.ijbiomac.2019.07.112 |
| [34] |
Zhu ZL, Li C, Liu X, Gao DK, Wang XY, Tanokura M, Qin HM, Lu FP. Biochemical characterization and biocatalytic application of a novel D-tagatose 3-epimerase from Sinorhizobium sp.[J]. RSC Advances, 2019, 9(6): 2919-2927. DOI:10.1039/C8RA10029B |
| [35] |
Yoshihara A, Kozakai T, Shintani T, Matsutani R, Ohtani K, Iida T, Akimitsu K, Izumori K, Gullapalli PK. Purification and characterization of D-allulose 3-epimerase derived from Arthrobacter globiformis M30, a GRAS microorganism[J]. Journal of Bioscience and Bioengineering, 2017, 123(2): 170-176. DOI:10.1016/j.jbiosc.2016.09.004 |
| [36] |
Park CS, Kim T, Hong SH, Shin KC, Kim KR, Oh DK. D-allulose production from D-fructose by permeabilized recombinant cells of Corynebacterium glutamicum cells expressing D-allulose 3-epimerase Flavonifractor plautii[J]. PLoS One, 2016, 11(7): e0160044. DOI:10.1371/journal.pone.0160044 |
| [37] |
Zhu ZL, Gao DK, Li C, Chen Y, Zhu ML, Liu X, Tanokura M, Qin HM, Lu FP. Redesign of a novel D-allulose 3-epimerase from Staphylococcus aureus for thermostability and efficient biocatalytic production of D-allulose[J]. Microbial Cell Factories, 2019, 18(1): 59. DOI:10.1186/s12934-019-1107-z |
| [38] |
Kim K, Kim HJ, Oh DK, Cha SS, Rhee S. Crystal structure of D-psicose 3-epimerase from Agrobacterium tumefaciens and its complex with true substrate D-fructose: a pivotal role of metal in catalysis, an active site for the non-phosphorylated substrate, and its conformational changes[J]. Journal of Molecular Biology, 2006, 361(5): 920-931. DOI:10.1016/j.jmb.2006.06.069 |
| [39] |
Yoshida H, Yamada M, Nishitani T, Takada G, Izumori K, Kamitori S. Crystal structures of D-tagatose 3-epimerase from Pseudomonas cichorii and its complexes with D-tagatose and D-fructose[J]. Journal of Molecular Biology, 2007, 374(2): 443-453. DOI:10.1016/j.jmb.2007.09.033 |
| [40] |
Chan HC, Zhu YM, Hu YM, Ko TP, Huang CH, Ren FF, Chen CC, Ma YH, Guo RT, Sun YX. Crystal structures of D-psicose 3-epimerase from Clostridium cellulolyticum H10 and its complex with ketohexose sugars[J]. Protein & Cell, 2012, 3(2): 123-131. |
| [41] |
Uechi K, Sakuraba H, Yoshihara A, Morimoto K, Takata G. Structural insight into L-ribulose 3-epimerase from Mesorhizobium loti[J]. Acta Crystallographica Section D: Biological Crystallography, 2013, 69(12): 2330-2339. DOI:10.1107/S0907444913021665 |
| [42] |
Qi ZL, Zhu ZL, Wang JW, Li ST, Guo QQ, Xu PP, Lu FP, Qin HM. Biochemical analysis and the preliminary crystallographic characterization of D-tagatose 3-epimerase from Rhodobacter sphaeroides[J]. Microbial Cell Factories, 2017, 16(1): 193. DOI:10.1186/s12934-017-0808-4 |
| [43] |
Choi JG, Ju YH, Yeom SJ, Oh DK. Improvement in the thermostability of D-psicose 3-epimerase from Agrobacterium tumefaciens by random and site-directed mutagenesis[J]. Applied and Environmental Microbiology, 2011, 77(20): 7316-7320. DOI:10.1128/AEM.05566-11 |
| [44] |
Zhang WL, Jia M, Yu SH, Zhang T, Zhou L, Jiang B, Mu WM. Improving the thermostability and catalytic efficiency of the D-psicose 3-epimerase from Clostridium bolteae ATCC BAA-613 using site-directed mutagenesis[J]. Journal of Agricultural and Food Chemistry, 2016, 64(17): 3386-3393. DOI:10.1021/acs.jafc.6b01058 |
| [45] |
Bosshart A, Hee CS, Bechtold M, Schirmer T, Panke S. Directed divergent evolution of a thermostable D-tagatose epimerase towards improved activity for two hexose substrates[J]. Chem Bio Chem, 2015, 16(4): 592-601. DOI:10.1002/cbic.201402620 |
| [46] |
Mao SH, Cheng XT, Zhu ZL, Chen Y, Li C, Zhu ML, Liu X, Lu FP, Qin HM. Engineering a thermostable version of D-allulose 3-epimerase from Rhodopirellula baltica via site-directed mutagenesis based on B-factors analysis[J]. Enzyme and Microbial Technology, 2020, 132: 109441. DOI:10.1016/j.enzmictec.2019.109441 |
| [47] |
Itoh H, Sato T, Izumori K. Preparation of D-psicose from D-fructose by immobilized D-tagatose 3-epimerase[J]. Journal of Fermentation and Bioengineering, 1995, 80(1): 101-103. DOI:10.1016/0922-338X(95)98186-O |
| [48] |
Tseng CW, Liao CY, Sun YX, Peng CC, Tzen JTC, Guo RT, Liu JR. Immobilization of Clostridium cellulolyticum D-psicose 3-epimerase on artificial oil bodies[J]. Journal of Agricultural and Food Chemistry, 2014, 62(28): 6771-6776. DOI:10.1021/jf502022w |
| [49] |
Sun F, Su LQ, Zhang K, Wu J. D-psicose 3-epimerase gene overexpression in Bacillus subtilis and immobilization of cells[J]. China Biotechnology, 2018, 38(7): 83-88. (in Chinese) 孙帆, 宿玲恰, 张康, 吴敬. D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的高效表达及固定化细胞研究[J]. 中国生物工程杂志, 2018, 38(7): 83-88. |
| [50] |
Li ZJ, Li Y, Duan SL, Liu J, Yuan P, Nakanishi H, Gao XD. Bioconversion of D-glucose to D-psicose with immobilized D-xylose isomerase and D-psicose 3-epimerase on Saccharomyces cerevisiae spores[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(8): 1117-1128. |
| [51] |
Kim P. Current studies on biological tagatose production using L-arabinose isomerase: a review and future perspective[J]. Applied Microbiology and Biotechnology, 2004, 65(3): 243-249. |
| [52] |
Patel MJ, Akhani RC, Patel AT, Dedania SR, Patel DH. A single and two step isomerization process for D-tagatose and L-ribose bioproduction using L-arabinose isomerase and D-lyxose isomerase[J]. Enzyme and Microbial Technology, 2017, 97: 27-33. DOI:10.1016/j.enzmictec.2016.11.001 |
| [53] |
Jayamuthunagai J, Gautam P, Srisowmeya G, Chakravarthy M. Biocatalytic production of D-tagatose: a potential rare sugar with versatile applications[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(16): 3430-3437. DOI:10.1080/10408398.2015.1126550 |
| [54] |
Bilal M, Iqbal HMN, Hu HB, Wang W, Zhang XH. Metabolic engineering pathways for rare sugars biosynthesis, physiological functionalities, and applications: a review[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(16): 2768-2778. DOI:10.1080/10408398.2017.1341385 |
| [55] |
Izumori K, Ueda Y, Yamanaka K. Pentose metabolism in Mycobacterium smegmatis: comparison of L-arabinose isomerases induced by L-arabinose and D-galactose[J]. Journal of Bacteriology, 1978, 133(1): 413-414. DOI:10.1128/JB.133.1.413-414.1978 |
| [56] |
Torres PR, Manzo RM, Rubiolo AC, Batista-Viera FD, Mammarella EJ. Purification of an L-arabinose isomerase from Enterococcus faecium DBFIQ E36 employing a biospecific affinity strategy[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 102: 99-105. DOI:10.1016/j.molcatb.2014.01.023 |
| [57] |
Manjasetty BA, Chance MR. Crystal structure of Escherichia coli L-arabinose isomerase (ECAI), the putative target of biological tagatose production[J]. Journal of Molecular Biology, 2006, 360(2): 297-309. DOI:10.1016/j.jmb.2006.04.040 |
| [58] |
Xu Z, Li S, Liang JF, Feng XH, Xu H. Protein purification, crystallization and preliminary X-ray diffraction analysis of L-arabinose isomerase from Lactobacillus fermentum CGMCC2921[J]. Acta Crystallographica Section F, 2015, 71(1): 28-33. |
| [59] |
Choi JM, Lee YJ, Cao TP, Shin SM, Park MK, Lee HS, Di Luccio E, Kim SB, Lee SJ, Lee SJ, et al. Structure of the thermophilic L-arabinose isomerase from Geobacillus kaustophilus reveals metal-mediated intersubunit interactions for activity and thermostability[J]. Archives of Biochemistry and Biophysics, 2016, 596: 51-62. DOI:10.1016/j.abb.2016.02.033 |
| [60] |
Kim BJ, Hong SH, Shin KC, Jo YS, Oh DK. Characterization of a F280N variant of L-arabinose isomerase from Geobacillus thermodenitrificans identified as a D-galactose isomerase[J]. Applied Microbiology and Biotechnology, 2014, 98(22): 9271-9281. DOI:10.1007/s00253-014-5827-z |
| [61] |
Rhimi M, Juy M, Aghajari N, Haser R, Bejar S. Probing the essential catalytic residues and substrate affinity in the thermoactive Bacillus stearothermophilus US100 L-arabinose isomerase by site-directed mutagenesis[J]. Journal of Bacteriology, 2007, 189(9): 3556-3563. DOI:10.1128/JB.01826-06 |
| [62] |
Rhimi M, Aghajari N, Juy M, Chouayekh H, Maguin E, Haser R, Bejar S. Rational design of Bacillus stearothermophilus US100 L-arabinose isomerase: potential applications for D-tagatose production[J]. Biochimie, 2009, 91(5): 650-653. DOI:10.1016/j.biochi.2009.01.014 |
| [63] |
Lim BC, Kim HJ, Oh DK. High production of D-tagatose by the addition of boric acid[J]. Biotechnology Progress, 2007, 23(4): 824-828. DOI:10.1002/bp070056y |
| [64] |
Kim HJ, Ryu SA, Kim P, Oh DK. A feasible enzymatic process for D-tagatose production by an immobilized thermostable L-arabinose isomerase in a packed-bed bioreactor[J]. Biotechnology Progress, 2003, 19(2): 400-404. DOI:10.1021/bp025675f |
| [65] |
Zhang GY, Zabed HM, Yun JH, Yuan J, Zhang YF, Wang Y, Qi XG. Two-stage biosynthesis of D-tagatose from milk whey powder by an engineered Escherichia coli strain expressing L-arabinose isomerase from Lactobacillus plantarum[J]. Bioresource Technology, 2020, 305: 123010. DOI:10.1016/j.biortech.2020.123010 |
| [66] |
Sun ZJ, Chen WX, Ling J, Liu ZW, Wang ZY, Zhou T, Zhong PA, Xu B. Medium optimization of L-arabinose isomerase produced by Lactobacillus plantarum WU14 with high D-tagatose yield[J]. Food Science and Technology, 2019, 44(5): 24-32. (in Chinese) 孙志军, 陈文薪, 凌锦, 刘志文, 王志云, 周通, 钟平安, 徐波. 高产D-塔格糖植物乳杆菌WU14的L-阿拉伯糖异构酶发酵培养基优化[J]. 食品科技, 2019, 44(5): 24-32. |
| [67] |
Chen ZW, Chen JJ, Zhang WL, Zhang T, Guang CE, Mu WM. Recent research on the physiological functions, applications, and biotechnological production of D-allose[J]. Applied Microbiology and Biotechnology, 2018, 102(10): 4269-4278. DOI:10.1007/s00253-018-8916-6 |
| [68] |
Iga Y, Nakamichi K, Shirai Y, Matsuo T. Acute and sub-chronic toxicity of D-allose in rats[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(7): 1476-1478. DOI:10.1271/bbb.100121 |
| [69] |
Noguchi C, Kamitori K, Hossain A, Hoshikawa H, Katagi A, Dong YY, Sui L, Tokuda M, Yamaguchi F. D-allose inhibits cancer cell growth by reducing GLUT1 expression[J]. The Tohoku Journal of Experimental Medicine, 2016, 238(2): 131-141. DOI:10.1620/tjem.238.131 |
| [70] |
Malm SW, Hanke NT, Gill A, Carbajal L, Baker AF. The anti-tumor efficacy of 2-deoxyglucose and D-allose are enhanced with p38 inhibition in pancreatic and ovarian cell lines[J]. Journal of Experimental & Clinical Cancer Research, 2015, 34(1): 31. |
| [71] |
Shinohara N, Nakamura T, Abe Y, Hifumi T, Kawakita K, Shinomiya A, Tamiya T, Tokuda M, Keep RF, Yamamoto T, et al. D-allose attenuates overexpression of inflammatory cytokines after cerebral ischemia/reperfusion injury in gerbil[J]. Journal of Stroke and Cerebrovascular Diseases, 2016, 25(9): 2184-2188. DOI:10.1016/j.jstrokecerebrovasdis.2016.01.030 |
| [72] |
Sakoguchi H, Yoshihara A, Izumori K, Sato M. Screening of biologically active monosaccharides: growth inhibitory effects of D-allose, D-talose, and L-idose against the nematode Caenorhabditis elegans[J]. Bioscience, Biotechnology, and Biochemistry, 2016, 80(6): 1058-1061. DOI:10.1080/09168451.2016.1146069 |
| [73] |
Xu W, Zhang WL, Zhang T, Jiang B, Mu WM. L-Rhamnose isomerase and its use for biotechnological production of rare sugars[J]. Applied Microbiology and Biotechnology, 2016, 100(7): 2985-2992. DOI:10.1007/s00253-016-7369-z |
| [74] |
Seo MJ, Choi JH, Kang SH, Shin KC, Oh DK. Characterization of L-rhamnose isomerase from Clostridium stercorarium and its application to the production of D-allose from D-allulose (D-psicose)[J]. Biotechnology Letters, 2018, 40(2): 325-334. DOI:10.1007/s10529-017-2468-1 |
| [75] |
Park CS, Yeom SJ, Kim HJ, Lee SH, Lee JK, Kim SW, Oh DK. Characterization of ribose-5-phosphate isomerase of Clostridium thermocellum producing D-allose from D-psicose[J]. Biotechnology Letters, 2007, 29(9): 1387-1391. DOI:10.1007/s10529-007-9393-7 |
| [76] |
Yeom SJ, Kim BN, Park CS, Oh DK. Substrate specificity of ribose-5-phosphate isomerases from Clostridium difficile and Thermotoga maritima[J]. Biotechnology Letters, 2010, 32(6): 829-835. DOI:10.1007/s10529-010-0224-x |
| [77] |
Park HY, Park CS, Kim HJ, Oh DK. Substrate specificity of a galactose 6-phosphate isomerase from Lactococcus lactis that produces D-allose from D-psicose[J]. Journal of Biotechnology, 2007, 132(1): 88-95. DOI:10.1016/j.jbiotec.2007.08.022 |
| [78] |
Yoon RY, Yeom SJ, Park CS, Oh DK. Substrate specificity of a glucose-6-phosphate isomerase from Pyrococcus furiosus for monosaccharides[J]. Applied Microbiology and Biotechnology, 2009, 83(2): 295-303. DOI:10.1007/s00253-009-1859-1 |
| [79] |
Menavuvu BT, Poonperm W, Leang K, Noguchi N, Okada H, Morimoto K, Granström TB, Takada G, Izumori K. Efficient biosynthesis of D-allose from D-psicose by cross-linked recombinant L-rhamnose isomerase: separation of product by ethanol crystallization[J]. Journal of Bioscience and Bioengineering, 2006, 101(4): 340-345. DOI:10.1263/jbb.101.340 |
| [80] |
Morimoto K, Park CS, Ozaki M, Takeshita K, Shimonishi T, Granström TB, Takata G, Tokuda M, Izumori K. Large scale production of D-allose from D-psicose using continuous bioreactor and separation system[J]. Enzyme and Microbial Technology, 2006, 38(6): 855-859. DOI:10.1016/j.enzmictec.2005.08.014 |
| [81] |
Bai W, Shen J, Zhu YM, Men Y, Sun YX, Ma YH. Characteristics and kinetic properties of L-rhamnose isomerase from Bacillus subtilis by isothermal titration calorimetry for the production of D-allose[J]. Food Science and Technology Research, 2015, 21(1): 13-22. DOI:10.3136/fstr.21.13 |
| [82] |
Xu W, Zhang WL, Tian YQ, Zhang T, Jiang B, Mu WM. Characterization of a novel thermostable L-rhamnose isomerase from Thermobacillus composti KWC4 and its application for production of D-allose[J]. Process Biochemistry, 2017, 53: 153-161. DOI:10.1016/j.procbio.2016.11.025 |
| [83] |
Yeom SJ, Seo ES, Kim YS, Oh DK. Increased D-allose production by the R132E mutant of ribose-5-phosphate isomerase from Clostridium thermocellum[J]. Applied Microbiology and Biotechnology, 2011, 89(6): 1859-1866. DOI:10.1007/s00253-010-3026-0 |
| [84] |
Itoh H, Sato T, Takeuchi T, Khan AR, Izumori K. Preparation of D-sorbose from D-tagatose by immobilized D-tagatose 3-epimerase[J]. Journal of Fermentation and Bioengineering, 1995, 79(2): 184-185. DOI:10.1016/0922-338X(95)94091-5 |
| [85] |
Itoh H, Izumori K. Enzymatic production of L-tagatose and L-fructose from L-sorbose and L-psicose, respectively[J]. Journal of Fermentation and Bioengineering, 1996, 81(4): 351-353. DOI:10.1016/0922-338X(96)80590-3 |
| [86] |
Franke D, Machajewski T, Hsu CC, Wong CH. One-pot synthesis of L-fructose using coupled multienzyme systems based on rhamnulose-1-phosphate aldolase[J]. The Journal of Organic Chemistry, 2003, 68(17): 6828-6831. DOI:10.1021/jo030021m |
| [87] |
Sugiyama M, Hong ZY, Whalen LJ, Greenberg WA, Wong CH. Borate as a phosphate ester mimic in aldolase-catalyzed reactions: practical synthesis of L-fructose and L-iminocyclitols[J]. Advanced Synthesis & Catalysis, 2006, 348(18): 2555-2559. |
| [88] |
Rao D, Gullapalli P, Yoshihara A, Jenkinson SF, Morimoto K, Takata G, Akimitsu K, Tajima S, Fleet GWJ, Izumori K. Direct production of L-tagatose from L-psicose by Enterobacter aerogenes 230S[J]. Journal of Bioscience and Bioengineering, 2008, 106(5): 473-480. DOI:10.1263/jbb.106.473 |
| [89] |
Lerner LM, Mennitt G. A new synthesis of L-talose and preparation of its adenine nucleosides[J]. Carbohydrate Research, 1994, 259(2): 191-200. DOI:10.1016/0008-6215(94)84057-1 |
| [90] |
Bhuiyan SH, Itami Y, Takada G, Izumori K. Preparation of L-talose and D-gulose from L-tagatose and D-sorbose, respectively, using immobilized L-rhamnose isomerase[J]. Journal of Bioscience and Bioengineering, 1999, 88(5): 567-570. DOI:10.1016/S1389-1723(00)87677-X |
| [91] |
Wheeler GL, Jones MA, Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683): 365-369. DOI:10.1038/30728 |
| [92] |
McCarthy ET, Sharma M, Savin VJ. Circulating permeability factors in idiopathic nephrotic syndrome and focal segmental glomerulosclerosis[J]. Clinical Journal of the American Society of Nephrology, 2010, 5(11): 2115-2121. DOI:10.2215/CJN.03800609 |
| [93] |
Yin ZJ, Huang XF. Recent development in carbohydrate based anticancer vaccines[J]. Journal of Carbohydrate Chemistry, 2012, 31(3): 143-186. DOI:10.1080/07328303.2012.659364 |
 2021, Vol. 48
2021, Vol. 48