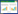扩展功能
文章信息
- 何亚琼, 彭凡, 赵铖, 付贝贝, 黄勃, 胡丰林
- HE Yaqiong, PENG Fan, ZHAO Cheng, FU Beibei, HUANG Bo, HU Fenglin
- 人工培养柞蚕蝉花不同部位的代谢组差异
- Metabolomic differences among different parts of Isaria cicadae cultured on Antheraea pernyi
- 微生物学通报, 2021, 48(2): 480-492
- Microbiology China, 2021, 48(2): 480-492
- DOI: 10.13344/j.microbiol.china.200162
-
文章历史
- 收稿日期: 2020-02-28
- 接受日期: 2020-04-02
- 网络首发日期: 2020-06-29
2. 安徽农业大学 安徽 合肥 230036
2. Anhui Agricultural University, Hefei, Anhui 230036, China
蝉花(Isaria cicadae)隶属子囊菌门肉座菌目虫草科棒束孢属,是世界上最早用于药物治疗的真菌。《中国藏药》指出蝉花具有降血压、降血糖、抗辐射、抗肿瘤、抗疲劳、抗应激、解热镇痛、改善肾功能、滋补壮阳和增强机体免疫力等药用功效[1]。蝉花和冬虫夏草有很多相同或类似代谢物,如腺苷、甘露醇、多糖、麦角甾醇等[2-3]。但较之冬虫夏草,蝉花具有容易实现人工培养、培养周期短、价格经济等特点,这也推进了蝉花商业化生产的步伐。人工培养柞蚕蝉花其外形与野生蝉花非常相似,因此受到消费者的喜爱。
本团队前期研究发现人工培养柞蚕蝉花,其代谢组与野生蝉花类似[4],但是人工培养柞蚕蝉花主要还是利用其孢梗束部分,虫体和虫体表面菌丝利用则较少。本研究试图通过代谢组学的方法比较人工培养蝉花各部分的代谢组差异,以期为合理利用人工培养柞蚕蝉花提供理论依据。
1 材料与方法 1.1 菌株和培养蝉棒束孢(RCEF4219)由安徽农业大学微生物防治重点实验室提供,蝉棒束孢接种于SDAY培养基[5],25 ℃培养15 d,将孢子刮入装有20 mL 0.02%吐温-80的灭菌三角瓶中,用涡旋混匀器涡旋15 min,经脱脂棉过滤后,用血球计数板计数,将浓度稀释至1×107个/mL,即为孢子悬液。
柞蚕蝉花:以柞蚕蛹为培养基,每只柞蚕蛹注入200 μL孢子悬液。前期菌丝培养阶段温度为22 ℃,湿度不低于70%,无光照。待柞蚕蛹表面有少量菌丝时,进入子实体诱发阶段,温度为20 ℃,湿度不低于70%,24 h光照。培养30 d后得到人工虫体培养的蝉花。采集的样品信息见表 1。
| 样品编号 Sample No. |
样品种类 Sample type |
| CK(01-05) | 柞蚕蛹空白 A. pernyi pupae blank |
| CT(01-05) | 长满菌丝的柞蚕蛹 A. pernyi pupae with Isaria cicadae |
| JS(01-05) | 柞蚕蛹表面的菌丝 Mycelia on the surface of the A. pernyi pupae |
| BGS(01-05) | 孢梗束部分 Coremia of I. cicadae cultured on A. pernyi pupae |
所有样品液氮淬灭,冷冻,干燥粉碎,填充氩气防止氧化,放至-80 ℃冰箱备用。每种样品5个生物学重复。
1.2 样品处理称取30 mg样品粉末,加入3 mL MeOH/CHCl3/H2O (2.5:1:1,体积比)提取液和30 μL Fmoc-Glycine (1 mg/mL)内标,涡旋1 min,4 ℃、40 kHz超声1 h,随后将样品放在4 ℃条件下避光静置10 h。然后将样品提取物以8 000 r/min离心10 min,取2.4 mL上清液,真空浓缩干燥,填充氩气防止氧化,置于-80 ℃保存。在HPLC-MS分析前用400 μL 90%甲醇超声复溶,以10 000 r/min离心10 min,上清液即为HPLC-MS分析样品。
1.3 主要试剂和仪器色谱纯甲醇和乙腈,Tedia公司;色谱纯甲酸,Agilent公司。高分辨液质联用分析仪、分析型色谱柱Agilent poroshell 120 EC-C18 (2.7 µm,3.0 nm× 100 mm),Agilent公司;电子天平,上海民桥精密科学仪器公司;立式冷冻干燥机,GOLD-SIM公司;数控超声波清洗器,昆山市超声仪器有限公司。
1.4 HPLC-MS条件流动相:A=0.1%甲酸的水,B=0.1%甲酸的乙腈。洗脱条件:0.0-45.0 min,5%-100% B;45.0-55.0 min,100% B。进样量5 μL,柱温25 ℃,流速0.4 mL/min。质谱阴、阳离子模式条件:用氮气作干燥气,温度325 ℃,流速12 L/min,雾化气压35 psi;毛细管电压:阴离子3 500 V,阳离子4 000 V;碎裂电压:阴离子175 V,阳离子215 V,分离器电压60 V;质量采集范围:阴阳离子模式均为0.05-1 kD。
1.5 数据处理和统计分析来自HPLC-DAD-TOF/MS的原始数据通过MassHunter软件(Agilent Technologies,Santa Clara,USA)进行预处理。数据处理过程包括分子特征提取(Molecular Feature Extraction,MFE)、自动峰检测、色谱去卷积和滤噪等。信噪比(S/N)低于5的峰被去除,每个样品生成一组质量/保留时间/峰高数据并将其导出为.csv文件。然后,将所有数据上传到MetaboAnalyst进行后续数据处理和统计分析[6]。质量偏差设定为0.01 Da,时间偏差设定为30 s,将每个峰的强度归一化为每个数据集的峰强度之和。最后,下载处理后的数据进行多变量分析。主成分分析(Principal Component Analysis,PCA)和正交偏最小二乘法判别分析(Orthogonal Projection to Latent Structure Discriminant Analysis,OPLS-DA)由SIMCA 14.1进行。Pareto缩放适用于PCA和OPLS-DA。单因素方差分析,t-Test和Hierarchical Clustering Analysis (HCA)由MetaboAnalyst进行。
将基于代谢物质谱特征、精确质荷比和同位素丰度计算得到的分子式,与本室编制的昆虫病原真菌天然产物数据库和网络数据库[Dictionary of Natural Products (DNP)、PubChem、METLIN、ChemSpider等]匹配,初步鉴定代谢差异物;用代谢物的碎片与数据库中相同或具有类似结构的化合物的质谱比对;以代谢物的极性(洗脱顺序)初步验证推断的代谢物结构;根据代谢物的紫外光谱与已知物质的紫外光谱图对照;对于已知物,尽可能使用标准品进行对照分析。
2 结果与分析 2.1 主成分分析为了了解柞蚕培养蝉花中孢梗束部分(Coremia,BGS)、菌丝部分(Mycelia,JS)、虫体部分(Insect Body,CT)和空白虫体(Control,CK)化合物之间的差异,通过液质联用技术和多变量统计技术相结合对柞蚕培养蝉花中孢梗束部分、菌丝部分、虫体部分和虫体空白4个部分的化合物进行识别,并使用PCA进行统计分析[7]。
图 1为HPLC-MS阳、阴离子模式下柞蚕培养的蝉花中孢梗束、菌丝、虫体部分与空白虫体化合物差异的PCA-2D得分图。其中A为总的阳离子模式,前2个主成分可以对61.5%的变量进行解释,其中PC1=38.4%、PC2=23.1%;B为总的阴离子模式,前2个主成分可以对57%的变量进行解释,其中PC1=32.7%、PC2=25.0%。从图 1中可以看出,在阳、阴离子模式下,柞蚕培养出的蝉花孢梗束、菌丝、虫体和空白虫体之间化合物存在较大差异。表明蝉棒束孢在侵入柞蚕虫体后,生长繁殖和形成孢梗束过程中消耗了虫体中成分,并在不同生长阶段(部位)具有不同代谢特征。
|
| 图 1 二维主成分分析得分图 Figure 1 Score plots of two dimensional principal component analysis 注:A:阳离子模式;B:阴离子模式。CT:虫体;JS:菌丝;BGS:孢梗束;CK:对照 Note: A: Positive mode; B: Negative mode. CT: Insect body; JS: Mycelia; BGS: Coremia; CK: Control |
|
|
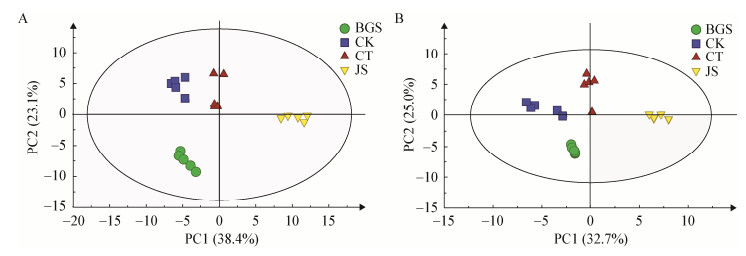
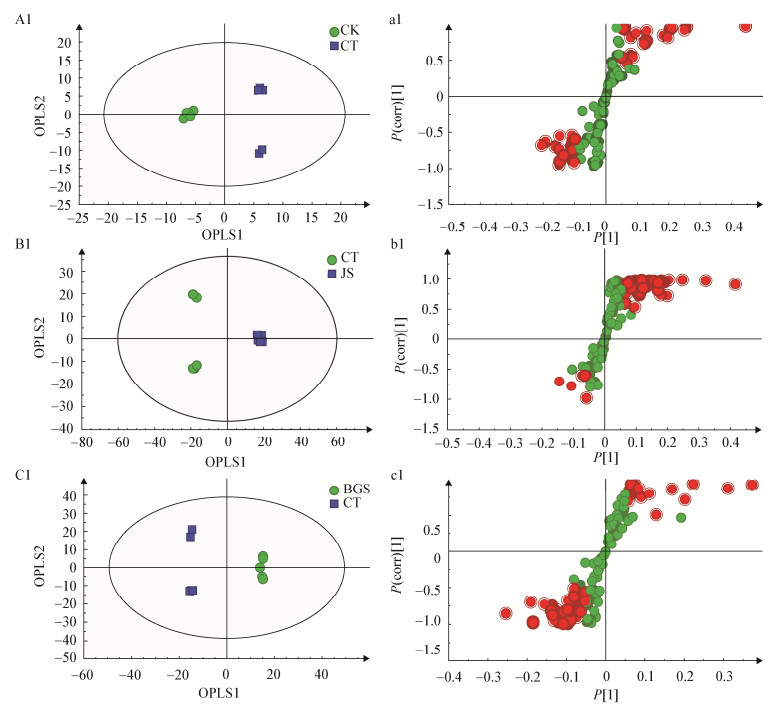
由于PCA是一种没有监督的分组方法,当对样品分组时,出现组内差异大于组间差异时,该分组方式就变得不够清晰。因此,采用一种有监督的分析方法十分必要。OPLS-DA是一种通过去除与分组无关的系统自身差异筛选代谢差异物,从而能够使分离达到最大化[6]。OPLS-DA使用中要求R2X≥0.5、R2Y≥0.5、Q2≥0.5;与此同时,还需要对PLS-DA进行排列检验,使用与OPLS-DA实验具有相同数量的成分(Permutations,n=200),当截距Q2≤0.05,满足上述条件则表示该模型预测能力较好。S-Plot主要用来获得OPLS-DA分组后的样品之间代谢差异物,其中P[1]≥|0.05|、P(Corr)≥|0.5|,而且要对所得结果进行t-Test,其中P < 0.05的变量被认为是和分组相关的显著性差异物[8]。结果见图 2和图 3。
|
| 图 2 阳离子模式下的OPLS-DA得分图和对应的S-Plot图 Figure 2 OPLS-DA score plots and corresponding S-plot in positive mode 注:A1:虫体(CT)和对照(CK)比较;B1:虫体(CT)和菌丝(JS)比较;C1:虫体(CT)和孢梗束(BGS);a1-c1:A1-C1对应的S-Plot图 Note: A1: Comparison between insect body (CT) and control (CK); B1: Comparison between insect body (CT) and mycelia (JS); C1: Comparison between insect body (CT) and coremia (BGS); a1-c1: Corresponding S-plot figures of A1-C1 |
|
|
|
| 图 3 阴离子模式下的OPLS-DA得分图和对应的S-Plot图 Figure 3 OPLS-DA score plots and corresponding S-plot in negative mode 注:A2:虫体(CT)和对照(CK)比较;B2:虫体(CT)和菌丝(JS)比较;C2:虫体(CT)和孢梗束(BGS);a2-c2:A2-C2对应的S-Plot图 Note: A2: Comparison between insect body (CT) and control (CK); B2: Comparison between insect body (CT) and mycelia (JS); C2: Comparison between insect body (CT) and coremia (BGS); a2-c2: Corresponding S-plot figures of A2-C2 |
|
|
OPLS-DA的得分图显示柞蚕培养蝉花的虫体与虫体空白、虫体表面的菌丝体、蝉花孢梗束在OPLS1上可以明显分开,两组间的差异代谢物通过S-Plot (a1、b1、c1、a2、b2、c2)识别,阴、阳离子模式下共识别86个差异化合物,具体详情见表 2。
| 出峰时间 Retention time (min) |
检测到的质荷比 Detected mass (Da) |
化合物 Metabolite |
离子模式 Ionization mode |
分子式 Molecular formula |
误差 ΔMass (mDa) |
| 1.75 | 103.063 8 | Gamma-aminobutyric acid | ESI (-) | C4H9NO2 | -1.02 |
| 1.75 | 103.099 5 | Aminopentanol | ESI (+) | C5H13NO | -0.33 |
| 1.76 | 147.054 7 | Glutamic acid | ESI (-) | C5H9NO4 | -2.09 |
| 1.81 | 161.103 6 | Carnitine | ESI (+) | C7H15NO3 | 1.04 |
| 1.90 | 115.063 1 | Proline | ESI (+) | C5H9NO2 | -0.32 |
| 1.92 | 235.142 6 | Glyceryl homoserine betaine | ESI (+) | C10H21NO5 | -1.18 |
| 1.94 | 607.082 0 | UDP-N-acetylglucosamine | ESI (-) | C17H27N3O17P2 | -0.98 |
| 2.01 | 134.021 0 | Malic acid | ESI (-) | C4H6O5 | -0.93 |
| 2.04 | 240.148 1 | 1-hydroxy-aspergillic acid | ESI (+) | C12H20N2O3 | -1.26 |
| 3.86 | 192.027 0 | Citric acid | ESI (-) | C6H8O7 | -0.60 |
| 3.92 | 112.016 4 | 3-furoic acid | ESI (-) | C5H4O3 | -0.90 |
| 9.17 | 323.169 8 | Antibiotic 8345 C | ESI (+) | C17H25NO5 | 2.92 |
| 9.26 | 122.056 9 | Erythritol | ESI (+) | C4H10O4 | 0.46 |
| 9.45 | 485.220 4 | 2-amino-2-deoxy-β-D-mannopyranosyl-(1→3)-2-amino-2-deoxy-α-L-fucopyranosyl-(1→3)- 2-amino-2-deoxy-D-galactose | ESI (+) | C18H35N3O12 | 1.08 |
| 9.94 | 135.066 2 | 1-(2-aminophenyl) ethanone | ESI (+) | C8H9NO | 1.67 |
| 10.11 | 465.126 9 | Unknown glycosides | ESI (+) | C21H23NO11 | -0.34 |
| 10.21 | 165.079 0 | Phenylalanine | ESI (-) | C9H11NO2 | -0.57 |
| 10.34 | 123.032 2 | Nicotinate | ESI (-) | C6H5NO2 | -0.72 |
| 10.56 | 335.171 6 | Senecionine | ESI (+) | C18H25NO5 | 1.12 |
| 10.78 | 253.153 2 | Cyclo(arginylprolyl) | ESI (+) | C11H19N5O2 | 0.13 |
| 11.28 | 300.071 5 | Ribofuranosyluric acid | ESI (-) | C10H12N4O7 | -1.45 |
| 11.73 | 179.094 0 | Adenine | ESI (+) | C7H9N5O | 0.08 |
| 12.29 | 466.257 5 | Androsterone glucuronide | ESI (-) | C25H38O8 | -1.38 |
| 13.30 | 204.089 9 | Tryptophan | ESI (-) | C11H12N2O2 | -0.57 |
| 13.30 | 312.085 2 | Isariketide | ESI (-) | C14H16O8 | -1.23 |
| 13.60 | 143.069 2 | 2-amino-4, 5-dihydro-1H-imidazole-4-acetic acid | ESI (+) | C5H9N3O2 | -0.27 |
| 13.60 | 145.070 6 | A-aminoadipic semialdehyde | ESI (+) | C6H11NO3 | 2.74 |
| 13.63 | 117.079 1 | Valine | ESI (+) | C5H11NO2 | -0.67 |
| 13.71 | 158.094 5 | 3, 6-epoxyoctanoic acid | ESI (+) | C8H14O3 | -0.75 |
| 13.75 | 169.048 7 | 3-amino-2-pyrazinecarboxylic acid | ESI (+) | C6H7N3O3 | -0.56 |
| 13.76 | 131.067 8 | Creatine | ESI (+) | C4H9N3O2 | 1.13 |
| 13.80 | 187.063 5 | Unknown | ESI (+) | C6H10ClN5 | -1.58 |
| 15.33 | 338.093 4 | Melanocin A | ESI (-) | C18H14N2O5 | -3.68 |
| 15.43 | 370.127 3 | PPEA | ESI (-) | C17H22O9 | -1.52 |
| 15.89 | 146.069 4 | Glutamine | ESI (+) | C5H10N2O3 | -0.81 |
| 16.29 | 368.111 5 | Isocoumarin glucosides | ESI (-) | C17H20O9 | -1.32 |
| 20.16 | 295.142 2 | Neopestalotin E | ESI (-) | C15H21NO5 | -0.78 |
| 21.39 | 156.115 4 | Nonenoic acid | ESI (-) | C9H16O2 | -0.97 |
| 31.69 | 519.261 6 | PS(18:3/0:0) | ESI (-) | C24H42NO9P | -2.43 |
| 32.12 | 563.323 6 | PS(21:2/0:0) | ESI (-) | C27H50NO9P | -1.83 |
| 32.19 | 317.292 7 | Phytosphingosine | ESI (+) | C18H39NO3 | -0.25 |
| 32.25 | 299.282 3 | Glycidyl oleate | ESI (+) | C18H37NO2 | -0.42 |
| 32.31 | 475.241 5 | Fluspirilene | ESI (-) | C29H31F2N3O | 1.47 |
| 32.38 | 475.268 9 | PE(18:3/0:0) | ESI (+) | C23H42NO7P | 0.44 |
| 32.48 | 517.317 6 | PC(18:3/0:0) | ESI (+) | C26H48NO7P | -1.31 |
| 32.67 | 596.298 3 | Tyr-Lys-Thr-Trp | ESI (-) | C30H40N6O7 | -3.00 |
| 32.80 | 578.294 0 | Unknown | ESI (+) | C28H42N4O9 | 0.63 |
| 33.48 | 521.276 9 | PS(18:2/0:0) | ESI (-) | C24H44NO9P | -2.08 |
| 33.52 | 521.276 5 | Linoleylserine phosphate | ESI (+) | C24H44NO9P | -1.68 |
| 33.84 | 477.287 2 | PE(18:2/0:0) | ESI (-) | C23H44NO7P | -2.21 |
| 34.13 | 565.349 8 | PS(21:1/0:0) | ESI (-) | C27H52NO9P | -4.14 |
| 34.15 | 572.298 5 | PI(16:0/0:0) | ESI (-) | C25H49O12P | -2.89 |
| 34.30 | 477.285 8 | Linoleylglycerol phosphate ethanolamine | ESI (+) | C23H44NO7P | -0.81 |
| 34.32 | 336.266 1 | Hydroxymethyl methylandrostane, diol | ESI (+) | C21H36O3 | -0.20 |
| 34.38 | 329.292 2 | Dihydroceramide | ESI (+) | C19H39NO3 | 0.25 |
| 34.45 | 519.331 6 | PC(18:2/0:0) | ESI (+) | C26H50NO7P | 0.34 |
| 34.96 | 497.276 7 | PS(16:0/0:0) | ESI (-) | C22H44NO9P | -1.88 |
| 35.49 | 296.235 8 | 8-oxo-9(E)-octadecenoic acid | ESI (-) | C18H32O3 | -1.20 |
| 35.69 | 453.287 1 | PE(16:0/0:0) | ESI (-) | C21H44NO7P | -2.11 |
| 35.76 | 453.282 9 | Terpendole F | ESI (+) | C28H39NO4 | 4.46 |
| 35.80 | 312.265 5 | Oxo-nonadecanoic acid | ESI (+) | C19H36O3 | 0.40 |
| 35.95 | 495.330 6 | PC(16:0/0:0) | ESI (+) | C24H50NO7P | 1.34 |
| 36.01 | 523.292 8 | PS(18:1/0:0) | ESI (-) | C24H46NO9P | -2.33 |
| 36.25 | 338.281 8 | Glycidyl oleate | ESI (+) | C21H38O3 | -0.25 |
| 36.44 | 278.224 0 | Linolenic acid | ESI (+) | C18H30O2 | 0.03 |
| 36.57 | 434.244 7 | PA(18:2/0:0) | ESI (-) | C21H39O7P | -1.91 |
| 36.74 | 479.302 6 | PE(18:1/0:0) | ESI (-) | C23H46NO7P | -1.96 |
| 36.82 | 479.301 6 | PE(18:1/0:0) | ESI (+) | C23H46NO7P | -0.96 |
| 36.94 | 567.355 6 | PS(21:0/0:0) | ESI (-) | C27H54NO9P | -2.53 |
| 36.96 | 521.348 2 | PC(18:1/0:0) | ESI (+) | C26H52NO7P | -0.61 |
| 38.05 | 490.306 5 | Paeciloketal A | ESI (-) | C32H42O4 | 1.26 |
| 38.28 | 376.313 6 | Ergostapentaene | ESI (+) | C28H40 | -1.15 |
| 38.80 | 300.133 4 | Trimethy1-6-(1-oxo-3-phenylpropy1) cyclohexanetrione |
ESI (+) | C18H20O4 | 2.21 |
| 40.06 | 481.318 2 | Phosphatidylcholine | ESI (-) | C23H48NO7P | -1.91 |
| 40.31 | 523.362 8 | PC(18:0/0:0) | ESI (+) | C26H54NO7P | 0.44 |
| 41.19 | 466.304 5 | Androsterone glucuronide | ESI (+) | C30H42O4 | 3.26 |
| 43.24 | 354.274 0 | Linoleyl glyceride | ESI (+) | C21H38O4 | 2.46 |
| 43.27 | 262.228 2 | Muquketone | ESI (+) | C18H30O | 0.92 |
| 44.98 | 480.283 2 | PA(20:1/0:0) | ESI (+) | C23H45O9P | 1.46 |
| 45.45 | 464.289 1 | PA(20:1/0:0) | ESI (+) | C23H45O8P | 0.64 |
| 45.49 | 280.240 9 | Linoleic acid | ESI (-) | C18H32O2 | -1.22 |
| 45.50 | 380.162 7 | Dicitrinin A | ESI (-) | C23H24O5 | -0.87 |
| 45.53 | 352.261 7 | Linolenic acid monoglyceride | ESI (+) | C21H36O4 | 0.89 |
| 48.02 | 282.256 2 | Oleic acid | ESI (-) | C18H34 O2 | -0.87 |
| 注:PA:磷脂酸;PE:磷脂酰乙醇胺;PC:磷脂酰胆碱;PS:磷脂酰丝氨酸;PI:磷脂酰肌醇;PPEA:3-{3-Methoxy-5-[(4-O-methyl-glucopyranosyl)oxy]phenyl}prop-2-enoic acid Note: PA: Phosphatidic acid; PE: Phosphatidyl-ethanolamine; PC: Phosphatidyl-choline; PS: Phosphatidyl-serine; PI: Phosphatidyl-inositol; PPEA: 3-{3-Methoxy-5-[(4-O-methyl-glucopyranosyl)oxy]phenyl}prop-2-enoic acid | |||||
通过OPLS-DA中的S-Plot图获得了柞蚕培养蝉花的虫体部分与虫体空白、虫体表面的菌丝体、蝉花孢梗束之间的差异代谢物,这些差异代谢物主要包括磷脂类、氨基酸类、生物碱类和脂肪酸及其酯类等。
为了更加直观地了解这些差异代谢物在人工培养蝉花的虫体部分(CT)与虫体空白(CK)、虫体体表菌丝体(JS)、蝉花孢梗束(BGS)之间的变化规律,将这些差异物代谢物进行了可视化分析(Hierarchical Clustering Analysis,HCA)。先将蝉花各部分及对照的数据进行Pareto Scaling均一化处理,然后采用Spearman’s Rank聚类分析,测量距离为Average Linkage[9]。聚类图将代谢轮廓相近的样品及相关的代谢物聚在一起。热图中颜色由深蓝色到深棕色,表示该代谢物的数值由低(冷)到高(热),左端为差异代谢物的聚类,见图 4、5。
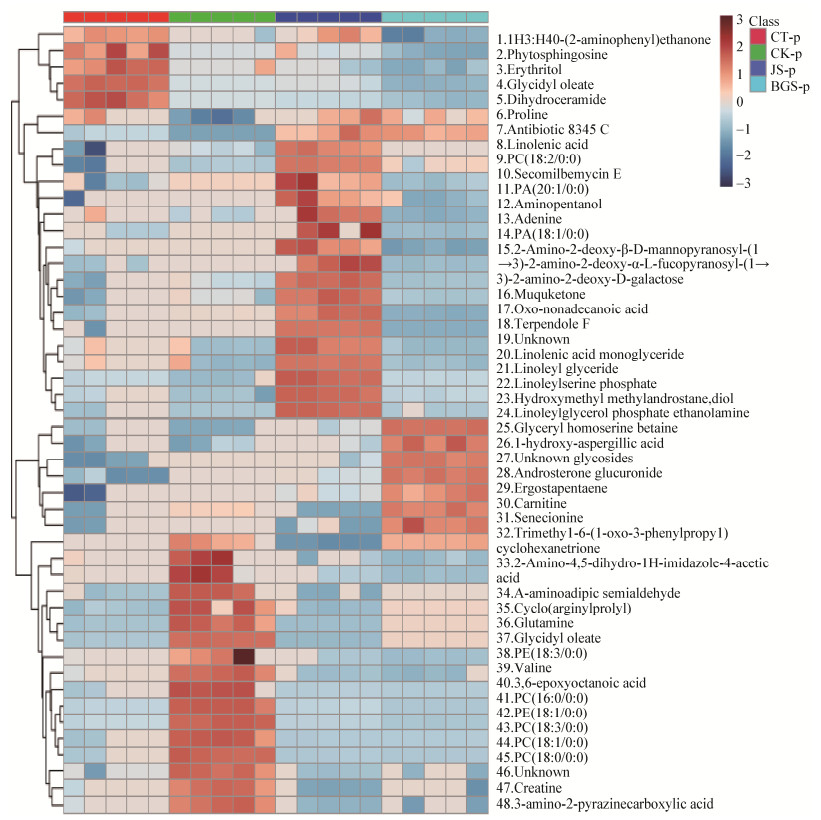
|
| 图 4 阳离子模式下识别的差异代谢物的聚类分析 Figure 4 Heatmap of metabolites in positive mode 注:CT:虫体;JS:菌丝体;BGS:孢梗束;CK:对照 Note: CT: Insect body; JS: Mycelia; BGS: Coremia; CK: Control |
|
|
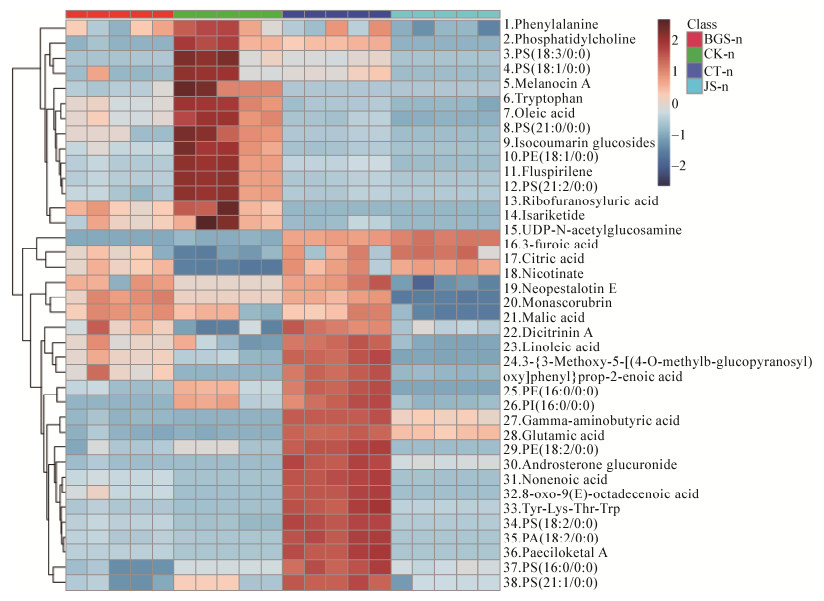
|
| 图 5 阴离子模式下识别的差异代谢物的聚类分析 Figure 5 Heatmap of metabolites in negative mode 注:CT:虫体;JS:菌丝体;BGS:孢梗束;CK:对照 Note: CT: Insect body; JS: Mycelia; BGS: Coremia; CK: Control |
|
|
从阳离子模式的HCA图中可以得出以下结果:
(1) 虫体空白中检测到较高的磷脂类和氨基酸类衍生物,主要有PE(18:3/0:0)、PC(16:0)、PE[18:1(11Z)/0:0]、PC[18:3(6Z, 9Z, 12Z)/0:0]、PC[18:1(9Z)]、PC(18:0),以及谷氨酰胺(Glutamine)和缬氨酸(Valine)等氨基酸及其衍生类物。与蝉花各部分成分相比,虫体空白中缬氨酸和谷氨酰胺含量显著较高,说明蝉花菌(蝉棒束孢)可能对虫体中缬氨酸和谷氨酰胺的利用能力较高,导致蝉花各部分代谢物中缬氨酸和谷氨酰胺含量相对偏低,提示我们这2种化合物有可能在蝉棒束孢生长中起着重要作用。
(2) 蝉花的虫体部分中检测到的高含量物质较少,主要是鞘酯类物质,包括二氢神经酰胺和植物鞘胺醇(Phytosphingosine),其中植物鞘胺醇是真菌和植物中主要的鞘胺醇类物质,而动物,包括昆虫中的鞘胺醇类物质主要是鞘氨醇和二氢鞘胺醇,同时也有少量的三氢鞘氨醇[10],显然,蝉花的虫体部分中检测到较多的植物鞘氨醇应该主要是由蝉棒束孢所合成的。
(3) 人工蝉花虫体表面的菌丝体中含有多达20种高含量代谢产物,其中不饱和脂肪酸及其衍生物多达6种,包括α-亚麻酸(α-Linolenic Acid)、亚麻酸单甘酯(Linolenic Acid Monoglyceride)、亚油酸甘油酯(Linoleyl Glyceride)、亚油酰丝氨酸磷酯(Linoleylserine Phosphate)、十九烷酸(Oxo- Nonadecanoic Acid)、亚油酰磷酸甘油酯和磷脂酰乙醇胺(Linoleylglycerol Phosphate Ethanolamine)。除不饱和脂肪酸及其衍生物外,人工蝉花虫体表面的菌丝体中还含有较多甘油磷酯酸等多种代谢产物。甘油磷酯酸是油脂代谢的中间产物,该物质含量高,说明虫体表面的菌丝酯类物质代谢旺盛。
(4) 蝉花孢梗束中含量较高的物质较少,仅有6种,这可能因为孢梗束的大部分是支撑组织,纤维含量较高,次生代谢产物相对较少。含量较高的次生代谢物是4种含氮化合物,包括肉碱和甜菜碱衍生物甘油高丝氨酸甜菜碱(Glyceryl Homoserine Betaine),以及2种未知含氮物质,其中,甘油高丝氨酸甜菜碱被认为可能与蝉棒束孢产孢有一定关系[11]。据报道肉碱与孢子中甘油磷脂积累有关[12],本研究与其一致,因为蝉花孢梗束是产孢器官。
从阴离子模式的HCA图中可以得出以下结果:
(1) 虫体空白中检测到较多磷脂酸类物质,这一结果和阳离子模式的HCA图一致。由于不同结构的同类物质形成阴阳离子特性不同,阴、阳离子模式下分析出的化合物并不相同。在阴离子模式下,检测到含量较高的磷脂主要有磷脂酰丝氨酸类[PS(16:0/0:0)、PS(18:3/0:0)、PS(18:1/0:0)、PS(21:2/0:0)]和磷脂酰乙醇胺(Phosphatidylethanolamine,PE),而磷脂酰胆碱(Phosphatidylcholine,PC)由于不易形成阴离子,在阴离子模式下并未检测到显著变化。虫体空白中多种磷脂酰丝氨酸类物质含量都相对较高,表明虫体接种后该类物质被蝉棒束孢菌消耗。阴离子模式下昆虫空白中也检测到较多氨基酸类物质,包括苯丙氨酸和色氨酸等,表明这些物质在虫体接种棒束孢后被菌体所利用,导致虫体空白中含量相对较高。
(2) 蝉花的虫体中含量高且易形成阴离子的代谢物种类较少,此与阳离子模式下检测结果一致。其含量较高的代谢物主要是一些有机酸如柠檬酸(Citric Acid)、苹果酸(Malic Acid)和亚油酸(Linoleic Acid)。这些物质在蝉花虫体部分中含量相对较高,说明这些成分在蝉花其他部分被大量消耗,用于菌体生长,而虫体内菌核处于活力较低状态,因此有较多代谢中间产物的积累。蝉花的虫体中还检测到含量较高的Neopestalotin E和Monascorubrin,前者最初是从新拟盘多毛孢中分离得到,具有刺激植物生长的作用[13];后者最初是从一种青霉菌株分离得到,具有一定的抗癌活性[14]。由于这2种物质都是真菌代谢物,因此蝉花虫体中的这2个成分应该是虫体中棒束孢菌所产生。
(3) 蝉花虫体表面的菌丝体中易形成阴离子的代谢物也多达20种,包括磷脂酸类、有机酸类、肽和氨基酸类。由于蝉花虫体上菌丝是蝉花孢梗束从虫体中吸收营养的基础,虫体内分解的营养成分会首先被菌丝吸收,菌丝再给孢梗束提供营养,供其生长产孢。菌丝中含有相对大量的代谢物,表明有虫体在不断地供给营养。由于菌丝中磷脂酸组成与虫体空白中磷脂酸并不完全相同,如多了PI(16:0/0:0)、PS(21:1/0:0)和PS(18:2/0:0)等,表明菌丝并不是仅仅将虫体营养传递给孢梗束,而是经过加工和转化。
(4) 蝉花孢梗束中代谢物在阴离子模式下同阳离子模式一样,高含量的代谢物种类较少,仅UDP-N-乙酰葡糖胺和呋喃甲酸含量较高,同时苹果酸、氨基丁酸和谷氨酸含量略高。
3 讨论与结论结合阳、阴离子模式的HCA图整体代谢变化趋势来看,蝉棒束孢菌侵入柞蚕虫体后,分解柞蚕体内丰富的酯类、蛋白等物质,为菌体生长提供能量、磷脂酸和氨基酸等物质,用于菌体生长繁殖。虫体内虽然充满菌丝(菌核),但次生代谢产物并不多,仅二氢神经酰胺和植物鞘胺醇等少数化合物,表明虫体内物质以储藏物质为主,用于虫体表面的菌丝和孢梗束生长需要。虫体内的植物鞘胺醇含量较高,可能与蝉棒束孢受柞蚕蛹的免疫损伤有关。虫体表面菌丝是蝉花孢梗束从虫体中吸收营养的基础,虫体内分解的营养成分会首先被菌丝吸收,菌丝再给孢梗束提供营养供其生长产孢,因此菌丝中被检测到大量次生代谢产物。孢梗束的大部分是支撑组织,纤维含量高,次生代谢产物相对较少。从代谢物利用角度来看,柞蚕虫体表面菌丝具有较高利用价值,柞蚕虫体上孢梗束的利用价值较低。
蝉棒束孢菌接种到柞蚕蛹后,缬氨酸、苯丙氨酸、色氨酸和谷氨酰胺等化合物在接菌后的虫体中含量显著降低,表明蝉棒束孢菌可能优先利用虫体蛋白分解出来的这些氨基酸。这4种氨基酸都具有十分广泛的生理功能[15],但目前并无关于它们对真菌生长作用的报道,值得进一步深入研究。另外,虫体中磷脂酰丝氨酸类化合物在接菌后含量显著降低,而植物鞘氨醇、神经酰胺等丝氨酸代谢产物含量显著升高,表明昆虫中磷脂酰丝氨酸可能被用于这些物质的合成。神经酰胺水平的升高被认为与DNA损伤有关[16],表明蝉棒束孢菌进入虫体后,活虫对菌体的免疫自由基损伤可能伤及DNA。在虫体空白中,本研究还检测到含量较高的一种异氰酸酯化合物Melanocin A,其具有抑制黑色素合成的作用[17]。昆虫受微生物感染后的黑化反应是常见的现象[18],该物质在空白昆虫中含量较高,说明接种真菌后该成分在抵御真菌侵染过程中被消耗。
蝉棒束孢菌侵入柞蚕体内后合成大量植物鞘胺醇,该物质含量升高可能与蝉棒束孢受柞蚕蛹的免疫损伤有关[19]。另外,植物鞘胺醇是重要信号分子,具有多种生理功能[20],其含量在休眠状态的菌核中含量显著高于虫体外菌丝及孢梗束,表明大量植物鞘氨醇可能有利于菌丝转化成休眠状态的菌核。
研究表明,虫体表面生长的菌丝中小分子代谢物最多,其中含量较高的不饱和脂肪酸及其衍生物可能是由昆虫体内饱和脂肪转化而来,因为昆虫体的油脂类物质中,饱和酯类占1/3左右[21]。菌丝中含量较高的磷脂类物质、γ-氨基丁酸、谷氨酸和多不饱和脂肪酸类物质都是重要的营养物质,这些物质含量高表明菌丝在不断地从虫体内及虫体表面吸收营养。
本研究发现蝉花孢梗束中小分子代谢物最少,这可能因为孢梗束的大部分是支撑组织,含有大量纤维素等大分子物质。然而,蝉花孢梗束中小分子代谢物虽然较少,但甾类化合物Ergostapentaene和Androsterone Glucuronide却含量较高,后者是雄甾酮衍生物,可能具有雄性激素类似活性,这与蝉花等虫草菌具有滋补壮阳作用的报道[22]一致。孢梗束还含有肉碱和甜菜碱衍生物Glyceryl Homoserine Betaine,前者是脂肪酸代谢的必需因子,与孢子中甘油磷脂积累有关[12];后者被认为与产孢有一定关系[11],这与蝉花孢梗束的产孢功能一致。柞蚕蝉花不同部位的代谢组差异研究结果为蝉花的进一步理论和应用研究提供了科学基础。
| [1] |
Gu J. Chinese Tibetan Medicine[M]. Beijing: Nationalities Press, 2016: 322-323. (in Chinese) 顾健. 中国藏药[M]. 北京: 民族出版社, 2016: 322-323. |
| [2] |
Chu BZ, Chang J, Zhu Y, Sun X. Chemical constituents of Cordyceps cicadae[J]. Natural Product Communications, 2015, 10(12): 2145-2146. DOI:10.1177/1934578X1501001233 |
| [3] |
Sharma SK, Gautam N, Atri NS. Optimized extraction, composition, antioxidant and antimicrobial activities of exo and intracellular polysaccharides from submerged culture of Cordyceps cicadae[J]. BMC Complementary and Alternative Medicine, 2015, 15: 446. DOI:10.1186/s12906-015-0967-y |
| [4] |
He YQ, Zhang WC, Peng F, Lu RL, Zhou H, Bao GH, Wang B, Huang B, Li ZZ, Hu FL. Metabolomic variation in wild and cultured cordyceps and mycelia of Isaria cicada e[J]. Biomedical Chromatography, 2019, 33(4): e4478. DOI:10.1002/bmc.4478 |
| [5] |
Ma LH, Cui SY, Kan FQ, Ye JZ. Handbook of Microbiological Media[M]. Changchun: Science and Technology Press of Jilin, 2006: 613. (in Chinese) 马乐好, 崔树玉, 阚方琦, 叶建中. 微生物培养基实用手册[M]. 长春: 吉林科学技术出版社, 2006: 613. |
| [6] |
Xia JG, Wishart DS. Web-based inference of biological patterns, functions and pathways from metabolomic data using Metaboanalyst[J]. Nature Protocols, 2011, 6(6): 743-760. DOI:10.1038/nprot.2011.319 |
| [7] |
Luo FF. The biomarkers of germination and virulence of Beauveria bassiana and the effects of exogenouos gene on its metabolome[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2013 (in Chinese) 罗飞飞. 球孢白僵菌萌发和毒力标记物及外源基因对其代谢组影响[D]. 合肥: 安徽农业大学硕士学位论文, 2013 |
| [8] |
Lee JL, Lee BJ, Chung JO, Hwang JA, Lee SJ, Lee CH, Hong YS. Geographical and climatic dependencies of green tea (Camellia sinensis) metabolites: A 1H NMR-based metabolomics study[J]. Journal of Agricultural and Food Chemistry, 2010, 58(19): 10582-10589. DOI:10.1021/jf102415m |
| [9] |
Ametaj BN, Zebeli Q, Saleem F, Psychogios N, Lewis MJ, Dunn SM, Xia JG, Wishart DS. Metabolomics reveals unhealthy alterations in rumen metabolism with increased proportion of cereal grain in the diet of dairy cows[J]. Metabolomics, 2010, 6(4): 583-594. DOI:10.1007/s11306-010-0227-6 |
| [10] |
Shi XX. The functions of sphingolipids and their metabolic enzymes in development and reproduction of the rice brown planthopper, Nilaparvata lugens (Stål)[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2018 (in Chinese) 史肖肖. 鞘脂类及其代谢酶在褐飞虱发育与生殖中的功能[D]. 杭州: 浙江大学博士学位论文, 2018 |
| [11] |
Zhang WC, Chen LY, Gao S, Xu F, Liu JY, Lu RL, Hu FL. Metabolomic analysis of the mycelia of Isaria cicadae at different incubation time[J]. Mycosystema, 2015, 34(2): 252-268. (in Chinese) 张万存, 陈龙云, 高沙, 徐飞, 刘景云, 陆瑞利, 胡丰林. 不同培养时间下蝉棒束孢菌丝体的代谢组研究[J]. 菌物学报, 2015, 34(2): 252-268. |
| [12] |
Luo FF, Li SL, Chen LY, Zhang WC, Wang B, Huang B, Hu FL. Identification of spore germination and virulence related biomarkers from Beauveria bassiana using an LC-MS-based metabolomic technique[J]. Acta Microbiologica Sinica, 2014, 54(1): 33-41. (in Chinese) 罗飞飞, 李淑林, 陈龙云, 张万存, 王滨, 黄勃, 胡丰林. 代谢组学方法鉴定球孢白僵菌孢子萌发和杀虫毒力相关的标记物[J]. 微生物学报, 2014, 54(1): 33-41. |
| [13] |
Zhao SS, Chen SX, Wang B, Niu SB, Wu WP, Guo LD, Che YS. Four new tetramic acid and one new furanone derivatives from the plant endophytic fungus Neopestalotiopsis sp[J]. Fitoterapia, 2015, 103: 106-112. DOI:10.1016/j.fitote.2015.03.023 |
| [14] |
Ogihara J, Oishi K. Effect of ammonium nitrate on the production of Pp-V and monascorubrin homologues by Penicillium sp. Az[J]. Journal of Bioscience and Bioengineering, 2002, 93(1): 54-59. DOI:10.1016/S1389-1723(02)80054-8 |
| [15] |
Tian H. Research overview of amino acids and fatty acids of edible insects[J]. Modern Agricultural Science and Technology, 2015(1): 292-293. (in Chinese) 田华. 食用昆虫氨基酸及脂肪酸研究综述[J]. 现代农业科技, 2015(1): 292-293. DOI:10.3969/j.issn.1007-5739.2015.01.172 |
| [16] |
Huang Y, Yu YN, Yang J. Current progress in study of sphingolipids[J]. Journal of Zhejiang University (Medical Sciences), 2005, 34(4): 375-379. (in Chinese) 黄韵, 余应年, 杨军. 鞘脂类研究进展[J]. 浙江大学学报:医学版, 2005, 34(4): 375-379. DOI:10.3785/j.issn.1008-9292.2005.04.020 |
| [17] |
Kim JP, Kim BY, Yun BS, Ryoo IJ, Lee IK, Kim WG, Pyun YR, Yoo ID. Melanocins a, b and c, new melanin synthesis inhibitors produced by Eupenicillium shearii : Ⅱ. Physico-chemical properties and structure elucidation[J]. Journal of Antibiotics, 2002, 56(12): 1000-1003. |
| [18] |
Yang XF, Zhou XX, Zheng XL. Research progress in insect immunity response induced by fungi[J]. Guizhou Agricultural Sciences, 2008, 36(5): 73-76. (in Chinese) 杨晓峰, 周小霞, 郑小莉. 真菌诱导的昆虫免疫反应研究进展[J]. 贵州农业科学, 2008, 36(5): 73-76. DOI:10.3969/j.issn.1001-3601.2008.05.028 |
| [19] |
Zhang C, Wang W, Lu RL, Jin S, Chen YH, Fan MZ, Huang B, Li ZZ, Hu FL. Metabolic responses of Beauveria bassiana to hydrogen peroxide-induced oxidative stress using an LC-MS-based metabolomics approach[J]. Journal of Invertebrate Pathology, 2016, 137: 1-9. DOI:10.1016/j.jip.2016.04.005 |
| [20] |
Ohanian J, Ohanian V. Sphingolipids in mammalian cell signalling[J]. Cellular and Molecular Life Sciences, 2001, 58(14): 2053-2068. DOI:10.1007/PL00000836 |
| [21] |
Liu XG, Liao XF, Xu MS, Chen MM. Development and using of insect oil and its functions[J]. Cereals & Oils, 2002(2): 24-27. (in Chinese) 刘晓庚, 廖晓峰, 徐明生, 陈梅梅. 昆虫油脂及其功能性成分开发利用研究[J]. 粮食与油脂, 2002(2): 24-27. DOI:10.3969/j.issn.1008-9578.2002.02.010 |
| [22] |
Chen ZA, Li ZZ, Chen YP. Jin Chanhua[M]. Beijing: Chinese Medicine Ancient Books Press, 2014: 6. (in Chinese) 陈祝安, 李增智, 陈以平. 金蝉花[M]. 北京: 中医古籍出版社, 2014: 6. |
 2021, Vol. 48
2021, Vol. 48