扩展功能
文章信息
- 高沙尔·卡依尔哈力, 热子亚·麦麦吐逊, 祖丽皮亚·玉努斯
- Gaoshaer·Kayierhali, Raziye·Memettursun, Zulfiya·Yunus
- 地锦草内生细菌多样性、拮抗及促生特性测定
- Endophytic bacteria from Euphorbia humifusa: diversity, antagonism and growth-promoting activities
- 微生物学通报, 2021, 48(2): 392-406
- Microbiology China, 2021, 48(2): 392-406
- DOI: 10.13344/j.microbiol.china.191069
-
文章历史
- 收稿日期: 2019-12-20
- 接受日期: 2020-08-22
- 网络首发日期: 2020-12-09
内生细菌广泛分布于各种植物组织或细胞间隙内,与宿主互惠共生[1]。该类微生物具有多种生物学作用,包括植物促生[2]、提高植物抗逆能力[3]、增加宿主植物的他感作用[4]等。植物病原菌侵染是农业发展中的关键问题,而内生细菌存在抑菌方式多样、种类和数量众多、容易培养等特点,因此,筛选和研究内生生防细菌具有重要的现实意义[5]。
当前应用较多的内生生防细菌有气单胞菌属(Aeromonas)、微杆菌属(Microbacterium)、芽孢杆菌属等细菌,其中应用最为普遍的是芽孢杆菌属细菌[6]。陈虹娇等将枯草芽孢杆菌菌株(Bacillus subtilis S37)接种到棉苗上,测定其对棉苗立枯病(Cotton Rhizoctoniosis)的防治效果,结果表明该菌株具有一定的拮抗作用[7]。此外,内生细菌还具有促生作用,促生特性包括产生吲哚乙酸、固氮、溶解磷、铁载体生物合成等[8]。
地锦草(Euphorbia humifusa)为大戟科大戟属的一年生草本植物,有地瓣草、乳汁草等多种别名[9],是一种常用的中药材,一般夏、秋季节采收全株。种子细小、卵形,茎纤细,长约20 cm,表面略带红色,采收季节带紫红色,长圆形叶片,叶绿色或带紫红色。该植物资源丰富、分布广泛,含有萜类[10]、甾醇类、鞣质及酚酸[11]等主要化学成分,该植物作为中药材多用于抗炎以及抑菌等方面,显示出重要的生物学潜力[12-14]。有研究表明,地锦草对多种植物致病菌及动物致病菌有一定抑制作用,抗菌能力强且抗菌谱较广[15-17]。除药理作用外,地锦草也具有重要的经济价值。例如,可以利用地锦草的抗菌作用来提高真丝织物的抗菌活性[18]。在韩国,该植物用于生产许多功能性饮品如清热消炎的草药茶,以及护肤、防止脱发的产品,还利用其提取物生产缓解宿醉的饮料[19]。
目前,地锦草的研究主要集中在成分分析、化合物的含量测定及生物学活性研究等方面,而对地锦草内生细菌的研究还未见报道。因此,本研究对地锦草内生细菌进行分离鉴定,以3种常见的植物病原菌为指示菌筛选拮抗菌株,并验证内生细菌产吲哚乙酸(Indole Acetic Acid,IAA)、固氮、溶磷、铁载体合成能力,挖掘优异的拮抗、促生内生菌资源,以期有益于内生细菌的综合利用。
1 材料与方法 1.1 材料供试植物:2016年7月在新疆和田地区吉亚乡地锦草培养点采集地锦草健康品种。采样点位置为:80°0′10.44′′E,37°9′42.12′′N。采样时将整株植物拔出,4 ℃下保存带至实验室后立即进行处理。供试病原菌:小麦赤霉病菌(Fusarium graminearum FG-389)、棉花立枯丝核菌(Rhizoctonia solani AG-4)和玉米小斑病菌(Bipolaris maydis JC2530)均来自新疆农业大学农学院。
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠10.0,琼脂粉20.0,pH 7.2;NA培养基(g/L):蛋白胨10.0,牛肉膏3.0,氯化钠5.0,琼脂粉20.0,pH 7.4;PDA培养基(g/L):去皮马铃薯200.0,葡萄糖20.0,琼脂粉20.0,pH 7.0;高氏一号培养基(g/L):可溶性淀粉20.0,硝酸钾1.0,磷酸氢钾0.5,氯化钠0.5,七水合硫酸镁0.5,七水合硫酸亚铁0.01,琼脂粉15.0,pH 7.4;NBRIP培养基(g/L):葡萄糖10.0,磷酸三钙5.0,氯化镁5.0,七水合硫酸镁0.25,氯化钾0.2,硫酸铵0.1,琼脂粉15.0,pH 7.0;Ashby无氮培养基(g/L):甘露醇10.0,磷酸二氢钾0.2,七水合硫酸镁0.2,氯化钠0.2,二水合硫酸钙0.1,碳酸钙5.0,琼脂粉15.0,pH 7.0。
主要试剂和仪器:铬天青(Chromeazurol S,CAS)、革兰氏染色试剂盒,青岛海博生物技术有限公司;细菌16S rRNA基因通用引物27F (5′-AG AGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGT TACCTTGTTACGACTT-3′),生工生物工程(上海)股份有限公司。超声波清洗机,宿迁华诺超声科技有限公司;PCR仪,Biometra Gmbh公司;紫外分光光度计,Eppendorf公司。
1.2 方法 1.2.1 内生细菌的分离鉴定取植物全草进行表面消毒,具体步骤如下:(1)冲洗表面泥土,超声波清洗机清洗15−20 min;(2) 0.1%的吐温-20浸泡1 min;(3)有效氯含量为5%的次氯酸钠溶液处理5 min,无菌水清洗3次;(4)灭菌的2.5%硫代硫酸钠溶液处理10 min,无菌水冲洗3次;(5) 70%乙醇处理3 min,最后用无菌水将全草样品冲洗5次,置于无菌环境中自然干燥[20]。
取100 μL最终冲洗地锦草的水在NA培养基上进行涂布,28 ℃培养5 d,根据有无菌落的生长确认表面消毒是否充分。
上述处理后的全草样品用提前灭好菌的研钵进行研磨,称1 g于49 mL的生理盐水中,28 ℃、180 r/min摇床培养2 h,培养后的菌液进行6个梯度的10倍比稀释[21]。不同浓度的菌悬液各取150 μL于分离培养基上,28 ℃培养2−7 d,重复3次。平板上有菌长出后,观察菌落及细胞形态,选取单菌落在各培养基上反复进行纯化,得到的菌株视为纯分离株,在各分离培养基的斜面上临时保藏。菌株用无菌生理盐水制成细菌悬液,无菌条件下取等体积的菌悬液和50%的甘油溶液,倒入离心管中,于−20 ℃进行长期保藏[22]。
对已保存好的菌株进行形态、革兰氏染色,以及分子系统学特征鉴定。
首先提取细菌总DNA,选用煮沸法。参照文献[5]进行细菌16S rRNA基因PCR扩增。PCR反应体系(50 μL):2×TSINGKE Master Mix 25 μL,模板DNA 1 μL,27F和1492R引物(100 μmol/L)各0.7 μL,ddH2O 22.6 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃ 8 min。
PCR扩增后所得产物用1%的琼脂糖凝胶进行检测,将条带清晰的PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。得到的序列结果进行序列比对,按序列相似度大于97%的标准选择参考菌株。采用邻接(Neighbor-Joining,NJ)法构建系统发育树,进行系统发育学分析[23]。
1.2.2 内生拮抗菌株的筛选采用平板对峙法[24],首先活化内生细菌和植物病原菌,小麦赤霉病菌用NA培养基,其余2个病原菌用PDA培养基;然后在培养基中间接入直径为6 mm的供试菌菌饼,同时在菌饼两旁2 cm处对称接种内生细菌,每组重复3次,28 ℃培养5−7 d,对照组只接病原菌,根据公式计算抑菌率。抑菌率(%)=(对照菌落半径−处理菌落半径)/对照菌落半径×100。对不同菌株抑菌率进行单因素方差分析,并用Duncan法对数据进行多重比较。
1.2.3 内生细菌促生潜力研究(1) 内生固氮细菌的筛选
将已活化好的菌株接种于NA液体培养基中,28 ℃、180 r/min培养1 d,菌悬液以1:50的比例加到Ashby液体培养基中,培养5−7 d;如果实验组变浑浊则为阳性,具有固氮活性;将具有固氮活性的菌株在固体Ashby培养基上连续继代3次,第3次仍有活性即可视为具有稳定固氮活性。
(2) 内生溶磷细菌的筛选
用NBRIP固体培养基测试细菌溶解磷酸盐的能力[25],首先进行菌株活化,随后接种于上述培养基上,在28 ℃培养5−7 d,测定溶磷圈直径(D)和菌落直径(d),根据能否产生溶磷圈与D/d值的大小初步判断菌株的溶磷能力。
(3) 产吲哚乙酸内生细菌的筛选
产吲哚乙酸细菌的筛选:将试验菌株用NA液体培养基暗培养4 d,该培养基含有L-色氨酸(200 μg/mL);将菌悬液和Sallcowski比色液同体积滴到白色陶瓷板上,立即避光静置30 min,以50 μL浓度为50 mg/L的吲哚乙酸标准品液作对照。如果菌株产吲哚乙酸,颜色会变红。
吲哚乙酸的定量测定:将已筛选出的能产IAA的菌按照上述方法暗培养4 d,发酵液浓度调为一致,OD600值都调为1.0。取适当的发酵液,8 000 r/min离心10 min后取上清液转入EP管中,Sallcowski比色液取同样体积于EP管中,立即置于避光条件下,30 min之后测定其OD530值,重复3次,测定功能菌株产生的吲哚乙酸含量[26]。
(4) 合成铁载体内生细菌的筛选
用CAS检测固体平板测定菌株能否产生铁载体。将已活化菌株点接于已配好的CAS检测固体平板上,28 ℃培养3 d,观察菌落周围是否形成橙黄色晕圈,如有则为能产铁载体。
2 结果与分析 2.1 内生细菌的多样性分析课题组于7月份采集地锦草样品,正值该植物结果。共采集40多株地锦草健康植株。分离内生菌时选择地锦草全草,包括根、茎、叶和未成熟果实,植株高度分布在12−20 cm。由于该植物根、茎纤细,叶片细小,果实很小,采用全草研磨法分离内生菌。
消毒处理后的全草进行研磨,称1 g于49 mL生理盐水中,28 ℃、180 r/min摇床培养2 h,随后进行10倍比稀释菌悬液,6个梯度的菌悬液各取150 μL于分离培养基上,培养2−7 d。根据形态差异,从4种不同的培养基中获得133株细菌,其中革兰氏阳性菌株有59株、阴性菌株74株,各占总菌株的44.36%和54.14%。根据培养基的不同对菌株命名DHL、DHP、DHN、DHG,分别为LB、PDA、NA、高氏一号培养基上筛选的菌株。初步判定:133株菌分属于4门5纲8目13科25属。优势门和优势属分别为变形菌门(52.63%)和芽孢杆菌属(15.79%)。此外,相似性小于98.65%的潜在新种菌株有8个,是否新种需进一步研究(表 1)。
| 门 Phylum |
纲 Class |
属 Genus |
相似菌株及GenBank登录号 Similar strain and GenBank accession No. |
菌株数 Number of strains |
| 放线菌门 Actinobacteria |
放线菌纲 Actinobacteria |
微杆菌属Microbacterium | Microbacterium oleivorans NBRC103075 (BCRG01000019) |
5 |
| Microbacterium maritypicum DSM 12512 (AJ853910) | 1 | |||
| Microbacterium sorbitolivorans SZDIS-1-1 (KX250270) |
2 | |||
| 微球菌属 Micrococcus |
Micrococcus endophyticus YIM 56238 (EU005372) |
1 | ||
| Micrococcus yunnanensis YIM 65004 (FJ214355) | 1 | |||
| 白杆菌属 Leucobacter |
Leucobacter aridicollis CIP108388 (AJ781047) |
3 | ||
| 考克氏菌属 Kocuria |
Kocuria rosea DSM 20447 (X87756) |
1 | ||
| 谷氨酸杆菌 Glutamicibacter |
Glutamicibacter protophormiae DSM20168 (X80745) | 1 | ||
| 短小杆菌属 Curtobacterium |
Curtobacterium flaccumfaciens LMG 3645 (AJ312209) | 4 | ||
| 棒杆菌属 Corynebacterium |
Corynebacterium stationis DSM 20302 (CP009251) |
1 | ||
| 短杆菌属 Brevibacterium |
Brevibacterium sediminis FXJ8.269 (KX356313) |
1 | ||
| 拟杆菌门 Bacteroidetes |
黄杆菌纲 Flavobacteria |
香味菌属 Myroides |
Myroides odoratus 90A (C2M) (KF254739) | 2 |
| Myroides xuanwuensis TH-19 (NR133793) | 3 | |||
| 厚壁菌门 Firmicutes |
芽孢杆菌纲 Bacilli |
芽孢杆菌属 Bacillus |
Bacillus stratosphericus SN4-2 (MT071703) | 2 |
| Bacillus cereus EVRAPSUBAC-1 (KY293394) | 1 | |||
| Bacillus halotolerans KSI1507 (MN519259) |
2 | |||
| Bacillus paramycoides NH24A2 (KJ812444) |
1 | |||
| Bacillus subtilis ZGL14 (MH362700) | 4 | |||
| Bacillus terrae RA9 (KY072724) |
2 | |||
| Bacillus velezensis EH9 (MN750764) |
3 | |||
| Bacillus zhangzhouensis SEA-1 (MF442426) |
6 | |||
| 金黄杆菌属 Chryseomicrobium |
Chryseomicrobium amylolyticum JC16 (FM209428) |
6 | ||
| 肠球菌属 Enterococcus |
Enterococcus avium ATCC 14025 (KE136366) |
1 | ||
| 梭形杆菌属 Lysinibacillus |
Lysinibacillus alkalisoli Y2A20 (KX258757) |
7 | ||
| 葡萄球菌属 Staphylococcus |
Staphylococcus sciuri DSM 20345 (AJ421446) |
2 | ||
| 变形菌门 Proteobacteria |
β-变形菌纲 Beta- proteobacteria |
产碱杆属 Alcaligenes |
Alcaligenes faecalis subsp. faecalis AE1.16 (GQ284565) |
6 |
| Kerstersia | Kerstersia gyiorum LMG5906 (AY131213) |
4 | ||
| Paenalcaligenes | Paenalcaligenes suwonensis ABC02-12 (JX217748) |
1 | ||
| γ-变形菌纲 Gamma- proteobacteria |
不动杆菌属 Acinetobacter |
Acinetobacter schindleri CIP 107287 (APPQ01000011) | 5 | |
| 肠杆菌属 Enterobacter |
Enterobacter hormaechei subsp. xiangfangensis OSUVMCKPC4-2 (CP029246) |
4 | ||
| Kosakonia | Kosakonia cowanii JCM 10956 (BBEU01000098) |
11 | ||
| 泛菌属 Pantoea |
Flavobacterium acidificum LMG 8364 (JX986959) | 3 | ||
| Pantoea dispersa LMG 2603 (DQ504305) |
16 | |||
| 变形杆菌属 Proteus |
Proteus penneri NCTC 12737 (DQ885258) | 2 | ||
| Proteus vulgaris ATCC29905 (DQ885257) | 4 | |||
| 普罗维登菌属 Providencia |
Providencia rettgeri DSM 4542 (AM040492) |
3 | ||
| Providencia vermicola OP1 (AM040495) | 1 | |||
| 假单胞菌属 Pseudomonas |
Pseudomonas psychrotolerans S6-247 (JQ660202) |
2 | ||
| Siccibacter | Siccibacter colletis WTB73 (MK241859) |
8 |
133株菌经传代后93株活化成功,选用3种常见的植物病原菌进行拮抗实验。每种病原菌单独为一批实验,培养时间为5−7 d,期间观察抑菌圈及对照组的生长状况,待抑菌圈稳定且对照组长满平板时计算抑菌率。玉米小斑病菌组和小麦赤霉病菌培养到第5天,棉花立枯丝核菌组培养到第7天,22株内生细菌对3种病原菌有不同程度的抑制作用(表 2)。其中,19株菌能抑制棉花立枯丝核菌,DHL56抑制作用最强,抑制率为74.60%;8株菌能抑制小麦赤霉病菌,DHP3抑制作用最强,抑制率为75.40%;11株菌能抑制玉米小斑病菌,DHP8抑制作用最强,抑制率为61.70%。菌株DHL56、DHP8、DHP3、DHN17对3种病原菌都有抑制作用,其中菌株DHP8对3种病原菌综合抑制作用最强,对棉花立枯丝核菌和小麦赤霉病菌抑制率分别为73.80%和71.25%,对玉米小斑病菌抑制率为61.70%。
| 菌株号Strains No. | 抑菌率Inhibition rate (%) | ||
| 棉花立枯丝核菌 R. solani |
小麦赤霉病菌 F. graminearum |
玉米小斑病菌 B. maydis |
|
| DHL10 | 31.70fg | − | − |
| DHL18 | 6.70i | 10.40d | − |
| DHL19 | 6.70i | 24.58c | − |
| DHL24 | 27.90g | − | − |
| DHL26 | 18.75h | − | − |
| DHL27 | 28.75g | − | − |
| DHL28 | − | − | 34.58f |
| DHL30 | 35.00f | − | 45.40d |
| DHL31 | 41.70e | − | 50.40cd |
| DHL54 | 49.60d | − | 48.75cd |
| DHL56 | 74.60a | 74.60a | 52.90bc |
| DHN2 | 56.30c | − | 57.08ab |
| DHN17 | 62.90b | 50.00b | 50.80cd |
| DHN19 | − | − | 40.00e |
| DHN25 | − | − | − |
| DHN32 | 5.00i | 21.25c | − |
| DHG3 | 10.00i | 20.80c | − |
| DHG28 | 27.10g | − | − |
| DHP3 | 72.50a | 75.40a | 57.90ab |
| DHP6 | 45.80de | − | 58.75a |
| DHP7 | 58.30bc | − | − |
| DHP8 | 73.80a | 71.25a | 61.70a |
| 注:−:无拮抗作用;同一列不同字母表示在0.05水平差异显著。下同 Note: −: No antagonistic activity; The different letters in the same row indicate significant difference at P < 0.05 level. The same below |
|||
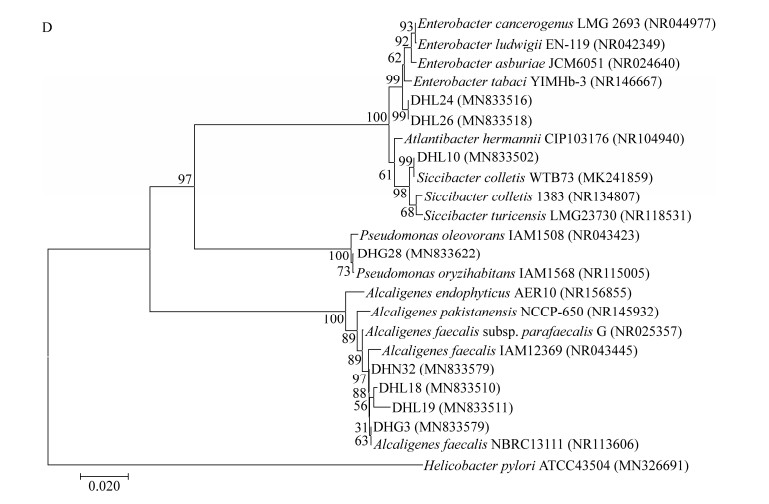
结合分子生物学鉴定,22株拮抗菌株属于5门7属,芽孢杆菌属占优势(图 1)。
|
| 图 1 拮抗菌系统发育分析 Figure 1 The phylogenetic analysis of antagonistic bacteria 注:A、B、C、D分别为香味菌属、微球菌属、芽孢杆菌属、变形菌门菌株的系统发育树;括号内数值为菌株在GenBank中的登录号;分支点上数字为重复1 000次的自展值;标尺0.020为核苷酸替换率;选择的外群分别是:A:Sphingobacterium spiritivorum DSM2582;B:Staphylococcus pasteuri ATCC51129;C:Clostridium bowmanii DSM14206;D: Helicobacter pylori ATCC43504 Note: A, B, C, D are phylogenetic trees of Myroides, Micrococcus, Bacillus and Proteobacteria respectively; Numbers in parentheses are GenBank accession numbers; Numbers at the nodes indicate the level of bootstrap values based on 1 000 replications; The scale bar indicates 0.020 substitutions per nucleotide position; The selected out-groups are A: Sphingobacterium spiritivorum DSM2582; B: Staphylococcus pasteuri ATCC51129; C: Clostridium bowmanii DSM14206; D: Helicobacter pylori ATCC43504 |
|
|
93株内生细菌活化后接种于Ashby培养基,结果显示76株菌能够使Ashby液体培养基变浑浊,并能在Ashby固体培养基上生长,说明有固氮能力(表 3),占所用菌株的81.72%。这76株分别属于25个属,芽孢杆菌属占优势。
| 菌株号 Strains No. |
相似物种 Similar species |
固氮作用 Nitrogen fixation |
| DHL1 | Acinetobacter radioresistens | ++ |
| DHL2 | Flavobacterium acidificum | +++ |
| DHL3 | Microbacterium oleivorans | + |
| DHL4 | Kerstersia gyiorum | +++ |
| DHL5 | Proteus vulgaris | + |
| DHL6 | Glutamicibacter protophormiae | ++ |
| DHL10 | Siccibacter colletis | ++ |
| DHL12 | Kerstersia gyiorum | +++ |
| DHL13 | Myroides xuanwuensis | + |
| DHL14 | Kosakonia cowanii | +++ |
| DHL16 | Lysinibacillus alkalisoli | ++ |
| DHL17 | Providencia rettgeri | + |
| DHL18 | Alcaligenes faecalis subsp. phenolicus | +++ |
| DHL19 | Alcaligenes faecalis subsp. phenolicus | +++ |
| DHL20 | Staphylococcus sciuri | ++ |
| DHL21 | Leucobacter aridicollis | + |
| DHL23 | Staphylococcus sciuri | +++ |
| DHL24 | Enterobacter xiangfangensis | +++ |
| DHL25 | Enterobacter xiangfangensis | +++ |
| DHL26 | Enterobacter xiangfangensis | +++ |
| DHL27 | Bacillus tequilensis | ++ |
| DHL28 | Bacillus zhangzhouensis | +++ |
| DHL30 | Bacillus altitudinis | +++ |
| DHL31 | Bacillus zhangzhouensis | +++ |
| DHL32 | Alcaligenes faecalis subsp. phenolicus | +++ |
| DHL33 | Microbacterium sorbitolivorans | ++ |
| DHL34 | Corynebacterium stationis | +++ |
| DHL36 | Chryseomicrobium amylolyticum | + |
| DHL43 | Kocuria rosea | ++ |
| DHL47 | Brevibacterium sediminis | +++ |
| DHL48 | Microbacterium maritypicum | ++ |
| DHL49 | Leucobacter aridicollis | ++ |
| DHL51 | Bacillus zhangzhouensis | + |
| DHL53 | Bacillus velezensis | +++ |
| DHL54 | Bacillus velezensis | +++ |
| DHL55 | Proteus penneri | +++ |
| DHL56 | Bacillus anthracis | +++ |
| DHL57 | Microbacterium oleivorans | ++ |
| DHN1 | Lysinibacillus alkalisoli | ++ |
| DHN2 | Bacillus altitudinis | + |
| DHN8 | Enterococcus avium | + |
| DHN10 | Microbacterium sorbitolivorans | + |
| DHN11 | Flavobacterium acidificum | ++ |
| DHN13 | Proteus vulgaris | + |
| DHN15 | Proteus vulgaris | + |
| DHN16 | Proteus penneri | ++ |
| DHN17 | Bacillus zhangzhouensis | +++ |
| DHN21 | Acinetobacter schindleri | ++ |
| DHN23 | Acinetobacter schindleri | +++ |
| DHN25 | Micrococcus endophyticus | + |
| DHN26 | Providencia vermicola | + |
| DHN29 | Proteus vulgaris | +++ |
| DHN31 | Paenalcaligenes suwonensis | + |
| DHN32 | Alcaligenes faecalis subsp. phenolicus | ++ |
| DHN33 | Alcaligenes faecalis subsp. phenolicus | ++ |
| DHG3 | Alcaligenes faecalis subsp. phenolicus | ++ |
| DHG4 | Curtobacterium flaccumfaciens | ++ |
| DHG9 | Curtobacterium flaccumfaciens | ++ |
| DHG10 | Pantoea dispersa | +++ |
| DHG14 | Microbacterium oleivorans | +++ |
| DHG15 | Microbacterium oleivorans | +++ |
| DHG18 | Providencia rettgeri | ++ |
| DHG19 | Curtobacterium flaccumfaciens | ++ |
| DHG22 | Siccibacter colletis | +++ |
| DHG26 | Micrococcus yunnanensis | + |
| DHG27 | Pantoea dispersa | ++ |
| DHG28 | Pseudomonas psychrotolerans | +++ |
| DHG29 | Microbacterium oleivorans | +++ |
| DHP3 | Bacillus halotolerans | ++ |
| DHP6 | Bacillus zhangzhouensis | +++ |
| DHP7 | Bacillus velezensis | +++ |
| DHP8 | Bacillus halotolerans | +++ |
| DHP9 | Bacillus tequilensis | +++ |
| DHP12 | Bacillus tequilensis | +++ |
| DHP13 | Bacillus paramycoides | +++ |
| DHP14 | Bacillus tequilensis | +++ |
| 注:+++:液体培养基浑浊度及菌株在Ashby固体培养基上生长很明显;++:明显;+:较明显 Note: +++: Turbidity of liquid medium and growth of strain on Ashby solid medium are very obvious; ++: Obvious; +: Relatively obvious |
||
93株内生细菌中19株菌能在NBRIP固体培养基上形成透明圈(表 4),说明对磷酸钙有溶解效果,它们分属于8个属,芽孢杆菌属占优势。同时,这19株菌都具有固氮能力,即93株菌中有19株菌同时具有溶磷和固氮能力。
| 菌株号 Strains No. |
相似物种 Similar species |
溶磷能力 Phosphate solubilization |
溶磷圈直径D Soluble phosphorus circle (cm) |
菌落直径d Colony diameter (cm) |
D/d |
| DHL2 | Flavobacterium acidificum | ++ | 2.32cde | 1.03ef | 2.24cd |
| DHL10 | Siccibacter colletis | ++ | 2.61cd | 1.43bcd | 1.83ef |
| DHL14 | Kosakonia cowanii | +++ | 4.00a | 1.47bc | 2.73ab |
| DHL24 | Enterobacter xiangfangensis | +++ | 3.99a | 1.31cde | 3.05a |
| DHL25 | Enterobacter xiangfangensis | ++ | 3.42b | 1.87a | 1.83ef |
| DHL26 | Enterobacter xiangfangensis | + | 1.52ghi | 1.16cdef | 1.33gh |
| DHL30 | Bacillus altitudinis | + | 1.12i | 0.89f | 1.28h |
| DHL53 | Bacillus velezensis | + | 1.33hi | 0.92f | 1.42gh |
| DHN2 | Bacillus altitudinis | ++ | 2.13def | 1.28cde | 1.68efg |
| DHN17 | Bacillus zhangzhouensis | +++ | 2.71c | 1.07ef | 2.53bc |
| DHG9 | Curtobacterium flaccumfaciens | + | 1.62fghi | 1.32cde | 1.23h |
| DHG18 | Providencia rettgeri | + | 1.62fghi | 1.31cde | 1.22h |
| DHG22 | Siccibacter colletis | +++ | 3.79ab | 1.41bcd | 2.71ab |
| DHG27 | Pantoea dispersa | + | 1.66fgh | 1.32cde | 1.25h |
| DHG28 | Pseudomonas psychrotolerans | ++ | 2.43cde | 1.23cde | 1.98de |
| DHP3 | Bacillus halotolerans | ++ | 2.59cd | 1.16def | 2.24cd |
| DHP7 | Bacillus velezensis | ++ | 1.98efg | 1.24cde | 1.61fgh |
| DHP8 | Bacillus halotolerans | ++ | 2.73c | 1.22cde | 2.25cd |
| DHP12 | Bacillus tequilensis | + | 2.38cde | 1.61b | 1.47fgh |
| 注:+++:D/d在2.5−3.5之间;++:D/d在1.5−2.5之间;+:D/d在1.0−1.5之间 Note: +++: D/d is between 2.5−3.5; ++: D/d is between 1.5−2.5; +: D/d is between 1.0−1.5 |
|||||
Sallcowski比色液加到菌悬液中立即避光静置,观察变色来确定此菌是否产生吲哚乙酸。结果显示37株菌产吲哚乙酸,占所用菌株的39.78%,菌株产吲哚乙酸的量如表 5所示。它们分别属于4门19属,假单胞菌属和泛菌属占优势。菌株DHL55产吲哚乙酸量最多,为105.67 mg/L,其属于变形杆菌属;产吲哚乙酸量大于50 mg/L的菌株有DHL25、DHG27、DHL36、DHL2、DHN29、DHL12、DHG28;其他29株菌的吲哚乙酸产量在0.67−49.98 mg/L之间。其中,有9株菌同时具有固氮和溶磷能力(DHL2、DHL14、DHL24、DHL25、DHL26、DHL53、DHG18、DHG27和DHG28)。
| 菌株号 Strains No. |
相似物种 Similar species |
吲哚乙酸 IAA (mg/L) |
| DHL2 | Flavobacterium acidificum | 64.10cd |
| DHL4 | Kerstersia gyiorum | 39.30fg |
| DHL9 | Siccibacter colletis | 2.30mn |
| DHL11 | Myroides odoratus | 2.50mn |
| DHL12 | Kerstersia gyiorum | 86.30b |
| DHL14 | Kosakonia cowanii | 26.95ghij |
| DHL17 | Providencia rettgeri | 23.05hijk |
| DHL21 | Leucobacter aridicollis | 34.80gh |
| DHL24 | Enterobacter xiangfangensis | 5.67lmn |
| DHL25 | Enterobacter xiangfangensis | 50.39ef |
| DHL26 | Enterobacter xiangfangensis | 22.62hijk |
| DHL31 | Bacillus zhangzhouensis | 5.64lmn |
| DHL34 | Corynebacterium stationis | 24.14hijk |
| DHL36 | Chryseomicrobium amylolyticum | 62.50cd |
| DHL43 | Kocuria rosea | 38.69fg |
| DHL47 | Brevibacterium sediminis | 33.51gh |
| DHL49 | Leucobacter aridicollis | 4.82lmn |
| DHL52 | Myroides xuanwuensis | 2.52mn |
| DHL53 | Bacillus velezensis | 22.02hijk |
| DHL55 | Proteus penneri | 105.67a |
| DHL57 | Microbacterium oleivorans | 3.86mn |
| DHN11 | Flavobacterium acidificum | 15.28jklm |
| DHN13 | Proteus vulgaris | 16.42jkl |
| DHN15 | Proteus vulgaris | 0.67n |
| DHN16 | Proteus penneri | 49.98ef |
| DHN21 | Acinetobacter schindleri | 28.19ghij |
| DHN22 | Pantoea dispersa | 13.24klmn |
| DHN25 | Micrococcus endophyticus | 16.48jkL |
| DHN26 | Providencia vermicola | 12.44klmn |
| DHN28 | Myroides xuanwuensis | 6.65lmn |
| DHN29 | Proteus vulgaris | 71.33c |
| DHN33 | Alcaligenes faecalis subsp. phenolicus | 7.37mn |
| DHG18 | Providencia rettgeri | 20.24ijk |
| DHG26 | Micrococcus yunnanensis | 32.64ghi |
| DHG27 | Pantoea dispersa | 58.81de |
| DHG28 | Pseudomonas psychrotolerans | 86.75b |
| DHG29 | Microbacterium oleivorans | 5.55lmn |
| CK | 0 |
使用CAS蓝色检测平板,通过观察菌株周围是否有橙黄色晕圈来判断是否能合成铁载体。结果显示,DHL51、DHL56、DHP3、DHP8、DHP12、DHP13和DHP14这7株菌能合成铁载体,占所用菌株的7.52%,均为芽孢杆菌属。其中DHL56合成铁载体的能力最强(图 2),DHP8同时还具有固氮和解磷功能。

|
| 图 2 菌株DHL56合成铁载体能力 Figure 2 Siderophore activity of strain DHL56 |
|
|
植物内生菌在多数情况下与宿主植物是互惠共生的[27]。在从宿主那里获得稳定生活环境的同时,内生菌可从以下几个方面对宿主产生积极作用:(1)内生菌可以提高宿主抗性。主要是通过产生抗生素等代谢产物或通过诱导宿主系统抗性来帮助宿主应对生物胁迫,也可提高宿主抗性基因表达,进而促进宿主体内与抗性相关代谢物的积累,比如,有研究表明油菜内生菌Heteroconium chaetospira能诱导宿主对油菜疟原虫的抗性,进一步研究发现,该内生菌通过上调宿主中与茉莉酸、乙烯、生长素及PR-2蛋白生物合成相关的基因来诱导宿主对疟原虫的抗性[28];一些内生细菌通过自身代谢产物,如脱落酸(Abscisic Acid,ABA)等来提高宿主植物在非生物胁迫下的抗逆性[29]。(2)内生菌能够促进宿主生长。一些内生细菌通过调节生长相关激素、帮助宿主获得氮磷等限制性植物营养来促进宿主生物量的增加,从而发挥促生作用[30]。(3)内生菌能产生与宿主相同或相似的代谢产物,甚至有些天然代谢产物是内生菌与宿主相结合而产生的物质。例如,我国珍稀中药龙血竭是在内生菌侵染条件下激活龙血树免疫系统产生的防御性产物。我国学者从龙血树产生天然血竭部位分离出优势内生菌镰孢霉菌(Fusarium proliferatum),在云南等地采用为植物“输液”的办法将真菌孢子输入龙血树体内,在较短的时间内产生高质量的血竭[31]。
内生菌对宿主植物有广泛的生物学作用,宿主植物的优良性状与内生菌功能息息相关。因此,深入研究植物内生菌的种群结构以及生物学功能具有重要意义[32]。
本研究中共分离到133株地锦草内生细菌。通过16S rRNA基因分子鉴定,所有菌株分属4门5纲8目13科25属,具有较丰富的多样性。研究表明,植物中分离到的内生细菌大部分属于芽孢杆菌属[33-34]。本研究中优势属为芽孢杆菌属,占15.79%。这与其他研究者的结果一致,但本研究中分离到的Kerstersia、Paenalcaligenes、Kosakonia等属很少见,增加了植物内生可培养细菌范畴。
随着农业的不断发展,某些植物病害的发生呈逐渐上升趋势,需要一些无病害、资源丰富的生防剂。内生菌凭借来源广泛、易于培养、与植物互惠共生等优势,成为近年来生防菌剂研发的热点。本研究测定内生细菌对3种常见植物病原菌的拮抗活性,发现22株菌有不同程度的拮抗活性。其中19株菌抑制棉花立枯丝核菌、8株菌抑制小麦赤霉病菌、11株菌能抑制玉米小斑病菌。菌株DHL56、DHN17、DHP3、DHP8对3种原病菌都有抑制作用,是芽孢杆菌属的不同物种。这与前人的研究结果吻合[35-37]。本研究虽然在实验室水平上分离得到具有较强拮抗功能的菌株,但是选用的病原菌数目较少。筛选生防内生菌时,用作供试菌的病原菌种类应当较多,防止筛选的功能菌株生防能力单一、应用范围窄,也可将多种菌剂配合使用,提高内生细菌的综合应用效果[38]。
采用4个指标进行促生潜力研究,初步筛选分离到76株具有固氮能力的菌株,占所用菌株的81.72%,多数为芽孢杆菌属。7株菌能合成铁载体,占7.52%,均为芽孢杆菌属。芽孢杆菌属是目前生防菌中研究较多的一类细菌,枯草芽孢杆菌、巨大芽孢杆菌(Bacillus megaterium)等均为生物防治中重要的菌种资源[39]。芽孢杆菌属不仅对一些植物病害有较好的防治效果,并且对植物的生长具有促生作用,这可能与芽孢杆菌属具有较强的抗逆性有关。19株菌具有解磷能力,占所有菌株的20.4%。国内外已经研究发现假单胞菌属、泛菌属、伯克霍尔德氏菌属(Burkholderia)是常见的解磷内生细菌[40],本研究结果中也出现能解磷的假单胞菌属、泛菌属,与该研究结果相似。37株菌具有产吲哚乙酸能力,占39.78%,吲哚乙酸产量在0.67−105.67 mg/L之间;菌株DHL55产吲哚乙酸量的达到105.67 mg/L,能力最强,属于变形杆菌属。9株菌同时有固氮、解磷、产吲哚乙酸能力。DHP8不仅对本研究中3种植物病原菌有明显的抑制作用,也具有多种促生特性,需进一步研究。
本研究对内生细菌促生特性只进行了初步分析,需进一步对固氮酶活性、溶磷量等进行测定。本研究中通过无氮培养基初筛得到较高比例的内生固氮菌,但只是对内生细菌有无固氮能力作了初步判断,没有进一步测定固氮酶活性,因此结果可靠性不强。固氮酶活性是衡量生物固氮效率的重要指标之一。除了体外固氮能力的测定,还应该将固氮菌回接到植物体内研究其促生效应。此外,最新研究表明能否高产胞外多糖也成为了固氮菌筛选的一种指标[41]。因为固氮菌所含的固氮酶对氧极其敏感,在一切氧条件下固氮酶均会失活,从而丧失了固氮催化反应的能力,而胞外多糖可以控制进入固氮菌菌体细胞的氧浓度[42-43]。近年来,国内外研究者对各类植物中的内生固氮菌及其固氮能力进行了研究,发现许多植物中都存在较高比例的内生固氮菌。例如,从尼瓦拉野生稻中共分离到57株内生细菌,其中44株为内生固氮菌,固氮酶活性在5.79−899.72 nmol/(mL·h)之间[44];采用高通量测序技术对巨菌草不同生长时期的内生固氮菌群组成进行分析,结果表明该植物含有丰富的固氮菌群种类和丰度[45]。溶磷圈法常用于溶磷菌株的筛选,该方法常用于初步判断菌株是否有溶磷能力,该方法容易出现假阴性结果,平板筛选时可能会因菌落较多以及菌落间竞争,使一些原本具有溶磷能力的菌株未出现溶磷圈;对菌株的溶磷能力进行定量时常用液体培养法,而且液体培养时溶磷细菌可以利用多种难溶性的无机磷,理论上更严谨、合理[46]。本研究中缺少盆栽试验环节,此外,能否在植物体内定殖是生防细菌发挥其生防作用的重要影响因素之一,可以在后期试验中加入内生细菌定殖以及定殖的追踪与监测。
| [1] |
Ying WL. Screening and preparation of the wettable powder of two plant endophytic bacteria[D]. Jinzhong: Master's Thesis of Shanxi Agricultural University, 2016 (in Chinese) 应万里. 两株植物内生拮抗细菌的筛选及其可湿性粉剂的制备[D]. 晋中: 山西农业大学硕士学位论文, 2016 |
| [2] |
Santoyo G, Moreno-Hagelsieb G, Del Carmen Orozco-Mosqueda M, Glick BR. Plant growth-promoting bacterial endophytes[J]. Microbiological Research, 2016, 183: 92-99. DOI:10.1016/j.micres.2015.11.008 |
| [3] |
Choudhary DK, Kasotia A, Jain S, Vaishnav A, Kumari S, Sharma KP, Varma A. Bacterial-mediated tolerance and resistance to plants under abiotic and biotic stresses[J]. Journal of Plant Growth Regulation, 2016, 35(1): 276-300. DOI:10.1007/s00344-015-9521-x |
| [4] |
Pei SL, Liu D, Liu HQ, Wang YH, Han JC, Liu HP. Study on screening, identification and detection of antibiotic activity of endophytic bacteria from wild jujube[J]. Journal of Plant Protection, 2018, 45(4): 871-877. (in Chinese) 裴淑兰, 刘东, 刘慧芹, 王远宏, 韩巨才, 刘慧平. 野生酸枣内生细菌筛选、鉴定及其抑菌活性测定[J]. 植物保护学报, 2018, 45(4): 871-877. |
| [5] |
Jin MJ, Li SS, Tian WB, Yang CD, Wang YQ. Screening, identification and detection of growth-promoting antagonistic endophytic bacteria from Carex moorcroftii in alpine grassland[J]. Journal of Plant Protection, 2019, 46(4): 779-786. (in Chinese) 金梦军, 李珊珊, 田文波, 杨成德, 王玉琴. 高寒草地青藏苔草拮抗内生细菌筛选、鉴定及其促生作用测定[J]. 植物保护学报, 2019, 46(4): 779-786. |
| [6] |
Shi H, Tian YL, Wang J, Zhang W. Quantitative microflora variation and CCP of processing in clam (Cyclina sinensis)[J]. Fisheries Science, 2012, 31(3): 152-155. (in Chinese) 施惠, 田益玲, 王颉, 张伟. 青蛤原料微生态体系分析与加工过程中关键点的关系研究[J]. 水产科学, 2012, 31(3): 152-155. DOI:10.3969/j.issn.1003-1111.2012.03.006 |
| [7] |
Chen HJ, Li YX, Chen WJ, Yao ZQ, Cao XL, Zhao SF. Colonization of 2 Bacillus on cotton roots and their control effect on cotton rhizoctoniosis[J]. Journal of Shihezi University (Natural Science), 2018, 36(1): 75-80. (in Chinese) 陈虹娇, 李怡心, 陈文静, 姚兆群, 曹晓蕾, 赵思峰. 2株芽孢杆菌在棉花根部定殖动态及其对棉苗立枯病的防效[J]. 石河子大学学报:自然科学版, 2018, 36(1): 75-80. |
| [8] |
Wang SS. Screening of plant growth promoting and anti-drought bacteria isolated from populus euphratica forest soils and the study of their mechanisms[D]. Shanghai: Master's Thesis of East China University of Science and Technology, 2014 (in Chinese) 王珊珊. 胡杨林地土壤中促进植物耐旱生长微生物的筛选及其机理[D]. 上海: 华东理工大学硕士学位论文, 2014 |
| [9] |
Xu HY, Xue JY, Lu YD, Zheng WH. Study on extraction and biological activity of the effective constituents of Euphorbia humifusa[J]. Guangzhou Chemistry, 2020, 45(1): 24-30. (in Chinese) 许慧瑶, 薛建云, 卢玉栋, 郑文贺. 地锦草有效成分的提取及其生物活性的研究[J]. 广州化学, 2020, 45(1): 24-30. |
| [10] |
Lu ZQ, Chen GT, Zhang JQ, Huang HL, Guan SH, Guo DA. Four new lanostane triterpenoids from Euphorbia humifusa[J]. Helvetica Chimica Acta, 2007, 90(11): 2245-2250. DOI:10.1002/hlca.200790233 |
| [11] |
Yoshida T, Amakura Y, Liu YZ, Okuda T. Tannins and related polyphenols of euphorbiaceous plants. XI. Three new hydrolyzable tannins and a polyphenol glucoside from Euphorbia humifusa[J]. Chemical & Pharmaceutical Bulletin, 1994, 42(9): 1803-1807. |
| [12] |
Gao SY, Sun DJ, Wang G, Zhang J, Jiang YN, Li GY, Zhang K, Wang L, Huang J, Chen LX. Growth inhibitory effect of paratocarpin E, a prenylated chalcone isolated from Euphorbia humifusa Wild., by induction of autophagy and apoptosis in human breast cancer cells[J]. Bioorganic Chemistry, 2016, 69: 121-128. DOI:10.1016/j.bioorg.2016.10.005 |
| [13] |
Chang SY, Park JH, Kim YH, Kang JS, Min JY. A natural component from Euphorbia humifusa Willd displays novel, broad-spectrum anti-influenza activity by blocking nuclear export of viral ribonucleoprotein[J]. Biochemical and Biophysical Research Communications, 2016, 471(2): 282-289. DOI:10.1016/j.bbrc.2016.01.123 |
| [14] |
Tian Y, Sun LM, Li B, Liu XQ, Dong JX. New anti-HBV caryophyllane-type sesquiterpenoids from Euphorbia humifusa Willd[J]. Fitoterapia, 2011, 82(2): 251-254. DOI:10.1016/j.fitote.2010.10.005 |
| [15] |
Wang TT, Wen JF, Jin SN. Research progress on chemical constituents and pharmacological effects of Euphorbia humifusa[J]. Journal of Taishan Medical College, 2012, 33(8): 629-632. (in Chinese) 王婷婷, 文今福, 金松南. 地锦草的化学成分及药理作用研究进展[J]. 泰山医学院学报, 2012, 33(8): 629-632. DOI:10.3969/j.issn.1004-7115.2012.08.025 |
| [16] |
Bai XL, Mi W, Wang ZQ, Qiu SC, Wang D. The in vitro growth-inhibitory effect of Euphorbia humifusa Willd. (EHW) on bacteria[J]. Lishizhen Medicine and Materia Medica Research, 2007, 18(11): 2747. (in Chinese) 柏雪莲, 宓伟, 王志强, 邱世翠, 王冬. 地锦草体外抑菌作用研究[J]. 时珍国医国药, 2007, 18(11): 2747. DOI:10.3969/j.issn.1008-0805.2007.11.080 |
| [17] |
Xia JM, Hu ZY, Hai Y, Zhang ZW, Shi L, Li YM. Study on in vitro antimicrobial activity of traditional Chinese medicine herbal pair of Euphorbia humifusa Willd. and Portulaca oleracea L.[J]. China Pharmacist, 2016, 19(10): 1843-1846. (in Chinese) 夏俊梅, 胡中译, 海洋, 张振巍, 石磊, 李月梅. 地锦草-马齿苋药对的体外抑菌作用研究[J]. 中国药师, 2016, 19(10): 1843-1846. DOI:10.3969/j.issn.1008-049X.2016.10.010 |
| [18] |
Luyen BTT, Tai BH, Thao NP, Eun KJ, Cha JY, Xin MJ, Lee YM, Kim YH. Anti-inflammatory components of Euphorbia humifusa Willd[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(8): 1895-1900. |
| [19] |
Wu L, Zhou PJ, Wang XF. The application of antibacterial components of Euphorbia humifusa Willd on silk fabrics[J]. Advanced Materials Research, 2012, 441: 315-319. DOI:10.4028/www.scientific.net/AMR.441.315 |
| [20] |
Li J. Resources of endophytic actinobacteria associated with Artemisia annua and their influences on the growth and artemisinin biosynthesis of host plant[D]. Kunming: Doctoral Dissertation of Yunnan University, 2010 (in Chinese) 李洁. 黄花蒿内生放线菌资源及其对黄花蒿生长和青蒿素生物合成的影响[D]. 昆明: 云南大学博士学位论文, 2010 |
| [21] |
Xu JJ, Song P, Feng L, Hong W, Wu CZ, Li GQ, Zhao XJ, Ge HY. Growth-promoting effect and triptolide production regulation of endophytic bacteria from Tripterygium wilfordii[J]. Chinese Journal of Applied Ecology, 2014, 25(6): 1681-1687. (in Chinese) 许进娇, 宋萍, 封磊, 洪伟, 吴承祯, 李国庆, 赵希俊, 葛恒懿. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响[J]. 应用生态学报, 2014, 25(6): 1681-1687. |
| [22] |
Song XX. Screening, identification and growth condition optimization of an alkalophilic strain for lignin degradation[D]. Dalian: Master's Thesis of Dalian University of Technology, 2013 (in Chinese) 宋晓雪. 嗜碱木质素降解菌株筛选鉴定与生长条件优化[D]. 大连: 大连理工大学硕士学位论文, 2013 |
| [23] |
Tian L, Jiang Y, Chen CQ, Zhang GJ, Li T, Tong B, Xu P. Screening and identification of an endophytic bacterium with 1-aminocyclopropane-1-carboxylate deaminase activity from Panax ginseng and its effect on host growth[J]. Acta Microbiologica Sinica, 2014, 54(7): 760-769. (in Chinese) 田磊, 姜云, 陈长卿, 张冠军, 李桐, 佟斌, 许朋. 一株人参内生1-氨基环丙烷-1-1羧酸(ACC)脱氨酶活性细菌的筛选、鉴定及其对宿主生长的影响[J]. 微生物学报, 2014, 54(7): 760-769. |
| [24] |
Qiu ZW, Chen YZ, Yu AA, Zhu WY, Yang JL, Chen ZR. Isolation and characterization of endophytic bacteria from jujube roots and their antimicrobial activities to three kinds of jujube pathogenic fungi[J]. Journal of Tianjin Agricultural College, 2019, 26(3): 12-16. (in Chinese) 邱志伟, 陈有忠, 于奥安, 朱伟垚, 杨俊林, 陈招荣. 枣树根部内生细菌的分离及对3种枣病原真菌拮抗活性研究[J]. 天津农学院学报, 2019, 26(3): 12-16. |
| [25] |
Liu YF, Ma LJ, Zhang TT, Ma L. Identification and culture conditions optimization of phosphate-solubilizing bacteria in rhizosphere of Carthamus tinctorius L.[J]. Jiangsu Agricultural Sciences, 2019, 47(18): 287-291. (in Chinese) 刘玉凤, 马丽娟, 张婷婷, 马磊. 红花根际溶磷菌的筛选与培养条件优化[J]. 江苏农业科学, 2019, 47(18): 287-291. |
| [26] |
Zhang DY, Liu Y, Wu Y, Wang GW, Wan BB, Jiang Y. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(1): 104-110. (in Chinese) 张东艳, 刘晔, 吴越, 王国文, 万兵兵, 姜瑛. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 |
| [27] |
Luo MY, Lu XJ, Liao XL. Research advances on application of endophytic bacteria[J]. Modern Agricultural Science and Technology, 2010(7): 11-12, 16. (in Chinese) 罗茗月, 路雪君, 廖晓兰. 植物内生细菌的应用研究进展[J]. 现代农业科技, 2010(7): 11-12, 16. DOI:10.3969/j.issn.1007-5739.2010.07.001 |
| [28] |
Lahlali R, McGregor L, Song T, Gossen BD, Narisawa K, Peng G. Heteroconium chaetospira induces resistance to clubroot via upregulation of host genes involved in jasmonic acid, ethylene, and auxin biosynthesis[J]. PLoS One, 2017, 9(4): e94144. |
| [29] |
Hou K, Liu YJ, Lu R, Liu XJ, Zhou Y, Fan MZ. A comparative study on the free radical scavenging activities of the secondary metabolites of endophytic fungus from Pueraria lobata[J]. Journal of Anhui Agricultural University, 2008, 35(2): 262-265. (in Chinese) 侯奎, 刘玉军, 陆荣, 刘小娟, 周芸, 樊美珍. 葛内生真菌次生代谢产物清除自由基活性的研究[J]. 安徽农业大学学报, 2008, 35(2): 262-265. |
| [30] |
Khamwan S, Boonlue S, Riddech N, Jogloy S, Mongkolthanaruk W. Characterization of endophytic bacteria and their response to plant growth promotion in Helianthus tuberosus L.[J]. Biocatalysis and Agricultural Biotechnology, 2018, 13: 153-159. DOI:10.1016/j.bcab.2017.12.007 |
| [31] |
Cui JL, Guo SX, Xiao PG. Interaction between endophytes and host plant and the role of endophytes in genuineness analysis of medicinal plant[J]. Acta Pharmaceutica Sinica, 2017, 52(2): 214-221. (in Chinese) 崔晋龙, 郭顺星, 肖培根. 内生菌与植物的互作关系及对药用植物的影响[J]. 药学学报, 2017, 52(2): 214-221. |
| [32] |
Liu LH, Peng GX, Huang SF, Wang ZC, Ting YW, Tan ZY. Diversity and growth promotion of endophytic diazotrophic bacteria isolated from Bryophyllum pinnatum[J]. Microbiology China, 2019, 46(10): 2538-2547. (in Chinese) 刘丽辉, 彭桂香, 黄淑芬, 王祖城, 庭友卫, 谭志远. 落地生根内生固氮菌多样性和促生特性[J]. 微生物学通报, 2019, 46(10): 2538-2547. |
| [33] |
Yang CD, Wang YQ, Chen XR, Zhang ZF, Xue L, Wang Y, Yao YL. Diversity of endophytic bacteria isolated from Kobresia during winter dormancy[J]. Acta Prataculturae Sinica, 2016, 25(8): 136-144. (in Chinese) 杨成德, 王玉琴, 陈秀蓉, 张振粉, 薛莉, 王颖, 姚玉玲. 2种嵩草属牧草休眠期内生细菌多样性研究[J]. 草业学报, 2016, 25(8): 136-144. |
| [34] |
Chen ZB, Li B, Wang DK, Yu SG, Liu JN, Yu L, Zhang YF, Ren Z, Jin S. Composition and diversity of endophytic bacteria in Bletilla striata[J]. Journal of Southern Agriculture, 2016, 47(2): 227-233. (in Chinese) 陈泽斌, 李冰, 王定康, 徐胜光, 刘佳妮, 余磊, 张永福, 任禛, 靳松. 白芨内生细菌组成及多样性分析[J]. 南方农业学报, 2016, 47(2): 227-233. |
| [35] |
Lu ZH. Endophytic bacterial and fungi diversity of panax ginseng and their antimicrobial activity against pathogens[D]. Shenyang: Master's Thesis of Shenyang Agricultural University, 2016 (in Chinese) 卢占慧. 人参内生菌群落多样性及拮抗菌株的抑菌作用研究[D]. 沈阳: 沈阳农业大学硕士学位论文, 2016 |
| [36] |
Chu M, Zhang ZD, Wang W, Song SQ, Tang QY, Gu MY. The diversity of endophytes in ginger and screening of the antagonism[J]. Xinjiang Agricultural Sciences, 2011, 48(11): 2061-2066. (in Chinese) 楚敏, 张志东, 王玮, 宋素琴, 唐琦勇, 顾美英. 生姜内生菌多样性及微生物拮抗作用的初步研究[J]. 新疆农业科学, 2011, 48(11): 2061-2066. |
| [37] |
Fan ZY, Miao CP, Qiao XG, Zheng YK, Chen HH, Chen YW, Xu LH, Zhao LX, Guan HL. Diversity, distribution, and antagonistic activities of rhizobacteria of Panax notoginseng[J]. Journal of Ginseng Research, 2016, 40(2): 97-104. |
| [38] |
He LM, Ye JR. Endophytic bacteria: research advances and biocontrol applications[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2014, 38(6): 153-159. (in Chinese) 何玲敏, 叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报:自然科学版, 2014, 38(6): 153-159. |
| [39] |
Qin XD. Study on the diversity of Tangtsinia nanchuanica's endophytic and rhizosphere microorganisms[D]. Beijing: Master's Thesis of Chinese Academy of Forestry, 2014 (in Chinese) 秦晓丹. 金佛山兰内生及根圈微生物多样性[D]. 北京: 中国林业科学研究院硕士学位论文, 2014 |
| [40] |
Puente ME, Li CY, Bashan YB. Endophytic bacteria in cacti seeds can improve the development of cactus seedlings[J]. Environmental and Experimental Botany, 2009, 66(3): 402-408. |
| [41] |
Deng C, Du XJ, Huang T, Guo Y, Li BX, Bu N. The promotion of proper carbon nitrogen ratio in the synthesis of extracellular polysaccharide by nitrogen-fixing strains WN-F[J]. Biotechnology Bulletin, 2018, 34(3): 194-199. (in Chinese) 邓超, 杜秀娟, 黄涛, 郭英, 李炳学, 卜宁. 碳氮比对固氮菌株WN-F合成胞外多糖的影响[J]. 生物技术通报, 2018, 34(3): 194-199. |
| [42] |
Fang XJ, You CB. Gene regulation of biosynthesies of acidic exoploysaccharides in diazotrophs[J]. Journal of Agricultural Biotechnology, 1995, 3(1): 21-27. (in Chinese) 方宣钧, 尤崇杓. 固氮菌酸性胞外多糖生物合成的基因调控(综述)[J]. 农业生物技术学报, 1995, 3(1): 21-27. |
| [43] |
Xu YJ, Zhao LF. The research on rhizobia exopolysaccharides' structure and function[J]. Journal of Shangqiu Vocational and Technical College, 2009, 8(2): 96-98. (in Chinese) 徐亚军, 赵龙飞. 根瘤菌胞外多糖的结构与功能性研究[J]. 商丘职业技术学院学报, 2009, 8(2): 96-98. |
| [44] |
Gao C, Huang SF, Hu L, Wang Z, Cao YL, Tan ZY. Diversity and plant growth promotion of endophytic bacteria isolated from Oryza nivara[J]. Chinese Journal of Applied & Environmental Biology, 2018, 24(1): 33-38. (in Chinese) 郜晨, 黄淑芬, 胡莉, 王增, 曹玉琳, 谭志远. 尼瓦拉野生稻内生菌多样性和促生作用[J]. 应用与环境生物学报, 2018, 24(1): 33-38. |
| [45] |
Lin BS, Fan JL, Song ZZ, Zhang LL, Zhang YL, Lin ZX. Endophytic diazotrophs composition of Pennisetum sp. at different growth stages[J]. Microbiology China, 2018, 45(7): 1479-1490. (in Chinese) 林标声, 范锦琳, 宋昭昭, 张丽丽, 张煜隆, 林占熺. 巨菌草不同生长时期的内生固氮菌群组成分析[J]. 微生物学通报, 2018, 45(7): 1479-1490. |
| [46] |
Xue YY, Ye W, Yang S, Li P, Xu BL. Isolation and identification of P-dissolving fungi strain and its effects on phosphate-solubilizing and plant growth promotion[J]. Agricultural Research in the Arid Areas, 2019, 37(4): 253-262. (in Chinese) 薛应钰, 叶巍, 杨树, 李培, 徐秉良. 一株溶磷菌的分离鉴定及溶磷促生作用[J]. 干旱地区农业研究, 2019, 37(4): 253-262. |
 2021, Vol. 48
2021, Vol. 48