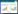扩展功能
文章信息
- 刘志霞, 杨茂华, 穆廷桢, 刘金龙, 邢建民
- LIU Zhixia, YANG Maohua, MU Tingzhen, LIU Jinlong, XING Jianmin
- 表面活性剂对嗜盐嗜碱硫碱弧菌D301生成及利用硫颗粒的影响
- Effect of surfactants on the formation and metabolism of sulfur particles by Thialkalivibrio versutus D301
- 微生物学通报, 2021, 48(2): 362-372
- Microbiology China, 2021, 48(2): 362-372
- DOI: 10.13344/j.microbiol.china.200245
-
文章历史
- 收稿日期: 2020-03-16
- 接受日期: 2020-07-02
- 网络首发日期: 2020-09-11
2. 中国科学院过程工程研究所 中国科学院绿色过程与工程重点实验室 北京 100190
2. Key Laboratory of Green Process and Engineering, Chinese Academy of Sciences; Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
硫化氢(H2S)是一种可溶于水的有毒有害气体,以毒性、腐蚀性和气味难闻著称,不但会引起人的神经中毒,而且能与大气层的臭氧反应生成硫酸,形成酸雨[1]。我国规定工作场地的环境中最大允许H2S浓度为10 mg/L (GB-Z2-2002)[2]。因此,含H2S的废气排放或利用之前必须进行有效的脱硫处理[3]。与物理化学方法相比,微生物脱硫法可以高效地将H2S转化为单质硫,同时具有硫化物去除效率高、投资少、成本低、无二次污染等优点而被广泛使用[4-5]。
在生物脱硫过程中[6],硫化物首先失去2个电子被氧化为单质硫,形成的单质硫通过沉降作用实现硫的分离,同时单质硫也可被微生物进一步氧化为亚硫酸、硫酸。作为生物脱硫的中间产物,硫颗粒本身的粒径一般在0.1−10.0 μm之间,是由一个硫核心结构和外层包裹如蛋白质一样的有机聚合物构成,该结构使其具有空间和电稳定性[7-9]。同时,硫颗粒的产率是影响脱硫效率的关键,如果大量的硫颗粒被氧化菌继续氧化会导致脱硫效率下降。目前,人们已经通过筛选优良菌种、调控S2−/O比、优化培养条件等方式研究了硫颗粒生成和利用的影响因素,以达到调控硫颗粒形成和利用的目的。许吉现等[10]的研究发现,当脱硫菌实际消耗的O2与S2−物质的量之比为0.83时,硫化物向单质硫的转化率可达75.54%,这极大地降低了硫酸盐的生成。而且,溶液内盐的浓度越高越有利于硫的聚集[11],促进更好地絮凝分离。有研究发现,当硫氧化菌利用硫颗粒时会分泌一些有机物对硫颗粒进行修饰,使其亲水性增强,增加颗粒在液体中的分散性[12-13],促进对硫颗粒的利用速率。
表面活性剂一般为具有亲水与疏水基团的有机两性分子,可形成特定的胶束与无机物质产生静电吸引、氢键及配位等相互作用力[14],从而改善物质的界面状态和界面能,甚至影响某些应用方面的性能[15]。一般情况下,表面活性剂可分为离子型表面活性剂和非离子型表面活性剂。曾颖峰等[16]的研究表明,十二烷基苯磺酸钠(Sodium Dodecylbenzenesulphonate,SDBS)、聚乙二醇(Polyethylene Glycol,PEG)、十六烷基三甲基氯化铵(Hexadecyltrimethylammonium Chloride,CTAC)这3种表面活性剂均可降低MoS2颗粒间的团聚程度,有利于MoS2纳米颗粒的生成,其中CTAC的改性效果最好。姜成英等[17]发现,不同的表面活性剂对微生物脱除柴油中有机硫的影响不同,同一条件下,添加吐温-80的样品脱硫率高于加入Span80和TrintonX-100的脱硫率。王怡等[18]发现,添加十二烷基磺酸钠(Sodium Dodecyl Sulfate,SDS)可促进剩余污泥水解释放溶解性碳、氮、磷,但导致总硫绝对量增加。崔晶晶等[19]的研究表明,经过十六烷基三甲基氯化铵、十六烷基三甲基溴化铵(Hexadecyl Trimethyl Ammonium Bromide,CTAB)、十二烷基三甲基溴化铵(N, N, N-Trimethyl-1-Dodecanaminium Bromide,DTAB)这3种季胺类表面活性剂改性后,高岭土纳米管的吸附脱硫能力有所增强。有研究表明[20-21],当以硫粉为硫源时,加入吐温类表面活性剂可提高硫粉表面亲水性,促进硫杆菌与硫粉附着,有利于细菌生长。然而,如果表面活性剂过量,会使溶液表面张力低于最适范围,导致细菌的浓度降低,因此需要确定表面活性剂的最佳加入量。
气体生物脱硫过程涉及固、液、气三相,硫颗粒作为该过程的中间产物起着重要作用,所以调控硫颗粒生成和利用的过程是关键。同时,嗜盐嗜碱硫氧化菌作为嗜盐嗜碱菌中重要的功能性类群,具有很好的脱硫活性,可以氧化低价还原态的硫化合物形成单质硫以及SO42−。其中,化能自养型嗜盐嗜碱硫碱弧菌(Thialkalivibrio)[22]已经被用于脱除气体中的硫化氢[23],并且取得了很好的效果。因此,本文以课题组从内蒙古盐湖泥样中分离得到的一株嗜盐嗜碱硫碱弧菌(Thialkalivibrio versutus) D301[24]为研究对象,探讨不同表面活性剂对培养过程中硫颗粒的生成及利用的影响。
1 材料与方法 1.1 菌种所用菌株是从内蒙古盐湖的泥样中分离得到一株T. versutus D301[24],为革兰氏阴性细菌,细菌大都单个存在,成棒状或弧状,宽0.2−0.4 μm,长0.5−2.5 μm。
1.2 主要试剂和仪器及培养基十二烷基磺酸钠(SDS)、十六烷基三甲基氯化铵(CTAC)、吐温-80,河北百灵威超精细材料有限公司;蛋白牛血清白蛋白(Albumin Bovine,BSA),西陇化工股份有限公司。
超净工作台,北京亚太科隆实验科技开发中心;恒温培养箱,黄石医疗器械厂;全温摇床,太仓市实验设备厂;台式高速冷冻离心机,上海力申科学仪器有限公司;电子天平,梅特勒-托利多仪器(上海)有限公司;离子色谱,Dionex公司;可见分光光度计,日本株式会社日立(HITACHI)制作所;X射线衍射仪,日本理学株式会社北京公司;冷场发射扫描电镜,Carl Zeiss Jena公司;傅立叶红外光谱仪,Thermo Scientific公司。
TD液体培养基(g/L):Na2S2O3·5H2O 19.820,NaHCO3 58.800,NaOH 5.000,NH4Cl 0.268,KNO3 0.505,K2HPO4 2.000,MgCl2·6H2O 0.100。
配制的微量元素液(mg/L):EDTA 5.000,FeSO4·7H2O 2.000,ZnSO4·7H2O 100.000,MnCl2·4H2O 30.000,CoCl2·6H2O 200.000,NiCl2·6H2O 20.000,Na2MoO4·2H2O 30.000,CaCl2·2H2O 10.000,H3BO3 300.000。使用量2 mL/L,微量元素过滤后加入,pH为9.5。
TD固体培养基(TDS):只需在TD液体培养基中加入1.5%的琼脂粉,摇匀灭菌,倒平板即可获得。上述培养基在1×105 Pa灭菌20 min。
1.3 方法以硫代硫酸钠代替硫化氢为硫源进行培养。因为硫代硫酸钠分子中含有一个−2价硫原子,与剧毒的硫化氢培养结果类似,因此目前大多硫氧化菌实验室研究均以无毒的硫代硫酸钠为硫源,如Sharshar等[25]开展Thialkalivibrio versutus D306生长驱动的多级诱导表达系统的研究和Kappler等[26]研究硫代碱性菌环菌型菌株ALM1的全基因组序列(DSM 14477T)时都是以硫代硫酸盐为硫源对菌株进行培养的。
1.3.1 表面活性剂对硫颗粒生成和利用的影响通过2次划线得到单菌落,经摇瓶活化,按5%的接种量接入100 mL TD培养基中,分别加入不同浓度的吐温-80 (终浓度为0.1、0.01、0.001 g/L)、SDS (终浓度为0.1、0.3、0.5 g/L)、BSA (终浓度为0.03、0.02、0.01、0.005 g/L)和CTAC (终浓度为0.1、0.2、0.4、0.5 g/L),在30 ℃、160 r/min下培养4−5 d,观察培养过程中硫颗粒的形态变化、均一性和分散性等情况。
1.3.2 不同浓度的吐温-80和SDS对硫颗粒生成的影响挑取单菌落活化后,按5%的接种量接入100 mL TD培养基中,分别加入不同量的吐温-80 (至终浓度为0.1、0.01、0.001 g/L)和SDS (至终浓度为0.1、0.3、0.5 g/L),以不加表面活性剂为对照,每组实验设置3个平行。在30 ℃、160 r/min下培养4−5 d,定时取样用分光光度计在600 nm下进行细菌光密度测定,然后基于测定值绘制出D301的生长曲线;同时定时取样测定S2O32−的消耗和SO42−的生成情况,再基于测定值绘制出其代谢曲线。
1.4 分析方法 1.4.1 细菌光密度测定以TD培养液为校准液,样品经4 000 r/min离心3 min后取上清,用可见分光光度计在600 nm下测定OD值。
1.4.2 S2O32−及SO42−的测定样品以10 000 r/min的转速离心5 min后,取上清液加水稀释500倍,用0.22 μm微孔滤膜进行过滤。样品测定方法参考文献[27]。
色谱条件:淋洗液:0.848 g/L Na2CO3、0.084 g/L NaHCO3;色谱柱:Dionex IonPacTM AS14A分析柱(4 mm×250 mm);流速1.000 mL/min;抑制器:自动再生抑制模式,抑制电流43 mA;电导检测器检测;进样量10 μL,样品保留时间为30 min。
1.4.3 XRD测定在培养60 h后取样10 000 r/min离心10 min,弃去上清液及沉淀上层的菌液,收集硫颗粒,再用超纯水充分洗涤、混匀,3 000 r/min低速离心5 min,重复3次后置于恒温培养箱中干燥成粉末,然后把样品粉末尽可能均匀地洒入制样框的窗口中,再用小抹刀的刀口轻轻剁紧,使粉末在窗孔内摊匀堆好,然后用小抹刀把粉末轻轻压紧,最后用保险刀片(或载玻片的断口)把多余凸出的粉末削去,然后用Bruker-D8 XRD的单色CuK α1源对玻片进行了分析。衍射角度为10−90°,角度变化速率是0.05(°)/s,物相成分根据哈氏无机数值索引通过对比得到。
1.4.4 冷场发射扫描电镜观察在硫颗粒利用期(60 h)取样,3 000 r/min低速离心5 min收集硫颗粒,再用超纯水充分洗涤、低速离心,重复3次,适当稀释后点到铝箔上,室温干燥,用扫描电镜对样品形貌情况进行表征,通过能谱分析其元素组成。
1.4.5 傅里叶红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)分析硫颗粒表面特征以不加表面活性剂为对照,分别在培养基中加入适量的吐温-80和SDS,按5%的接种量接入300 mL TD培养基中,在30 ℃、160 r/min培养60 h后如上离心收集硫颗粒,再用超纯水充分洗涤、混匀、低速离心,重复3次后置于恒温培养箱中干燥成粉末,以KBr为背景样,研磨后测其图谱作为基准,再取少量样品与KBr混匀,研磨、压片,置于傅立叶红外光谱仪中扫描和记录400−2 300 cm−1波数的红外吸收光谱值。
2 结果与分析 2.1 表面活性剂对硫颗粒生成的影响研究首先对比了不同表面活性剂对T. versutus D301生成硫颗粒的影响(图 1)。摇瓶培养42 h后静置观察发现,对照组、加入CTAC或BSA的样品组中,硫颗粒的存在形态和样貌相似,如图 1A所示,其硫颗粒均呈淡黄色,以分散状沉积于瓶底,上层溶液较澄清。如图 1B所示,加吐温-80的样品组中,硫颗粒仍呈淡黄色,但硫颗粒生成量明显增加,而且硫颗粒团聚现象明显,出现絮状沉淀。如图 1C所示,加入SDS的样品组,硫颗粒呈白色,明显与对照组不同,而且硫颗粒生成量很小,且硫颗粒被很快利用,整个培养过程溶液较浑浊。从对硫颗粒生成的影响来看,不同表面活性剂表现出不同的作用,这与顾华志等[28]的结果一致,不同类型的表面活性剂对反应过程所起的作用效果完全不同。其中,吐温-80和SDS的作用更明显,因此后续实验也将以吐温-80和SDS作为研究对象进行考察。

|
| 图 1 表面活性剂对硫颗粒形成的影响 Figure 1 Effect of surfactant on sulfur particle formation 注:A:对照组;B:吐温-80;C:SDS Note: A: Control; B: Tween-80; C: SDS |
|
|
在T. versutus D301的生长过程中,首先将硫代硫酸钠氧化为单质硫来获得生长的能量,单质硫经过聚集-团聚形成硫颗粒,此阶段细胞大量繁殖;待硫代硫酸钠耗尽后,细胞利用生成的单质硫进行第二阶段生长,将单质硫氧化为硫酸盐,之后细胞进入衰亡期。由于硫颗粒的分离纯化比较困难,而且硫颗粒中含有一定量的非硫组分,因此很难对单质硫进行准确定量。研究将忽略体系中浓度极低的有机硫、聚硫化物等,仅考虑3种最主要的硫元素存在形式:单质硫、硫代硫酸钠和硫酸钠,其中,单质硫生成量根据硫元素守恒原则来计算,即单质硫(mol/L)=总硫(mol/L)−2硫代硫酸钠(mol/L)−硫酸钠(mol/L)。
通过摇瓶实验可确定加入表面活性剂吐温-80和SDS后会导致硫颗粒形态发生显著性变化,为了进一步确定二者对硫源消耗和硫颗粒生成及利用的影响,通过T. versutus D301的代谢、硫源的消耗和硫酸盐的生成进行分析。其结果如图 2所示。
|
| 图 2 不同浓度的吐温-80和SDS对菌体生长及硫代谢的影响 Figure 2 The effects of different concentrations of Tween-80 and SDS on bacterial growth and sulfur metabolism 注:A:加入吐温-80;B:加入SDS。a:生长曲线;b:S2O32−的消耗曲线;c:SO42−的生成曲线;d:S0代谢曲线 Note: A: Tween-80; B: SDS. a: Bacterial growth; b: Consumption of thiosulfate; c: Production of sulfate; d: Metabolic of S0 |
|
|
图 2A显示了不同浓度吐温-80对T. versutus D301生长和硫代谢的影响。从OD600值的变化来看,在培养的前32 h,加入吐温-80的实验组与对照组相差不大,42 h后实验组OD600值明显低于对照组。从与之相对应的S2O32−的消耗曲线可以看出,加入吐温-80的实验组与对照组相差不大,培养32 h后基本消耗完全,这说明在T. versutus D301利用S2O32−生长的阶段,吐温-80的作用不明显,这与培养前期OD600值的变化规律相一致。同时,实验组中单质硫的生成量高于对照组,与图 1B中观察到的硫颗粒沉淀增多这一现象相符,而且培养后期硫单质氧化产物SO42−的生成量低于对照组,以上现象均说明了加入吐温-80可以减缓硫颗粒的利用,而且从图 1中可以看出,不同浓度的吐温-80对菌及硫颗粒的影响程度不同,其中加入0.01 g/L吐温-80的实验组与对照组差别最为明显。国内研究者肖鹏飞等[29]的研究也曾得到相似的结果,表明不同浓度的表面活性剂吐温-80对P. acanthocystis TMIC34875菌株生长的影响不同。
图 2B显示了不同浓度SDS对T. versutus D301生长和硫代谢的影响。从生长曲线可以看出,加入SDS对T. versutus D301的生长影响较大,实验组中OD600值呈现一直上升的规律,而对照组在培养后期OD600值呈现下降趋势,说明加入SDS后可以减缓T. versutus D301的衰亡。与吐温-80对S2O32−利用的影响类似,加入SDS对S2O32−的利用速率没有明显影响,在32 h左右对照组和实验组中S2O32−均已消耗完。从单质硫的生成量来看,在培养后期,实验组中生成的硫颗粒几乎全被利用掉,这与图 1C中观察到的现象相一致,王怡等[18]的研究也表明添加SDS可促进有机硫向溶解硫快速转化,加速了硫的消耗。因此本文加入SDS后应该是促进了单质硫的利用,这同样也解释了在培养后期OD600值持续上升的原因。从培养后期单质硫的含量来看,加入0.3 g/L SDS的实验组与对照组差异最大,所以后续的硫颗粒表征中SDS的使用量选取0.3 g/L。
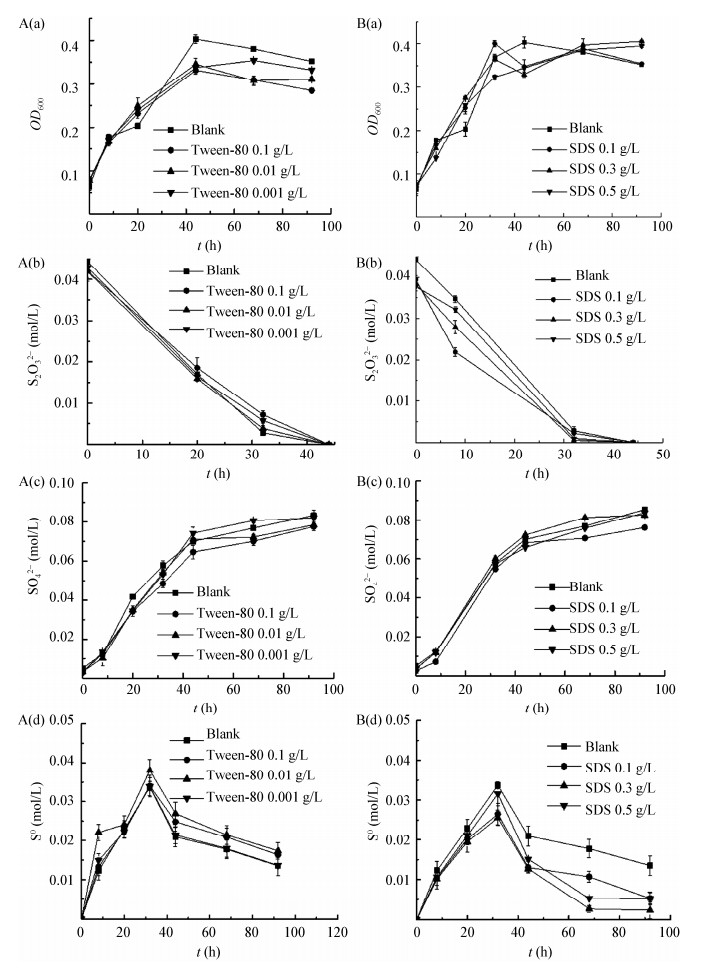
2.3 XRD表征硫颗粒为确定培养产物中的主要成分,利用X射线衍射仪检测培养42 h后生成的硫颗粒特性。经对比,其XRD图谱与数据库衍射模式良好匹配。试验结果如图 3所示,在10−90°的范围内集中了多种物相的特征峰。其中最大峰出现在衍射角度为22.94−23°的位置。该样品成分主要为生物S0,包含S、S8、S4、S3等,其中S8强度最强,说明以硫代硫酸钠为硫源培养的产物是单质硫,并且主要以S8形式存在。其中,S8是硫的一种同素异形体,属于分子晶体,分子中每个S原子与另外2个S原子形成S−S单键。在衍射图中也可以看出,产物的衍射峰相当尖锐,而且最高峰的峰强可达到7 800,这意味着单质硫的结晶度较高,是比较理想的硫晶体。
|
| 图 3 硫颗粒的XRD图谱 Figure 3 XRD pattern of sulfur particles |
|
|
通过借助扫描电镜探索表面活性剂(对照组、吐温-80组、SDS组)对硫颗粒微观形态的影响,结果如图 4所示。3组实验下硫颗粒的微观形态明显不同,图 4A的对照组中硫颗粒呈规则球形,光滑完整且大小不一,颗粒直径约为0.05−10 μm,推测大的硫颗粒可能是由多个小球聚集而成。加入0.01 g/L吐温-80的样品中,如图 4B所示,硫颗粒形状发生很大变化,呈现大小不一的长杆状(1−3) μm×(5−25) μm。如图 4C所示,当加入0.3 g/L SDS时生成的硫颗粒呈短棒状,约1 μm×(2−3) μm,与对照组相比其均一性、分散度较好。3种条件下硫颗粒均呈现不同程度的团聚,尤其在对照组中硫颗粒团聚得更加紧密。由此可见,表面活性剂的添加极大地改变了硫颗粒形态和团聚程度,并通过此特性进而影响其利用速率。

|
| 图 4 硫颗粒的微观区域元素分布(EDS) Figure 4 Elemental distribution on the surface of sulfur particles (EDS) 注:A:冷场发射扫描电镜图;B:能谱分析图。a:对照组;b:0.01 g/L吐温-80;c:0.3 g/L SDS Note: A: Field emission scanning electron microscopy (SEM); B: Energy dispersive system (EDS) analysis diagram. a: Control; b: 0.01 g/L Tween-80; c: 0.3 g/L SDS |
|
|
对硫颗粒微观区域进行能谱分析(EDS)确定元素种类及相对含量。由于样品粘贴在铝箔纸上以及样品处理时需要喷金处理,导致铝、铂等元素含量高,除此之外,样品中还含有少量铁、铜、锌、钾等培养基残留成分,结果如图 4所示。从对照组中硫颗粒表面元素来看,除含有4.8%硫元素外,还含有碳(12.6%)、氧(5.9%)、氮(0.9%),表明反应生成的硫颗粒表面附着了大量的有机大分子物质。其中氮元素的存在说明其中存在一定量的蛋白质。由于蛋白质中碳氮比一般为(3.5−2.5):1,而对照组中碳氮比远大于此比例,表明硫颗粒表层的大分子中可能还有多糖、脂类等不含氮元素的物质存在。添加吐温-80后,硫元素(10%)占比显著增加,比对照组增加一倍,同时氮元素(0.1%)明显减少,表明硫颗粒表面附着的物质发生改变,推测硫元素占比上升可能是由于未包覆有机物的纳米级硫颗粒吸附量增加所致。该变化促进了硫颗粒之间的吸附与聚集,导致硫颗粒体积增大、比表面积减小,影响了其与硫氧化菌的接触。加入SDS后,与对照组相比,硫颗粒表面的氮(0.4%)、氧元素(1.9%)占比下降,尤其是氧元素下降明显,说明经SDS作用后生成的硫颗粒表面物质也发生变化,可能是由于硫颗粒表层吸附的无机硫分子(如硫酸盐等)减少造成的。
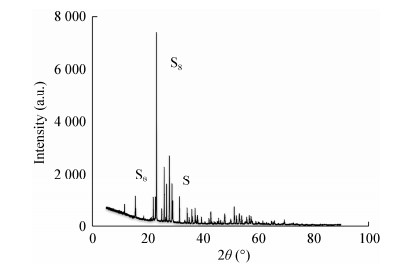
2.5 傅里叶红外光谱分析FTIR分析硫颗粒表面物质组成特性的结果如图 5所示,其谱带通过比较以往文献确定[30-32]。斜方晶硫(S8)的特征峰出现在845 cm−1附近的锐区,该形态是单质硫(S0)最稳定的存在形式,这也与文献[33]报道相一致。对照组中硫颗粒的表观吸收区在2 000−1 200 cm−1之间,这可能是培养过程中附着于硫颗粒表面的物质成分。1 650− 1 890 cm−1和1 502−1 675 cm−1附近的锐区分别是由−C=O拉伸和−NH2弯曲振动造成的,这2个锐区表明存在蛋白酰胺基团(−CONH−)。在1 450 cm−1附近的条带可能是−CH3和−CH2基团的弯曲振动,它们可能包含在多糖和脂质中。650 cm−1的波段代表−NH的变形振动,如图 5B所示,加入吐温-80后,1 275、1 008和1 107 cm−1出现锐度波段,分别代表−C−O组和−S=O组的伸缩振动,即出现了一些新官能团,说明可能纳米硫颗粒裸露在外且与其表面物质结合;而图 5C中800−1 200 cm−1并无任何特征峰,与对照组相比,部分−C−O、−C−C、−C=N键消失,即硫颗粒表面覆盖的多糖或脂质成分变化,与能谱分析结果一致,可能是SDS与硫颗粒表面物质发生反应。总之,加入表面活性剂后生成的硫颗粒表面成分形态及比例发生改变。
|
| 图 5 傅里叶红外光谱表征硫颗粒表面基团 Figure 5 Characterization of surface groups of sulfur particles by Fourier transform infrared spectroscopy 注:A:对照组;B:0.01 g/L吐温-80;C:0.3 g/L SDS Note: A: Control; B: 0.01 g/L Tween-80; C: 0.3 g/L SDS |
|
|
研究表明[9],粒径3 mm左右生物硫颗粒是由1 μm左右的小颗粒聚合而成。生物硫颗粒外膜由蛋白和多糖等物质组成,此种外膜使生物硫颗粒表面呈现亲水性,生物可利用性增强[34]。本文通过XRD分析(图 3)和扫描电镜分析硫颗粒(图 4)以及傅里叶红外光谱(图 5),得到一致的结论,而且证明T. versutus D301所产生硫颗粒中的硫元素主要以S8形式存在[35]。
在生物脱硫过程中,控制硫颗粒的生成和利用是调控整个脱硫过程的关键。因此,本研究通过添加不同类型的表面活性剂来探究其对T. versutus D301的生长以及硫颗粒的影响。经过摇瓶培养后发现,生成的硫颗粒量、形态和分散性出现了显著差异(图 1),这说明加入适当浓度的表面活性剂是改变硫颗粒产生的有效途径。
根据T. versutus D301的生长代谢和硫颗粒产量的变化情况,添加吐温-80 (0.01 g/L)不仅减缓了T. versutus D301的生长,而且硫颗粒产量明显增多(图 2A),这可能是因为适当浓度的吐温-80能有效地改变硫颗粒表面成分,进而影响细菌与硫颗粒之间的接触。研究表明[36],菌与硫颗粒的接触正是硫颗粒利用过程中必不可少的步骤。细菌细胞外聚合物(EPS)是一类两亲性物质,其可以介导细胞与疏水性表面的接触,在嗜酸硫氧化菌与化学硫磺颗粒吸附过程中起到至关重要的作用。通过扫描电镜观察和能谱分析(图 4),我们认为吐温-80可能与细菌细胞的分泌物(EPS)结合,在一定程度上减弱了硫颗粒表面的亲水性,从而导致多个疏水性的硫颗粒团聚紧密而暴露在外,最终使硫颗粒的利用率降低。然而阴离子表面活性剂SDS极易与阳离子型胞外聚合物反应,使阴离子型胞外聚合物牢牢附着于硫颗粒表面,提高了硫颗粒的亲水性并加快其消耗,同时促进了T. versutus D301的生长(图 2B)。FTIR光谱分析(图 5)硫颗粒表面基团(−OH、−NH、−NH2、−CH2、−CH3、−C=O、−C−O、−C−C、−C=N、−CONH−等)发现,表面活性剂的应用导致的部分基团发生改变,或增加或减少,应该也是其与硫颗粒表面物质相互作用的结果。
目前,研究者虽然对生物脱硫中硫氧化过程的生化机理还没有全面的认识,但在本研究中,表面活性剂吐温-80和SDS已被证实对细胞黏附和硫活化过程具有重要作用。进一步的研究不仅有助于建立更有效的生物脱硫体系,而且有助于对硫氧化过程调控的认识。
4 结论通过对比阴离子型(SDS)、非离子型(吐温-80)、阳离子型表面活性剂(CTAC)和蛋白质(BSA),结果发现吐温-80和SDS对硫颗粒的生成和利用影响明显。对照组中生成的硫颗粒呈规则球形,光滑完整,其表面附着蛋白质等生物大分子;加入0.01 g/L吐温-80后,硫颗粒呈长杆状,颗粒体积增大,聚集性强,比表面积减小,影响了硫颗粒与硫氧化菌之间的接触,硫颗粒利用速率减慢;加入0.3 g/L的SDS后硫颗粒呈短棒状,生成量减少,促进硫颗粒利用,同时延缓了硫碱弧菌D301的衰亡。所以,表面活性剂的添加可改变硫颗粒的形态及作用特性。
| [1] |
Van Den Bosch PL, Van Beusekom OC, Buisman CJN, Janssen AJH. Sulfide oxidation at halo-alkaline conditions in a fed-batch bioreactor[J]. Biotechnology and Bioengineering, 2007, 97(5): 1053-1063. DOI:10.1002/bit.21326 |
| [2] |
National Environmental Protection Agency. Determination of Water Quality Sulfides - Methylene Blue Spectrophotometric Method[M]. Beijing: China Environmental Science Press, 1996. (in Chinese) 国家环境保护局. 水质硫化物的测定亚甲基蓝分光光度法[M]. 北京: 中国环境科学出版社, 1996. |
| [3] |
Zhang KQ. Study on electrocoagulation and biological treatment of wastewater containing sulfide (H2S, S2–, HS–)[D]. Tianjin: Doctoral Dissertation of Tianjin University, 2004 (in Chinese) 张克强. 含硫化物(H2S, S2–, HS–)废水电凝聚与生物处理的技术研究[D]. 天津: 天津大学博士学位论文, 2004 |
| [4] |
Chi YZ, Li YX. Progress in harm and treatment of sulfide[J]. Journal of Tianjin Institute of Urban Construction, 2001, 7(2): 105-108. (in Chinese) 池勇志, 李亚新. 硫化物的危害与治理进展[J]. 天津城市建设学院学报, 2001, 7(2): 105-108. DOI:10.3969/j.issn.1006-6853.2001.02.009 |
| [5] |
Tu Y. Application of biodesulfurization technology in natural gas purification[J]. Chemical Engineering of Oil & Gas, 2003, 32(2): 97-99. (in Chinese) 涂彦. 微生物脱硫技术在天然气净化中的应用[J]. 石油与天然气化工, 2003, 32(2): 97-99. DOI:10.3969/j.issn.1007-3426.2003.02.011 |
| [6] |
Deng LW, Tang Y, Wu Y. Mechanism of biological desulfurization and its progress[J]. Shanghai Environmental Sciences, 1998, 17(5): 35-39. (in Chinese) 邓良伟, 唐一, 吴彦. 生物脱硫机理及其研究进展[J]. 上海环境科学, 1998, 17(5): 35-39. |
| [7] |
He H, Xia JL, Peng AA, Zhang CG, Qiu GZ. Research progress of sulfur chemical speciation impacted by acidophilic sulfur-oxidizing bacteria[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(6): 1143-1151. (in Chinese) 何环, 夏金兰, 彭安安, 张成桂, 邱冠周. 嗜酸硫氧化细菌作用下元素硫化学形态的研究进展[J]. 中国有色金属学报, 2008, 18(6): 1143-1151. DOI:10.3321/j.issn:1004-0609.2008.06.030 |
| [8] |
Kleinjan WE, De Keizer A, Janssen AJH. Equilibrium of the reaction between dissolved sodium sulfide and biologically produced sulfur[J]. Colloids and Surfaces B: Biointerfaces, 2005, 43(3/4): 228-237. |
| [9] |
Song ZY. Screening of sulfur oxidizing bacteria and its application in gas desulfurization process[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2013 (in Chinese) 宋子煜. 硫氧化菌筛选及其在气体脱硫工艺中的应用[D]. 北京: 中国科学院大学博士学位论文, 2013 |
| [10] |
Xu JX, Li SY, Li SM, Zhang S, Zhang J. Analysis on the generation rate of sulfur in biological desulfurization process[J]. China Water & Wastewater, 2004, 19(S1): 96-97. (in Chinese) 许吉现, 李素燕, 李思敏, 张胜, 张娟. 生物脱硫工艺中单质硫的生成率分析[J]. 中国给水排水, 2004, 19(S1): 96-97. |
| [11] |
Zhang KQ, Huang WX, Ji M, Li JX, Li Y, Li B, Zhang JF. Characteristics of microbiologically sulfur producing during biological treatment for wastewater containing sulfide[J]. Journal of Agro-Environment Science, 2006, 25(2): 522-526. (in Chinese) 张克强, 黄文星, 季民, 李军幸, 李野, 李斌, 张金风. 含硫化物废水生物处理过程中单质硫的形成特性[J]. 农业环境科学学报, 2006, 25(2): 522-526. DOI:10.3321/j.issn:1672-2043.2006.02.053 |
| [12] |
Hanson TE, Bonsu E, Tuerk A, Marnocha CL, Powell DH, Chan CS. Chlorobaculum tepidum growth on biogenic S(0) as the sole photosynthetic electron donor[J]. Environmental Microbiology, 2016, 18(9): 2856-2867. DOI:10.1111/1462-2920.12995 |
| [13] |
Zhang CG, Xia JL, Ding JN, Ouyang XD, Nie ZY, Qiu GZ. Cellular acclimation of Acidithiobacillus ferrooxidans to sulfur biooxidation[J]. Mining, Metallurgy & Exploration, 2009, 26(1): 30-34. |
| [14] |
Huo QS, Margolese DI, Stucky GD. Surfactant control of phases in the synthesis of mesoporous silica-based materials[J]. Chemistry of Materials, 1996, 8(5): 1147-1160. DOI:10.1021/cm960137h |
| [15] |
Wang SR, Li XG, Liu DZ. Surfactant Chemistry[M]. Beijing: Chemical Industry Press, 2005. (in Chinese) 王世荣, 李祥高, 刘东志. 表面活性剂化学[M]. 北京: 化学工业出版社, 2005. |
| [16] |
Zeng YF, Jiang XM, Chen YZ. Influence of surfactants on the preparation of MoS2 nanoparticles[J]. Acta Petroles Sinica (Petroleum Processing Section), 2001, 17(4): 55-58. (in Chinese) 曾颖峰, 蒋晓明, 陈月珠. 表面活性剂对制备纳米MoS2颗粒的影响[J]. 石油学报(石油加工), 2001, 17(4): 55-58. DOI:10.3969/j.issn.1001-8719.2001.04.010 |
| [17] |
Jiang CY, Li L, Yang YT, Xing JM, Liu HZ, Chen JY. Effect of surfactants on microbial removal of organic sulfur in diesel oil[J]. The Chinese Journal of process engineering, 2002, 2(2): 122-126. (in Chinese) 姜成英, 李磊, 杨永谭, 邢建民, 刘会洲, 陈家镛. 表面活性剂对微生物脱除柴油中有机硫的影响[J]. 过程工程学报, 2002, 2(2): 122-126. DOI:10.3321/j.issn:1009-606X.2002.02.006 |
| [18] |
Wang Y, Zhang J, Feng S, Peng DC, Xia SQ, Wang SP. Effect of sodium dodecyl sulfate addition on sulfur in hydrolysis system of excess sludge[J]. China Water & Wastewater, 2017, 33(3): 102-106. (in Chinese) 王怡, 张洁, 冯莎, 彭党聪, 夏四清, 王社平. 添加SDS对剩余污泥水解系统中硫的影响[J]. 中国给水排水, 2017, 33(3): 102-106. |
| [19] |
Chun JJ, Ma Z, Ding T, Qi XZ. Effect of quaternary ammonium surfactants on adsorption desulfurization performance of kaolin nanotubes[J]. Chemical Industry and Engineering, 2016, 33(6): 14-18. (in Chinese) 崔晶晶, 马智, 丁彤, 齐晓周. 季铵盐表面活性剂改性对高岭土纳米管吸附脱硫性能的影响[J]. 化学工业与工程, 2016, 33(6): 14-18. |
| [20] |
Kingma Jr JG, Silver M. Autotrophic growth of Thiobacillus acidophilus in the presence of a surface-active agent, Tween 80[J]. Applied and Environmental Microbiology, 1979, 38(5): 795-799. DOI:10.1128/AEM.38.5.795-799.1979 |
| [21] |
Gong WQ, Zhang XZ, Liu YJ, Chen W, Bian X, Liu J, Huang YB, Yang HG. Influence of surfactants on leaching of phosphate ore with Acidithiobacillus thiooxidans[J]. Journal of Central South University (Science and Technology), 2007, 38(1): 60-64. (in Chinese) 龚文琪, 张晓峥, 刘艳菊, 陈伟, 边勋, 刘俊, 黄永炳, 杨红刚. 表面活性剂对嗜酸氧化硫硫杆菌浸磷的影响[J]. 中南大学学报:自然科学版, 2007, 38(1): 60-64. |
| [22] |
Xu XH. Removal of H2S from high-salt and high-alkali solution by immobilized magnetic nanoparticles of Thialkalivibrio versutus multipotent[D]. Beijing: Master's Thesis of University of Chinese Academy of Sciences, 2015 (in Chinese) 许晓卉. 磁性纳米颗粒固定化多能硫碱弧菌从高盐高碱溶液中脱除H2S的研究[D]. 北京: 中国科学院大学硕士学位论文, 2015 |
| [23] |
Van Den Bosch PLF, Sorokin DY, Buisman CJN, Janssen AJH. The effect of pH on thiosulfate formation in a biotechnological process for the removal of hydrogen sulfide from gas streams[J]. Environmental Science & Technology, 2008, 42(7): 2637-2642. |
| [24] |
Mu TZ. Study on metabolic engineering and desulphurization process of Thialkalivibrio versutus SOB306[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2016 (in Chinese) 穆廷桢. 嗜盐嗜碱多能硫碱弧菌SOB306代谢工程及脱硫工艺研究[D]. 北京: 中国科学院大学博士学位论文, 2016 |
| [25] |
Sharshar MM, Samak NA, Hao XM, Mu TZ, Zhong W, Yang MH, Peh S, Ambreen S, Xing JM. Enhanced growth-driven stepwise inducible expression system development in haloalkaliphilic desulfurizing Thioalkalivibrio versutus[J]. Bioresource Technology, 2019, 288: 121486. DOI:10.1016/j.biortech.2019.121486 |
| [26] |
Kappler U, Davenport K, Beatson S, Lapidus A, Pan C, Han C, Del Carmen Montero-Calasanz M, Land M, Hauser L, Rohde M, et al. Complete genome sequence of the haloalkaliphilic, obligately chemolithoautotrophic thiosulfate and sulfide-oxidizing γ-proteobacterium Thioalkalimicrobium cyclicum type strain ALM 1 (DSM 14477T)[J]. Standards in Genomic Sciences, 2016, 11(1): 38. DOI:10.1186/s40793-016-0162-x |
| [27] |
Conboy JJ, Henion JD, Martin MW, Zweigenbaum JA. Ion chromatography/mass spectrometry for the determination of organic ammonium and sulfate compounds[J]. Analytical Chemistry, 1990, 62(8): 800-807. DOI:10.1021/ac00207a006 |
| [28] |
Gu HZ, Wang HF, Wang HZ, Wang J. Influence of different surface active agents on the preparation of nanometer ZnO/ZrO2 and the desulphurization properties[J]. Journal of Synthetic Crystals, 2007, 36(3): 642-645. (in Chinese) 顾华志, 汪慧峰, 汪厚植, 汪姣. 不同表面活性剂对纳米ZnO/ZrO2的制备和脱硫性能的影响[J]. 人工晶体学报, 2007, 36(3): 642-645. DOI:10.3969/j.issn.1000-985X.2007.03.035 |
| [29] |
Xiao PF, Qin BD, Li YW. Effects of nonionic surfactants on degradation of organochlorine pesticides by white rot fungus and its enzyme[J]. Chinese Journal of Applied & Environmental Biology, 2015, 21(1): 22-28. (in Chinese) 肖鹏飞, 秦必达, 李玉文. 非离子表面活性剂强化白腐菌及其粗酶液对有机氯农药的降解[J]. 应用与环境生物学报, 2015, 21(1): 22-28. |
| [30] |
Peng AA, Liu HC, Nie ZY, Xia JI. Effect of surfactant Tween-80 on sulfur oxidation and expression of sulfur metabolism relevant genes of Acidithiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China,, 2012, 22(12): 3147-3155. DOI:10.1016/S1003-6326(12)61767-1 |
| [31] |
He H, Yang Y, Xia JL, Ding JN, Zhao XJ, Nie ZY. Growth and surface properties of new thermoacidophilic archaea strain Acidianus manzaensis YN-25 grown on different substrates[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1374-1378. DOI:10.1016/S1003-6326(09)60011-X |
| [32] |
Marnocha CL, Sabanayagam CR, Modla S, Powell DH, Henri PA, Steele AS, Hanson TE, Webb SM, Chan CS. Insights into the mineralogy and surface chemistry of extracellular biogenic S0 globules produced by Chlorobaculum tepidum[J]. Frontiers in Microbiology, 2019, 10: 271. |
| [33] |
Zhang CG, Xia JI, Zhang RY, Peng AA, Nie ZY, Qiu GZ. Comparative study on effects of Tween-80 and sodium isobutyl-xanthate on growth and sulfur-oxidizing activities of Acidithiobacillus albertensis BY-05[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(4): 1003-1007. |
| [34] |
Tan SN, Chen M. Early stage adsorption behaviour of Acidithiobacillus ferrooxidans on minerals I: an experimental approach[J]. Hydrometallurgy, 2012, 119-120: 87-94. |
| [35] |
Janssen AJH, Lettinga G, De Keizer A. Removal of hydrogen sulphide from wastewater and waste gases by biological conversion to elemental sulphur: colloidal and interfacial aspects of biologically produced sulphur particles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1999, 151(1/2): 389-397. |
| [36] |
Marnocha CL, Levy AT, Powell DH, Hanson TE, Chan CS. Mechanisms of extracellular S0 globule production and degradation in Chlorobaculum tepidum via dynamic cell-globule interactions[J]. Microbiology, 2016, 162(7): 1125-1134. |
 2021, Vol. 48
2021, Vol. 48