扩展功能
文章信息
- 黄新新, 何宇平, 袁辰刚, 郭德华, 赵勇, 孙晓红, 曾静, 郑秋月
- HUANG Xinxin, HE Yuping, YUAN Chengang, GUO Dehua, ZHAO Yong, SUN Xiaohong, ZENG Jing, ZHENG Qiuyue
- 荧光重组酶介导等温扩增检测食品中单增李斯特菌
- Detection of Listeria monocytogenes in food by fluorescent recombinase-aided amplification
- 微生物学通报, 2021, 48(12): 4989-5000
- Microbiology China, 2021, 48(12): 4989-5000
- DOI: 10.13344/j.microbiol.china.210670
-
文章历史
- 收稿日期: 2021-07-23
- 接受日期: 2021-09-14
- 网络首发日期: 2021-10-22
2. 上海海洋大学食品学院 上海 201306;
3. 中国海关科学技术研究中心 北京 100026;
4. 大连民族大学生命科学学院 辽宁 大连 116600
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
3. Science and Technology Research Center of China Customs, Beijing 100026, China;
4. College of Life Sciences, Dalian Minzu University, Dalian, Liaoning 116600, China
单增李斯特菌(Listeria monocytogenes)为重要的食源性致病菌,也是李斯特菌中唯一的人畜共患致病菌[1]。其对孕妇、老人和儿童等免疫力低下的人群尤为易感,可引发脑膜炎、败血症及流产[2-3],死亡率高达30%[1-4]。由于单增李斯特菌广泛存在于各类食品中,在4 ℃冰箱保存的食物中也可生长繁殖,并能抵御各种严苛的加工条件,在冷冻及真空包装条件下依旧能存活,造成食品安全的重大隐患[5]。目前世界各国将单增李斯特菌列为食品安全检测中法定的项目。
传统的微生物鉴定方法通常以培养和生化分析相结合,耗时耗力,不适合快速检测及现场分析。近年来,各种分子生物学技术被应用到单增李斯特菌检测中,包括实时荧光PCR、环介导等温扩增(Loop Mediated Isothermal Amplification,LAMP)和微流控芯片等[6-8]。这些方法有优点但也存在缺点,荧光PCR需要热循环仪且设备较大,只能在实验室使用,无法进行现场检测;LAMP扩增速度快但特异性不高,容易污染;微流控芯片成本不菲,因而需建立既能进行实验室检测又能现场快速检测的灵敏、简便、快速和低成本的检测方法。
重组酶介导等温扩增(Recombinase-Aided Amplification,RAA)的酶混合物包括重组酶UvsX、单链DNA结合蛋白(Single Stranded DNA Binding Protein,SSB)和DNA聚合酶。重组酶UvsX从大肠杆菌获得,RAA技术利用重组酶UvsX结合引物对模板DNA进行退火,SSB结合上去形成D环结构,在DNA聚合酶的作用下保持模板DNA的单链状态进行扩增和延伸。在37–42 ℃的恒温下,荧光信号可在20 min内获得,有效缩短了检测时间,而且在核酸扩增过程中不需要温度变化,特别适合在现场及资源简易的场所操作。目前重组酶介导等温扩增技术已取得长足的发展,并被应用在病原体及食品安全等多个检测领域[9-15]。
本研究针对口岸中进出口食品需快速检测通关的需求,建立单增李斯特菌荧光RAA检测法,并在食品基质及实际样品中应用验证,以期满足大批量进出口食品尤其是肉类、海产品及乳制品中单增李斯特菌的快速检测要求,提升政府监管力度,保障食品安全。
1 材料与方法 1.1 菌株单增李斯特菌(ATCC7644)、英诺克李斯特菌(ATCC33090)、斯氏李斯特菌(ATCC35967)、伊氏李斯特菌(ATCC19119)、格式李斯特菌(ATCC700545)、威氏李斯特菌(ATCC35897)、铜绿假单胞菌(ATCC27853)、奇异变形杆菌(ATCC12453)、肺炎克雷伯氏菌(ATCC13883)、鼠伤寒沙门氏菌(ATCC14028)、产气肠杆菌(ATCC13048)、大肠埃希氏菌(ATCC29522)、迟缓爱德华氏菌(ATCC15947)、金黄色葡萄球菌(ATCC6538)、粪肠球菌(ATCC49452)和溶血性链球菌(ATCC21059)购自上海汉尼生物技术有限公司。单增李斯特菌分离株M2、M3、M4、M5、M6、M7为本实验室分离保存,所有菌株−80 ℃保存于10% (质量体积分数)甘油肉汤中。
1.2 主要试剂和仪器荧光RAA扩增试剂盒,江苏奇天基因生物科技有限公司;细菌基因组DNA抽提试剂盒,大连宝生物工程有限公司;缓冲蛋白胨水、脑心浸液培养基(BHI)、李氏增菌(LB1,LB2)基础培养基,北京陆桥技术有限责任公司;李斯特菌显色培养基,上海中欣生物工程有限公司。荧光RAA检测仪,江苏奇天基因生物科技有限公司;ESCO生物二级安全柜,新加坡艺思高科技有限公司;高速冷冻离心机,Eppendorf公司。
1.3 方法 1.3.1 菌株复苏从甘油冻存管中取100 μL菌液接种到5 mL BHI培养基中,37 ℃、150 r/min培养过夜。
1.3.2 细菌基因组DNA制备取1 mL细菌培养物置于1.5 mL EP离心管,12 000 r/min离心10 min收集菌液,弃上清。按照试剂盒方法提取细菌基因组DNA,−20 ℃保存备用。
1.3.3 引物设计从NCBI GenBank数据库中获得单增李斯特菌hlyA基因序列,根据RAA引物、探针设计原则设计荧光RAA引物和探针序列。引物、探针由生工生物工程(上海)股份有限公司合成,具体序列见表 1。
| 引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
| hlyA-F1 | CTGTAAATAATAGCTTGAATGTAAACTTCGGCGC |
| hlyA-R1 | TCTGCATTCACTCCAAGCGCTTGCAACTGCTC |
| hlyA-F2 | CGCAATCAGTGAAGGGAAAATGCAAGAAGAAGTC |
| hlyA-R2 | TTGCAACTGCTCTTTAGTAACAGCTTTGCCGAAA |
| hlyA-P | TAGTTTTAAACAAATTTACTATAACGTGAA(FAM-dT)(THF)(BHQ-dT)TAATGAACCTACAAG |
将2条正向引物与2条反向引物互相组合,与探针形成4个组合,对引物和探针的浓度进行最佳配比筛选,通过荧光信号值的大小以及反应时间筛选最佳引物、探针组合。
1.3.5 反应温度的优化RAA反应液包括正、反向引物(10 μmol/L)各2.1 μL、探针(10 μmol/L) 0.6 μL,2×反应缓冲液25 μL,DNA模板4 μL,乙酸镁2.5 μL,ddH2O 13.7 μL。将RAA反应液置于荧光RAA检测仪中,在不同温度(30、35、39、42、45 ℃)进行反应30 min,确定最佳扩增温度。
1.3.6 引物、探针浓度的优化在探针终浓度为120 nmol/L时将引物终浓度分别稀释为100、200、400、800 nmol/L,引物终浓度为400 nmol/L时对应的探针终浓度分别稀释为100、200、300、400 nmol/L进行扩增。比较最佳扩增效果时的引物、探针浓度。
1.3.7 特异性检测选取单增李斯特菌(ATCC7644)、英诺克李斯特菌(ATCC33090)、斯氏李斯特菌(ATCC35967)、伊氏李斯特菌(ATCC19119)、格式李斯特菌(ATCC700545)、威氏李斯特菌(ATCC35897)和单增李斯特菌分离株M2–M7以及铜绿假单胞菌(ATCC27853)、奇异变形杆菌(ATCC12453)、肺炎克雷伯(ATCC13883)、鼠伤寒沙门氏(ATCC14028)、产气肠杆菌(ATCC13048)、大肠埃希氏菌(ATCC29522)、迟缓爱德华氏菌(ATCC15947)、金黄色葡萄球菌(ATCC6538)、粪肠球菌(ATCC49452)、溶血性链球菌(ATCC21059)等菌株纯培养物,提取DNA模板后进行荧光RAA检测,验证方法的特异性。
1.3.8 灵敏度检测挑取单增李斯特菌单菌落接种至BHI培养液,37 ℃、150 r/min培养过夜。用无菌生理盐水做10倍梯度稀释,取菌液1 mL加入灭菌培养皿,倒入56 ℃恒温水浴的计数琼脂摇匀,37 ℃恒温倒置培养24 h。每个稀释度做3个平行对照,设空白对照。各稀释度的菌液提取DNA后,用荧光RAA法检测,观察记录结果。从培养过夜的平板上选取菌落数在30−300之间的平板进行菌落计数,计算出菌悬液中单增李斯特菌的浓度,推算出该方法的检测灵敏度。
1.3.9 基质中检测限检测选取牛肉、大西洋鲑鱼及再制干酪等3种样品,经GB 4789.30-2016《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》[16]检测,无单增李斯特菌污染。将菌液浓度为3×108 CFU/mL的单增李斯特菌进行10−1–10−10稀释。称取25 g上述样品,向其中添加不同稀释度的单增李斯特菌纯菌液。将人工污染的样品加到225 mL LB1增菌培养基中,采集1 mL LB1增菌前培养液提取DNA,做荧光RAA法检测。置30 ℃培养24 h,取100 μL LB1增菌液加入到10 mL LB2增菌液中。30 ℃培养2、4、24 h后采集1 mL培养液,提取DNA并用RAA法进行扩增,观察结果。所有做荧光RAA检测的样品同时采用文献[16]的标准方法进行检测。
1.3.10 实际样品检测收集上海口岸及市场中100份实际样品进行荧光RAA检测。所有样品同时采用文献[16]的标准方法检测。
2 结果与分析 2.1 单增李斯特菌荧光RAA方法的建立及优化 2.1.1 扩增温度优化分别选择30、35、39、42、45 ℃作为扩增温度测试单增李斯特菌RAA扩增效果差异,结果表明,30 ℃时无扩增信号,42 ℃时荧光信号最强,优于39 ℃;而当扩增温度升为45 ℃时扩增信号减弱,所以最佳扩增温度为42 ℃ (图略)。
2.1.2 RAA不同引物、探针浓度优化如图 1所示,探针终浓度为120 nmol/L、引物浓度为400 nmol/L时扩增最平稳,信号最好;而在引物浓度为400 nmol/L时,随着探针浓度的升高(100−400 nmol/L),扩增信号也随之上升(图 2),因此选择最佳引物终浓度为400 nmol/L和探针终浓度为400 nmol/L。
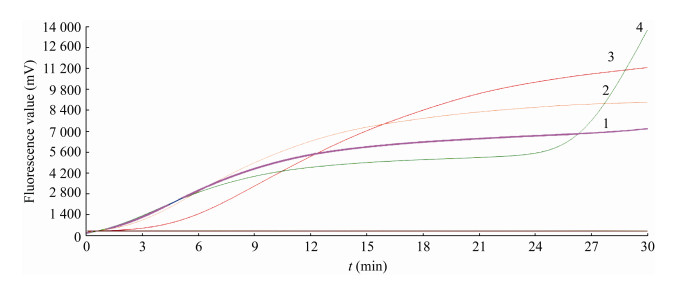
|
| 图 1 单增李斯特菌不同引物浓度荧光RAA扩增效果 Figure 1 Amplification effects of different primer concentrations of fluorescent RAA for Listeria monocytogenes Note: 1: 100 nmol/L; 2: 200 nmol/L; 3: 400 nmol/L; 4: 800 nmol/L |
|
|

|
| 图 2 单增李斯特菌不同探针浓度荧光RAA扩增效果 Figure 2 Amplification effect of fluorescent RAA concentration at different probe concentrations for Listeria monocytogenes Note: 1: 100 nmol/L; 2: 200 nmol/L; 3: 300 nmol/L; 4: 400 nmol/L |
|
|
将hlyA-F1、hlyA-R1、hlyA-F2、hlyA-R2两两组合,测试F1/R1、F1/R2、F2/R1、F2/R2引物对结合探针的扩增效果。由图 3可见,F1/R1/P对不同稀释度的菌液扩增梯度及灵敏度最稳定,因此筛选F1/R1/P引物、探针组合作为以后的扩增引物。最后确定单增李斯特菌荧光RAA最佳反应条件为:缓冲液25 μL,上、下游引物(10 μmol/L)各2 μL,探针(10 μmol/L) 2 μL,乙酸镁2.5 μL,DNA模板2 μL,纯化水14.5 μL;反应管放入荧光检测仪中42 ℃反应30 min。

|
| 图 3 不同引物探针组合荧光RAA测试结果 Figure 3 Fluorescence RAA test results of different primer probe combination Note: A: F1/R1/P; B: F1/R2/P; C: F2/R1/P; D: F2/R2/P. The dilution of Listeria monocytogenes ranged from 106 CFU/mL to 102 CFU/mL, ddH2O as the negative control |
|
|
特异性荧光RAA反应(同2.1.3),由图 4和图 5显示,只有单增李斯特菌ATCC株及分离株能扩增出特异性条带,其余菌株均无扩增信号,表明设计的引物和探针特异性好。

|
| 图 4 单增李斯特菌标准株荧光RAA特异性反应结果 Figure 4 Results of fluorescence RAA specific reaction for Listeria monocytogenes Note: 1: L. monocytogenes ATCC7644; 2: P. aeruginosa; 3: P. mirabilis; 4: K. pneumoniae; 5: S. typhimurium; 6: E. aerogenes; 7: E. coli; 8: E. tarda; 9: L. innocua; 10: L. seeligery; 11: L. ivanovii; 12: L. grayi; 13: L. welshimeri; 14: S. aureus; 15: E. faecalis; 16: S. hemolyticus; 17: ddH2O |
|
|

|
| 图 5 单增李斯特菌分离菌株荧光RAA特异性反应结果 Figure 5 Results of fluorescence RAA specific reaction of Listeria monocytogenes isolated strains Note: 1: L. monocytogenes M2 strain; 2: L. monocytogenes M3 strain; 3: L. monocytogenes M4 strain; 4: L. monocytogenes M5 strain; 5: L. monocytogenes M6 strain; 6: L. monocytogenes M7 strain; 7: ddH2O |
|
|
对不同稀释度的菌液提取DNA进行荧光RAA反应(同2.1.3)。图 6表明,单增李斯特菌以引物探针组合F1/R1/P进行荧光RAA扩增时灵敏度可达3×102 CFU/mL。
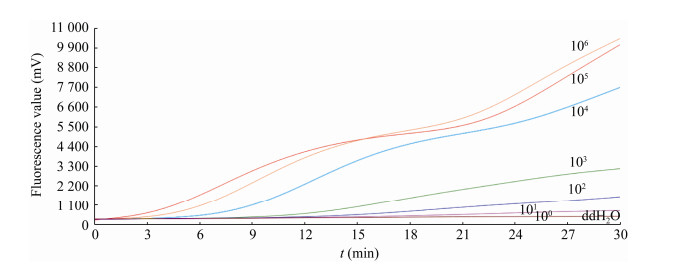
|
| 图 6 单增李斯特菌ATCC7644荧光RAA灵敏度试验 Figure 6 Fluorescence RAA sensitivity test for Listeria monocytogenes ATCC7644 注:单增李斯特菌稀释度由106–100 CFU/mL,ddH2O作为阴性对照 Note: The dilution of Listeria monocytogenes ranged from 106 CFU/mL to 100 CFU/mL, ddH2O as the negative control |
|
|
牛肉样品中添加不同浓度的单增李斯特菌经接种LB2二次增菌,荧光RAA反应(同2.1.3)检测结果见图 7。LB2增菌2 h后荧光RAA对牛肉中原始添加单增李斯特菌的检出限可达3×103 CFU/mL (图 7A),LB2增菌4 h后即可达到3 CFU/mL (图 7B),LB2增菌24 h后荧光扩增值更高(图 7C)。传统划线培养法LB2增菌24 h后检出限才达到30 CFU/mL,可见荧光RAA灵敏度及速度明显高于传统划线培养法。
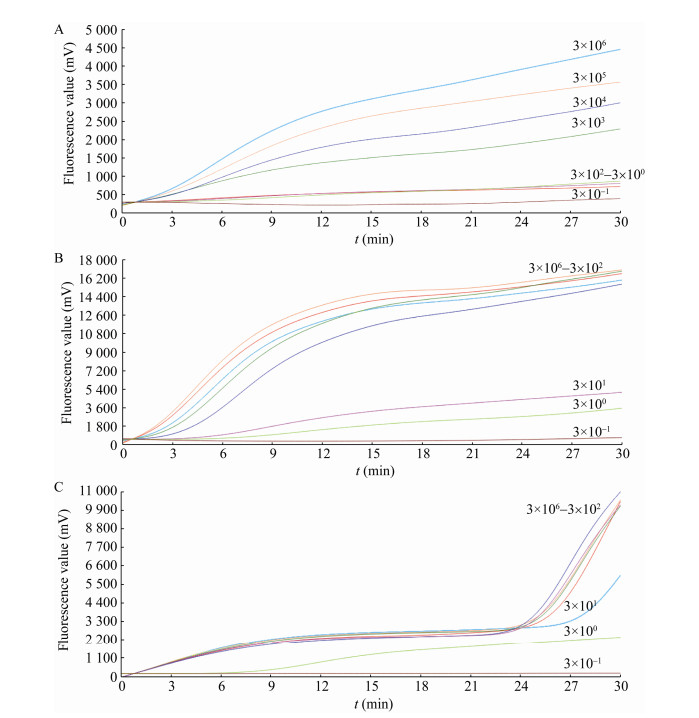
|
| 图 7 牛肉基质在LB2中不同增菌时间后荧光RAA扩增结果 Figure 7 Fluorescence RAA amplification results of beef matrix after different enrichment time in LB2 Note: A: Enrichment 2 h; B: Enrichment 4 h; C: Enrichment 24 h. The dilution of Listeria monocytogenes ranged from 3×106 CFU/mL to 3×10−1 CFU/mL, ddH2O as the negative control |
|
|
大西洋鲑鱼样品中添加不同浓度的单增李斯特菌,荧光RAA反应(同2.1.3)检测结果见图 8。LB2增菌2 h后,荧光RAA对大西洋鲑鱼中原始添加单增李斯特菌的检出限即可达到3 CFU/mL(图 8A);增菌4 h后检测限可达到0.3 CFU/mL (图 8B);增菌24 h后检测限可达到0.03 CFU/mL (图 8C)。传统划线培养法则在LB2增菌24 h后检出限才达到3 CFU/mL。
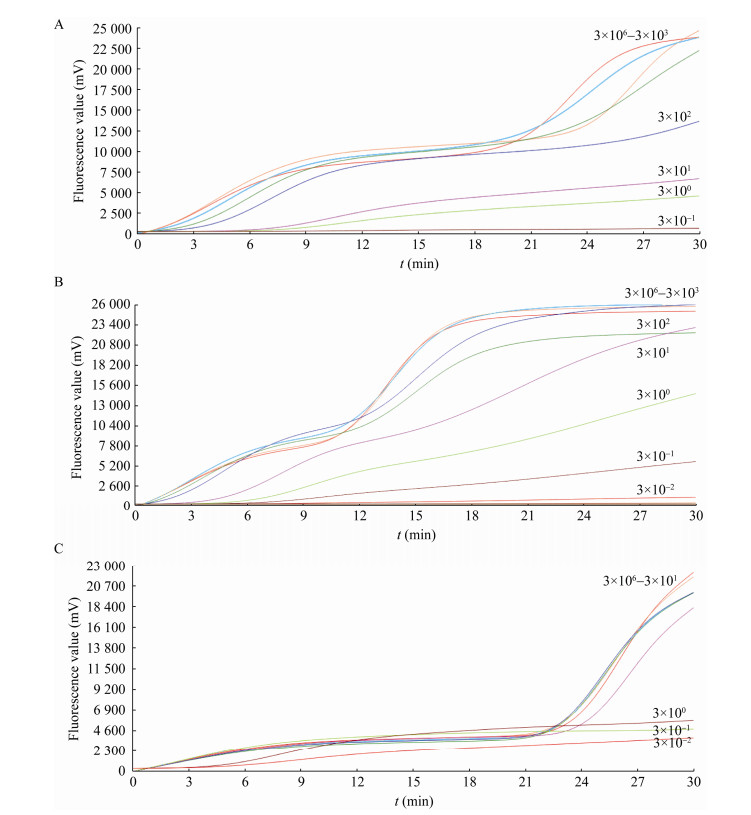
|
| 图 8 大西洋鲑鱼基质在LB2中不同增菌时间后荧光RAA扩增结果 Figure 8 Fluorescence RAA amplification results of Atlantic salmon matrix after different enrichment time in LB2 注:单增李斯特菌稀释度由3×106–3×10–2 CFU/mL Note: A: Enrichment 2 h; B: Enrichment 4 h; C: Enrichment 24 h. The dilution of Listeria monocytogenes ranged from 3×106 CFU/mL to 3×10–2 CFU/mL |
|
|
再制干酪样品中添加不同浓度的单增李斯特菌,RAA荧光反应(同2.1.3)检测结果见图 9。LB2增菌2 h后,荧光RAA对再制干酪中原始添加单增李斯特菌的检出限即可达到3×102 CFU/mL (结果未显示);LB2增菌4 h后检出限即可达到30 CFU/mL (图 9A);LB2增菌24 h后荧光扩增值更高(图 9B)。传统划线培养法则需LB2增菌24 h后检出限才能达到30 CFU/mL。

|
| 图 9 再制干酪基质在LB2中不同增菌时间后荧光RAA扩增结果 Figure 9 Fluorescence RAA amplification results of processed cheese matrix after different enrichment time in LB2 Note: A: Enrichment 4 h; B: Enrichment 24 h. The dilution of Listeria monocytogenes ranged from 3×106 CFU/mL to 3×10−1 CFU/mL |
|
|
上述3种食品基质中添加单增李斯特菌,经LB1预增菌,再经LB2增菌4 h,牛肉、大西洋鲑鱼及再制干酪中原始添加的单增李斯特菌检测限即可分别达到0.3、3、30 CFU/mL,而对于传统培养法,则均需LB2增菌24 h后检测限才分别达到3、30、30 CFU/mL。由于荧光RAA反应只需20−30 min即可观察结果,而传统培养法还需再培养24 h后才能出结果,因而荧光RAA在实验的简便性、灵敏度及快速性方面远胜于传统方法。
2.5 样品中单增李斯特菌的实际检测按照文献[16]标准方法对上海口岸跨境及市售的鸡肉、牛肉、大西洋鲑鱼、珍宝蟹及再制干酪等各20份共100份进行前处理增菌后提取基因组DNA,采用建立的荧光RAA方法进行检测,同时采用文献[16]标准方法中推荐的传统划线培养方法进行检测,结果表明有2份鸡肉、2份牛肉和1份大西洋鲑鱼荧光RAA方法检测结果呈阳性,与国家标准GB 4789.4-2016检测结果一致。
3 讨论与结论本研究建立了一种快速、简便、灵敏地检测单增李斯特菌的荧光RAA法。结果表明,除了单增李斯特菌标准株ATCC7644及分离株有扩增信号,其余的李斯特菌包括英诺克李斯特菌、斯氏李斯特菌、伊氏李斯特菌、格式李斯特菌、威氏李斯特菌及10种其他菌株均未有扩增,显示了该方法的高度特异性。
本研究通过优化反应条件,使荧光RAA法检测单增李斯特菌纯菌灵敏度达到3×102 CFU/mL。通常RAA技术推荐的温度为39 ℃,而本研究通过优化反应条件,确定单增李斯特菌荧光RAA扩增的最佳温度为42 ℃,探针的最佳浓度为400 nmol/L。引物探针的浓度,尤其是探针浓度对RAA法检测低拷贝的DNA比较关键。RAA扩增曲线在菌液浓度稀释到小于104 CFU/mL后呈现明显的下降趋势,在菌液浓度为102 CFU/mL时扩增信号比较微弱,影响了灵敏度。这一方面和引物探针的设计有关,也和最佳反应浓度相关。本研究发现,将探针终浓度提高到400 nmol/L以上可以很好地解决扩增信号低的缺点。绝大部分细菌的RAA反应灵敏度可达到102 CFU/mL以上。
在实际食品检测中,污染的食源性致病菌不如纯菌检测方便和灵敏。受食品基质的干扰及食品加工运输如冷冻、干燥及辐射等的影响,食源性致病菌通常处于一种受损状态,因而需要有预增菌及二次增菌的过程。即使是再灵敏、快速的分子生物学方法,也需要一定程序的增菌时间。不同食品基质表现出来的检测性质也有较大差异。本研究选择经常被单增李斯特菌污染的3种食品牛肉、大西洋鲑鱼及再制干酪为代表,作为人工添加单增李斯特菌的食品基质。研究表明,3种人工加标的食品基质在LB1预增菌前的荧光RAA检测限均只有3×105 CFU/mL,表明基质的检测干扰作用明显(结果未显示);而在LB2二次增菌后2−4 h检测限均明显提升。需说明的是LB2二次增菌至关重要,本试验曾尝试在LB1增菌后直接进行荧光RAA扩增,但线条比较混乱(结果未显示);经LB2二次增菌后荧光RAA的扩增曲线清晰有层次。牛肉、大西洋鲑鱼及再制干酪在LB2增菌4 h后检测限分别达到了原始添加浓度3、0.3及30 CFU/mL,大西洋鲑鱼在LB2增菌2 h后检测限即可达到3 CFU/mL。荧光RAA法灵敏度及速度均明显优于传统培养法。实际样品的检测结果也与国标法吻合。
近年来随着RAA技术的发展,出现了多种实际应用和检测方式。有学者将CRISPR/Cas12a系统与PCR及RAA技术结合起来检测单增李斯特菌,灵敏度分别达到3.37 CFU/mL和135 CFU/mL,检测时间为15 min,既快速灵敏度又高[17-18]。Xie等[12]利用叠氮溴化丙锭结合RAA法去除死菌干扰作用检测食品样品中活的金黄色葡萄球菌,能检测出人工加标污染奶中富集3 h后102 CFU/mL及6 h后10 CFU/mL的原始活菌。由此可见,该技术有望在将来引起更多的关注与发展,进而成为食品安全检测领域的新起点。
| [1] |
De Noordhout CM, Devleesschauwer B, Angulo FJ, Verbeke G, Haagsma J, Kirk M, Havelaar A, Speybroeck N. The global burden of listeriosis: a systematic review and meta-analysis[J]. The Lancet Infectious Diseases, 2014, 14(11): 1073-1082. DOI:10.1016/S1473-3099(14)70870-9 |
| [2] |
Carloni E, Rotundo L, Brandi G, Amagliani G. Rapid and simultaneous detection of Salmonella spp., Escherichia coli O157, and Listeria monocytogenes by magnetic capture hybridization and multiplex real-time PCR[J]. Folia Microbiologica, 2018, 63(6): 735-742. DOI:10.1007/s12223-018-0617-0 |
| [3] |
Bundidamorn D, Supawasit W, Trevanich S. A new single-tube platform of melting temperature curve analysis based on multiplex real-time PCR using EvaGreen for simultaneous screening detection of Shiga toxin-producing Escherichia coli, Salmonella spp. and Listeria monocytogenes in food[J]. Food Control, 2018, 94: 195-204. DOI:10.1016/j.foodcont.2018.07.001 |
| [4] |
Maury MM, Bracq-Dieye H, Huang L, Vales G, Lavina M, Thouvenot P, Disson O, Leclercq A, Brisse S, Lecuit M. Hypervirulent Listeria monocytogenes clones' adaption to mammalian gut accounts for their association with dairy products[J]. Nature Communications, 2019, 10: 2488. DOI:10.1038/s41467-019-10380-0 |
| [5] |
Buchanan RL, Gorris LGM, Hayman MM, Jackson TC, Whiting RC. A review of Listeria monocytogenes: an update on outbreaks, virulence, dose-response, ecology, and risk assessments[J]. Food Control, 2017, 75: 1-13. DOI:10.1016/j.foodcont.2016.12.016 |
| [6] |
Bundidamorn D, Supawasit W, Trevanich S. Taqman® probe based multiplex RT-PCR for simultaneous detection of Listeria monocytogenes, Salmonella spp. and Shiga toxin-producing Escherichia coli in foods[J]. Lebensmittel-Wissenschaft und-Technologie-Food Science and Technology, 2021, 147: 111696. DOI:10.1016/j.lwt.2021.111696 |
| [7] |
Roumani F, Azinheiro S, Carvalho J, Prado M, Garrido-Maestu A. Loop-mediated isothermal amplification combined with immunomagnetic separation and propidium monoazide for the specific detection of viable Listeria monocytogenes in milk products, with an internal amplification control[J]. Food Control, 2021, 125: 107975. DOI:10.1016/j.foodcont.2021.107975 |
| [8] |
Zhang Y, Hu XZ, Wang QJ. Sensitive and specific detection of E. coli, Listeria monocytogenes, and Salmonella enterica serovar Typhimurium in milk by microchip electrophoresis combined with multiplex PCR amplification[J]. Microchemical Journal, 2020, 157: 104876. DOI:10.1016/j.microc.2020.104876 |
| [9] |
Chen C, Li XN, Li GX, Zhao L, Duan SX, Yan TF, Feng ZS, Ma XJ. Use of a rapid reverse-transcription recombinase aided amplification assay for respiratory syncytial virus detection[J]. Diagnostic Microbiology and Infectious Disease, 2018, 90(2): 90-95. DOI:10.1016/j.diagmicrobio.2017.10.005 |
| [10] |
Xue GH, Li SL, Zhao HQ, Yan C, Feng YL, Cui JH, Jiang TT, Yuan J. Use of a rapid recombinase-aided amplification assay for Mycoplasma pneumoniae detection[J]. BMC Infectious Diseases, 2020, 20: 79. DOI:10.1186/s12879-019-4750-4 |
| [11] |
Hu JQ, Wang Y, Su HJ, Ding HM, Sun XC, Gao H, Geng Y, Wang ZC. Rapid analysis of Escherichia coli O157:H7 using isothermal recombinase polymerase amplification combined with triple-labeled nucleotide probes[J]. Molecular and Cellular Probes, 2020, 50: 101501. DOI:10.1016/j.mcp.2019.101501 |
| [12] |
Xie GY, Zhou DG, Zhao GJ, Feng XY, Aguilar ZP, Xu HY. Recombinase aided amplification with photoreactive DNA- binding dye for rapid detection of viable Staphylococcus aureus[J]. Lebensmittel-Wissenschaft und-Technologie-Food Science and Technology, 2021, 135: 110249. DOI:10.1016/j.lwt.2020.110249 |
| [13] |
Zhang XP, Guo LC, Ma RR, Cong LJ, Wu ZH, Wei Y, Xue SJ, Zheng W, Tang SJ. Rapid detection of Salmonella with recombinase-aided amplification[J]. Journal of Microbiological Methods, 2017, 139: 202-204. DOI:10.1016/j.mimet.2017.06.011 |
| [14] |
Sun XH, Hou LW, Li DR, Zhao Y, Huang XX, He YP, Lan WQ. Research progress on the application of isothermal recombinase amplification in analytical detection[J]. Food and Fermentation Industries, 2020, 46(24): 265-270. (in Chinese) 孙晓红, 后来旺, 李达容, 赵勇, 黄新新, 何宇平, 蓝蔚青. 重组酶等温扩增技术在分析检测中的应用研究进展[J]. 食品与发酵工业, 2020, 46(24): 265-270. |
| [15] |
Wei Y, Guo LC, Zhang XP, Huang L, Zheng LY, Ying QJ, Wu ZH, Zheng W. Establishment of recombinase-aided amplification assay for group A Streptococcus pyogens detection[J]. Chinese Journal of Frontier Health and Quarantine, 2018, 41(5): 314-316, 323. (in Chinese) 魏莹, 郭利川, 张小平, 黄雷, 郑乐怡, 应清界, 吴忠华, 郑伟. 重组酶介导扩增方法快速检测A族乙型溶血性链球菌[J]. 中国国境卫生检疫杂志, 2018, 41(5): 314-316, 323. |
| [16] |
Ministry of Health of the People's Republic of China. National Standard (Mandatory) of the People's Republic of China: National food safety standard Food microbiological examination: Listeria monocytogenes. GB 4789.30-2016[S]. Beijing: Standards Press of China, 2016 (in Chinese) 中华人民共和国卫生部. 中华人民共和国国家标准: 食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验GB 4789.30-2016[S]. 北京: 中国标准出版社, 2016 |
| [17] |
Li F, Ye QH, Chen MT, Xiang XR, Zhang JM, Pang R, Xue L, Wang J, Gu QH, Lei T, et al. Cas12aFDet: a CRISPR/Cas12a-based fluorescence platform for sensitive and specific detection of Listeria monocytogenes serotype 4c[J]. Analytica Chimica Acta, 2021, 1151: 338248. DOI:10.1016/j.aca.2021.338248 |
| [18] |
Li F, Ye QH, Chen MT, Zhou BQ, Zhang JM, Pang R, Xue L, Wang J, Zeng HY, Wu S, et al. An ultrasensitive CRISPR/Cas12a based electrochemical biosensor for Listeria monocytogenes detection[J]. Biosensors and Bioelectronics, 2021, 179: 113073. DOI:10.1016/j.bios.2021.113073 |
 2021, Vol. 48
2021, Vol. 48




