扩展功能
文章信息
- 杨林莉, 夏媛媛, 陈献忠
- YANG Linli, XIA Yuanyuan, CHEN Xianzhong
- 蔗糖磷酸化酶的研究进展
- Research progress on sucrose phosphorylase
- 微生物学通报, 2021, 48(12): 4904-4917
- Microbiology China, 2021, 48(12): 4904-4917
- DOI: 10.13344/j.microbiol.china.210250
-
文章历史
- 收稿日期: 2021-03-15
- 接受日期: 2021-04-29
- 网络首发日期: 2021-06-07
糖苷类化合物在自然界中广泛存在,并具有多种功能。例如,大量的抗生素是糖苷类药物,糖苷基对其药物活性至关重要并介导一些肿瘤药物的靶向作用和抗生素选择性[1]。然而,在一些不耐热分子(如抗坏血酸)上连接糖苷基可以极大地改善稳定性,从而实现长期保存[2]。虽然糖苷类化合物在食品、化妆品和制药行业上广泛应用,但由于部分化合物在自然界中数量很少,不足以用于商业开发。因此,利用廉价且易获得的原料合成此类糖苷化合物是目前研究的重点。化学方法可以合成糖基类化合物,但存在许多缺点,如需要昂贵的或有毒的催化剂、收率低、合成步骤复杂[3-4]。然而使用适当的酶进行糖基化反应时产生的废物减少了15 kg以上,时空产率是原来的16倍[5],这种利用酶催化合成糖苷类化合物的方法目前很受欢迎。
碳水化合物活性酶(Carbohydrate-Active Enzymes,CAZy)是一类对糖苷键有活性的酶,可以降解、修饰及生成糖苷键。CAZy可以分为4类:糖苷水解酶(GHs)、糖苷磷酸化酶(GPs)、转糖苷酶(TGs)及糖基转移酶(GTs)[6]。GH13家族,又称α-淀粉酶家族,是CAZy中最大的糖苷水解酶家族,这些酶在结构上相似但具有不同的特异性[7]。蔗糖磷酸化酶(Sucrose Phosphorylase,SPase)是GH13家族中的一类,其能够催化蔗糖磷酸解及其可逆反应,反应式为:Sucrose+ Phosphate
本文综述了蔗糖磷酸化酶的结构、来源、催化机制和应用等,概述了近年来对SPase的工程改造,最后讨论了未来的研究方向。
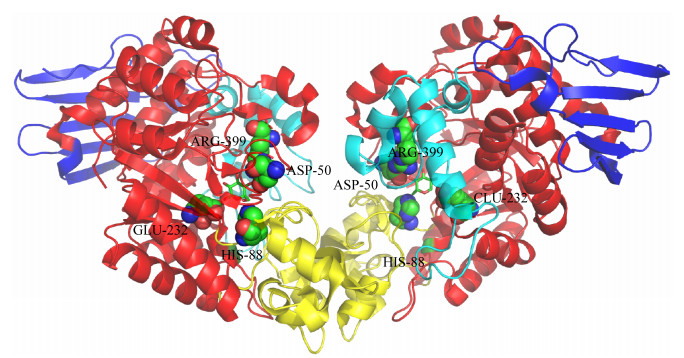
1 蔗糖磷酸化酶概述 1.1 酶的结构蔗糖磷酸化酶约有500个氨基酸,分子量在50−60 kD之间[9]。不同来源的SPase有其独特的蛋白结构和底物特异性,来源于肠膜明串珠菌和变形链球菌的蔗糖磷酸化酶(LmSP、SmSP)是一种单体蛋白[10-11],而来自青春双歧杆菌和嗜糖假单胞菌的SPase是一类二聚体[11-12]。2004年,来源于青春双歧杆菌(Bifidobacterium adolescentis)的蔗糖磷酸化酶(BaSP)的晶体结构(PDB 2gdv)被首次解析[13]。如图 1所示,BaSP的晶体结构由4部分组成:结构域A、B、B′、C。结构域A包含一个GH13家族所共有的结构——(β/α)8桶,以及酶的活性位点;结构域B由2个反向平行的β-折叠和2个短的α-螺旋组成;结构域B′包括一长一短α-螺旋,其拓扑结构减小了底物通道的大小,不利于低聚糖的结合;结构域C由一个5链反向平行的β-折叠组成,虽然所有GH13家族的酶都含有此结构域,但仅在蔗糖磷酸化酶中存在折叠结构[14]。
|
| 图 1 BaSP的晶体结构图 Figure 1 Crystal structure of BaSP 注:图片由PyMOL软件生成;不同颜色的折叠代表不同的结构域,红色:结构域A;黄色:结构域B;蓝绿色:结构域B′;蓝色:结构域C;球体代表BaSP的结合位点,分别为:ASP-50、HIS-88、GLU-232、ARG-399 (该蛋白为二聚体,左右结构相同,残基也相同);棍状结构代表蔗糖分子 Note: The picture is generated by PyMOL software; Different colors of sheets represent different domians, Red: Domain A; Yellow: Domain B; Turquoise: Domain B′; Blue: Domain C; Spheres represent the binding sites of BaSP, ASP-50, HIS-88, GLU-232, ARG-399, respectively (the protein is a dimer with the same left and right structure and the same residues); Sticks represent the sucrose molecules |
|
|
蔗糖磷酸化酶首次由Kagan等[15]在肠膜明串珠菌中发现,随后在多种微生物中发现。SPase主要分布在细菌中,在植物细胞中仅有少量分布。
目前报道的SPase的来源菌株主要有[16]:(1) 肠膜明串珠菌(Leuconostoc mesenteroides),其中肠膜明串珠菌ATCC 12291是目前产酶量最高的菌株;(2) 变异链球菌(Streptococcus mutans),Russell等[17]研究发现,由变异链球菌产生的葡萄糖基转移酶A可以可逆地催化蔗糖与磷酸生成D-果糖和α-D-葡萄糖-1-磷酸,因此将葡萄糖基转移酶A鉴定为蔗糖磷酸化酶;(3) 双歧杆菌(Bifidobacterium sp.),常见的产蔗糖磷酸化酶的有长双歧杆菌(Bifidobacterium longum)和青春双歧杆菌(Bifidobacterium adolescentis);(4) 嗜糖假单胞菌(Pseudomonas saccharophila),利用该菌株产生的SPase从葡萄糖-1-磷酸和L-阿拉伯糖合成了一种新的非还原性二糖和一种新的还原性二糖,前者在结构和某些化学反应上类似于蔗糖。
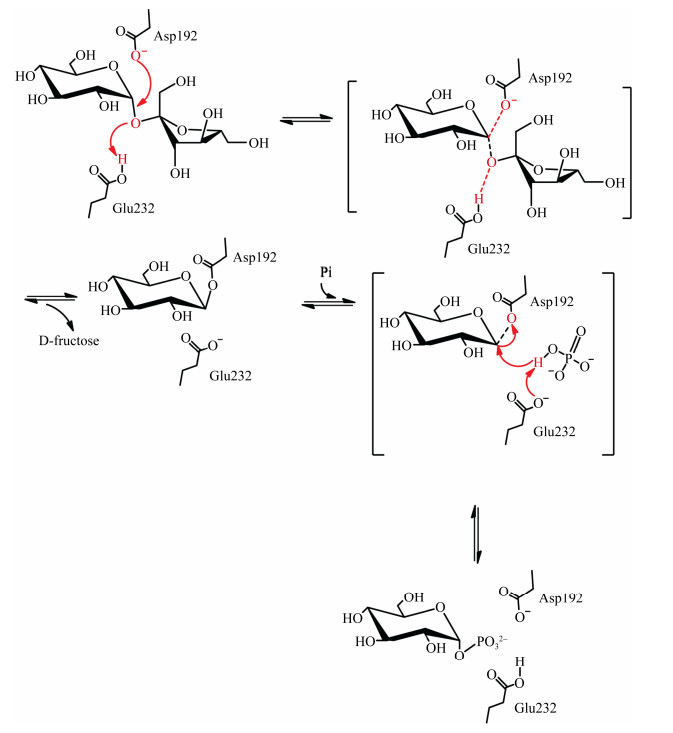
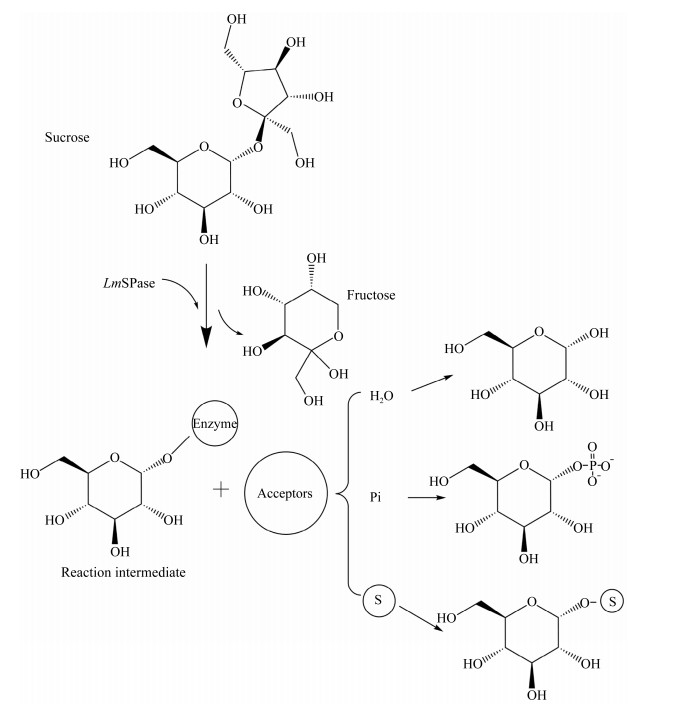
1.3 催化机制蔗糖磷酸化酶与GH13家族的其他酶一样,在反应时遵循双重置换机制。2个羧基氨基酸(在BaSP中为Asp192和Glu232,对应于LmSP中的Asp196和Glu237)在双重置换机制中起着关键作用[18],而且这2个催化残基完全保守。Asp192 (催化亲核试剂)攻击异头碳,同时Glu232 (一般酸/碱催化剂)将糖苷键的氧质子化,随后形成共价糖基酶中间体和释放果糖。如图 2所示,在受体位点发生构象变化后,中间体可与不同的受体底物(水、无机磷酸、糖等)反应,释放出糖苷产物[19]。值得注意地是,水解作为副反应总是存在[20]。在反应过程中,构型被翻转2次,最后底物和产物的构型相同,说明SPase属于保留构型酶[6]。
|
| 图 2 SPase催化的反应图 Figure 2 The reactions catalyzed by SPase 注:SPase与不同受体的反应,H2O:水解反应;Pi:磷酸解反应;糖:转糖基化反应 Note: The reactions of SPase with different receptors, H2O: Hydrolysis; Pi: Phosphorolysis; Sugar: Transglycosylation |
|
|
虽然早期就提出了蔗糖磷酸化酶是通过共价中间体进行转糖基化反应的概念,但是,近年来研究者才利用酶的晶体结构和定点突变等方法详细阐释了酶的反应机制[6]。将Asp196突变为Ala196得到了一种无活性的突变体D196A,添加叠氮化物作为外源亲核试剂对突变体D196A进行化学挽救,形成了具有反向异头构型的葡糖基-叠氮化物产物,证实Asp196是SPase的催化亲核试剂[21]。Schwarz等通过定点突变将Glu237突变为Gln237,发现突变体E237Q的糖基化在表观pKa为6.0以下时减慢,而且丧失了野生型的高pH依赖性,证实了E237Q的去糖基化与pH无关,以及Glu237是SPase的酸/碱催化剂[22]。除了起催化作用的残基外,其他一些高度保守的残基也有稳定过渡态的作用,有助于反应的进行,如Asp295、Phe52等[23-24]。SPase的催化反应机制如图 3所示[25]。
2 蔗糖磷酸化酶的应用蔗糖磷酸化酶具有广泛的受体混杂性,可以将蔗糖中的葡萄糖基转移到受体,对不同的受体进行葡萄糖基修饰作用,糖基化后的产物性能更加优越,可以用于食品、药品、化妆品等领域。此外,将蔗糖磷酸化酶与其他酶一起反应,可以得到其他更有价值的产物[26]。例如,利用3种酶(蔗糖磷酸化酶、木糖异构酶、纤维二糖磷酸化酶)合成的纤维二糖可作为可溶性膳食纤维和功能食品的原料之一;直链淀粉可作为可生物降解塑料薄膜的前体和潜在的高密度氢载体,目前可以利用SPase和马铃薯α-葡聚糖磷酸化酶从蔗糖合成直链淀粉[27]。因此,SPase是一种很有潜力的酶,主要用于合成低聚糖和糖苷类产物,具有很大的商业价值[28-29]。
2.1 合成低聚糖低聚糖是一种新型功能型糖原,广泛应用于食品、保健品、医药和饲料添加剂等领域,具有多种功能生物学活性。目前,用于低聚糖合成的磷酸化酶主要有3类:蔗糖磷酸化酶、麦芽糖磷酸化酶和纤维二糖磷酸化酶,均属葡萄糖基转移酶。用于合成低聚糖的原料,如淀粉类、蔗糖、乳糖等,来源丰富且价格低廉。
曲二糖具有益生元及抑制α-葡萄糖苷酶的活性等作用,其可以通过SPase催化,以廉价的葡萄糖和蔗糖为底物合成,具有广泛的应用前景[30]。SPase可以催化蔗糖和D-半乳糖合成蜜二糖,而蜜二糖可作为合成更高聚合度的糖的前体并对减轻过敏性皮炎症状有益[31]。
此外,蔗糖磷酸化酶与其他酶一起反应也可以生成低聚糖。将来自Bifidobacterium longum的蔗糖磷酸化酶(BlSP)、来自Cellulomonas uda的纤维二糖磷酸化酶(CuCbP)及来自Clostridium cellulosi的纤维糊精磷酸化酶(CcCdP)混合,以蔗糖和葡萄糖为底物,可以合成短链纤维低聚糖[32]。一锅多酶系统的开发,实现了在一个罐中进行复杂的多步化学转化,可以合成低聚糖、多糖和糖缀合物等;而且无需分离反应中间体,简化了下游分离的步骤,在工业应用上引起了极大的关注[33-34]。
2.2 合成糖苷类化合物 2.2.1 α-熊果苷熊果苷(Arbutin)是对苯二酚的糖苷形式,天然存在于许多植物中,大多由糖基转移酶在对苯二酚分子上加一个葡萄糖基形成的[35-36]。由于对酪氨酸酶有较强的抑制作用,可以抑制黑色素的生成,因此在商业上熊果苷是一种有效的皮肤美白剂,广泛应用于化妆品行业[37]。此外,熊果苷还具有抗氧化、抗菌活性及利尿特性,如今已用于治疗炎症、糖尿病、肾结石等病症[38-39]。熊果苷可分为α-熊果苷和β-熊果苷2类,在美白效果、水溶性和稳定性方面α-熊果苷要优于β-熊果苷[40],因此合成α-熊果苷越来越受到人们的关注。
目前,α-熊果苷的合成主要有3种方式,即化学合成、酶法合成及微生物合成。化学法合成熊果苷因其反应条件剧烈且易产生副产物,限制了该法在工业上的应用[37]。酶催化转糖基化反应是当前生产熊果苷的主要方式,表 1列出了用于生产熊果苷的几种酶的相关信息。
| 酶 Enzymes |
反应条件 Reaction conditions |
产量 Yield |
参考文献 References |
| LmSP | 40 g/L hydroquinone, sucrose: hydroquinone=5:1, pH 7.0, 30 ℃, 24 h | 98.00 g/L | [41] |
| SmSPI336L | Whole cell transformation | 110.30 g/L | [42] |
| Amylosucrase | 20 mmol/L sucrose, 5 mmol/L hydroquinone, pH 7.0, 40 ℃ |
44.70% | [43] |
| XcAS | 1 mol/L sucrose, 200 mmol/L hydroquinone | 53.86 g/L | [44] |
| Dextransucrase | 215 mmol/L sucrose, 450 mmol/L hydroquinone | 544.00 mg/L | [45] |
甘油葡萄糖苷(Glucosylglycerol,GG),是由一分子甘油和一分子葡萄糖通过糖苷键连接而成,最早发现于日本清酒和用酒曲酿造的其他食物中[46]。GG是一种相容性溶质,可作为渗透剂,在保护细胞免受高盐浓度、极端温度和其他形式的外部压力的侵害中起着重要作用[47];在促进益生菌生长、抑制致病性和胃肠道耐受性方面也具有很高的益生元潜力,这使其有望在未来作为一种新型功能食品[48]。此外,Sawangwan等通过对4种模型酶在不存在相容性溶质或存在0.5 mol/L的GG和GGA (R-2-O-α-D- Glucopyranosyl-Glycerate)的条件下进行灭活,发现在存在GG和GGA时,模型酶没有发生明显的失活,说明甘油葡萄糖苷可作为一种蛋白质的稳定剂[49]。GG还具有滋润保湿的作用,是化妆品中重要的保湿成分。同时,GG也是一种低热量的甜味剂,可防止蛀牙。
GG在化妆品、食品等商业上的广泛应用,促进了其合成方法的发展。GG可分为1-甘油葡萄糖苷和2-甘油葡萄糖苷,其中2-甘油葡萄糖苷又称为αGG[50]。目前,合成GG的方法有3种:生物合成、化学合成及酶法合成[51]。利用蓝藻Synechocystis sp. PCC 6803并结合基因工程技术可在盐胁迫及蓝藻凝胶封装条件下,以半连续培养方式合成GG,并且实现GG的胞外分泌[52]。由于αGG的保湿效果优于1-甘油葡萄糖苷,因此目前的研究主要集中于合成αGG。早期报道过利用化学法合成αGG,但由于化学法合成效率低、提取复杂、生物合成法成本高,因此酶法合成是目前最常用的方法[53]。酶法合成αGG如表 2所示。
| 酶 Enzymes |
反应条件 Reaction conditions |
产量 Yield |
参考文献 References |
| LmSP | 0.8 mol/L sucrose, 2.0 mol/L glycerol, 20 U/mL SPase, pH 7.0, 30 ℃ |
63.0% | [54] |
| LmSP | Immobilized Zbasic2-SPase | 85.0% | [55] |
| LmSP | Whole-cell catalyst, 1 mol/L sucrose, 2.5 mol/L glycerol, pH 7.0, 30 ℃ |
189.3 g/L | [56] |
| BaSP/L341W | 200 g/L sucrose, 200 g/L glycerol, 30 ℃ | 86.0 g/L | [50] |
除了合成熊果苷和GG外,SPase还可以将葡萄糖基转移至羧基化合物或多酚类化合物中,用于改善这些化合物的一些特性,增强它们作为食品和化妆品添加剂的有效性[57]。
L-抗坏血酸(L-Ascorbic Acid,L-AA),又称维生素C,具有抗氧化、抗自由基、抑制酪氨酸酶的形成等功能,从而达到美白、淡斑的效果,可作为化妆品的有效成分。然而由于L-AA的高抗氧化活性,其在自然状态下不稳定,限制了L-AA在化妆品和食品工业的广泛应用[2]。利用来自Bifidobacterium longum的SPase (BlSP)催化蔗糖和L-AA合成L-抗坏血酸2-O-α-D-葡萄糖苷(L-Ascorbic Acid 2-Glucoside,AA-2G),该化合物是L-AA的稳定形式[58]。由于AA-2G可以被上皮组织中广泛分布的α-葡萄糖苷酶缓慢水解,因此其在稳定性和人体生物利用度之间存在折衷,并且已经在护肤化妆品中确立了作用效果。
曲酸(5-羟基-2-羟甲基-γ-吡喃酮)是由许多曲霉和青霉菌产生的真菌代谢产物。作为一种美白产品,曲酸能够抑制酪氨酸酶的活性,减少黑色素的产生。但是从丝状真菌中提取出的曲酸具有一定毒性。利用SPase对曲酸进行糖基化后,其产物不仅能抑制酪氨酸酶的活性,还有更好的水溶性、稳定性[59]。
植物多酚类物质,如芪类化合物、白藜芦醇、黄酮类化合物,由于其抗菌和抗肿瘤等活性在医药领域有很大的用处。白藜芦醇是天然存在于葡萄、虎杖中的芪类化合物,作为植物抗毒素用于防御伤害和微生物感染[60-61]。近年来的临床试验证明,白藜芦醇可用于治疗糖尿病、心血管疾病和神经系统疾病,并作为食品和化妆品成分用于商业上[62]。然而天然白藜芦醇水溶性较差,生物利用度较低,导致其在工业上应用的效果大大下降[63]。将白藜芦醇糖基化是改善白藜芦醇水溶性或药物特性的一般策略[64],Kraus等对BaSP进行合理地诱变后,得到突变体BaSP Q345F;随后,利用该突变体对白藜芦醇进行高效糖基化,改善了白藜芦醇的水溶性和生物利用度[65]。
目前,已经商业化的产品有α-熊果苷、αGG及曲二糖等。α-熊果苷从2002年起已作为化妆品的美白添加剂在许多品牌中使用(如:日本资生堂、蝶翠诗),其价格约为4 000−8 000元/kg。商业上将αGG称为格莱可因(Glycoin),由于其生产过程价格昂贵且没有较好的分离方法,导致其价格昂贵——含量50%的αGG价格约为3 000元/kg。曲二糖在中国的研究还不多,但已作为试剂及一些药物中间体在日本等国家商业出售[28]。利用SPase生产这些高价值的产品经济快速,因此研究该酶具有重要作用及很高的经济价值。
3 蔗糖磷酸化酶的工程改造 3.1 热稳定性在不良条件下,高热稳定性往往伴随良好的性能。热稳定性的提高可能会导致:酶在异源宿主中表达产量更高;在温和条件下,酶的长期存活率提高;在恶劣的工业条件下半衰期更长[66-67]。目前工业生产中使用的SPase来源于非嗜热菌株,稳定性都不高,而在工业应用上利用蔗糖磷酸化酶进行的转糖基化反应最好在60 ℃或更高的温度下,以避免微生物污染[68]。因此,SPase的低热稳定性成为其工业应用发展的瓶颈,提高热稳定性是工程改造的重要目标。
获得热稳定性高的酶的方式通常有2种:自然筛选和工程改造。工程改造包括定向进化、半理性设计和理性设计[69]。表 3总结了提高SPase热稳定性的改造策略。利用易错PCR对来自变形链球菌的SPase随机突变,这种定向进化的方式获得的突变体在60 ℃加热20 min后仍保留60%的初始酶活性[70];在理性设计中,利用计算机选出BaSP晶体结构中最灵活的区域,将其定点突变也获得了热稳定性提高的突变体[71]。与定向进化相比,半理性和理性设计可以创建少量SPase的突变体,减少了筛选的工作量。除上述方法外,固定化也是一种非常有效的酶强化策略[75]。将BaSP多点共价固定在Sepabeads EC-HFA上,酶的最佳温度从58 ℃提高到65 ℃,而且pH稳定性也有了显著提高。此外,Valikhani等还对酶与微反应器进行融合设计,将酶与2个Zbasic2模块多价结合,结果在连续反应器操作过程中,经过690个反应周期后酶仍能保持约70%的活性[76]。
| 来源 Sources |
方式 Strategy |
结果 Results |
参考文献 References |
| Streptococcus mutans | Random mutations | 60% activity remains at 60 ℃ for 20 min | [70] |
| Bifidobacterium adolescentis | Combination of sequence- and structure-based mutagenesis | The half-life at 60 ℃ improved double | [71] |
| Streptococcus mutans | Consensus engineering | Tm value increased by 7 ℃ | [72] |
| Bifidobacterium adolescentis | Multipoint covalent immobilization | The optimum temperature reached 65 ℃ | [73] |
| Bifidobacterium adolescentis | CLEAs | The optimum temperature improved 17 ℃ | [74] |
虽然通过各种方法可以将SPase的最适反应温度提高到60 ℃左右,但在实际改造过程中仍存在许多问题。固定化方法虽然提高了酶的热稳定性,但固定化过程耗时且昂贵,限制了该法在工业上的广泛应用[71]。此外,半理性与理性设计热稳定性酶突变体也是一大挑战,因为目前尚不清楚引入的氨基酸突变与相邻残基的相互作用。另一个亟待解决的问题是引入的突变可能会导致酶失去活性或者活性大幅降低,导致酶突变体不适合工业应用。在未来的研究工作中,需要清楚该酶的三级结构,明确引入的氨基酸残基突变点的具体位置,为半理性和理性设计提供基础。
3.2 转糖基化活性改造利用蔗糖磷酸化酶对一些化合物进行糖基化,可显著改善它们的水溶性和生物利用度。目前需要解决的问题是,SPase对这些化合物的亲和力很低且在与水解反应竞争时,转糖基化反应处于劣势。例如,在以芳香族化合物为受体时,转糖基化速率低于水解速率,即使有很高的供受体底物浓度,产率仍然不高,因此在工业上的应用受到了限制[20, 77]。此外,SPase利用蔗糖和葡萄糖为供受体底物时,可以合成低热量的甜味剂——曲二糖,但其仅为次要产物,需要通过各种方法将酶的特异性转移至曲二糖的形成上[78]。
提高转糖基化活性的方法包括改变环结构、定向进化和蛋白质工程等,构建突变体是最常用的方法,如表 4所示。通过半理性诱变和低通量筛选获得的组合突变体L341I_Q345S对曲二糖的选择性为95%,原因是突变体对麦芽糖的选择性减少[78]。然而利用BaSP Q345F突变体对多酚化合物进行转糖基化反应,转化率相比野生型的4%提高到了97%[65]。这主要是由于突变形成了结构域转移,在活性位点引入了新的π-π和疏水相互作用,使SPase的受体偏好性由磷酸变为多酚底物,对包括白藜芦醇在内的多种芳香族底物的转化率增加[65, 82]。
| 酶的来源 Sources of enzyme |
突变位点 Mutant site |
结果 Results |
参考文献 References |
| Bifidobacterium adolescentis | L341I, Q345S | The selectivity of kojibiose was 95% | [78] |
| Leuconostoc mesenteroides | E237Q | The product impoved seven times | [79] |
| Leuconostoc mesenteroides | T180, T219, P236 | Increased L-sorbose transglycosidation activity | [80] |
| Bifidobacterium adolescentis | Q345F | The glycosylation rate of aromatic receptors reached up to 97% | [63] |
| Thermoanaerobacterium thermosaccharolyticum | R134A | The ability of binding to macromolecular receptors increased | [81] |
目前通过构建突变体获得了许多转糖基化活性提高的酶突变体,但由于许多改造位点位于酶关键活性位点的附近,直接导致酶活性丧失或降低[81]。此外,利用酶突变体合成产物的产率通常过低,使突变体在工业应用上受到限制。未来需要在寻找既能提高酶转糖基化活性又不使酶活性降低的酶突变体方面做出努力,以获得更适合于工业生产的蔗糖磷酸化酶突变体。
3.3 SPase在大肠杆菌(Escherichia coli)中的可溶性表达改造大肠杆菌是一种具有2层细胞膜的革兰氏阴性菌,因此表达的重组蛋白可以位于细胞质、周质和细胞外培养基中。表达的重组蛋白分泌到细胞外通常是最理想的,因为目标蛋白质被较少的蛋白质污染,并且需要的提取步骤更简单。细胞外表达蛋白质中的优良蛋白质折叠特性也可以提高生物学活性、溶解性和稳定性。然而SPase是一种天然的细胞质酶,需要经过物理、化学等方法破坏膜结构将酶从细胞内提取出来。大肠杆菌具有良好的遗传特性,培养要求简单和生长周期较短,是SPase表达最常用的宿主。但是在酶表达过程中通常会产生大量的包涵体,极大地限制了SPase的生产,给工业应用带来了不便。目前,许多研究集中在改善SPase在大肠杆菌中的可溶性表达。
通过对几种诱导因子进行诱导,如初始细胞密度、诱导剂(IPTG)浓度、诱导时间和温度等,经过优化后,纯化的SPase比活性大大提高,在大肠杆菌中的可溶性表达提高了1.8倍[29]。除了这种方法外,下述方法也可用于提高SPase的可溶性。
3.3.1 利用分子伴侣许多新合成的蛋白质的有效折叠依赖于分子伴侣的帮助,这有助于防止蛋白质在细胞拥挤的环境中错误折叠和聚集[83]。De Marco等提出两步法来增加溶解度:第一步,利用4个伴侣系统GroEL/GroES、DnaK/DnaJ/GrpE、ClpB和小的HSPs IbpA/IbpB与重组蛋白协同过量生产,以优化从头折叠;第二步,抑制蛋白质生物合成以允许伴侣蛋白介导的体内错误折叠和聚集蛋白质的重新折叠,最终使70%的64种外源蛋白的溶解度提高了42倍[84]。
Yao等在大肠杆菌BL21(DE3)中表达了来自Thermoanaerobacterium thermosaccharolyticum的蔗糖磷酸化酶基因(TtSP),为了增强TtSP的可溶性表达,共表达了一些伴侣质粒,并优化了它们的共表达条件;在最佳条件下,TtSP的活性,特别是与pG-TF2共表达,达到25.7 U/mg,是未共表达时的6.92倍[85]。
3.3.2 选择性引入稀有密码子外源基因中稀有密码子导致的蛋白合成提前终止,以及氨基酸的错误插入和/或mRNA的缓慢翻译,会降低外源蛋白质的表达。Zhong等将同义稀有密码子(SRCs)选择性引入到经密码子优化的Thermoanaerobacterium thermosaccharolyticum的蔗糖磷酸化酶基因和Streptomyces caatingaensis的酰胺水解酶基因中,研究了引入SRCs对这2个基因在大肠杆菌BL21(DE3)中表达的影响;结果表明,包含9个SRCs的最佳SPase突变体的可溶性蛋白水平是原来的6倍,而且选择性引入SRCs可以减弱特定位点的翻译,而这种不连续的衰减可以暂时分离肽链片段的翻译并主动协调其共翻译折叠,从而增强功能蛋白的表达[86]。
3.3.3 使用组成型表达系统天然酶通常不适用于工业生产,需要改善其底物特异性、稳定性或选择性。这些特性可以通过蛋白质工程优化,其中定向进化是一种非常有效的方法。突变体库的高通量筛选通常被认为是定向进化的瓶颈,在筛选文库之前,必须实现酶的可溶性表达。在Aerts等[87]的研究中,研究者设计了一组具有不同启动子强度的组成型表达质粒,并通过在大肠杆菌中表达多种微生物来源的蔗糖磷酸化酶,以证实该表达系统可用于高通量小规模表达。总体而言,在较低温度和较弱启动子条件下,使用深孔或低孔表达的酶产量有所提高,说明包涵体形成减少,可溶性表达提高。
4 展望以上总结了近年来关于蔗糖磷酸化酶的一些研究,虽然已经利用多种酶工程策略对SPase进行改造并得到了一些有益产品,但仍需更快更好的方法构建新的酶突变体,以生产更有价值的化合物。近年来仅研究了催化残基及受体位点中的一些残基,而活性位点中的残基在酶的特异性中也起重要作用,而且其他残基对特异性是否有作用是未知的,未来可以对这些残基进行研究。此外,SPase与淀粉蔗糖酶和蔗糖水解酶密切相关,将这些酶进行比较可以产生新的突变位点,可能获得新的高价值产物。在转糖基化反应中,由于水解副反应占有利地位,转糖基化反应活性很低。增加酶量仅对某些受体的转糖基化活性有利,而大多数受体与酶没有特异性作用,因此可能需要对受体位点进行彻底重构,从而获得转糖基化活性提高的酶变体。
目前,仍然主要通过随机或饱和突变等半理性方法进行酶的改造,所以需要更有效的方法,例如,利用同源性建模、配体对接及多序列比对等技术通过限制突变点的数量来降低筛选的工作量。另一方面,了解蛋白质的结构也同样重要,它们决定了催化机制和活性位点,相关分析后可以对更远的残基进行突变,以得到好的结果。
| [1] |
Křen V, Řezanka T. Sweet antibiotics: the role of glycosidic residues in antibiotic and antitumor activity and their randomization[J]. FEMS Microbiology Reviews, 2008, 32(5): 858-889. DOI:10.1111/j.1574-6976.2008.00124.x |
| [2] |
Li Y, Li Z, He XY, Chen LL, Cheng YC, Jia HH, Yan M, Chen KQ. Characterisation of a Thermobacillus sucrose phosphorylase and its utility in enzymatic synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid[J]. Journal of Biotechnology, 2019, 305: 27-34. DOI:10.1016/j.jbiotec.2019.08.018 |
| [3] |
Kiessling LL, Splain RA. Chemical approaches to glycobiology[J]. Annual Review of Biochemistry, 2010, 79: 619-653. DOI:10.1146/annurev.biochem.77.070606.100917 |
| [4] |
Lindhorst TK. Essentials of carbohydrate chemistry and biochemistry[J]. Carbohydrate Polymers, 2002, 47(1): 87. |
| [5] |
De Roode BM, Franssen MCR, Van Der Padt A, Boom RM. Perspectives for the industrial enzymatic production of glycosides[J]. Biotechnology Progress, 2003, 19(5): 1391-1402. DOI:10.1021/bp030038q |
| [6] |
Desmet T, Soetaert W. Enzymatic glycosyl transfer: mechanisms and applications[J]. Biocatalysis and Biotransformation, 2011, 29(1): 1-18. DOI:10.3109/10242422.2010.548557 |
| [7] |
Stam MR, Danchin EGJ, Rancurel C, Coutinho PM, Henrissat B. Dividing the large glycoside hydrolase family 13 into subfamilies: towards improved functional annotations of α-amylase-related proteins[J]. Protein Engineering, Design and Selection, 2006, 19(12): 555-562. DOI:10.1093/protein/gzl044 |
| [8] |
Goedl C, Schwarz A, Minani A, Nidetzky B. Recombinant sucrose phosphorylase from Leuconostoc mesenteroides: characterization, kinetic studies of transglucosylation, and application of immobilised enzyme for production of α-D-glucose 1-phosphate[J]. Journal of Biotechnology, 2007, 129(1): 77-86. DOI:10.1016/j.jbiotec.2006.11.019 |
| [9] |
Goedl C, Sawangwan T, Wildberger P, Nidetzky B. Sucrose phosphorylase: a powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals[J]. Biocatalysis and Biotransformation, 2010, 28(1): 10-21. DOI:10.3109/10242420903411595 |
| [10] |
Lee JH, Moon YH, Kim N, Kim YM, Kang HK, Jung JY, Abada E, Kang SS, Kim D. Cloning and expression of the sucrose phosphorylase gene from Leuconostoc mesenteroides in Escherichia coli[J]. Biotechnology Letters, 2007, 30(4): 749-754. |
| [11] |
Jiang RN, Ye K, Gan T, Lu YL, Zhu LJ, Chen XL, Chen HC. Application of sucrose phosphorylase in glycosylation[J]. Chinese Journal of Biotechnology, 2021, 37(1): 112-129. (in Chinese) 江瑞妮, 叶康, 甘恬, 陆跃乐, 朱林江, 陈小龙, 陈翰驰. 蔗糖磷酸化酶及其在糖基化反应中的应用[J]. 生物工程学报, 2021, 37(1): 112-129. |
| [12] |
Broek LAM, Boxtel EL, Kievit RP, Verhoef R, Beldman G, Voragen AGJ. Physico-chemical and transglucosylation properties of recombinant sucrose phosphorylase from Bifidobacterium adolescentis DSM20083[J]. Applied Microbiology and Biotechnology, 2004, 65(2): 219-227. DOI:10.1007/s00253-003-1534-x |
| [13] |
Sprogøe D, Van Den Broek LAM, Mirza O, Kastrup JS, Voragen AGJ, Gajhede M, Skov LK. Crystal structure of sucrose phosphorylase from Bifidobacterium adolescentis[J]. Biochemistry, 2004, 43(5): 1156-1162. DOI:10.1021/bi0356395 |
| [14] |
Verhaeghe T. Improving the glycosylation potential of sucrose phosphorylase through enzyme engineering[D]. Ghent: Doctoral Dissertation of Ghent University, 2014
|
| [15] |
Kagan BO, Latker SN, Zfasman EM. Phosphorolysis of saccharose by cultures of Leuconostoc mesenteroides[J]. Biokhimiya, 1942, 7: 93-108. |
| [16] |
Hou GW, Ma JF, Sui SS, Jiang M, Wei P. Research progress on production and application of sucrose phosphorylase[J]. China Brewing, 2010, 29(6): 17-20. (in Chinese) 侯顾伟, 马江锋, 隋姗姗, 姜岷, 韦萍. 蔗糖磷酸化酶制备及应用的研究进展[J]. 中国酿造, 2010, 29(6): 17-20. DOI:10.3969/j.issn.0254-5071.2010.06.006 |
| [17] |
Russell RR, Mukasa H, Shimamura A, Ferretti JJ. Streptococcus mutans gtfA gene specifies sucrose phosphorylase[J]. Infection and Immunity, 1988, 56(10): 2763-2765. DOI:10.1128/iai.56.10.2763-2765.1988 |
| [18] |
Rye CS, Withers SG. Glycosidase mechanisms[J]. Current Opinion in Chemical Biology, 2000, 4(5): 573-580. DOI:10.1016/S1367-5931(00)00135-6 |
| [19] |
Mirza O, Skov LK, Sprogøe D, Van Den Broek LAM, Beldman G, Kastrup JS, Gajhede M. Structural rearrangements of sucrose phosphorylase from Bifidobacterium adolescentis during sucrose conversion[J]. Journal of Biological Chemistry, 2006, 281(46): 35576-35584. DOI:10.1074/jbc.M605611200 |
| [20] |
Aerts D, Verhaeghe TF, Roman BI, Stevens CV, Desmet T, Soetaert W. Transglucosylation potential of six sucrose phosphorylases toward different classes of acceptors[J]. Carbohydrate Research, 2011, 346(13): 1860-1867. DOI:10.1016/j.carres.2011.06.024 |
| [21] |
Schwarz A, Nidetzky B. Asp-196→Ala mutant of Leuconostoc mesenteroides sucrose phosphorylase exhibits altered stereochemical course and kinetic mechanism of glucosyl transfer to and from phosphate[J]. FEBS Letters, 2006, 580(16): 3905-3910. DOI:10.1016/j.febslet.2006.06.020 |
| [22] |
Schwarz A, Brecker L, Nidetzky B. Acid-base catalysis in Leuconostoc mesenteroides sucrose phosphorylase probed by site-directed mutagenesis and detailed kinetic comparison of wild-type and Glu237→Gln mutant enzymes[J]. The Biochemical Journal, 2007, 403(3): 441-449. DOI:10.1042/BJ20070042 |
| [23] |
Mueller M, Nidetzky B. The role of Asp-295 in the catalytic mechanism of Leuconostoc mesenteroides sucrose phosphorylase probed with site-directed mutagenesis[J]. FEBS Letters, 2007, 581(7): 1403-1408. DOI:10.1016/j.febslet.2007.02.060 |
| [24] |
Wildberger P, Luley-Goedl C, Nidetzky B. Aromatic interactions at the catalytic subsite of sucrose phosphorylase: their roles in enzymatic glucosyl transfer probed with Phe52 → Ala and Phe52 → Asn mutants[J]. FEBS Letters, 2011, 585(3): 499-504. DOI:10.1016/j.febslet.2010.12.041 |
| [25] |
Mirza O, Skov LK, Remaud-Simeon M, Potocki De Montalk G, Albenne C, Monsan P, Gajhede M. Crystal structures of amylosucrase from Neisseria polysaccharea in complex with D-glucose and the active site mutant Glu328Gln in complex with the natural substrate sucrose[J]. Biochemistry, 2001, 40(30): 9032-9039. DOI:10.1021/bi010706l |
| [26] |
Franceus J, Desmet T. Sucrose phosphorylase and related enzymes in glycoside hydrolase family 13: discovery, application and engineering[J]. International Journal of Molecular Sciences, 2020, 21(7): 2526. DOI:10.3390/ijms21072526 |
| [27] |
Qi P, You C, Zhang YHP. One-pot enzymatic conversion of sucrose to synthetic amylose by using enzyme cascades[J]. ACS Catalysis, 2014, 4(5): 1311-1317. DOI:10.1021/cs400961a |
| [28] |
Wang MM. Study on heterologous expression of Bifidobacterium adolescentis sucrose phosphorylase and its application and immobilization[D]. Wuxi: Master's Thesis of Jiangnan University, 2019 (in Chinese) 王淼淼. Bifidobacterium adolescentis蔗糖磷酸化酶的重组表达、应用及固定化研究[D]. 无锡: 江南大学硕士学位论文, 2019 |
| [29] |
Zhang H. Optimization of expression and property analysis of recombinant sucrose phosphorylase in Escherichia coli BL21[D]. Shenyang: Master's Thesis of Shenyang Agricultural University, 2018 (in Chinese) 张蕙. 重组蔗糖磷酸化酶在大肠杆菌BL21中的表达优化及酶学性质分析[D]. 沈阳: 沈阳农业大学硕士学位论文, 2018 |
| [30] |
Wang MM, Wu J, Wu D. Cloning and expression of the sucrose phosphorylase gene in Bacillus subtilis and synthesis of kojibiose using the recombinant enzyme[J]. Microbial Cell Factories, 2018, 17(1): 23. DOI:10.1186/s12934-017-0842-2 |
| [31] |
Lin JF, Xie L, Guo LQ, Ye ZW. Application of recombinant sucrose phosphatase in preparation of functional oligosaccharide: CN. CN106367458A[P]. 2017-02-01 (in Chinese) 林俊芳, 谢露, 郭丽琼, 叶志伟. 重组蔗糖磷酸化酶在制备功能性低聚糖中的应用: 中国CN106367458A[P]. 2017-02-01 |
| [32] |
Zhong C, Duić B, Bolivar JM, Nidetzky B. Three-enzyme phosphorylase cascade immobilized on solid support for biocatalytic synthesis of cello-oligosaccharides[J]. ChemCatChem, 2020, 12(5): 1350-1358. DOI:10.1002/cctc.201901964 |
| [33] |
Muschiol J, Peters C, Oberleitner N, Mihovilovic MD, Bornscheuer UT, Rudroff F. Cascade catalysis: strategies and challenges en route to preparative synthetic biology[J]. Chemical Communications: Cambridge, England, 2015, 51(27): 5798-5811. DOI:10.1039/C4CC08752F |
| [34] |
Li WQ, McArthur JB, Chen X. Strategies for chemoenzymatic synthesis of carbohydrates[J]. Carbohydrate Research, 2019, 472: 86-97. DOI:10.1016/j.carres.2018.11.014 |
| [35] |
Liu CQ, Deng L, Zhang P, Zhang SR, Liu L, Xu T, Wang F, Tan TW. Screening of high α-arbutin producing strains and production of α-arbutin by fermentation[J]. World Journal of Microbiology and Biotechnology, 2013, 29(8): 1391-1398. DOI:10.1007/s11274-013-1302-8 |
| [36] |
Zhu XT, Tian YQ, Zhang WL, Zhang T, Guang CE, Mu WM. Recent progress on biological production of α-arbutin[J]. Applied Microbiology and Biotechnology, 2018, 102: 8145-8152. DOI:10.1007/s00253-018-9241-9 |
| [37] |
Seo DH, Jung JH, Lee JE, Jeon EJ, Kim W, Park CS. Biotechnological production of arbutins (α- and β-arbutins), skin-lightening agents, and their derivatives[J]. Applied Microbiology and Biotechnology, 2012, 95(6): 1417-1425. DOI:10.1007/s00253-012-4297-4 |
| [38] |
Jurica K, Gobin I, Kremer D, Čepo DV, Grubešić RJ, Karačonji IB, Kosalec I. Arbutin and its metabolite hydroquinone as the main factors in the antimicrobial effect of strawberry tree (Arbutus unedo L.) leaves[J]. Journal of Herbal Medicine, 2017, 8: 17-23. DOI:10.1016/j.hermed.2017.03.006 |
| [39] |
Oliveira I, Coelho V, Baltasar R, Pereira JA, Baptista P. Scavenging capacity of strawberry tree (Arbutus unedo L.) leaves on free radicals[J]. Food and Chemical Toxicology, 2009, 47(7): 1507-1511. DOI:10.1016/j.fct.2009.03.042 |
| [40] |
Avonto C, Wang YH, Avula B, Wang M, Rua D, Khan IA. Comparative studies on the chemical and enzymatic stability of alpha- and beta-arbutin[J]. International Journal of Cosmetic Science, 2016, 38(2): 187-193. DOI:10.1111/ics.12275 |
| [41] |
Li XY, Xia YY, Shen W, Yang HQ, Cao Y, Chen XZ. Characterization of a sucrose phosphorylase from Leuconostoc mesenterides for the synthesis of α-arbutin[J]. Chinese Journal of Biotechnology, 2020, 36(8): 1546-1555. (in Chinese) 李晓玉, 夏媛媛, 沈微, 杨海泉, 曹钰, 陈献忠. 肠膜明串珠菌蔗糖磷酸化酶的酶学表征及在催化合成α-熊果苷中的应用[J]. 生物工程学报, 2020, 36(8): 1546-1555. |
| [42] |
Shen Y, Lü XQ, Lin L, Li JH, Du GC, Liu L. Semi-rational design of sucrose phosphorylase and optimization of conditions for α-arbutin production[J]. Food and Fermentation Industries, 2020, 46(13): 1-9. (in Chinese) 沈洋, 吕雪芹, 林璐, 李江华, 堵国成, 刘龙. 蔗糖磷酸化酶的半理性设计及生产α-熊果苷的条件优化[J]. 食品与发酵工业, 2020, 46(13): 1-9. |
| [43] |
Yu SH, Wang YC, Tian YQ, Xu W, Bai YX, Zhang T, Mu WM. Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J]. Process Biochemistry, 2018, 68: 93-99. DOI:10.1016/j.procbio.2018.02.012 |
| [44] |
Peng Y, Tang SY, Zhang Y, Zhu L, Ling JY, Hu MR, Tao Y. High-yield production of α-arbutin by an Escherichia coli whole-cell biocatalyst expressing amylosucrase[A]// National Symposium on Enzyme Engineering and Glycobiotechnology[C]. 2015
|
| [45] |
Seo ES, Kang J, Lee JH, Kim GE, Kim GJ, Kim D. Synthesis and characterization of hydroquinone glucoside using Leuconostoc mesenteroides dextransucrase[J]. Enzyme and Microbial Technology, 2009, 45(5): 355-360. DOI:10.1016/j.enzmictec.2009.07.011 |
| [46] |
Takenaka F, Uchiyama H, Imamura T. Identification of α-D-glucosylglycerol in sake[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(2): 378-385. DOI:10.1271/bbb.64.378 |
| [47] |
Klähn S, Hagemann M. Compatible solute biosynthesis in cyanobacteria[J]. Environmental Microbiology, 2011, 13(3): 551-562. DOI:10.1111/j.1462-2920.2010.02366.x |
| [48] |
Sawangwan T. Glucosylglycerol on performance of prebiotic potential[J]. Functional Foods in Health and Disease, 2015, 5(12): 427. DOI:10.31989/ffhd.v5i12.222 |
| [49] |
Sawangwan T, Goedl C, Nidetzky B. Glucosylglycerol and glucosylglycerate as enzyme stabilizers[J]. Biotechnology Journal, 2010, 5(2): 187-191. DOI:10.1002/biot.200900197 |
| [50] |
Su GZ, Wang CG, Xue HY, Shi LQ. Sucrose phosphorylase mutant and its application in the production of glycosylglycerol: CN. CN107858335A[P]. 2018-03-30 (in Chinese) 苏桂珍, 汪昌国, 薛虹宇, 史鲁秋. 蔗糖磷酸化酶突变体及其在生产甘油葡萄糖苷中应用: 中国CN107858335A[P]. 2018-03-30 |
| [51] |
Tan XM, Luo Q, Lu XF. Biosynthesis, biotechnological production, and applications of glucosylglycerols[J]. Applied Microbiology and Biotechnology, 2016, 100(14): 6131-6139. DOI:10.1007/s00253-016-7608-3 |
| [52] |
Tan XM, Du W, Lu XF. Photosynthetic and extracellular production of glucosylglycerol by genetically engineered and gel-encapsulated cyanobacteria[J]. Applied Microbiology and Biotechnology, 2015, 99(5): 2147-2154. DOI:10.1007/s00253-014-6273-7 |
| [53] |
Takenaka F, Uchiyama H. Synthesis of α-D-glucosylglycerol by α-glucosidase and some of its characteristics[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(9): 1821-1826. DOI:10.1271/bbb.64.1821 |
| [54] |
Goedl C, Sawangwan T, Mueller M, Schwarz A, Nidetzky B. A high-yielding biocatalytic process for the production of 2-O-(alpha-D-glucopyranosyl)-sn-glycerol, a natural osmolyte and useful moisturizing ingredient[J]. Angewandte Chemie: International Ed in English, 2008, 47(52): 10086-10089. DOI:10.1002/anie.200803562 |
| [55] |
Bolivar JM, Luley-Goedl C, Leitner E, Sawangwan T, Nidetzky B. Production of glucosyl glycerol by immobilized sucrose phosphorylase: options for enzyme fixation on a solid support and application in microscale flow format[J]. Journal of Biotechnology, 2017, 257: 131-138. DOI:10.1016/j.jbiotec.2017.01.019 |
| [56] |
Duan PF, You JJ, Xu MJ, Yang TW, Shao ML, Zhang X, Rao ZM. Whole-cell biosynthesis of 2-O-α-D-glu- copyranosyl-sn-glycerol by recombinant Bacillus subtilis[J]. Chinese Journal of Biotechnology, 2020, 36(9): 1918-1928. (in Chinese) 段培枫, 尤甲甲, 徐美娟, 杨套伟, 邵明龙, 张显, 饶志明. 重组枯草芽孢杆菌全细胞催化合成2-O-α-D-甘油葡糖苷[J]. 生物工程学报, 2020, 36(9): 1918-1928. |
| [57] |
Sugimoto K, Nomura K, Nishiura H, Ohdan K, Ohdan K, Hayashi H, Kuriki T. Novel transglucosylating reaction of sucrose phosphorylase to carboxylic compounds such as benzoic acid[J]. Journal of Bioscience and Bioengineering, 2007, 104(1): 22-29. DOI:10.1263/jbb.104.22 |
| [58] |
Gudiminchi RK, Nidetzky B. Walking a fine line with sucrose phosphorylase: efficient single-step biocatalytic production of l-ascorbic acid 2-glucoside from sucrose[J]. Chembiochem, 2017, 18(14): 1387-1390. DOI:10.1002/cbic.201700215 |
| [59] |
Nakajima N, Ishihara K, Hamada H. Functional glucosylation of kojic acid and daidzein with the Eucalyptus membrane-associated UDP-glucosyltransferase reaction system[J]. Journal of Bioscience and Bioengineering, 2001, 92(5): 469-471. DOI:10.1016/S1389-1723(01)80298-X |
| [60] |
Vestergaard M, Ingmer H. Antibacterial and antifungal properties of resveratrol[J]. International Journal of Antimicrobial Agents, 2019, 53(6): 716-723. DOI:10.1016/j.ijantimicag.2019.02.015 |
| [61] |
Sáez-Sáez J, Wang GK, Marella ER, Sudarsan S, Cernuda Pastor M, Borodina I. Engineering the oleaginous yeast Yarrowia lipolytica for high-level resveratrol production[J]. Metabolic Engineering, 2020, 62: 51-61. DOI:10.1016/j.ymben.2020.08.009 |
| [62] |
Turner RS, Thomas RG, Craft S, Van Dyck CH, Mintzer J, Reynolds BA, Brewer JB, Rissman RA, Raman R, Aisen PS, et al. A randomized, double-blind, placebo-controlled trial of resveratrol for Alzheimer disease[J]. Neurology, 2015, 85(16): 1383-1391. DOI:10.1212/WNL.0000000000002035 |
| [63] |
Kraus M, Grimm C, Seibel J. Redesign of the active site of sucrose phosphorylase through a clash-induced cascade of loop shifts[J]. Chembiochem, 2016, 17(1): 33-36. DOI:10.1002/cbic.201500514 |
| [64] |
Gantt RW, Peltier-Pain P, Thorson JS. Enzymatic methods for glycol (diversification/randomization) of drugs and small molecules[J]. Natural Product Reports, 2011, 28(11): 1811-1853. DOI:10.1039/c1np00045d |
| [65] |
Kraus M, Grimm C, Seibel J. Reversibility of a point mutation induced domain shift: expanding the conformational space of a sucrose phosphorylase[J]. Scientific Reports, 2018, 8(1): 10490. DOI:10.1038/s41598-018-28802-2 |
| [66] |
Ferdjani S, Ionita M, Roy B, Dion M, Djeghaba Z, Rabiller C, Tellier C. Correlation between thermostability and stability of glycosidases in ionic liquid[J]. Biotechnology Letters, 2011, 33(6): 1215-1219. DOI:10.1007/s10529-011-0560-5 |
| [67] |
Wijma HJ, Floor RJ, Janssen DB. Structure- and sequence-analysis inspired engineering of proteins for enhanced thermostability[J]. Current Opinion in Structural Biology, 2013, 23(4): 588-594. DOI:10.1016/j.sbi.2013.04.008 |
| [68] |
Haki GD, Rakshit SK. Developments in industrially important thermostable enzymes: a review[J]. Bioresource Technology, 2003, 89(1): 17-34. DOI:10.1016/S0960-8524(03)00033-6 |
| [69] |
Unsworth LD, Van Der Oost J, Koutsopoulos S. Hyperthermophilic enzymes-Stability, activity and implementation strategies for high temperature applications[J]. The FEBS Journal, 2007, 274(16): 4044-4056. DOI:10.1111/j.1742-4658.2007.05954.x |
| [70] |
Fujii K, Iiboshi M, Yanase M, Takaha T, Kuriki T. Enhancing the thermal stability of sucrose phosphorylase from Streptococcus mutans by random mutagenesis[J]. Journal of Applied Glycoscience, 2006, 53(2): 91-97. DOI:10.5458/jag.53.91 |
| [71] |
Cerdobbel A, De Winter K, Aerts D, Kuipers R, Joosten HJ, Soetaert W, Desmet T. Increasing the thermostability of sucrose phosphorylase by a combination of sequence- and structure-based mutagenesis[J]. Protein Engineering, Design and Selection, 2011, 24(11): 829-834. DOI:10.1093/protein/gzr042 |
| [72] |
Aerts D, Verhaeghe T, Joosten HJ, Vriend G, Soetaert W, Desmet T. Consensus engineering of sucrose phosphorylase: the outcome reflects the sequence input[J]. Biotechnology and Bioengineering, 2013, 110(10): 2563-2572. DOI:10.1002/bit.24940 |
| [73] |
Cerdobbel A, Desmet T, De Winter K, Maertens J, Soetaert W. Increasing the thermostability of sucrose phosphorylase by multipoint covalent immobilization[J]. Journal of Biotechnology, 2010, 150(1): 125-130. DOI:10.1016/j.jbiotec.2010.07.029 |
| [74] |
Cerdobbel A, De Winter K, Desmet T, Soetaert W. Sucrose phosphorylase as cross-linked enzyme aggregate: improved thermal stability for industrial applications[J]. Biotechnology Journal, 2010, 5(11): 1192-1197. DOI:10.1002/biot.201000202 |
| [75] |
Mateo C, Grazú V, Pessela BCC, Montes T, Palomo JM, Torres R, López-Gallego F, Fernández-Lafuente R, Guisán JM. Advances in the design of new epoxy supports for enzyme immobilization-stabilization[J]. Biochemical Society Transactions, 2007, 35(Pt 6): 1593-1601. |
| [76] |
Valikhani D, Bolivar JM, Pfeiffer M, Nidetzky B. Multivalency effects on the immobilization of sucrose phosphorylase in flow microchannels and their use in the development of a high-performance biocatalytic microreactor[J]. ChemCatChem, 2017, 9(1): 161-166. DOI:10.1002/cctc.201601019 |
| [77] |
Verhaeghe T, Diricks M, Aerts D, Soetaert W, Desmet T. Mapping the acceptor site of sucrose phosphorylase from Bifidobacterium adolescentis by alanine scanning[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 96: 81-88. DOI:10.1016/j.molcatb.2013.06.014 |
| [78] |
Verhaeghe T, De Winter K, Berland M, De Vreese R, D'Hooghe M, Offmann B, Desmet T. Converting bulk sugars into prebiotics: semi-rational design of a transglucosylase with controlled selectivity[J]. Chemical Communications: Cambridge, England, 2016, 52(18): 3687-3689. DOI:10.1039/C5CC09940D |
| [79] |
Wiesbauer J, Goedl C, Schwarz A, Brecker L, Nidetzky B. Substitution of the catalytic acid-base Glu237 by Gln suppresses hydrolysis during glucosylation of phenolic acceptors catalyzed by Leuconostoc mesenteroides sucrose phosphorylase[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 65(1-4): 24-29. DOI:10.1016/j.molcatb.2009.12.007 |
| [80] |
He HH, Lin HM, Kou LD, Qin FL, Wei YT, Huang RB, Du LQ. Characterization of recombinant sucrose phosphorylase from Leuconostoc mesenteroides ATCC 12291 and its molecular modification for improved transglucoside activity[J]. Food Science, 2019, 40(20): 122-129. (in Chinese) 何贺贺, 林厚民, 寇力丹, 覃凤兰, 韦宇拓, 黄日波, 杜丽琴. 肠膜明串珠菌ATCC 12291蔗糖磷酸化酶的酶学性质及转糖苷分子改造[J]. 食品科学, 2019, 40(20): 122-129. DOI:10.7506/spkx1002-6630-20181024-279 |
| [81] |
Dirks-Hofmeister ME, Verhaeghe T, De Winter K, Desmet T. Creating space for large acceptors: rational biocatalyst design for resveratrol glycosylation in an aqueous system[J]. Angewandte Chemie International Edition, 2015, 54(32): 9289-9292. DOI:10.1002/anie.201503605 |
| [82] |
Kraus M, Grimm C, Seibel J. Switching enzyme specificity from phosphate to resveratrol glucosylation[J]. Chemical Communications, 2017, 53(90): 12181-12184. DOI:10.1039/C7CC05993K |
| [83] |
Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein[J]. Science, 2002, 295(5561): 1852-1858. DOI:10.1126/science.1068408 |
| [84] |
De Marco A, Deuerling E, Mogk A, Tomoyasu T, Bukau B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli[J]. BMC Biotechnology, 2007, 7: 32. DOI:10.1186/1472-6750-7-32 |
| [85] |
Yao D, Fan J, Han RZ, Xiao J, Li Q, Xu GC, Dong JJ, Ni Y. Enhancing soluble expression of sucrose phosphorylase in Escherichia coli by molecular chaperones[J]. Protein Expression and Purification, 2020, 169: 105571. DOI:10.1016/j.pep.2020.105571 |
| [86] |
Zhong C, Wei P, Zhang YHP. Enhancing functional expression of codon-optimized heterologous enzymes in Escherichia coli BL21(DE3) by selective introduction of synonymous rare codons[J]. Biotechnology and Bioengineering, 2017, 114(5): 1054-1064. DOI:10.1002/bit.26238 |
| [87] |
Aerts D, Verhaeghe T, De Mey M, Desmet T, Soetaert W. A constitutive expression system for high-throughput screening[J]. Engineering in Life Sciences, 2011, 11(1): 10-19. DOI:10.1002/elsc.201000065 |
 2021, Vol. 48
2021, Vol. 48