扩展功能
文章信息
- 吕丽丽, 梅飞, 曹守林, 郭佳静, 李槿年
- Lü Lili, MEI Fei, CAO Shoulin, GUO Jiajing, LI Jinnian
- 加州鲈源鰤鱼诺卡氏菌的分离鉴定及致病性
- Isolation, identification and pathogenicity of Nocardia seriolae from Micropterus salmoides
- 微生物学通报, 2021, 48(12): 4765-4775
- Microbiology China, 2021, 48(12): 4765-4775
- DOI: 10.13344/j.microbiol.china.210538
-
文章历史
- 收稿日期: 2021-06-15
- 接受日期: 2021-07-15
- 网络首发日期: 2021-08-10
加州鲈(Micropterus salmoides)学名大口黑鲈,是一种具有重要经济价值的淡水鱼类[1]。自20世纪80年代引进我国以来,加州鲈养殖业迅速发展。据统计,2019年我国加州鲈养殖总产量近50万t。然而,随着人工养殖规模的不断扩大,养殖集约化程度不断提高,加州鲈病害频繁发生已成为制约水产养殖业健康发展的瓶颈。
鰤鱼诺卡氏菌(Nocardia seriolae)隶属于诺卡氏菌科(Nocardiaceae)诺卡氏菌属(Nocardia),为革兰氏阳性、兼性胞内寄生菌[2]。该菌也是鱼类养殖生产中常见的病原菌,可引起以体表溃疡、出血及组织器官形成结节为特征的多种鱼类慢性肉芽肿疾病[3-6]。其中,加州鲈诺卡氏菌病(Nocardiosis)在国内首先发生在广东省[7]。随后,四川、湖北、安徽等地养殖的加州鲈中均有该病流行[8-9]。由于加州鲈诺卡氏菌病的潜伏期长、发病率高、病情发展缓慢且无特效的治疗药物,常导致患病鱼大批死亡,给加州鲈养殖业造成了巨大的经济损失。因此,加强加州鲈鰤鱼诺卡氏菌病的防治研究显得十分必要。
2020年5月,安徽省临泉县某养殖场加州鲈陆续发病,眼观症状为体表出血、溃疡,而且内脏器官和肌肉表面散在大小与数量不等的白色结节,死亡率达40%以上,疑似为诺卡氏菌病。本文从患病加州鲈体内分离病原,获得一株优势细菌(命名为NI),经鉴定为鰤鱼诺卡氏菌。进一步通过检测分离菌株NI的毒力基因、测定其对加州鲈的半数致死量、检查感染后加州鲈的组织病理学变化及组织载菌量,确定其致病性,以期为加州鲈鰤鱼诺卡氏菌病的防治提供科学依据。
1 材料与方法 1.1 菌株和质粒大肠杆菌DH5α感受态细胞购自北京天根生化科技有限公司;鰤鱼诺卡氏菌菌株JCM3360和杀鲑诺卡氏菌(Nocardia salmonicida)菌株173685购自中国普通微生物菌种保藏管理中心;克隆质粒pMD19-T Simple购自TaKaRa公司。
1.2 实验动物健康加州鲈鱼(体质量30-40 g,体长15-18 cm),购自安徽省望江县某养殖渔场。
1.3 主要试剂和仪器SGExcel UltraSYBR Mixture (With ROX)、SanPrep柱式DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;T4 DNA连接酶,TaKaRa公司;2×Taq PCR MasterMix、DNA Marker、细菌基因组DNA提取试剂盒和质粒抽提试剂盒,北京天根生化科技有限公司;LB、TSB培养基及细菌微量生化鉴定管,杭州微生物试剂有限公司;通用型组织固定液,武汉赛维尔生物科技有限公司。
Thermal Cycler PCR仪,Bio-Rad公司;实时荧光定量PCR仪,罗氏公司;全自动凝胶成像分析系统,上海培清科技有限公司;电泳仪,北京六一生物科技有限公司;生化培养箱,上海一恒科学仪器有限公司;医用低温保存箱,海尔特种电器有限公司;透射电子显微镜,日立公司;细菌浊度计,上海昕瑞仪器仪表有限公司。
1.4 病鱼解剖与细菌分离培养患病鱼经体表消毒后,无菌操作剖检鱼体,观察体表与脏器病变情况。取肝脏结节病灶接种于TSB培养基,28 ℃培养至长出菌落。挑取菌落转接TSB培养基纯化细菌,纯化后的菌株命名为分离菌株NI。
1.5 分离菌株NI的鉴定 1.5.1 形态学检查将分离菌株NI接种于含0.05%吐温与玻璃珠的TSB液体培养基,28 ℃、130 r/min振荡培养3 d。取菌液涂片/滴加在铜网上,经革兰氏染色/磷钨酸负染后,在光镜及透射电镜下观察该分离菌株的形态、大小、排列方式、染色特性和结构。
1.5.2 生理生化特性测定将分离菌株NI与鰤鱼诺卡氏菌菌株JCM3360分别接种TSB培养基,28 ℃培养至长出菌落。挑取新鲜菌落分别接种16种细菌微量生化鉴定管,28 ℃培养3-5 d,测定并比较它们的生理生化特性。
1.5.3 16S rRNA基因的PCR扩增与序列分析委托通用生物系统(安徽)有限公司合成细菌16S rRNA基因通用引物(表 1)。使用细菌基因组DNA提取试剂盒提取分离菌株NI的基因组DNA作为模板。PCR反应体系(30 μL):2×Taq PCR MasterMix 15 μL,上、下游引物(10 μmol/L)各1.5 μL,DNA模板1.5 μL,ddH2O补足30 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳检测有目的基因条带后,委托上述生物公司对PCR产物进行纯化与序列测定。
| Gene name | Primers name | Primers sequence (5′→3′) | Annealing temperature (℃) | Size (bp) | References |
| 16S rRNA | 16S rRNA-F | AGAGTTTGATCCTGGCTCAG | 54 | 1 500 | [10] |
| 16S rRNA-R | TACGGCTACCTTGTTACGACTT | ||||
| gntR | gntR-F | CCTGCACATGGCCTCGTTCT | 59 | 249 | Designed by the researcher |
| gntR-R | AGCGACTGGGTGAGTTCCTG | ||||
| gapA | gapA-F | GTGACTGTCCGGGTAGGGAT | 65 | 987 | Designed by the researcher |
| gapA-R | TTAGGCGAGACGGTTGGAGTAGC | ||||
| ibeA | ibeA-F | ATGGGGGTGTTCTGTGGCATG | 65 | 1 194 | Designed by the researcher |
| ibeA-R | TCAGATCCGGTACCAGGTCGATT | ||||
| mip | mip-F | ATGAGCAGCAAGCCGG | 52 | 363 | Designed by the researcher |
| mip-R | CGACCTGCAGGACTTGACT |
将测得的序列提交GenBank进行BLAST检索,选取相似性较高的10条参考菌株序列,利用MEGA 6.0软件构建基于细菌16S rRNA基因的系统进化树,分析分离菌株NI与参考菌株间的亲缘关系。
1.5.4 鰤鱼诺卡氏菌的特异性PCR检测转录调控因子GntR在细菌中广泛分布[11]。根据GenBank中收录的鰤鱼诺卡氏菌转录调控因子GntR的基因序列(NZ_AP017900),利用Primer 6.0软件在GntR的效应子结合域/寡聚化结构域设计特异性引物(具体信息见表 1)。以分离菌株NI的基因组DNA为模板,参照1.5.3反应体系与表 1中退火温度,PCR扩增GntR的基因片段,用1.5%琼脂糖凝胶电泳检测PCR产物。试验中同时设置了鰤鱼诺卡氏菌菌株JCM3360阳性对照和杀鲑诺卡氏菌菌株173685阴性对照。
1.6 鰤鱼诺卡氏菌分离菌株NI的毒力基因检测黏附素甘油醛-3-磷酸脱氢酶、侵袭素IbeA蛋白和巨噬细胞感染增强因子Mip蛋白是多种病原菌的重要毒力因子[12-14]。根据GenBank中收录的鰤鱼诺卡氏菌全基因组数据,获得黏附素甘油醛-3-磷酸脱氢酶(CP017839.1,gapA)、侵袭素IbeA蛋白(AP017900.1,ibeA)和巨噬细胞感染增强因子Mip (CP059737.1,mip)的基因序列,并以此设计3对特异性引物(具体信息见表 1)。以分离菌株NI基因组DNA为模板,参照1.5.3反应体系与表 1中退火温度,PCR检测该分离菌株是否携带这些毒力基因。试验中同时设置了鰤鱼诺卡氏菌菌株JCM3360阳性对照和杀鲑诺卡氏菌菌株173685阴性对照。
1.7 分离菌株NI的致病性分析 1.7.1 实验鱼的饲养60尾(体质量30-40 g,体长15-18 cm)健康加州鲈在循环水系统中适应性饲养,一周后随机取3尾实验鱼进行细菌培养,确定其无细菌感染后方可进行试验。在适应性饲养期间,水温为26 ℃左右,连续充氧,每日换1/3-1/2水,早晚饲喂加州鲈鱼膨化饲料(浙江东裕生物科技有限公司),饲喂量为鱼总体重的6%。
1.7.2 分离菌株NI对加州鲈的LD50测定将实验用加州鲈随机分为5组,每组10尾。1-4组分别腹腔注射浓度为5.00×108、6.25×107、7.80×106和9.75×105 CFU/mL的NI菌液,注射量为0.2 mL/尾;第5组腹腔注射等体积的无菌生理盐水。注射后各组实验鱼放入不同鱼缸中继续饲养,观察14 d内实验鱼的发病死亡情况,取死亡鱼组织再次分离细菌,并采用Reed-Muench法[15]计算分离菌株NI对加州鲈的半数致死量LD50。
1.7.3 显微组织病理学检查随机取健康加州鲈10尾分成2组,即5尾/组,一组腹腔注射浓度为5×108 CFU/mL (0.2 mL/尾)的NI菌液,另一组腹腔注射等体积无菌生理盐水作为对照。感染后第5天对濒死实验鱼进行解剖,无菌条件下取肝脏、脾脏、头肾、心脏、胃、肠和肌肉组织,同时采集对照组健康鱼的相应组织。同一组织病料等分为2份,一份样品置于通用型组织固定液中固定,委托武汉赛维尔生物(合肥)科技有限公司做组织病理切片,光学显微镜下观察组织病理学变化并拍照;另一份样品用于组织载菌量检测。
1.7.4 组织载菌量检测以鰤鱼诺卡氏菌GntR基因片段为检测靶点,建立SYBR GreenⅠ荧光定量PCR (Quantitative PCR,qPCR)检测方法。主要步骤是:参照1.5.4方法PCR扩增GntR基因片段并克隆至pMD19-T构建重组克隆质粒pMD19-T-GntR,提取pMD19-T-GntR作为阳性标准品进行qPCR,建立GntR基因片段的标准曲线,推导其线性回归方程。qPCR反应体系:2×SGExcel UltraSYBR Mixture 10 μL,pMD19-T-GntR 1 μL,上、下游引物(1 μmol/L)各1 μL,ddH2O 7 μL。qPCR反应条件:95 ℃ 3 min;95 ℃ 15 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。
称取感染后组织样品40 mg,用组织DNA提取试剂盒提取组织样品的基因组DNA (包含细菌DNA)作为模板进行qPCR检测,每个样品做3个平行,根据线性回归方程计算各检测组织中的载菌量。另外,将各组织匀浆液接种TSB培养基,再次分离细菌。
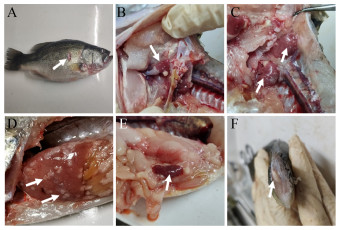
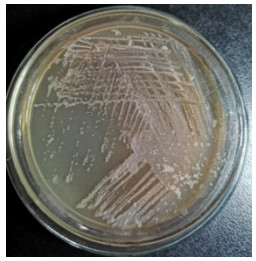
2 结果与分析 2.1 病鱼的剖检变化与细菌的分离培养患病加州鲈体表出血、溃疡,眼观病变为心脏、头肾、肝脏、脾脏和肌肉表面散在大小与数量不等的白色结节(图 1)。取肝脏结节病灶接种TSB培养基,28 ℃培养4 d后分离到几乎接近纯培养的白色或淡黄色、表面粗糙、边缘不齐、难以挑起的菜花样菌落(图 2),经纯化后命名为分离菌株NI。
|
| 图 1 患病加州鲈的外观与剖检变化 Figure 1 Changes of body surface and autopsy in diseased Micropterus salmoides 注:箭头分别指示体表出血、溃烂(A)以及心脏(B)、头肾(C)、肝脏(D)、脾脏(E)和肌肉表面(F)的白色结节 Note: Arrows indicate bleeding and ulceration on the body surface (A), and white nodules on the heart (B), head kidney (C), liver (D), spleen (E) and muscle surface (F), respectively |
|
|
|
| 图 2 分离菌株在TSB培养基上形成的菌落特征 Figure 2 Colony characteristics of isolated strain on TSB medium |
|
|
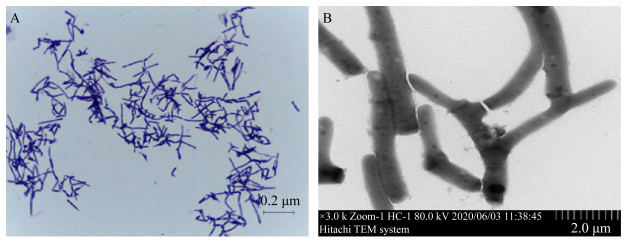
如图 3所示,光学显微镜下观察到分离菌株NI为革兰氏阳性杆菌,有的呈分枝状。透射电镜下呈长杆状或分枝状,两端钝圆,菌体大小约为(0.6-0.8) μm×(4.0-6.8) μm,无鞭毛、菌毛、荚膜和芽孢特殊结构。生理生化试验结果显示,分离菌株NI的生理生化特性与鰤鱼诺卡氏菌菌株JCM3360一致,表现为能分解D-葡萄糖与水解七叶苷,枸橼酸盐利用试验和过氧化氢酶试验均阳性,硝酸盐还原试验阴性,不分解乳糖、麦芽糖、甘露醇、蔗糖、果糖、L-阿拉伯糖、鼠李糖、山梨醇和尿素,不液化明胶,不水解淀粉(表 2)。
|
| 图 3 分离菌株NI的形态、染色特性及结构 Figure 3 Morphology, dyeing characteristics and structure of the isolated strain NI 注:A:光学显微镜下照片(100×);B:透射电镜下照片(3 000×) Note: A: Micrograph under optical microscope (100×); B: Micrograph under transmission electron microscope (3 000×) |
|
|
| Item | NI isolate | JCM3360 N.seriolae JCM3360 |
| D-glucose | + | + |
| Lactose | – | – |
| Maltose | – | – |
| Mannitol | – | – |
| Sucrose | – | – |
| Fructose | – | – |
| Rhamnose | – | – |
| Arabinose | – | – |
| Sorbitol | – | – |
| Aesculin | + | + |
| Citrate | + | + |
| Gelatin | – | – |
| Starch | – | – |
| Urea | – | – |
| Catalase | + | + |
| Nitrate reduction | – | – |
| 注:+:阳性结果;–:阴性结果 Note: +: Positive result; –: Negative result |
||
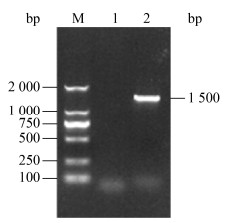
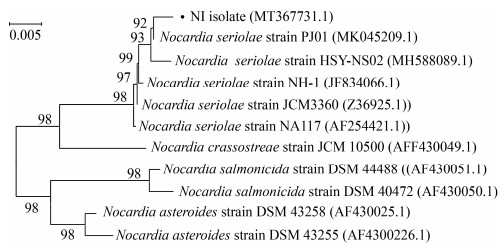
分离菌株NI的16S rRNA基因PCR扩增结果如图 4所示,在1 500 bp左右出现单一DNA条带。测序结果显示该DNA条带长度为1 416 bp(GenBank登录号为MT367731.1)。选取相似性较高的10条参考菌株16S rRNA基因序列构建系统进化树。结果如图 5所示,分离菌株NI与加州鲈源鰤鱼诺卡氏菌参考株PJ01自然聚为一支(置信度为92%),亲缘关系最近,序列相似性高达99.9%。
|
| 图 4 分离菌株NI的16S rRNA基因的PCR扩增 Figure 4 PCR amplification for 16S rRNA gene of the isolated strain NI M:DL2000 DNA Marker;1:未加模板的阴性对照;2:NI分离株 M: DL2000 DNA Marker; 1: Negative control without template; 2: Isolated strain NI |
|
|
|
| 图 5 基于16S rRNA基因序列的分离菌株NI与诺卡氏菌参考株系统进化树 Figure 5 Phylogenetic tree of the isolated strain NI and Nocardia reference strains based on 16S rRNA gene sequence 注:括号内数字代表各菌株在GenBank中的登录号;比例尺“0.005”代表遗传距离的单位;每一分支上的数字表示1 000次重复抽样检测的自举分析置信度值 Note: Numbers in parentheses represent the sequences accession number of each strain in GenBank; Scale "0.005" represents the unit of genetic distance; The number at each branch points represents the bootstrap confidence value of the 1 000 repeated sampling test |
|
|
用鰤鱼诺卡氏菌的GntR基因特异性引物分别对分离菌株NI、鰤鱼诺卡氏菌菌株JCM3360和杀鲑诺卡氏菌菌株173685进行PCR检测,1.5%琼脂糖凝胶电泳结果显示,从分离菌株和鰤鱼诺卡氏菌菌株JCM3360中均扩增出一条与预期大小(249 bp)相符的DNA条带,而从杀鲑诺卡氏菌菌株173685中未扩增到相应条带(图 6)。

|
| 图 6 分离菌株NI的GntR基因片段的PCR扩增 Figure 6 PCR amplification for GntR gene segment of the isolated strain NI M:DL2000 DNA Marker;1:杀鲑诺卡氏菌菌株173685阴性对照;2:鰤鱼诺卡氏菌菌株JCM3360阳性对照;3:NI分离株 M: DL2000 DNA Marker; 1: Negative control of N. salmonicida strain 173685; 2: Positive control of N. seriolae strain JCM3360; 3: Isolated strain NI |
|
|
综合上述表型与分子生物学鉴定结果,确定分离菌株NI为鰤鱼诺卡氏菌。
2.5 分离菌株NI的毒力基因检测结果PCR检测结果显示,从分离菌株NI和鰤鱼诺卡氏菌菌株JCM3360基因组DNA中扩增到gapA、ibeA和mip基因(图 7),表明该分离株携带这3种重要毒力基因。

|
| 图 7 分离菌株NI毒力基因的PCR检测 Figure 7 Virulence genes of the isolated strain NI detected by PCR 注:A:GapA的基因片段;B:IbeA的基因片段;C:Mip的基因片段。M:DL2000或DL600 DNA Marker;1:杀鲑诺卡氏菌菌株173685阴性对照;2:鰤鱼诺卡氏菌菌株JCM3360阳性对照;3:NI分离株 Note: A: gapA segment; B: ibeA segment; C: mip segment. M: DL2000 or DL600 DNA Marker; 1: Negative control of N. salmonicida strain 173685; 2: Positive control of N. seriolae strain JCM3360; 3: Isolated strain NI |
|
|
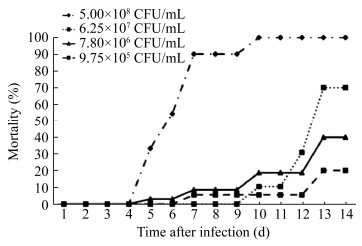
以不同浓度的分离株菌液回归感染加州鲈鱼,4 d后各感染组实验鱼陆续发病并表现出与自然病例相似的症状和眼观病变(图 1),并且从结节病灶中再次分离到相同的细菌,而对照组实验鱼未见发病与死亡现象,说明分离菌株NI是引起此次加州鲈结节病的病原菌。如图 8与表 3所示,5.00×108 CFU/mL菌液浓度组实验鱼在感染10 d内全部死亡;6.25×107 CFU/mL菌液浓度组实验鱼在感染14 d后不再死亡,累计死亡率为81.25%;7.80×106 CFU/mL和9.75×105 CFU/mL菌液浓度组实验鱼在14 d内累计死亡率分别为40.00%和10.53%。按Reed-Muench法计算出该分离株对加州鲈的LD50为1.29×107 CFU/mL或2.58×106 CFU/尾。
|
| 图 8 基于不同浓度的分离菌株NI菌液感染加州鲈的死亡曲线 Figure 8 Death curves of Micropterus salmoides infected with the isolated strain NI at different concentration |
|
|
| Group No. | Concentration (CFU/mL) | Dose (mL) | Number of fish used | Cumulative results | ||
| Survive number | Death number | Mortality (%) | ||||
| 1 | 5.00×108 | 0.20 | 10 | 0 | 23 | 100.00 |
| 2 | 6.25×107 | 0.20 | 10 | 3 | 13 | 81.25 |
| 3 | 7.80×106 | 0.20 | 10 | 9 | 6 | 40.00 |
| 4 | 9.75×105 | 0.20 | 10 | 17 | 2 | 10.53 |
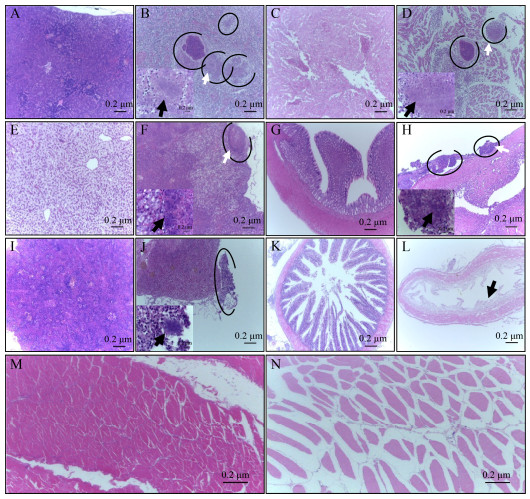
分离菌株NI人工感染加州鲈5 d后,其组织病理学变化主要表现为头肾、心脏、肝脏、胃和脾脏均发生不同程度的肉芽肿结节病变,其中头肾中肉芽肿结节数量最多,而且油镜下可观察到肉芽肿内有蓝染的鰤鱼诺卡氏菌或菌团、坏死细胞和钙盐沉着;同时肠管肌层疏松、肠绒毛脱落,肌肉组织中肌纤维疏松、间隙增宽(图 9)。
|
| 图 9 分离菌株NI感染加州鲈的组织病理学变化(H & E染色) Figure 9 Histopathological changes of Micropterus salmoides infected with the isolated strain NI (H & E staining) 注:A、C、E、G、I、K和M为正常的头肾、心、肝、胃、脾、肠和肌肉组织(10×);B、D、F、H和J:感染后头肾、心、肝、胃和脾组织中出现肉芽肿(10×,圆圈),白色箭头部分进一步放大后在肉芽肿坏死灶内可见丝状细菌或菌团(100×,黑色箭头);L:感染后肠组织中肌层疏松、部分肠绒毛脱落(10×,黑色箭头);N:感染后肌肉组织中肌纤维疏松、间隙增宽(10×) Note: A, C, E, G, I, K and M represent normal head kidney, heart, liver, stomach, spleen, intestine and muscle, respectively (10×); B, D, F, H and J represent granulomas (10×, round) found in the head kidney, heart, liver, stomach and spleen after infection, respectively, filamentous bacteria or bacterial clusters (100×, black arrow) are observed in granulomatous necrosis after further enlargement of the white arrow section; L: Loose muscle layer of intestine and partial abscission of intestinal villi (10×, black arrow) after infection; N: Loose muscle fiber and widened gap in muscle tissue after infection (10×) |
|
|
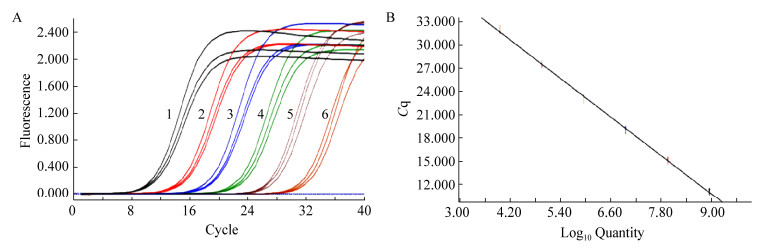
用鰤鱼诺卡氏菌GntR的基因特异性引物,以10倍比系列稀释的pMD19-T-GntR为模板进行qPCR。结果如图 10所示,扩增曲线呈“S”型,拐点清楚、指数期明显,而且各个稀释度间平行性好。标准曲线在8.98×103-8.98×108拷贝范围内呈现良好线性关系,推导出的线性回归方程为y=-4.180 9x+48.23,相关系数R2为1.00。
|
| 图 10 基于重组质粒pMD19-T-GntR的qPCR扩增曲线与标准曲线 Figure 10 Amplification and standard curve of qPCR based on the recombinant plasmid pMD19-T-GntR 注:A:扩增曲线;B:标准曲线。1-6:从8.98×108到8.98×103拷贝/μL稀释的重组质粒 Note: A: Amplification curve; B: Standard curve. 1-6: pMD19-T-GntR diluted from 8.98×108 to 8.98×103 copies/μL |
|
|
人工感染5 d后采集濒死鱼不同组织,用建立的qPCR方法检测组织中细菌载量。结果如图 11所示,在被检测组织内均有分离菌株NI存在,其中头肾中载菌量最高,达到(54.82±0.93)×102拷贝/mg,极显著高于其他各检测组织(P < 0.01)。其次为心脏与肝脏组织,分别为(42.72±1.95)×102拷贝/mg和(41.35±2.48)×102拷贝/mg,两者间无显著差异,但显著或极显著高于胃、脾、肠和肌肉组织(P < 0.05或P < 0.01)。胃、脾、肠和肌肉组织中载菌量依次递减为(35.54±1.10)×102、(20.77±1.17)×102、(16.26±1.49)×102和(4.06±0.23)×102拷贝/mg,而且相互之间也有显著或极显著差异(P < 0.05或P < 0.01)。同时,也从组织匀浆中分离到人工感染菌。结果表明,鰤鱼诺卡氏菌分离菌株NI可在不同组织中广泛定殖。
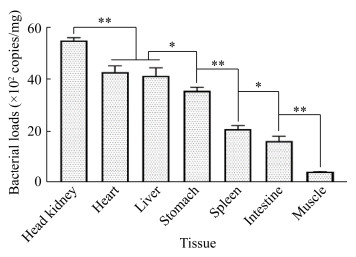
|
| 图 11 分离菌株NI感染5 d后加州鲈不同组织中的载菌量 Figure 11 Bacterial loads in different tissues of Micropterus salmoides at 5 days post-injection with the isolated strain NI 注:星号代表不同组织间载菌量的显著(*)或极显著(**)差异 Note: Asterisks represent significant (*) or extremely significant (**) differences in bacterial load among different tissues |
|
|
鉴定细菌常用的方法是在检查细菌表型特征的基础上再进行细菌16S rRNA基因序列分析,但是对于一些亲缘关系较近的不同菌种而言,由于种间16S rRNA基因序列相似度较高,常造成其在“种”水平上的鉴定结果准确性不高。目前已知能引起水产动物诺卡氏菌病的病原包括鰤鱼诺卡氏菌(Nocardia seriolae)、星状诺卡氏菌(N. asteroids)、粗形诺卡氏菌(N. crassostreae)和杀鲑诺卡氏菌(N. salmonicida) 4个种[16]。李路茜等[17]报道诺卡氏菌16S rRNA基因的种内与种间序列相似度非常接近,分别为99.1%-100.0%和95.7%-98.8%。对此,本研究在对NI分离株进行表型鉴定与16S rRNA基因序列分析的基础上,进一步比对分析4种鱼源诺卡氏菌的全基因组数据,发现转录调控因子GntR的效应子结合域/寡聚化结构域编码基因片段在鱼源诺卡氏菌种间差异大、种内高度保守;进而利用Primer 6.0软件在该基因的效应子结合域/寡聚化结构域设计特异性引物,进行鰤鱼诺卡氏菌特异性PCR检测并获得阳性结果,从而将引起加州鲈结节病的NI分离株准确鉴定为鰤鱼诺卡氏菌。
为了明确鰤鱼诺卡氏菌NI分离株的致病性,本文从毒力基因检测、LD50测定、组织病理学检查和组织载菌量检测4个方面加以探究。夏立群等[18]报道鰤鱼诺卡氏菌分离株ZJ0503对斑马鱼的LD50为3.39×106 CFU/尾;王文基等[19]的研究结果显示鰤鱼诺卡氏菌对乌斑杂交鳢的LD50为1.52×105 CFU/尾。本研究中NI分离株对加州鲈的LD50为2.58×106 CFU/尾,而且同时携带gapA、ibeA和mip这3种重要毒力基因,结果表明不同种鱼类之间抵抗不同鰤鱼诺卡氏菌分离株入侵的能力不同,造成LD50测定结果的差异。
NI分离株人工回归感染后可引起加州鲈头肾、心脏、肝脏、胃和脾脏出现慢性肉芽肿结节,而且结节内含有细菌团,这些病理组织学变化与雷雪平等[8]、何晟毓等[9]、王文基等[19]的研究结果相似。肉芽肿结节为鰤鱼诺卡氏菌与宿主细胞之间相互作用所致的特征性结构,其形成过程是侵入体内的鰤鱼诺卡氏菌通过黏附素(如甘油醛-3-磷酸脱氢酶)黏附巨噬细胞表面,进而借助侵袭素(如IbeA)侵入巨噬细胞,并在巨噬细胞感染增强因子Mip作用下使其于巨噬细胞内大量增殖,导致巨噬细胞聚集、死亡和肉芽肿结节的形成。已有文献报道巨噬细胞和活化的T细胞持续性产生炎性因子,趋化未吞噬细菌的巨噬细胞、单核细胞和淋巴细胞不断聚集到病变部位,也参与肉芽肿形成过程[20]。本研究进一步采用qPCR检测NI分离株在组织中的载菌量,发现被检测组织中均有NI分离株存在,表明鰤诺卡氏菌可以在不同组织内广泛定殖,其中头肾组织中的载菌量最高,这与头肾中肉芽肿结节数量最多、病变最严重是一致的,也提示头肾是鰤诺卡氏菌侵染的最适靶组织。
本研究明确鰤鱼诺卡氏菌NI分离株是此次安徽省某养殖场加州鲈结节病的病原菌,从毒力基因检测、LD50测定、组织病理学检查和组织载菌量检测4个方面探明该分离株具有较强致病性,但其致病机制还需要进一步研究。
| [1] |
Brown TG, Runciman B, Pollard S, Grant ADA. Biological synopsis of largemouth bass (Micropterus salmoides)[J]. Canadian Manuscript Report of Fisheries and Aquatic Sciences, 2009, 2884: 1-27. |
| [2] |
Brown-Elliott BA, Brown JM, Conville PS, Wallace RJ. Clinical and laboratory features of the Nocardia spp. based on current molecular taxonomy[J]. Clinical Microbiology Reviews, 2006, 19(2): 259-282. DOI:10.1128/CMR.19.2.259-282.2006 |
| [3] |
Wang F, Wang XG, Liu C, Chang OQ, Feng YY, Jiang L, Li KB. Nocardia seriolae infection in cultured jade perch, Scortum barcoo[J]. Aquaculture International, 2017, 25(6): 2201-2212. DOI:10.1007/s10499-017-0184-4 |
| [4] |
Vu-Khac H, Duong VQ, Chen SC, Pham TH, Nguyen TT, Trinh TT. Isolation and genetic characterization of Nocardia seriolae from snubnose pompano Trachinotus blochii in Vietnam[J]. Diseases of Aquatic Organisms, 2016, 120(2): 173-177. DOI:10.3354/dao03023 |
| [5] |
Kim JD, Lee NS, Do JW, Kim MS, Seo HG, Cho M, Jung SH, Han HJ. Nocardia seriolae infection in the cultured eel Anguilla japonica in Korea[J]. Journal of Fish Diseases, 2018, 41(11): 1745-1750. DOI:10.1111/jfd.12881 |
| [6] |
Liao PC, Tsai MA, See MS, Wang PC, Chen SC. Isolation and characterization of Nocardia seriolae, a causative agent of systematic granuloma in cultured East Asian four finger threadfin, Eleutheronema rhadinum, and red snapper, Lutjanus erythropterus[J]. Aquaculture Research, 2020, 52(2): 763-770. |
| [7] |
Jiang YY, Li YW, Zhou SM, Li AX. Isolation and identification of Nocardia, a pathogen of nocardiosis in largemouth bass, Micropterus salmoides[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni: Natural Science, 2012, 51(1): 76-81. (in Chinese) 蒋依依, 李言伟, 周素明, 李安兴. 加州鲈诺卡菌病病原的分离与鉴定[J]. 中山大学学报(自然科学版), 2012, 51(1): 76-81. |
| [8] |
Lei XP, Geng Y, Zhao RX, Bai MH, Qin ZY, Ouyang P, Huang XL, Chen DF. Isolation and identification of Nocardia seriolae from large-mouth bass (Micropterus salmoides) and pathological lesions of its infection[J]. Journal of Yunnan Agricultural University: Natural Science, 2020, 35(4): 635-642. (in Chinese) 雷雪平, 耿毅, 赵若璇, 白明焕, 秦振阳, 欧阳萍, 黄小丽, 陈德芳. 大口黑鲈鰤诺卡菌的分离鉴定及其感染的病理损伤研究[J]. 云南农业大学学报(自然科学), 2020, 35(4): 635-642. |
| [9] |
He SY, Wei WY, Liu T, Yang Q, Xie H, He QY, Wang KY. Isolation, identification and histopathological study on lethal sarcoidosis of Micropterus salmoides[J]. Journal of Fisheries of China, 2020, 44(2): 253-265. (in Chinese) 何晟毓, 魏文燕, 刘韬, 杨倩, 谢恒, 何琦瑶, 汪开毓. 大口黑鲈致死性结节病病原的分离、鉴定及组织病理学观察[J]. 水产学报, 2020, 44(2): 253-265. |
| [10] |
Edwards U, Rogall T, Blöcker H, Emde M, Böttger EC. Isolation and direct complete nucleotide determination of entire genes: characterization of a gene coding for 16S ribosomal RNA[J]. Nucleic Acids Research, 1989, 17(19): 7843-7853. DOI:10.1093/nar/17.19.7843 |
| [11] |
Liu GF, Wang XX, Su HZ, Lu GT. Progress on the GntR family transcription regulators in bacteria[J]. Hereditas, 2021, 43(1): 66-73. (in Chinese) 刘国芳, 王欣欣, 苏辉昭, 陆光涛. 细菌GntR家族转录调控因子的研究进展[J]. 遗传, 2021, 43(1): 66-73. |
| [12] |
Ho PY, Chen YC, Maekawa S, Hu HH, Tsai AW, Chang YF, Wang PC, Chen SC. Efficacy of recombinant protein vaccines for protection against Nocardia seriolae infection in the largemouth bass Micropterus salmoides[J]. Fish and Shellfish Immunology, 2018, 78(7): 35-41. |
| [13] |
Cieza RJ, Hu J, Ross BN, Sbrana E, Torres AG. The IbeA invasin of adherent-invasive Escherichia coli mediates interaction with intestinal epithelia and macrophages[J]. Infection and Immunity, 2015, 83(5): 1904-1918. DOI:10.1128/IAI.03003-14 |
| [14] |
Cianciotto NP, Fields BS. Legionella pneumophila mip gene potentiates intracellular infection of protozoa and human macrophages[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(11): 5188-5191. DOI:10.1073/pnas.89.11.5188 |
| [15] |
Reed LJ, Muench H. A simple method of estimating fifty per cent endpoints[J]. American Journal of Epidemiology, 1938, 27(3): 493-497. DOI:10.1093/oxfordjournals.aje.a118408 |
| [16] |
Maekawa S, Yoshida T, Wang PC, Chen SC. Current knowledge of nocardiosis in teleost fish[J]. Journal of Fish Diseases, 2018, 41(3): 413-419. DOI:10.1111/jfd.12782 |
| [17] |
Li LX, Zhang YY, Liu HC, Tan XL, Li ZJ, Lou YL. Evaluation of 16S rDNA sequence method in identification of Nocardia species[J]. Chinese Journal of Zoonoses, 2015, 31(11): 1017-1022. (in Chinese) 李路茜, 张媛媛, 刘海灿, 谭晓罗, 李振军, 楼永良. 16S rDNA序列在诺卡菌菌种鉴定中的价值研究[J]. 中国人兽共患病学报, 2015, 31(11): 1017-1022. DOI:10.3969/j.issn.1002-2694.2015.11.006 |
| [18] |
Xia LQ, Wang M, Lai JB, Chen RM, Xu L, Lu YS. Establishment of a zebrafish model for Nocardia seriolae and histopathological study[J]. Journal of Tropical Biology, 2016, 7(4): 409-416. 夏立群, 汪美, 赖杰彬, 陈锐敏, 徐亮, 鲁义善. 鰤鱼诺卡氏菌感染斑马鱼模型的建立与组织病理学研究[J]. 热带生物学报, 2016, 7(4): 409-416. |
| [19] |
Wang WJ, Chen JL, Hou SY, Lu YS, Xia LQ. A histopathological study of Nocardia seriolae infection in hybrid snakehead[J]. Genomics and applied Biology, 2019, 38(10): 4439-4446. (in Chinese) 王文基, 陈建林, 侯素莹, 鲁义善, 夏立群. 鰤鱼诺卡氏菌感染乌斑杂交鳢的组织病理学研究[J]. 基因组学与应用生物学, 2019, 38(10): 4439-4446. |
| [20] |
Man QM. Studies on pathogenic mechanism of Nocardia seriolae[D]. Shanghai: Shanghai Ocean University, 2013 (in Chinese) 满其蒙. 鰤鱼诺卡氏菌致病机制的研究[D]. 上海: 上海海洋大学, 2013 |
 2021, Vol. 48
2021, Vol. 48




