扩展功能
文章信息
- 周亚男, 韩小斌, 魏可可, 芶剑渝, 王先勃, 张成省, 郑艳芬
- ZHOU Yanan, HAN Xiaobin, WEI Keke, GOU Jianyu, WANG Xianbo, ZHANG Chengsheng, ZHENG Yanfen
- 烟草根际可培养微生物多样性及防病促生菌的筛选
- The culturable microbial diversity in tobacco rhizosphere and their plant growth-promoting and biocontrol properties
- 微生物学通报, 2021, 48(12): 4649-4663
- Microbiology China, 2021, 48(12): 4649-4663
- DOI: 10.13344/j.microbiol.china.210398
-
文章历史
- 收稿日期: 2021-05-07
- 接受日期: 2021-07-02
- 网络首发日期: 2021-08-18
2. 贵州省烟草公司遵义市公司 贵州 遵义 563000
2. Zunyi Branch of Guizhou Tobacco Company, Zunyi, Guizhou 563000, China
烟草是我国重要的经济作物之一,由于长期使用农药化肥及单作种植等因素,致使植烟土壤结构变差,土传病害时有发生,烟叶品质和产量持续下降。近年来,微生物制剂被认为是一种绿色农业投入品,是提升植物产量和防控植物病害的有效途径[1]。
根际微生物在促进植物营养吸收和维持植物健康中发挥着关键作用[2-4],对作物的生长和产量具有重要的科学和农艺价值[5]。生活在植物根际或根表并能够促进植物生长的一类微生物被称为植物根际促生菌(Plant Growth-Promoting Rhizobacteria,PGPR)[6]。它们的作用方式分为直接作用或间接作用,直接作用途径包括:(1) 产生1-氨基环丙烷-1-羧酸(1-Aminocyclopropane-1-Carboxylate,ACC)脱氨酶,将乙烯前体ACC进行转化,降低植物根系中的乙烯水平,从而促进根系生长;(2) 产生吲哚-3-乙酸(Indole-3-Acetic Acid,IAA)等植物激素,促进植物生长;(3) 通过溶磷、固氮、解钾和产生铁载体等作用,为植物提供可利用的营养元素,促进植物营养吸收[7]。间接作用途径包括通过产生抗菌物质、诱导植物产生系统抗性以及与病原菌竞争营养物质和生态位而降低植物的发病几率[8]。
研究表明,根际微生物在特定环境下能够产生“根际效应”,为根际微生物提供丰富的碳源和能量,从而提高根际微生物数量、活性和多样性,增强植物在不利环境下的适应性[9]。近年来已有很多学者通过扩增子测序等免培养技术,对不同健康状况的烟草根际微生物组进行了研究,发现健康烟草根际富含大量有益微生物,如假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和固氮螺菌属(Azospirillum)等[10-12]。然而这种免培养技术虽然能提供大量菌种信息,却无法了解根际微生物的活性特征和功能,而传统的培养技术能使我们全面认识微生物的特性及其在防病促生中的作用,也是烟草病害绿色防控和微生物制剂开发的资源基础。
本研究对遵义烟区4个常年不发病田块(抑病土壤)的烟草根际土进行了微生物分离培养,基于16S rRNA基因和rDNA ITS测序鉴定其分类地位,分析烟草根际可培养细菌和真菌的多样性;选取代表性细菌进行促生指标测定,筛选对烟草常见病原菌具有拮抗能力的菌株,并经盆栽试验验证典型菌株的促生效果,研究结果将丰富烟草根际微生物库,为改善植烟土壤质量和提升烟草品质与效益提供重要资源。
1 材料与方法 1.1 材料 1.1.1 供试植物烤烟品种K326由玉溪中烟种子有限责任公司提供。
1.1.2 供试培养基微生物分离培养所用培养基包括LB培养基和PDA培养基[13]。细菌促生指标测定所用培养基包括:PKO培养基[14],用于测定无机磷溶解能力;蒙金娜培养基[14],用于测定有机磷溶解能力;PAF、DF盐和ADF培养基[14],用于ACC脱氨酶活性测定;CAS培养基[15],用于铁载体产生能力测定。拮抗菌株的筛选所用培养基包括营养琼脂培养基NA[16]和燕麦培养基OA[13]。
1.1.3 供试菌株试验所用的烟草青枯病菌[青枯雷尔氏菌(Ralstonia solanacearum) Rs10]和烟草黑胫病菌[烟草疫霉(Phytophthora nicotianae) JM1]均为本实验室保存。
1.2 样品收集2018年8月份从遵义烟区选择常年种植烟草不发病的4个田块,整棵烟株带根挖出,抖落非根际土,根系样品及其附着的根际土壤放入无菌自封袋,4 ℃条件下运回实验室进行菌株分离培养。
1.3 微生物的分离培养细菌的分离培养:在超净工作台中称取1.0 g烟草根际土加入9 mL无菌生理盐水中,充分振荡,静置后吸取100 μL加入900 μL生理盐水中,梯度稀释至10−4。吸取100 μL涂布于LB固体培养基上,置28 ℃恒温培养箱中培养4−6 d,根据菌落颜色、形态、表面光滑度等挑取单菌落。纯化2−3次后,接种于LB液体培养基,28 ℃、180 r/min振荡培养24−48 h至浑浊,菌液与50%甘油在冻存管中1:1 (体积比)混匀,于−80 ℃冰箱冷冻保存。
真菌的分离培养:分离方法同细菌,不同的是将稀释后的土壤悬液涂布于PDA培养基上,在28 ℃恒温培养箱中培养7−10 d。根据菌落特征挑取菌丝于PDA培养基上纯化。
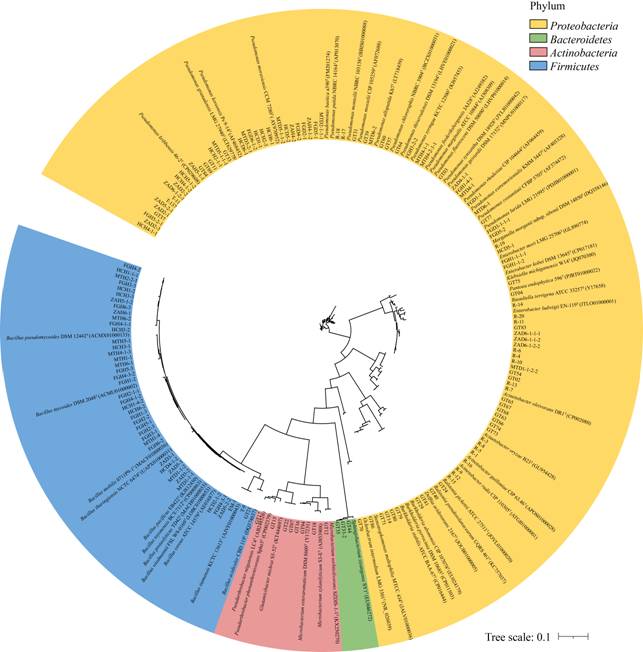
1.4 微生物的分子鉴定细菌使用菌落PCR法,利用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCCTGGC TCAG-3′)和1492R (5′-GGTTACCTTGTTACGAC TT-3′)进行PCR扩增[17]。对于真菌,则先提取基因组DNA再进行PCR扩增:取50 μL裂解液(Lysis Buffer for Microorganism to Direct PCR)于灭菌的离心管中,挑取少许菌丝置于管中,80 ℃热变性15 min后,5 000 r/min离心2 min,上清液用作PCR反应模板。真菌以ITS1 (5′-TCCGTAGGTGAAC CTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATA TGC-3′)为引物进行PCR扩增[18]。所有PCR产物送往青岛睿博生物技术有限公司进行测序,所得细菌序列经校对后上传至EzBioCloud数据库(https://www.ezbiocloud.net/)进行比对;rDNA ITS序列则提交至NCBI进行比对。比对完成后分别下载相似性最高的模式菌株序列,使用MEGA 5.0进行ClustalX多重比对,采用邻接法(Neighbor-Joining Method)构建系统发育树,自举值(Bootstrap)为1 000,并用iTOL在线工具(https://itol.embl.de/login.cgi )处理进化树。
1.5 细菌的促生特性测定从获得的所有细菌中挑选出44株代表性菌株进行促生指标的测定。
菌株解磷能力测定:将选出的44株代表性菌株接种至LB液体培养基中,28 ℃、180 r/min培养至OD600为0.6时,点接到PKO无机磷和蒙金娜有机磷培养基上,28 ℃恒温培养3 d,观察是否有溶磷圈的产生,根据溶磷圈的大小判断菌株溶磷能力强弱。
菌株ACC脱氨酶活性测定:参考Penrose等[19]方法进行测定。
菌株IAA产生能力测定:将待测菌株在28 ℃、180 r/min条件下振荡培养至OD600为0.6,接种到含0.1 g/L色氨酸的LB液体培养基,以不接菌的培养基为对照,28 ℃、180 r/min振荡培养3 d。然后4 ℃、8 000 r/min离心10 min,取1 mL上清液加入1 mL Salkowski比色液于黑暗中反应30 min,迅速用分光光度计于530 nm波长下测定吸光度,根据标准曲线计算IAA的含量。标准曲线(0、20、40、60、80、100 mg/L)用IAA纯品制作。
菌株产生铁载体能力的测定:将同上培养的菌液转接至5 mL新鲜LB液体培养基中,28 ℃、180 r/min振荡培养3 d。然后将培养液于4 ℃、10 000 r/min离心15 min,取上清液,并加入等体积的CAS检测液,充分混匀后于黑暗中静置30 min,测定630 nm处吸光值(As)。另取空白培养基与CAS检测液等体积混匀,以其吸光值作为参比值(Ar)。根据公式[(Ar−As)/Ar]×100%计算,即得铁载体的相对含量。
1.6 细菌对烟草常见病原菌的拮抗能力测定所有细菌菌株采用平板对峙法检测其是否对烟草常见病原菌具有拮抗作用。对烟草青枯病菌具有拮抗作用的细菌的筛选:将青枯雷尔氏菌Rs10在28 ℃、180 r/min条件下振荡培养至OD600为0.6,均匀喷洒至NA固体培养基上,并将活化的待测菌液点种在NA平板上,28 ℃培养48 h,观察是否有抑菌圈出现,并测量抑菌圈直径。对于烟草黑胫病菌拮抗菌的筛选,在燕麦培养基中央接入直径为5 mm的黑胫病菌菌饼,轻轻刮取待测细菌点种于距供试菌饼22.5 mm处,放于28 ℃培养箱中培养5 d,观察是否有抑菌圈出现,并测量抑菌圈直径。
1.7 细菌对盆栽烟苗的促生作用烟草种子均匀播撒在育苗盘中,置于28 ℃ (10 h,光照)/25 ℃ (14 h,黑暗)培养箱中萌发。15 d后挑选大小一致的幼苗进行假植,待烟苗长出第3片叶时进行移栽。每个小盆装180 g土(基质与土壤的质量比为3:7),每个处理6盆烟苗。将筛选得到的菌株HCH2-3、FGD5-2和EM-1接种至LB液体培养基,28 ℃、180 r/min培养24 h后,于4 ℃、4 000 r/min离心10 min收集菌体,然后用无菌水重悬,调节OD600为0.8。每盆烟苗浇菌液20 mL至终浓度为107 CFU/g。混合菌液按照1:1:1 (体积比)混合。每隔5 d浇一次菌液,共浇2次。7 d后调查农艺学性状,评价菌株是否具有促生效果。
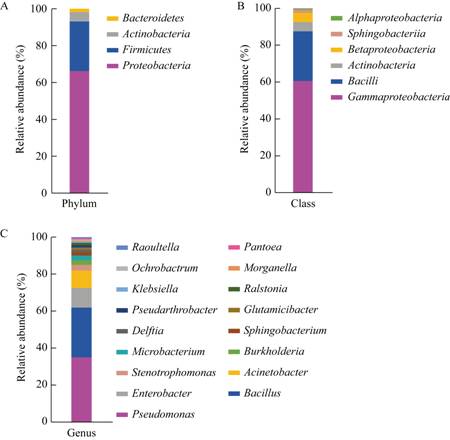
2 结果与分析 2.1 烟草根际可培养细菌的多样性对遵义烟田4个田块的烟草根际土样品进行了微生物分离鉴定,共获得160株细菌,分属于4个门6个纲9个目14个科17个属和63个种(图 1)。4个门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),分别占总分离菌株的66.2%、26.9%、5.0%和1.9%。在纲水平上,γ-变形菌纲(Gammaproteobacteria)占绝对优势,占总菌株数的60.6%;其次为芽孢杆菌纲(Bacilli,26.9%)、放线菌纲(Actinobacteria,5.0%)和β-变形菌纲(Betaproteobacteria,5.0%)。在属水平上,γ-变形菌纲中的假单胞菌属(Pseudomonas)所获菌株最多,共分离得到56株,属于31个种;第二大优势属为芽孢杆菌纲中的芽孢杆菌属(Bacillus),共分离得到43株,属于11个种;其次为不动杆菌属(Acinetobacter)和肠杆菌属(Enterobacter),分别获得15株和17株细菌(表 1)。以上研究结果表明,遵义烟田根际可培养细菌具有丰富的多样性,并且假单胞菌属和芽孢杆菌属细菌为优势类群(图 2)。
|
| 图 1 烟草根际可培养细菌在门(A)、纲(B)和属(C)水平上的组成 Figure 1 The culturable bacterial composition of tobacco rhizosphere at the phylum (A), class (B) and genus (C) levels |
|
|
| 种类 Species |
菌株数 Strain number |
所占比例 Percentage (%) |
相似度范围 Similarity range (%) |
相似度中位数 Similarity median (%) |
| Acinetobacter guillouiae | 1 | 0.63 | 99.89 | 99.89 |
| Acinetobacter oleivorans | 7 | 4.38 | 99.55−100.00 | 100.00 |
| Acinetobacter oryzae | 4 | 2.50 | 98.54−98.97 | 98.88 |
| Acinetobacter rudis | 3 | 1.88 | 99.55−100.00 | 100.00 |
| Bacillus acidiceler | 1 | 0.63 | 99.89 | 99.89 |
| Bacillus cereus | 7 | 4.38 | 99.79−100.00 | 100.00 |
| Bacillus mobilis | 1 | 0.63 | 99.93 | 99.93 |
| Bacillus mycoides | 4 | 2.50 | 99.58−100.00 | 99.69 |
| Bacillus pacificus | 2 | 1.25 | 100.00 | 100.00 |
| Bacillus proteolyticus | 2 | 1.25 | 99.79−100.00 | 99.90 |
| Bacillus pseudomycoides | 5 | 3.13 | 99.16−100.00 | 100.00 |
| Bacillus velezensis | 2 | 1.25 | 100.00 | 100.00 |
| Bacillus thuringiensis | 9 | 5.63 | 99.44−100.00 | 99.79 |
| Bacillus toyonensis | 8 | 5.00 | 99.17−100.00 | 99.76 |
| Bacillus wiedmannii | 2 | 1.25 | 99.93−100.00 | 99.97 |
| Burkholderia pyrrocinia | 2 | 1.25 | 99.66 | 99.66 |
| Burkholderia stabilis | 1 | 0.63 | 99.89 | 99.89 |
| Burkholderia ubonensis | 1 | 0.63 | 99.65 | 99.65 |
| Delftia acidovorans | 2 | 1.25 | 100.00 | 100.00 |
| Enterobacter kobei | 1 | 0.63 | 99.76 | 99.76 |
| Enterobacter ludwigii | 12 | 7.50 | 99.77−100.00 | 100.00 |
| Enterobacter mori | 4 | 2.50 | 99.42−100.00 | 99.53 |
| Glutamicibacter mishrai | 2 | 1.25 | 99.89−100.00 | 99.95 |
| Klebsiella michiganensis | 1 | 0.63 | 98.97 | 98.97 |
| Microbacterium esteraromaticum | 2 | 1.25 | 99.32−99.43 | 99.38 |
| Microbacterium sorbitolivorans | 1 | 0.63 | 99.77 | 99.77 |
| Microbacterium xylanilyticum | 1 | 0.63 | 99.32 | 99.32 |
| Morganella morganii subsp. sibonii | 1 | 0.63 | 98.36 | 98.36 |
| Ochrobactrum intermedium | 1 | 0.63 | 100.00 | 100.00 |
| Pantoea endophytica | 1 | 0.63 | 99.66 | 99.66 |
| Pseudarthrobacter niigatensis | 1 | 0.63 | 99.89 | 99.89 |
| Pseudarthrobacter phenanthrenivorans | 1 | 0.63 | 99.43 | 99.43 |
| Pseudomonas alloputida | 1 | 0.63 | 100.00 | 100.00 |
| Pseudomonas atagosis | 3 | 1.88 | 99.63 | 99.63 |
| Pseudomonas baetica | 2 | 1.25 | 99.57 | 99.57 |
| Pseudomonas capeferrum | 2 | 1.25 | 99.55−99.66 | 99.61 |
| Pseudomonas chlororaphis | 1 | 0.63 | 99.50 | 99.50 |
| Pseudomonas costantinii | 1 | 0.63 | 99.89 | 99.89 |
| Pseudomonas extremorientalis | 1 | 0.63 | 100.00 | 100.00 |
| Pseudomonas fluorescens | 2 | 1.25 | 99.86−99.93 | 99.90 |
| Pseudomonas frederiksbergensis | 1 | 0.63 | 99.79 | 99.79 |
| Pseudomonas geniculata | 2 | 1.25 | 98.84−99.64 | 99.24 |
| Pseudomonas gessardii | 1 | 0.63 | 98.84 | 98.84 |
| Pseudomonas glycinae | 1 | 0.63 | 99.72 | 99.72 |
| Pseudomonas granadensis | 1 | 0.63 | 99.77 | 99.77 |
| Pseudomonas hibiscicola | 1 | 0.63 | 99.30 | 99.30 |
| Pseudomonas koreensis | 11 | 6.88 | 99.36−100.00 | 99.93 |
| Pseudomonas kribbensis | 10 | 6.25 | 99.86−100.00 | 99.89 |
| Pseudomonas lurida | 2 | 1.25 | 100.00 | 100.00 |
| Pseudomonas mandelii | 1 | 0.63 | 99.78 | 99.78 |
| Pseudomonas marginalis | 2 | 1.25 | 99.78−100.00 | 99.89 |
| Pseudomonas monteilii | 2 | 1.25 | 99.77−100.00 | 99.89 |
| Pseudomonas moraviensis | 1 | 0.63 | 99.64 | 99.64 |
| Pseudomonas mosselii | 2 | 1.25 | 99.79−100.00 | 99.90 |
| Pseudomonas putida | 1 | 0.63 | 99.93 | 99.93 |
| Pseudomonas rhodesiae | 1 | 0.63 | 99.93 | 99.93 |
| Pseudomonas syringae | 2 | 1.25 | 99.64−100.00 | 99.82 |
| Pseudomonas thivervalensis | 1 | 0.63 | 99.93 | 99.93 |
| Ralstonia pickettii | 1 | 0.63 | 99.54 | 99.54 |
| Ralstonia pseudosolanacearum | 1 | 0.63 | 100.00 | 100.00 |
| Raoultella terrigena | 1 | 0.63 | 99.66 | 99.66 |
| Sphingobacterium siyangense | 3 | 1.88 | 99.20−99.54 | 99.20 |
| Stenotrophomonas maltophilia | 5 | 3.13 | 98.32−99.66 | 99.66 |
|
| 图 2 烟草根际可培养细菌与其参考菌株的系统进化树 Figure 2 Neighbor-joining phylogenetic tree of culturable bacteria isolated from tobacco rhizosphere and their closest type strains based on 16S rRNA gene sequences |
|
|
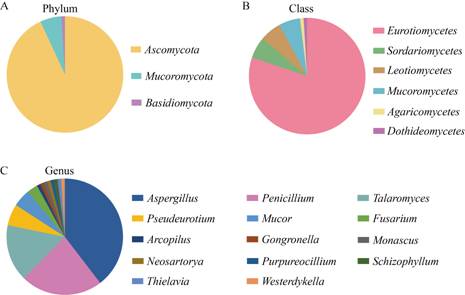
对遵义烟田4个田块的烟草根际土样品进行微生物分离鉴定共获得101株真菌,分属于3个门6个纲7个目11个科14个属和26个种。3个门为子囊菌门(Ascomycota) 94株、毛霉菌门(Mucoromycota) 6株和担子菌门(Basidiomycota) 1株,分别占总分离菌株的93.1%、5.9%和1.0%。在纲水平上,散囊菌纲(Eurotiomycetes,81株)占绝对优势,占总菌株数的80.2%;其次为锤舌菌纲(Leotiomycetes,6株,占5.9%)、毛霉菌纲(Mucoromycetes,6株,占5.9%)和粪壳菌纲(Sordariomycetes,5株,占5.0%)。在属水平上,散囊菌纲中的曲霉属(Aspergillus)菌株最多,共分离出40株,分属于5个种,占真菌分离总数的39.60%;散囊菌纲中的青霉属(Penicillium)为第二大优势属,共分离出23株菌,分属于3个种,占真菌分离总数的22.77%;另外,篮状菌属(Talaromyces)获得的菌株数目也较多,共获得6种16株菌(表 2)。以上研究结果表明遵义烟苗根际土可培养真菌丰富多样(图 3)。
| 种类 Species |
菌株数 Strain number |
所占比例 Percentage (%) |
相似度范围 Similarity range (%) |
相似度中位数 Similarity median (%) |
| Arcopilus aureus | 1 | 0.99 | 100.00 | 100.00 |
| Aspergillus fischeri | 1 | 0.99 | 99.83 | 99.83 |
| Aspergillus fumigatus | 3 | 2.97 | 100.00 | 100.00 |
| Aspergillus lentulus | 28 | 27.72 | 99.32−100.00 | 100.00 |
| Aspergillus terreus | 5 | 4.95 | 99.83−100.00 | 100.00 |
| Aspergillus udagawae | 3 | 2.97 | 98.95−100.00 | 100.00 |
| Fusarium oxysporum | 3 | 2.97 | 100.00 | 100.00 |
| Gongronella butleri | 1 | 0.99 | 100.00 | 100.00 |
| Monascus fumeus | 1 | 0.99 | 99.64 | 99.64 |
| Mucor circinelloides | 2 | 1.98 | 98.52−100.00 | 99.26 |
| Mucor racemosus | 3 | 2.97 | 99.23−99.48 | 99.48 |
| Neosartorya udagawae | 1 | 0.99 | 100.00 | 100.00 |
| Penicillium citrioviride | 7 | 6.93 | 99.64−100.00 | 99.64 |
| Penicillium coprophilum | 1 | 0.99 | 99.64 | 99.64 |
| Penicillium janthinellum | 15 | 14.85 | 99.64−100.00 | 100.00 |
| Pseudeurotium ovale | 6 | 5.94 | 98.02−98.22 | 98.02 |
| Purpureocillium lilacinum | 1 | 0.99 | 100.00 | 100.00 |
| Schizophyllum commune | 1 | 0.99 | 100.00 | 100.00 |
| Talaromyces flavus | 2 | 1.98 | 99.81−100.00 | 99.91 |
| Talaromyces gossypii | 1 | 0.99 | 100.00 | 100.00 |
| Talaromyces liani | 1 | 0.99 | 99.09 | 99.09 |
| Talaromyces pinophilus | 3 | 2.97 | 99.15−100 | 99.21 |
| Talaromyces purpureogenus | 2 | 1.98 | 98.59−99.83 | 99.21 |
| Talaromyces trachyspermus | 7 | 6.93 | 98.20−100 | 98.64 |
| Thielavia hyrcaniae | 1 | 0.99 | 99.25 | 99.25 |
| Westerdykella dispersa | 1 | 0.99 | 99.17 | 99.17 |
|
| 图 3 烟草根际可培养真菌在门(A)、纲(B)和属(C)水平上的组成 Figure 3 The culturable fungal composition of tobacco rhizosphere at the phylum (A), class (B) and genus (C) levels |
|
|
为了探究菌株的促生特性,从不同种的细菌中选择了44株细菌作为代表性菌株。结果发现,44株细菌均具有不同程度的IAA产生能力,其中菌株盖氏假单胞菌(Pseudomonas gessardii) GT03的IAA产生能力最强,可达170.31 mg/L;此外,菌株FGH1-4-1、HCH2-3、GT83和GT31产生的IAA也超过50 mg/L。能够溶解有机磷的细菌有9株,溶解无机磷的有16株,产生铁载体的有13株,产生ACC脱氨酶的有14株(表 3)。重要的是,有2株细菌同时具有产IAA、溶磷、产铁载体和ACC脱氨酶4项促生特性,分别为菌株GT24和GT79。该部分结果体现出烟草根际细菌在植物促生方面具有较好的应用潜力。
| 菌株编号 Strain No. |
最相似菌 Closest relatives |
IAA产量 IAA production (mg/L) |
铁载体产生 Siderophore production |
溶磷 Phosphate solubilizing |
ACC脱氨酶 ACC deaminase |
|
| 有机磷 Organic phosphorus |
无机磷 Inorganic phosphorus |
|||||
| GT63 | Acinetobacter oleivorans | 8.27 | − | + | + | − |
| FGH4-3-2 | Bacillus cereus | 5.36 | + | − | − | + |
| HCD2-1-2 | Bacillus proteolyticus | 20.03 | − | − | − | + |
| MTD1-1-2 | Bacillus thuringiensis | 3.58 | − | − | − | − |
| FGH4-1-1 | Bacillus toyonensis | 3.06 | + | − | − | − |
| HCH3-2 | Bacillus toyonensis | 6.20 | − | − | − | − |
| EM-1 | Bacillus velezensis | 8.59 | − | − | − | − |
| GT79 | Burkholderia pyrrocinia | 11.11 | + | + | + | + |
| GT14 | Burkholderia stabilis | 4.16 | + | − | + | − |
| GT29 | Delftia acidovorans | 5.98 | − | − | − | + |
| GT41 | Delftia acidovorans | 11.42 | − | − | − | + |
| GT83 | Enterobacter kobei | 50.22 | − | − | + | − |
| FGH1-1-1 | Enterobacter mori | 42.86 | − | − | + | + |
| GT07 | Glutamicibacter mishrai | 38.58 | − | − | − | − |
| GT16 | Microbacterium esteraromaticum | 49.47 | + | − | − | − |
| GT12 | Microbacterium sorbitolivorans | 1.31 | − | − | − | − |
| GT18 | Microbacterium xylanilyticum | 6.06 | − | − | − | − |
| GT70 | Ochrobactrum intermedium | 1.49 | − | − | − | + |
| GT04 | Pantoea endophytica | 5.02 | + | + | + | − |
| GT60 | Pseudomonas alloputida | 1.00 | − | − | − | − |
| ZAH4-2 | Pseudomonas atagosis | 6.79 | + | − | − | + |
| FGD5-1 | Pseudomonas baetica | 7.38 | − | − | + | − |
| GT64 | Pseudomonas chlororaphis | 3.89 | − | + | + | − |
| MTD6-1 | Pseudomonas extremorientalis | 8.29 | − | − | + | − |
| ZAH5-1-1 | Pseudomonas fluorescens | 9.19 | − | − | − | − |
| MTH4-2-1 | Pseudomonas frederiksbergensis | 38.06 | − | + | + | − |
| MTH4-1-2 | Pseudomonas geniculata | 20.03 | − | − | − | − |
| GT03 | Pseudomonas gessardii | 170.31 | − | + | − | − |
| FGH5-2-1 | Pseudomonas glycinae | 8.61 | − | − | − | − |
| GT33 | Pseudomonas granadensis | 25.25 | − | − | − | − |
| MTH1-2-1 | Pseudomonas hibiscicola | 11.03 | + | + | − | − |
| HCH2-3 | Pseudomonas koreensis | 61.36 | + | − | + | + |
| HCH4-1-1 | Pseudomonas kribbensis | 22.58 | − | − | − | − |
| FGD5-2 | Pseudomonas lurida | 6.17 | + | − | − | − |
| FGH1-4-1 | Pseudomonas marginalis | 50.22 | − | − | + | − |
| MTD6-2 | Pseudomonas monteilii | 7.29 | − | − | − | − |
| GT31 | Pseudomonas mosselii | 51.28 | + | + | + | − |
| MTD4-1 | Pseudomonas rhodesiae | 2.60 | + | − | + | − |
| ZAH4-1-2 | Pseudomonas syringae | 9.48 | − | − | + | + |
| FGH3-2-2 | Pseudomonas thivervalensis | 16.28 | − | − | − | − |
| GT24 | Ralstonia pickettii | 8.29 | + | + | + | + |
| GT35 | Sphingobacterium siyangense | 2.71 | − | − | − | + |
| MTD3-1-1 | Stenotrophomonas maltophilia | 0.40 | − | − | − | + |
| MTH5-2-1 | Stenotrophomonas maltophilia | 48.67 | − | − | − | + |
| 注:+:阳性反应;−:阴性反应
Note: +: Positive; −: Negative |
||||||
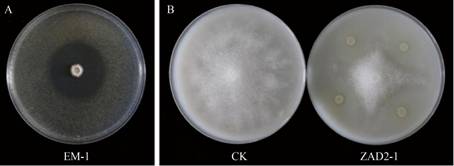
为了探究烟草根际细菌对常见烟草土传病害(青枯病和黑胫病)的防治潜力,将所有获得的细菌菌株进行平板对峙试验。结果发现,在160株细菌中,能够抑制青枯病菌的菌株有25株,能够抑制黑胫病菌的菌株有26株,两者都能抑制的菌株有10株(表 4)。其中,菌株EM-1对青枯病菌的拮抗作用最强,抑菌圈直径可达4.1 cm;菌株ZAD2-1对黑胫病菌的拮抗作用最强,抑菌率可达56% (图 4)。
| 编号 Strain No. |
最相似菌 Closest relatives |
抑制青枯病菌 Inhibition against R. solanacearum |
抑制黑胫病菌 Inhibition against P. nicotianae |
| HCH6-2 | Bacillus cereus | − | + |
| HCH1-4-2 | Bacillus cereus | − | + |
| ZAD3-2 | Bacillus pacificus | + | − |
| MTH1-1 | Bacillus pseudomycoides | − | + |
| MTH5-1 | Bacillus pseudomycoides | − | + |
| HCH3-1 | Bacillus pseudomycoides | − | + |
| EM-1 | Bacillus velezensis | + | + |
| T-9 | Bacillus velezensis | + | + |
| FGH6-3 | Bacillus thuringiensis | − | + |
| FGH6-2 | Bacillus thuringiensis | − | + |
| ZAH6-1 | Bacillus thuringiensis | − | + |
| MTH6-2 | Bacillus thuringiensis | − | + |
| ZAH5-1-2 | Bacillus thuringiensis | − | + |
| ZAD5-1 | Bacillus thuringiensis | − | + |
| HCH1-1-1 | Bacillus toyonensis | − | + |
| GT14 | Burkholderia stabilis | − | + |
| GT07 | Glutamicibacter mishrai | − | + |
| GT04 | Pantoea endophytica | − | + |
| ZAH4-2 | Pseudomonas atagosis | + | + |
| FGD2-1 | Pseudomonas atagosis | + | − |
| FGD5-1 | Pseudomonas baetica | + | − |
| GT64 | Pseudomonas chlororaphis | + | + |
| GT77 | Pseudomonas costantinii | + | − |
| MTD6-1 | Pseudomonas extremorientalis | + | − |
| ZAH5-1-1 | Pseudomonas fluorescens | + | − |
| GT03 | Pseudomonas gessardii | + | + |
| ZAD2-1 | Pseudomonas koreensis | − | + |
| ZAD2-3 | Pseudomonas koreensis | + | − |
| ZAD2-2 | Pseudomonas koreensis | + | + |
| HCD1-1 | Pseudomonas koreensis | + | + |
| HCD6-1 | Pseudomonas koreensis | + | + |
| HCH2-3 | Pseudomonas koreensis | + | + |
| HCH6-1 | Pseudomonas koreensis | + | + |
| T-11 | Pseudomonas kribbensis | + | − |
| T-137 | Pseudomonas kribbensis | + | − |
| FGD5-2 | Pseudomonas lurida | + | − |
| FGH1-4-1 | Pseudomonas marginalis | + | − |
| FGD4-2 | Pseudomonas moraviensis | + | − |
| GT39 | Pseudomonas mosselii | + | − |
| FGD1-1 | Pseudomonas putida | + | − |
| MTD4-1 | Pseudomonas rhodesiae | + | − |
| 注:+:具有拮抗作用;−:无拮抗作用
Note: +: With antagonistic activity; −: No antagonistic activity |
|||
|
| 图 4 菌株EM-1和ZAD2-1对烟草青枯病菌(A)和黑胫病菌(B)的平板抑制效果 Figure 4 The inhibition of strains EM-1 and ZAD2-1 against Ralstonia solanacearum (A) and Phytophthora nicotianae (B) respectively |
|
|
由于前期研究发现韩国假单胞菌(P. koreensis) HCH2-3和浅黄绿假单胞菌(P. lurida) FGD5-2为遵义抑病土壤中的关键菌株[12],而贝莱斯芽孢杆菌(B. velezensis) EM-1具有较强的青枯病菌拮抗能力,因此选择上述3株细菌进行后续盆栽烟苗促生试验。结果表明,菌株EM-1、HCH2-3、FGD5-2及其混合菌对烟苗呈现不同程度的促生作用(图 5A)。3株菌的联合施用显著提高了烟苗的最大叶面积,而单株细菌对烟苗最大叶面积的影响不显著(图 5B)。与对照相比,所有处理均增加了烟苗的株高,但差异不显著(图 5C)。所有处理均显著提高了烟苗地上部分的鲜重,尤其以混合菌和菌株HCH2-3处理最为明显,与对照相比分别提高了32.0%和28.6% (图 5D)。
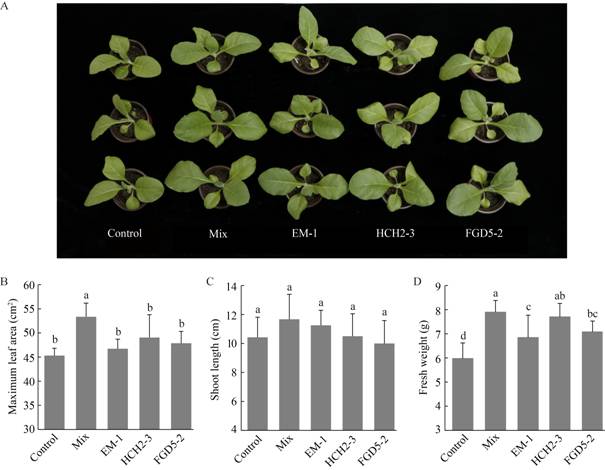
|
| 图 5 实验菌株对盆栽烟苗生长的影响 Figure 5 The shoot growth of tobacco treated with single strains EM-1, HCH2-3 and FGD5-2 and with a consortium of all three strains (mix) 注:A:促生效果图;B:最大叶面积;C:株高;D:鲜重。图B、C和D柱状图上的不同小写字母表示两组处理间具有显著性差异(P < 0.05) Note: A: The growth promoting effects; B: Maximum leaf area; C: Shoot length; D: Fresh weight. Different letters in panels B, C and D indicate statistically significant differences between treatments as determined by student's t-test (P < 0.05) |
|
|
烟草根际具有丰富的微生物类群,这些微生物在烟草营养吸收和健康生长中发挥着重要作用[20]。虽然扩增子测序及宏基因组测序等免培养技术已广泛应用于烟草根际微生物组的研究中,但要深入解析微生物对烟草的促生和防病机制,仍需传统培养技术获得单个微生物菌株进行探索。
本研究对4个常年不发病烟田中的烟草根际微生物进行了分离培养和鉴定,并对其促生和抗病活性进行了检测,从4个采样点共分离获得160株细菌和101株真菌。细菌主要由变形菌门和厚壁菌门组成,γ-变形菌纲和芽孢杆菌纲为主要优势类群;在属水平上,假单胞菌属和芽孢杆菌属是主要优势菌,说明2个属中的细菌可能在烟草生长中具有重要作用。真菌主要由子囊菌门和毛霉菌门组成,散囊菌纲为主要优势类群;在属水平上,散囊菌纲中的曲霉属和青霉属占优势地位。李正风等[21]通过高通量测序技术也发现青霉属在植烟土壤中的丰度较高。据报道曲霉属和青霉属为烟草根际的常见生态类群[22],能够溶磷、解钾并产生抗生素或通过营养和生态位竞争以及诱导植物产生系统抗性的方式,促进植物生长和防治病害[23-26]。因此,它们在烟草健康生长中可能发挥着有益作用。
研究表明,PGPR能够以多种途径促进植物的生长[27-28],因此,本研究对44株代表性细菌的促生特性进行了检测,以筛选出对烟草具有促生活性的潜在促生菌株。结果发现,所有细菌均具有不同程度的IAA产生能力,9株细菌能够溶解有机磷,16株溶解无机磷,13株产生铁载体,14株产生ACC脱氨酶;同时,具有产IAA、溶磷、产铁载体和ACC脱氨酶4项促生特性的菌株占11.4%。王艳霞等对田菁根际分离得到的105株细菌进行了促生特性测定,也发现所有菌株均可产生IAA[29],因此,IAA产生能力在植物根际微生物中较为常见,可能只有IAA产生能力较强的菌株才具有植物促生的潜力。此外,本研究从160株细菌中筛选出25株青枯病菌拮抗菌和26株黑胫病菌拮抗菌,两者都能拮抗的细菌有10株。所有拮抗菌株均为假单胞菌属和芽孢杆菌属细菌,这2个属中的众多物种已被证明具有防病作用[30-33],暗示着烟草根际主要微生物类群的存在是其常年不发病的原因。盆栽试验表明,韩国假单胞菌HCH2-3、浅黄绿假单胞菌FGD5-2和贝莱斯芽孢杆菌EM-1均能促进烟苗的生长。先前的报道也发现韩国假单胞菌能够提高土壤pH值、土壤酶活性并增加土壤养分含量[34]。另外,在本研究中,上述3株细菌联合施加对烟苗的促生效果最明显,说明这3株细菌在促进烟苗生长中具有协同作用。因此,合成菌群或者接种具有不同促生特性的PGPR是未来微生物菌剂开发的一个重要方向[12, 35-36]。
综上所述,烟草根际具有丰富多样的可培养微生物,本研究获得了许多具有防病促生潜力的菌株,为后续应用研究提供了核心微生物资源。然而要想获得更多数量以及更加多样的根际可培养微生物,仍需不同种类的培养基和培养条件相结合,或者利用最新开发的高通量分离培养技术[37]。另外,本研究还证实了多种细菌混合施加的效果优于单株细菌,多种微生物间的协同互作机制还需要进一步研究。
| [1] |
Kang LY, Liu ZB, Ou LJ, Yuan ZH. Research progress on effects of soil microbial on the growth and development of crops[J]. Hunan Agricultural Sciences, 2017(3): 113-116. (in Chinese) 康林玉, 刘周斌, 欧立军, 袁祖华. 土壤微生物促进作物生长发育研究进展[J]. 湖南农业科学, 2017(3): 113-116. |
| [2] |
Zhang JY, Liu YX, Zhang N, Hu B, Jin T, Xu HR, Qin Y, Yan PX, Zhang XN, Guo XX, et al. NRT1.1B is associated with root microbiota composition and nitrogen use in field-grown rice[J]. Nature Biotechnology, 2019, 37(6): 676-684. DOI:10.1038/s41587-019-0104-4 |
| [3] |
Carrión VJ, Perez-Jaramillo J, Cordovez V, Tracanna V, De Hollander M, Ruiz-Buck D, Mendes LW, Van Ijcken WFJ, Gomez-Exposito R, Elsayed SS, et al. Pathogen-induced activation of disease-suppressive functions in the endophytic root microbiome[J]. Science, 2019, 366(6465): 606-612. DOI:10.1126/science.aaw9285 |
| [4] |
Kwak MJ, Kong HG, Choi K, Kwon SK, Song JY, Lee J, Lee PA, Choi SY, Seo M, Lee HJ, et al. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology, 2018, 36(11): 1100-1109. DOI:10.1038/nbt.4232 |
| [5] |
Mitter B, Brader G, Pfaffenbichler N, Sessitsch A. Next generation microbiome applications for crop production — limitations and the need of knowledge-based solutions[J]. Current Opinion in Microbiology, 2019, 49: 59-65. DOI:10.1016/j.mib.2019.10.006 |
| [6] |
Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria[J]. Annual Review of Microbiology, 2009, 63: 541-556. DOI:10.1146/annurev.micro.62.081307.162918 |
| [7] |
Ji C, Wang XH, Liu XL. Research progress on the action mechanism of plant growth-promoting bacteria under salt stress[J]. Biotechnology Bulletin, 2020, 36(4): 131-143. (in Chinese) 纪超, 王晓辉, 刘训理. 盐胁迫环境下植物促生菌的作用机制研究进展[J]. 生物技术通报, 2020, 36(4): 131-143. |
| [8] |
Rao YP. Disease prevention and growth promoting effect of growth-promoting rhizosphere in cucumber[J]. Journal of Changjiang Vegetables, 2009(14): 11-14. (in Chinese) 饶毅萍. 黄瓜根际促生菌的促生效应与防病作用[J]. 长江蔬菜, 2009(14): 11-14. DOI:10.3865/j.issn.1001-3547.2009.14.004 |
| [9] |
Lynch JM, Whipps JM. Substrate flow in the rhizosphere[J]. Plant and Soil, 1990, 129(1): 1-10. DOI:10.1007/BF00011685 |
| [10] |
Kyselková M, Kopecký J, Frapolli M, Défago G, Ságová-Marečková M, Grundmann GL, Moënne-Loccoz Y. Comparison of rhizobacterial community composition in soil suppressive or conducive to tobacco black root rot disease[J]. The ISME Journal, 2009, 3(10): 1127-1138. DOI:10.1038/ismej.2009.61 |
| [11] |
Hu QL, Tan L, Gu SS, Xiao YS, Xiong XY, Zeng WA, Feng K, Wei Z, Deng Y. Network analysis infers the wilt pathogen invasion associated with non-detrimental bacteria[J]. npj Biofilms and Microbiomes, 2020, 6: 8. DOI:10.1038/s41522-020-0117-2 |
| [12] |
Zheng YF, Han XB, Zhao DL, Wei KK, Yuan Y, Li YQ, Liu MH, Zhang CS. Exploring biocontrol agents from microbial keystone taxa associated to suppressive soil: a new attempt for a biocontrol strategy[J]. Frontiers in Plant Science, 2021. DOI:10.3389/fpls.2021.655673 |
| [13] |
Fang ZD. Research Methods of Plant Diseases[M]. Beijing: Chinese Agriculture Press, 1998: 46-49. (in Chinese) 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 46-49. |
| [14] |
Man J, Tang B, Deng B, Li JH, He YJ, Zhang JL. Isolation, screening and beneficial effects of plant growth-promoting rhizobacteria (PGPR) in the rhizosphere of Leymus chinensis[J]. Acta Prataculturae Sinica, 2021, 30(1): 59-71. (in Chinese) 漫静, 唐波, 邓波, 李佳欢, 何玉娟, 张家良. 羊草根际促生菌的分离筛选及促生作用研究[J]. 草业学报, 2021, 30(1): 59-71. |
| [15] |
Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [16] |
Wang HC, Li WH, Chen QY, Huang YF, Li K, Xia HQ, Wang MS, Cai LT, Shang SH, Shi JX. A rapid microbioassay for discovery of antagonistic bacteria for Phytophthora parasitica var. nicotianae[J]. Phytopathology, 2012, 102(3): 267-271. DOI:10.1094/PHYTO-09-11-0247 |
| [17] |
Weisburg WG, Barns SM, Pelletier DA, Lane DJ. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703. DOI:10.1128/jb.173.2.697-703.1991 |
| [18] |
Lee SB, Taylor JW. PCR protocols: a guide to methods and applications[EB/OL]. 1990
|
| [19] |
Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10-15. DOI:10.1034/j.1399-3054.2003.00086.x |
| [20] |
Liu BB, Guo SX, Chen X, Liu ZY, Zhou KX, Song HF, Chen W, Li WJ. Diversity and function of culturable rhizospheric bacteria of flue-cured tobacco K326 intercropped with five spice plants[J]. Microbiology China, 2020, 47(8): 2436-2449. (in Chinese) 刘冰冰, 郭书贤, 陈兴, 刘正宇, 周开心, 宋豪锋, 陈微, 李文均. 烤烟K326与香料植物间作模式下根际土可培养细菌多样性及功能[J]. 微生物学通报, 2020, 47(8): 2436-2449. |
| [21] |
Li ZF, Zhong L, Zhu J, Tang L, Wu T, Liao TG, Xia YZ, Yang LQ. Succession characteristics of fungal communities in tobacco rhizospheric soil in Yunnan[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(7): 1545-1553. (in Chinese) 李正风, 钟莉, 朱杰, 唐丽, 吴涛, 廖头根, 夏玉珍, 杨利擎. 云南烟草根际土壤真菌群落演替特征[J]. 西南农业学报, 2020, 33(7): 1545-1553. |
| [22] |
Wang N, Lü GZ, Sun XD, Mu DY, Zhao ZH, Wang FL. Fungal diversity in tobacco rhizosphere soil[J]. Mycosystema, 2012, 31(6): 827-836. (in Chinese) 王娜, 吕国忠, 孙晓东, 慕东艳, 赵志慧, 王凤龙. 烟草根际土壤真菌多样性的研究[J]. 菌物学报, 2012, 31(6): 827-836. |
| [23] |
Chuang CC, Kuo YL, Chao CC, Chao WL. Solubilization of inorganic phosphates and plant growth promotion by Aspergillus niger[J]. Biology and Fertility of Soils, 2007, 43(5): 575-584. DOI:10.1007/s00374-006-0140-3 |
| [24] |
Waqas M, Khan AL, Hamayun M, Shahzad R, Kang SM, Kim JG, Lee IJ. Endophytic fungi promote plant growth and mitigate the adverse effects of stem rot: an example of Penicillium citrinum and Aspergillus terreus[J]. Journal of Plant Interactions, 2015, 10(1): 280-287. DOI:10.1080/17429145.2015.1079743 |
| [25] |
Salas-Marina MA, Silva-Flores MA, Cervantes-Badillo MG, Rosales-Saavedra MT, Islas-Osuna MA, Casas-Flores S. The plant growth-promoting fungus Aspergillus ustus promotes growth and induces resistance against different lifestyle pathogens in Arabidopsis thaliana[J]. Journal of Microbiology and Biotechnology, 2011, 21(7): 686-696. DOI:10.4014/jmb.1101.01012 |
| [26] |
Meena VS, Bahadur I, Maurya BR, Kumar A, Meena RK, Meena SK, Verma JP. Potassium-Solubilizing Microorganism in Evergreen Agriculture: An Overview[M]//Potassium Solubilizing Microorganisms for Sustainable Agriculture. New Delhi: Springer India, 2016: 1-20
|
| [27] |
Gouda S, Kerry RG, Das G, Paramithiotis S, Shin HS, Patra JK. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture[J]. Microbiological Research, 2018, 206: 131-140. DOI:10.1016/j.micres.2017.08.016 |
| [28] |
Etesami H, Maheshwari DK. Use of plant growth promoting rhizobacteria (PGPRs) with multiple plant growth promoting traits in stress agriculture: action mechanisms and future prospects[J]. Ecotoxicology and Environmental Safety, 2018, 156: 225-246. DOI:10.1016/j.ecoenv.2018.03.013 |
| [29] |
Wang YX, Xie ZH, Zhang L, Chang DY. Screening of plant growth promoting and salt tolerant rhizobacteria in Sesbania cannabina[J]. Acta Microbiologica Sinica, 2020, 60(5): 1023-1035. (in Chinese) 王艳霞, 解志红, 张蕾, 常大勇. 田菁根际促生菌的筛选及其促生耐盐效果[J]. 微生物学报, 2020, 60(5): 1023-1035. |
| [30] |
Haas D, Keel C. Regulation of antibiotic production in root-colonizing Pseudomonas spp. and relevance for biological control of plant disease[J]. Annual Review of Phytopathology, 2003, 41(1): 117-153. DOI:10.1146/annurev.phyto.41.052002.095656 |
| [31] |
Kinsella K, Schulthess CP, Morris TF, Stuart JD. Rapid quantification of Bacillus subtilis antibiotics in the rhizosphere[J]. Soil Biology and Biochemistry, 2009, 41(2): 374-379. DOI:10.1016/j.soilbio.2008.11.019 |
| [32] |
Zhuang LB, Li Y, Wang ZS, Yu Y, Zhang N, Yang C, Zeng QC, Wang Q. Synthetic community with six Pseudomonas strains screened from garlic rhizosphere microbiome promotes plant growth[J]. Microbial Biotechnology, 2021, 14(2): 488-502. DOI:10.1111/1751-7915.13640 |
| [33] |
Hu J, Wei Z, Friman VP, Gu SH, Wang XF, Eisenhauer N, Yang TJ, Ma J, Shen QR, Xu YC, et al. Probiotic diversity enhances rhizosphere microbiome function and plant disease suppression[J]. mBio, 2016, 6. DOI:10.1128/mbio.01790-16 |
| [34] |
Zhao Q, Ren GW, Wang J, Wang XW, Wei JY, Wang XQ, Lu YH, Chen X, Wang J. Effects of adding Pseudomonas koreensis CLP-7 on soil quality and soil microbial community functional diversity in continuous cropping tobacco fields[J]. Acta Ecologica Sinica, 2020, 40(15): 5357-5366. (in Chinese) 赵倩, 任广伟, 王杰, 王新伟, 韦建玉, 王晓强, 卢燕回, 陈信, 王静. 施用韩国假单胞菌(Pseudomonas koreensis) CLP-7对连作烟田土壤质量及微生物群落功能多样性的影响[J]. 生态学报, 2020, 40(15): 5357-5366. |
| [35] |
Liu YX, Qin Y, Bai Y. Reductionist synthetic community approaches in root microbiome research[J]. Current Opinion in Microbiology, 2019, 49: 97-102. DOI:10.1016/j.mib.2019.10.010 |
| [36] |
Wei Z, Huang JF, Yang TJ, Jousset A, Xu YC, Shen QR, Friman VP. Seasonal variation in the biocontrol efficiency of bacterial wilt is driven by temperature-mediated changes in bacterial competitive interactions[J]. The Journal of Applied Ecology, 2017, 54(5): 1440-1448. DOI:10.1111/1365-2664.12873 |
| [37] |
Zhang JY, Liu YX, Guo XX, Qin Y, Garrido-Oter R, Schulze-Lefert P, Bai Y. High-throughput cultivation and identification of bacteria from the plant root microbiota[J]. Nature Protocols, 2021, 16(2): 988-1012. DOI:10.1038/s41596-020-00444-7 |
 2021, Vol. 48
2021, Vol. 48




