扩展功能
文章信息
- 刘洪艳, 袁媛, 张姗, 李凯强
- LIU Hongyan, YUAN Yuan, ZHANG Shan, LI Kaiqiang
- 异化铁还原细菌Clostridium sp. LQ25分离及其产氢与铁还原特性
- Isolation of Fe(III)-reducing bacterium Clostridium sp. LQ25 and characteristics of Fe(III) reduction and hydrogen production
- 微生物学通报, 2021, 48(12): 4521-4529
- Microbiology China, 2021, 48(12): 4521-4529
- DOI: 10.13344/j.microbiol.china.210308
-
文章历史
- 收稿日期: 2021-03-26
- 接受日期: 2021-05-21
- 网络首发日期: 2021-06-25
异化铁还原是微生物将有机物中的电子转移到以Fe(III)为末端电子受体的过程,并在这一过程中将Fe(III)还原为Fe(II)[1]。由于电子受体位于细胞外,异化铁还原细菌的电子传递即为胞外电子传递方式。异化铁还原细菌能够利用有机污染物为电子供体驱动有机物的降解,被应用于工业有机废水的处理[2-3]。异化铁还原细菌可利用细胞外的重金属为电子受体,实现有毒金属污染物的转化,被应用于重金属污染的处理[4-5]。已有研究发现,一些异化铁还原细菌能够同时具备产氢、产电及异化铁还原能力,被应用于可再生新能源的生产[6]。
根据是否通过还原Fe(III)过程获得能量用于自身生长,异化铁还原菌可分为两大类:呼吸型异化铁还原细菌和发酵型异化铁还原细菌。呼吸型异化铁还原菌将Fe(III)还原过程中获得的能量用于自身生长,以地杆菌属(Geobacter spp.)和希瓦氏菌属(Shewanella spp.)为代表菌属。发酵型异化铁还原菌可以发酵糖类和蛋白质等有机物,生成乙酸、乙醇和氢气等发酵产物,并不能将Fe(III)还原过程中获得的能量完全用于自身生长[7]。早期研究发现,发酵型异化铁还原菌在发酵有机物的过程中只有不到5%的电子传递至胞外将Fe(III)还原为Fe(II),其余电子从有机物转移到发酵产物[8],因此研究者更多关注呼吸型异化铁还原细菌胞外电子传递机理[9]。呼吸型异化铁还原细菌基因组中含有大量细胞色素c的编码序列,胞外电子传递过程中,细胞色素c对电子从细胞内膜传递到细胞外膜至关重要。希瓦氏菌胞外电子传递中内膜蛋白CymA、膜周质细胞色素c以及外膜蛋白复合物MtrABC共同实现跨膜电子传递[10]。地杆菌胞外电子传递由内膜蛋白MacA、膜周质细胞色素c以及外膜蛋白复合物(Outer Membrane Protein Complex,OMPC)共同实现。地杆菌细菌中细胞色素c种类更丰富,而且膜蛋白复合物OMPC与MtrABC无同源性,这也表明呼吸型异化铁还原细菌胞外电子传递机制的多样性[11]。
Vecchia等以一株发酵型的异化铁还原菌Desulfotomaculum reducens strain MI-1为研究对象,通过SDS-PAGE及质谱分析研究发现,该菌株没有相关的多血红素细胞色素c参与电子传递[12]。这是关于发酵型异化铁还原细菌胞外电子传递机制的首次报道。Li等研究发酵型异化铁还原细菌Anoxybacter fermentans DY22613T,发现该菌株基因组序列无编码细胞色素c的基因,通过SDS-PAGE和细胞色素c的生化检测均未检测到细胞色素c,这表明发酵型异化铁还原细菌胞外电子传递过程可能缺少细胞色素c;而且发酵型菌株DY22613T属于革兰氏阳性菌,具有很厚的细胞壁,电子在传递过程中如何跨越细胞壁的机理还不清楚[13]。这意味着发酵型异化铁还原细菌胞外电子传递过程不同于呼吸型异化铁还原细菌。
梭菌Clostridium是一类重要的厌氧发酵产氢菌,典型的产氢梭菌有C. pasteurianum和C. butyricum等[14-15]。其中一些梭菌属细菌不仅能够厌氧发酵产氢,还能同时异化还原Fe(III)。Park等[16]研究发现产氢模式菌株C. butyricum同时还具有还原无定形水铁矿中Fe(III)的能力。张月超等[6]研究发现梭菌C. bifermentans EZ-1具有同时异化铁还原与产氢性质。同样地,梭菌C. beijerinckii JX1-25在葡萄糖为电子供体、氢氧化铁为电子受体的异化铁还原培养体系中,异化铁还原累积产生Fe(II)浓度为481.83 mg/L,氢气量为5.88 kPa[17]。菌株C. butyricum以氧化铁为电子受体的异化铁还原过程累积产氢量可达2.20 mol/mol葡萄糖[18]。由此可见,分析梭菌属菌株异化铁还原及产氢特性,有助于加深对发酵型异化铁细菌胞外电子传递机制的认识。
本研究从渤海沉积物中分离出一株发酵型异化铁还原细菌Clostridium sp. LQ25,并对其异化铁还原和产氢效率进行分析,以期为研究发酵型异化铁还原细菌胞外电子传递机制提供新的选择。
1 材料与方法 1.1 样品来源海洋沉积物取自渤海天津海域(116°E,38°N)。10 g沉积物于80 ℃热休克预处理10 min,再将沉积物加到含100 mL富集培养基的血清瓶中,充氮气5 min,密封瓶口,30 ℃、120 r/min摇床培养72 h。取5 mL细菌悬浊液接种到100 mL富集培养基中,如上摇床培养72 h,此步骤重复3次。富集培养基(g/L):葡萄糖20.0,胰蛋白胨1.0,NaCl 30.0,K2HPO4 1.5,L-半胱氨酸0.5,人工合成Fe(OH)3 20.0。
1.2 菌株的分离与鉴定采用三层平板法分离菌株,即在第1层固体培养基划线接种,再倒入琼脂用于隔离氧气,待第2层固体冷却凝固,最后倒入一层灭菌固体石蜡,作为第3层平板,以保证厌氧环境。30 ℃培养48 h,平板长出菌落时,挑取第1层平板有透明圈(或颜色变淡)且第3层石蜡发生鼓起的单菌落。单菌落转接到厌氧螺口管(内含发酵管)中,30 ℃培养24 h。铁还原能力的初步判断是通过培养基颜色的变化,选取培养基颜色变浅的菌株,测定液体培养基中Fe(II)浓度。产气情况是利用发酵管内气泡进行判断,如果观察到发酵管内有气泡,就表明该菌株有产气行为,气泡大小则可以判定菌株的产气能力。选取液体培养基中Fe(II)浓度高且同时发酵管内含有气泡的菌株,将它们分别接种固体培养基,通过三层平板法进行培养和再分离,重复此过程3−5次,筛选一株同时产氢与异化铁还原细菌,命名为LQ25。
利用普通光学显微镜和扫描电镜对菌株进行形态观察并初步鉴定。采用16S rRNA基因序列分析在分子生物学水平上对菌株进行分类鉴定。采用细菌基因组DNA提取试剂盒提取基因组DNA作为模板进行16S rRNA基因的扩增,PCR扩增引物采用细菌通用引物27F (5′-AGAGTTTGATCCAT GGCTCAG-3′)和1541R (5′-AAGGAGGTGATCCA GCC-3′)。PCR反应体系:10×PCR Buffer 5 µL,引物27F和引物1541R (10 µmol/L)各1 µL,dNTPs (10 mmol/L) 1 µL,DNA模板1 µL,Taq酶(5 U/µL) 1 µL,超纯水40 µL。PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR扩增产物由北京奥科生物工程技术服务有限公司进行测序。在NCBI (http://www.ncbi.nlm.nih.gov/blast)中进行核酸序列的比对,并在MEGA 6.0软件中用Neighbor-Joining法构建系统进化树,Bootstrap选择1 000次。
1.3 菌株Fe(III)还原性质菌株生长曲线测定分别在未添加氢氧化铁和添加氢氧化铁2种培养条件下进行,30 ℃、120 r/min厌氧培养36 h内间隔6 h取样,测定菌液在600 nm处光吸收值。菌株在不同电子供体培养条件下的生长和异化铁还原效率测定,是在Fe(OH)3为电子受体的异化铁培养体系中,设置葡萄糖、乳酸钠、丙酮酸钠、乙酸钠和甲酸钠5种电子供体,以葡萄糖(20 g/L)为固定含碳量标准,其他电子供体按等摩尔碳换算。培养基其他成分相同:胰蛋白胨1.0 g/L,NaCl 30 g/L,K2HPO4 1.5 g/L。菌株LQ25按相同接种比例分别培养于含不同电子供体的培养基中。充氮气5 min,保证血清瓶内无氧培养环境,30℃、120 r/min厌氧培养结束后,测定菌体生长OD600、菌体蛋白质浓度和Fe(II)浓度,分析电子供体对菌株LQ25异化铁还原性质的影响。
1.4 菌株产氢性质菌株厌氧发酵产氢培养体系同异化铁培养体系,即培养基成分和培养条件相同。葡萄糖、乳酸钠、丙酮酸钠、乙酸钠和甲酸钠分别为电子供体,Fe(OH)3为电子受体。厌氧条件培养结束时,采用排水法收集气体。测定菌株LQ25的产氢量和液相发酵产物,分析电子供体对菌株LQ25产氢性质的影响。
1.5 分析方法菌株生长是通过分光光度计测定细菌培养液在600 nm吸收值来表示。pH值采用酸度计测量。Fe(III)还原效率采用邻菲啰啉分光光度法测定培养液OD510并计算Fe(II)浓度来表示,具体步骤参考文献[19]:吸取1 mL培养液,置于4 mL 0.5 mol/L盐酸溶液中,在30℃下静置浸提24 h,3 000×g离心5 min,取100 μL上清液与10%盐酸羟胺、1 mol/L乙酸-乙酸钠溶液(pH 5.0)和0.1%邻菲啰啉混合,然后加蒸馏水定容至5 mL。
氢气含量采用气相色谱仪测定,反应条件:分子筛(60/80目),柱长2 m,以氮气作为载气,流速30 mL/min;柱温和进样器温度分别为40 ℃和250 ℃;检测器为TCD,温度200 ℃。产氢量=根据排水法收集的气体总量×氢气含量。发酵产物分析测定利用气相色谱质谱仪GC-2010,色谱柱:HP-FFAP毛细管分析柱(30 m×0.53 mm,膜厚1.0 μm);载气是N2,10 mL/min;检测器是FID;柱箱初始温度为40 ℃,恒温3 min后,以20 ℃/min的速率升温至220 ℃。
2 结果与分析 2.1 菌株鉴定在扫描电子显微镜下观察,菌株LQ25呈梭杆状,长4.5 µm−5.0 µm (图 1)。革兰氏染色呈阳性,单菌落形态呈圆形。16S rRNA基因序列测定结果是基因片段长度为1 441 bp。GenBank登录号为MK156151。选取相似性较高的序列以及典型异化铁还原和产氢梭菌的16S rRNA基因序列,采用BLAST和ClustalW程序与选取的16S rRNA基因序列进行比对分析,并构建系统发育树(图 2)。结果显示菌株LQ25与C. butyricum相似性达到100%,处于同一分支上。结合形态观察和16S rRNA基因序列分析,菌株鉴定为Clostridium sp. LQ25。

|
| 图 1 菌株LQ25扫描电镜图像 Figure 1 The scanning electronic microscopy of Clostridium sp. LQ25 |
|
|

|
| 图 2 基于16S rRNA基因序列构建的菌株LQ25系统发育树 Figure 2 Neighbor-joining phylogenetic tree based on 16S rRNA gene fragments of strain LQ25 注:括号中序号表示对应菌株的GenBank登录号;分支点上的数字表示不同支在进化学上的亲缘关系;距离标尺表示序列间差异数值的单位长度 Note: The serial number in brackets indicates the GenBank number of the corresponding strains; Numbers on the branching points indicate the evolutionary relationships of different branches; The distance scale represents the unit length of the difference between sequences |
|
|
在葡萄糖、乳酸钠、丙酮酸钠、乙酸钠和甲酸钠分别为电子供体培养条件下,菌株LQ25细胞生长和蛋白质含量见图 3。在利用葡萄糖和丙酮酸钠为电子供体时,菌株细胞生长效率较高,其菌体蛋白质含量分别达到(73.18±3.11) mg/L和(78.88±3.40) mg/L。菌株LQ25在葡萄糖和丙酮酸钠电子供体组之间蛋白质含量无显著差异(P > 0.05)。菌株在以乳酸钠为电子供体时生长缓慢,OD600为0.53±0.01,蛋白质浓度是(10.10±0.85) mg/L。菌株对丁酸钠、乙酸钠和甲酸钠的利用有限,OD600基本都在0.10左右,蛋白质浓度都不及5.00 mg/L。电子供体种类,如葡萄糖、丙酮酸钠、乳酸钠、乙酸钠和甲酸钠对菌株LQ25生长的影响具有极显著差异(P < 0.01)。
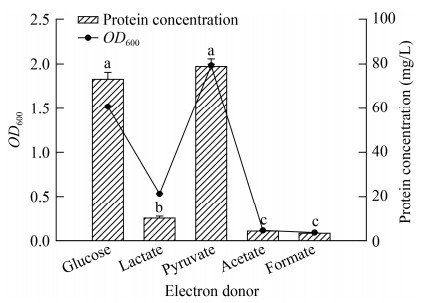
|
| 图 3 菌株LQ25利用电子供体生长情况 Figure 3 The cell growth of Clostridium sp. LQ25 using different electron donors 注:不同小写字母表示存在显著性差异,下同 Note: Different lowercase letters indicate significant differences, the same below |
|
|
氢氧化铁为电子受体,不同电子供体对菌株LQ25异化铁还原性质影响见图 4。菌株LQ25利用葡萄糖及丙酮酸钠为电子供体累积产生的Fe(II)浓度分别是(6.86±0.09) mg/L和(8.27±0.23) mg/L。菌株LQ25还原Fe(III)累积产生的Fe(II)浓度在以葡萄糖和丙酮酸钠为电子供体组之间存在显著差异(P < 0.05),这表明异化铁还原细菌LQ25能够以葡萄糖和丙酮酸钠为电子供体进行异化Fe(III)还原。乳酸钠作为电子供体时,菌株还原Fe(III)效率较低,累积Fe(II)浓度为(1.56±0.3) mg/L,极显著低于葡萄糖和丙酮酸钠电子供体组(P < 0.01)。菌株不能利用乙酸钠和甲酸钠为电子供体还原Fe(III)。在设置的5种电子供体中,电子供体种类对菌株铁还原性质的影响具有极显著差异(P < 0.01)。
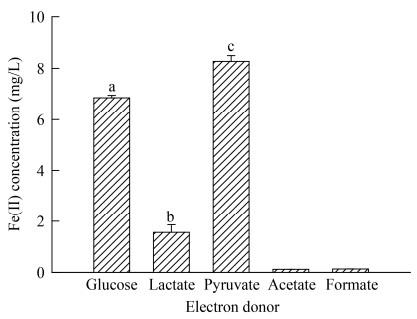
|
| 图 4 电子供体对菌株LQ25异化铁还原的影响 Figure 4 The effect of electron donors on Fe(III) reduction by strain LQ25 |
|
|
在异化铁培养体系中,电子供体对菌株LQ25发酵产氢的影响见图 5。菌株LQ25能够利用葡萄糖和丙酮酸钠作为底物发酵产氢,产氢量分别为(475.2±14.4) mL/L和(386.2±12.3) mL/L。葡萄糖和丙酮酸钠电子供体组相比较,菌株发酵产氢量在葡萄糖电子供体组要显著高于丙酮酸钠电子供体组(P < 0.01)。厌氧培养条件下,细菌发酵葡萄糖过程中pH值下降,这是由于在发酵产物中产生较多小分子有机酸[20],而细菌发酵产氢一般在酸性条件下进行。因此,在葡萄糖为电子供体时菌株具有较高产氢量。菌株利用乳酸钠为电子供体时产氢效率不高,产氢量只有(44.3±1.3) mL/L。菌株无法利用甲酸钠和乙酸钠作为底物发酵产氢。显著性分析结果是电子供体种类对菌株产氢的影响具有极显著差异(P < 0.01)。
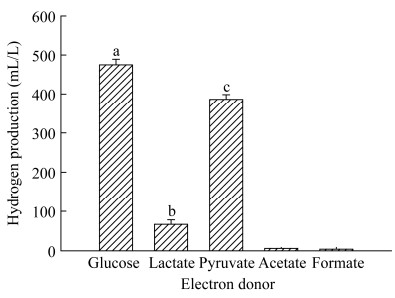
|
| 图 5 电子供体对菌株LQ25发酵产氢量的影响 Figure 5 The effect of electron donors on hydrogen production by strain LQ25 |
|
|
此外,研究结果显示,相比较单纯利用葡萄糖的产氢量(253.3±14.3) mL/L,在氢氧化铁为电子受体和葡萄糖为电子供体异化铁培养体系中,菌株LQ25的产氢量提高87.7%。同样地,相较于单纯利用丙酮酸钠的产氢量(222.6±7.8) mL/L,在氢氧化铁为电子受体和丙酮酸钠为电子供体异化铁培养体系中,菌株LQ25的产氢量提高73.7%。菌株LQ25在异化铁还原培养体系中的产氢量有极显著性提高(P < 0.01)。
2.5 菌株发酵产物在葡萄糖和丙酮酸钠为电子供体时,菌株LQ25具有异化铁还原和产氢的能力。在这2种电子供体培养条件下,菌株发酵产物组成见表 1。葡萄糖为电子供体的异化铁培养体系中菌株的发酵产物主要是丁酸和乙酸,丁酸浓度是420.7 μL/mL,乙酸浓度是13.8 μL/mL,表现为典型的丁酸型发酵。丙酮酸钠为电子供体时,发酵液组分中只有乙酸,浓度是64.3 μL/mL,未检测出丁酸。
| Electron donor | Butyrate (μL/mL) | Acetate (μL/mL) |
| Glucose | 420.7 | 13.8 |
| Pyruvate | − | 64.3 |
| 注:−:未检出 Note: −: Not detected | ||
菌株LQ25在含氢氧化铁和不含氢氧化铁2种培养条件下,细胞生长具有显著性差异(P < 0.01)。菌株LQ25在添加氢氧化铁电子受体时,生长稳定期最高OD600是1.519 5±0.01,蛋白质含量为(73.18±3.11) mg/L。相比对照组(未添加氢氧化铁),菌株LQ25在异化铁培养条件下细胞生长显著提高。Beckers等研究发现,铁还原过程促进菌株BS2细胞生长,添加Fe(III)可促进细胞密度由1.8×108个/mL提高至2.6×108个/mL[18]。由此可见,异化铁培养体系下菌株Fe(III)还原过程能够促进细胞生长。然而Zhou等研究发现菌株Klebsiella sp. FD-3细胞生物量从0.10 g/L提高到0.15 g/L (细胞干重),与之相关联的是Fe(III)从10 mmol/L降低到9.2 mmol/L;当细胞生长量累积到0.27 g/L (细胞干重)时,则伴随着Fe(III)浓度明显降低至4.76 mmol/L,这表明Fe(III)还原过程影响菌株Klebsiella sp. FD-3的细胞生长[21]。
葡萄糖为电子供体时,菌株LQ25在厌氧发酵过程中能产生丁酸和乙酸等中间产物,表现为典型的丁酸发酵型,而丙酮酸钠为电子供体时,菌株发酵液检测出乙酸。乙酸和丁酸含量能在一定程度上反映菌株发酵代谢类型以及异化铁还原细菌胞外电子传递状态[22]。由此可见,菌株LQ25是一株发酵型异化铁还原细菌。相比呼吸型异化铁还原细菌,目前尚无公认的关于发酵型异化铁还原细菌研究的模式菌,这可能是由于发酵型异化铁还原细菌种属多样性高。已报道发酵型异化铁还原细菌有Rhizomicrobium palustre、Comamonas koreensis、Klebsiella pneumonia、Caloranaerobacter ferrireducens、Calculibacillus koreensis和Bacillus sp.等,分离菌株的来源包括有水稻土、森林土壤、微生物燃料电池、深海热液口区、矿山沉积物以及盐滩沉积物等[23-28]。菌株LQ25分离自海洋沉积物,菌株鉴定并命名为Clostridium sp. LQ25。海洋沉积物的特殊厌氧环境有利于富集异化铁还原细菌,继续广泛筛选发酵型异化铁还原细菌不仅拓宽了异化铁还原细菌种质资源,也是揭示发酵型异化铁还原细菌还原机制的重要途径。
氢气是梭菌(Clostridium)发酵代谢的中间产物,同时也是能量代谢的电子载体,发酵产氢是一种胞外电子传递方式。C. butyricum在生物制氢研究中是典型的厌氧发酵产氢细菌,例如C. butyricum CWBI1009[29]、C. butyricum NRRL B-41122[30]和C. butyrium[31],利用葡萄糖产氢量分别是1.43 mol H2/mol葡萄糖、17.44 H2/L、2.02 mol H2/mol葡萄糖。相比这些产氢菌株,菌株LQ25产氢量相对较低,一方面可能是由于本研究所选用培养基成分比较简单,未添加微量元素和维生素等;另一方面菌株分离自海洋沉积物,培养基盐度设置较高,达到30。
在氢氧化铁和葡萄糖异化铁培养条件下,菌株LQ25累积产氢量为(475.2±14.4) mL/L,相比对照组(未添加氢氧化铁)的产氢量(253.3±14.3) mL/L提高了87.7%。菌株LQ25具有异化铁还原和发酵产氢能力,在异化铁培养条件下菌株发酵产氢量极显著提高(P < 0.01),这表明Fe(III)的添加促进了菌株电子传递产生氢气的过程。张月超等研究发现,添加铁氧化物可以提高发酵产氢梭菌C. pasteurianum产氢量1.8倍[6]。添加氢氧化铁条件下,梭菌C. saccarobutylicum BS2发酵葡萄糖的产氢量相比对照组(未添加氢氧化铁)提高3倍[32]。添加铁氧化物,菌株C. butyricum利用葡萄糖发酵的产氢速率相比对照组(未添加铁氧化物)提高38%[18]。Han等研究表明,异化铁还原过程产生Fe(II),通过提高产氢细菌氢酶活性从而提高产氢量[33]。Seelert等研究认为是由于铁氧化物具有导电性,其可以充当电子载体提高电子传递效率,从而提高产氢量[34]。目前关于添加Fe(III)促进细菌发酵产氢的机理还需要进一步揭示。然而这种兼具产氢及异化铁还原的多功能梭菌为研究发酵型细菌胞外电子传递机制提供了选择,同时也可以作为发酵型异化铁还原细菌研究的候选模式菌。
本研究从海洋沉积物中筛选得到一株革兰氏阳性细菌Clostridium sp. LQ25。菌株LQ25具有异化铁还原和发酵产氢能力,属于发酵型异化铁还原细菌。菌株LQ25能够利用氢氧化铁为电子受体,在丙酮酸钠、葡萄糖和乳酸钠等不同电子供体条件下进行厌氧生长、异化铁还原及发酵产氢。丙酮酸钠为电子供体时,菌株LQ25细胞生长和异化铁还原效率显著高于其他电子供体组。菌株LQ25在葡萄糖为电子供体时发酵产氢量最高,极显著高于其他电子供体组,同时比对照组(未添加氢氧化铁)的产氢量提高87.7%。虽然相比已报道具有异化铁还原能力的产氢梭菌,菌株LQ25的异化铁还原效率和产氢量相对较弱,但由于该菌株分离自海洋沉积物,为模拟海水培养盐度,培养条件的盐度设置比较高。本实验结果拓宽了发酵型异化铁还原细菌的研究范围,为深化认识发酵型异化铁还原细菌胞外电子传递机制提供了新的选择。
| [1] |
Si YB, Wang J. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil[J]. Environmental Science, 2015, 36(9): 3533-3542. (in Chinese) 司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 2015, 36(9): 3533-3542. |
| [2] |
Aeschbacher M, Brunner SH, Schwarzenbach RP, Sander M. Assessing the effect of humic acid redox state on organic pollutant sorption by combined electrochemical reduction and sorption experiments[J]. Environmental Science & Technology, 2012, 46(7): 3882-3890. |
| [3] |
Wu K, Yang YR, Zhou C, Jiang J, Si YB. Organic acids enhanced and Fe(Ⅲ) reduction mediated sulfamethoxazole degradation by Shewanella oneidensis MR-1[J]. Acta Scientiae Circumstantiae, 2019, 39(7): 2117-2124. (in Chinese) 吴康, 杨玉蓉, 周晨, 蒋瑾, 司友斌. 有机酸强化Fe(Ⅲ)还原介导的Shewanella oneidensis MR-1降解磺胺甲噁唑[J]. 环境科学学报, 2019, 39(7): 2117-2124. |
| [4] |
He YX, Gong YF, Su YM, Zhang YL, Zhou XF. Bioremediation of Cr(VI) contaminated groundwater by Geobacter sulfurreducens: environmental factors and electron transfer flow studies[J]. Chemosphere, 2019, 221: 793-801. DOI:10.1016/j.chemosphere.2019.01.039 |
| [5] |
Si YB, Zou Y, Liu XH, Si XY, Mao JD. Mercury methylation coupled to iron reduction by dissimilatory iron-reducing bacteria[J]. Chemosphere, 2015, 122: 206-212. DOI:10.1016/j.chemosphere.2014.11.054 |
| [6] |
Zhang YC, Xiao LL, Wang OM, Liu FH. Hydrogen-producing and electrochemical properties of a dissimilatory Fe(Ⅲ) reducer Clostridium bifermentans EZ-1[J]. Acta Microbiologica Sinica, 2018, 58(4): 525-537. (in Chinese) 张月超, 肖雷雷, 王欧美, 刘芳华. 异化铁还原梭菌Clostridium bifermentans EZ-1产氢与电化学特性[J]. 微生物学报, 2018, 58(4): 525-537. |
| [7] |
Luu YS, Ramsay JA. Review: microbial mechanisms of accessing insoluble Fe(Ⅲ) as an energy source[J]. World Journal of Microbiology & Biotechnology, 2003, 19(2): 215-225. |
| [8] |
Jones JG, Davison W, Gardener S. Iron reduction by bacteria: range of organisms involved and metals reduced[J]. FEMS Microbiology Letters, 1984, 21(1): 133-136. DOI:10.1111/j.1574-6968.1984.tb00198.x |
| [9] |
Han R. A study on the extracellular electron transfer processes mediated by outer membrane C-type cytochromes of Shewanella oneidensis MR-1[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2016 (in Chinese) 韩蕊. Shewanella oneidensis MR-1外膜细胞色素c介导的胞外电子传递过程研究[D]. 广州: 华南理工大学博士学位论文, 2016 |
| [10] |
Liu PC, Zhu WW, Xiao X. Metabolic networks of electricigens Shewanella for anaerobic respiration[J]. Microbiology China, 2015, 42(11): 2238-2244. (in Chinese) 刘鹏程, 朱雯雯, 肖翔. 产电微生物Shewanella菌厌氧呼吸代谢网络研究进展[J]. 微生物学通报, 2015, 42(11): 2238-2244. |
| [11] |
Jin H, Wang HW. Research progress and environmental effectsEon extracellular electron transfer mechanism[J]. Sichuan Environment, 2020, 39(2): 179-185. (in Chinese) 金辉, 王红武. 胞外电子传递机制及其环境效应研究进展[J]. 四川环境, 2020, 39(2): 179-185. |
| [12] |
Vecchia ED, Suvorova EI, Maillard J, Bernier-Latmani R. Fe(III) reduction during pyruvate fermentation by Desulfotomaculum reducens MI-1[J]. Geobiology, 2014, 12(1): 48-61. DOI:10.1111/gbi.12067 |
| [13] |
Li X, Zeng X, Qiu DH, Zhang Z, Zhang XB, Shao ZZ. Extracellular electron transfer in fermentative bacterium Anoxybacter fermentans DY22613T isolated from deep-sea hydrothermal sulfides[J]. Science of the Total Environment, 2020, 722: 137723. DOI:10.1016/j.scitotenv.2020.137723 |
| [14] |
Jiang L, Wu Q, Xu Q, Zhu LY, Huang H. Fermentative hydrogen production from Jerusalem artichoke by Clostridium tyrobutyricum expressing exo-inulinase gene[J]. Scientific Reports, 2017, 7: 7940. DOI:10.1038/s41598-017-07207-7 |
| [15] |
Masset J, Calusinska M, Hamilton C, Hiligsmann S, Joris B, Wilmotte A, Thonart P. Fermentative hydrogen production from glucose and starch using pure strains and artificial co-cultures of Clostridium spp.[J]. Biotechnology for Biofuels, 2012, 5(1): 1-15. DOI:10.1186/1754-6834-5-1 |
| [16] |
Park HS, Kim BH, Kim HS, Kim HJ, Kim GT, Kim M, Chang IS, Park YK, Chang HI. A novel electrochemically active and Fe(III)-reducing bacterium phylogenetically related to Clostridium butyricum isolated from a microbial fuel cell[J]. Anaerobe, 2001, 7(6): 297-306. DOI:10.1006/anae.2001.0399 |
| [17] |
You P, Jia R, Qiao SS, Qu D. Effect of carbon source concentrations on microbial hydrogen production and Fe(Ⅲ) reduction[J]. Journal of Agro-Environment Science, 2015, 34(4): 722-727. (in Chinese) 游萍, 贾蓉, 乔莎莎, 曲东. 碳源浓度对微生物发酵产氢及铁还原特征的影响[J]. 农业环境科学学报, 2015, 34(4): 722-727. |
| [18] |
Beckers L, Hiligsmann S, Lambert SD, Heinrichs B, Thonart P. Improving effect of metal and oxide nanoparticles encapsulated in porous silica on fermentative biohydrogen production by Clostridium butyricum[J]. Bioresource Technology, 2013, 133: 109-117. DOI:10.1016/j.biortech.2012.12.168 |
| [19] |
Liu HY, Wang S. Characteristics of chromate reduction by Fe(Ⅲ) reduction using mixed bacteria from marine sediment[J]. Marine Sciences, 2019, 43(5): 19-26. (in Chinese) 刘洪艳, 王珊. 海洋沉积物中异化铁还原细菌还原重金属Cr(Ⅵ)研究[J]. 海洋科学, 2019, 43(5): 19-26. |
| [20] |
Sun QM, Liu W, Yao H. Enterococcus faecium reduces agar gelatination via generating organic acids[J]. Chinese Journal of Microecology, 2018, 30(11): 1252-1257. (in Chinese) 孙青民, 刘威, 姚红. 屎肠球菌产生有机酸降低琼脂胶凝作用[J]. 中国微生态学杂志, 2018, 30(11): 1252-1257. |
| [21] |
Zhou ZM, Jing GH, Zheng XJ. Reduction of Fe(III) EDTA by Klebsiella sp. strain FD-3 in NOx scrubber solutions[J]. Bioresource Technology, 2013, 132: 210-216. DOI:10.1016/j.biortech.2013.01.022 |
| [22] |
Zhang YC. Extracellular electron transfer mechanisms of hydrogen-producing Clostridium mediated by iron oxide minerals[D]. Yantai: Master's Thesis of Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, 2018 (in Chinese) 张月超. 铁氧化物介导的产氢梭菌胞外电子传递机制[D]. 烟台: 中国科学院大学(中国科学院烟台海岸带研究所)硕士学位论文, 2018 |
| [23] |
Ueki A, Kodama Y, Kaku N, Shiromura T, Satoh A, Watanabe K, Ueki K. Rhizomicrobium palustre gen. nov., sp. nov., a facultatively anaerobic, fermentative stalked bacterium in the class Alphaproteobacteria isolated from rice plant roots[J]. The Journal of General and Applied Microbiology, 2010, 56(3): 193-203. DOI:10.2323/jgam.56.193 |
| [24] |
Wu CY, Zhuang L, Zhou SG, Li FB, Li XM. Fe(III)-enhanced anaerobic transformation of 2, 4-dichlorophenoxyacetic acid by an iron-reducing bacterium Comamonas koreensis â CY01[J]. FEMS Microbiology Ecology, 2010, 71(1): 106-113. DOI:10.1111/j.1574-6941.2009.00796.x |
| [25] |
Yuvraj C, Aranganathan V. Enhancement of voltage generation using isolated dissimilatory iron-reducing (DIR) bacteria Klebsiella pneumoniae in microbial fuel cell[J]. Arabian Journal for Science and Engineering, 2017, 42(1): 65-73. DOI:10.1007/s13369-016-2108-4 |
| [26] |
Li X, Zeng X, Zhang Z, Shao ZZ. Characteristics of different iron oxides reduction by a thermophilic dissimilatory iron reducing bacterium Caloranaerobacter ferrireducens DY22619T from deep sea[J]. Haiyang Xuebao, 2016, 38(8): 82-91. (in Chinese) 李曦, 曾湘, 张昭, 邵宗泽. 深海嗜热异化铁还原菌Caloranaerobacter ferrireducens DY22619T对不同铁氧化物的铁还原特性[J]. 海洋学报, 2016, 38(8): 82-91. |
| [27] |
Min UG, Kim SJ, Hong H, Kim SG, Gwak JH, Jung MY, Kim JG, Na JG, Rhee SK. Calculibacillus koreensis gen. Nov., sp. nov., an anaerobic Fe(III)-reducing bacterium isolated from sediment of mine tailings[J]. Journal of Microbiology, 2016, 54(6): 413-419. DOI:10.1007/s12275-016-6086-8 |
| [28] |
Pollock J, Weber KA, Lack J, Achenbach LA, Mormile MR, Coates JD. Alkaline iron(III) reduction by a novel alkaliphilic, halotolerant, Bacillus sp. isolated from salt flat sediments of Soap Lake[J]. Applied Microbiology and Biotechnology, 2007, 77(4): 927-934. DOI:10.1007/s00253-007-1220-5 |
| [29] |
Hamilton C, Calusinska M, Baptiste S, Masset J, Beckers L, Thonart P, Hiligsmann S. Effect of the nitrogen source on the hydrogen production metabolism and hydrogenases of Clostridium butyricum CWBI1009[J]. International Journal of Hydrogen Energy, 2018, 43(11): 5451-5462. DOI:10.1016/j.ijhydene.2017.12.162 |
| [30] |
Pachapur VL, Sarma SJ, Brar SK, Bihan YL, Buelna G, Verma M. Hydrogen production from biodiesel industry waste by using a co-culture of Enterobacter aerogenes and Clostridium butyricum[J]. Biofuels, 2017, 8(6): 651-662. DOI:10.1080/17597269.2015.1122471 |
| [31] |
Jiang D, Fang Z, Chin SX, Tian XF, Su TC. Biohydrogen production from hydrolysates of selected tropical biomass wastes with Clostridium butyricum[J]. Scientific Reports, 2016, 6: 27205. DOI:10.1038/srep27205 |
| [32] |
Lehours AC, Rabiet M, Morel-Desrosiers N, Morel JP, Jouve L, Arbeille B, Mailhot G, Fonty G. Ferric iron reduction by fermentative strain BS2 isolated from an iron-rich anoxic environment (Lake Pavin, France)[J]. Geomicrobiology Journal, 2010, 27(8): 714-722. DOI:10.1080/01490451003597663 |
| [33] |
Han HL, Cui MJ, Wei LL, Yang HJ, Shen JQ. Enhancement effect of hematite nanoparticles on fermentative hydrogen production[J]. Bioresource Technology, 2011, 102(17): 7903-7909. DOI:10.1016/j.biortech.2011.05.089 |
| [34] |
Seelert T, Ghosh D, Yargeau V. Improving biohydrogen production using Clostridium beijerinckii immobilized with magnetite nanoparticles[J]. Applied Microbiology and Biotechnology, 2015, 99(9): 4107-4116. DOI:10.1007/s00253-015-6484-6 |
 2021, Vol. 48
2021, Vol. 48




