扩展功能
文章信息
- 陈冰清, 葛艳, 司伏生, 董世娟, 李震
- CHEN Bingqing, GE Yan, SI Fusheng, DONG Shijuan, LI Zhen
- 猪流行性腹泻病毒诱导的猪肠道-乳腺-sIgA轴以及免疫机制探讨
- Gut-mammary-sIgA axis and immunologic mechanisms induced by porcine epidemic diarrhea virus
- 微生物学通报, 2021, 48(11): 4240-4249
- Microbiology China, 2021, 48(11): 4240-4249
- DOI: 10.13344/j.microbiol.china.210041
-
文章历史
- 收稿日期: 2021-01-14
- 接受日期: 2021-05-05
- 网络首发日期: 2021-08-12
2. 同济大学医学院 上海 200092
2. Tongji University School of Medicine, Shanghai 200092, China
猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus,PEDV)为猪流行性腹泻(Porcine Epidemic Diarrhea,PED)的病原,属于冠状病毒科α冠状病毒属,引起感染猪以水样腹泻为主要症状的高度传染性疾病。新生仔猪的免疫系统未发育成熟,感染PEDV后会出现严重的急性腹泻、呕吐和脱水,死亡率高。
“肠道-乳腺-sIgA轴”理论主要来源于猪传染性胃肠炎(Transmissible Gastroenteritis,TGE)的防控实践。前期关于TGE的病原体猪传染性胃肠炎病毒(Transmissible Gastric Enteritis Virus,TGEV)的研究表明,自然感染TGEV的母猪哺乳新生仔猪,可以使仔猪获得被动免疫保护,对仔猪的保护率是85%,而通过实验感染TGEV强毒的母猪所产仔猪的保护率是98.3%[1],仔猪保护主要与初乳和常乳中高的sIgA抗体有关。系统免疫的母猪初乳中主要是IgG抗体,而在常乳中IgG抗体迅速降低,导致对仔猪提供很少的保护[2-3],研究人员因此提出了“肠道-乳腺-sIgA轴”免疫概念,即TGEV感染肠道细胞后,激活IgA浆母细胞;分泌IgA的浆细胞可以归巢到肠黏膜固有层和乳腺,在此分泌sIgA。因TGEV与PEDV同属α冠状病毒,可引起类似的腹泻症状,研究人员推测“肠道-乳腺-sIgA轴”的免疫通路同样适用于PEDV。
PEDV诱发的“肠道-乳腺-sIgA轴”反应是一个有机整体,即从病毒入侵感染肠道上皮细胞开始,直到乳腺组织内浆细胞合成分泌sIgA[4]。这个过程涉及抗原提呈、宿主天然免疫、淋巴细胞激活、分化、成熟、归巢和sIgA合成分泌等,本文将分步解析整个反应过程的机理模式和特点,为将该理论应用于PED疫苗设计提供参考。
1 PEDV感染肠道上皮细胞后的抗原提呈虽然PEDV的细胞受体是最近几年的研究热 点[5],但目前关于该病毒侵染过程以及抗原提呈的研究非常有限。感染性的PEDV病毒粒子到达母猪肠道后,会穿过肠黏液层与肠上皮细胞受体结合。肠黏液层是由肠道上皮杯状细胞释放的黏蛋白溶解于肠液形成,其形成和存在本身是个动态过程。PEDV如何突破宿主肠道上皮细胞表面的肠黏液保护屏障?PEDV可以感染杯状细胞并使其黏蛋白合成分泌功能降低,导致肠道黏液层保护作用降低,从而使其他肠道病原容易侵害肠道上皮细胞[6]。另外,也有人发现,感染PEDV导致肠绒毛变短,酸性黏蛋白含量下降,跨肠上皮电阻降低[7]。但这些都是PEDV感染结果,而非造成PEDV感染原因。推测黏液层对PEDV病毒粒子可能不构成障碍,因黏液层主要是保护肠道上皮免受胃酸或胰酶等理化因素的侵蚀,而对于病毒或细菌的防御作用很小。因此,病毒粒子能够穿过黏液层直接与肠上皮细胞的受体结合,并不需要突破特别的保护机制。
PEDV感染诱发的“肠道-乳腺-sIgA轴”作用 第一步是有效的抗原提呈,该步是宿主启动免疫预警机制以及产生有效的免疫反应的关键。此过程离不开肠道黏膜部位的抗原递呈细胞。研究表明,树突状细胞(Dendritic Cell,DC)参与抗原提呈,而且研究者也基于DC细胞进行了相关疫苗的设计;DC细胞是猪肠道黏膜最有效的抗原提呈细胞,它们广泛分布于猪肠道黏膜下[8],可以将突触从肠上皮细胞间穿过进入肠腔内直接获取抗原或通过M细胞传递在肠派尔集合淋巴结上皮下穹隆中获取抗原[5],也可以处理进入凋亡状态的肠道上皮细胞中的病毒抗原成分[9]。Gao等研究发现,仔猪肠道感染经典弱毒株CV777后,肠道DC细胞摄取的抗原量上升并在体内活化T淋巴细胞增殖[10]。Li等研究发现,经细胞传代的PEDV流行毒株接种猪可以激活DC细胞[11]。这些研究表明DC细胞是PEDV感染过程中宿主特异性免疫的抗原提呈细胞。因此,为增加抗原提呈的有效性,有学者把抗原表位序列与DC细胞或M细胞靶向的多肽(DC/M Cells-Targeted Peptide)基因连接,利用益生菌表达该融合基因获得了较理想的免疫效果[12-13]。但Subramaniam等研究发现,此类疫苗免疫母猪虽然可以减少仔猪排毒,却加重了仔猪肠道的病理损伤[14]。
除DC细胞外,是否其他淋巴细胞也作为抗原提呈细胞参与了PEDV特异性免疫反应的建立,如巨噬细胞、细胞毒性T细胞甚至B细胞。这方面问题还需更多的研究进行证实。
2 淋巴细胞激活及免疫反应体液免疫和细胞免疫产生的中心环节是辅助性T细胞(Th细胞)的活化和克隆增殖。T细胞受 体-共受体(TCR-CD3)复合物与存在于抗原递呈细胞表面并与MHC-II类分子结合的抗原肽之间的相互作用介导了Th细胞活化。Th细胞与抗原肽的相互作用可激发级联式的生化反应,诱导静止的Th细胞进入细胞周期,最终表达高亲和力的IL-2受体和分泌IL-2。在IL-2作用下,进入细胞周期的Th细胞通过增殖和分化成效应性T细胞(细胞毒性T细胞CTL和迟发型变态反应性T细胞TDTH),发挥细胞免疫效应。其中一部分T细胞停留在分化中间阶段,成为记忆性T细胞[15]。由于Th细胞对 B细胞活化的辅助作用,T细胞对体液免疫效应的发挥同样重要。
前文已述及:仔猪肠道感染PEDV弱毒后,肠道DC细胞摄取抗原量上升并活化T细胞增殖[10]。有研究表明,与肌肉注射和鼻腔免疫途径相比,口服免疫产生的CD3+/CD8+ T细胞比例更高[16]。因CD8+ T细胞可以杀灭病毒感染的细胞,据此推测,口服免疫PEDV比其他免疫途径有优势。此外T细胞对于初生仔猪被动免疫也有一定意义。初生仔猪肠道上皮细胞不仅可以转运抗体,甚至可以转运初乳中的淋巴细胞,使其进入仔猪的肠系膜淋巴结或其他组织。初乳中含有大量的淋巴细胞,这些细胞进入仔猪体内后可以提供短时的免疫反应[17]。在乳汁以及仔猪的肠道派尔集合淋巴结都发现了带有肠道归巢标记整合素α4β7和趋化因子受体CCR9的细胞毒性CD8+ T细胞,但在早期“肠道-乳腺-sIgA轴”免疫通路的描述中并未提及T淋巴细胞的作用。
De Arriba等[18]研究发现,用CV777株感染11−12日龄断奶仔猪后4−7 d,在肠系膜淋巴结、十二指肠和空肠的固有层、脾脏等组织,检测到分泌IgM的抗体分泌细胞(Antibody-Secreting Cells,ASCs),其中肠道固有层中含量最高。从感染后21 d开始,小肠淋巴组织中检测到IgG和IgA的ASCs,其中十二指肠中IgG ASCs最多,为 每5×105单核细胞(Mononuclear Cells,MNC)中23.5个。小肠淋巴细胞中的IgA ASCs数量总体远少于IgG ASCs,IgA ASCs数量在十二指肠中最多,回肠中最少(在感染后第25天,回肠中每5×105 MNC少于1个IgA ASCs)。该研究中血清IgA比IgG产生的量少而且维持时间短[18]。血清中IgA的作用以及在怀孕母猪体内与乳腺免疫的相关性还有待进一步研究。
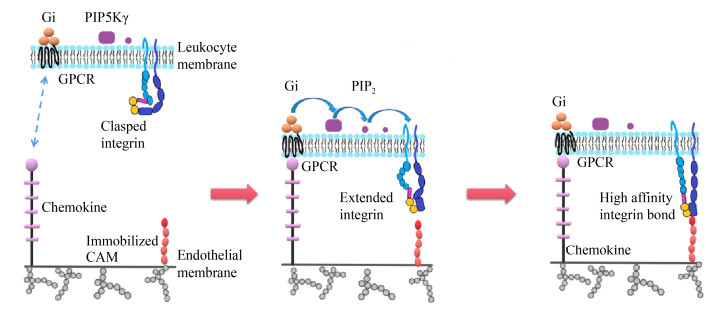
3 怀孕期母猪淋巴细胞归巢至肠道和乳腺的影响因素初始B淋巴细胞和T淋巴细胞分别来自骨髓及胸腺,并在血液和次级淋巴组织间循环。在这些淋巴组织中,淋巴细胞担负外来病原入侵警戒和免疫反应的功能,一旦遇到抗原刺激,它们将启动一系列分化成熟的生化反应,包括细胞表面细胞因子受体、归巢受体的表达等。活化后的T、B淋巴细胞会返回血液循环,然后在归巢分子系统的作用下穿过高内皮微静脉(High Endothelial Venules,HEVs)离开微循环,进入肠道固有层或乳腺[19]。T、B淋巴细胞穿越高内皮微静脉是 一个多步过程,涉及淋巴细胞归巢受体和高内皮微静脉上配体的互作[20]。另外,趋化因子受体(Chemoattractant Receptor)需要被趋化因子活化,引导淋巴细胞在剪切流环境里依赖整合素锚定在高内皮微静脉内皮细胞表面,并透过高内皮微静脉渗出进入组织微环境(图1)[21]。
|
| 图 1 淋巴细胞通过趋化因子及整合素与血管内皮细胞膜相互联系模式图 Figure 1 Schematic of leukocyte arresting on vascular endothelium through chemokine and integrin 注:内皮细胞趋化因子与淋巴细胞膜上受体(GPCRs)结合,通过一系列反应启动淋巴细胞膜表面整合素导致空间构象改变,然后整合素与内皮细胞膜表面的配体(固定或溶解状态的CAM)结合(此处CAM为附着分子之一,这类分子还包括VCAM-1、MAdCAM-1等)。只有与固定的CAM作用,淋巴细胞与内皮细胞膜稳定的结合才会发生 Note: First the chemokine expressed by endothelium combines with the receptor GPCR which resides on the leukocyte membrane. The chemokine-receptor combination then triggers a series of process to change the conformation of the leukocyte integrin, and finally the integrin can combine to its ligand (CAM on vascular endothelium), the immobilized state of which can make the arrest of the leukocyte on endothelium stable |
|
|
淋巴细胞和高内皮微静脉表达的归巢分子是决定淋巴细胞向黏膜系统还是外周迁移的关键,因此,了解这项机制对于黏膜免疫的疫苗设计和佐剂选择非常重要。例如:淋巴细胞表面L-选择素(α4β1)、趋化因子受体7 (CCR7)分别与黏附分子1 (VCAM-1)以及趋化因子配体21 (CCL21)相互作用,这一过程决定了淋巴细胞进入外周组织。但淋巴细胞向肠道组织的迁移则需要这些细胞表面的整合素α4β7与肠道相关淋巴组织(Gut-Associated Lymphatic Tissues,GALT)中HEVs上面的黏膜地址素细胞黏附分子1 (MAdCAM-1)相互作用[22]。在肠道的淋巴细胞迁移中,还需要血管内皮表面的趋化因子配体CCL25和CCL28与淋巴细胞的受体CCR9和CCR10分别结合。淋巴细胞进入乳腺组织同样需要CCR10/CCL28相互作 用[23]。对于小鼠、人、猪,CCR10选择性地表达于IgA ASCs,如果给予小鼠CCL28抗体或者敲除CCR10基因,IgA ASCs便不能到达乳腺,表明CCR10/CCL28相互作用对于“肠道-乳腺-sIgA轴”是必不可少的。
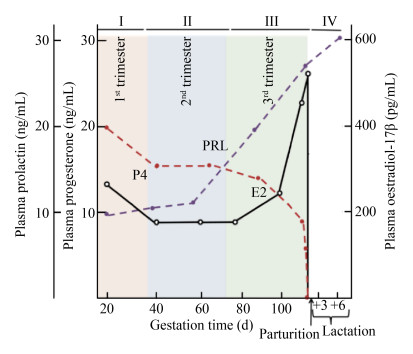
怀孕期母猪血液淋巴细胞归巢受激素、细胞因子甚至营养因子影响。这些因素会通过相关因子表达而影响淋巴细胞表面整合素α4β7、趋化因子受体CCR9、CCR10与内皮细胞表面的MAdCAM-1、CCL25和CCL28相互作用。早期研究显示,怀孕期激素能够影响淋巴细胞从肠道向乳腺转移[24],对卵巢切除的小鼠补充雌激素、孕酮和催乳素可以在乳腺中增加肠系膜淋巴结(Mesenteric Lymph Nodes,MLN)来源的IgA浆母细胞。研究发现,怀孕后期和泌乳期母猪乳腺中CCL28 mRNA量上调,同时乳中出现CCL28蛋白,这与CCL28是猪乳腺中IgA ASCs趋化因子的认识相一致[25-26]。
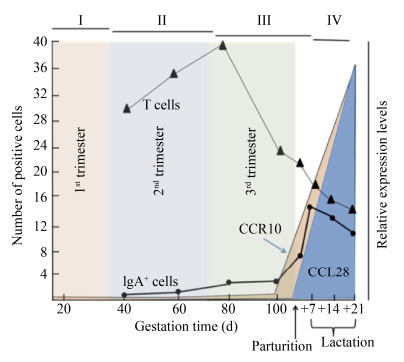
怀孕期母猪血液激素水平有很大变化(图2)[4]。孕酮通常在孕期的前1/3保持高水平;雌激素在后1/3起主导作用;催乳素从妊娠后期开始增加,泌乳期初始阶段达到高峰[27-28]。母猪怀孕后期催乳素和雌激素水平提高与CCR10和CCL28的表达以及乳腺中IgA分泌细胞的数量上升相一致(图3)[5,29],IgA分泌B细胞的动态变化与雌激素和催乳素的变化呈正相关,与孕酮变化呈负相关,但T细胞的动态变化与激素变化之间无明显相关性。虽然乳腺组织抗体分泌细胞的数量变化与这几种孕期激素消长存在一定关系,但这些因子作用的确切时间窗口还有待进一步阐明。近期 一项研究表明,怀孕母猪感染PEDV的具体时间对于乳腺保护性免疫的形成非常重要[30]。
其他影响淋巴细胞归巢的因素:如维生素A可以促进T、B细胞表面α4β7以及趋化因子受体CCR9的表达[31-32]。给感染PEDV的怀孕中期的母猪口服维生素A (30 000 IU/d)可以增加其产前血清中特异的IgA ASCs及IgA抗体,也增加乳中IgAβ7阳性细胞(肠道归巢)[33]。这些研究结果表明,维生素A可以作为增强怀孕母猪针对肠道病原免疫的乳腺免疫佐剂。
由于趋化因子对于淋巴细胞向乳腺组织转移起着至关重要作用,可以利用这一原理设计疫苗或免疫策略以实现淋巴细胞定点归巢乳腺组织并分泌相应抗体。最近,Hsueh等尝试用灭活疫苗结合趋化因子CCL25、CCL27和CCL28免疫5周龄仔猪[34],发现这种组合经肌肉注射有助于注射部位募集携带趋化因子受体CCR9或CCR10的淋巴细胞,显著提高PEDV特异IgG、粪便IgA以及中和抗体水平,并能提供更好的免疫保护,提示这些趋化因子可以作为免疫佐剂用于疫苗设计。这样的设计虽然可以促进淋巴细胞向注射位置募集,但是否能够比对照多诱导IgA产生似乎缺乏现有免疫学理论的支持。有人根据研究结果推测CCL28不仅可以作为趋化因子,而且能够作为共同激活因子(Co-Activator)使募集到注射点部位的淋巴细胞表达CCR10增加,进而使这些细胞能够更加准确地归巢至肠道或乳腺系统[35]。
4 PEDV防控实践的问题及思考“肠道-乳腺-sIgA轴”理论可以很好地解释自然感染状况下的免疫反应及获得的良好保护效应[1,36],但该理论用于指导免疫防控实践却遇到挑战。自然强毒感染情况下,所获得的IgA免疫抗体滴度和活性都比较高,但在弱毒疫苗免疫时往往发现疫苗株毒力过于弱化(多是因为活疫苗安全性考虑),不能给予母猪胃肠道足够的免疫刺 激[37]。在这种情况下,科学研究不得不对弱毒疫苗的设计和作用进行重新研判,同时进一步了解PEDV灭活疫苗及其诱导的抗体的作用。
4.1 PEDV灭活疫苗的保护作用值得重视在灭活疫苗研制遇到困难的情况下,研究者无疑都非常想确认灭活疫苗及其IgG在防控PEDV中的积极作用。PEDV感染仔猪过程中有短时的病毒血症[38-39],血液中IgG如果能中和病毒可以缓解症状,甚至提供完全保护。Poonsuk等通过抗体被动转移仔猪模型研究发现,血液中的IgG能使仔猪获得部分免疫保护,主要表现为PEDV感染后的症状减轻,抗体阳性仔猪体温回复更快,成活率更高[40]。Opriessnig等用PEDV灭活疫苗经肌肉注射接种2周龄断奶仔猪,能诱导产生高水平IgG,对免疫动物产生有效保护[41]。人们据此推断,肌肉注射的PEDV灭活疫苗也有重要的防控作用。我们研究发现,用灭活疫苗免疫怀孕母猪后,其初生仔猪攻毒后比未免疫对照组存活率显著提高,发病症状明显减轻[42]。有研究表明PEDV灭活疫苗免疫母猪,乳汁中能产生IgA但不足以保护仔猪[43]。可见,传统PEDV灭活疫苗能够诱导以IgG为主的抗体反应并提供免疫保护,但免疫保护程度有待更多研究确认。
前文已述及,Hsueh等最近用灭活疫苗结合趋化因子免疫5周龄仔猪[34],不仅诱导产生高水平PEDV特异IgG,而且检测到高水平粪便IgA以及中和抗体,并提供有效免疫保护。因此,用PED灭活疫苗结合趋化因子的新型疫苗愈发受到关注。
4.2 PEDV活疫苗诱导IgG抗体的产生及其作用值得更多关注母猪感染野毒PEDV后不仅可以产生高水平口腔液IgA,而且能够产生高水平IgG[44]。Kao等研究表明,仔猪接种基因工程弱毒株iPEDVPT-P96不仅能够产生IgA,而且能够产生一定水平的IgG[45]。这些研究进一步说明淋巴细胞接受PEDV活疫苗胃肠道免疫刺激后,同时分化为IgG ASC和IgA ASC。将来,在PEDV弱毒疫苗诱导产生IgG方面应有更多研究阐明。
4.3 应重视PEDV感染诱导细胞免疫的作用无论是抗原提呈还是体液免疫的建立,均需要T淋巴细胞的作用。病毒感染会引起天然免疫细胞如NK细胞、DC细胞以及巨噬细胞向感染部位的聚集。NK细胞利用细胞毒性杀死病毒感染的细胞,对于病毒清除发挥重要作用[46]。有研究表明仔猪感染PEDV后的排毒和腹泻指数与NK细胞的数量、溶细胞活性以及其释放的IFN-γ呈负相关[39]。另外血清中细胞因子IFN-α和IL-12对于控制PEDV感染也发挥着重要作用。DC细胞不仅负责抗原提呈,而且在PEDV病理发展中发挥重要作用,因此,有研究者设计了靶向DC细胞的PEDV亚单位疫苗,发现这样的疫苗可以增强CD4+ T细胞免疫反应,并产生了中和性抗体和部分免疫防护[47-48]。巨噬细胞不仅可以作为病毒增殖的场所,而且在对抗免疫中发挥作用[4]。
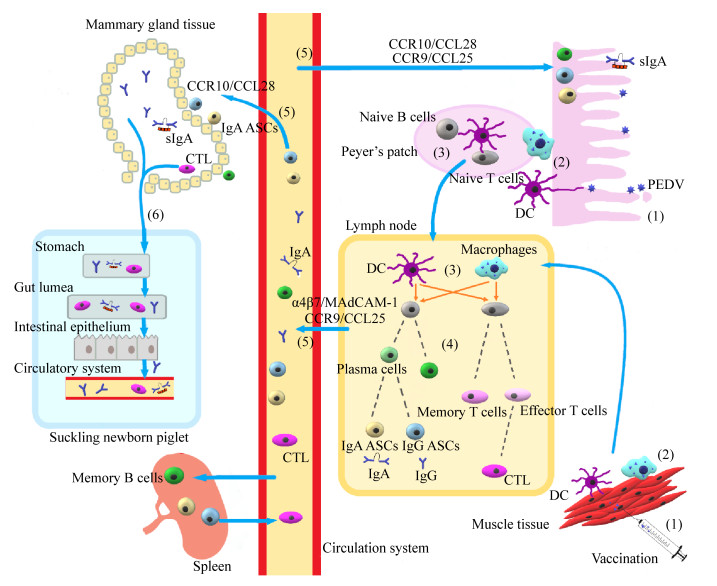
总之,轴系理论虽能很好地阐述自然感染野毒情况下PEDV的免疫防控。但实践中完全依赖该理论却往往得不到理想效果。实际操作中,如何产生足够的乳汁抗体(IgA或IgG)对于新生仔猪抗PEDV感染的被动免疫保护至关重要。因此,详细了解影响乳腺免疫的因素及其作用机制有助于PEDV等肠道病原体的疫苗设计,并完善PEDV免疫理论。通过上述讨论,我们将PEDV诱导母猪乳腺产生免疫抗体机制进行了归纳总结(图4)。该机制在原来“肠道-乳腺-sIgA轴”理论的基础上补充了肠道外免疫途径以及细胞免疫和IgG的作用。应该相信,良好免疫效应的获得离不开多种免疫因素的综合作用。在过去PEDV防控实践中,有过于突出强调肠道-乳腺-sIgA轴系作用现象,如此便忽视了IgG和细胞免疫作用。这样对PEDV防控实践是十分不利的。
|
| 图 4 PEDV免疫途径与仔猪被动免疫 Figure 4 Routes of PEDV vaccination and passive immunity by new born piglet 注:(1) 肠道PEDV感染或者弱毒疫苗接种以及灭活疫苗肌肉注射是诱导母猪免疫的主要途径。(2) 肠道组织或肌肉组织内的树突状细胞及巨噬细胞以吞噬及结合方式捕获PEDV粒子的成分作为抗原。(3) 树突状细胞或巨噬细胞在派尔集合淋巴结或淋巴结内激活初始B、T淋巴细胞。(4) 被激活的B淋巴细胞增殖分化为浆细胞(包括IgA和IgG ASCs)和记忆性B细胞。激活的T细胞增殖分化为效应性T细胞(包括CTL细胞)和记忆性T细胞。(5) 在不同归巢标记和趋化因子引导下免疫细胞进入血液系统、肠道以及乳腺并分泌抗体。分娩前2天母猪血液中抗体IgG和IgA也可直接进入初乳。(6) 初生仔猪通过母猪初乳中IgA、IgG以及CTL细胞获得被动免疫 Note: PEDV infection or live vaccine inoculation in the gut or muscle injection of PEDV vaccine are the two common routes arousing sow lactogenic immunity (1). DCs and macrophages in the intestine tissues or in the muscle tissues capture components of PEDV particles as antigen (2). In Peyer’s patches or lymph nodes DCs and macrophages activate naive B or T lymphocytes (3). Activated B cells proliferate and differentiate into plasma cells including IgA and IgG ASCs or memory B cells; Activated T cells proliferate and differentiate into effector T cells including CTLs and memory T cells (4). The immune cells traffick to circulation, intestine or mammary gland tissues to secret antibodies under the guide of different homing markers and chemokines. In the first two days postpartum, serum IgG and IgA can be leaked to the sow’s colostrum (5). The new born suckling piglets acquire passive immunity through colostrum which contains IgA, IgG and CTLs (6) |
|
|
| [1] |
Saif LJ, Van Cott JL, Brim TA. Immunity to transmissible gastroenteritis virus and porcine respiratory coronavirus infections in swine[J]. Veterinary Immunology and Immunopathology, 1994, 43(1/2/3): 89-97. |
| [2] |
Bohl EH, Gupta RK, Olquin MV, Saif LJ. Antibody responses in serum, colostrum, and milk of swine after infection or vaccination with transmissible gastroenteritis virus[J]. Infection and Immunity, 1972, 6(3): 289-301. DOI:10.1128/iai.6.3.289-301.1972 |
| [3] |
Saif LJ, Bohl EH, Gupta RK. Isolation of porcine immunoglobulins and determination of the immunoglobulin classes of transmissible gastroenteritis viral antibodies[J]. Infection and Immunity, 1972, 6(4): 600-609. DOI:10.1128/iai.6.4.600-609.1972 |
| [4] |
Langel SN, Wang QH, Vlasova AN, Saif LJ. Host factors affecting generation of immunity against porcine epidemic diarrhea virus in pregnant and lactating swine and passive protection of neonates[J]. Pathogens, 2020, 9(2): 130-150. DOI:10.3390/pathogens9020130 |
| [5] |
Li WT, Van Kuppeveld FJM, He QG, Rottier PJM, Bosch BJ. Cellular entry of the porcine epidemic diarrhea virus[J]. Virus Research, 2016, 226: 117-127. DOI:10.1016/j.virusres.2016.05.031 |
| [6] |
Jung K, Saif LJ. Goblet cell depletion in small intestinal villous and crypt epithelium of conventional nursing and weaned pigs infected with porcine epidemic diarrhea virus[J]. Research in Veterinary Science, 2017, 110: 12-15. DOI:10.1016/j.rvsc.2016.10.009 |
| [7] |
Curry SM, Schwartz KJ, Yoon KJ, Gabler NK, Burrough ER. Effects of porcine epidemic diarrhea virus infection on nursery pig intestinal function and barrier integrity[J]. Veterinary Microbiology, 2017, 211: 58-66. DOI:10.1016/j.vetmic.2017.09.021 |
| [8] |
Haverson K, Singha S, Stokes CR, Bailey M. Professional and non-professional antigen-presenting cells in the porcine small intestine[J]. Immunology, 2000, 101(4): 492-500. DOI:10.1046/j.1365-2567.2000.00128.x |
| [9] |
Fleeton MN, Contractor N, Leon F, Wetzel JD, Dermody TS, Kelsall BL. Peyer’s patch dendritic cells process viral antigen from apoptotic epithelial cells in the intestine of reovirus-infected mice[J]. Journal of Experimental Medicine, 2004, 200(2): 235-245. DOI:10.1084/jem.20041132 |
| [10] |
Gao Q, Zhao SS, Qin T, Yin YY, Yang Q. Effects of porcine epidemic diarrhea virus on porcine monocyte-derived dendritic cells and intestinal dendritic cells[J]. Veterinary Microbiology, 2015, 179(3/4): 131-141. |
| [11] |
Li YC, Wang GH, Wang JL, Man K, Yang Q. Cell attenuated porcine epidemic diarrhea virus strain Zhejiang08 provides effective immune protection attributed to dendritic cell stimulation[J]. Vaccine, 2017, 35(50): 7033-7041. DOI:10.1016/j.vaccine.2017.10.052 |
| [12] |
Wang XN, Wang L, Huang XW, Ma ST, Yu ML, Shi W, Qiao XY, Tang LJ, Xu YG, Li YJ. Oral delivery of probiotics expressing dendritic cell-targeting peptide fused with porcine epidemic diarrhea virus COE antigen: a promising vaccine strategy against PEDV[J]. Viruses, 2017, 9(11): 312-327. DOI:10.3390/v9110312 |
| [13] |
Wang XN, Wang L, Zheng DZ, Chen S, Shi W, Qiao XY, Jiang YP, Tang LJ, Xu YG, Li YJ. Oral immunization with a Lactobacillus casei-based anti-porcine epidemic diarrhea virus (PEDV) vaccine expressing microfold cell-targeting peptide Co1 fused with the COE antigen of PEDV[J]. Journal of Applied Microbiology, 2018, 124(2): 368-378. DOI:10.1111/jam.13652 |
| [14] |
Subramaniam S, Yugo DM, Heffron CL, Rogers AJ, Sooryanarain H, LeRoith T, Overend C, Cao DJ, Meng XJ. Vaccination of sows with a dendritic cell-targeted porcine epidemic diarrhea virus S1 protein-based candidate vaccine reduced viral shedding but exacerbated gross pathological lesions in suckling neonatal piglets[J]. The Journal of General Virology, 2018, 99(2): 230-239. DOI:10.1099/jgv.0.001001 |
| [15] |
Yang HC. Animal Immunology[M]. (the second edition). Beijing: China Agricultural university Press, 2003. (in Chinese) 杨汉春. 动物免疫学[M]. 2版. 北京: 中国农业大学出版社, 2003. |
| [16] |
Effect of route of inoculation on innate and adaptive immune responses to porcine epidemic diarrhea virus infection in suckling pigs[J]. Veterinary Microbiology, 2019, 228: 83-92. DOI:10.1016/j.vetmic.2018.11.019 |
| [17] |
Immunomodulating effects of intestinal absorbed maternal colostral leukocytes by neonatal pigs[J]. Canadian Journal of Veterinary Research, 1993, 57(1): 1-8. |
| [18] |
Isotype-specific antibody-secreting cells in systemic and mucosal associated lymphoid tissues and antibody responses in serum of conventional pigs inoculated with PEDV[J]. Veterinary Immunology and Immunopathology, 2002, 84(1/2): 1-16. |
| [19] |
Leukocyte trafficking to the small intestine and colon[J]. Gastroenterology, 2016, 150(2): 340-354. DOI:10.1053/j.gastro.2015.10.046 |
| [20] |
Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm[J]. Cell, 1994, 76(2): 301-314. DOI:10.1016/0092-8674(94)90337-9 |
| [21] |
Chemokine-triggered leukocyte arrest: force-regulated bi-directional integrin activation in quantal adhesive contacts[J]. Current Opinion in Cell Biology, 2012, 24(5): 670-676. DOI:10.1016/j.ceb.2012.06.001 |
| [22] |
Human mucosal addressin cell adhesion molecule-1 is preferentially expressed in intestinal tract and associated lymphoid tissue[J]. American Journal of Pathology, 1997, 151(1): 97-110. |
| [23] |
Gut-associated lymphoid tissue-primed CD4+ T cells display CCR9-dependent and -independent homing to the small intestine[J]. Blood, 2006, 107(9): 3447-3454. DOI:10.1182/blood-2005-07-2860 |
| [24] |
Hormonal induction of the secretory immune system in the mammary gland[J]. Proceedings of the Natlional Academy of Sciences of the United States of America, 1978, 75(6): 2928-2932. DOI:10.1073/pnas.75.6.2928 |
| [25] |
Critical roles of chemokine receptor CCR10 in regulating memory IgA responses in intestines[J]. Proceedings of the Natlional Academy of Sciences of the United States of America, 2011, 108(45): E1035-E1044. DOI:10.1073/pnas.1100156108 |
| [26] |
Molecular cloning and functional characterization of porcine CCL28: possible involvement in homing of IgA antibody secreting cells into the mammary gland[J]. Molecular Immunology, 2008, 45(1): 271-277. DOI:10.1016/j.molimm.2007.04.026 |
| [27] |
Plasma concentrations of progesterone, oestrone, oestradiol-17beta and of oestrone sulphate in the pig at implantation, during pregnancy and at parturition[J]. Journal of Reproduction and Fertility, 1974, 40(1): 133-141. DOI:10.1530/jrf.0.0400133 |
| [28] |
Prolactin and luteinizing hormone secretion in the pregnant pig[J]. Journal of Animal Science, 1992, 70(11): 3521-3527. DOI:10.2527/1992.70113521x |
| [29] |
Expression of TECK/CCL25 and MEC/CCL28 chemokines and their respective receptors CCR9 and CCR10 in porcine mucosal tissues[J]. Veterinary Immunology and Immunopathology, 2006, 113(3/4): 313-327. |
| [30] |
Stage of gestation at porcine epidemic diarrhea virus infection of pregnant swine impacts maternal immunity and lactogenic immune protection of neonatal suckling piglets[J]. Frontiers in Immunology, 2019, 10: 727-745. DOI:10.3389/fimmu.2019.00727 |
| [31] |
Retinoic acid imprints gut-homing specificity on T cells[J]. Immunity, 2004, 21(4): 527-538. DOI:10.1016/j.immuni.2004.08.011 |
| [32] |
Role of retinoic acid in the imprinting of gut-homing IgA-secreting cells[J]. Seminars in Immunology, 2009, 21(1): 28-35. DOI:10.1016/j.smim.2008.08.002 |
| [33] |
Oral vitamin A supplementation of porcine epidemic diarrhea virus infected gilts enhances IgA and lactogenic immune protection of nursing piglets[J]. Veterinary Research, 2019, 50(1): 101-116. DOI:10.1186/s13567-019-0719-y |
| [34] |
Intramuscular immunization with chemokine-adjuvanted inactive porcine epidemic diarrhea virus induces substantial protection in pigs[J]. Vaccines, 2020, 8(1): 102-117. DOI:10.3390/vaccines8010102 |
| [35] |
CCL28 induces mucosal homing of HIV-1-specific IgA-secreting plasma cells in mice immunized with HIV-1 virus-like particles[J]. PLoS One, 2011, 6(10): e26979. DOI:10.1371/journal.pone.0026979 |
| [36] |
Passive immunity to transmissible gastroenteritis virus: intramammary viral inoculation of sows[J]. Annals of the New York Academy of Sciences, 1983, 409: 708-723. DOI:10.1111/j.1749-6632.1983.tb26910.x |
| [37] |
Pathogenicity and immunogenicity of attenuated porcine epidemic diarrhea virus PC22A strain in conventional weaned pigs[J]. BMC Veterinary Research, 2019, 15: 26-36. DOI:10.1186/s12917-018-1756-x |
| [38] |
Pathology of US porcine epidemic diarrhea virus strain PC21A in gnotobiotic pigs[J]. Emerging Infectious Diseases, 2014, 20(4): 662-665. |
| [39] |
Age-dependent variation in innate immune responses to porcine epidemic diarrhea virus infection in suckling versus weaned pigs[J]. Veterinary Immunology and Immunopathology, 2015, 168(3/4): 193-202. |
| [40] |
Does circulating antibody play a role in the protection of piglets against porcine epidemic diarrhea virus?[J]. PLoS One, 2016, 11(4): e0153041. DOI:10.1371/journal.pone.0153041 |
| [41] |
Evaluation of the efficacy of a commercial inactivated genogroup 2b-based porcine epidemic diarrhea virus (PEDV) vaccine and experimental live genogroup 1b exposure against 2b challenge[J]. Veterinary Research, 2017, 48(1): 69-78. DOI:10.1186/s13567-017-0472-z |
| [42] |
Men CF. Immunization test of genetically engineered inactivated vaccine of porcine epidemic diarrhea virus[D]. Taian: Master’s Thesis of Shandong Agricultural University, 2020 (in Chinese) 门程芳. 猪流行性腹泻病毒基因工程灭活疫苗的免疫试验研究[D]. 泰安: 山东农业大学硕士学位论文, 2020 |
| [43] |
Growth and decline of PEDV IgA antibody in sow milk after immunization with porcine viral diarrhea vaccine[J]. Chinese Journal of Veterinary Science, 2017, 37(9): 1659-1663. (in Chinese) 猪病毒性腹泻(PED)疫苗免疫后母猪乳汁中PEDV IgA消长动态[J]. 中国兽医学报, 2017, 37(9): 1659-1663. |
| [44] |
Evaluation of humoral immune status in porcine epidemic diarrhea virus (PEDV) infected sows under field conditions[J]. Veterinary Research, 2015, 46: 140-150. DOI:10.1186/s13567-015-0285-x |
| [45] |
The characterization of immunoprotection induced by a cDNA clone derived from the attenuated Taiwan porcine epidemic diarrhea virus pintung 52 strain[J]. Viruses, 2018, 10(10): 543-557. DOI:10.3390/v10100543 |
| [46] |
NK cells in host responses to viral infections[J]. Current Opinion in Immunology, 2017, 44: 43-51. DOI:10.1016/j.coi.2016.11.003 |
| [47] |
Efficient priming of CD4 T cells by Langerin-expressing dendritic cells targeted with porcine epidemic diarrhea virus spike protein domains in pigs[J]. Virus Research, 2017, 227: 212-219. DOI:10.1016/j.virusres.2016.10.007 |
| [48] |
Oral immunization against PEDV with recombinant Lactobacillus casei expressing dendritic cell-targeting peptide fusing COE protein of PEDV in piglets[J]. Viruses, 2018, 10(3): 106-119. DOI:10.3390/v10030106 |
 2021, Vol. 48
2021, Vol. 48
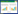


 ,
,