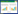扩展功能
文章信息
- 廖家龙, 郑雪漫, 黎双飞, 徐芳芳
- LIAO Jialong, ZHENG Xueman, LI Shuangfei, XU Fangfang
- 活性污泥中群体感应淬灭菌的分离纯化及功能验证
- Isolation and characterization of indigenous quorum quenching bacteria from activated sludge
- 微生物学通报, 2021, 48(10): 3532-3542
- Microbiology China, 2021, 48(10): 3532-3542
- DOI: 10.13344/j.microbiol.china.210013
-
文章历史
- 收稿日期: 2021-01-06
- 接受日期: 2021-03-23
- 网络首发日期: 2021-04-28
膜生物污堵导致膜生物反应器(Membrane Bioreactor,MBR)的运行高能耗、高成本等问题,是制约MBR进一步推广应用的首要因素之一。膜生物污堵的传统解决方法包括物理清洗、化学清洗、膜材料改进、活性污泥条件改善、反应器运行模式调节等[1-2],但这些方法都不能从根本上解决生物污堵的问题。近年来,利用群体感应淬灭(Quorum Quenching,QQ)技术控制膜污堵的研究受到了广泛关注。QQ技术有望从生物的角度控制膜生物污堵的问题。形成膜生物污堵的首要原因在于微生物在膜材料表面附着、定殖并逐渐发展成为生物膜(Biofilm)[3]。生物膜的形成受到细菌群体感应(Quorum Sensing,QS)系统的调控,QS是指细菌通过生产、释放并检测特定的化学信号分子进行通讯,从而调控细菌群体行为的一种现象。当信号分子达到特定阈值后,细菌能够接收到信号并激活下游一系列功能基因的表达,如毒力表达[4]、抗生素分泌[5]、孢子形成[6]和生物膜形成[7]等。细菌的群体感应信号类型主要包括革兰氏阴性菌的N-酰基高丝氨酸内酯(N-Acyl Homoserine Lactones,AHL)、革兰氏阳性菌的自诱导肽(Autoinducer Peptides,AIP)以及2类细菌跨物种交流的自诱导肽(Autoinducer-2,AI-2)。QQ技术主要通过破坏细菌的信号分子、阻断菌间信号传导从而干扰和破坏细菌间的正常交流。QQ途径主要包括抑制信号分子产生、分解或失活已产生的信号分子、干扰信号分子与受体结合或破坏受体蛋白等[8]。近年来,基于群体感应淬灭理论的膜污染控制技术发展迅速,在实验室规模、中试规模MBR中的抗膜生物污堵效果均得到了有效验证,并有望投入实际应用中[9-12]。研究表明,堵塞的MBR膜组件表面含有种类丰富的细菌、真菌和原生生物等微生物,而且微生物的分布呈现显著的时空变化与域间关联性[13],其中细菌之间存在广泛的通讯交流。研究已证明,革兰氏阴性菌在膜污堵中占据主导地位,而且AHL信号分子是MBR废水处理系统中最为普遍存在的信号分子之一[14]。因此,淬灭AHL类信号分子是有效减缓膜污堵的潜在手段。然而,当前可应用于防止膜污堵的QQ菌菌种单一,菌种资源匮乏。本文汇总了当前研究较多的QQ-MBR相关的菌株(表 1),其中已进行中试应用测试的AHL型QQ菌仅有Rhodococcus sp. BH4一株。由于污水处理活性污泥是一个复杂的微生物群落,外源加入的细菌往往难以适应复杂的土著环境,因而会影响QQ效果。然而分离土著QQ菌可以在不影响污水处理水质的同时有效避免细菌的环境适应性问题,更易于实际应用。因此迫切需要从实际运行的MBR反应器中分离培养土著QQ微生物菌,进而建立和完善适应中国污水处理厂中水质状况的QQ菌库。
| QQ菌 QQ strain |
可分解的AHL Degradable AHL |
QQ酶 QQ enzyme |
应用案例 Case studied |
参考文献 References |
| Pseudomonas sp. 1A1 | C6, C8, C10, C12, 3OC6, 3O, 3OC10, 3OC12 | Acylase | Lab-scale MBR | [15] |
| Rhodococcus sp. BH4 | C6, C8, C10L, C12, 3OC6, 3OC8, 3OC10, 3OC12 | Lactonase | Lab-scale MBR, pilot-scale MBR | [16-17] |
| Enterococcus HEMM-1 | C4-C14 | Lactonase | AHL degradation | [18] |
| Rhodococcus erythropolis W2 | 3-O-HSL | Oxidoreductase | AHL degradation | [19] |
| Bacillus sp. T5 | C8 | Lactonase | Lab-scale MBR | [20] |
| Bacillus cereus HG10 | C6-C10 | Lactonase | Biofilm inhibition | [21] |
本研究从实际运行的MBR污水处理设备中分离纯化具有AHL降解能力的菌株,通过定性、定量测定菌株对典型革兰氏阴性菌N-酰基高丝氨酸内酯信号分子的降解能力、分析所得QQ菌对生物膜的抑制能力,筛选出高效QQ菌株,再对其进行菌种鉴定、包埋固定,并验证包埋后菌株的QQ活性,以期为后续进一步应用到实际的QQ-MBR中提供理论依据。
1 材料与方法 1.1 菌株红球菌Rhodococcus sp. BH4 (BH4)由首尔国立大学Lee Chung-Hak教授惠赠。用于生物膜抑制能力检测的QS菌株铜绿假单胞菌(Pseudomonas aeruginosa) PAO1 (ATCC 15692)和菠萝泛菌(Pantoea ananatis) SK-1 (ATCC 19321),以及报告菌株根瘤农杆菌(Agrobacterium tumefaciens) A136 (Ti-,pCF218,pCF372,ATCC 51350)和紫色色杆菌(Chromobacterium violaceum) VIR24 (ATCC 12472)均为实验室保存菌种。
1.2 培养基用于QQ菌筛选的培养基包含:Na2HPO4 6.0 g/L,KH2PO4 3.0 g/L,NaCl 0.5 g/L,NH4Cl 1.0 g/L,MgSO4 0.3 g/L,CaCl2 10.0 mg/L,FeCl3 0.1 mg/L,CuSO4·5H2O 0.1 mg/L,MnCl2·4H2O 0.1 mg/L,ZnSO4·7H2O 0.1 mg/L,pH 7.0-7.3,1.0×105 Pa灭菌25 min,待冷却后加入399.5 mg/L用0.22 μm针式滤器过滤除菌的C8-HSL。
1.3 主要试剂和仪器AHL型信号分子N-己酰高丝氨酸内酯(N-Hexanoyl-DL-Homoserine Lactone,C6-HSL)与N-辛酰高丝氨酸内酯(N-Octanoyl-DL- Homoserine Lactone,C8-HSL),Sigma公司;LB肉汤培养基、四环素、大观霉素、5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷(5-Bromo-4-Chloro-3-Indolyl- β-D-Galactopyranoside,X-Gal)、二甲基亚砜(Dimethyl Sulfoxide,DMSO)、甲醇、结晶紫、乙酸、聚乙烯醇(Polyvinyl Alcohol,PVA)、海藻酸钠(Sodium Alginate,SA)、Na2SO4、CaCl2、H3BO3、Tris-HCl缓冲液、Na2HPO4与NaH2PO4、戊二醛与甘油,Macklin公司。
高分辨扫描电镜,Thermo Scientific公司;多功能酶标仪,BioTek公司;PCR仪,Bio-Rad公司;凝胶成像系统,上海复日科技有限公司。
1.4 QQ菌的分离纯化MBR活性污泥样本源自深圳市某污水处理厂实际运行工艺。菌株分离纯化方法参考已建立的方法[22]。大致流程为:将取得的活性污泥样品用超纯水稀释10倍后,以5% (体积分数)接种于LB液体培养基中,30 ℃、200 r/min恒温振荡培养48 h后将培养液以2% (体积分数)转移至以399.5 mg/L C8-HSL为唯一碳源的基本培养基中,30 ℃、200 r/min恒温振荡富集培养24 h。用无菌水将培养液稀释100倍后涂布到LB平板上,30 ℃恒温培养24-48 h,挑取不同形态菌落进行分离纯化,并对所有分离菌落进行QQ功能检测。
1.5 QQ能力测定QQ能力测定通过分析细菌对信号分子AHL的分解情况进行表征。AHL的定性测定采用报告菌A136的X-Gal生物显色法[17, 23]。首先将分离菌株接种至LB液体培养基中,30 ℃、200 r/min培养过夜,将所得培养液稀释至OD600为1.0,加入200 nmol/L C8-HSL,30 ℃、200 r/min分别孵育5 h和10 h后,6 230×g离心5 min取上清液,用0.45 μm滤膜过滤除菌后-20 ℃保存备用。用含有45 μg/mL四环素、50 μg/mL大观霉素和200 μg/mL X-Gal及报告菌株A136的LB平板检测上清液中剩余的C8-HSL含量。30 ℃恒温培养24 h后观察指示平板显色圈的大小和颜色深浅。
AHL的定量分析采用VIR24报告菌检测[24]。基本原理为VIR24接收到AHL信号分子后产生紫色素,通过提取并测量紫色素的吸光值表征体系中信号分子的含量。将细菌接种到LB液体培养基中,30 ℃、200 r/min振荡培养过夜,用新鲜LB液体培养基稀释至OD600为1.0,加入10 μmol/L C6-HSL后30 ℃、200 r/min振荡培养,在5 h、10 h时分别取500 μL培养液,6 230×g离心5 min收集上清液,将上清液放入95 ℃恒温水浴锅灭活5 min,待冷却后于-20 ℃冷冻保存。将报告菌株VIR24于LB液体培养基中30 ℃、200 r/min培养过夜后,稀释至OD600为0.1备用。取稀释液1 000 μL添加到24孔板中,再分别加入标准样品(10、5、2.5、1.25 μmol/L C6-HSL)和待测样品20 μL,加入等体积无菌水作为阴性对照,30 ℃、200 r/min恒温振荡培养24 h。培养液9 300×g离心5 min后去上清,加入150 μL二甲基亚砜重悬,将细胞置于超声清洗仪30 ℃水浴中,600 W处理10 min,11 600×g离心5 min,取上清100 μL加入96孔板中,530 nm下测样品的吸光值。
1.6 QS活性验证用报告菌株A136检测分离所得QQ菌的AHL信号分子生产能力。报告菌株A136接种于含有45 μg/mL四环素及50 μg/mL大观霉素的LB液体培养基中,30 ℃、200 r/min培养过夜。将待测QQ菌接种至LB液体培养基中,30 ℃、200 r/min培养48 h。11 600×g离心5 min收集上清液,并将上清液置于95 ℃恒温水浴锅灭活3 min,冷却至室温。将上清液与A136菌液(含200 μg/mL X-Gal)以1:10混合后,取100 μL至96孔板中,30 ℃恒温培养过夜,观察样品的显色情况。
1.7 QQ菌的生物膜抑制能力分析以典型AHL型群体感应铜绿假单胞菌PAO1和菠萝泛菌SK-1为测试对象,分析分离所得QQ菌对PAO1和SK-1生物膜生长的抑制情况[25]。QQ菌、PAO1和SK-1分别在30 ℃、200 r/min下LB液体培养基中培养过夜后,用新鲜LB培养基稀释至OD600为0.05。分别取100 μL单菌菌液或1:1混合后的混合菌液至900 μL LB液体培养基中(24孔板),30 ℃孵育24 h后倒去培养液;用灭菌水轻柔清洗3次,去除游离细菌;加入95%甲醇溶液,室温孵育10 min,固定孔壁上的生物膜;倒去甲醇溶液静置晾干,加入120 μL 0.1%的结晶紫溶液,室温染色15 min;倒去结晶紫溶液,缓慢冲洗3-4次吸干水分;倒置孔板静置干燥,加入120 μL 30%乙酸溶液,室温180 r/min下孵育10-15 min溶解结晶紫,590 nm下测定样本的吸光度。
1.8 QQ菌的分类鉴定 1.8.1 QQ菌的形态鉴定在LB平板上观察QQ菌的菌落形态,用革兰氏染色法于油镜下观察菌体形态。用扫描电子显微镜观察QQ菌形态[9]。QQ菌接种于LB液体培养基中,30 ℃、200 r/min培养过夜,11 600×g离心5 min收集菌体,重悬于0.1 mol/L磷酸盐缓冲液中,重复洗涤2次后加1%戊二醛固定30 min。梯度乙醇脱水,干燥,粘样,喷金并进行扫描电镜检测。
1.8.2 QQ菌的生理生化分析参照《伯杰细菌鉴定手册》(第8版)[26]和《微生物学实验》[27]对JL5进行葡萄糖氧化发酵试验、柠檬酸盐试验、淀粉水解试验、过氧化氢酶试验、明胶水解试验、硝酸盐试验、甲基红(M.R)试验、V.P试验、吲哚试验、乙酰甲基甲醇试验。
1.8.3 QQ菌的16S rRNA基因序列测定与分析利用16S rRNA基因测序鉴定分离所得QQ菌株。用Ezup柱式细菌基因组DNA抽提试剂盒提取细菌基因组DNA,使用通用引物对27F (5′-AGATTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增细菌的16S rRNA基因[21]。纯化PCR产物并送至生工生物工程(上海)股份有限公司测序,测序结果通过NCBI的BLAST进行序列识别,再与GenBank数据库中的序列进行比对,获得相关物种信息。将获得的分离株序列与已知的高效QQ菌株Rhodococcus sp. BH4的16S rRNA基因序列一起,采用MEGA 7.0软件绘制系统发育树,比较分离得到的QQ菌与BH4的亲缘关系。
1.9 固定化QQ菌的信号分子分解能力验证 1.9.1 QQ菌的包埋固定采用PVA和SA交联制备QQ微球[28]。配制200 mL的12.5% PVA和1.25% SA的混合液,1×105 Pa灭菌30 min。将QQ菌在LB液体培养基中30 ℃、200 r/min培养24 h,6 230×g离心10 min收集菌体,去除上清液后加去离子水重悬细菌。将QQ菌悬液与聚合溶液以1:4的比例混合后滴入300 mL饱和H3BO3-CaCl2混合液中交联反应1 h。用去离子水清洗2次第一交联反应后的QQ微球,继而将QQ微球放入200 mL的0.5 mol/L Na2SO4溶液中反应6-8 h,去离子水洗涤2-3次后保存备用。
1.9.2 固定化QQ菌降解信号分子的能力验证用传感菌A136表征所得QQ菌降解C8-HSL的能力。取25颗PVA-SA包埋的QQ微球加入10 mL Tris-HCl溶液(50 mmol/L,pH 7.0)中,加入200 nmol/L C8-HSL,30 ℃、200 r/min振荡培养,以空微球作为阴性对照。分别于1、30、60、90 min取样测定C8-HSL的分解情况。报告菌株A136指示琼脂平板制备过程同1.5。以标准浓度C8-HSL为对照,将不同时间点取得的样品滴加至A136指示平板的孔洞后30 ℃培养24 h,观察平板上显色圈的大小及颜色。
2 结果与讨论 2.1 QQ菌的分离从实际运行的MBR污水处理设备中以AHL为唯一碳源富集培养并经多次平板划线后分离得到纯培养物,从中挑取了21个单菌落进行富集培养(分别命名为B-3、A1-1、A1-2、A1-3、A1-4、A2-5、A2-6、A2-7、A2-8a、B-1、A2-9、A2-10、A4-11、A4-12、A4-13、A5-14、A6-15、A7-16、A8-17、A9-18和A2-19)。以目前研究最为广泛的高效QQ菌株BH4为阳性对照,对比分析了分离所得21株细菌的C8-HSL信号分子分解能力(图 1)。结果表明其中有17株菌能够有效降解C8-HSL,具有QQ活性;其中9个菌株在24 h内将C8-HSL完全降解。从中挑选出原始命名为A2-9、A4-13、A5-14、A6-15、B-1、B-3的6株具备较高QQ活性的细菌,进一步富集培养并依次正式命名为JL5、SZU83、SZU18、XM19、FF19和SZU68。
|
| 图 1 分离所得细菌的群体感应淬灭能力验证 Figure 1 Quorum quenching ability of isolated strains 注:BH4为阳性对照 Note: BH4 is a positive control |
|
|
对分离纯化的6种QQ活性较高的分离株进行16S rRNA基因测序,结果如表 2所示。
| 原始命名 Original name |
菌株 Strains |
GenBank登录号 GenBank accession No. |
相似菌株 Similar strains |
相似性 Similarity (%) |
| A2-9 | JL5 | MN559091.2 | Delftia lacustris strain 332 (NR_116495.1) | 99.93 |
| A4-13 | SZU83 | MN559093.1 | Pseudomonas multiresinivorans strain ATCC 700690 (NR_119225.1) | 98.90 |
| A5-14 | SZU18 | MN559094.1 | Pseudomonas nitritireducens strain WZBFD3-5A2 (NR_133020.1) | 99.01 |
| A6-15 | XM19 | MN559095.1 | Pseudomonas nitroreducens strain NBRC 12694 (NR_113601.1) | 99.41 |
| B-1 | FF19 | MN559097.1 | Acinetobacter modestus strain NIPH 2369 (NR_148845.1) | 98.06 |
| B-3 | SZU68 | KY039272.1 | Pseudomonas nitroreducens strain DSM 14399 (NR_114975.1) | 99.04 |
比对结果显示6株分离所得QQ菌分别属于假单胞菌属(Pseudomonas sp.)、戴尔福特菌属(Delftia sp.)及不动杆菌属(Acinetobacter sp.),比对结果与数据库中相关细菌的相似性接近99%。值得注意的是,具有显著C6-HSL降解能力的菌株JL5与戴尔福特菌属的Delftia lacustris的相似性为99.93%,初步鉴定为Delftia sp.,该菌已送至中国典型培养物保藏中心进行菌种保藏(保藏编号为CCTCC M 2021139)。Gül等[29]报道Delftia sp. T6具有显著降解AHL型信号分子的能力。此外,相关研究报道Delftia sp.具有许多其他特性,主要包括具有嗜盐/耐高盐能力(能耐受≥100 mmol/L的硒酸盐与25 mmol/L亚硒酸盐)、硝酸盐还原能力、细胞外肽聚糖降解能力、对许多类型重金属的耐受能力、多种有机化合物利用能力以及促进植物生长的能力[30-33]。然而应用Delftia sp.作为QQ菌应用于膜防污堵的研究鲜有报道。
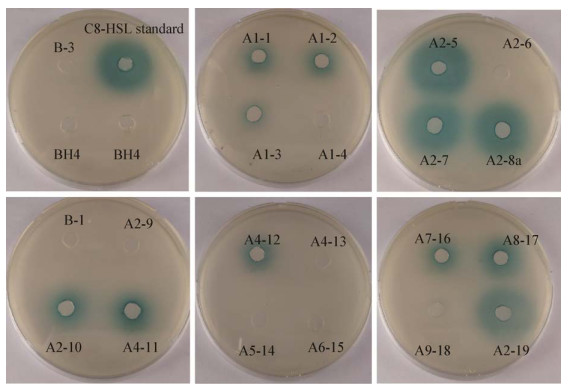
将分离株的16S rRNA基因测序结果与已有的高效QQ菌Rhodococcus sp. BH4[17]的16S rRNA基因序列进行比对,使用最大似然法构建系统发育树,分析6个分离株与BH4的亲缘关系,结果如图 2所示。由分离株与高效QQ菌株BH4的系统发育树可看出,6株分离株由4个分支组成:SZU83、XM19与SZU18构成一个以Pseudomonas sp.为代表的独立分支;JL5与FF19处在同一分支,但代表不同的属;BH4单独处在一个分支上;SZU68处在与其他分离株相对较远的分支上。观察分支结点与分支长度可知JL5、FF19与SZU83、SZU18、XM19的亲缘关系较近,它们与BH4的亲缘关系稍远,SZU68与SZU83、SZU18、FF19、XM19、JL5的亲缘关系都较远。JL5与已报道具有高效QQ能力的BH4属于不同属。此外,序列比对结果显示SZU83、SZU18、XM19与SZU68均属于Pseudomonas sp.,但SZU68与SZU83、SZU18、XM19处于距离较远的不同分支。
|
| 图 2 分离纯化所得的QQ菌与已有QQ菌BH4的系统发育树 Figure 2 Phylogenetic tree of newly isolated strains and previously reported Rhodococcus sp. BH4 |
|
|
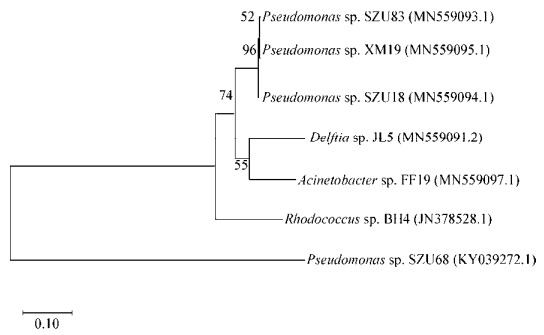
为定量分析所得QQ菌对AHL型信号分子的降解能力,使用报告菌株VIR24测定了6株QQ菌对C6-HSL降解能力,通过C6-HSL的浓度变化表征分离株的QQ活性(图 3)。结果表明共同培养5 h后,JL5将C6-HSL从初始的10.0 μmol/L降低至1.2 μmol/L,降解率达88%,而其他分离株SZU83、SZU18、XM19、FF19和SZU68降解了约40%-50%的C6-HSL;培养10 h后,JL5几乎完全降解体系中的C6-HSL,SZU18和SZU83的降解量达到70%;SZU68、XM19、FF19的降解量分别为60%、58%和68%,对C6-HSL的分解能力弱于JL5、SZU18和SZU83。不加任何菌株的C6-HSL对照样中,经过10 h的培养后C6-HSL的含量略微下降,信号分子的自然降解率大约为10%。
|
| 图 3 QQ菌降解C6-HSL Figure 3 QQ bacteria degraded C6-HSL 注:实心、空心柱子分别表示5 h、10 h时剩余的信号分子的量 Note: The solid column and the hollow column indicate the degradation of the signal molecule at 5 h and 10 h, respectively |
|
|
上述结果表明菌株JL5具备较强的AHL信号分子降解能力(10 h时已基本将培养液中的C6-HSL完全降解),其他5株细菌同样具有较好的该降解能力,但较菌株JL5弱。此外,除了菌株SZU68,大部分分离株在前5 h的C6-HSL降解速率比后5 h大。上述结果表明6株细菌均具有AHL信号分子降解能力,在后续研究中具备潜在的应用价值。根据上述筛选结果,选取了最高效的QQ菌JL5为对象,继续深入研究其细菌形态、对典型模式菌的生物膜形成抑制能力及固定化后的QQ效果。
2.4 高效QQ菌JL5的形态学和生理生化分析菌株JL5在LB平板上呈不透明的淡黄色菌落,菌落边缘整齐、表面光滑、圆形凸起,革兰氏染色呈阴性。扫描电镜结果表明JL5呈杆状,菌体长度约为2.6-3.1 μm,宽度约为0.6-0.8 μm (图 4)。葡萄糖氧化发酵试验、柠檬酸盐试验、过氧化氢酶试验结果呈阳性,M.R试验、吲哚试验、V.P试验、淀粉水解试验、明胶水解试验、乙酰甲基甲醇试验及硝酸盐试验结果呈阴性。

|
| 图 4 JL5扫描电镜观察结果(15 000×) Figure 4 Scanning electron microscope (SEM) observation of JL5 (15 000×) |
|
|
铜绿假单胞菌PAO1和菠萝泛菌SK-1是典型的AHL型QS细菌,其生物膜的产生受QS过程的调控。为了检测JL5抑制生物膜形成的能力,将其与PAO1和SK-1共同培养,并测定了共培养前后生物膜形成的差异。结果如图 5所示,空白对照组LB培养基中基本无生物膜的形成,JL5形成生物膜的能力较弱,而PAO1和SK-1在单独培养时具有极强的生物膜形成能力,而JL5的加入将PAO1和SK-1的生物膜形成量分别降低了57%和68%,说明JL5对PAO1和SK-1的生物膜形成有显著的抑制能力。
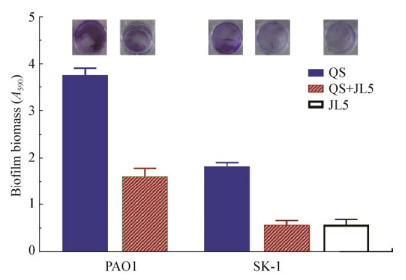
|
| 图 5 JL5对PAO1和SK-1生物膜形成抑制作用分析 Figure 5 Inhibition of PAO1 and SK-1 biofilm formation via JL5 |
|
|
将JL5与PVA和SA的混合液在饱和硼酸氯化钙混合溶液中进行第一交联反应,在0.5 mol/L Na2SO4溶液中进行第二交联反应,获得直径约为4 mm、密度约为1.06 mg/mL、大小接近、形态均一的细菌包埋珠(图 6A),其包埋后的电镜照片如图 6B所示。通过报告菌株A136指示琼脂平板法分析了固定化JL5微球的C8-HSL降解能力,以确认包埋后QQ菌的活性。结果表明包埋微球具备较强的韧性及稳定性,形态和结构完整,并未出现破损、变形等不良情况。JL5微球、BH4微球和无菌的空微球分别与200 nmol/L C8-HSL共培养1、30、60和90 min后,通过报告菌株A136指示琼脂平板法测定了剩余信号分子的浓度(图 6C)。结果表明,JL5微球显示出较强的C8-HSL降解能力,1 min时加样孔周围的蓝圈尺寸与对照组相当;30 min后加样孔周围的蓝圈范围明显变小,C8-HSL的量开始快速降低;60 min时,加样孔周围的蓝圈范围极小,颜色较浅;90 min后加样孔周围蓝色消失,表明C8-HSL已被完全降解。BH4微球培养液在90 min时仍观察到颜色圈,表明C8-HSL未完全降解。定量分析结果表明(图 6D),JL5和BH4在30、60、90 min时的降解率分别为70%、91%、98%和50%、73%、88%,相同时间内JL5的降解速率较BH4高,而90 min时对照组空微球中C8-HSL自然降解率约为5%,自然降解可能因为微球的吸附作用。因此,PVA与海藻酸钠混合材料的包埋过程并未破坏JL5的QQ活性,包埋固定化后的JL5微球能在90 min内将C8-HSL完全降解,而且降解速率高于目前研究最为广泛的BH4菌株。
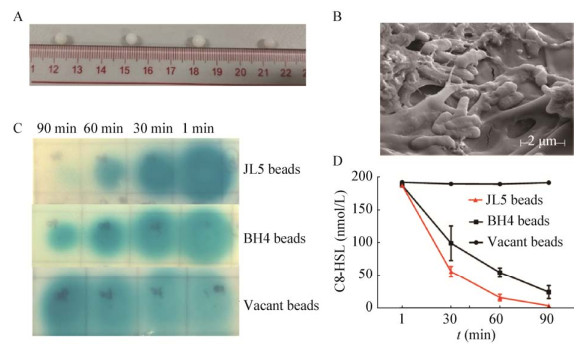
|
| 图 6 JL5固定化微球的QQ能力分析 Figure 6 QQ activity of JL5 beads 注:A:JL5固定化微球;B:JL5固定化微球电镜照片(放大倍数15 000×);C:JL5微球、BH4微球及空微球的C8-HSL降解能力比较;D:JL5微球、BH4微球及空微球的C8-HSL降解时间曲线 Note: A: Immobilized QQ beads; B: SEM picture of immobilized JL5 beads (magnification 15 000×); C: C8-HSL degradation comparison between JL5 beads, BH4 beads and vacant beads; D: C8-HSL degradation time course of JL5 beads, BH4 beads and vacant beads |
|
|
上述结果综合表明了JL5具备高效的AHL型信号分子降解能力,能有效抑制典型QS模式菌的生物膜形成,包埋固定化后仍具备高QQ活性,但其分解AHL的分子机制有待进一步探究。目前已发现的细菌AHL分解酶通常包括三大类,即内酯酶[34]、酰基转移酶[35]和氧化还原酶[36]。内酯酶作用于高丝氨酸内酯环,通过打开内酯环使信号分子失去活性,该过程与pH介导的内酯环水解类似,可以简单地通过降低pH值使内酯环重新闭合,从而使AHL恢复活性。酰基转移酶则作用于信号分子的酰基侧链,通过切断侧链中的酰胺键,将信号分子分解成脂肪酸和高丝氨酸内酯环,该分解过程不可逆。氧化还原酶的报道相对较少,这一类酶不降解信号分子,而是通过氧化或还原酰基侧链对信号分子进行修饰。本研究对JL5分解信号分子的机制进行了初步探索,发现JL5降解信号分子的酶位于细胞内,而且被JL5分解后的信号分子活性不可逆,表明JL5的QQ酶更有可能属于酰基转移酶类,具体的信号分子降解机制有待进一步深入研究。
3 结论本研究从实际运行的MBR活性污泥样本中成功富集培养并纯化出了6株高效土著QQ菌,其中Delftia sp. JL5是一株具极强群体感应淬灭能力的细菌,该属的细菌曾被报道具有硝酸盐还原、高盐耐受、抵抗多种重金属等能力,但该菌属在QQ-MBR中的应用鲜有报道,有待进一步深入研究。本研究验证了JL5能够高效降解C6-HSL和C8-HSL,可有效地抑制典型AHL型群体感应的革兰氏阴性菌PAO1及SK-1生物膜的形成。此外,包埋固定化后的菌株JL5依然保持了高QQ活性,能够有效降解信号分子,因此在基于群体感应淬灭的MBR膜生物污染防控领域具有较大的应用潜力。然而,菌株JL5降解信号分子的分子机制、包埋固定化后其在实验室水平及工程水平MBR中膜防污堵的能力、在MBR中QQ活性的稳定性、耐用性及环境适应性等问题有待进一步完善与研究。
致谢: 感谢深圳大学测试中心为本论文研究提供高分辨率扫描电子显微镜,为完成本课题提供平台支持;感谢首尔国立大学Lee Chung-Hak教授惠赠红球菌Rhodococcus sp. BH4 (BH4)。| [1] |
Ni LF, Wang YY. Advances in MBR biofouling control based on quorum sensing and quenching[J]. Journal of Harbin Institute of Technology, 2019, 51(8): 191-200. (in Chinese) 倪凌峰, 王亚宜. 基于群体感应猝灭理论的MBR膜污染控制技术研究进展[J]. 哈尔滨工业大学学报, 2019, 51(8): 191-200. |
| [2] |
Meng FG, Zhang SQ, Oh Y, Zhou ZB, Shin HS, Chae SR. Fouling in membrane bioreactors: an updated review[J]. Water Research, 2017, 114: 151-180. DOI:10.1016/j.watres.2017.02.006 |
| [3] |
Yeon KM, Cheong WS, Oh HS, Lee WN, Hwang BK, Lee CH, Beyenal H, Lewandowski Z. Quorum sensing: a new biofouling control paradigm in a membrane bioreactor for advanced wastewater treatment[J]. Environmental Science & Technology, 2009, 43(2): 380-385. |
| [4] |
Pirhonen M, Flego D, Heikinheimo R, Palva ET. A small diffusible signal molecule is responsible for the global control of virulence and exoenzyme production in the plant pathogen Erwinia carotovora[J]. The EMBO Journal, 1993, 12(6): 2467-2476. DOI:10.1002/j.1460-2075.1993.tb05901.x |
| [5] |
Fuqua WC, Winans SC, Greenberg EP. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. Journal of Bacteriology, 1994, 176(2): 269-275. DOI:10.1128/jb.176.2.269-275.1994 |
| [6] |
Chhabra SR, Stead P, Bainton NJ, Salmond GS, William P, Bycroft BW. Autoregulation of carbapenem biosynthesis in erwinia-carotovora by analogs of N-(3-oxohexanoyl)-L-homoserine lactone[J]. Journal of Antibiotics, 1993, 46(3): 441-454. DOI:10.7164/antibiotics.46.441 |
| [7] |
Davies DG, Parsek MR, Pearson JP, Iglewski BH, Costerton JW, Greenberg EP. The involvement of cell-to-cell signals in the development of a bacterial biofilm[J]. Science, 1998, 280(5361): 295-308. DOI:10.1126/science.280.5361.295 |
| [8] |
Rasmussen TB, Givskov M. Quorum sensing inhibitors: a bargain of effects[J]. Microbiology: Reading, England, 2006, 152(Pt 4): 895-904. |
| [9] |
Kim SR, Oh HS, Jo SJ, Yeon KM, Lee CH, Lim DJ, Lee CH, Lee JK. Biofouling control with bead-entrapped quorum quenching bacteria in membrane bioreactors: physical and biological effects[J]. Environmental Science & Technology, 2013, 47(2): 836-842. |
| [10] |
Yu H, Lee K, Zhang X, Choo KH. Core-shell structured quorum quenching beads for more sustainable anti-biofouling in membrane bioreactors[J]. Water Research, 2019, 150: 321-329. DOI:10.1016/j.watres.2018.11.071 |
| [11] |
Lee K, Lee S, Lee SH, Kim SR, Oh HS, Park PK, Choo KH, Kim YW, Lee JK, Lee CH. Fungal quorum quenching: a paradigm shift for energy savings in membrane bioreactor (MBR) for wastewater treatment[J]. Environmental Science & Technology, 2016, 50(20): 10914-10922. |
| [12] |
Lee SH, Lee S, Lee K, Nahm CH, Kwon H, Oh HS, Won YJ, Choo KH, Lee CH, Park PK. More efficient media design for enhanced biofouling control in a membrane bioreactor: quorum quenching bacteria entrapping hollow cylinder[J]. Environmental Science & Technology, 2016, 50(16): 8596-8604. |
| [13] |
Jeong SY, Yi T, Lee CH, Kim TG. Spatiotemporal dynamics and correlation networks of bacterial and fungal communities in a membrane bioreactor[J]. Water Research, 2016, 105: 218-230. DOI:10.1016/j.watres.2016.09.001 |
| [14] |
Lee K, Yu HR, Zhang XL, Choo KH. Quorum sensing and quenching in membrane bioreactors: opportunities and challenges for biofouling control[J]. Bioresource Technology, 2018, 270: 656-668. DOI:10.1016/j.biortech.2018.09.019 |
| [15] |
Cheong WS, Lee CH, Moon YH, Oh HS, Kim SR, Lee SH, Lee CH, Lee JK. Isolation and identification of indigenous quorum quenching bacteria, Pseudomonas sp. 1A1, for biofouling control in MBR[J]. Industrial & Engineering Chemistry Research, 2013, 52(31): 10554-10560. |
| [16] |
Oh HS, Kim SR, Cheong WS, Lee CH, Lee JK. Biofouling inhibition in MBR by Rhodococcus sp. BH4 isolated from real MBR plant[J]. Applied Microbiology and Biotechnology, 2013, 97(23): 10223-10231. DOI:10.1007/s00253-013-4933-7 |
| [17] |
Oh HS, Yeon KM, Yang CS, Kim SR, Lee CH, Park SY, Han JY, Lee JK. Control of membrane biofouling in MBR for wastewater treatment by quorum quenching bacteria encapsulated in microporous membrane[J]. Environmental Science & Technology, 2012, 46(9): 4877-4884. |
| [18] |
Ham SY, Kim HS, Cha E, Park JH, Park HD. Mitigation of membrane biofouling by a quorum quenching bacterium for membrane bioreactors[J]. Bioresource Technology, 2018, 258: 220-226. DOI:10.1016/j.biortech.2018.03.007 |
| [19] |
Uroz S, Chhabra SR, Cámara M, Williams P, Oger P, Dessaux Y. N-acylhomoserine lactone quorum-sensing molecules are modified and degraded by Rhodococcus erythropolis W2 by both amidolytic and novel oxidoreductase activities[J]. Microbiology: Reading, England, 2005, 151(Pt10): 3313-3322. |
| [20] |
Gül BY, Imer DY, Park PK, Koyuncu I. Selection of quorum quenching (QQ) bacteria for membrane biofouling control: effect of different Gram-staining QQ bacteria, Bacillus sp. T5 and Delftia sp. T6, on microbial population in membrane bioreactors[J]. Water Science and Technology, 2018, 78(1/2): 358-366. |
| [21] |
Zhao C, Wang WZ, Xu QY. Isolation of quorum quenching bacteria and their function for controlling membrane biofouling[J]. Environmental Science, 2016, 37(12): 4720-4726. (in Chinese) 赵畅, 王文昭, 徐期勇. 群体感应淬灭菌的分离及其膜污染控制性能[J]. 环境科学, 2016, 37(12): 4720-4726. |
| [22] |
Zhang C, Zhan SJ, Wang J, Liu ZJ, You H, Jia YH. Isolation and characterization of seven quorum quenching bacteria for biofouling control in MBR[J]. Clean Technologies and Environmental Policy, 2017, 19(4): 991-1001. DOI:10.1007/s10098-016-1294-9 |
| [23] |
Fuqua C, Winans SC. Conserved cis-acting promoter elements are required for density-dependent transcription of Agrobacterium tumefaciens conjugal transfer genes[J]. Journal of Bacteriology, 1996, 178(2): 435-440. DOI:10.1128/jb.178.2.435-440.1996 |
| [24] |
Someya N, Morohoshi T, Okano N, Otsu E, Usuki K, Sayama M, Sekiguchi H, Ikeda T, Ishida S. Distribution of N-acylhomoserine lactone-producing fluorescent pseudomonads in the phyllosphere and rhizosphere of potato (Solanum tuberosum L.)[J]. Microbes and Environments, 2009, 24(4): 305-314. DOI:10.1264/jsme2.ME09155 |
| [25] |
O'Toole GA. Microtiter dish biofilm formation assay[J]. Journal of Visualized Experiment, 2011, 47: e2437. |
| [26] |
Buchanan RE, Gibbs N. Berger's Bacterial Identification Manual[M]. Beijing: Beijing Science Press, 1984. (in Chinese) 布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984. |
| [27] |
Cai XZ, Huang JH. Microbiological Experiment[M]. Beijing: Beijing Science Press, 2010. (in Chinese) 蔡信之, 黄君红. 微生物学实验[M]. 北京: 科学出版社, 2010. |
| [28] |
Lee S, Park SK, Kwon H, Lee SH, Lee K, Nahm CH, Jo SJ, Oh HS, Park PK, Choo KH, et al. Crossing the border between laboratory and field: bacterial quorum quenching for anti-biofouling strategy in an MBR[J]. Environmental Science & Technology, 2016, 50(4): 1788-1795. |
| [29] |
Gül BY, Koyuncu I. Assessment of new environmental quorum quenching bacteria as a solution for membrane biofouling[J]. Process Biochemistry, 2017, 61: 137-146. DOI:10.1016/j.procbio.2017.05.030 |
| [30] |
Wadgaonkar SL, Nancharaiah YV, Jacob C, Esposito G, Lens PNL. Microbial transformation of Se oxyanions in cultures of Delftia lacustris grown under aerobic conditions[J]. Journal of Microbiology, 2019, 57(5): 362-371. DOI:10.1007/s12275-019-8427-x |
| [31] |
Jørgensen NOG, Brandt KK, Nybroe O, Hansen M. Delftia lacustris sp. nov., a peptidoglycan-degrading bacterium from freshwater and emended description of Delftia tsuruhatensis as a peptidoglycan-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 2195-2199. DOI:10.1099/ijs.0.008375-0 |
| [32] |
Wu WY, Huang HY, Ling ZM, Yu ZS, Jiang YM, Liu P, Li XK. Genome sequencing reveals mechanisms for heavy metal resistance and polycyclic aromatic hydrocarbon degradation in Delftia lacustris strain LZ-C[J]. Ecotoxicology: London, England, 2016, 25(1): 234-247. DOI:10.1007/s10646-015-1583-9 |
| [33] |
Ubalde MC, Braña V, Sueiro F, Morel MA, Martínez-Rosales C, Marquez C, Castro-Sowinski S. The versatility of Delftia sp. isolates as tools for bioremediation and biofertilization technologies[J]. Current Microbiology, 2012, 64(6): 597-603. DOI:10.1007/s00284-012-0108-5 |
| [34] |
Dong YH, Xu JL, Li XZ, Zhang LH. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(7): 3526-3531. DOI:10.1073/pnas.97.7.3526 |
| [35] |
Leadbetter JR, Greenberg EP. Metabolism of acyl-homoserine lactone quorum-sensing signals by Variovorax paradoxus[J]. Journal of Bacteriology, 2000, 182(24): 6921-6926. DOI:10.1128/JB.182.24.6921-6926.2000 |
| [36] |
Chowdhary PK, Keshavan N, Nguyen HQ, Peterson JA, González JE, Haines DC. Bacillus megaterium CYP102A1 oxidation of acyl homoserine lactones and acyl homoserines[J]. Biochemistry, 2007, 46(50): 14429-14437. DOI:10.1021/bi701945j |
 2021, Vol. 48
2021, Vol. 48