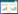扩展功能
文章信息
- 李慧, 李雪梦, 姚庆智, 李强
- LI Hui, LI Xue-Meng, YAO Qing-Zhi, LI Qiang
- 基于Biolog-ECO方法的两种不同草原中5种不同植物根际土壤微生物群落特征
- Biolog-ECO analysis of rhizosphere soil microbial community characteristics of five different plants in two different grasslands
- 微生物学通报, 2020, 47(9): 2947-2958
- Microbiology China, 2020, 47(9): 2947-2958
- DOI: 10.13344/j.microbiol.china.200451
-
文章历史
- 收稿日期: 2020-05-10
- 接受日期: 2020-08-27
- 网络首发日期: 2020-09-03
2. 内蒙古四子王旗尚泰养殖专业合作社 内蒙古 乌兰察布 011800
2. Inner Mongolia Siziwang Banner Shangtai Breeding Professional Cooperative, Wulanchabu, Inner Mongolia 011800, China
我国草原资源丰富,在生态平衡及牧区经济发展中扮演着重要角色[1]。近年来,随着人口数量的剧增和经济的快速发展以及全球气候的变化等因素导致内蒙古四子王旗草原资源被过度开垦利用,植被和土壤受到严重破坏,草原日渐退化成荒漠化草原[2]。内蒙古四子王旗位于我国内蒙古自治区阴山北麓农牧交错带[3],不仅是我国畜牧业发展的重要基地,更是我国北方重要的生态屏障[4]。荒漠草原是典型草原与荒漠之间的缓冲地带,其生态环境脆弱,植被群落组成较简单,生物量较低,稳定性较差,对自然和人类活动的干扰较为敏感[5]。然而草原荒漠化逐步加重的更核心问题是土壤环境恶化[6-7],植被-土壤-土壤微生物系统遭到破坏时,荒漠草原生态稳定性降低[8]。在恢复四子王旗荒漠草原生态系统时不仅要恢复植被,还要兼顾土壤环境,重建土壤微生物生态系统。
植被对土壤微生物群落结构及多样性有着重要的影响[9]。在荒漠草原生态恢复实践中,随着对地下部分重要性认识的深入,土壤微生物在生态中的重要作用日益凸显[10-11]。土壤微生物是土壤中细菌、真菌、放线菌以及藻类的总称,推动着整个土壤生态系统中养分转化和循环,促进植物吸收养分以及在调节土壤肥力与健康等方面有着不可替代的作用[12-13]。土壤微生物对土壤环境变化十分敏感,并随着土壤生态环境的恶化影响其周围的微环境[7, 14]。土壤微生物功能多样性作为土壤微生物生态学特征的关键指标之一,对于探索土壤微生物群落在不同环境中的作用以及了解生态系统的内部结构和功能具有重要意义[15-16]。近年来,越来越多的研究将土壤微生物数量、群落结构及功能多样性等作为评价退化草原生态系统恢复过程的重要指标,逐渐成为国内外草原研究的热点[12, 17-19]。然而传统培养方法所得到的土壤微生物很难全面反映其实际信息[20],Biolog-ECO微平板法可利用各种微生物群落对31种单一碳源的不同利用能力,反映出土壤微生物群落的代谢功能多样性[21-22]。鉴于此,本研究以内蒙古四子王旗荒漠草原不同植物根际的土壤微生物为研究对象,采用Biolog-ECO微平板法对土壤微生物的平均颜色变化率、群落多样性指数、群落功能多样性与植被特征的关系进行了研究,以期为荒漠草原植被恢复与土壤改良提供理论依据。
1 材料与方法 1.1 试验区概况试验区位于内蒙古自治区乌兰察布市四子王旗的阿德格草原(112°31′E,42°02′N,海拔1 340 m,简称ADG,土壤含水量在9.01%-10.4%)和格根塔拉草原(111°46′E,41°43′N,海拔1 440 m,简称GGTL,土壤含水量在10.99%-13.78%),属中温带大陆性季风气候区,年降雨量在300 mm左右,气温平均在1-6 ℃,最低气温达到-39 ℃,最高气温在36 ℃左右。四子王旗主要草原类型有典型草原、荒漠草原和干旱草原荒漠草原。土壤主要为栗钙土,含沙量大且疏松。土壤贫瘠,植被群落组成简单,以短花针茅(Stipa breviflora)为建群种,冷蒿(Artemisia frigida)为优势种,主要伴生种有银灰旋花(Convolvulus ammannii)、阿尔泰狗娃花(Heteropappus altaicus)、细叶葱(Allium tenuissimum)等。
1.2 样地设置与样品采集以荒漠草原中最具代表性的短花针茅草原为研究对象,在2018年8月中旬分别选择阿德格样地以及格根塔拉样地的5种植物(短花针茅、冷蒿、细叶葱、阿尔泰狗娃花和银灰旋花) (表 1),每个样地中设置3个样方(2×2 m),距离相差不低于100 m,每个样方内同一种植物取5株作为重复,采用抖落法抖落非根际土壤,将每个点同种植物样品混匀作为一个样品分析,共计获得10个土壤样品,于无菌塑封袋中带回到实验室,其中置于4 ℃冰箱内的土样进行土壤微生物数量和碳源利用研究。
| 植物名称 Specific name |
所属科 Scientific name |
生活型 Life style |
根系类型 Root type |
| 短花针茅 S. breviflora |
禾本科 Gramineae |
多年生草本 Perennial herb |
密丛型 Intensive |
| 冷蒿 A. frigida |
菊科 Compositae |
多年生草本 Perennial herb |
轴根型 Axial root type |
| 细叶葱 A. tenuissimum |
百合科 Uiaceae |
多年生草本 Perennial herb |
鳞茎型 Phosphate stem type |
| 阿尔泰狗娃花 H. altaicus |
菊科 Compositae |
多年生草本 Perennial herb |
轴根型 Axial root type |
| 银灰旋花 C. ammannii |
旋花科 Convolvulaceae |
多年生草本 Perennial herb |
轴根型 Axial root type |
称取四子王旗两种草原不同植物根际土10 g于90 mL无菌水混匀,拟定为10-1浓度,依次10倍比稀释至10-2、10-3、10-4、10-5、10-6梯度。采用传统稀释涂布平板法[24]测定土壤中细菌、真菌和放线菌数量。其中,分离细菌采用悬浮液10-4、10-5稀释梯度在牛肉膏蛋白胨固体培养基;真菌采用悬浮液10-2、10–3稀释梯度在马丁-孟加拉红固体培养基上进行培养;放线菌采用悬浮液10–3、10–4稀释梯度在高氏一号固体培养基上进行培养[25]。
1.4 Biolog-ECO板测定碳源利用情况土壤微生物功能多样性采用Biolog-ECO法测定,称取10 g新鲜的样品土壤,置于已灭菌的装有90 mL 0.85% NaCl溶液的三角瓶中,25 ℃、200 r/min振荡30 min,并用NaCl溶液稀释到10-3 g/mL后,向Biolog-ECO板的96个孔中加入150 μL稀释液,将接种好的Biolog-ECO板于25 ℃黑暗环境下培养10 d,每隔24 h在Biolog- ECO板读数仪上测定590 nm与750 nm波长下吸光值,并用OD590值与OD750值的差值来表征代谢活性,用于后续分析[26]。
1.5 数据处理试验中Biolog-ECO板上的碳源底物按照有机物化学官能团、微生物生理代谢途径以及生态功能的不同分成了6个大类,分别是碳水化合物类(12种)、羧酸类(5种)、多聚体(4种)、酚酸类(2种)和胺类(2种)共31种碳源底物[27],以此分析土壤微生物对不同类型碳源的利用情况[28]。
平均颜色变化率(average well color development,AWCD)是指Biolog-ECO板孔的吸光度平均值,代表样品土壤中微生物不同时间的平均活性,按公式(1)计算:

|
(1) |
式中:Ai为Biolog-ECO板上除空白孔外的各孔吸光值,A0为对照孔的吸光值,31为ECO板中的碳源数量。
Shannon多样性指数(H′值)按公式(2)和(3)计算:

|
(2) |

|
(3) |
丰富度指数S=微平板中碳源被利用的总数目(Ai-A0 > 0.25);
Simpson优势度指数(D值)的计算公式(4):
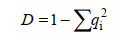
|
(4) |
Pielou均匀度指数(E值)的计算公式(5):

|
(5) |
碳源相对利用率=(培养第96 h的某一类碳源类型AWCD之和/31种碳源的AWCD之和)×100%。
上述相关试验数据采用Excel处理,单因素方差分析和Pearson相关性分析以及主成分分析利用SPSS 20.0软件进行,运用Excel 2019与R语言绘图。
1.6 主要试剂和仪器牛肉浸膏,广东环凯微生物科技有限公司;蛋白胨,北京奥博星生物技术有限责任公司;琼脂,北京酷来搏科技有限公司;Biolog-ECO板,Biolog公司。全功能微孔板检测仪,BioTek仪器公司。
牛肉膏蛋白胨、马丁-孟加拉红和高氏一号固体培养基的配制参考文献[25]。
2 结果与分析 2.1 不同地区不同植物根际土壤微生物数量土壤微生物能反映土壤能量代谢的旺盛程度,因此微生物数量在草原生产力中发挥着重要作用[29]。如表 2中土壤微生物的数量所示,在相同植被条件下,不同地区细菌、真菌、放线菌以及微生物总数都是格根塔拉草原 > 阿德格;在同一地区,不同植物间3种根际微生物数量及微生物总数存在显著性差异(P < 0.05),在阿德格样地中短花针茅根际土壤中细菌、真菌、放线菌数量及微生物总数均显著高于其他4种植物,格根塔拉草原中短花针茅根际土壤中放线菌的数量最低,H. altaicus根际土壤中真菌、放线菌数量及微生物总数高于其他植物。表明根际微生物随环境以及植物种类的改变而发生改变。
| 植物名称Specific name | 细菌Bacteria (×106 CFU/g) | 真菌Fungi (×103 CFU/g) | 放线菌Actinomycetes (×106 CFU/g) | 微生物总数Total number of microbes (×107 CFU/g) | |||||||
| ADG | GGTL | ADG | GGTL | ADG | GGTL | ADG | GGTL | ||||
| S. breviflora | 5.91a | 16.1a | 8.54a | 12.4a | 5.61a | 9.05d | 1.15a | 2.52d | |||
| A. frigida | 4.47c | 13.6c | 6.22b | 9.95b | 3.65b | 10.4c | 0.812c | 2.40e | |||
| A. tenuissimum | 5.14b | 13.8c | 5.51c | 11.9a | 3.58b | 12.2b | 0.873b | 2.60c | |||
| H. altaicus | 3.35d | 15.7a | 6.32b | 8.95c | 3.24c | 14.7a | 0.659e | 3.04a | |||
| C. ammannii | 5.13b | 14.8b | 6.42b | 9.77b | 2.51d | 12.3b | 0.764d | 2.71b | |||
| Total | 24 | 74 | 33.01 | 52.97 | 18.59 | 58.65 | 4.258 | 13.27 | |||
| 注:同列小写字母表示不同植物在0.05水平差异性显著.
Note: Lowercase letters in the same column indicate that different plants are significantly different at 0.05 level. | |||||||||||
AWCD表示土壤微生物群落对31种碳源的利用能力和代谢活性的变化,体现了土壤微生物群落生理功能多样性[30]。不同地区土壤AWCD值随着时间的增加而不断升高(图 1),而且呈“S”型趋势变化,均在1-2 d缓慢增加;2-6 d迅速增加,表明在整个培养过程中24 h后土壤中的微生物对31种碳源开始利用;第6天后增加速度减慢,逐渐呈平缓状态递增。对培养第3天[7]的土壤微生物AWCD值进行方差分析,结果表明(图 1),格根塔拉土壤微生物AWCD值明显高于阿德格样地;在阿德格草原短花针茅根际的土壤微生物碳代谢能力较其他4种植物高,格根塔拉草原中A. frigida根际的土壤微生物碳代谢能力最高,说明在不同环境中,土壤微生物碳代谢能力存在差异性,导致植物根际的土壤微生物对碳源的利用情况不同。

|
| 图 1 不同地区荒漠草原土壤微生物平均颜色变化率(AWCD) Figure 1 Soil microbes AWCD of desert steppe in different regions 注:A:短花针茅;B:冷蒿;C:细叶葱;D:阿尔泰狗娃花;E:银灰旋花. Note: A: S. breviflora; B: A. frigida; C: A. tenuissimum; D: H. altaicus; E: C. ammannii. |
|
|
不同类型的碳源被土壤微生物群落利用后吸光值存在一定的差异,从而反映出土壤微生物群落功能多样性的差异。测定培养96 h后土壤微生物的AWCD值、Shannon指数、Simpson指数和Pielou指数,以侧面反映土壤微生物群落多样性。如图 2所示,培养96 h后,5种植物根际土壤微生物在格根塔拉草原中的Shannon指数与Simpson指数表现出了高度的一致性,而在阿德格草原中5种植物的Shannon指数与Simpson指数有较大差异,阿德格样地中C. ammannii的Shannon指数与Simpson指数远低于其他植物,说明C. ammannii根际土壤微生物受环境影响较大。然而格根塔拉样地5种植物的Shannon指数与Simpson指数高于阿德格样地,说明格根塔拉草原的土壤微生物群落多样性高于阿德格样地,同时,环境改变时,不同植物使其根际土壤微生物的菌群结构、分布发生改变;两样地不同植物的Pielou指数无显著差异,表明两样地不同植物土壤微生物均一性相似。

|
| 图 2 培养96 h后不同植物根际土壤微生物AWCD值和多样性指数 Figure 2 AWCD values and diversity index of soil microbes of different plants after 96 h cultivation 注:A:AWCD值;B:Shannon指数;C:Simpson指数;D:Pielou指数,不同小写字母表示不同样地间显著性差异(P < 0.05). Note: A: AWCD value; B: Shannon index; C: Simpson index; D: Pielou index. Different lowercase letters indicate significant differences between different soil plots (P < 0.05). |
|
|
土壤微生物对不同碳源的利用能够反映出微生物的代谢功能类群。将96 h测定的AWCD值按照不同碳源利用特征进行热图绘制,如图 3所示,5种植物均可将以L-天门冬酰胺、r-羟基丁酸、L-丝氨酸和D-半乳糖醛酸等为碳源的功能微生物显著富集,且不同地区土壤微生物群落结构及功能均存在小的差异。对两样地不同植物根际土壤微生物单一碳源利用能力进一步进行方差分析,结果显示:阿德格样地中土壤微生物对L-天门冬酰胺、D-甘露醇、D-半乳糖酸γ内酯和D-纤维二糖的利用能力较高;格根塔拉样地中土壤微生物对L-天门冬酰胺和D-半乳糖醛酸、L-丝氨酸以及r-羟基丁酸有较高的利用能力。
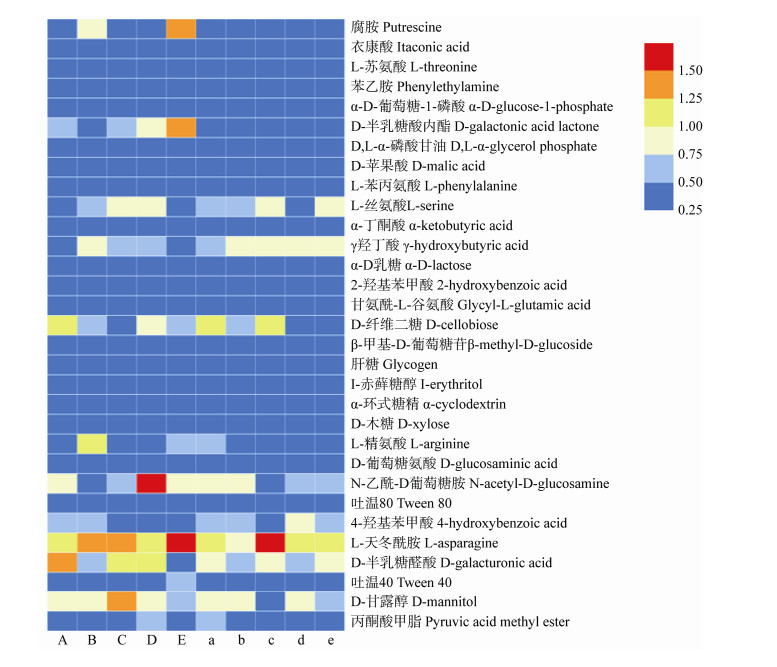
|
| 图 3 不同植物根际土壤微生物对不同碳源的利用特征图 Figure 3 Characteristic maps of different rhizosphere soil microbes using different carbon sources 注:红色表示对应样本中AWCD值较高的碳源,蓝色表示AWCD值较低的碳源;横向表示为样品信息,右侧纵向表示不同碳源,图例为碳源的AWCD值. A:S. breviflora (ADG);B:A. frigida (ADG);C:A. tenuissimum (ADG);D:H. altaicus (ADG);E:C. ammannii (ADG);a:S. breviflora (GGTL);b:A. frigida (GGTL);c:A. tenuissimum (GGTL);d:H. altaicus (GGTL);e:C. ammannii (GGTL). Note: Red indicates the carbon source with a higher AWCD value in the corresponding sample, blue indicates the carbon source with a lower AWCD value; The horizontal indicates the sample information, and the vertical on the right indicates the different carbon sources. The legend is the AWCD value of the carbon source. A: S. breviflora (ADG); B: A. frigida (ADG); C: A. tenuissimum (ADG); D: H. altaicus (ADG); E: C. ammannii (ADG); a: S. breviflora (GGTL); b: A. frigida (GGTL); c: A. tenuissimum (GGTL); d: H. altaicus (GGTL); e: C. ammannii (GGTL). |
|
|
为进一步了解不同样地下不同植物根际土壤微生物群落功能的差异,选用培育144 h土壤微生物对31种碳源的AWCD值进行PCA分析,提取2个主成分,用第l主成分(PC1)和第2主成分(PC2)作图表征土壤微生物的代谢特征。如图 4所示,两样地的S. breviflora位于PC1轴与PC2的正方向,A. tenuissimum位于PC1轴正方向与PC2的负方向,表面荒漠草原两样地S. breviflora和A. tenuissimum根际土壤微生物对碳源的利用较为相似。阿德格样地中H. altaicus和S. breviflora处于PC1轴与PC2的正方向,A. tenuissimum和C. ammannii位于PC1正轴与PC2负轴上,表明H. altaicus和S. breviflora以及A. tenuissimum和C. ammannii之间的碳源利用能力相似;格根塔拉样地中S. breviflora和C. ammannii位于PC1轴与PC2的正方向,A. tenuissimum和A. frigida位于PC1正轴与PC2负轴上,表明S. breviflora和C. ammannii以及A. tenuissimum和A. frigida之间的碳源利用能力相似。
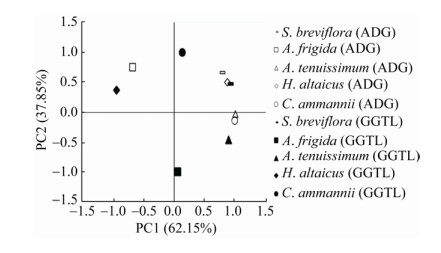
|
| 图 4 不同土壤微生物群落碳源利用主成分分析 Figure 4 Principal component analysis of different soil microbes community carbon sources utilization |
|
|
通过表 3相关性分析表明,土壤微生物AWCD和多样性指数与细菌、放线菌以及土壤微生物总数极显著正相关性(P < 0.01),优势度指数植物与微生物数量呈显著正相关(P < 0.05),均匀度指数与细菌、放线菌以及土壤微生物总数呈显著负相关关系(P < 0.05),表明在一般情况下,细菌和放线菌含量越高,土壤微生物碳代谢能力和微生物群落多样性越丰富。
| 项目 Items |
AWCD值 AWCD value |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
Pielou指数 Pielou index |
| 细菌Bacteria | 0.844** | 0.807** | 0.741* | -0.654* |
| 真菌Fungi | 0.661* | 0.712* | 0.669* | -0.611 |
| 放线菌 Actinonmycetes |
0.825** | 0.806** | 0.751* | -0.661* |
| 微生物总数 Total number of microbes |
0.850** | 0.821** | 0.759* | -0.669* |
| 注:*:在0.05水平上显著相关;**:在0.01水平上显著相关.
Note: *: Significantly correlated at 0.05 level; **: Significantly correlated at 0.01 level. | ||||
土壤微生物作为土壤环境的重要组分,是衡量土壤微生物活性的重要指标之一,土壤微生物群落功能多样性在维持土壤生态系统稳定性中起着重要作用。植物生长、土壤肥力、物质循环和能量转化都与土壤微生物的活性有极大的相关性[31]。通过分析阿德格草原和格根塔拉草原5种植物根际土壤微生物群落对不同碳源的利用能力,即对有机质的分解转化能力,可深入探讨不同程度荒漠草原不同植物根际微生物群落的功能多样性,更好地反映群落总体的动态变化。可培养微生物只占整个土壤微生物群落的一小部分,利用传统的培养分离技术很难反映土壤微生物的多样性,Biolog-ECO板法虽可快速、简便地获得大量快速生长的土壤微生物群落功能多样性方面的信息[7, 32],但不能揭示土壤微生物群落结构的详细信息。在荒漠地区,干旱植物群落下的土壤中必然生长着各种生长速度的微生物。因此,本实验将传统的培养分离技术与Biolog-ECO板法相结合,以探讨不同植物对土壤微生物数量以及群落代谢功能多样性的影响。
通过传统的培养分离技术研究发现,不同样地不同植物根际土壤细菌、真菌、放线菌的数量和微生物总数存在显著性差异(P < 0.05),在阿德格样地中S. breviflora根际土壤中细菌、真菌、放线菌和微生物的总数均显著高于其他4种植物,格根塔拉草原中S. breviflora根际土壤中放线菌的数量最低,H. altaicus真菌数量、放线菌数量、微生物总数高于其他植物。在草原生态系统中,季节变换、温度以及土壤的湿度等都是改变土壤微生物数量的主要因素[9],而S. breviflora作为草原的建群种植物,微生物数量高于其他几种植物。利用Biolog-ECO板法将格根塔拉草原和阿德格草原5种植物根际土壤微生物对碳源的利用情况进行分析发现:两个样地不同植物对土壤微生物群落碳源代谢活性变化趋势基本一致,随培养时间延长呈“S”型趋势渐增:24 h前变化缓慢,24-144 h AWCD值快速增长,144 h后趋于平缓,在荒漠化草原中植物根际土壤微生物群落对碳源的利用情况较差,不能较快地适应环境碳源[33]。格根塔拉草原的5种植物根际土壤的AWCD值均高于阿德格草原,而且不同样地的5种植物随着培养时间的推移,AWCD值也存在明显差异,说明植被类型是影响根际土壤微生物群落多样性的因素之一,在环境条件一致的情况下,不同植物对土壤微生物群落结构以及多样性具有一定程度的影响[34]。目前Shannon指数(H′)和Simpson (D)指数是应用最为广泛的群落多样性指数,用来衡量土壤微生物多样性[32]。通过对格根塔拉草原和阿德格草原5种植物土壤微生物的Shannon指数(H′)、Simpson指数(D)和Pielou指数(E)分析,两样地不同植物的Shannon指数(H′)与Simpson指数(D)表现出了高度的一致性,而且格根塔拉草原的土壤微生物群落多样性和常见菌群的优势度均高于阿德格草原;5种植物根际土壤微生物在阿德格草原的H′值与D值有较大差异,C. ammannii H′值与D值更是远低于其他植物,说明不同土壤环境等均对土壤微生物活性、功能类群具有一定影响[35]。C. ammannii植株矮小,对不良环境适应能力较弱,使根系附近土壤微生物群落减少。两样地不同植物的Pielou指数无显著差异,表明两样地不同植物土壤微生物均一性相似。
不同植物根系对土壤中碳源的有效利用有一定差异,使得31种单一碳源被不同植被根际土壤微生物利用时差异显著。两样地5种植物根际微生物均对L-天门冬酰胺有较高的利用能力,除此之外,对其他氨基酸类碳源(L-精氨酸和L-丝氨酸)和碳水化合物类碳源(D-甘露醇和D-半乳糖醛酸)也有较高的利用能力,氨基酸类和碳水化合物类是这5种植物根际土壤微生物群落的敏感碳源[15]。不同样地同种植物根际土壤微生物对碳源的利用各不相同,C. ammannii根际土壤微生物在不同样地中对不同碳源利用的差异更为显著,阿德格样地中对L-天门冬酰胺、D-甘露醇、D-半乳糖酸γ内酯和D-纤维二糖的利用能力较高;格根塔拉样地对L-天门冬酰胺、D-半乳糖醛酸、L-丝氨酸以及r-羟基丁酸有较高的利用能力,而草原环境、土壤状况以及植物群落的差异导致土壤微生物对各类底物的适应发生了变化[36]。通过对不同草原不同植物根际土壤微生物的碳源利用情况进行主成分分析,发现导致5种植物根际土壤微生物群落变化的主要碳源是碳水化合物类和氨基酸类。阿德格草原和格根塔拉草原中S. breviflora和A. tenuissimum根际土壤微生物对碳源的利用较为相似。两个样地其他植物土壤微生物对碳源的利用模式均有极大的差异。通过对土壤微生物AWCD和功能多样性与土壤微生物数量相关性分析表明,微生物数量越高,土壤微生物碳代谢能力微生物群落功能多样性越丰富。
4 结论四子王旗是内蒙古自治区重要的生态资源和经济来源,近年来,自然灾害和各种非自然条件的改变给四子王旗草原带来了很大程度的伤害,草原不断退化,植被生长环境逐渐恶化,损害了该生态系统的自我调节能力,加剧了该草原的荒漠化,导致了该地区原生物种的消退及其他物种的入侵,极大程度地影响了土壤微生物群落组成。因此,对四子王旗2个草原类型中5种植物根际土壤中微生物群落的差异和关联进行研究发现:(1)两样地中可培养土壤微生物数量存在显著性差异(P < 0.05);土壤微生物的AWCD曲线变化基本一致呈“S”型,且格根塔拉样地的5种植物根际土壤的AWCD值均高于阿德格样地。(2)在Biolog-ECO板培养96 h后,发现阿德格样地中5种植物Shannon指数(H′)与Simpson指数(D)差异显著;5种植物根际土壤微生物群落利用碳源的主要利用类型为氨基酸类和碳水化合物,而且均对氨基酸类的L-天门冬酰胺具有较高的利用率,两样地中环境差异对S. breviflora和A. tenuissimum碳源利用的能力影响较小。(3)阿德格样地中H. altaicus和S. breviflora以及A. tenuissimum和C. ammannii之间的碳源利用能力相似;格根塔拉样地中S. breviflora和C. ammannii以及A. tenuissimum和A. frigida之间的碳源利用能力相似。(4)根际土壤微生物的AWCD和多样性指数与细菌、放线菌数量以及土壤微生物总数呈极显著正相关性(P < 0.01),匀度指数与细菌、放线菌数量以及土壤微生物总数呈显著负相关(P < 0.05)。
| [1] |
Jin YX, Liu F, Zhang XJ, et al. Responses of net carbon exchange to stocking rate in Stipa breviflora desert steppe[J]. Ecology and Environmental Sciences, 2018, 27(4): 643-650. (in Chinese) 靳宇曦, 刘芳, 张新杰, 等. 短花针茅荒漠草原生态系统净碳交换对载畜率的响应[J]. 生态环境学报, 2018, 27(4): 643-650. |
| [2] |
Liu N. Evaluation of ecosystem service of desert steppe in Inner Mongolia under different grazing intensity—A case study of Siziwangqi desert steppe[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2016 (in Chinese) 刘娜.放牧对内蒙古荒漠草原生态系统服务功能影响的评估——以四子王旗荒漠草原为例[D].北京: 中国农业科学院硕士学位论文, 2016 |
| [3] |
Yu YJ, Li YJ, Li QC, et al. Effect of different land use types on soil nutrient contents under grassland, woodland and cultivated land in the farming—pastoral ecotone in the Siziwang Banner of Inner Mongolia[J]. Journal of Northern Agriculture, 2019, 47(2): 66-72. (in Chinese) 余雅婧, 李跃进, 李青春, 等. 农牧交错带土地利用方式对土壤养分的影响——以内蒙古四子王旗为例[J]. 北方农业学报, 2019, 47(2): 66-72. |
| [4] |
Gao YN, Zhao ML, Wang HL, et al. Evolution of grassland ecological footprints based on variable structures of farming-pasturing interlocked areas[J]. Chinese Journal of Eco-Agriculture, 2019, 27(5): 774-784. (in Chinese) 高艺宁, 赵萌莉, 王宏亮, 等. 基于结构突变的农牧交错带草地生态足迹演变阶段分析[J]. 中国生态农业学报, 2019, 27(5): 774-784. |
| [5] |
Zhang RY, Wang ZW, Han GD, et al. The response of plant alpha diversity to different grazer stocking rate in a Stipa breviflora desert steppe[J]. Acta Ecologica Sinica, 2017, 37(3): 906-914. (in Chinese) 张睿洋, 王忠武, 韩国栋, 等. 短花针茅荒漠草原α多样性对绵羊载畜率的响应[J]. 生态学报, 2017, 37(3): 906-914. |
| [6] |
Cai XB, Qian C, Zhang YQ. Characterization of soil biological properties on degraded alpine grasslands[J]. Chinese Journal of Applied Ecology, 2007, 18(8): 1733-1738. (in Chinese) 蔡晓布, 钱成, 张永清. 退化高寒草原土壤生物学性质的变化[J]. 应用生态学报, 2007, 18(8): 1733-1738. |
| [7] |
Liu Y, Li SX, Yin YL, et al. Analysis on soil microbial community characteristics of black soil beach degraded grassland based on Biolog fingerprint[J]. Ecology and Environmental Sciences, 2019, 28(7): 1394-1403. (in Chinese) 刘燕, 李世雄, 尹亚丽, 等. 基于Biolog指纹解析黑土滩退化草地土壤微生物群落特征[J]. 生态环境学报, 2019, 28(7): 1394-1403. |
| [8] |
Li S, Shakoor A, Wubet T, et al. Fine-scale variations of fungal community in a heterogeneous grassland in Inner Mongolia: Effects of the plant community and edaphic parameters[J]. Soil Biology and Biochemistry, 2018, 122: 104-110. |
| [9] |
Bi JT, He DH, Sha YX, et al. Functional diversity of soil microbial community under different types of vegetation in the desert grassland[J]. Agricultural Research in the Arid Areas, 2009, 27(5): 149-155. (in Chinese) 毕江涛, 贺达汉, 沙月霞, 等. 荒漠草原不同植被类型土壤微生物群落功能多样性[J]. 干旱地区农业研究, 2009, 27(5): 149-155. |
| [10] |
Bi JT, He DH, Huang ZY, et al. Response of soil microbial community activity to vegetation restoration in degraded ecological system[J]. Journal of Soil and Water Conservation, 2008, 22(4): 195-200. (in Chinese) 毕江涛, 贺达汉, 黄泽勇, 等. 退化生态系统植被恢复过程中土壤微生物群落活性响应[J]. 水土保持学报, 2008, 22(4): 195-200. |
| [11] |
Gao XF, Han GD, Zhang GG. Soil microbial community structure and composition of Stipa breviflora on the desert steppe[J]. Acta Ecologica Sinica, 2017, 37(15): 5129-5136. (in Chinese) 高雪峰, 韩国栋, 张国刚. 短花针茅荒漠草原土壤微生物群落组成及结构[J]. 生态学报, 2017, 37(15): 5129-5136. |
| [12] |
Tan HY, Chen BR, Yan RR, et al. Advances on soil microbiological characteristics of grassland ecosystems and its response to human disturbances[J]. Acta Agrestia Sinica, 2014, 22(6): 1163-1170. (in Chinese) 谭红妍, 陈宝瑞, 闫瑞瑞, 等. 草地土壤微生物特性及其对人为干扰响应的研究进展[J]. 草地学报, 2014, 22(6): 1163-1170. |
| [13] |
Yang YF, Wu LW, Lin QY, et al. Responses of the functional structure of soil microbial community to livestock grazing in the Tibetan alpine grassland[J]. Global Change Biology, 2013, 19(2): 637-648. |
| [14] |
Yin YL, Wang YQ, Li SX, et al. Study on seasonal various of characteristics of soil microbial community at degraded alpine meadows in the Three-River-Source Area[J]. Ecology and Environmental Sciences, 2018, 27(10): 1791-1800. (in Chinese) 尹亚丽, 王玉琴, 李世雄, 等. 三江源区退化高寒草甸土壤微生物群落季节特征研究[J]. 生态环境学报, 2018, 27(10): 1791-1800. |
| [15] |
Jin YH, Wu HP, Tan FZ, et al. Study on functional diversity of soil microorganism in different mangrove plants based on Biolog-ECO technology[J]. Ecology and Environmental Sciences, 2017, 26(8): 1292-1300. (in Chinese) 金映虹, 吴红萍, 谭方正, 等. 不同红树植物类群土壤微生物功能多样性的研究[J]. 生态环境学报, 2017, 26(8): 1292-1300. |
| [16] |
Tian YN, Wang HQ. Application of Biolog to study of environmental microbial function diversity[J]. Environmental Science & Technology, 2011, 34(3): 50-57. (in Chinese) 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术, 2011, 34(3): 50-57. |
| [17] |
Wang P, Zhu WW, Niu YB, et al. Effects of nitrogen addition on plant community composition and microbial biomass ecological stoichiometry in a desert steppe in China[J]. Chinese Journal of Plant Ecology, 2019, 43(5): 427-436. (in Chinese) 王攀, 朱湾湾, 牛玉斌, 等. 氮添加对荒漠草原植物群落组成与微生物生物量生态化学计量特征的影响[J]. 植物生态学报, 2019, 43(5): 427-436. |
| [18] |
Yang Y, Jia LX, Qiao JR, et al. Effects of heavy grazing on soil nutrients and microbial diversity in desert steppe[J]. Chinese Journal of Grassland, 2019, 41(4): 72-79. (in Chinese) 杨阳, 贾丽欣, 乔荠瑢, 等. 重度放牧对荒漠草原土壤养分及微生物多样性的影响[J]. 中国草地学报, 2019, 41(4): 72-79. |
| [19] |
Sun X, Shen Y, Schuster MJ, et al. Initial responses of grass litter tissue chemistry and N:P stoichiometry to varied N and P input rates and ratios in Inner Mongolia[J]. Agriculture, Ecosystems & Environment, 2018, 252: 114-125. |
| [20] |
Li H, Yao QZ, Zhang X, et al. Effects of Suillus luteus on rhizosphere soil fungal diversity of Pinus sylvestris var. mongolica and Pinus tabulaeformis[J]. Mycosystema, 2019, 38(7): 1071-1081. (in Chinese) 李慧, 姚庆智, 张星, 等. 褐环乳牛肝菌对樟子松和油松根际土壤真菌多样性的影响[J]. 菌物学报, 2019, 38(7): 1071-1081. |
| [21] |
Diao C, Lu XK, Tian J, et al. Effects of long-term nitrogen addition on the metabolic diversity of microbial carbon sources in subtropical forest soils[J]. Acta Ecologica Sinica, 2019, 39(18): 6622-6630. (in Chinese) 刁婵, 鲁显楷, 田静, 等. 长期氮添加对亚热带森林土壤微生物碳源代谢多样性的影响[J]. 生态学报, 2019, 39(18): 6622-6630. |
| [22] |
Jiang JR, Xue LG, Shang H, et al. Analysis of the carbon metabolic properties and functional diversity of airborne microbial communities in Lanzhou City[J]. Journal of Microbiology, 2017, 37(6): 81-86. (in Chinese) 姜金融, 薛林贵, 尚海, 等. 兰州市空气微生物群落的碳代谢特征及功能多样性研究[J]. 微生物学杂志, 2017, 37(6): 81-86. |
| [23] |
Li XM. Study on dark septate endophytes of defferent plants in the desert steppe of Siziwang Banner[D]. Hohhot: Master's Thesis of Inner Mongolla Agricultural University, 2019 (in Chinese) 李雪梦.四子王旗荒漠草原植物深色有隔内生真菌(DSE)研究[D].呼和浩特: 内蒙古农业大学硕士学位论文, 2019 |
| [24] |
Meng HQQG, Liu L, Yao QZ, et al. Rhizosphere soil microorganism quantity and enzyme activity of 3 tree species in Daqing Mountain[J]. Chinese Agricultural Science Bulletin, 2018, 34(17): 89-94. (in Chinese) 孟和其其格, 刘雷, 姚庆智, 等. 大青山不同树种土壤微生物数量及酶活性的研究[J]. 中国农学通报, 2018, 34(17): 89-94. |
| [25] |
Zhao PL. Community structure of soil microorganism in coal-based solid waste and biomass preparation[D]. Hohhot: Master's Thesis of Inner Mongolia University, 2017 (in Chinese) 赵佩伦.煤基固废与生物质配制再造土壤微生物的群落结构特征[D].呼和浩特: 内蒙古大学硕士学位论文, 2017 |
| [26] |
Tang K. Community structure and diversity of bacteria in biological soil crusts of Hunshandake deserts[D]. Hohhot: Master's Thesis of Inner Mongolia Agricultural University, 2016 (in Chinese) 唐凯.浑善达克沙地生物土壤结皮细菌多样性和群落结构研究[D].呼和浩特: 内蒙古农业大学硕士学位论文, 2016 |
| [27] |
Wang Q, Dai JL, Wu DQ, et al. Statistical analysis of data from BIOLOG method in the study of microbial ecology[J]. Acta Ecologica Sinica, 2010, 30(3): 817-823. (in Chinese) 王强, 戴九兰, 吴大千, 等. 微生物生态研究中基于BIOLOG方法的数据分析[J]. 生态学报, 2010, 30(3): 817-823. |
| [28] |
Chen YZ, Tang QY, Gu MY, et al. Microbial distribution characteristics around the roots of Kalidium foliatum and the effect of salt concentrations on microbial metabolism analysis[J]. Microbiology China, 2019, 46(11): 2900-2908. (in Chinese) 陈禹竹, 唐琦勇, 顾美英, 等. 盐爪爪根部微生物分布特征及盐浓度对碳源代谢分析的影响[J]. 微生物学通报, 2019, 46(11): 2900-2908. |
| [29] |
Li XM, Yao QZ, Cui L, et al. Soil enzyme activity and microorganisms quantity of rhizosphere typical forest tree species in Yinshan mountains[J]. Journal of Arid Land Resources and Environment, 2019, 33(10): 150-155. (in Chinese) 李雪梦, 姚庆智, 崔丽, 等. 阴山山脉典型森林植被土壤酶活性与微生物数量的研究[J]. 干旱区资源与环境, 2019, 33(10): 150-155. |
| [30] |
Guo Y, Wang YM, Wu P, et al. Influence of long-term manure application in paddy soil on the functional diversity of microbial community[J]. Chinese Journal of Applied & Environmental Biology, 2019, 25(3): 593-602. (in Chinese) 郭莹, 王一明, 巫攀, 等. 长期施用粪肥对水稻土中微生物群落功能多样性的影响[J]. 应用与环境生物学报, 2019, 25(3): 593-602. |
| [31] |
Deng JJ, Zhou YB, Yin Y, et al. Effects of mixed Pinus tabuliformis and Quercus mongolica plantation on the functional diversity of soil microbial community[J]. Chinese Journal of Ecology, 2017, 36(11): 3028-3035. (in Chinese) 邓娇娇, 周永斌, 殷有, 等. 油松和蒙古栎混交对土壤微生物群落功能多样性的影响[J]. 生态学杂志, 2017, 36(11): 3028-3035. |
| [32] |
Lv CY, Chen CY, Ge F, et al. The new development of the research method for molecular microbial ecology[J]. China Biotechnology, 2012, 32(8): 111-118. (in Chinese) 吕昌勇, 陈朝银, 葛锋, 等. 微生物分子生态学研究方法的新进展[J]. 中国生物工程杂志, 2012, 32(8): 111-118. |
| [33] |
Wang JY, Wang ML, Zhang FH. Soil microbial properties under typical halophytic vegetation communities in arid regions[J]. Acta Ecologica Sinica, 2016, 36(8): 2363-2372. (in Chinese) 王静娅, 王明亮, 张凤华. 干旱区典型盐生植物群落下土壤微生物群落特征[J]. 生态学报, 2016, 36(8): 2363-2372. |
| [34] |
Kennedy N, Connolly J, Clipson N. Impact of lime, nitrogen and plant species on fungal community structure in grassland microcosms[J]. Environmental Microbiology, 2005, 7(6): 780-788. |
| [35] |
Fisk MC, Ruether KF, Yavitt J B. Microbial activity and functional composition among northern peatland ecosystems[J]. Soil Biology and Biochemistry, 2003, 35(4): 591-602. |
| [36] |
Li FX, Wang XQ, Guo YZ, et al. Study of microbial diversity and the soil enzyme activity in different salinized soil in Ningxia Yellow River irrigation region[J]. Research of Soil and Water Conservation, 2013, 20(1): 61-65. (in Chinese) 李凤霞, 王学琴, 郭永忠, 等. 宁夏引黄灌区不同盐化程度土壤酶活性及微生物多样性研究[J]. 水土保持研究, 2013, 20(1): 61-65. |
 2020, Vol. 47
2020, Vol. 47