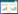扩展功能
文章信息
- 曹敏, 胡开治, 刘燕琴, 刘春雷, 唐祥友, 肖忠, 余米
- CAO Min, HU Kai-Zhi, LIU Yan-Qin, LIU Chun-Lei, TANG Xiang-You, XIAO Zhong, YU Mi
- 高通量测序分析重庆地区茅苍术根际丛枝菌根真菌多样性
- Arbuscular mycorrhizal fungi diversity in rhizosphere soil of Atractylodes lancea (Thunb.) DC. in Chongqing region by high-throughput sequencing
- 微生物学通报, 2020, 47(9): 2877-2886
- Microbiology China, 2020, 47(9): 2877-2886
- DOI: 10.13344/j.microbiol.china.200670
-
文章历史
- 收稿日期: 2020-07-01
- 接受日期: 2020-08-08
- 网络首发日期: 2020-08-14
苍术(Atractylodes lancea)为菊科苍术属多年生草本药用植物,以干燥根茎入药,是我国的大宗药材之一。其具有燥湿健脾、祛风散寒、明目的功效,常用于治疗湿阻中焦、脘腹胀满、泄泻、水肿、脚气痿躄、风湿痹痛、风寒感冒、夜盲、眼目昏涩等[1]。我国南方种植的苍术种类多为茅苍术[Atractylodes lancea (Thunb.) DC.],主要分布于江苏、浙江、山东、山西、湖北、四川和重庆等地[2]。随着市场需求的增加,野生资源逐渐枯竭,人工栽培面积逐渐扩大,仅重庆地区的栽培总量就达到200 hm2。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是广泛分布的土壤微生物,能与90%以上的陆生和水生植物形成共生体,参与植物的生理代谢过程[3-5]。AMF以其庞大的菌丝网络系统将植物与土壤有机地联合起来,增强植物对矿质营养和水分的吸收。郭兰萍等以苍术生物量为基础考察苍术菌根的依赖性,发现苍术对AMF依赖性很强,高达245%,表明接种AMF对苍术幼苗的生长有很大的促进作用[6]。另外,接种摩西球囊霉(Glomus mosseae)可以促进苍术根系对土壤养分的吸收,提高苍术根际土壤微生物的多样性及代谢活性,促进苍术的营养生长[6],促进苍术苗挥发油积累[7]。曾燕等在对丛枝菌根及其在中药栽培中的应用进行了讨论,认为AMF在药用植物的药效成分、抗逆性、连作障碍等方面具有积极作用,AMF在中药材栽培研究领域具有广泛的应用前景[8]。目前国内外未见对茅苍术根际土壤AMF多样性研究的报道。
为了揭示重庆茅苍术主产区土壤AMF的结构与组成,解析土壤因子对AMF类群的影响,本研究以重庆不同地区种植的茅苍术根际土壤为材料,利用Illumina MiSeq 2500测序平台进行真菌扩增子测序,研究重庆地区茅苍术主产区AMF类群的结构组成、丰度和遗传多样性,并解析土壤因子对AMF类群的影响,以期为AMF资源发掘和物种多样性研究提供依据。
1 材料与方法 1.1 主要试剂和仪器NucleoSpin 96 Soil,Macherey-Nagel (MN)公司;KOD FX Neo,东洋纺(上海)生物科技有限公司;Phusion高保真酶、Monarch DNA胶回收试剂盒,NEB公司;DNA纯化试剂盒,Omega公司。96 Well PCR仪,AB公司;酶标仪,基因有限公司;NanoDrop 2000,Thermo公司;显微镜,Olympus公司;pH计,上海仪电科学仪器股份有限公司;火焰光度计,上海精科实业有限公司。
1.2 样地概况及样品采集土壤样品于2019年9月采自重庆境内茅苍术主产区的5个区县,包括彭水县、秀山县、石柱县、南川区和酉阳县,栽培面积占重庆茅苍术总栽培面积的2/3。每个区县设一个采样点,随机选取3个茅苍术栽培地块,每个栽培地按5点取样法挖取5株茅苍术根际土混合均匀取一个样。每个区县取3个重复,共15个土壤样品,分别记为:PS (彭水县棣棠乡)、XS (秀山县回星村)、SZ (石柱县三河乡三店村)、NC (南川区金山镇小河坝社区)、YY (酉阳县木叶乡梨耳村)。所采样品均为以种根栽植2-3年的茅苍术根际土壤,均为砂壤土。取样时去除土壤表层的杂草、草根、石砾等杂物,挖出茅苍术植株,连带土壤一起装入无菌自封袋,随即带回实验室处理。收集粘附于根系表面的土壤作为根际土壤,用于检测分析AMF多样性,多余的土壤样品置于低温通风处风干保存,用于检测土壤基本理化性质、孢子密度,采样点基本信息见表 1。同时,将茅苍术新鲜的须根系剪下用FAA固定液固定,用于AMF菌丝及侵染情况观察。
| 采样点 Sample site |
栽培面积 Cultivation area (hm2) |
经/纬度 Longitude/Latitude |
海拔 Elevation (m) |
土壤类型 Soil type |
样本数 Number of sample |
| PS | 30 | E108°13′50″ N29°38′6″ |
967 | 砂壤土 Sandy loam |
3 |
| XS | 70 | E108°52′30″ N28°28′12″ |
924 | 砂壤土 Sandy loam |
3 |
| SZ | 20 | E108°12′54″ N30°1′43″ |
974 | 砂壤土 Sandy loam |
3 |
| NC | 15 | E107°6′28″ N28°57′35″ |
1 124 | 砂壤土 Sandy loam |
3 |
| YY | 40 | E108°56′46″ N29°11′8″ |
1 096 | 砂壤土 Sandy loam |
3 |
pH值用pH计进行测定;碱解氮采用碱解扩散法测定;速效磷采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾采用乙酸铵-火焰光度计法测定;有机质采用重铬酸钾法测定。
1.4 茅苍术根系中AMF的侵染情况观察及根际土壤中AMF孢子密度(spore density)检测采用墨水醋染色法测定菌根侵染率(公式1)[9]:取FAA固定液固定后的根系,用自来水清洗干净,剪成1 cm小段。先用10% KOH溶液90 ℃水浴0.5-1.0 h,然后用蒸馏水漂洗干净;再用碱性双氧水(1 mL 10% NaOH+10 mL 10% H2O2加H2O定容至200 mL)室温脱色30 min,用蒸馏水漂洗干净,控干水分;再用墨水醋(95 mL家用白醋+5 mL蓝黑墨水)煮开染色3-5 min,清水冲洗3-4次,此时的根段可放在水中保存;制片后在显微镜下检查每条根段的侵染情况(包括入侵点、菌丝、丛枝、泡囊等),并记录拍照。
其中,0表示整条根段均未被侵染,10表示有10%长度根段被侵染形成菌根,20表示有20%长度根段被侵染形成菌根,以此类推,100则表示整条根段全部被侵染。
采用湿筛倾析-蔗糖离心法[10]分离AMF孢子,在解剖镜下记录孢子数量(1个孢子果按1个孢子计数)。计算根际土壤中AMF的孢子密度(spore density),以每10 g风干土样中含有的孢子数表示;采用SPSS 16.0统计软件对实验数据进行统计分析。
1.5 土壤总DNA的提取与测序根际土中微生物DNA采用试剂盒NucleoSpin 96 Soil进行提取。提取的DNA在1.0%琼脂糖凝胶中通过电泳检测其质量,同时利用NanoDrop 2000测定其浓度,合格后用于构建文库。以各样品总DNA为模板,进行融合引物PCR。PCR扩增引物为丛枝菌根真菌AMF的特异性引物AMV4.5NF (5′-AAGCTCGTAGTTGAATTTCG-3′)和AMDGR (5′-CCCAACTATCCCTATTAATCAT-3′)[11]。PCR反应体系(10 μL):样品基因组DNA 50 ng,引物AMV4.5NF (10 μmol/L)和AMDGR (10 μmol/L)各0.3 μL,2×KOD FX Neo Buffer 5 μL,dNTPs (2 mmol/L) 2 μL,KOD FX Neo (1.0 U/μL) 0.2 μL,ddH2O补足至10 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,共25个循环;72 ℃ 7 min;4 ℃保存。使用琼脂糖凝胶电泳检测PCR扩增产物的纯度,采用DNA纯化试剂盒进行过柱纯化,纯化后作为二轮PCR扩增的模板,按PCR产物浓度进行等量混样,并再次纯化,用1.8%琼脂糖凝胶回收目的片段,在Illumina MiSeq 2500测序平台进行高通量测序。由北京百迈客生物科技有限公司完成测序,再对原始数据进行拼接,将拼接得到的序列进行质量过滤,并去除嵌合体,得到高质量的Tags序列。在相似性97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OTU。并使用BLAST比对MaarjAM分类学数据库,移除非AMF的OTU,再次比对,对OTU进行分类学注释。
1.6 分析方法采用Mothur (V1.30)软件对样品α多样性指数进行评估。采用ANOVA对土壤理化性质、AMF多样性指数以及物种的组间差异进行统计分析。用到的绘图工具有R语言、Python语言等。
2 结果与分析 2.1 土壤理化性质由表 2可知,重庆地区茅苍术主产地土壤均为酸性土壤,pH范围是4.63-6.32。除秀山的栽培地土壤碱解氮为缺氮水平,其余4个区县均属中等水平。5个区县采样点土壤有效磷和速效钾含量均为丰富,而从有机质来看,除石柱的栽培地土壤属于中等肥力水平外,其余4个区县茅苍术栽培地土壤均属于高肥力水平。

|
(1) |
| 采样点 Location |
酸碱度 pH |
碱解氮 Available nitrogen (mg/kg) |
有效磷 Available phosphorus (mg/kg) |
速效钾 Available potassium (mg/kg) |
有机质 Organic matter (%) |
| PS | 5.23±0.25b | 65.24±5.78b | 123.80±31.48b | 778.49±65.18a | 2.39±0.19ab |
| XS | 6.32±0.26c | 55.29±2.67ab | 58.81±15.66a | 773.12±46.56a | 2.50±0.65ab |
| SZ | 4.63±0.13a | 27.46±3.64a | 82.05±17.78ab | 654.84±153.86a | 1.25±0.09a |
| NC | 4.86±0.06ab | 69.45±21.12b | 82.05±9.09ab | 687.10±42.67a | 2.19±0.68ab |
| YY | 5.34±0.18b | 73.41±6.55b | 38.40±6.76a | 843.01±76.22a | 3.31±0.52b |
| 注:同一列数据后不同字母表示在P < 0.05水平上差异显著.
Note: Data with different superscripts in the same column indicate significant difference at P < 0.05. | |||||
重庆5个区县的茅苍术栽培地均存在AMF,而且茅苍术根系受到AMF的侵染(表 3)。5个区县茅苍术的AMF侵染率均在50%以上,秀山(XS)和酉阳(YY)的茅苍术菌根侵染率均大于90%。另外,各采样点AMF土壤孢子含量丰富,均在每10 g风干土壤50个以上,最高达到144个。此外,茅苍术菌根侵染率与土壤AMF孢子含量变化趋势基本相同,XS、SZ和YY地区的茅苍术菌根侵染率和孢子密度均显著高于PS和NC地区。
| 采样点 Location |
侵染率 Infection rate (%) |
孢子密度(个/10 g风干土样) Spore density (number/10 g air drying soil) |
| PS | 56.25±8.65b | 64±4.58c |
| XS | 90.00±14.77a | 118±11.14b |
| SZ | 82.50±12.92a | 133±7.21ab |
| NC | 51.25±13.97b | 50±2.65c |
| YY | 95.00±5.53a | 144±8.08a |
| 注:同一列数据后不同字母表示在P < 0.05水平上差异显著.
Note: Data with different superscripts in the same column indicate significant difference at P < 0.05. | ||
所有样品经PCR检测合格后构建文库并测序。由表 4可知,各采样点的土壤样品获得的有效序列数差异明显,均在5万条以上,以酉阳县茅苍术根际土壤测得的有效序列数最多,为60 751条。各采样点土壤样品的有效序列百分比均在90%以上,平均序列长度在217-220 bp之间。
| 测序数据 Sequencing data |
PS | XS | SZ | NC | YY |
| 原始序列数 Raw Tags |
53 238 | 52 160 | 59 624 | 56 563 | 63 184 |
| 有效序列数 Effective Tags |
51 408 | 50 340 | 56 151 | 53 883 | 60 751 |
| 有效序列百分比 Effective (%) |
93.24 | 91.88 | 90.45 | 91.09 | 92.27 |
| 平均序列长度 AvgLen (bp) |
219 | 220 | 217 | 218 | 217 |
Shannon指数稀释曲线反映各样本在不同测序数量时的微生物多样性。由图 1可知,各采样点供试样品的稀释曲线已趋于平滑,表明样品测序数据量足够大,测得的数据能反映土壤中AMF群落的真实情况,可进行数据分析。另外,由图 1可知,各采样点土样的Shannon指数XS > YY > PS > NC > SZ,说明各采样点AMF多样性由高到低依次为XS、YY、PS、NC、SZ。

|
| 图 1 各土壤样品的Shannon指数稀释曲线 Figure 1 Shannon index dilution curves of each soil sample |
|
|
统计了各样品的OTU覆盖率(coverage),均在0.999 3-0.999 7之间,说明本次检测结果能代表样本中AMF的多样性。α多样性用于反映样品物种丰度及多样性,多样性指标包括均匀度指数ACE、丰度指数Chao1、多样性指数Simpson和Shannon。由表 5可知,各采样点间OTU和均匀度指数ACE无显著性差异。丰度指数Chao1显示,茅苍术根际土壤的AMF丰度依次为SZ > XS > YY > NC > PS。除SZ地区显著高于PS地区外,其余采样点间差异性均不显著。另外,Shannon指数显示XS地区显著高于其他采样点,其他采样点间Shannon指数差异不显著;而Simpson指数则相反,XS地区显著低于其他采样点。Simpson和Shannon指数均表明XS地区茅苍术根际土壤的AMF多样性最高,其次为YY地区。这与图 2中各采样点的AMF种类统计结果一致,XS地区土样中AMF种类最多,共检测到73种;其次为YY地区,共66种。
| 采样点 Location |
OTU数 OTUs |
ACE指数 ACE index |
Chao1指数 Chao1 index |
Simpson指数 Simpson index |
Shannon指数 Shannon index |
| PS | 171a | 196a | 188a | 0.098b | 3.10a |
| XS | 191a | 236a | 217ab | 0.05a | 3.70b |
| SZ | 193a | 217a | 245b | 0.144b | 2.77a |
| NC | 176a | 198a | 196ab | 0.123b | 3.04a |
| YY | 182a | 207a | 214ab | 0.078ab | 3.21ab |
| 注:同一列数据后不同字母表示在P < 0.05水平上差异显著.
Note: Data with different superscripts in the same column indicate significant difference at P < 0.05. | |||||
|
| 图 2 不同采样点土壤样品中AMF种类统计 Figure 2 Statistical analysis of AMF species in soil samples from different sampling sites |
|
|
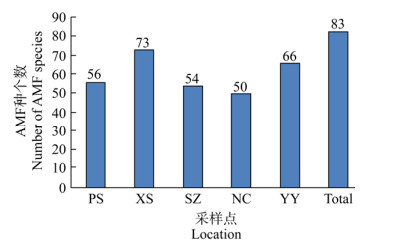
从5个采样点的15个土样中共获得461个OTU,除6.47%未注释到的OTU外,其余OTU经序列比对归为球囊菌门(Glomeromycota)的3纲4目8科9属83种AMF (图 2、表 6)。其中,Glomus相对丰度最高,占所有AMF总量的67%,是所有样品的优势属;其次是Paraglomus和Claroideoglomus,3属之和在所有土样中占AMF总量的96%。
| 纲 Class |
目 Order |
科 Family |
属 Genus |
占比 Rate (%) |
| 球囊菌纲 Glomeromycetes |
球囊霉目Glomerales | 球囊霉科 Glomeraceae |
球囊霉属 Glomus |
67.00 |
| 近明球囊霉科 Claroideoglomeraceae |
近明球囊霉属 Claroideoglomus |
10.00 | ||
| 多孢囊霉目 Diversisporales |
巨孢囊霉科 Gigasporaceae |
巨孢囊霉属 Gigaspora |
2.00 | |
| 盾巨孢囊霉 Scutellospora |
0.06 | |||
| 无梗囊霉科 Acaulosporaceae |
无梗囊霉属 Acaulospora |
0.20 | ||
| 多孢囊霉科 Diversisporaceae |
多孢囊霉属 Diversispora |
0.09 | ||
| 类球囊霉纲 Paraglomeromycetes |
类球囊霉目 Archaeosporales |
类球囊霉科 Paraglomeraceae |
类球囊霉属 Paraglomus |
19.00 |
| 原囊霉纲 Archaeosporomycetes |
原囊霉目 Archaeosporales |
原囊霉科 Archaeosporaceae |
原囊霉属 Archaeospora |
1.00 |
| 双型囊霉科 Ambisporaceae |
双型囊霉属 Ambispora |
0.20 |
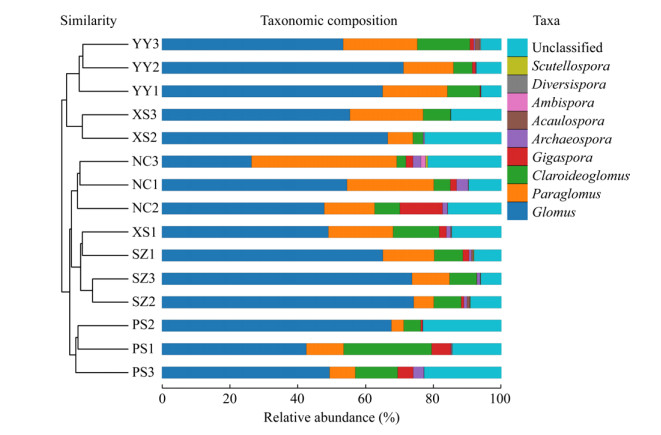
如图 3所示,将已对比的序列按属分类水平进行统计分析可知,5个样地的供试样品中AMF属组成不同,采样点SZ和YY的供试样品中9个属的AMF均被检测到,采样点NC和PS未检出Acaulospora,采样点XS未检出Diversispora和Scutellospora,其余6个属为5个采样点共有。由图 3可知,不同采样点各属的相对丰度也存在差异,说明茅苍术根际AMF群落结构存在地理分布差异。
|
| 图 3 各供试样品的聚类树柱状图 Figure 3 The cluster tree histogram of each sample |
|
|
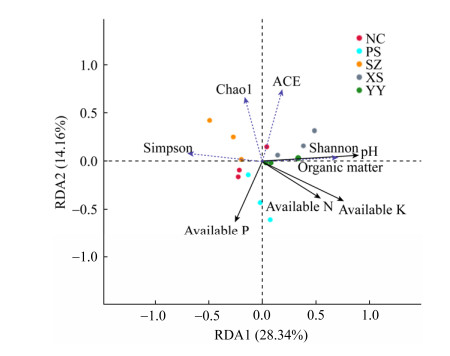
冗余度分析(redundancy analysis,RDA)土壤因子pH、有机质(organic matter)、碱解氮(available N)、速效钾(available K)、有效磷(available P)与AMF多样性之间的相关性(图 4)可知,两轴累积解释信息量达42.5%,所有环境变量中土壤pH对AMF多样性和丰度影响最大。pH、有机质、碱解氮、速效钾与AMF多样性(Shannon指数)呈正相关,而有效磷与之呈负相关;5个土壤因子均与丰度(Chao1指数)呈负相关;pH和有机质与均匀度(ACE指数)呈正相关,而碱解氮、速效钾、有效磷与之呈负相关。另外,图 4横坐标从左至右表示Shannon指数逐渐增加,表明各采样点的AMF多样性XS > YY > PS > NC > SZ。
|
| 图 4 土壤因子与AMF多样性的RDA冗余分析 Figure 4 Results of redundancy analysis of soil factors and AMF diversity index 注:不同颜色的点代表不同采样点的样品;灰色箭头代表不同的土壤因子;蓝色虚线箭头代表多样性指数;横坐标上的刻度为每个样品与土壤因子进行回归分析计算产生的值. Note: Different color dots represent samples from different sampling points; Grey arrows represent different soil factors; The blue dashed arrows represent the diversity index; The scale on the abscissa is the value calculated by regression analysis of each sample and soil factor. |
|
|
AMF是土壤微生物区系中分布最广泛的一类菌根真菌,地球上90%的维管植物都能形成丛枝菌根[12]。但AMF在中药材研究领域的应用时间较短,主要集中在已知的AMF对中药材中生长、物质积累的影响及对病虫害防治的作用等方面[13-14],而且基本都处于起步阶段,有待更深入的研究。国内学者采用传统的形态鉴定法对40多种药用植物进行了丛枝菌根研究,共分离鉴定到20多种AMF[15]。传统培养法无法准确反映土壤中真菌的真实情况,仅能反映占土壤真菌总量1%的可培养真菌的状况[16]。因此,本研究首次采用高通量测序技术检测分析了重庆地区中药材茅苍术根际土壤AMF多样性,发现各采样点AMF群落组成相似,相对丰度存在较大差异,所有样品共检测到8科9属AMF。其中Glomus相对丰度最高,达到67%,是所有样品的优势属。王永明等对中国区域内已报道的AMF进行了归类总结,发现我国境内已报道的AMF有145种,隶属于8科12属,而且Glomus为我国境内AMF的优势属,占所有种的71%[17]。本研究检测到的AMF种占我国已知AMF种的57.24%,且优势属与王永明等的研究结论一致。结合茅苍术的菌根侵染率和土壤孢子含量可以得出结论:茅苍术根际土壤AMF资源丰富,能与AMF很好地形成共生体,而且对AMF具有较高菌根依赖性。
3.2 土壤因子与AMF物种多样性的关系AMF是土壤习居菌,其生长发育和生理功能取决于自身和寄主植物的特性、环境因子以及农业措施等[12]。有研究发现土壤理化性质和环境条件对AMF群落的影响比寄主植物更大[18-19]。本研究中同一植物不同采样点AMF的丰度(Chao1)指数、多样性指数Simpson和Shannon均存在显著差异,说明土壤理化性质和环境因子对AMF的分布影响较大。相关性分析结果显示,土壤pH对AMF多样性和丰度影响最大,pH与Shannon指数呈正相关,与丰度(Chao1)指数呈负相关。郭兰萍等的研究表明茅苍术在生长发育过程中土壤酸化严重[20],本研究中5个采样点的土壤pH均为酸性,在4.63-6.32之间,与其研究结果一致。一般来说,中性至微酸性土壤有利于AM菌根的发育[12]。这可能是重庆地区茅苍术菌根侵染率高,根际土壤AMF多样性丰富的重要原因之一。
另外,AMF作为土壤中的主要微生物群体,其群落组成及丰度必然会受到土壤中有机质、N、P、K含量的影响。本研究结果表明有机质、碱解氮和速效钾与AMF的Shannon指数呈正相关,与丰度(Chao1)指数呈负相关。研究报道AMF在土壤中具有一定的腐生生长能力,而有机质在这一过程中可能起着重要作用,在一定范围内AMF的丰度会随有机质含量的升高而增大[14]。与张之为等对马铃薯的研究结果一致,在一定范围内土壤N和K含量增加会使AMF丰度和多样性增高[21]。可能是由于根部药材茅苍术在温度较高的九月时,植株生长和根部膨大需要大量的N和K,共生菌AMF帮助寄主吸收更多的N和K,寄主茅苍术再为AMF提供更多的养分使其增长繁殖,从而使AMF丰度和多样性增加。本研究结果中有效磷与Shannon和Chao1指数均呈负相关,而且AMF丰度和多样性较高的2个采样点有效P含量均显著低于其他3个采样点,这与Tawaraya等的研究结果[22]一致,土壤磷含量过高往往会抑制AMF的发育和功能。总之,土壤速效养分对AMF群落结构和丰度影响显著,各采样点间土壤养分的差异可能是导致AMF群落结构地理格局差异的重要原因之一。本研究可为今后研究AMF与植物之间的共生,筛选其共生体适宜的培养基质提供参考。
综上所述,茅苍术根际土壤AMF资源丰富,不同地理分布的AMF群落组成和丰度存在差异,土壤pH和速效养分与AMF群落结构的地理格局差异密切相关。深入研究土壤因子与AMF多样性和丰度的关系,可为进一步探索AMF在中药材栽培中的作用提供良好的基础。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: The Medicine Science and Technology Press of China, 2015: 161-162. (in Chinese) 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 161-162. |
| [2] |
He SA, He HS, Lü Y, et al. The conservation and utilization of Atractylodes lancea (Thunb.) DC.[J]. Journal of Plant Resources and Environment, 1993, 2(1): 1-6. (in Chinese) 贺善安, 贺慧生, 吕晔, 等. 茅苍术资源的保护和利用[J]. 植物资源与环境, 1993, 2(1): 1-6. |
| [3] |
Treseder KK. The extent of mycorrhizal colonization of roots and its influence on plant growth and phosphorus content[J]. Plant and Soil, 2013, 371(1/2): 1-13. |
| [4] |
Tang X, Liu DJ, Tu B, et al. Promotion effect on growth of mycorrhiza-inoculated mulberry saplings and physiological and biochemical mechanism to drought tolerance[J]. Journal of Southwest University (Natural Science Edition), 2013, 38(8): 19-26. (in Chinese) 唐许, 刘代军, 涂波, 等. 菌根桑的促生效应及耐旱生理生化机制分析[J]. 西南大学学报:自然科学版, 2013, 38(8): 19-26. |
| [5] |
Cao M, Yu M, Lu M, et al. Ecological adaptability of mulberry saplings inoculated with Gigaspora rosea under stress conditions in rocky desertification areas and riparian zones[J]. Science of Sericulture, 2017, 43(2): 189-195. (in Chinese) 曹敏, 余米, 卢敏, 等. 菌根桑苗在石漠化和消落带地区逆境胁迫下的生态适应性[J]. 蚕业科学, 2017, 43(2): 189-195. |
| [6] |
Guo LP, Wang HG, Huang LQ, et al. Effects of arbuscular mycorrhizae on growth and essential oil of Atractylodes lancea[J]. China Journal of Chinese Materia Medica, 2006, 31(18): 1491-1496. (in Chinese) 郭兰萍, 汪洪钢, 黄璐琦, 等. 泡囊丛枝菌根(AM)对苍术生长发育及挥发油成分的影响[J]. 中国中药杂志, 2006, 31(18): 1491-1496. |
| [7] |
Liang XF, Tang MJ, Lü LX, et al. Effects of three arbuscular mycorrhizal fungi (AMF) species on the growth, physiology, and major components of essential oil of Atractylodes lancea[J]. Chinese Journal of Ecology, 2018, 37(6): 1871-1879. (in Chinese) 梁雪飞, 唐梦君, 吕立新, 等. 三种丛枝菌根真菌对茅苍术的生长、生理及主要挥发油成分的影响[J]. 生态学杂志, 2018, 37(6): 1871-1879. |
| [8] |
Zeng Y, Guo LP, Sun YZ, et al. AM and its application in TCM cultivation[J]. Word Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2007, 9(6): 83-87. (in Chinese) 曾燕, 郭兰萍, 孙宇章, 等. 丛枝菌根及其在中药材栽培中的应用[J]. 世界科学技术-中医药现代化, 2007, 9(6): 83-87. |
| [9] |
Wang YS, Zhang SB, Zhang MQ. Resources and Germplasms of Arbuscular Mycorrhizal Fungi in China[M]. Beijing: China Agriculture Press, 2012: 166-168. (in Chinese) 王幼珊, 张淑彬, 张美庆. 中国丛枝菌根真菌资源与种质资源[M]. 北京: 中国农业出版社, 2012: 166-168. |
| [10] |
Daniels HBA, Skipper HD. Methods for the recovery and quantitative estimation of propagules from soil[A]//Schenck NC. Methods and Principles of Mycorrhizal Research[M]. St. Paul, MN.: American Phytopathological Society, 1982: 24-35
|
| [11] |
van Geel M, Busschaert P, Honnay O, et al. Evaluation of six primer pairs targeting the nuclear rRNA operon for characterization of arbuscular mycorrhizal fungal (AMF) communities using 454 pyrosequencing[J]. Journal of Microbiological Methods, 2014, 106: 93-100. DOI:10.1016/j.mimet.2014.08.006 |
| [12] |
Liu RJ, Li XL. Arbuscular Mycorrhizal and Its Application[M]. Beijing: Science Press, 2000: 148-160. (in Chinese) 刘润进, 李晓林. 丛枝菌根及其应用[M]. 北京: 科学出版社, 2000: 148-160. |
| [13] |
Jia HM, Fang Q, Zhang SH, et al. Effects of AM fungi on growth and rhizosphere soil enzyme activities of Salvia miltiorrhiza[J]. Acta Prataculturae Sinica, 2020, 29(6): 83-92. (in Chinese) 贾红梅, 方千, 张秫华, 等. AM真菌对丹参生长及根际土壤酶活性的影响[J]. 草业学报, 2020, 29(6): 83-92. |
| [14] |
Gryndler M, Larsen J, Hršelová H, et al. Organic and mineral fertilization, respectively, increase and decrease the development of external mycelium of arbuscular mycorrhizal fungi in a long-term field experiment[J]. Mycorrhiza, 2006, 16(3): 159-166. DOI:10.1007/s00572-005-0027-4 |
| [15] |
Chen ML, Guo LP, Yang G, et al. Discussion on appraisal methods and key technologies of arbuscular mycorrhizal fungi and medicinal plant symbiosis system[J]. China Journal of Chinese Materia Medica, 2011, 36(21): 3051-3056. (in Chinese) 陈美兰, 郭兰萍, 杨光, 等. 药用植物AM共生体系评价方法和关键技术的探讨[J]. 中国中药杂志, 2011, 36(21): 3051-3056. |
| [16] |
He YH, Zhou GY, Wang SJ, et al. Fungal diversity in Cunninghamia lanceolata plantation soil[J]. Acta Ecologica Sinica, 2014, 34(10): 2725-2736. (in Chinese) 何苑皞, 周国英, 王圣洁, 等. 杉木人工林土壤真菌遗传多样性[J]. 生态学报, 2014, 34(10): 2725-2736. |
| [17] |
Wang YM, Fan JQ, Shi ZY. Molecular diversity of arbuscular mycorrhizal fungal in China[J]. Microbiology China, 2018, 45(11): 2399-2408. (in Chinese) 王永明, 范洁群, 石兆勇. 中国丛枝菌根真菌分子多样性[J]. 微生物学通报, 2018, 45(11): 2399-2408. |
| [18] |
Wang TZ, Bao YY. Effects of AM fungi on the growth and drought resistance of endangered shrub Tetraena mongolica maxim. and Zygophyllumx anthoxylum maxim.[J]. Acta Agriculturae Boreali-Sinica, 2014, 29(3): 170-175. (in Chinese) 王同智, 包玉英. AM真菌对濒危物种四合木及近缘种霸王抗旱性的影响[J]. 华北农学报, 2014, 29(3): 170-175. |
| [19] |
Yang HS, Wang Q, Guo Y, et al. Correlation analysis between arbuscular mycorrhizal fungal community and host plant phylogeny[J]. Chinese Journal of Plant Ecology, 2015, 39(4): 383-387. (in Chinese) 杨海水, 王琪, 郭伊, 等. 丛枝菌根真菌群落与植物系统发育的相关性分析[J]. 植物生态学报, 2015, 39(4): 383-387. |
| [20] |
Guo LP, Huang LQ, Shao AJ, et al. The status and changes of soil nutrients in rhizosphere of cultivated Atractylodes lancea[J]. China Journal of Chinese Materia Medica, 2005, 30(19): 1504-1507. (in Chinese) 郭兰萍, 黄璐琦, 邵爱娟, 等. 苍术根际区土壤养分变化规律[J]. 中国中药杂志, 2005, 30(19): 1504-1507. |
| [21] |
Zhang ZW, Tian YW, Yang JF, et al. Arbuscular mycorrhizal fungi population diversity of rhizosphere soil and root system in potato field in central Inner Mongolia[J]. Microbiology China, 2020, 47(3): 738-748. (in Chinese) 张之为, 田永伟, 杨剑峰, 等. 内蒙古中部地区马铃薯根际和根系丛枝菌根真菌类群的多样性[J]. 微生物学通报, 2020, 47(3): 738-748. |
| [22] |
Tawaraya K, Satio M, Morioka M, et al. Effect of phosphate application to arbuscular mycorrhizal onion on the development and succinate dehydrogenase activity of internal hyphae[J]. Soil Science and Plant Nutrition, 1994, 40(4): 667-673. DOI:10.1080/00380768.1994.10414306 |
 2020, Vol. 47
2020, Vol. 47