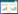扩展功能
文章信息
- 滕凯, 陈前锋, 周志成, 向青松, 张敏, 尹华群, 刘勇军
- TENG Kai, CHEN Qian-Feng, ZHOU Zhi-Cheng, XIANG Qing-Song, ZHANG Min, YIN Hua-Qun, LIU Yong-Jun
- 烟草连作障碍与土壤理化性质及微生物多样性特征的关联
- Effect of soil physical and chemical properties and microbial community on continuous cropping obstacles in tobacco field
- 微生物学通报, 2020, 47(9): 2848-2856
- Microbiology China, 2020, 47(9): 2848-2856
- DOI: 10.13344/j.microbiol.china.200331
-
文章历史
- 收稿日期: 2020-04-01
- 接受日期: 2020-08-22
- 网络首发日期: 2020-08-27
2. 湖南烟草科学研究所 湖南 长沙 410014;
3. 湘西自治州烟草公司凤凰县分公司 湖南 凤凰 416200;
4. 中南大学资源加工与生物工程学院 湖南 长沙 410083
2. Hunan Tobacco Science Research Institute, Changsha, Hunan 410014, China;
3. Xiangxi Autonomous Prefecture Tobacco Company Fenghuang County Branch, Fenghuang, Hunan 416200, China;
4. School of Resource Processing and Bioengineering, Central South University, Changsha, Hunan 410083, China
连作障碍是指因作物连年种植而导致作物发育不良或病虫害发生严重,造成作物减产甚至绝产的一种现象[1]。由于土地资源和水源条件的相对不足,我国许多粮食作物、经济作物、药用植物、园艺植物和蔬菜等都有不同程度的连作障碍现象[2-4]。烟草是我国重要的经济作物,也是一种忌连作作物[3]。已有研究表明,长期连作会影响烟草田间长势及农艺性状[5]、降低烟草的产量和品质[6]、加重病虫害的发生[7],而作物连作障碍的产生机理十分复杂,是系统内诸多因素综合作用的结果[8]。随着研究的深入,越来越多学者认为,作物-微生物-土壤系统的失调是引起烟草连作障碍的主要因素[9]。连作障碍因子归纳起来主要有土壤理化性质和生态环境恶化[5]、植物自毒作用[10]、土壤微生物区系的变化[11]等,要缓解甚至有效解除烟草连作障碍,可采用对连作烟田进行消毒、调整种植模式、选用合理的施肥模式、采用微生物菌剂等方法[9]。
烟草是湖南省重要的经济作物,常年种植烤烟面积在6-8万hm2,年收购烟叶2.0×105 t以上,是我国优质烟叶的重要产区之一[12]。根据湖南省烟草种植区划,全省分为湘西烟区、湘南烟区、湘中烟区和湘东烟区这4个主要产烟区。湘西烟区是湖南省的主要烟区之一,是湖南烤烟的主产区和老烟区,目前年收购烟叶50万担左右[8],其烟草连作情况比较严重,烟草连作障碍尤为突出,出现了烟叶的产量降低、烟草病虫害情况加重、烤烟的质量和口感下降等情况[13]。因此,湘西烟草连作障碍问题亟待解决。已有工作探究了烟草连作时间与烟田土壤理化性质、烟田土壤微生物多样性的相互关系[14-15],而针对耕作方式相同、地理位置相差不大但克服连作障碍情况相差较大烟田的研究还鲜有报道。为此,本研究基于高通量测序技术,以湘西烟区连作障碍克服情况不同的烟田为对照,研究烟草连作障碍与土壤理化性质和微生物多样性特征的关系,从而为解决湘西烟区连作障碍问题制定有效的烟草生产技术提供理论基础和技术支持。
1 材料与方法 1.1 采样地概况采样地点分别位于湖南省湘西州龙山县大安乡木鱼坪村(109°64′N、29°49′E)和湖南省张家界市慈利县双星村(110°61′N、29°38′E),按照湖南烟区种植区划,取样地点均属于湘西烟区。结合本次的研究目标,在两个取样地点分别选取气候条件、农艺措施和耕作年限等相同但烟叶根茎病害程度有明显差异的典型烟田进行调查。
1.2 样品采集在本次的取样地点为湖南省湘西州龙山县大安乡木鱼坪克服连作障碍烟田(A_HLTH)和连作障碍严重烟田(A_SV)、湖南省张家界市慈利县双星村克服连作障碍烟田(B_HLTH)和连作障碍严重烟田(B_SV),采集烟区耕作层(0-20 cm)土壤,为保证结果的准确性,每份样品设置9个重复,共取36个样品。采样时遵循随机、等量、多点混合的原则,采用S形布点取样[11]。每份土样分2份,1份取100 g新鲜土样放入液氮冷冻后放在一个试管里,上面用棉花塞住,再用牛皮纸封存后放入保鲜袋中,在-80 ℃冰箱中保存,得到4个处理的土壤样品36个,用于分子生物学试验。用于土壤理化性状分析的土壤风干后保存于4 ℃冰箱,土壤有机质、总碳、总氮、有效磷、有效钾、速效氮、pH等参照国家标准方法进行分析[16]。
1.3 主要试剂和仪器细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;Gel Extraction Kit D2500,Omega公司;2×Taq PCR MasterMix,Solarbio公司;TruSeq™ DNA Sample Prep Kit,Illumina公司。NanoDrop 1000分光光度计,Thermo Scientific公司;MiSeq PE300测序平台,Illumina公司。
1.4 样品理化性质的测定采集的部分土壤样品自然风干后,用常规方法测定土壤的基本物理化学性质。其中,测定土壤pH需要称取10.0±0.1 g试样,置于50 mL的高型烧杯中,并加入25 mL水,将容器密封后,用搅拌器搅拌5 min,然后静置1−3 h,以校正后的pH计测定读数[17];土壤有效磷含量采用碳酸氢钠提取采取钼锑抗比色法测定;土壤总氮含量采用半微量克氏法测定;土壤氨氮含量采用KCl浸提-蒸馏法测定;测定土壤硝氮含量需要称取土样10.0 g,用100 mL的2 mol/L KCl振荡提取土样30 min后,提取液中硝氮采用紫外分光光度法;测定土壤有机质含量需要在加热条件下,用过量的重铬酸钾-硫酸溶液氧化土壤有机碳,多余的重铬酸钾用硫酸亚铁标准溶液滴定,由消耗的重铬酸钾量按氧化校正系数计算出有机碳量,乘以常数1.72,获得土壤有机质含量[17]。
1.5 样品16S rRNA基因测序土壤DNA采用试剂盒提取,使用原核生物16S rRNA基因的V3−V4区域通用引物515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增。PCR反应体系(50 μL):PCR 2×Master Mix 25 μL,正、反向引物(10 μmol/L)各1.5 μL,DNA模板(20−30 ng/μL) 2μL,ddH2O 20 μL[18]。PCR反应条件:94 ℃ 1 min;94 ℃ 20 s,57 ℃ 25 s,68 ℃ 45 s,循环30次;68 ℃ 10 min;4 ℃保存[18]。用1.5%琼脂糖凝胶电泳检测PCR产物质量,利用Gel Extraction Kit D2500切胶纯化PCR产物。根据纯化PCR产物的条带亮度及浓度计算混样体积并连接测序接头,构建各样本的16S rRNA基因V3-V4区测序文库。PCR产物经电泳检测后使用磁珠纯化作为二轮PCR模板,进行二轮PCR扩增和纯化,最后进行Qubit定量。根据PCR产物浓度进行等量混样[19],使用Illumina测序平台测序,每个样本至少获得1万条Reads。
1.6 数据处理与统计分析运用Excel软件对植烟土壤理化特性原始数据的进行整理,SPSS Statistics 17软件计算各组数据的均值、标准误差并进行方差分析(analysis of variance,ANOVA),从而探究植烟土壤抗连作能力与土壤理化性质的联系。
测序数据处理在Galaxy平台(http://zhoulab5.rccc.ou.edu/)进行,通过移除引物序列和过滤低质量序列,使用Flash将双末端测序得到的成对短序列(reads)拼接成一条序列,对拼接后的Reads进行处理而获取去杂序列(clean reads)。把Tags中的Singletons (对应的reads只有一条)过滤掉,然后利用Usearch在0.97相似度下进行聚类,对聚类后的序列进行嵌合体过滤,得到用于物种分类的OTU,每个OTU被认为可代表一个物种。根据样本的共有OTU以及OTU所代表的物种找到核心微生物组,即覆盖90%样本的微生物组。
进行物种注释分析,分别从各个OTU中挑选出一条序列作为该OTU的代表序列,与16S rRNA基因数据库进行比对,对每个OTU进行物种鉴定,然后根据每个OTU中序列的数目得到各OTU的丰度值。物种丰度分析是在不同分类水平上,将每个注释上的物种或OTU在不同样本中的序列数整理在一张表格上,形成物种丰度的星图、柱状图及统计表等。
群落分析包括α多样性指数计算、非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析、典型对应(canonical correspondence analysis,CCA)分析、判别效应(linear discriminant analysis effect size,LEfSe)分析、Mantel检验等。其中,应用R语言(V3.3.2)的Vegan包(V2.4.2)计算α多样性指数,进行非度量多维尺度(NMDS)分析探究不同植烟土壤中细菌的群落结构,进行Mantel检验和典型对应(CCA)分析表征环境因子与微生物群落的相关关系。其中,本研究中α多样性指数包括物种丰富度指数(Species richness)、香农指数(Shannon index)、Invsimpson指数、辛普森指数(Simpson index)、Pielou均匀度指数、Fisher指数和Chao1指数。
2 结果与分析 2.1 植烟土壤理化特性的比较对采集的植烟土壤样品进行理化特性分析,分析2个取样地点HLTH和SV样品的差异(表 1)。由表 1可知,两个取样点的HLYH和SV样品在土壤理化性质方面存在差异,同时存在着较为相似的规律:pH、总氮含量、硝氮含量和有机质含量均有较为明显的变化,有机磷含量和硝氮含量变化不明显;并且与SV相比,HLTH植烟土壤pH和有机质含量显著提高,总氮含量和氨氮含量显著降低;与取样点B相比,取样点A的植烟土壤在氨氮含量普遍较高,pH和硝氮含量普遍偏低,有效磷含量、总氮含量和有机质含量差别不明显。以上结果表明,植烟土壤抗连作能力在一定程度上与土壤理化性质有一定的关系。
| 理化性质 Physical and chemical properties |
A | B | |||
| HLTH | SV | HLTH | SV | ||
| pH | 4.4±0.12c | 4.19±0.13d | 6.55±0.18a | 6.18±0.15b | |
| 有效磷Available phosphorous (mg/kg) | 112.94±22.91a | 113.48±19.35a | 85.79±15.34b | 121.77±27.04a | |
| 总氮Total nitrogen (mg/kg) | 1 914±153a | 1 730±138b | 1 395±93c | 1 825±207b | |
| 氨氮Ammonia nitrogen (mg/kg) | 6.32±1.6b | 9.5±3.64a | 0.30±0.10c | 0.76±0.21c | |
| 硝氮Nitrate nitrogen (mg/kg) | 80±14c | 64±17d | 159±24a | 126±33b | |
| 有机质Organic matter (%) | 2.63±0.21a | 2.36±0.03b | 2.32±0.21c | 1.96±0.17b | |
| 注:表中数据为平均值±标准差,同一列中不同小写字母表示处理间差异显著(0.05水平差异). Note: The data in the table are average±standard deviation; Different lowercase letters in the same column indicate significant differences between treatments at 0.05 level. |
|||||
对2个取样地点的克服连作障碍烟田(HLTH)与连作障碍严重烟田(SV)进行土壤微生物α多样性分析(表 2),分别从Chao1丰富度估计量(Chao1 richness estimator)、香农多样性指数(Shannon diversity index)、辛普森多样性指数(Simpson diversity index)等7个常用的度量指标来探究样品之间微生物种类数量变化规律。从α多样性指数来看,同一取样地的HLTH和SV在微生物多样性方面没有显著的差异,而且HLTH的多样性指数值普遍比SV略大,说明同一取样地的HLTH和SV样品在微生物多样性上差别不明显。不同取样地点相比,可以明显发现取样地B点的多样性指数值比取样地A点高,而且部分指标值差别明显。以上结果说明,烟田克服连作障碍的能力与土壤中微生物种类数量无较为明显的联系,但很有可能与植烟土壤理化特征有较大联系。结合已有分析,推断最有可能影响烟田克服连作障碍能力的土壤理化特征为pH、氨氮含量和硝氮含量。
| 多样数指数 Diversity index |
A_HLTH | A_SV | B_HLTH | B_SV |
| Species richness | 520±136 | 394±71 | 755±115 | 711±121 |
| Shannon index | 5.08±0.16 | 4.83±0.15 | 5.71±0.11 | 5.73±0.15 |
| Invsimpson index | 66±25.27 | 51.35±8.78 | 111.69±26.09 | 134.86±25.79 |
| Simpson index | 0.982 8±0.006 5 | 0.980 0±0.003 4 | 0.990 4±0.003 4 | 0.992 3±0.001 5 |
| Pielou index | 0.82±0.05 | 0.81±0.02 | 0.86±0.02 | 0.87±0.02 |
| Fisher index | 132.19±11.76 | 113.3±12.48 | 242.21±18.16 | 247.23±16.58 |
| Chao1 index | 615±110 | 522±59 | 937.4±101.6 | 922.1±82.2 |
利用非度量型多维尺度分析(NMDS)方法分析不同取样点HLTH和SV土壤微生物群落之间的差别(图 1),可以看出,同一取样地的克服连作障碍烟田(HLTH)和连作障碍严重烟田(SV)土壤微生物组成发生显著的改变,并且与取样点B相比较,取样点A的样品之间距离较为紧凑,样品间差距较小。
|
| 图 1 HLTH和SV土壤微生物组成的NMDS分析 Figure 1 NMDS analysis of soil microbial composition of HLTH and SV 注:A:取样点A;B:取样点B. Note: A: Sampling point A; B: Sampling point B. |
|
|
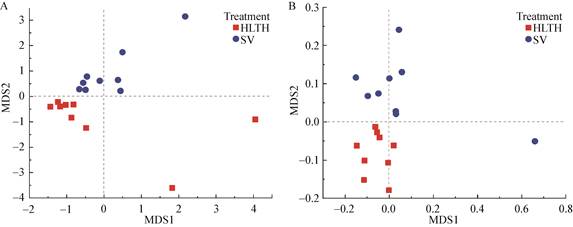
利用LEfSe分析,实现各取样点土壤微生物优势群落之间的比较(图 2),从而找到组间在丰度上有显著差异的物种(即biomaker)。同样可以看出,同一取样点克服连作障碍烟田(HLTH)和连作障碍严重烟田(SV)土壤微生物组成有明显的差异,在取样点A,与SV样品中微生物群落相比,HLTH样品微生物明显的优势群落为放线菌门,如链霉菌、单孢菌和微球菌等;在取样点B,与SV样品中微生物群落相比,HLTH样品微生物明显的优势群落为厚壁菌门和变形菌门,如芽孢杆菌、根瘤菌、鞘氨醇单胞菌等。以上研究结果表明,土壤是否克服连作障碍与土壤中微生物群落的组成有关联。根据此结果初步判定以上微生物类群可能为克服障碍严重烟田(HLTH)土壤中的关键核心微生物类群,与已有研究结果相一致:放线菌门、厚壁菌门和变形菌门均为烟草生长的有益菌[20],如芽孢杆菌属能促进植物生长,控制传播病害[21];鞘氨醇单胞菌可以有效降解土壤中的有毒物质,能促进植物的吸收和生长[22]。
|
| 图 2 LEfSe解析取样点A、B中HLTH和SV土壤中关键微生物类群 Figure 2 Key microbial groups in HLTH and SV soils at sampling sites A and B by LEfSe analysis 注:A:取样点A;B:取样点B. Note: A: Sampling point A; B: Sampling point B. |
|
|
通过Mantel指数分析,计算环境因子矩阵和微生物群落矩阵的相关性,得出R=0.132 3,P=0.015,表明植烟土壤理化性质与细菌丰度显著相关。将植烟土壤理化性质与微生物群落作相关性分析(表 3)并利用CCA方法进一步探究土壤理化性质与微生物群落的关联性(图 3),结果P均小于0.05,同样可以得出结论:植烟土壤的各理化性质与微生物群落均相关联,并且由R可以看出,土壤的pH、有机质含量与微生物群落存在着紧密的正相关,总氮含量、有效磷含量、氨氮含量和硝态氮含量与微生物群落关联性较小。
| 理化性质 Physical and chemical properties |
R | P |
| pH | 0.799 | 0.001 |
| 有机质 Organic matter |
0.692 | 0.002 |
| 总氮 Total nitrogen |
0.319 8 | 0.023 0 |
| 有效磷 Available phosphorous |
0.398 4 | 0.008 |
| 氨氮 Ammonia nitrogen |
0.447 | 0.006 |
| 硝态氮 Nitrate nitrogen |
0.407 | 0.005 |

|
| 图 3 CCA解析土壤理化性质与微生物群落的关系 Figure 3 CCA analysis of soil physical and chemical properties and microbial community 注:OM:有机质;TN:总氮;AP:有效磷;amN:氨氮;nitN硝态氮. Note: OM: Organic matter; TN: Total nitrogen; AP: Available phosphorous; amN: Ammonia nitrogen; nitN: Nitrate nitrogen. |
|
|
作物根须分泌物-土壤-微生物在土壤微生态系统中相互作用,共同影响着作物的生长发育,协调好它们之间的关系是解决作物连作障碍的关键[23]。本研究基于高通量测序技术,以湖南省连作障碍克服情况不同的烟田为对照,研究烟草连作障碍与土壤理化性质和微生物多样性特征的关系,发现在相同的气候条件、农艺措施和耕作年限情况下,连作障碍差异明显的烟区,其土壤理化性质差异明显,主要体现在pH、总氮含量、硝氮含量、有机质含量和氨氮含量方面,有效磷含量变化不明显,因此可以推测土壤理化性质的差异是导致连作障碍不同的因素之一;对土壤中的微生物进行分析,发现连作障碍的差异并不会对微生物的多样性产生较大的影响,但是对其中核心微生物的影响较大,并且克服连作障碍的烟田中有益微生物占据比例较大,烟田不易受病虫害的影响,并且对烟叶的产量和质量无明显影响;为了探究微生物和土壤理化性质在作物-微生物-土壤系统中的联系,利用CCA分析验证了土壤理化性质与环境微生物有着较为明显的相关性,并且土壤的pH、有机质含量与微生物群落存在着紧密的正相关。以上研究证明了连作障碍的差异和微生物性状及土壤理化性质相互关联,由于土壤本身理化性质的差异,使有助于克服连作障碍的微生物聚集,微生物在整个微系统中对提升烟叶的质量、促进土壤中有益物质的释放发挥着重要的作用。同时,土壤理化性质及烟草根部释放的物质促进了微生物的聚集和生长,从而形成了相互联系的系统,有效提高了克服连作障碍的能力。
本次试验初步探究了作物-微生物-土壤系统的相互联系,利用高通量测序技术明确了样品中微生物的种类及相对丰度,但是对于各类微生物在克服连作障碍中发挥的作用、如何调节土壤理化性质克服连作障碍以及研究有助于克服连作障碍的菌剂,还需要进一步的研究。另外,扩大研究范围对本次研究结论的广泛性也具有重要意义。
| [1] |
Liu Y, Jiang Y, Wang GW, et al. Effect of different continuous cropping years on tobacco-growing soil's physical and chemical properties and microflora[J]. Chinese Agricultural Science Bulletin, 2016, 32(13): 136-140. (in Chinese) 刘晔, 姜瑛, 王国文, 等. 不同连作年限对植烟土壤理化性状及微生物区系的影响[J]. 中国农学通报, 2016, 32(13): 136-140. |
| [2] |
Wu FZ, Zhao FY. Study on root exudates and continues cropping obstacle[J]. Journal of Northeast Agricultural University, 2003, 34(1): 114-118. (in Chinese) 吴凤芝, 赵凤艳. 根系分泌物与连作障碍[J]. 东北农业大学学报, 2003, 34(1): 114-118. |
| [3] |
Liu JJ, Yao Q, Li YS, et al. Continuous cropping of soybean alters the bulk and rhizospheric soil fungal communities in a Mollisol of Northeast PR China[J]. Land Degradation & Development, 2019, 30(14): 1725-1738. |
| [4] |
Liu ST, Luo XL, Wu MY, et al. Comparison of cassava yield and soil microbial characteristics under continuous cropping and rotation[J]. Chinese Journal of Tropical Crops, 2019, 40(8): 1468-1473. (in Chinese) 刘珊廷, 罗兴录, 吴美艳, 等. 连作与轮作下木薯产量及土壤微生物特征比较[J]. 热带作物学报, 2019, 40(8): 1468-1473. |
| [5] |
Chen JF, Sun H, Xia Y, et al. Changes of enzyme activities and nutrient contents in continuous cropping tobacco soil for different years[J]. Journal of Henan Agricultural Sciences, 2016, 45(10): 60-64. (in Chinese) 陈继峰, 孙会, 夏阳, 等. 不同连作年限烟田土壤酶活性及养分含量变化[J]. 河南农业科学, 2016, 45(10): 60-64. |
| [6] |
Tan XB, Zhu Y, Yang HW, et al. Autotoxicity effect of tobacco root exudates[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(7): 1518-1522. (in Chinese) 谭小兵, 朱媛, 杨焕文, 等. 烤烟根系分泌物自毒效应研究[J]. 西南农业学报, 2018, 31(7): 1518-1522. |
| [7] |
Li YY. Microbal diversity in continuous cropped tobacco field and application of microbial agents[D]. Zhengzhou: Master's Thesis of Zhengzhou University, 2017 (in Chinese) 李远远.连作烟田土壤微生物多样性及微生物制剂应用研究[D].郑州: 郑州大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10459-1017150617.htm |
| [8] |
Liu X. Study on characteristic of ecological and tobacco quality and their relations in Xiangxi[D]. Changsha: Doctoral Dissertation of Hunan Agricultural University, 2014 (in Chinese) 刘逊.湘西烟区气候与土壤环境特征及其对烟草品质的影响[D].长沙: 湖南农业大学博士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10537-1015602496.htm |
| [9] |
Li SJ, Zhu QF, Pei ZY, et al. Reasons and countermeasures of tobacco successive cropping obstacle[J]. Modern Agricultural Science and Technology, 2018(4): 54-56, 58. (in Chinese) 李世金, 朱启法, 裴洲洋, 等. 烟草种植连作障碍产生的原因及防治对策[J]. 现代农业科技, 2018(4): 54-56, 58. |
| [10] |
Xu Y, Qian HM, Ju LY, et al. Effects of cropping patterns on soil organic matter, bacterial number and enzyme activities[J]. Modern Agricultural Science and Technology, 2017(24): 8-10, 13. (in Chinese) 许仪, 千慧敏, 琚联营, 等. 不同植烟模式对土壤有机质和细菌数量及酶活性的影响[J]. 现代农业科技, 2017(24): 8-10, 13. |
| [11] |
Yang WY. Traditional livelihoods of the Tujia——Longshan country, Hunan province, Da local family case study of traditional livelihoods of the Tujia[D]. Jishou: Master's Thesis of Jishou University, 2011 (in Chinese) 杨文英.土家族传统生计方式研究——以湖南省龙山县大安乡为研究个案[D].吉首: 吉首大学硕士学位论文, 2011 http://d.wanfangdata.com.cn/thesis/D237185 |
| [12] |
Guan GS. Studies on characters of magnesium uptake and accumulation of tobacco and its regulatory measurement[D]. Changsha: Doctoral Dissertation of Hunan Agricultural University, 2007 (in Chinese) 关广晟.烟草镁吸收积累规律与调控研究[D].长沙: 湖南农业大学博士学位论文, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10537-2007208172.htm |
| [13] |
Wu F. Effect of tobacco continuous cropping on yield and quality of soil and tobacco plant and its prevention and control measures[J]. Nongyekeji, 2012(11): 58. (in Chinese) 吴锋. 烟草连作对土壤、烟株产量和质量的影响及防控措施[J]. 农家科技(下旬刊), 2012(11): 58. |
| [14] |
Wang PW, Zhu JF, Chen Z, et al. Coupling analysis based on high throughput sequencing technology of soil bacterial community and soil environmental factors in continuous cropping tobacco soil[J]. Journal of Agricultural Biotechnology, 2016, 24(11): 1754-1763. (in Chinese) 王佩雯, 朱金峰, 陈征, 等. 高通量测序技术下连作植烟土壤细菌群落与土壤环境因子的耦合分析[J]. 农业生物技术学报, 2016, 24(11): 1754-1763. |
| [15] |
Gao L, Wang XW, Shen GM, et al. Difference of bacteria and fungi community structure in tobacco-planting soil of different continuous cropping years[J]. Journal of Agricultural Science and Technology, 2019, 21(8): 147-152. (in Chinese) 高林, 王新伟, 申国明, 等. 不同连作年限植烟土壤细菌和真菌群落结构差异[J]. 中国农业科技导报, 2019, 21(8): 147-152. |
| [16] |
Shi QH, Jiao F, Geng W, et al. An overview on research into factors hindering continuous cropping in flue-cured tobacco[J]. Acta Tabacaria Sinica, 2009, 15(6): 81-84. (in Chinese) 石秋环, 焦枫, 耿伟, 等. 烤烟连作土壤环境中的障碍因子研究综述[J]. 中国烟草学报, 2009, 15(6): 81-84. |
| [17] |
Zheng LY, Hu JF, Lin CH, et al. The production of succession cropping obstacles and its prevention and cure steps[J]. Chinese Journal of Tropical Agriculture, 2005, 25(2): 58-62. (in Chinese) 郑良永, 胡剑非, 林昌华. 作物连作障碍的产生及防治[J]. 热带农业科学, 2005, 25(2): 58-62. |
| [18] |
Zhao X, Liu HL, Yang P, et al. Effects of drip irrigation on bacterial diversity and community structure in rhizosphere soil of alfalfa[J]. Microbiology China, 2019, 46(10): 2579-2590. (in Chinese) 赵祥, 刘红玲, 杨盼, 等. 滴灌对苜蓿根际土壤细菌多样性和群落结构的影响[J]. 微生物学通报, 2019, 46(10): 2579-2590. |
| [19] |
Wan WJ, Yuan LJ, Zhang BJ, et al. Evaluation for influence of dehumidification air drying on detection accuracy of soil physical and chemical properties[J]. Modern Agricultural Science and Technology, 2018(14): 187-188. (in Chinese) 万伟杰, 袁丽娟, 张标金, 等. 除湿风干对土壤主要理化性质检测准确性的影响评价[J]. 现代农业科技, 2018(14): 187-188. |
| [20] |
Ozdal M, Ozdal OG, Sezen A, et al. Continuous production of indole-3-acetic acid by immobilized cells of Arthrobacter agilis[J]. 3 Biotech, 2017, 7(1): 23. |
| [21] |
Wang YZ, Xu XM, Liu TM, et al. Analysis of bacterial and fungal communities in continuous-cropping ramie (Boehmeria nivea L. Gaud) fields in different areas in China[J]. Scientific Reports, 2020, 10(1): 3264. DOI:10.1038/s41598-020-58608-0 |
| [22] |
Gao XN, Wu ZL, Liu R, et al. Rhizosphere bacterial community characteristics over different years of sugarcane ratooning in consecutive monoculture[J]. BioMed Research International, 2019, 2019: 4943150. |
| [23] |
Chen DM, Huang JW, Ke WH, et al. Allelopathic evaluation of continuous cropping tobacco rhizospheric soil and allelochemical identification[J]. Acta Tabacaria Sinica, 2012, 18(1): 46-52. (in Chinese) 陈冬梅, 黄锦文, 柯文辉, 等. 连作烟草根际土壤化感潜力评价及化感物质鉴定[J]. 中国烟草学报, 2012, 18(1): 46-52. |
 2020, Vol. 47
2020, Vol. 47