扩展功能
文章信息
- 侯萌, 陈一民, 焦晓光, 孙波, 隋跃宇
- HOU Meng, CHEN Yi-Min, JIAO Xiao-Guang, SUN Bo, SUI Yue-Yu
- 两种气候条件下不同有机质含量农田黑土真菌群落结构特征
- Characteristics of fungal community structure in arable mollisols with different organic matter content under two climatic conditions
- 微生物学通报, 2020, 47(9): 2822-2832
- Microbiology China, 2020, 47(9): 2822-2832
- DOI: 10.13344/j.microbiol.china.200740
-
文章历史
- 收稿日期: 2020-07-17
- 接受日期: 2020-08-26
- 网络首发日期: 2020-08-28
2. 黑龙江大学现代农业与生态环境学院 黑龙江 哈尔滨 150080;
3. 中国科学院南京土壤研究所 江苏 南京 210008;
4. 中国科学院大学 北京 100049
2. College of Modern Agriculture and Ecological Environment, Heilongjiang University, Harbin, Heilongjiang 150080, China;
3. Institute of Soil Science, Chinese Academy of Sciences, Nanjing, Jiangsu 210008, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
土壤真菌作为土壤生态系统的重要组成部分,参与土壤中的有机质分解、腐殖质形成及土壤养分循环等生物化学过程[1-2],土壤真菌群落结构变化是生态系统恢复的关键性指标[3]。土壤真菌可利用的能源主要来自土壤中的动植物残体、植物根系及其分泌物和土壤有机质[4-6]。有研究表明,一些农业措施会对真菌群落结构和多样性产生影响,其中施肥会改变土壤真菌群落结构[7],并降低其多样性。王小玲等[8]提出免耕覆盖配施有机肥提高宁夏南部地区土壤真菌群落多样性。陈祖静等[9]对桉树人工林进行短期施肥处理发现,施肥组与不施肥组真菌群落结构差异显著,短期施肥后土壤真菌α多样性和丰富度指数均降低。真菌群落结构与土壤养分的有效性密切相关[10]。王蕊等[11]以东北丘陵区土壤为研究对象,发现土壤总氮、速效磷和硝态氮是驱动其真菌群落变化的关键因子。同时,关于真菌群落受气候变化的影响也受到广泛关注,有研究表明,气候变化带来的升温和干燥可能会影响土壤真菌的群落组成[12],升温明显提高了土壤真菌的活性,增加了丰富度[13]。Looby等[14]也认为气候变暖会促进一些稀有真菌的生长,使群落多样性增加,并且也会通过直接作用和间接作用改变真菌的群落结构。但有学者提出升温并不影响土壤真菌的丰富度[15]。
东北黑土有机质含量变化较大,范围在6.5−128.9 g/kg之间[16],有机质含量的不同影响土壤真菌群落结构[17];同时,东北黑土区地处中高纬度,是粮食生产受气候变化影响的敏感区,气候条件的改变也会导致土壤真菌群落结构改变。然而目前关于土壤真菌群落的研究大多数集中在气候条件、施肥方式、有机质含量等单一因素对土壤微生物影响的领域[18-21],对不同有机质含量农田黑土真菌群落对不同气候条件的响应鲜有报道。因此,本研究在东北黑土带上选取不同有机质含量的农田黑土,通过空间移位的方法分别将其放置在两种气候条件下,设置施肥与不施肥两种施肥水平,用以研究气候-有机质含量-施肥对土壤真菌群落结构的综合影响,以明确有机质含量和气候对土壤微生物群落的影响,对于实现全球气候变化条件下农业生态系统的可持续发展具有重要意义。
1 材料与方法 1.1 试验地概况试验地分别位于黑龙江省海伦市中国科学院海伦农业生态实验站(N47°27ʹ,E126°56ʹ)和吉林省德惠市黑土研究基地(N44°12ʹ,E125°33ʹ)。黑龙江省海伦市属寒温带大陆性季风气候。冬季寒冷干燥,夏季温热多雨,年平均气温1.5℃,年均降水量500−600 mm左右,年有效积温2 400−2 600 ℃,无霜期110−125 d。吉林省德惠市属于中温带大陆性季风气候,春季多风干旱,夏季炎热多雨,年平均气温4.5℃,降水量550−600 mm左右,年有效积温2 800 ℃左右,无霜期135−140 d。
1.2 材料设计试验依托于2004年秋季建立的“黑土土壤生产力空间移位长期定位试验”,该试验在海伦和德惠分别建立30个试验小区(1.2×1.4×1.0 m),小区之间用20 cm厚砖墙分隔,砖墙以水泥覆盖,内侧贴防水布。在黑土带上选取5块不同有机质含量的农田黑土,分别为SOM1.7 (16.6 g/kg)、SOM3 (32.0 g/kg)、SOM5 (50.6 g/kg)、SOM6 (58.8 g/kg)和SOM11 (108.9 g/kg),土壤基础理化性质见表 1,以土壤剖面分层采集,按原土层层次分别置入小区中。试验设施肥(NPK)和不施肥(CK)两个组别,每个处理 3次重复。
| Item | SOM1.7 | SOM3 | SOM5 | SOM6 | SOM11 |
| 有机质 Soil organic matter (g/kg) |
16.6 | 32.0 | 50.6 | 58.8 | 108.9 |
| 全氮 Total nitrogen (g/kg) |
0.8 | 1.7 | 2.6 | 2.9 | 4.9 |
| 全磷 Total phosphorous (g/kg) |
0.6 | 0.8 | 1.6 | 1.9 | 2.4 |
| 全钾 Total potassium (g/kg) |
12.6 | 13.0 | 13.8 | 14.4 | 15.6 |
| pH | 6.63 | 5.95 | 6.1 | 5.42 | 6.34 |
试验地种植作物为玉米,采用相同的种植与管理模式。氮肥为尿素,施入量(以N计)为150 kg/hm2,60%作基肥,40%在玉米大喇叭口期追施;磷酸二铵磷为磷肥,施入量(以P2O5计)为75 kg/hm2;氯化钾为钾肥,施入量(以K2O计)为60 kg/hm2。磷肥、钾肥全部作为基肥施入[22]。
1.3 主要试剂和仪器Fast DNA Spin Kit for Soil,MP Biomedicals公司;DNA聚合酶,北京全式金生物技术有限公司;DNA纯化试剂盒,Thermo公司;TS1F/ITS2R引物,上海美吉生物公司。PCR仪,AB公司;Qubit 3.0荧光计,Thermo公司;测序仪,Illumina公司。
1.4 样品采集与分析土壤样品采集于2017年玉米收获后(德惠9月28日,日均温7.1 ℃,晴;海伦10月8号,日均温15.4 ℃,晴)取样。用土钻采用“S”型均匀采集0−20 cm土样,每个小区取5−7个点混成一个样。混合的土样装入封口聚乙烯袋,置于保鲜盒中带回实验室进行处理。取回的土样分成两份:一份立即过2 mm筛,在−80℃冰箱保存,用于土壤总DNA的提取;另一份经风干后过1 mm和0.25 mm筛,供土壤pH、有机碳、全氮、全磷的测定用。
土壤理化性质:采用常规分析法测定,pH以2.5:1的水土比用pH计测定;有机质、全氮测定用元素分析仪;全磷采用酸溶-钼锑抗比色法[23]。
使用Fast DNA Spin Kit for Soil提取土壤总DNA,选取引物ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS rRNA基因序列进行扩增。PCR反应体系:5×FastPfu Buffer 4 μL,dNTPs (2.5 mmol/L) 2 μL,引物ITS1F (5 mmol/L) 0.8 μL,引物ITS2R (5 mmol/L) 0.8 μL,FastPfu Polymerase (2.5 U/μL) 0.4 μL,BSA 0.2 μL,Template DNA 10 ng,补ddH2O至20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。PCR扩增产物采用2%琼脂糖凝胶电泳检测,使用DNA纯化试剂盒进行纯化。纯化后的PCR扩增产物等量混合后提交至上海美吉公司进行Illumina MiSeq序列分析。原始序列上传至SRA数据库(SUB7928466)。
1.5 数据分析根据Barcode序列和PCR扩增产物序列从原始序列中分出各样品数据,对其进行拼接及质控过滤,获得优化序列。对优化序列提取非重复序列,便于降低分析中间过程冗余计算量(http://drive5.com/usearch/manual/dereplication.html),去除没有重复的单序列(http://drive5.com/usearch/manual/singletons.html),按照97%相似性对非重复序列(不含单序列)进行OTU聚类。
测序数据采用QIIME 1.9软件,对数据进行OTU聚类分析、物种分类学分析、α多样性分析、β多样性分析及Redundancy analysis (RDA)/Canonical correspondence analysis (CCA)分析。
采用Excel 2013对所有基础数据进行整理,利用SPSS 20.0进行差异显著性统计分析,采用Sigmaplot 12.5软件和R软件绘图。
2 结果与分析 2.1 气候-施肥-有机质对农田黑土真菌群落结构的影响利用Illumina MiSeq测序平台对60个样品进行了高通量测序分析,得到的原始序列共386万多条序列,经Unite (Release 6.0 http://unite.ut.ee/index.php)真菌数据库比对,其中98.70%的序列为真菌序列,每个样品中平均有64 355条序列。对两种气候条件下不同处理土壤真菌群落组成分析发现,在门水平上,共检测到7个真菌门。如图 1所示,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)属于优势菌门,相对丰度较高,共占所有序列的92.48%;在60个土壤样品中,它们的相对丰度分别为14.49%−74.37%、2.16%−83.04%和1.05%−31.06%。子囊菌门的相对丰度随有机质含量无明显变化规律,同时对气候响应在不同有机质农田黑土中不同(图 2A),气候较冷降低SOM1.7和SOM5土壤子囊菌门的相对丰度,其余3种土壤相对丰度增加。施肥仅增加了SOM5中子囊菌门的相对丰度,气候较暖条件下增加幅度为10%,气候较冷条件下增加幅度为11%;其余肥力水平下施肥处理均降低土壤中子囊菌门的相对丰度,降低幅度为2.89%−31.89%,而且降低幅度随土壤有机质含量升高而减小。担子菌门仅在不施肥处理中随土壤有机质含量先增加,在SOM5中达到最高,之后随有机质含量升高而降低。气候变化对担子菌门的丰度无显著影响(P > 0.05),而施肥处理显著增加各有机质含量农田黑土中担子菌门的相对丰度,在SOM1.7和SOM3中增加幅度达到最高。接合菌门的相对丰度随有机质含量的增加而增加,气候变冷和施肥处理均降低土壤中接合菌门的相对丰度,施肥所带来的降低幅度在气候较冷条件下不明显,甚至在SOM5和SOM11中会使接合菌门的丰度略有增加,但在气候较暖条件下,施肥在各有机质含量农田黑土中均会显著降低(P < 0.05)接合菌门的相对丰度。

|
| 图 1 真菌门水平相对丰度 Figure 1 The relative abundances of fungal phyla |
|
|

|
| 图 2 真菌OTU水平Heatmap图与聚类分析 Figure 2 Heatmap and cluster analysis of fungal OTU |
|
|
选取相对丰度 > 0.5% OTU,得到35个优势OTU (图 2),包括OTU1261 (Zygomycota门Norank纲Mortierellales目)、OTU572 (Basidiomycota门Tremellomycetes纲Cystofilobasidiales目)、OTU1071 (Basidiomycota门Tremellomycetes纲Cystofilobasidiales目)、和OTU1146 (Zygomycota门Tremellomycetes纲Tremellales目),它们的相对丰度最高可达10%以上,分别为3.29%−14.86%、0.33%−20.02%、1.99%−20.65%和0.49%−15.73%。经比对后发现,它们属于担子菌门(Basidiomycota)和接合菌门(Zygomycota)两大优势菌门。选取总丰度前50的OTU进行聚类分析,由图 3可见,相同施肥处理、相同气候条件下各有机质含量农田黑土真菌OTU组成较接近,可聚类到一起,但是相同有机质含量并未聚到一起。说明气候条件、施肥对真菌OTU组成会造成较大影响,但有机质含量造成的影响较小。

|
| 图 3 真菌群落结构PCoA分析图 Figure 3 PCoA analysis of fungal communities |
|
|
如表 2所示,在97%相似水平下进行OTU统计分析,每个样品OTU数在259−761个之间,每个样品平均获得540个OTU。真菌测序覆盖度均达到99%以上,证明测序结果能较好地反映不同有机质含量农田黑土中真菌群落多样性的真实情况。两种气候条件、不同施肥处理下,5个有机质含量农田黑土中OTU数量、Shannon指数、Simpson指数和Chao1指数分别为355−689、2.71−3.88、0.049−0.201和485−830。总体来看,有机质含量对多样性指数影响不大,但施肥和气候对多样性指数产生了较大的影响。气候较冷条件下,OTU数量、Chao1指数、Shannon指数和Simpson指数均出现不同程度的降低,说明气候变冷不仅会减少农田黑土中真菌物种数量,还会降低其多样性。与气候较冷相似,施肥也会降低各有机质含量农田黑土中真菌物种数量和多样性,但是降低幅度随有机质含量升高而逐渐减小。
| Treatment | OTU number | Shannon index | Simpson index | Chao1 index | Coverage (%) |
| DH-CK-SOM1.7 | 635±36 | 3.87±0.15 | 0.050±0.015 | 766±78 | 99.77 |
| DH-NPK-SOM1.7 | 424±72 | 2.71±0.49 | 0.191±0.083 | 520±58 | 99.82 |
| DH-CK-SOM3 | 689±29 | 3.88±0.15 | 0.059±0.019 | 830±53 | 99.78 |
| DH-NPK-SOM3 | 506±45 | 3.15±0.34 | 0.117±0.055 | 642±48 | 99.80 |
| DH-CK-SOM5 | 658±56 | 3.86±0.23 | 0.049±0.012 | 808±78 | 99.76 |
| DH-NPK-SOM5 | 501±74 | 3.38±0.31 | 0.087±0.040 | 628±88 | 99.81 |
| DH-CK-SOM6 | 658±101 | 3.64±0.79 | 0.086±0.085 | 803±137 | 99.76 |
| DH-NPK-SOM6 | 511±52 | 3.4±0.27 | 0.078±0.014 | 650±59 | 99.79 |
| DH-CK-SOM11 | 628±107 | 3.84±0.28 | 0.052±0.016 | 768±125 | 99.71 |
| DH-NPK-SOM11 | 573±65 | 3.73±0.3 | 0.059±0.020 | 720±14 | 99.79 |
| HL-CK-SOM1.7 | 544±116 | 3.38±1 | 0.123±0.134 | 662±126 | 99.80 |
| HL-NPK-SOM1.7 | 420±146 | 3.06±1.26 | 0.201±0.258 | 514±152 | 99.82 |
| HL-CK-SOM3 | 573±18 | 3.89±0.19 | 0.051±0.010 | 669±5 | 99.80 |
| HL-NPK-SOM3 | 404±69 | 2.91±0.53 | 0.140±0.083 | 545±65 | 99.79 |
| HL-CK-SOM5 | 578±68 | 3.36±0.59 | 0.112±0.088 | 720±62 | 99.80 |
| HL-NPK-SOM5 | 489±40 | 3.53±0.26 | 0.068±0.012 | 619±47 | 99.79 |
| HL-CK-SOM6 | 585±38 | 3.22±0.67 | 0.147±0.125 | 710±16 | 99.81 |
| HL-NPK-SOM6 | 355±52 | 2.99±0.35 | 0.115±0.064 | 485±104 | 99.81 |
| HL-CK-SOM11 | 591±76 | 3.58±0.49 | 0.105±0.060 | 729±48 | 99.74 |
| HL-NPK-SOM11 | 491±77 | 3.58±0.35 | 0.075±0.034 | 602±126 | 99.81 |
为了进一步分析气候-有机质-施肥对真菌群落结构的影响,将测序数据按最小序列数抽平后进行PCoA分析(图 3)。基于Bray-curtis距离,从PCoA图谱发现,沿PC1轴方向,施肥与不施肥处理明显分开;沿PC2轴方向,气候较冷与气候较暖条件也明显分开。但是相同气候条件下,相同施肥处理中各有机质含量农田黑土之间无明显区分。PCoA分析结果进一步表明,施肥和气候对不同有机质含量农田黑土中真菌群落结构的影响较大,而有机质含量的影响较小。
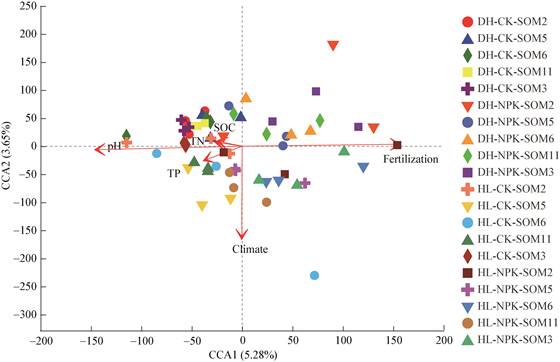
采用CCA分析进一步对两种环境条件、两种施肥处理下不同有机质含量农田黑土中真菌群落结构变化进行了分析,并明确了影响真菌群落结构变化的环境因子(图 4)。与PCoA分析类似,CCA分析图谱显示施肥与不施肥处理沿CCA1方向发生分异,变异解释率为5.28%;不同气候条件真菌群落结构沿CCA2方向发生分异,变异解释率为3.65%,总变异解释率为8.93%。RDA分析结果表明,气候因子(r2=0.519 6,P=0.001)、有机质含量(r2=0.198 3,P=0.001)、全氮(r2=0.199 7,P=0.001)、施肥(r2=0.687 8,P=0.001)和pH (r2=0.494 2,P=0.001)是影响不同有机质含量农田黑土中真菌群落结构发生变化的主要因素。综上所述,气候、有机质含量、施肥均会对土壤真菌群落结构产生影响。
|
| 图 4 真菌群落结构CCA分析图 Figure 4 CCA analysis of fungal communities |
|
|
本研究发现气候较暖土壤农田黑土多样性略高于气候较冷条件,这主要是由于温度升高加速有机质分解[24],为真菌生长繁殖提供充足碳源,这与Treseder等[25]研究提出温度升高提高土壤真菌多样性结论相似。然而本文土壤真菌多样性随有机质含量增加无显著变化,这与Liu等[26]研究提出的有机质含量是我国东北黑区真菌多样性主导因素不一致,原因可能是本研究仅选取5个不同含量的有机质农田黑土,并不能很好地体现二者之间的关系;同时,在海伦和德惠实验站,不同有机质土壤自然环境和人工管理均保持一致,可能会导致有机质对土壤真菌多样性影响被遮蔽。本研究中真菌多样性与施肥处理间呈显著负相关(P < 0.05),可能主要由氮肥施入引起[8, 27]。有报道称,氮肥施入造成局部氮素浓度过高,导致一部分真菌死亡[28];同时,氮肥施入导致土壤pH降低,共同造成氮肥施入降低土壤总体真菌的多样性[29]。但本研究中有机质含量高的农田黑土施肥后真菌多样性降低幅度变小,是因为土壤有机质含量的升高[30]导致土壤缓冲能力变强,施肥造成的负面影响被减弱。
不同有机质含量农田黑土在两种施肥处理并置于不同气候条件下,优势真菌菌门均为子囊菌门、担子菌门和接合菌门,这与其他关于黑土优势真菌研究相一致[31]。气候条件、有机质含量和施肥处理均对土壤真菌相对丰度产生一定的影响,造成的原因可能是真菌的繁殖能力较细菌等来说较低,导致其稳定性低、受干扰程度大。轻微的气候变化对子囊菌门和不施肥处理下担子菌门的相对丰度影响不大,对施肥处理下担子菌门和接合菌门相对丰度产生一定影响。原因可能是:子囊菌门真菌的孢子一般都具有较厚的细胞壁,造成其对轻微的气候变化无明显响应[25];担子菌门对难分解碳的利用能力较强,而且对低养分环境的适应能力也比较强[32];接合菌门主要是在富营养型环境中生长[33],气候较冷会降低其相对丰度。施肥导致子囊菌门和接合菌门相对丰度降低、担子菌门相对丰度升高。可能是由于黑土本身供氮能力高,施入氮肥后造成局部氮素浓度偏高,而这样的环境不利于子囊菌门和接合菌门类真菌的生长[34];还有一种可能是氮肥施入刺激植物对氮素的吸收作用,与其发生竞争作用,局部形成氮素缺乏的环境也不利于这两种菌门真菌的生长。然而担子菌门对有机质中碳利用能力有限,施肥增加了土壤中养分的有效性,但随有机质含量升高,施肥对担子菌门的增加效果也减弱。本研究中不同有机质含量对农田黑土中子囊菌门和担子菌门相对丰度产生一定的影响,但有机质与二者均无明显相关关系,与Liu等[26]的研究结果不一致,这可能与土壤有机质结构有关[35],而且本研究中5种不同有机质含量农田黑土种植作物均为玉米,植被选择作用可能减弱了土壤有机质含量对二者的影响[36]。
由图 3可知,气候-有机质-施肥对农田黑土真菌群落结构产生了一定的影响。与本研究相似,Looby等[14]提出气候条件是森林土壤真菌群落结构差异的主要驱动因子,气候对真菌群落的影响可能主要是通过改变碳源可利用性来实现[24]。陈文婷等[37]研究表明不同有机质含量农田黑土有机碳组分存在较大差异,使真菌群类间的碳源分配不同,导致真菌群落差异[38]。施肥对真菌群落影响促进担子菌门等真菌的生长,抑制子囊菌门和接合菌门等真菌的繁殖增长。同时本研究发现群落结构受土壤pH显著影响,但在有些研究中指出pH对真菌群落结构的影响要远远弱于细菌[34]。原因可能是本研究中消除了部分种植作物类型、施肥量差异和一些不稳定气候因子等带来的变异,使pH对真菌群落结构的影响凸显出来。综上所述,气候因素、施肥和土壤自身理化性质均会改变真菌群落结构,但其之间的交互作用需要进一步深入研究。
4 结论(1) 在门和OTU水平上,有机质含量、施肥和气候影响农田黑土中真菌群落组成。两种气候条件下不同处理农田黑土土壤真菌群落的优势菌门保持一致,均为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)。
(2) 气候条件、施肥和有机质含量均在一定程度上改变了农田黑土真菌的多样性。但有机质含量对多样性指数影响不大,气候变冷和施肥使多样性指数均出现不同程度的降低。
(3) CCA分析表明,气候、pH、SOC、施肥与农田黑土真菌多样性与群落结构密切相关。
| [1] |
Bridge P, Spooner B. Soil fungi: diversity and detection[J]. Plant and Soil, 2001, 232(1/2): 147-154. DOI:10.1023/A:1010346305799 |
| [2] |
Varma A, Buscot F. Microorganisms in Soils: Roles in Genesis and Functions[M]. Berlin: Springer, 2005.
|
| [3] |
Siciliano SD, Palmer AS, Winsley T, et al. Soil fertility is associated with fungal and bacterial richness, whereas pH is associated with community composition in polar soil microbial communities[J]. Soil Biology and Biochemistry, 2014, 78: 10-20. DOI:10.1016/j.soilbio.2014.07.005 |
| [4] |
de Boer W, Folman LB, Summerbell RC, et al. Living in a fungal world: impact of fungi on soil bacterial niche development[J]. FEMS Microbiology Reviews, 2005, 29(4): 795-811. DOI:10.1016/j.femsre.2004.11.005 |
| [5] |
Frey SD, Six J, Elliott ET. Reciprocal transfer of carbon and nitrogen by decomposer fungi at the soil-litter interface[J]. Soil Biology and Biochemistry, 2003, 35(7): 1001-1004. DOI:10.1016/S0038-0717(03)00155-X |
| [6] |
Kramer C, Gleixner G. Variable use of plant- and soil-derived carbon by microorganisms in agricultural soils[J]. Soil Biology and Biochemistry, 2006, 38(11): 3267-3278. DOI:10.1016/j.soilbio.2006.04.006 |
| [7] |
Allison SD, Hanson CA, Treseder KK. Nitrogen fertilization reduces diversity and alters community structure of active fungi in boreal ecosystems[J]. Soil Biology and Biochemistry, 2007, 39(8): 1878-1887. DOI:10.1016/j.soilbio.2007.02.001 |
| [8] |
Wang XL, Ma K, Fu YZ, et al. Effects of no-tillage, mulching, and organic fertilization on soil fungal community composition and diversity[J]. Chinese Journal of Applied Ecology, 2020, 31(3): 890-898. (in Chinese) 王小玲, 马琨, 伏云珍, 等. 免耕覆盖及有机肥施用对土壤真菌群落组成及多样性的影响[J]. 应用生态学报, 2020, 31(3): 890-898. |
| [9] |
Chen ZJ, Gao SK, Chen Y, et al. Effects of short-term fertilization on soil fungal community structure and functional group in Eucalyptus artificial forest[J]. Acta Ecologica Sinica, 2020, 40(11): 3813-3821. (in Chinese) 陈祖静, 高尚坤, 陈园, 等. 短期施肥对桉树人工林土壤真菌群落结构及功能类群的影响[J]. 生态学报, 2020, 40(11): 3813-3821. |
| [10] |
Sui YY, Jiao XG, Gao CS, et al. The relationship among organic matter content and soil microbial biomass and soil enzyme activities[J]. Chinese Journal of Soil Science, 2009, 40(5): 1036-1039. (in Chinese) 隋跃宇, 焦晓光, 高崇生, 等. 土壤有机质含量与土壤微生物量及土壤酶活性关系的研究[J]. 土壤通报, 2009, 40(5): 1036-1039. |
| [11] |
Wang R, Zhu K, Li G, et al. Metabolic characteristics of responses of soil fungi to land-use changes in the hilly regions of northeast China[J]. Journal of Agro-Environment Science, 2018, 37(9): 1925-1932. (in Chinese) 王蕊, 朱珂, 李刚, 等. 东北丘陵区林地、耕地和草地土壤真菌群落代谢特征[J]. 农业环境科学学报, 2018, 37(9): 1925-1932. |
| [12] |
Castaño C, Lindahl BD, Alday JG, et al. Soil microclimate changes affect soil fungal communities in a Mediterranean pine forest[J]. New Phytologist, 2018, 220(4): 1211-1221. DOI:10.1111/nph.15205 |
| [13] |
Zhang WJ, Xu Q, Wang XK, et al. Impacts of experimental atmospheric warming on soil microbial community structure in a tallgrass prairie[J]. Acta Ecologica Sinica, 2004, 24(8): 1742-1747. |
| [14] |
Looby CI, Maltz MR, Treseder KK. Belowground responses to elevation in a changing cloud forest[J]. Ecology and Evolution, 2016, 6(7): 1996-2009. DOI:10.1002/ece3.2025 |
| [15] |
Bergner B, Johnstone J, Treseder KK. Experimental warming and burn severity alter soil CO2 flux and soil functional groups in a recently burned boreal forest[J]. Global Change Biology, 2004, 10(12): 1996-2004. DOI:10.1111/j.1365-2486.2004.00868.x |
| [16] |
Zhang XY, Sui YY, Zhang XD, et al. Spatial variability of nutrient properties in black soil of northeast China[J]. Pedosphere, 2007, 17(1): 19-29. DOI:10.1016/S1002-0160(07)60003-4 |
| [17] |
Liu JJ, Sui YY, Yu ZH, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122. DOI:10.1016/j.soilbio.2013.12.014 |
| [18] |
Ji LF, Ni K, Ma LF, et al. Effect of different fertilizer regimes on the fungal community of acidic tea-garden soil[J]. Acta Ecologica Sinica, 2018, 38(22): 8158-8166. (in Chinese) 季凌飞, 倪康, 马立锋, 等. 不同施肥方式对酸性茶园土壤真菌群落的影响[J]. 生态学报, 2018, 38(22): 8158-8166. |
| [19] |
Wang YK, Su HW, Duan YN, et al. Improvement of root development of Malus hupehensis Rehd. seedlings and soil fungal diversity under replant condition by three kinds of biofertilizers[J]. Journal of Plant Nutrition and Fertilizers, 2020, 26(2): 316-324. (in Chinese) 王义坤, 苏厚文, 段亚楠, 等. 三种菌肥对连作平邑甜茶根系生长和土壤真菌群落多样性的促进效应[J]. 植物营养与肥料学报, 2020, 26(2): 316-324. |
| [20] |
Zhang BB, Wan XH, Yang JQ, et al. Effects of litters different in quality on soil microbial community structure in cunninghamia lanceolata plantation[J/OL]. Acta Pedologica Sinica: 1-11[2020-05-26]. https://kns.cnki.net/KCMS/detail/32.1119.P.20200526.1145.004.html (in Chinese) 张冰冰, 万晓华, 杨军钱, 等.不同凋落物质量对杉木人工林土壤微生物群落结构的影响[J/OL].土壤学报: 1-11[2020-05-26]. https://kns.cnki.net/KCMS/detail/32.1119.P.20200526.1145.004.html |
| [21] |
Smith AP, Marín-Spiotta E, de Graaff MA, et al. Microbial community structure varies across soil organic matter aggregate pools during tropical land cover change[J]. Soil Biology and Biochemistry, 2014, 77: 292-303. DOI:10.1016/j.soilbio.2014.05.030 |
| [22] |
Kong B, Sun B, Zheng XQ, et al. Effect of hydrothermal conditions and fertilization on metabolic characteristics of microbial community in a black soil[J]. Acta Pedologica Sinica, 2009, 46(1): 100-106. (in Chinese) 孔滨, 孙波, 郑宪清, 等. 水热条件和施肥对黑土中微生物群落代谢特征的影响[J]. 土壤学报, 2009, 46(1): 100-106. |
| [23] |
Lu RK. Methods for Soil Agrochemistry Analysis[M]. Beijing: China Agricultural Science and Technology Press, 2000. (in Chinese) 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. |
| [24] |
Looby CI, Treseder KK. Shifts in soil fungi and extracellular enzyme activity with simulated climate change in a tropical montane cloud forest[J]. Soil Biology and Biochemistry, 2018, 117: 87-96. DOI:10.1016/j.soilbio.2017.11.014 |
| [25] |
Treseder KK, Maltz MR, Hawkins BA, et al. Evolutionary histories of soil fungi are reflected in their large-scale biogeography[J]. Ecology Letters, 2014, 17(9): 1086-1093. DOI:10.1111/ele.12311 |
| [26] |
Liu JJ, Sui YY, Yu ZH, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China[J]. Soil Biology and Biochemistry, 2015, 83: 29-39. DOI:10.1016/j.soilbio.2015.01.009 |
| [27] |
Paungfoo-Lonhienne C, Yeoh YK, Kasinadhuni NRP, et al. Nitrogen fertilizer dose alters fungal communities in sugarcane soil and rhizosphere[J]. Scientific Reports, 2015, 5: 8678. DOI:10.1038/srep08678 |
| [28] |
Zhou J, Jiang X, Zhou BK, et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 135-143. DOI:10.1016/j.soilbio.2015.12.012 |
| [29] |
Maček I, Dumbrell AJ, Nelson M, et al. Local adaptation to soil hypoxia determines the structure of an arbuscular mycorrhizal fungal community in roots from natural CO₂ springs[J]. Applied and Environmental Microbiology, 2011, 77(14): 4770-4777. DOI:10.1128/AEM.00139-11 |
| [30] |
Dou S. Soil Organic Matters[M]. Beijing: Science Press, 2010. (in Chinese) 窦森. 土壤有机质[M]. 北京: 科学出版社, 2010. |
| [31] |
Yao Q, Liu JJ, Yu ZH, et al. Three years of biochar amendment alters soil physiochemical properties and fungal community composition in a black soil of northeast China[J]. Soil Biology and Biochemistry, 2017, 110: 56-67. DOI:10.1016/j.soilbio.2017.03.005 |
| [32] |
Ma AZ, Zhuang XL, Wu JM, et al. Ascomycota members dominate fungal communities during straw residue decomposition in arable soil[J]. PLoS One, 2013, 8(6): e66146. DOI:10.1371/journal.pone.0066146 |
| [33] |
Garbeva P, van Veen JA, van Elsas JD. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270. DOI:10.1146/annurev.phyto.42.012604.135455 |
| [34] |
Wang JT, Zheng YM, Hu HW, et al. Soil pH determines the alpha diversity but not beta diversity of soil fungal community along altitude in a typical Tibetan forest ecosystem[J]. Journal of Soils and Sediments, 2015, 15(5): 1224-1232. DOI:10.1007/s11368-015-1070-1 |
| [35] |
Li YC, Li YF, Chang SX, et al. Linking soil fungal community structure and function to soil organic carbon chemical composition in intensively managed subtropical bamboo forests[J]. Soil Biology and Biochemistry, 2017, 107: 19-31. DOI:10.1016/j.soilbio.2016.12.024 |
| [36] |
Broeckling CD, Broz AK, Bergelson J, et al. Root exudates regulate soil fungal community composition and diversity[J]. Applied and Environmental Microbiology, 2008, 74(3): 738-744. DOI:10.1128/AEM.02188-07 |
| [37] |
Chen WT, Liu XB, Sui YY, et al. Effect of fertilization on different types of active organic carbon along soil organic matter gradient in arable black soil[J]. Chinese Journal of Soil Science, 2013, 44(6): 1403-1407. (in Chinese) 陈文婷, 刘晓冰, 隋跃宇, 等. 施肥对梯度有机质含量农田黑土各类有机碳的影响[J]. 土壤通报, 2013, 44(6): 1403-1407. |
| [38] |
Hanson CA, Allison SD, Bradford MA, et al. Fungal taxa target different carbon sources in forest soil[J]. Ecosystems, 2008, 11(7): 1157-1167. DOI:10.1007/s10021-008-9186-4 |
 2020, Vol. 47
2020, Vol. 47