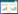扩展功能
文章信息
- 许国琪, 刘怡萱, 曹鹏熙, 刘星
- XU Guo-Qi, LIU Yi-Xuan, CAO Peng-Xi, LIU Xing
- 青藏高原冰川棘豆(Oxytropis glacialis)内生菌核心微生物组的界定及其互作网络分析
- Core microflora and endophytic interaction network of Oxytropis glacialis in Qinghai-Tibet Plateau
- 微生物学通报, 2020, 47(9): 2746-2758
- Microbiology China, 2020, 47(9): 2746-2758
- DOI: 10.13344/j.microbiol.china.200307
-
文章历史
- 收稿日期: 2020-03-28
- 接受日期: 2020-08-04
- 网络首发日期: 2020-08-13
2. 西藏大学青藏高原生态学研究中心 极端环境生物资源与适应性进化实验室 西藏 拉萨 850000;
3. 武汉大学生命科学学院 湖北 武汉 430072
2. Laboratory of Extreme Environmental Biological Resources and Adaptive Evolution, Research Center for Qinghai-Tibet Plateau Ecology, Tibet University, Lhasa, Tibet 850000, China;
3. College of Life Sciences, Wuhan University, Wuhan, Hubei 430072, China
核心微生物组(core microbiome)是微生物组中的关键组成部分,在进化过程中通过自然选择得以保留、富集和遗传,在不同环境样品中发挥重要的生态作用[1]。随着生物信息学和分子生态学的快速发展,核心微生物组研究在土壤[2]、植物[3]、水体[4]等环境样本中得到广泛应用。作为植物微生态系统中的重要部分,植物内生菌广泛存在于各种植物中并发挥重要的生态功能,而植物核心微生物组的研究认为,核心微生物在提高寄主生产力及维持其健康等生态功能中发挥了关键作用[5]。植物核心微生物组的研究有助于深入认识内生菌与寄主间的相互关系,深刻理解内生菌对寄主的影响及其在自然生态系统中的功能[6]。在自然界中,微生物并非以分离的个体形式存在,而是通过直接或间接的相互作用形成复杂多样的共发生网络,在互养、共生、竞争等种间关系的作用下,彼此之间产生正向、负向或中性的影响。目前,在人类肠道[7]、皮肤[8]、植物的叶际[9]、根际[10]等多种环境材料中已广泛开展了微生物互作的研究,通过构建微生物相关性网络,在阈值的控制下揭示微生物组中复杂的菌群关系及其可能的生态作用。
青藏高原作为地球“第三极”,多样的生态环境和丰富的生物多样性为植物内生菌的研究提供了丰富的资源储备[11],但目前青藏高原已有的植物内生菌研究多集中在基于可培养手段对植物内生菌进行分离、鉴定[12-13],以及不同环境中内生菌多样性的免培养测序分析[14-15],从核心菌群及其相关性网络的角度对青藏高原特有植物内生菌的研究未见报道。
冰川棘豆(Oxytropis glacialis)是青藏高原特有的豆科棘豆属多年生草本植物[16],作为影响西藏畜牧业发展的主要疯草之一,动物采食这种毒草后可引起以慢性神经机能障碍为特征的中毒反应,甚至死亡,这制约了西藏农牧民经济收入的发展,严重威胁青藏高原畜牧业的可持续发展[17-19]。目前,已有研究表明疯草的毒性来自植物内生真菌所产生的吲哚里西啶类生物碱苦马豆素[20]。2002年谭远友等分析发现西藏冰川棘豆的毒性成分为生物碱[21]。2009年余永涛等首次证实冰川棘豆中存在产苦马豆素内生真菌[20]。然而疯草内生真菌发现至今,分类地位先后发生了多次变化,2014年Woudenberg等将其重新界定为链格孢属,并为此类真菌建立了Undifilum组[22]。近年来国内的研究综合表明,我国的疯草植物无论黄芪还是棘豆的内生真菌均为棘豆链格孢属[23-27]。此外,基于微生物间的制约关系对利用疯草毒素的微生物研究也开始受到关注,赵兴华、王建华等从疯草生长的土壤中分离到嗜麦芽寡养单胞菌YLZZ-2能够有效降解苦马豆素[28-29],胡延春等在甘肃棘豆的研究中发现存在降解苦马豆素的短波单胞杆菌属内生细菌Brevundimonas diminuta Ab[30]。
本研究通过高通量测序分析西藏冰川棘豆不同组织内生细菌与内生真菌的多样性,揭示冰川棘豆内生菌的核心菌群结构,并从菌群相关性网络的角度对冰川棘豆苦马豆素毒性相关的内生菌互作模式进行探究,为青藏高原疯草类有毒植物的研究和治理提供参考依据。
1 研究方法 1.1 区域概况及样品采集西藏位于青藏高原西南部,地处N26°50′- 36°53′,E78°25′-99°06′之间,平均海拔在4 000 m以上,素有世界屋脊、地球“第三极”之称。根据西藏自治区2017年度土地利用变化情况分析报告显示,西藏土地总面积约为12 021万hm2,其中草地面积为达8 431万hm2,占全区总面积的70.132%,而且75%以上为海拔4 500 m的高寒草地,自然环境恶劣,水资源分布极不均匀,特别是位于昆仑山、唐古拉山和冈底斯山、念青唐古拉山之间的藏北高原干旱缺水面积大,作为西藏主要的牧业区,其草地生态十分脆弱[31]。同时,由于全球变暖及不合理放牧等因素的多重影响,草地有毒植物呈逐年扩散趋势,并成为继鼠害、虫害后制约西藏草地畜牧业可持续发展的又一生物灾害[32]。
本研究于2018年8月对高寒草原地带尼玛(NM)、双湖(SH)、扎布耶(ZBY)和普若(PR)等地生长旺盛期的冰川棘豆根(10)、叶(11)组织进行采样,共21个样品。将根、叶分别放入无菌管中,-20 ℃车载压缩机冰箱中带回实验室,对组织进行表面无菌化处理[33]:无菌水洗涤30 s,70%无菌乙醇洗涤2 min,2.5% NaClO (含0.1% Tween-80)浸泡5 min后转移至70%无菌乙醇浸泡30 s,最后使用无菌水洗涤植物组织3次,保存在无菌管中并置于超低温冰箱-80 ℃冷冻保存,用于内生菌总DNA提取。
1.2 主要试剂和仪器微生物总DNA提取试剂盒,Omega公司;FastPfu DNA Polymerase,北京全式金生物技术有限公司;rTaq DNA Polymerase,TaKaRa公司;引物799F/1193R、ITS1F/ITS2R由上海美吉生物医药科技有限公司合成。PCR基因扩增仪,Applied Biosystems公司。
1.3 微生物DNA提取和PCR扩增和测序用提取冰川棘豆内生菌总DNA作为模板。以799F (5′-AACMGGATTAGATACCCKG-3′)和1193R (5′-ACGTCATCCCCACCTTCC-3′)为引物,对细菌16S rRNA基因V5-V7可变区进行特异性扩增[33]。PCR反应体系(20 μL):5×FastPfu Buffer 4 μL,dNTPs (2.5 mmol/L) 2 μL,正、反向引物(5 μmol/L)各0.8 μL,FastPfu Polymerase (2.5 U/μL) 0.4 μL,BSA 0.2 μL,模板10 ng,加ddH2O补足至20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;72 ℃ 10 min;第二轮PCR反应扩展13个循环,其余条件均不变,10 ℃保温。以ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′)为引物,对真菌ITS1可变区进行特异性扩增[34]。PCR反应体系(20 μL):10×Buffer 2 μL,dNTPs (2.5 mmol/L) 2 μL,正、反向引物(5 μmol/L)各0.8μL,rTaq Polymerase (5 U/μL) 0.2 μL,BSA 0.2 μL,模板10 ng,加ddH2O补足至20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,37个循环;72 ℃ 10 min,10 ℃保温。在超微量分光光度计上检测PCR产物纯度和浓度,用2%的琼脂糖凝胶电泳检测DNA完整性,基于Illumina MiSeq进行测序,PCR扩增及测序工作由上海美吉生物医药科技有限公司完成。
基于I-Sanger云平台(https://www.i-sanger.com/)、R软件(V3.5.1)等进行生物信息学及数据统计分析。所有的测序原始数据已提交到GenBank获得登录号PRJNA613354和NCBI SRA (sequence read archive)登录号SRP253268。
1.4 核心微生物组的界定与互作网络分析使用FLASH软件(V1.2.7)对每个样本Illumina MiSeq测序得到的双端序列进行拼接,用Trimmomatic (V0.33)软件对拼接后的Raw tags质量和效果进行质控过滤,得到高质量的Tags数据(clean tags)。对测序得到各样本序列进行质量控制后,利用USEARCH (V7.0)软件,在细菌SILVA (release132,http://www.arb-silva.de)、真菌Unite (release 7.2,http://unite.ut.ee/index.php)数据库中按97%的相似度分类水平划分操作分类单元(operational taxonomic units,OTU),并按最小样本序列数进行抽平。
使用MEGA (V7.0.21)软件中的邻接法(neighbor-joining method,NJ)将测序获得产苦马豆素内生真菌和降解苦马豆素内生细菌的扩增子序列与国内外已报道的相关微生物序列构建系统发育树,确认冰川棘豆中与苦马豆素相关的内生菌分类学地位。
核心微生物组的研究可以从共存、OTU丰度、系统发育和功能冗余、持久性和连通性等多个角度进行考虑,从菌群功能相关性[35-36]、菌群丰度大小[37]以及菌群共现频率[38-39]等方面进行界定。但无论哪一种核心微生物的分析方法,设置样本及OTU同一性阈值对分析核心微生物组至关重要。本研究将至少在3个样地中共存的菌属定义为冰川棘豆的核心菌属,绘制Venn图分析核心菌属组成结构。Venn图分析作为一种传统、典型的核心微生物组分析方法,通过存在或不存在显示出与样本间密切相关的分类单元,实现对核心微生物组合理、简易的探索[40]。
基于R语言的PSYCH包中corr.test函数,以属水平下的内生细菌、内生真菌以及两者组合的3个丰度矩阵为基础,计算菌属间Spearman相关系数矩阵及其显著性水平,并采用Benjamini and Hochberg false discovery rate (FDR)方法矫正上述步骤中所得到的P值。进一步筛选出菌属间Spearman相关系数具有显著性关系(|ρ| > 0.6,P < 0.01)的内生菌属,利用Gephi软件(V0.9.2)[41]计算网络的节点平均度(每个节点连接边的平均数)、网络的直径(任意两个节点间最短距离之中的最大值)、网络的平均路径(所有节点的平均网络距离)、模块化指数(衡量网络图结构的模块化程度,一般大于0.44就说明该网络图达到了一定的模块化程度)[42]、平均聚类系数(节点间倾向于聚集在一起的程度)等拓扑属性,并绘制相关性网络图进行可视化,分析菌属间的互作关系[38]。网络中的每一个节点(node)代表一个菌属,连接节点之间每条边(edge)代表各菌属之间的相关性。
2 结果与分析 2.1 冰川棘豆内生菌OTU分析对高寒草原区21个样本进行测序共得到内生细菌175 791条有效序列,内生真菌757 113条有效序列。基于97%相似度的分类水平,注释到428个细菌OTU,分属于19个门和267个属;391个真菌OTU,分属于7个门和149个属,平均测序覆盖率分别为99.88%和99.99%,表明测序深度达到分析要求且数据质量可靠,具体的测序信息如Chao1、Shannon指数等见表 1。
| Samples | 16S rRNA gene | ITS rDNA | |||||||||
| Reads | OTU | Shannon | Chao1 | Coverage (%) | Reads | OTU | Shannon | Chao1 | Coverage (%) | ||
| NM_L1 | 23 338 | 95 | 2.487 | 81 | 99.89 | 55 820 | 46 | 1.499 | 29 | 99.99 | |
| NM_L2 | 24 807 | 108 | 2.966 | 82 | 99.93 | 46 246 | 54 | 1.918 | 48 | 99.98 | |
| NM_L3 | 21 408 | 148 | 3.176 | 109 | 99.90 | 72 818 | 56 | 1.479 | 37 | 99.98 | |
| RP_L4 | 19 928 | 104 | 3.175 | 75 | 99.95 | 42 218 | 32 | 0.688 | 27 | 100 | |
| RP_L5 | 18 188 | 70 | 2.749 | 59 | 99.93 | 65 742 | 20 | 0.180 | 19 | 99.99 | |
| SH_L6 | 13 824 | 22 | 0.061 | 26 | 99.90 | 44 592 | 27 | 0.495 | 23 | 99.99 | |
| SH_L7 | 11 043 | 50 | 1.212 | 51 | 99.88 | 49 104 | 11 | 0.494 | 10 | 99.99 | |
| SH_L8 | 22 865 | 44 | 0.369 | 38 | 99.88 | 74 178 | 21 | 0.124 | 18 | 99.99 | |
| ZBY_L9 | 11 292 | 99 | 2.390 | 79 | 99.86 | 59 955 | 9 | 0.561 | 11 | 99.99 | |
| ZBY_L10 | 11 397 | 79 | 2.571 | 64 | 99.90 | 63 741 | 20 | 0.187 | 20 | 99.98 | |
| ZBY_L11 | 19 723 | 81 | 2.558 | 66 | 99.94 | 72 069 | 6 | 0.356 | 9 | 99.99 | |
| NM_R1 | 23 905 | 67 | 1.855 | 73 | 99.82 | 38 144 | 50 | 3.154 | 36 | 100 | |
| NM_R2 | 23 132 | 166 | 3.382 | 121 | 99.86 | 71 753 | 62 | 1.073 | 37 | 99.99 | |
| NM_R3 | 14 504 | 118 | 2.409 | 97 | 99.80 | 64 702 | 66 | 1.419 | 40 | 99.99 | |
| PR_R4 | 20 454 | 49 | 0.861 | 45 | 99.88 | 64 282 | 37 | 0.679 | 22 | 100 | |
| PR_R5 | 24 653 | 75 | 1.739 | 77 | 99.84 | 48 246 | 31 | 2.179 | 16 | 100 | |
| PR_R6 | 24 366 | 45 | 1.032 | 47 | 99.86 | 44 763 | 35 | 2.838 | 25 | 100 | |
| SH_R7 | 22 477 | 63 | 0.399 | 55 | 99.87 | 43 445 | 40 | 0.448 | 32 | 99.99 | |
| SH_R8 | 14 692 | 78 | 1.155 | 72 | 99.83 | 66 694 | 31 | 1.332 | 23 | 100 | |
| SH_R9 | 16 065 | 56 | 0.871 | 49 | 99.89 | 56 878 | 70 | 1.328 | 41 | 99.99 | |
| ZBY_R10 | 23 206 | 47 | 0.801 | 54 | 99.87 | 36 133 | 10 | 1.566 | 8 | 100 | |
已报道的降解疯草苦玛豆素细菌嗜麦芽寡养单胞菌YLZZ-2 (GenBank登录号EU022689)及其同源Stenotrophomonas maltophilia菌株(GenBank登录号AB194708)与本实验鉴定到同属菌株OTU175、OTU190和BLAST比对获取的部分相近16S rRNA基因序列共同构建的系统发育树(图 1A)表明,OTU190与S. acidaminiphila等菌株聚集,自展值达99;而OTU175与S. panacihumi归为一类,自展值为71,与嗜麦芽寡养单胞菌YLZZ-2及其同源S. maltophilia菌株聚集,但自展值仅为36。结果表明冰川棘豆中不存在降解苦马豆素相关的嗜麦芽寡养单胞菌。

|
| 图 1 基于已知降解苦马豆素细菌序列和冰川棘豆中同属相近菌株的16S rRNA基因序列的系统发育树 Figure 1 Phylogenetic tree based on the known sequence of 16S rRNA gene of swainsonine-degrading bacteria in Oxytropis glacialis and similar strains 注:A:Stenotrophomonas maltophilia YLZZ-2相关菌株的系统发育树;B:Brevundimonas diminuta Ab相关菌株的系统发育树.节点上的数字表示基于1 000次重复取样下临接法分析得到的自展值;比例尺表示序列间差异数值的单位长度. Note: A: Phylogenetic tree of Stenotrophomonas maltophilia YLZZ-2 related strains; B: Phylogenetic tree of Brevundimonas diminuta Ab related strains. The numbers at the nodes represents the bootstrap values based on neighbor-joining analyses of 1 000 resample data sets; The scale represents the unit length of the difference value between nucleotide sequences. |
|
|
在短波单胞杆菌属Brevundimonas diminuta Ab (GenBank登录号HM625914)和同源性B. diminuta菌株(GenBank登录号FJ950569)、OTU266、OTU442以及BLAST比对获取的部分相近16S rRNA基因序列共同构建的系统发育树中(图 1B),OTU442与短波单胞杆菌属及其同源菌株归为一类,自展值达99。OTU266与同属菌株B. subvibrioides (GenBank登录号AB008393)、B. variabilis (GenBank登录号HM241945)聚集,自展值为98,提示冰川棘豆中OTU442菌株可能为降解苦马豆素的内生细菌。
2.3 冰川棘豆中产苦马豆素内生真菌与国内外已报道的疯草内生真菌菌种的ITS序列共同构建系统发育树(图 2)表明,实验鉴定到的链格孢属OTU268、OTU321和OTU330与已报道的疯草内生真菌Alternaria cinereum (GenBank登录号HM588129)、A. bornmuelleri (GenBank登录号FJ357317)、A. fulvum (GenBank登录号HM588123)、A. oxytropis (GenBank登录号FJ357320、AY228650、HM588133)聚集,自展值为78,为潜在的链格孢属Undifilum组物种。然而OTU160和OTU503与Allium sativum (GenBank登录号AY278840)、Carex hoodia (GenBank登录号AY278839)中已鉴定的Alternaria sp.物种归为一类。
|
| 图 2 基于ITS的链格孢属的系统发育树 Figure 2 Phylogenetic tree of Alternaria based on ITS 注:节点上的数字表示基于1 000次重复取样下邻接法分析得到的自展值;比例尺表示序列间差异数值的单位长度. Note: The numbers at the nodes represents the bootstrap values based on neighbor-joining analyses of 1 000 repeated sampling data sets; The scale represents the unit length of the difference value between nucleotides sequences. |
|
|
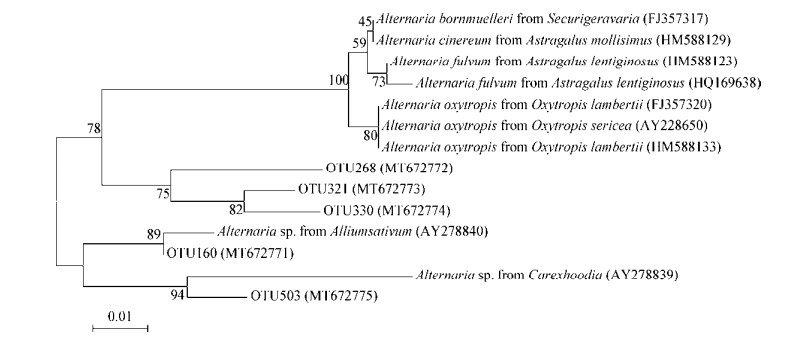
高寒草原区21个不同组织样本的内生细菌进行属水平Venn图表明(图 3),根组织中共鉴定到194个菌属,叶组织199个菌属,其中NM样本鉴定到的菌属最多,ZBY根组织样本中鉴定菌属最少,SH叶组织样本中鉴定的菌属最少。此外,根组织中至少在3个样地中共存的核心菌属有54个,占根部种类的27.84%;叶组织中有62个核心菌属,占叶部种类的31.16%。核心内生细菌种类以变形菌门(Proteobacteria,59.4%)、放线菌门(Actinobacteria,15.9%)、拟杆菌门(Bacteroidetes,11.5%)和厚壁菌门(Firmicutes,10.1%)为主。此外,本研究中包含潜在降解苦玛豆素内生细菌的Brevundimonas菌属在冰川棘豆根组织和叶组织中均作为核心菌群存在,平均相对丰度占比分别为2.174%和5.695%。

|
| 图 3 冰川棘豆不同组织中内生细菌属分类水平下的Venn图分析 Figure 3 Venn diagram analysis of endophytic bacteria in different tissues of Oxytropis glacialis based on genus level |
|
|
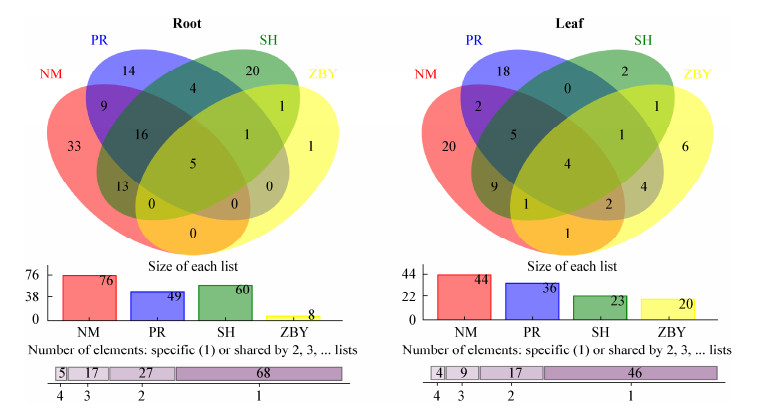
对21个不同组织样本的内生真菌进行属分类水平Venn图分析结果显示(图 4),根组织中共鉴定到117个菌属,叶组织共鉴定到76个菌属。同样是NM样本鉴定到的菌属最多,而ZBY样本鉴定菌属最少。此外,根组织中至少在3个样地中共存的核心菌属有22个,占根部种类的18.80%;叶组织中有13个核心菌属,占叶部种类的17.11%。核心内生真菌种类以子囊菌门(Ascomycota,77.2%)、担子菌门(Basidiomycota,13.6%)、接合菌门(Zygomycota,4.5%)、未分类菌门(unclassified fungi,4.5%)为主。冰川棘豆中潜在产苦马豆素的内生真菌Alternaria菌属是根组织中的核心菌属之一,在根、叶组织中平均相对丰度占比分别为0.012%和0.060%。
|
| 图 4 冰川棘豆不同组织中内生真菌属分类水平下的Venn图分析 Figure 4 Venn diagram analysis of endophytic fungi in different tissues of Oxytropis glacialis based on genus level |
|
|
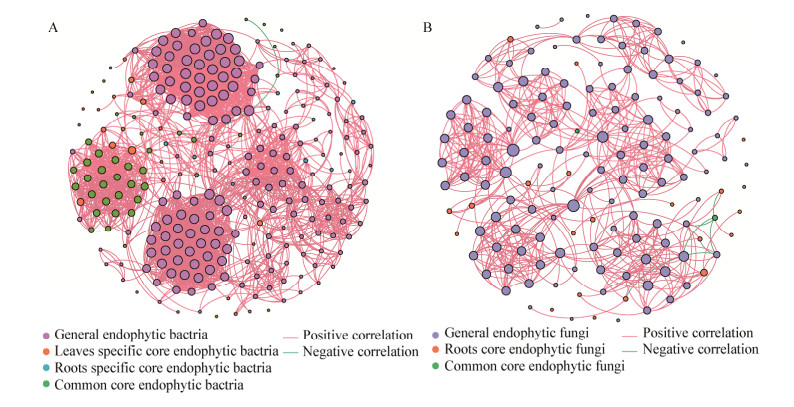
对不同类型内生菌在组织间的相关性网络互作分析结果表明,内生细菌(图 5A)网络结构中存在267个菌属或节点和2 689条边,平均度为20.14,平均路径长度为3.587,直径为9,平均聚类系数为0.7,模块化指数为0.699,网络具有模块化结构,内生细菌核心菌群相对聚集;网络结构中菌属间协同性大于拮抗性,正相关关系占99.93%。内生真菌的网络(图 5B)由149个节点和611条边组成,平均度为8.20,平均路径长度为4.635,直径为11,平均聚类系数为0.726,模块化指数0.768,核心菌群相对分散,内生真菌菌群间以正相关关系为主导,占比达99.02%。
|
| 图 5 属分类水平下冰川棘豆内生菌的相关性网络分析 Figure 5 Correlation network analysis of endophytes in Oxytropis glacialis based on genus level 注:A:内生细菌的互作分析;B:内生真菌的互作分析.红色连线表示正相关,绿色连线表示负相关,每个节点的大小与平均度成正比. Note: A: Interaction analysis of endophytic bacteria; B: Interaction analysis of endophytic fungi. The red line indicates the positive correlation, and the green line indicates the negative correlation. The size of each node is proportional to the degree. |
|
|
对冰川棘豆所有内生菌进行相关性网络互作分析显示,互作网络由416个节点和4 953条边构成,平均度为23.81条边,平均路径长度为3.599条边,直径为9条边,平均聚类系数为0.695,模块化指数为0.731,菌群间正相关协同关系大于负相关拮抗关系,达99.62%。就内生细菌与内生真菌的相关性网络来看(图 6A),内生细菌在网络中占比64.18%,内生真菌占比为35.82%,两者之间的显著性互作有1 653条边,占全部互作关系的33.37%,高于内生真菌内部间的互作程度(611条边),低于内生细菌内部间的互作(2 689条边)。从整个内生菌网络组成来看(图 6A),内生细菌以Proteobacteria (26.92%)、Firmicutes (14.42%)、Actinobacteria (13.94%)、Bacteroidetes (4.33%)和Chlamydiae (0.96%)为主,内生真菌以Ascomycota (26.92%)、Basidiomycota (6.97%)和Glomeromycota(0.96%)为主,其他菌门占比为4.58%。从核心菌群与普通菌群的相关性网络来看(图 6B),普通菌属占比78.12%,核心菌属占比21.88%,与核心菌属相关的互作网络有641条边,占全部网络的12.94%。分析发现与苦马豆素相关的内生菌Alternaria和Brevundimonas菌属之间无直接的显著性互作关系,但存在间接性相关关系。与苦马豆素相关的内生菌最短互作距离为Alternaria-Cloacibacterium-Paraphoma-Mycocentrospora-Brevundimonas,目标菌群间具有显著的拮抗性。同时,两者间也存在协同作用的互作路径,如Alternaria-Neostagonospora-Pseudoclavibacter-norank Nitriliruptoraceae-unclassified Alcaligenaceae- Brevundimonas,其中各菌属间均存在显著正相关关系。

|
| 图 6 冰川棘豆内生菌相关性网络分析 Figure 6 Correlation network analysis in endophytes of Oxytropis glacialis based on genus level 注:A:内生细菌-内生真菌互作分析;B:核心菌群-普通菌群互作分析.红色连线表示正相关,绿色连线表示负相关.连线粗细不代表相关性大小. Note: A: Endophytic bacteria-endophytic fungi interaction analysis; B: Core microbiota-common microbiota analysis. The red line indicates the positive correlation, and the green line indicates the negative correlation. The thickness of the line does not represent the size of the correlation coefficient. |
|
|
冰川棘豆除传统的去毒或解毒饲喂利用外,目前多集中在植物中苦马豆素的药用开发。随着研究的不断深入,有学者从其他疯草植物中发现植物体内存在降解苦马豆素的内生细菌[30],这为疯草类植物的生物防治提供了一种新的思路。本研究对冰川棘豆内生细菌的16S rRNA基因和内生真菌的ITS rDNA进行测序,鉴定到冰川棘豆中存在产苦马豆素的内生真菌Alternaria和降解苦马豆素的内生细菌Brevundimonas。
核心微生物组的定义应具有显著的稳定性,而稳定性阈值的确定一定程度上取决于所研究的生态学问题[6]。Segata等对按蚊生殖组织的研究中,以97%同一性水平确定了12个共享的核心OTU,但当放宽标准至90%时,核心OTU增加到54个[43]。Hu等在一定丰度基础上将至少出现在一个样品以上的属定义为白酒窖泥中的核心微生物属[37]。Rui等将至少在90%的家用沼气池中分布的OTU定义为核心OTU[39]。本研究将至少在3个样地中出现的菌属确定为冰川棘豆组织间内生菌的核心菌属,从种类上来看,冰川棘豆核心内生菌以Proteobacteria、Ascomycota菌门为主,两者作为目前大多数植物内生菌的广布菌门及优势菌门,在冰川棘豆核心微生物组中也占据主导地位。从内生菌类型和分布规律来看,冰川棘豆内生细菌中的核心菌群种类要多于内生真菌,根组织中的核心内生菌种类与叶组织相当,这可能在一定程度上反映出内生细菌相对内生真菌而言,在植物中参与寄主生理活动调控的紧密程度更高,但核心菌群在不同组织间的参与程度无明显差异。从生态功能来看,已有的研究表明植物的核心菌群往往与寄主植物健康密切相关。Hamonts等对甘蔗核心微生物组进行研究揭示了受黄冠综合症病影响的核心微生物组成员[5];Busby等通过对毛果杨叶际真菌分析发现4个核心真菌属与植物叶锈病存在显著相关性[44]。本研究中,Alternaria、Brevundimonas菌属作为核心菌属为寄主植物中苦马豆素的代谢调控发挥重要的生态作用。
微生物群落之间复杂的多边相互作用影响植物微生物组组成的多样性和复杂性[45]。Agler等在对拟南芥叶际微生物群落的研究认为,非生物因素和寄主基因型特征直接作用于核心微生物,通过微生物间的互作将影响传递到整个微生物群落。如白锈菌属(Albugo)的存在降低了群落α多样性,而酵母真菌Dioszegia以拮抗作用影响植物中的其他微生物[9]。Durán等在拟南芥根际微生物群落的研究中发现,根际细菌和真菌成员之间存在负相关关系,利用无菌拟南芥进行微生物的重组实验后发现,根际微生物在没有细菌的情况下,真菌群落对植物健康和生存产生不利影响,因此认为细菌在塑造真菌群落结构时有助于植物抵抗真菌,两者间的互作有利于拟南芥生存,健康的植物生长需要跨界的微生物群落平衡[10]。拟南芥叶际和根际微生物的研究表明,微生物互作对植物生长和防止微生物病原体的侵害等具有重要意义,但对于植物中内生微生物间的相互作用对寄主植物存活和维持寄主中微生物菌群平衡的研究很少受到关注。本研究基于冰川棘豆内生细菌和内生真菌核心菌群共同构建的相关性网络,发现冰川棘豆内生菌均具有较强的凝聚性和模块化特征,在内生真菌中表现得更为明显,而内生细菌网络平均度相对更高,具有更为复杂的互作关系,其核心菌群相对集中且互作关系更为紧密。就整体而言,与拟南芥根际细菌与真菌之间存在的显著性负相关关系不同,冰川棘豆内生细菌与内生真菌的互作以协同作用为主,这可能是物种和组织材料的差异所致,但不排除是因为植物在青藏高原恶劣的环境下其内生微生物间可能选择更趋向于互利共生的协作模式。此外,冰川棘豆中内生细菌与内生真菌菌属间的互作程度要高于内生真菌内部间的互作,但低于内生细菌内部的互作,而核心菌属相关的互作关系在全部的互作网络中占比不足15%,可能与拟南芥根际中细菌有助于真菌群落结构塑造来抵抗植物病原真菌的结论[10]相似,提示冰川棘豆内生细菌在互作网络中作用更为广泛,而核心菌群则主要通过间接性的互作方式将影响传递到微生物群落。
冰川棘豆中与苦马豆素代谢相关的Alternaria、Brevundimonas核心内生菌属在互作网络中存在间接的显著性相关关系,协同与拮抗作用在两者的互作网络中同时存在,一方面可能在苦马豆素处于低浓度时,冰川棘豆在接收到宿主植物的某些调控信号时诱导产苦马豆素内生真菌Alternaria丰度上调,并启动协同互作路径,促使内生细菌Brevundimonas丰度升高降解苦马豆素;而另一方面可能是苦马豆素浓度累计达到一定阈值时,Alternaria受信号调控丰度继续增加,但负相关互作路径被激活,并促使中间菌属发挥间接抑制作用使Brevundimonas丰度降低。此外,本课题组的研究发现,Brevundimonas丰度与空气CO2浓度具有显著性负相关关系[46]。同时结合瓦里关全球大气本底站检测数据发现,青藏高原CO2浓度一般在7、8月份最低,9月份开始有所升高,冬季受人类采暖影响达到一年中最高值[47]。综合来看,冰川棘豆中苦马豆素含量在6-9月份的花果期达到最高[48]的原因可能是冰川棘豆成熟期苦马豆素受到寄主和环境的双重影响。6-8月份冰川棘豆苦马豆素的调控受到寄主内部相关基因(如开花等基因)的调控,目标菌属间的协同和拮抗共同作用使苦马豆素含量增加。9月份随着寄主植物进入果期,相关调控信号减弱Brevundimonas的调控受到大气CO2浓度升高的环境影响,最终实现苦马豆素的累积。但上述可能性的假设仍有待进一步对不同时期的冰川棘豆内生菌菌群结构进行分析验证。
综上所述,冰川棘豆中内生菌菌群间以协同作用为主,核心内生细菌连接的紧密性和内生真菌相对较高的模块化菌群特征,为冰川棘豆生命活动和内生菌功能的实现和调控提供了可能,并通过间接性的互作方式将其重要的生态功能传递到整个微生物群落中。
| [1] |
Lemanceau P, Blouin M, Muller D, et al. Let the core microbiota be functional[J]. Trends in Plant Science, 2017, 22(7): 583-595. DOI:10.1016/j.tplants.2017.04.008 |
| [2] |
Zarraonaindia I, Owens SM, Weisenhorn P, et al. The soil microbiome influences grapevine-associated microbiota[J]. mBio, 2015, 6(2): e02527-14. DOI:10.1128/mBio.02527-14 |
| [3] |
Mendes R, Garbeva P, Raaijmakers JM. The rhizosphere microbiome: significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms[J]. FEMS Microbiology Reviews, 2013, 37(5): 634-663. DOI:10.1111/1574-6976.12028 |
| [4] |
Ji P, Parks J, Edwards MA, et al. Impact of water chemistry, pipe material and stagnation on the building plumbing microbiome[J]. PLoS One, 2015, 10(10): e0141087. DOI:10.1371/journal.pone.0141087 |
| [5] |
Hamonts K, Trivedi P, Garg A, et al. Field study reveals core plant microbiota and relative importance of their drivers[J]. Environmental Microbiology, 2018, 20(1): 124-140. DOI:10.1111/1462-2920.14031 |
| [6] |
Dong CB, Zhang ZY, Han YF, et al. Research and application prospects of core microbiome[J]. Mycosystema, 2019, 38(1): 1-10. (in Chinese) 董醇波, 张芝元, 韩燕峰, 等. 核心微生物组的研究及利用现状[J]. 菌物学报, 2019, 38(1): 1-10. |
| [7] |
Rakoff-Nahoum S, Foster KR, Comstock LE. The evolution of cooperation within the gut microbiota[J]. Nature, 2016, 533(7602): 255-259. DOI:10.1038/nature17626 |
| [8] |
Oh J, Byrd AL, Park M, et al. Temporal stability of the human skin microbiome[J]. Cell, 2016, 165(4): 854-866. DOI:10.1016/j.cell.2016.04.008 |
| [9] |
Agler MT, Ruhe J, Kroll S, et al. Microbial hub taxa link host and abiotic factors to plant microbiome variation[J]. PLoS Biology, 2016, 14(1): e1002352. DOI:10.1371/journal.pbio.1002352 |
| [10] |
Durán P, Thiergart T, Garrido-Oter R, et al. Microbial interkingdom interactions in roots promote Arabidopsis survival[J]. Cell, 2018, 175(4): 973-983. DOI:10.1016/j.cell.2018.10.020 |
| [11] |
Zhang TC, Qiao Q, Zhong Y. Current status and prospect of biological resources development in Qinghai-Tibet plateau[J]. Chinese Bulletin of Life Sciences, 2013, 25(5): 446-450. (in Chinese) 张体操, 乔琴, 钟扬. 青藏高原生物资源开发的现状与前景[J]. 生命科学, 2013, 25(5): 446-450. |
| [12] |
Bao GS, Li CJ. Isolation and identification of endophytes infecting Stipa purpurea, a dominant grass in meadows of the Qinghai-Tibet plateau[J]. Acta Prataculturae Sinica, 2016, 25(3): 32-42. (in Chinese) 鲍根生, 李春杰. 青藏高原高寒草地优势禾草-紫花针茅内生真菌分离和鉴定[J]. 草业学报, 2016, 25(3): 32-42. |
| [13] |
Zheng H. The effect of UV-B radiation on the endophytic bacteria in plants of Qinghai-Tibet plateau[D]. Lanzhou: Master's Thesis of Lanzhou University, 2009 (in Chinese) 郑红.紫外辐射对青藏高原植物内生细菌多样性的影响[D].兰州: 兰州大学硕士学位论文, 2009 http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1516143 |
| [14] |
Zhang AM, Han XY, Zhang SH, et al. Diversity of root nodule endophytic bacteria in Hippophae thibetana at different altitudes in Gannan area[J]. Biotic Resources, 2018, 40(2): 114-119. (in Chinese) 张爱梅, 韩雪英, 张世虎, 等. 甘南高寒地区不同海拔西藏沙棘根瘤内生菌多样性[J]. 生物资源, 2018, 40(2): 114-119. |
| [15] |
Jiang ZH, Zhou H, Zhang DG, et al. Diversity of endophytic fungi of Oxytropis ochrocephala in different altitude gradients on the Qinghai-Tibetan plateau[J]. Acta Agrestia Sinica, 2019, 27(6): 1526-1536. (in Chinese) 姜哲浩, 周恒, 张德罡, 等. 青藏高原不同海拔梯度黄花棘豆内生真菌多样性研究[J]. 草地学报, 2019, 27(6): 1526-1536. |
| [16] |
Wu ZY. Flora of Tibet (Volume Ⅱ)[M]. Beijing: Science Press, 1985: 855-856. (in Chinese) 吴征镒. 西藏植物志(第二卷)[M]. 北京: 科学出版社, 1985: 855-856. |
| [17] |
Gao XL, Han B, Zhao ML, et al. Locoweed and advances in research on toxic components[J]. Acta Prataculturae Sinica, 2011, 20(3): 279-286. (in Chinese) 高新磊, 韩冰, 赵萌莉, 等. 疯草及毒性成分研究进展[J]. 草业学报, 2011, 20(3): 279-286. |
| [18] |
Wang BH, Ciren DJ, Wang JL, et al. Research progress of locoweed in Tibet[J]. Grassland and Turf, 2009(4): 81-86. (in Chinese) 王保海, 次仁多吉, 王敬龙, 等. 西藏疯草研究进展[J]. 草原与草坪, 2009(4): 81-86. |
| [19] |
Wang YM, Han GD, Zhao ML. Prospects and research progress in locoweed-fungal endophyte symbiont[J]. Chinese Journal of Grassland, 2007, 29(4): 99-103. (in Chinese) 王雨梅, 韩国栋, 赵萌莉. 疯草-内生真菌共生体的研究与展望[J]. 中国草地学报, 2007, 29(4): 99-103. |
| [20] |
Yu YT, Wang JH, Wang Y, et al. Identification of swainsonine-producing fungal endophytes from three species of locoweeds in Tibet[J]. Scientia Agricultura Sinica, 2009, 42(10): 3662-3671. (in Chinese) 余永涛, 王建华, 王妍, 等. 西藏3种疯草中合成苦马豆素内生真菌的鉴定[J]. 中国农业科学, 2009, 42(10): 3662-3671. |
| [21] |
Tan YY, Wang JH, Li QF, et al. Extraction and separation of alkaloids from glacial crazyweed (Oxytropis glacialis)[J]. Acta Veterinaria et Zootechnica Sinica, 2002, 33(4): 352-355. (in Chinese) 谭远友, 王建华, 李勤凡, 等. 冰川棘豆生物碱的提取分离[J]. 畜牧兽医学报, 2002, 33(4): 352-355. |
| [22] |
Woudenberg JHC, Groenewald JZ, Binder M, et al. Alternaria redefined[J]. Studies in Mycology, 2013, 75: 171-212. DOI:10.3114/sim0015 |
| [23] |
Wang ZG, Cao S, Xu N, et al. Cultural characteristics of fungal endophyte from 3 locoweed species in China[J]. Acta Prataculturae Sinica, 2017, 26(10): 158-169. (in Chinese) 汪治刚, 曹师, 徐娜, 等. 我国3种疯草的内生真菌培养特性研究[J]. 草业学报, 2017, 26(10): 158-169. |
| [24] |
Lu P. Studies on correlated factors to swainsonine in three Oxytropis species in Inner Mongolia[D]. Hohhot: Doctoral Dissertation of Inner Mongolia Agricultural University, 2007 (in Chinese) 卢萍.内蒙古三种棘豆属植物中苦马豆素相关因子的研究[D].呼和浩特: 内蒙古农业大学博士学位论文, 2007 http://d.wanfangdata.com.cn/Thesis/Y1138179 |
| [25] |
Lu P, Zhao ML, Han GD, et al. The locoweed in Inner Mongolia and research progress[J]. Chinese Journal of Grassland, 2006, 28(1): 63-68. (in Chinese) 卢萍, 赵萌莉, 韩国栋, 等. 内蒙古疯草及其研究进展[J]. 中国草地学报, 2006, 28(1): 63-68. |
| [26] |
Cui Z. Study on the corresponding relationship of locoweed and locoweed endophyte population[D]. Lanzhou: Master's Thesis of Lanzhou University, 2015 (in Chinese) 崔振.疯草与疯草内生真菌类群对应关系研究[D].兰州: 兰州大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10730-1015347441.htm |
| [27] |
Yu YT. Isolation, identification and genetic polymorphism of swainsonine-producing fungal endophytes form locoweeds in China[D]. Yangling: Doctoral Dissertation of Northwest A & F University, 2009 (in Chinese) 余永涛.产苦马豆素疯草内生真菌的分离鉴定及其遗传多态性研究[D].杨凌: 西北农林科技大学博士学位论文, 2009 http://d.wanfangdata.com.cn/Conference/7385084 |
| [28] |
Zhao XH. Isolation and identification of swainsonine degrading bacteria and degradation character[D]. Yangling: Doctoral Dissertation of Northwest A & F University, 2008 (in Chinese) 赵兴华.苦马豆素降解菌分离、鉴定与特性研究[D].杨凌: 西北农林科技大学博士学位论文, 2008 http://cdmd.cnki.com.cn/Article/CDMD-10712-2008102472.htm |
| [29] |
Wang JH, Zhao XH, Geng GX. Spherosinin degradation phage wheat germ oligotrophy unit cell bacterium YLZZ-2 and separation process thereof: CN, 200710018722.X[P]. 2008-07-16 (in Chinese) 王建华, 赵兴华, 耿果霞.一种苦马豆素降解菌嗜麦芽寡养单胞菌YLZZ-2及其分离方法: 中国, 200710018722.X[P]. 2008-07-16 |
| [30] |
Hu YC, Liu P, Zhao CR, et al. Screening and identification of endophytic bacteria of Oxytropis kansuensis Bunge for swainsonine degradation[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2011, 37(5): 521-526. (in Chinese) 胡延春, 刘鹏, 赵春蕊, 等. 甘肃棘豆中降解苦马豆素内生细菌的筛选与鉴定[J]. 浙江大学学报:农业与生命科学版, 2011, 37(5): 521-526. |
| [31] |
Natural Resources Department of Tibet Autonomous Region. Overview of land resources in Tibet Autonomous Region[EB/OL]. (2018-12-03)[2020-03-24]. http://www.xzgtt.gov.cn/zygk/201008/t20100805_731612.htm (in Chinese) 西藏自治区自然资源厅.西藏自治区土地资源概况[EB/OL]. (2018-12-03)[2020-03-24]. http://www.xzgtt.gov.cn/zygk/201008/t20100805_731612.htm |
| [32] |
Wang JL, Wang BH, Ciren DJ, et al. Research progress on the distribution of main poisonous plants on Qinghai-Tibetan Plateau[J]. Grassland and Turf, 2015, 35(3): 67-71, 77. (in Chinese) 王敬龙, 王保海, 次仁多吉, 等. 西藏草地有毒植物分布调查[J]. 草原与草坪, 2015, 35(3): 67-71, 77. |
| [33] |
Beckers B, de Beeck MO, Thijs S, et al. Performance of 16S rDNA primer pairs in the study of rhizosphere and endosphere bacterial microbiomes in metabarcoding studies[J]. Frontiers in Microbiology, 2016, 7: 650. |
| [34] |
Blaalid R, Kumar S, Nilsson RH, et al. ITS1 versus ITS2 as DNA metabarcodes for fungi[J]. Molecular Ecology Resources, 2013, 13(2): 218-224. |
| [35] |
Wang P, Wu Q, Xu Y. Core microbiota in Chinese liquor fermentation and associations with environmental factors[J]. Acta Microbiologica Sinica, 2018, 58(1): 142-153. (in Chinese) 王鹏, 吴群, 徐岩. 中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J]. 微生物学报, 2018, 58(1): 142-153. |
| [36] |
Wang ZM, Lu ZM, Shi JS, et al. Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J]. Scientific Reports, 2016, 6(1): 26818. |
| [37] |
Hu XL, Du H, Ren C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2506-2515. |
| [38] |
Barberán A, Bates ST, Casamayor EO, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities[J]. The ISME Journal, 2012, 6(2): 343-351. |
| [39] |
Rui JP, Li JB, Zhang SH, et al. The core populations and co-occurrence patterns of prokaryotic communities in household biogas digesters[J]. Biotechnology for Biofuels, 2015, 8(1): 158. |
| [40] |
Shade A, Handelsman J. Beyond the Venn diagram: the hunt for a core microbiome[J]. Environmental Microbiology, 2012, 14(1): 4-12. |
| [41] |
Bastian M, Heymann S, Jacomy M. Gephi: an open source software for exploring and manipulating networks[A]. Proceedings of the Third International Conference on Weblogs and Social Media[C]. San Jose, 2009
|
| [42] |
Newman MEJ. Modularity and community structure in networks[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(23): 8577-8582. |
| [43] |
Segata N, Baldini F, Pompon J, et al. The reproductive tracts of two malaria vectors are populated by a core microbiome and by gender- and swarm-enriched microbial biomarkers[J]. Scientific Reports, 2016, 6(1): 24207. |
| [44] |
Busby PE, Peay KG, Newcombe G. Common foliar fungi of Populus trichocarpa modify Melampsora rust disease severity[J]. New Phytologist, 2016, 209(4): 1681-1692. |
| [45] |
Rodriguez PA, Rothballer M, Chowdhury SP, et al. Systems biology of plant-microbiome interactions[J]. Molecular Plant, 2019, 12(6): 804-821. |
| [46] |
Xu GQ, Liu YX, Cao PX, et al. Study on endophyte diversity of Oxytropis glacialis in different ecological environments in Qinghai-Tibet Plateau[J]. Plateau Science Research, 2020, 4(1): 20-29. (in Chinese) 许国琪, 刘怡萱, 曹鹏熙, 等. 青藏高原不同生态环境下冰川棘豆(Oxytropis glacialis)内生细菌多样性研究[J]. 高原科学研究, 2020, 4(1): 20-29. |
| [47] |
China Meteorological Administration. Carbon dioxide concentration in the atmosphere of the Qinghai-Tibet plateau has increased by nearly 10% in 20 years[EB/OL]. (2014-01-14)[2020-03-24]. http://www.cma.gov.cn/2011xwzx/2011xqhbh/2011xdtxx/201401/t20140114_236191.html (in Chinese) 中国气象局.青藏高原大气中二氧化碳浓度20年增长近10%[EB/OL]. (2014-01-14)[2020-03-24]. http://www.cma.gov.cn/2011xwzx/2011xqhbh/2011xdtxx/201401/t20140114_236191.html |
| [48] |
Zhao BY, Wang BH, Mo CH, et al. The disaster survey of the Oxytropis glacialis poisoning in livestock in the Ngari of Tibet[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2011, 20(4): 40-46. (in Chinese) 赵宝玉, 王保海, 莫重辉, 等. 西藏阿里地区牲畜冰川棘豆中毒灾害状况调查[J]. 西北农业学报, 2011, 20(4): 40-46. |
 2020, Vol. 47
2020, Vol. 47