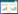扩展功能
文章信息
- 刘洪艳, 刘淼, 袁媛
- LIU Hong-Yan, LIU Miao, YUAN Yuan
- 海洋沉积物中铁还原细菌组成及异化铁还原与产氢性质分析
- Composition of Fe(Ⅲ)-reducing bacteria from marine sediments and characteristics of dissimilatory iron reduction coupled to hydrogen production
- 微生物学通报, 2020, 47(9): 2711-2719
- Microbiology China, 2020, 47(9): 2711-2719
- DOI: 10.13344/j.microbiol.china.200669
-
文章历史
- 收稿日期: 2020-07-01
- 接受日期: 2020-08-04
- 网络首发日期: 2020-08-28
微生物厌氧发酵过程需要电子受体接受代谢反应过程产生的还原力,因电子受体不同而产生不一样的中间代谢产物,如氢气、乙醇、丙酸、丁醇等[1-4]。当电子受体为质子时,微生物厌氧发酵形成的还原力产生氢气,此过程称作生物制氢。在能源短缺和环境污染的背景下,生物制氢的重要性不言而喻。生物制氢包括光合生物制氢和厌氧发酵细菌制氢两种方式,其中厌氧发酵细菌制氢不需光照、稳定性强,而且能够在制氢的同时参与有机废水(渣)等废弃物处理,具有更广阔的应用前景[5-6]。然而,目前厌氧发酵细菌制氢的主要问题是产氢能力不高,限制了其规模化应用[7-8]。生物制氢近百年的研究历史一直在探讨如何提高菌株的产氢能力。特别是近年来关于产氢菌株代谢途径的改造,目的是通过特殊的代谢通路向电子受体质子转移还原力,产生更多氢气[9-10]。
当厌氧培养体系存在外源电子受体Fe(Ⅲ).时,微生物代谢产生还原力传递给外源电子受体Fe(Ⅲ),而Fe(Ⅲ)接受电子后被还原为Fe(Ⅱ),此过程称作微生物异化铁还原。由于自然环境中Fe(Ⅲ)常以难溶的铁氧化物形式存在,微生物介导的异化铁还原过程能够转变不溶性Fe(Ⅲ)形成可溶性Fe(Ⅱ),从而影响铁元素的价态,是自然界中Fe(Ⅲ)氧化物还原的主要途径[11]。在异化还原Fe(Ⅲ)过程中,异化铁还原微生物还能同时利用不同形式的电子受体,实现多种重金属元素的价态转化,如:Cr(Ⅵ)还原为Cr(Ⅲ)[12],U(Ⅵ)转化成为毒性较小U(Ⅳ)[13],V(Ⅴ)以及Hg分别转化V(Ⅳ)[14]以及MeHg[15]。由此可见,微生物异化铁还原在重金属污染的生物修复研究领域具有广阔的应用前景。
微生物制氢和异化铁还原在开发新能源与治理重金属污染方面具有各自明显的优势。已报道的厌氧发酵产氢细菌多集中于梭菌属,这与梭菌底物利用广以及产氢量高有关。研究发现,有些梭菌属菌株同时具有异化铁还原能力,如Clostridium beijerinckii[16]、Clostridium butyricum[17]和Clostridium sporogenes[18]等。Liu等[19]从产氢菌株BH18的转座子突变库中筛选到一株同时产氢与异化铁还原的转座子突变菌株TB222。研究表明,在水稻土培养环境中添加外源电子受体磁铁矿,发酵型异化铁还原菌能够同时产生氢气与含Fe(Ⅱ)的蓝铁矿[20]。特别是从自然环境中分离的Clostridium bifermentans EZ-1菌株,为研究异化铁还原细菌同时产氢与异化铁还原过程提供了更丰富的微生物种质资源[21]。
本文以分离自海洋沉积物中的一组异化铁还原菌群为研究对象,通过测定混合菌群厌氧培养条件下生长曲线及异化铁还原能力,并结合高通量测序数据分析异化铁还原细菌种属特征。实验以不溶性Fe(Ⅲ)为电子受体,优化不同电子供体培养条件,分析异化铁还原菌群同时异化铁还原及产氢的性质,为研究同时具备产氢与异化铁还原性质的发酵型异化铁还原细菌提供新的选择。
1 材料与方法 1.1 主要试剂和仪器及培养基邻菲啰啉,天津市风船化学试剂科技有限公司;溶菌酶,北京索莱宝科技有限公司;胰蛋白胨和酵母提取物,赛默飞世尔科技有限公司。pH计,上海精密仪器厂;分光光度计,上海光谱仪器有限公司;气相色谱仪,安捷伦公司。
培养基(g/L):葡萄糖20.0,胰蛋白胨1.0,酵母提取物2.0,氯化钠4.0,氯化镁0.1,L-半胱氨酸0.5,磷酸氢二钾1.5,氢氧化铁悬浮液1.0 mL,pH 7.00±0.20。
1.2 富集与培养称取10 g海洋沉积物底泥(渤海海域,116°E,38°N)添加到150 mL厌氧瓶(含培养基100 mL)。电子受体氢氧化铁的配制:16.23 g三氯化铁溶于666 mL去离子水中,pH值控制在7.00-7.50,不停搅拌直至得到悬浮状氢氧化铁。悬液静置24 h,倒掉上清液,用去离子水反复洗涤3遍。向厌氧瓶充氮气5 min,置于30 ℃、100 r/min培养72 h。培养结束时,取1 mL细菌富集发酵液接种到100 mL新鲜培养基,按上述厌氧条件培养72 h,重复富集培养3次。
1.3 菌群组成分析富集培养结束,提取菌群基因组DNA。首先,采用低速离心(1 000 r/min,30 s)去除菌液中不溶性氢氧化铁;接着5 000 r/min离心5 min收集菌体,TE缓冲液重复洗涤2次;然后,菌体分别在溶菌酶、蛋白酶K以及SDS作用下直至反应液体澄清,细菌细胞完成裂解;最后,经酚:氯仿:异戊醇(25:24:1,体积比)反复抽提3次,预冷无水乙醇沉淀DNA。以提取的DNA为模板,PCR扩增细菌16S rRNA基因V4区,通用引物为515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系(30 μL):Phusion MasterMix 15 μL,515F引物(6 μmol/L) 1.5 μL,806R引物(6 μmol/L) 1.5 μL,DNA模板(1 ng/μL) 10 μL,ddH2O 2.0 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 10 s,55 ℃ 45 s,72 ℃ 1 min,25个循环;72 ℃ 10 min。
采用Qubit和Q-PCR构建DNA文库。文库合格,基于Illumina HiSeq测序平台进行高通量测序。数据处理首先通过FLASH软件对测序序列进行双端融合,得到拼接序列,依据质量控制标准过滤低质量序列,测序数据通过拼接过滤,获取有效数据[22]。接着采用UPARSE软件(UPARSE V7.0.1001)将有效序列按照相似性为97%的阈值进行操作分类单元(operational taxonomic units,OTU)聚类。随之采用Mothur方法将OTU代表序列与SSUrRNA数据库进行比对(设定阈值为0.8-1.0)[23],在门、纲、目、科和属水平上开展物种注释。测序由北京诺禾致源生物信息科技有限公司完成。
1.4 菌群异化铁还原在氢氧化铁(人工合成)为电子受体的异化铁还原培养体系中,分析电子供体对异化铁还原菌群生长及铁还原性质的影响。电子供体分别为蔗糖、葡萄糖、丙酮酸钠、乳酸钠、乙酸钠和甲酸钠,以葡萄糖(20 g/L)为固定含碳量标准,其他碳源按等摩尔碳换算。富集活化的混合菌群按1%接种于不同电子供体的培养基中,测定混合菌群细胞生长量OD600,以及培养液累积产生的Fe(Ⅱ)浓度,分析菌群异化铁还原能力。每组实验至少重复3次。
1.5 菌群厌氧发酵产氢在氢氧化铁为电子受体,蔗糖、葡萄糖、丙酮酸钠、乳酸钠、乙酸钠和甲酸钠分别为电子供体异化铁还原培养体系中,厌氧培养混合菌群,通过测定发酵液pH值及累积产氢量,分析电子供体对混合菌群厌氧发酵产氢性质的影响。每组设置3个重复样。
1.6 测定方法通过测定培养液在600 nm的吸收值表示菌群细胞生长量。采用pH计测定pH值。细菌异化还原Fe(Ⅲ)能力通过培养液中产生的Fe(Ⅱ)浓度表示。邻菲啰啉分光光度法测定培养液中Fe(Ⅱ)浓度的具体步骤参考文献[24],1 mL细菌培养液与1 mL邻菲罗啉溶液(0.1%)和1 mL乙酸乙酸钠溶液(pH 4.60)混合,蒸馏水定容至10 mL,静置10 min,利用分光光度计测定反应液于510 nm处吸光值,绘制Fe(Ⅱ)标准曲线并计算Fe(Ⅱ)浓度。利用排水法收集气体,具体步骤是:将导气管两端分别连接厌氧瓶和集气瓶,集气瓶预先装满水,菌群产生的气体经导气管进入集气瓶,利用排出水的体积表示气体量,利用气相色谱法分析气体中氢气含量,产氢量=气体量×氢气含量。气相色谱分析条件如下:柱长为2 m,填料为分子筛(60/80目),载气是氮气,流速30 mL/min;检测器为TCD,检测器温度,进样器温度和柱温分别200、250和40 ℃。
2 结果与分析 2.1 菌群生长曲线分析厌氧培养混合菌群过程中,间隔12 h测定细菌生长指标OD600、培养液pH以及培养液Fe(Ⅱ)浓度。从图 1可以看出,混合菌群细胞生长和异化铁还原性质呈现较明显规律。随着培养时间的延长,混合菌群细胞累积生长量不断增加,至培养48 h时,细胞密度OD600达到最高,为0.80±0.04。这表明混合菌群在异化铁还原培养体系中能够良好生长。菌群细胞生长过程中,培养液pH值表现出明显下降变化。在培养24 h时,pH值开始下降,由起始值7.00下降到5.45;至培养36 h时,pH值已经下降至4.45。在Fe(OH)3为电子受体的异化铁培养体系中,培养24 h时,培养液开始明显累积产生Fe(Ⅱ),浓度为12.70±2.45 mg/L;至培养48 h时,Fe(Ⅱ)浓度达到59.34±6.72 mg/L。表明混合菌群具有异化铁还原能力。
|
| 图 1 异化铁培养条件下混合菌群细胞生长曲线 Figure 1 The cell growth of the mixed culture under Fe(Ⅲ)-reducing condition |
|
|
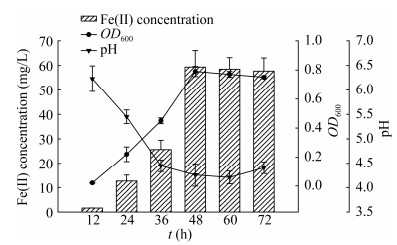
根据高通量测序数据分析厌氧培养条件下混合菌群的优势菌组成,结果见图 2。混合菌群优势菌在门水平上都归属为厚壁菌门(Firmicutes)。相关研究[25-26]发现,Firmicutes是大多数海洋沉积物中优势菌群,是参与Fe(Ⅲ)还原的主要菌种。具体在属水平,绝对优势菌属Clostridium占88.59%,次优势菌属Sporolactobacillus占9.17%。在种水平上,丁酸梭菌Clostridium butyricum占50.15%,是异化铁还原培养体系中混合菌群的主要菌种。
|
| 图 2 异化铁还原培养下菌群在属和种水平上的分类组成 Figure 2 Bacterial community compositions of the mixed cultures at genus and specis levels 注:A:属水平;B:种水平. Note: A: Genus level; B: Specis level. |
|
|
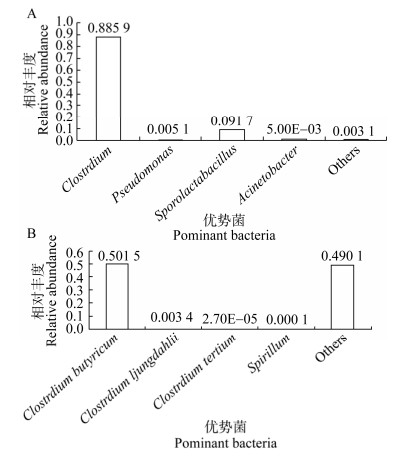
电子供体,如蔗糖、葡萄糖、丙酮酸钠、乳酸钠、乙酸钠和甲酸钠对异化铁还原混合菌群细胞生长和异化Fe(Ⅲ)还原性质的影响见图 3。在氢氧化铁为电子受体培养条件下,电子供体的种类影响菌群细胞生长。丙酮酸钠为电子供体时,异化铁还原菌群能够进行细胞生长,细胞密度OD600达到最高,为0.98±0.03。葡萄糖为电子供体时,异化铁还原菌群生长累积细胞密度OD600是0.77±0.04。在设置的6种电子供体中,甲酸钠为电子供体时,混合菌群生长的效率最低。这可能是由于甲酸钠的分子结构简单,很难再被发酵型异化铁还原细菌厌氧发酵利用。电子供体种类对异化铁还原菌群Fe(Ⅲ)还原的影响具有显著差异(P < 0.01)。葡萄糖和丙酮酸钠为电子供体,异化铁还原菌群培养液中积累Fe(Ⅱ)浓度分别是59.34±6.73 mg/L和51.28±3.31 mg/L,显著高于其他电子供体组(P < 0.01),葡萄糖和丙酮酸钠电子供体组之间没有显著差异(P > 0.05)。表明异化铁还原细菌能够以葡萄糖和丙酮酸钠为电子供体进行异化Fe(Ⅲ)还原,实验结果与He等[27]研究结果相一致。乳酸钠和乙酸钠为电子供体,菌群异化还原铁积累Fe(Ⅱ)浓度分别为12.11±4.21 mg/L和11.50±1.61 mg/L,显著低于其他电子供体组(P < 0.01),乳酸钠和乙酸钠电子供体组之间没有显著差异(P > 0.05)。在设置的6种电子供体中,以发酵型异化铁还原细菌梭菌为优势菌的混合菌群无法利用甲酸钠作为电子供体进行异化Fe(Ⅲ)还原,同时以乳酸钠和乙酸钠电子供体异化铁还原效率比较低。然而呼吸型异化铁还原细菌Shewanella putrefaciens能够氧化甲酸和乳酸等多种有机酸还原Fe(Ⅲ)[26]。
|
| 图 3 电子供体对菌群细胞生长及异化铁还原性质的影响 Figure 3 The effects of electron donor on cell growth and Fe(Ⅲ) reduction by the mixed culture 注:不同小写字母表示存在显著性差异(P < 0.05). Note: Lowercase letters indicate different significance at 0.05 level. |
|
|
探讨电子供体对细菌厌氧发酵产氢的影响有助于分析细菌转移电子发酵产氢的能力。从图 4可以看出,蔗糖、葡萄糖和丙酮酸钠为电子供体时,菌群发酵液的终pH值相比起始pH值都有不同程度下降,混合菌群能够分别利用这3种电子供体进行发酵产氢;葡萄糖为电子供体时,混合菌群产氢量最高,达到629.70±11.42 mL/L,同时其培养体系终pH值最低,只有4.26;丙酮酸钠和蔗糖为电子供体时,混合菌群产氢量分别是331.70±7.56 mL/L和318.40±2.13 mL/L。显著性分析结果是,葡萄糖电子供体组极显著高于丙酮酸钠和蔗糖电子供体组(P < 0.01),丙酮酸钠和蔗糖电子供体组之间存在显著差异(P < 0.05)。混合菌群在以乳酸钠、乙酸钠和甲酸钠为电子供体时都无法厌氧发酵产生氢气,培养液pH值没有出现下降。
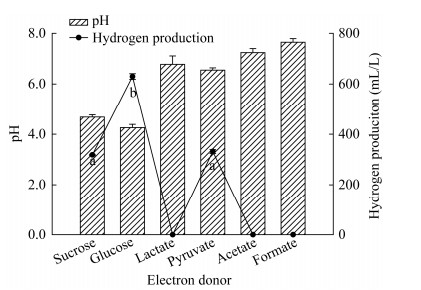
|
| 图 4 电子供体对菌群产氢量及发酵液终pH值的影响 Figure 4 The effects of electron donor on hydrogen production and final pH by the mixed culture 注:不同字母表示存在显著性差异(P < 0.05). Note: Lowercase letters indicate different significance at 0.05 level. |
|
|
相关研究表明,异化铁还原细菌根据能量产生来源不同,一般分为呼吸型异化铁还原菌和发酵型异化铁还原细菌,前者直接利用Fe(Ⅲ)作为电子受体产生能量,以地杆菌(Geobacter)和希瓦氏(Shewanella)为代表,研究领域集中于胞外电子传递机制,已经取得了重大进展[28-29]。后者通过发酵底物产生能量进行异化铁还原过程。发酵型异化铁还原菌发酵底物糖类或者蛋白胨并产生乙酸、乙醇、氢气等发酵产物的过程中,大量的电子储存于发酵代谢产物,而同时胞外电子受体Fe(Ⅲ)能够接收电子还原成Fe(Ⅱ)。目前,以梭菌(Clostridium)为代表的发酵型异化铁还原细菌,因代谢产物复杂其研究才刚刚起步[21, 30]。本实验中通过人工合成Fe(OH)3模拟自然环境中难溶态Fe(Ⅲ),其异化铁还原培养体系有利于富集发酵型细菌梭菌。同样地,Yi等[31]研究发现水稻土富集培养体系中异化铁还原微生物的优势种群是具有发酵功能的梭菌(Clostridium)。
混合菌群异化铁还原累积Fe(Ⅱ)浓度在葡萄糖和丙酮酸钠电子供体组之间没有显著差异(P > 0.05),这表明混合菌群能够有效利用这两种电子供体进行细胞生长。童磊等[32]研究发现一株异化铁还原细菌能够利用葡萄糖和丙酮酸钠为电子供体进行Fe(Ⅲ)还原,葡萄糖电子供体组产生Fe(Ⅱ)浓度是丙酮酸组电子供体组Fe(Ⅱ)浓度的1.36倍;实验结果表明分离自海洋沉积物的混合菌群利用电子供体乳酸钠和乙酸钠进行的异化铁还原过程比较微弱,显著低于其他电子供体组(P < 0.01)。关舒元等[33]研究发现分离自水稻土壤中的菌株Clostridium butyricum P4利用乳酸盐和乙酸盐为电子供体还原Fe(Ⅲ)的还原率要低于10%,而葡萄糖电子供体下,其Fe(Ⅲ)还原率是63.79%。
葡萄糖和丙酮酸钠电子供体组相比较,混合菌群厌氧发酵产氢量在葡萄糖电子供体组要显著高于丙酮酸钠电子供体组。厌氧培养条件下,细菌发酵葡萄糖过程产生氢气的同时会累积乙酸、丁酸、丙酸、乳酸等酸类物质[34-35],导致细菌厌氧发酵培养液pH值下降至4.00-5.00。然而细菌发酵产氢一般在酸性条件下进行,pH降低幅度间接表示厌氧发酵程度。游萍等研究发现培养体系pH值降至最低时,发酵产氢型Fe(Ⅲ)还原菌JX1-25产氢速率达到最大[36]。厌氧混合菌群不能利用乳酸钠、乙酸钠和甲酸钠产生氢气,培养液pH值相比起始值几乎没有变化。由此可见,发酵型异化铁还原细菌梭菌很难利用乳酸钠、乙酸钠和甲酸钠作为电子供体进行异化铁还原及产氢。
研究发现,一些梭菌能够利用不溶性Fe(Ⅲ)作为电子受体进行异化铁还原,同时结合生物产氢实现生物能源的开发,被应用于可再生新能源的生产。菌株Clostridium butyricum以氧化铁为电子受体,以葡萄糖为电子供体,其异化铁还原过程累积产氢量可达2.20 mol/mol葡萄糖[37]。同样地,梭菌Clostridium bifermentans EZ-1具有同时异化铁还原与产氢性质,利用柠檬酸铁为电子受体、葡萄糖为电子供体,累积产氢量为1.14 mol-H2/mol葡萄糖[21]。梭菌Clostridium saccarobutylicum BS2以氢氧化铁为电子受体、以葡萄糖为电子供体的异化铁还原过程累积产生氢气量为0.38 mol/mol葡萄糖[38]。在异化铁培养体系中,发酵型异化铁还原细菌梭菌表现出同时产氢与异化铁还原能力,这为利用微生物代谢过程还原力解决生物制氢新能源与重金属污染问题提供了实验数据支持。本实验中富集混合菌群的优势菌属是梭菌,其不仅异化还原不溶性三价铁化合物,还可以厌氧发酵产生氢气,蔗糖、葡萄糖和丙酮酸钠可以作为电子供体促进其同时产氢与异化铁还原。然而在实践生产中,菌群如何利用复杂有机物作为电子供体以减少培养成本,需进一步研究证实。
4 结论混合菌群分离自海洋沉积物,根据混合菌群生长曲线特征和高通量测序数据分析,菌群组成的优势菌是梭菌(Clostridium),属于发酵型异化铁还原细菌。在不溶性氢氧化铁为电子受体及蔗糖、葡萄糖和丙酮酸钠分别为电子供体的异化铁还原体系中,混合菌群具有同时异化铁还原及产氢性质。特别是菌群利用葡萄糖为电子供体时,培养液累积产生可溶性Fe(Ⅱ)浓度以及累积产氢量最高,分别达到59.34±6.73 mg/L和629.70±11.42 mL/L。发酵型异化铁还原细菌能够利用不溶性Fe(Ⅲ)为电子受体进行异化铁还原与产氢,这为拓宽异化铁还原细菌在重金属去除和生物能源开发上提供了新的实验支持。
| [1] |
Wang RX, Qian CX, Yuan XM. Research advance on fermentative microorganism and efficient approaches of hydrogen production[J]. Environmental Science & Technology, 2013, 36(12): 90-99. (in Chinese) 王瑞兴, 钱春香, 袁晓明. 发酵制氢微生物与高效发酵途径的研究进展[J]. 环境科学与技术, 2013, 36(12): 90-99. |
| [2] |
Du JL, Yang Y, Tian S. Research on direct ethanol production from xylan by use of an arming yeast strain codisplaying xylanolytic enzymes on the surface of xylose-utilizing diploid Saccharomyces cerevisiae Y5 cells[J]. Acta Energiae Solaris Sinica, 2017, 38(12): 3455-3460. (in Chinese) 杜济良, 杨玥, 田沈. 二倍体酿酒酵母表面展示半纤维素酶进行木质纤维素乙醇发酵的研究[J]. 太阳能学报, 2017, 38(12): 3455-3460. |
| [3] |
Li XC, Li F, Zhang GC, et al. Biogas yield by mixed anaerobic fermentation of kelp residue and aquaculture solid waste[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(18): 228-234. (in Chinese) 李秀辰, 李丰, 张国琛, 等. 海带渣与养殖固体废弃物混合发酵产沼气试验[J]. 农业工程学报, 2018, 34(18): 228-234. |
| [4] |
Tian YH, Zhu ZH, Gao Y, et al. Optimization on fermentation conditions of butanol from sweet potato[J]. Chemistry & Bioengineering, 2016, 33(2): 64-66. (in Chinese) 田毅红, 朱志豪, 高媛, 等. 红薯发酵产丁醇的工艺优化[J]. 化学与生物工程, 2016, 33(2): 64-66. |
| [5] |
Arimi MM, Knodel J, Kiprop A, et al. Strategies for improvement of biohydrogen production from organic-rich wastewater: a review[J]. Biomass and Bioenergy, 2015, 75: 101-118. DOI:10.1016/j.biombioe.2015.02.011 |
| [6] |
Wang DB, Zeng GM, Chen YG, et al. Effect of polyhydroxyalkanoates on dark fermentative hydrogen production from waste activated sludge[J]. Water Research, 2015, 73: 311-322. DOI:10.1016/j.watres.2015.01.017 |
| [7] |
Ren NQ, Guo WQ, Liu BF. Development and application prospect of bio-hydrogen production technology[J]. Journal of Harbin Institute of Technology, 2010, 42(6): 855-863. (in Chinese) 任南琪, 郭婉茜, 刘冰峰. 生物制氢技术的发展及应用前景[J]. 哈尔滨工业大学学报, 2010, 42(6): 855-863. |
| [8] |
Kumar GR, Chowdhary N. Biotechnological and bioinformatics approaches for augmentation of biohydrogen production: a review[J]. Renewable and Sustainable Energy Reviews, 2016, 56: 1194-1206. DOI:10.1016/j.rser.2015.12.022 |
| [9] |
Sun LL, Huang AY, Gu WH, et al. Hydrogen production by Enterobacter cloacae isolated from sugar refinery sludge[J]. International Journal of Hydrogen Energy, 2015, 40(3): 1402-1407. DOI:10.1016/j.ijhydene.2014.11.121 |
| [10] |
Liu HY, Wang GC. Characteristics of hydrogen production by an aciduric transposon-mutagenized strain of Pantoea agglomerans BH18[J]. International Journal of Hydrogen Energy, 2013, 38(30): 13192-13197. DOI:10.1016/j.ijhydene.2013.07.065 |
| [11] |
Li HJ, Peng JJ. Recent advances in studies on dissimilatory Fe(Ⅲ)-reducing microorganisms[J]. Acta Ecologica Sinica, 2012, 32(5): 1633-1642. (in Chinese) 黎慧娟, 彭静静. 异化Fe(Ⅲ)还原微生物研究进展[J]. 生态学报, 2012, 32(5): 1633-1642. |
| [12] |
Liu HY, Wang S. Chromate reduction by Fe(Ⅲ)-reducing bacterium Klebsiella sp. KB52[J]. Chinese Journal of Environmental Engineering, 2019, 13(5): 1113-1118. (in Chinese) 刘洪艳, 王珊. 异化铁还原细菌Klebsiella sp. KB52还原重金属Cr(Ⅵ)[J]. 环境工程学报, 2019, 13(5): 1113-1118. |
| [13] |
Fredrickson JK, Zachara JM, Kennedy DW, et al. Reduction of U(Ⅵ) in goethite (α-FeOOH) suspensions by a dissimilatory metal-reducing bacterium[J]. Geochimica et Cosmochimica Acta, 2000, 64(18): 3085-3098. DOI:10.1016/S0016-7037(00)00397-5 |
| [14] |
Zhang J, Dong HL, Zhao LD, et al. Microbial reduction and precipitation of vanadium by mesophilic and thermophilic methanogens[J]. Chemical Geology, 2014, 370: 29-39. DOI:10.1016/j.chemgeo.2014.01.014 |
| [15] |
Si YB, Zou Y, Liu XH, et al. Mercury methylation coupled to iron reduction by dissimilatory iron-reducing bacteria[J]. Chemosphere, 2015, 122: 206-212. DOI:10.1016/j.chemosphere.2014.11.054 |
| [16] |
Dobbin PS, Carter JP, Juan CGSS, et al. Dissimilatory Fe(Ⅲ) reduction by Clostridium beijerinckii isolated from freshwater sediment using Fe(Ⅲ) maltol enrichment[J]. FEMS Microbiology Letters, 1999, 176(1): 131-138. DOI:10.1111/j.1574-6968.1999.tb13653.x |
| [17] |
Park HS, Kim BH, Kim HS, et al. A novel electrochemically active and Fe(Ⅲ)-reducing bacterium phylogenetically related to Clostridium butyricum isolated from a microbial fuel cell[J]. Anaerobe, 2001, 7(6): 297-306. DOI:10.1006/anae.2001.0399 |
| [18] |
Jiang YB, Deng H, Huang XQ, et al. Characterization of a novel electrogenic Clostridium sporogenes isolated from forest soil[J]. Acta Microbiologica Sinica, 2016, 56(5): 846-855. (in Chinese) 姜允斌, 邓欢, 黄新琦, 等. 一株土壤产电菌Clostridium sporogenes的分离及其产电性能[J]. 微生物学报, 2016, 56(5): 846-855. |
| [19] |
Liu HY, Wand GC. Microbial Fe(Ⅲ) reduction and hydrogen production by a transposon-mutagenized strain of Pantoea agglomerans BH18[J]. Energy, 2015, 81: 691-695. DOI:10.1016/j.energy.2015.01.014 |
| [20] |
Wang BC. Electrochemical activity of iron reducing bacteria and diversity of methanogens in sediments of bohai sea and its coastal rivers[D]. Yantai: Doctoral Dissertation of Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, 2019 (in Chinese) 王炳臣.渤海及其入海河流沉积物中铁还原菌电活性及产甲烷菌多样性的研究[D].烟台: 中国科学院烟台海岸带研究所博士学位论文, 2019 http://cdmd.cnki.com.cn/Article/CDMD-80180-1019909675.htm |
| [21] |
Zhang YC, Xiao LL, Wang OM, et al. Hydrogen-producing and electrochemical properties of a dissimilatory Fe(Ⅲ) reducer Clostridium bifermentans EZ-1[J]. Acta Microbiologica Sinica, 2018, 58(4): 524-537. (in Chinese) 张月超, 肖雷雷, 王欧美, 等. 异化铁还原梭菌Clostridium bifermentans EZ-1产氢与电化学特性[J]. 微生物学报, 2018, 58(4): 524-537. |
| [22] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [23] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596. |
| [24] |
Wang WM, Qu D, Xu J. Isolation of iron-reducing bacteria in paddy soil and its Fe(Ⅲ) reduction potential analysis[J]. Journal of Northwest A & F University (Natural Science Edition), 2008, 36(10): 103-109. (in Chinese) 王伟民, 曲东, 徐佳. 水稻土中铁还原菌的分离纯化及铁还原能力分析[J]. 西北农林科技大学学报:自然科学版, 2008, 36(10): 103-109. |
| [25] |
Li XY, Zhou LN, Wang BL, et al. Difference of iron-reducing bacteria community structure in Bohai sediments under enrichment culture[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2012, 21(6): 35-40. (in Chinese) 李秀颖, 周莉娜, 王保莉, 等. 富集培养下不同渤海沉积物中铁还原菌的群落结构差异[J]. 西北农业学报, 2012, 21(6): 35-40. |
| [26] |
Li X, Zeng X, Zhang Z, et al. Characteristics of different iron oxides reduction by a thermophilic dissimilatory iron reducing bacterium Caloranaerobacter ferrireducens DY22619T from deep sea[J]. Haiyang Xuebao, 2016, 38(8): 83-92. (in Chinese) 李曦, 曾湘, 张昭, 等. 深海嗜热异化铁还原菌Caloranaerobacter ferrireducens DY22619T对不同铁氧化物的铁还原特性[J]. 海洋学报, 2016, 38(8): 83-92. |
| [27] |
He JZ, Qu D. Dissimilatory Fe(Ⅲ) reduction characteristics of paddy soil extract cultures treated with glucose or fatty acids[J]. Journal of Environmental Sciences, 2008, 20(9): 1103-1108. DOI:10.1016/S1001-0742(08)62156-7 |
| [28] |
Si YB, Wang J. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil[J]. Environmental Science, 2015, 36(9): 3533-3542. (in Chinese) 司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 2015, 36(9): 3533-3542. |
| [29] |
Han JC. Mechanisms of extracellular electron transfer in shewanella spp. and their applications[D]. Hefei: Doctoral Dissertation of University of Science and Technology of China, 2017 (in Chinese) 韩俊成.希瓦氏菌胞外电子传递机制的解析和应用[D].合肥: 中国科学技术大学博士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10358-1017283262.htm |
| [30] |
Li X. The Mechanisms of iron-reduction and biomineralization of two fermentative dissimilatory iron-reducing bacteria from deep-sea hydrothermal fields[D]. Xiamen: Master's Thesis of Third Institute of Oceanography, State Oceanic Administration, 2016 (in Chinese) 李曦.深海热液区嗜热发酵型异化铁还原细菌铁还原和生物成矿机制的研究[D].厦门: 国家海洋局第三海洋研究所硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-85303-1016256151.htm |
| [31] |
Yi WJ, Wang BL, Qu D. Diversity of isolates performing Fe(Ⅲ) reduction from paddy soil fed by different organic carbon sources[J]. African Journal of Biotechnology, 2012, 11(19): 4407-4417. |
| [32] |
Tong L, Li XL, Wu JN, et al. Isolation of an iron-reducing bacteria strain and its carbon source utilization[J]. Journal of Hefei University of Technology, 2016, 39(4): 536-542. (in Chinese) 童磊, 李湘凌, 吴纪南, 等. 一株铁还原菌的分离及其碳源利用特性研究[J]. 合肥工业大学学报:自然科学版, 2016, 39(4): 536-542. |
| [33] |
Guan SY, Zhu C, Wang BL, et al. Characterization of iron reduction using different carbon sources and phylogenetic analysis of Fe(Ⅲ)-reducing microorganism P4[J]. Journal of Northwest A & F University (Natural Science Edition), 2008, 36(3): 117-123. (in Chinese) 关舒元, 朱超, 王保莉, 等. 铁还原菌株P4的碳源利用特征及其系统发育学分析[J]. 西北农林科技大学学报:自然科学版, 2008, 36(3): 117-123. |
| [34] |
Sun QM, Liu W, Yao H. Enterococcus faecium reduces agar gelatination via generating organic acids[J]. Chinese Journal of Microecology, 2018, 30(11): 1252-1257. (in Chinese) 孙青民, 刘威, 姚红. 屎肠球菌产生有机酸降低琼脂胶凝作用[J]. 中国微生态学杂志, 2018, 30(11): 1252-1257. |
| [35] |
Lin XQ, Xia Y, Yan Q, et al. Acid tolerance response (ATR) of microbial communities during the enhanced biohydrogen process via cascade acid stress[J]. Bioresource Technology, 2014, 155: 98-103. DOI:10.1016/j.biortech.2013.12.097 |
| [36] |
You P, Jia R, Qiao SS, et al. Effect of carbon source concentrations on microbial hydrogen production and Fe(Ⅲ) reduction[J]. Journal of Agro-Environment Science, 2015, 34(4): 722-727. (in Chinese) 游萍, 贾蓉, 乔莎莎, 等. 碳源浓度对微生物发酵产氢及铁还原特征的影响[J]. 农业环境科学学报, 2015, 34(4): 722-727. |
| [37] |
Beckers L, Hiligsmann S, Lambert SD, et al. Improving effect of metal and oxide nanoparticles encapsulated in porous silica on fermentative biohydrogen production by Clostridium butyricum[J]. Bioresource Technology, 2013, 133: 109-117. DOI:10.1016/j.biortech.2012.12.168 |
| [38] |
Lehours AC, Rabiet M, Morel-Desrosiers N, et al. Ferric iron reduction by fermentative strain BS2 isolated from an iron-rich anoxic environment (Lake Pavin, France)[J]. Geomicrobiology Journal, 2010, 27(8): 714-722. DOI:10.1080/01490451003597663 |
 2020, Vol. 47
2020, Vol. 47