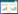扩展功能
文章信息
- 谢睿, 王煜, 焦念志, 郑强
- XIE Rui, WANG Yu, JIAO Nian-Zhi, ZHENG Qiang
- 南海环境微生物对聚球藻有机物质的响应
- The responses of environmental microbes from the South China Sea to Synechococcus-derived organic matter addition
- 微生物学通报, 2020, 47(9): 2685-2696
- Microbiology China, 2020, 47(9): 2685-2696
- DOI: 10.13344/j.microbiol.china.200306
-
文章历史
- 收稿日期: 2020-03-28
- 接受日期: 2020-07-10
- 网络首发日期: 2020-08-04
2. 福建省海洋碳汇重点实验室 福建 厦门 361102;
3. 厦门大学环境与生态学院 福建 厦门 361102
2. Fujian Key Laboratory of Marine Carbon Sequestration, Xiamen, Fujian 361102, China;
3. College of Environment and Ecology, Xiamen University, Xiamen, Fujian 361102, China
海洋占地球表面积的71%,是地球上最大的碳库[1]。海洋碳循环也是全球碳循环中的重要组成部分,发挥着调节和缓冲全球气候变化的重要作用[2-3]。海洋浮游植物通过光合作用产生的初级生产力,可占地球年净初级生产力的一半[4]。在海洋中,浮游植物以溶解有机碳(dissolved organic carbon,DOC)或颗粒有机物碳(particulate organic carbon,POC)的形式将有机物质释放到水体环境中或者传递到其他营养级,其释放途径包括以下几类:生长过程中有机物的主动或被动释放、病毒的裂解作用、浮游动物的捕食以及衰亡浮游植物细胞的碎屑等[5]。这些有机物质中的很大一部分通过异养细菌的吸收利用进入了“微食物环(microbial loop)”[6]。“微食物环”理论的提出[6],加深了人们对异养细菌在海洋物质和能量循环过程中的重要作用的认识。海洋中的异养细菌最终决定了有机碳的归宿:一部分变成异养细菌自身的生物量,一部分以二氧化碳的形式释放出去,还有一小部分转化为惰性有机物质(recalcitrant DOM,RDOM)在海洋中长期存储[7-10]。在有机碳的代谢利用过程中,异养细菌也推动了海洋中其他元素的生物地球循环,如氮、磷等[11-13]。
近年来海洋蓝细菌,主要包括原绿球藻(Prochlorococcus)和聚球藻(Synechococcus),在海洋初级生产和碳循环过程中的重要作用被大家广泛认识[14-15]。在寡营养环境下,蓝细菌对初级生产力的贡献可以与超微型真核浮游植物相媲美[16]。研究寡营养环境下蓝细菌光合作用产物与异养细菌之间的相互作用关系,对探究海洋物质和能量循环过程具有重要的意义。
南海(the South China Sea)作为全球最大的热带-亚热带陆架边缘海,其所属面积达3.5×106 m2,平均深度为1 350 m,最深深度超过5 500 m[17]。南海碳源汇的研究一直是中国科学家所关注的热点[18-20]。蓝细菌作为初级生产者在碳循环中有着不可忽视的作用[14],并且与异养细菌有着密切的碳转化关系[21],然而,目前对该海域微生物响应和转化代谢蓝细菌光合作用产物的研究仍相对缺乏。本研究选取了南海的两个站位:J4 (陆架)和SEATS (海盆),以聚球藻有机物质(Synechococcus-derived organic matter,SOM)作为添加有机碳源,在黑暗条件下进行培养。通过对培养过程中有机碳和营养盐变化的追踪,以及活性微生物群落结构变化的分析,探究南海微生物群落对SOM的响应和演替过程,以期加深对该海域生物地球化学循环过程的认识。
1 材料与方法 1.1 实验站位与设计 1.1.1 实验站位实验站位为中国南海珠江口外陆坡区J4站位(20.66°N;114.67°E)和寡营养海盆区SEATS站位(18°N,116°E)。搭载航次为2016年11月2号至12月2号的973南海航次。因两个站位都属于寡营养环境,并且采水点为表层,所以原位的氮磷无机营养盐(包括亚硝酸盐NO2–、硝酸盐NO3–和磷酸盐PO43–)都是在检测线以下(非痕量检测方法)。J4站位的细菌丰度(培养起始点,下同)为2.56×105 cells/mL,SEATS站位的细菌丰度为1.58×105 cells/mL。J4和SEATS站位总有机碳(total organic carbon,TOC)浓度分别为74.8 μmol-C/L和73.1 μmol-C/L。
1.1.2 主要试剂和仪器TRLzol® Reagent,Invitrogen公司;RNAlater™ Stabilization Solution,Thermo公司;Q5 DNA高保真聚合酶,New England Biolabs公司;TruSeq Nano DNA LT Library Prep Kit,Illumina公司。总有机碳分析仪,岛津公司;营养盐自动分析仪器,Bran+Luebbe公司;荧光计,Thermo Scientific公司。
1.1.3 实验设计选用一株分离于厦门海域的聚球藻(Synechococcus sp.) XM-24[21]作为添加有机物质的来源。采用SN培养基进行培养[22]。将培养至对数生长期(约15 d左右)的藻体细胞8 000 r/min离心15 min进行收集,去除上清培养液,留下藻体细胞。之后用适当体积(15-30 mL)的超纯(Milli-Q)水对藻体细胞进行重悬,并采用反复冻融的方法对藻体细胞进行破碎[23]。将处理后的藻体细胞破碎液置于-20 ℃保存备用。
采集J4和SEATS站位的表层海水(5 m),海水先经过装有3 μm滤膜的圆盘进行过滤(去除原生生物和大型浮游植物),收集过滤后的海水,分装到各个培养瓶(5 L)中。培养瓶为玻璃材质,使用前经过2 mol/L盐酸浸泡、Milli-Q水清洗和450 ℃高温灼烧4 h。实验组添加SOM,对照组不添加。实验组和对照组均设置2个平行重复。
1.2 总有机碳的采集与检测 1.2.1 TOC的采集利用移液管,将约20 mL样品收集到40 mL的玻璃瓶中,置于-20 ℃保存。实验中使用的玻璃耗材都经过2 mol/L盐酸浸泡、Milli-Q水清洗,450 ℃高温灼烧4 h,去除有机碳污染。
1.2.2 TOC的检测采用高温燃烧法,使用总有机碳分析仪,以纯度99.995%氧气作为载气,催化剂在680 ℃下将样品中有机物质氧化为二氧化碳,经过干燥除卤素后,通过非色散红外进行检测。使用邻苯二磷酸氢钾制作标准曲线,利用标准曲线斜率计算样品浓度,并且在检测过程中利用Hansell实验室的标准深海水(deep sea water,DSW)监测仪器状态。
1.3 营养盐的采集与检测 1.3.1 营养盐的采集用移液管吸取样品40 mL,经0.45 μm聚碳酸酯膜过滤,滤液置于50 mL离心管中,-20 ℃保存。
1.3.2 营养盐的检测检测的营养盐包括:硝态氮(NO2–和NO3–)和磷酸盐(PO43–),采用营养盐自动分析仪器进行测定。
1.4 活性微生物群落结构样品的采集与检测分析 1.4.1 RNA样品的采集与提取使用过滤器对RNA样品进行采集。用移液管吸取150 mL样品,海水通过0.2 μm聚碳酸酯膜进行过滤,将收集到的滤膜保存在加入了1 mL RNA保护液(RNAlater)的1.5 mL离心管中,-80 ℃保存。采用Trizol法对总RNA进行提取[24]。
1.4.2 高通量测序样品送至上海派森诺生物科技有限公司进行活性微生物群落结构的检测分析。用引物515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)进行细菌16S rRNA基因V4-V5区域的PCR扩增。PCR采用Q5 DNA高保真聚合酶。PCR反应体系(25 μL):Q5 Reaction Buffer 5 μL,Q5 High-Fidelity GC Buffer 5 μL,Q5 High-Fidelity DNA Polymerase (2 U/μL) 0.25 μL,dNTPs (200 μmol/L) 2 μL,正、反向引物(10 μmol/L)各1 μL,DNA样品2 μL,ddH2O 8.75 μL。PCR反应条件:98 ℃ 30 s;98 ℃ 15 s,50 ℃ 30 s,72 ℃ 30 s,30次循环;72 ℃ 5 min。使用TruSeq Nano DNA LT Library Prep Kit进行文库构建。之后,在荧光计和Agilent Bioanalyzer 2100系统上进行文库质量的评估。最后,在Illumina HiSeq 2500平台上对文库进行测序,产生450 bp的配对末端读数,然后使用FLASH软件(V1.2.7,http//ccb.jhu.edu/software/FLASH/)进行组合。首先,使用QIIME对原始数据进行质量过滤,以去除质量不符合的。接着使用Mothur37中的Chimera SLayer算法去除嵌合体。之后,使用UPARSE软件(UPARSE V7.0.1001,http://drive5.com/uparse/)对操作分类单元(OTU)进行聚类,以97%的相似性为基准。最后,在SILVA数据库中进行比对,对OTU进行分类。高通量数据上传于NCBI (National Center for Biotechnology Information)数据库,项目编号为PRJNA613952。
2 结果与分析 2.1 培养过程中TOC浓度的变化为了追踪培养过程中SOM的利用情况,检测了培养过程中TOC浓度的变化,结果如图 1A和1B所示。J4和SEATS站位培养体系中分别加入了约149.4 μmol-C/L和135.6 μmol-C/L的SOM。在整个培养过程中,两个站位对照组中TOC浓度保持在一个较为平稳的状态;而实验组中TOC浓度都有明显的下降。
|
| 图 1 J4 (A、C、E、G)和SEATS (B、D、F、H)站位培养过程中TOC和营养盐(NO2-、NO3-和PO43-)的浓度变化 Figure 1 The variation of TOC and nutrients (NO2-, NO3- and PO43-) concentration during the incubation of station J4 and SEAT |
|
|
在J4站位实验组中,培养前48 h内TOC浓度有较大幅度下降,从0 h的224.2 μmol-C/L下降到48 h的103.9 μmol-C/L;48 h后,TOC浓度的下降出现了平台期,并且一直维持到培养结束。在SEATS站位实验组中,TOC浓度从0 h的208.2 μmol-C/L下降为24 h的150.7 μmol-C/L;之后TOC浓度的下降出现平台期,浓度下降幅度变小;在培养结束时,TOC浓度为126.8 μmol-C/L。总而言之,TOC浓度的显著下降体现了J4和SEATS站位原位微生物群落对SOM快速响应以及SOM较好的生物可利用性。但是,在培养周期内SOM并没有被完全降解利用,说明对于J4和SEATS站位的微生物群落来说,SOM并不完全属于活性有机物质(labile DOM,LDOM)。此外,培养环境中较低浓度的无机氮可能限制了SOM被进一步利用。
2.2 培养过程中营养盐的变化研究检测的营养盐包括NO2-、NO3-和PO43-。原位环境(表层海水)的营养盐均低于仪器检测线,所以没能获得对照组中营养盐数据。实验组中,由于SOM的添加,两个站位实验组中营养盐的浓度变化明显。
对于NO2-和NO3-来说,在J4站位实验组中(图 1C和1E),起始NO2-和NO3-浓度分别为2.4 μmol/L和3.2 μmol/L,在整个培养过程中,NO2-和NO3-浓度在小范围内波动;在培养结束时,浓度分别为2.5 μmol/L和3.5 μmol/L,与起始的浓度相差不大。在SEATS站位中(图 1D和1F),NO2-和NO3-浓度变化有着相似的规律,起始NO2-和NO3-浓度分别为1.7 μmol/L和2.2 μmol/L,在培养结束时浓度分别为1.9 μmol/L和3.5 μmol/L。整个过程伴随着NO2-和NO3-的生成和再利用。
对于PO43-来说,J4 (图 1G)和SEATS (图 1H)站位实验组的起始浓度分别为1.1 μmol/L和0.8 μmol/L,并且在培养过程中有类似的变化规律:从0 h到12 h过程中有一个小幅度的下降,之后保持上升的趋势;到培养结束时,浓度分别为1.9 μmol/L和1.5 μmol/L。这个结果说明微生物在降解利用SOM的过程中将含磷有机物质以无机磷酸盐的形式释放出来,体现了微生物在海洋磷循环过程中的重要作用。
2.3 培养过程中活性微生物群落结构的变化 2.3.1 对照组中活性微生物群落组成的变化为了探究培养过程中活性微生物群落结构的变化,分别从J4和SEATS站位培养体系中获得301 059条和404 707条16S rRNA基因序列。
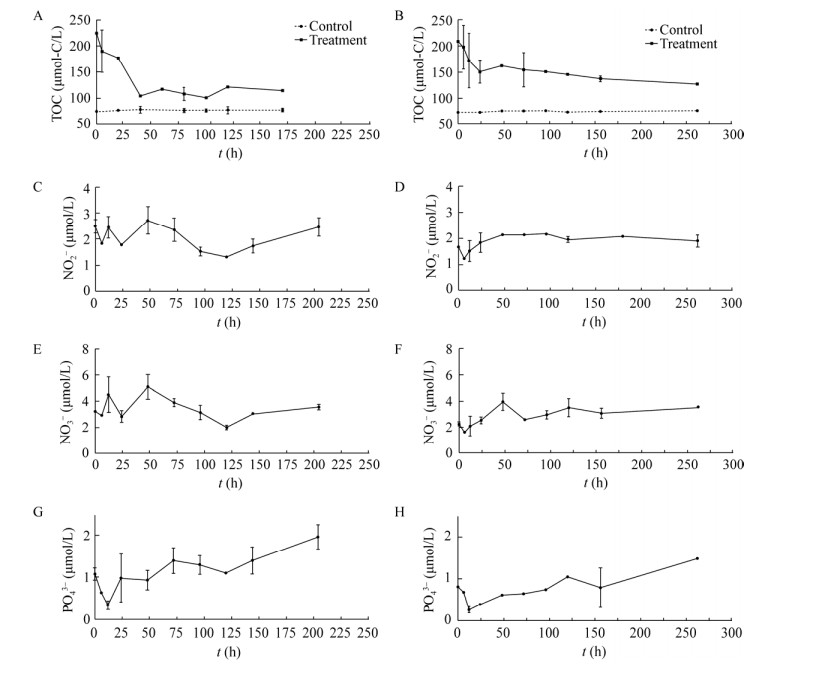
对照组中没有额外添加有机物质,但置于黑暗的条件下,活性微生物群落结构也发生了一些变化,结果如图 2所示。J4和SEATS站位的优势微生物类群较为相似,在原位环境中优势的微生物类群主要为α-变形菌(Alphaproteobacteria) (34.97%-36.66%)、γ-变形菌(Gammaproteobacteria) (23.29%-33.91%)、蓝细菌(Cyanobacteria) (22.33%-34.57%)和拟杆菌(Bacteroidetes) (1.37%-4.28%)。
|
| 图 2 J4 (A、C、E、G)和SEATS (B、D、F、H)站位对照组中活性微生物群落结构变化 Figure 2 The relative abundance of bacterial taxonomic community composition of J4 (A, C, E, G) and SEATS (B, D, F, H) in phylum level 注:门水平,变形菌门除外,其为纲水平. Note: Except for Proteobacteria, which are divided into classes. |
|
|
随着培养的进行,Alphaproteobacteria的相对丰度在两个站位中的变化都不大,培养结束时,在J4和SEATS站位的相对丰度分别为32.70%和37.05%。虽然Alphaproteobacteria相对丰度没有发生较明显变化,但是其中优势类群从早期的Pelagibacteraceae变为后期的Rhodobacteracea。然而Gammaproteobacteria在两个站位中的相对丰度都呈现上升趋势,在J4站位,Gammaproteobacteria的相对丰度从0 h的33.91%上升到了204 h的45.67%;在SEATS站位,从0 h的36.66%上升到262 h的57.29%,占到了培养体系活性微生物群落的一半以上。在培养的起始点,Cyanobacteria在SEATS站有着更高的相对丰度(34.57%),而J4站为22.33%。随着黑暗培养的进行,在两个站位中Cyanobacteria相对丰度都有所下降。在J4站位,培养72 h时Cyanobacteria相对丰度下降为11.23%,204 h时相对丰度仍保持在一定水平(12.28%)。相比之下,在SEATS站Cyanobacteria有较大的下降幅度:72 h时Cyanobacteria相对丰度为6.99%,培养结束时相对丰度降为2.53%。此外,J4站位有更高的Bacteroidetes相对丰度(4.28%),而在SEATS站仅为1.37%。在培养结束时,J4站位中的Bacteroidetes相对丰度有所上升(6.42%),SEATS站位降为0.78%。
对照组结果体现了Gammaproteobacteria类群对环境变化较强的适应能力。此外,虽然Cyanobacteria是光合自养生物,但是黑暗条件下仍可以维持一定的生物活性。相比之下,陆坡环境的J4站Cyanobacteria类群在黑暗环境能存活更长时间。
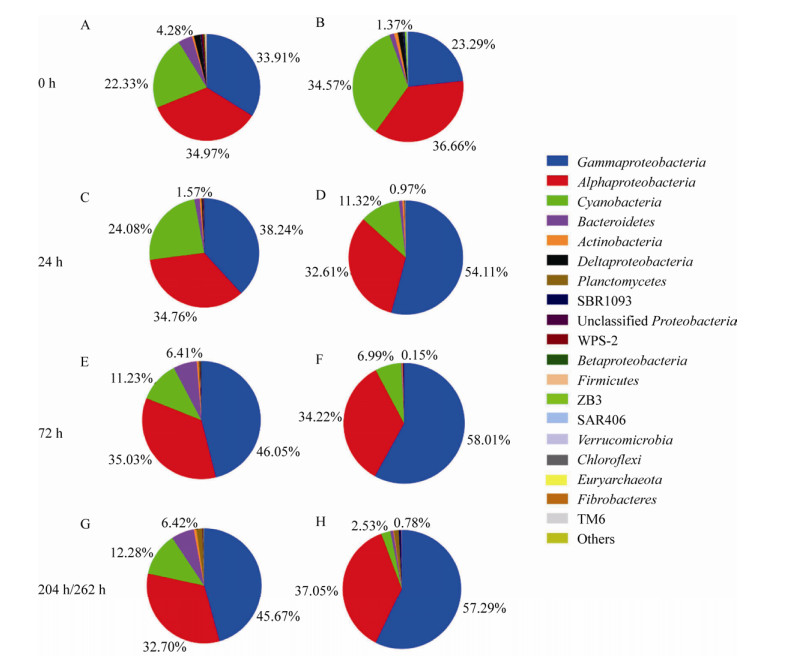
2.3.2 实验组中活性微生物群落组成的变化J4和SEATS站位实验组基于16S rRNA基因的微生物群落结构(目水平)变化如图 3所示。在J4站位实验组中(图 3A),0 h的活性微生物类群主要为:聚球藻(Synechococcales) (21.90%)、立克次氏体目(Rickettsiales) (17.89%,主要为Pelagibacteraceae)、海洋螺旋菌(Oceanospirillales) (13.23%,主要为Candidatus_Portiera)、红杆菌(Rhodobacterales) (8.75%)、交替单胞菌(Alteromonadales) (8.51%)和假单胞菌目(Pseudomonadales) (6.41%)。SOM的加入对活性微生物群落结构产生了很大的影响。到6 h时,培养体系中的优势活性微生物类群变为:Alteromonadales (62.49%,主要为Alteromonas)、弧菌目(Vibrionales) (29.33%,主要为Pseudoalteromonas)和黄杆菌(Flavobacteriales) (3.33%)。直到48 h时,Gammaproteobacteria中的Alteromonadales和Vibrionales仍然是培养体系中的优势微生物类群。同时,Rhodobacterales的相对丰度在6-48 h呈现增加的趋势,从6 h的0.66%增加为48 h的15.40%,其中主要为Nautella。在72 h时,培养体系内的活性微生物群落结构发生了很大的变化,优势微生物类群变为:军团菌目(Legionellales) (46.34%)、噬纤维菌目(Cytophagales) (10.24%,主要为Roseivirga)、Rhodobacterales (9.80%)和Unclassified Gammaproteobacteria (8.73%)和Flavobacteriales (5.33%)。相比6 h的高相对丰度,在72 h时Alteromonadales的相对丰度仅为5.35%。Gammaproteobacteria中的Legionellales取代了Alteromonadales的优势地位,并在培养后期保持优势地位,在204 h其相对丰度仍有45.03%。此外,Cytophagales的相对丰度在72 h时也有所上升(10.24%),并在培养后期保持上升趋势,在204 h相对丰度可达17.13%。在培养结束时,优势的活性微生物类群变为:Legionellales (45.03%)、Cytophagales (17.13%)、Flavobacteriales (5.40%)、Rhodobacterales (3.93%)和Sphingomonadales (3.23%)。
|
| 图 3 J4 (A)和SEATS (B)站位活性微生物群落结构变化(目水平) Figure 3 The relative abundance of bacterial taxonomic community composition of station J4 (A) and SEATS (B) in order level 注:C:对照组;T:实验组. Note: C: Control group; T: Treatment group. |
|
|
在SEATS站实验组中(图 3B),0 h的活性微生物类群主要为:Synechococcales (34.47%)、Rickettsiales (28.35%,主要为Pelagibacteraceae)、Oceanospirillales (8.68%,主要为Candidatus_Portiera)、Alteromonadales (6.93%,主要为Alteromonas)和Rhodobacterales (3.14%)。在培养6 h时,优势活性微生物类群变为:Unclassified Gammaproteobacteria (47.82%)、Alteromonadales (39.91%,主要为Alteromonas)、Vibrionales (4.98%,主要为Pseudoalteromonas)和Synechococcales (3.96%)。之后,Unclassified Gammaproteobacteria的相对丰度呈现逐渐下降的趋势,到培养结束时,其相对丰度仅为1.47%。Alteromonadales的相对丰度在96 h之前都保持在一个相对较高的水平(29.94%-42.43%),96 h后其相对丰度下降,培养结束时其相对丰度仅为1.65%。Rhodobacterales在96 h时有最高相对丰度,为15.81%。在120 h时活性微生物群落结构有较大的变化:Legionellales (40.79%)、Alteromonadales (19.44%)、Rhodobacterales (10.15%)、Unclassified Gammaproteobacteria (8.30%)、Flavobacteriales (6.18%)和Vibrionales (5.70%)。Gammaproteobacteria中的Legionellales成为优势活性微生物类群,其相对丰度为40.79%,直到培养结束Legionellales都保持着优势地位,在262 h时其相对丰度仍有51.26%,占到了活性微生物群落的一半。Flavobacteriales在120 h有最高的相对丰度,为12.74%。在培养后期,Cytophagales成为了优势微生物类群,在156 h之前,其相对丰度低于2%,而156 h和262 h的相对丰度分别为13.66%和26.17%。在培养结束时,体系中的微生物群落结构为:Legionellales (51.26%)、Cytophagales (26.17%,主要为Roseivirga)、Rhodothermales (4.60%)、Rhodobacterales (3.08%)。
2.3.3 培养过程中活性微生物群落结构及多样性变化为了探究微生物群落结构以及多样性的变化。基于OTU信息计算了α多样性指数并进行了主成分分析(principal component analysis,PCA)。
培养过程中丰富度,即Chao1指数(Chao1 index)和香农指数(Shannon-Wiener index)的变化如表 1所示。
| Time (h) | Chao1 index | Shannon-Wiener index | |||||||
| J4 control group | J4 treatment group | SEATS control group | SEATS treatment group | J4 control group | J4 treatment group | SEATS control group | SEATS treatment group | ||
| 0 | 374.65 | - | 511.00 | - | 5.25 | - | 4.64 | - | |
| 6 | - | 433.56 | - | 619.23 | - | 2.69 | - | 3.20 | |
| 12 | - | 507.11 | - | 754.06 | - | 3.38 | - | 4.39 | |
| 24 | 632.83 | 678.28 | 624.04 | 728.00 | 4.8 | 3.99 | 4.45 | 5.18 | |
| 48 | - | 645.17 | - | 932.07 | - | 3.90 | - | 5.17 | |
| 72 | 618.98 | 617.93 | 876.01 | 1 007.28 | 4.77 | 4.75 | 5.02 | 5.28 | |
| 96 | - | 486.02 | - | 834.83 | - | 4.62 | - | 5.12 | |
| 120 | - | - | - | 817.47 | - | - | - | 5.07 | |
| 144 | - | 532.23 | - | - | - | 4.58 | - | - | |
| 156 | - | - | - | 480.92 | - | - | - | 3.66 | |
| 204 | 602.25 | 464.00 | - | - | 5.09 | 5.05 | - | - | |
| 262 | - | - | 822.85 | 298.70 | - | - | 5.31 | 3.01 | |
| 注:-:未检测. Note: -: Undetected. | |||||||||
在J4站位中,对照组中的Chao1指数在24 h时呈现上升趋势,之后就保持相对稳定直到培养结束;香农指数在培养过程中没有太大的变化。实验组中的Chao1指数在24 h时呈现上升趋势,并在24 h有最高值,之后缓慢下降,培养结束时稍低于对照组;香农指数在6 h时有最低值,之后呈现上升趋势,在培养结束时与对照组中的Chao1指数保持一致。
在SEATS站位中,对照组中Chao1指数在72 h前呈现上升趋势,之后保持相对稳定;香农指数呈现小幅度上升趋势。在实验组中,Chao1指数在72 h前呈现升高趋势,并在72 h时达到最高值,之后逐渐下降,培养结束时Chao1指数大大低于对照组;香农指数在6 h时降至较低水平,之后呈现上升趋势,24 h后保持相对稳定直到156 h,156 h后又呈现下降趋势直到培养结束,培养结束时香农指数显著低于对照组。
PCA分析结果显示(图 4),J4站位(图 4A)对照组中不同时间点活性微生物群落结构彼此之间会更加接近,并与实验组有明显的差别;在实验组中,前期样品(48 h之前)聚在一起,后期样品(72 h之后)聚在一起,体现了培养过程中活性微生物群落结构的演替。在SEATS站中(图 4B),对照组0 h样品和其他样品有较大的差别;对照组中剩余样品和实验组中前期样品(96 h之前)更接近;而实验组中的后期样品(120 h之后)之间会更相似。
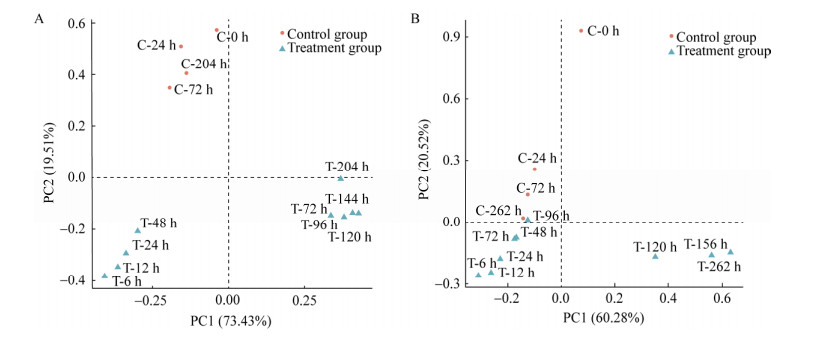
|
| 图 4 J4 (A)和SEATS (B)站位基于OTU的主成分分析 Figure 4 Principal component analysis of OTU in station J4 (A) and SEATS (B) |
|
|
总的来说,SOM的加入提高了微生物群落的丰富度(Chao1指数),说明不同微生物类群对新鲜有机物质进行了积极的响应。PCA结果体现了活性微生物群落结构在培养过程中的演替,可能与体系中有机碳的生物可利用性的变化有关。
3 讨论 3.1 微生物群落对SOM的降解利用海洋浮游植物通过被动或者主动的方式将大量光合作用产物释放到周围的水体中,这些有机物质为周围微生物的生长提供了物质和能量基础[5]。浮游植物也是海洋POC的重要来源,是海洋生物泵的重要组成部分[25]。本研究中,大约150 μmol-C/L SOM被添加到实验组中。实验结果显示TOC浓度在培养早期都有较为明显的下降,表明J4和SEATS站位的微生物群落都对SOM的添加进行了快速的代谢利用。但是,在9 d左右的培养周期中,只有60%-73%的SOM被降解利用,表明添加的SOM并没有在培养周期内被完全降解利用。这个结果说明,对于J4和SEATS站位的微生物群落来说,SOM并不完全属于LDOM,在早期就被降解利用的那部分有机物质应该属于LDOM或半活性有机物质(semi-LDOM,SLDOM)。在两个站位的培养过程中都出现了TOC下降平台期,说明SOM中生物利用性较差的那部分需要微生物花费更多的能量和时间去利用代谢,其中小部分有机物质或被转化成了RDOM在体系中积累。此外,培养体系中营养盐水平(特别是硝酸盐浓度)也可能限制了微生物对SOM的利用。
3.2 微生物群落结构的演替活性微生物群落结构结果显示,SOM的加入极大地改变了培养体系中的活性微生物群落结构。Gammaproteobacteria是最快的响应者,6 h时其相对丰度分别占J4和SEATS站位的92.90%和93.41%。Gammaproteobacteria通常被称为“机会主义者”,它们具有比较宽的底物利用能力,能对周围环境变化进行快速的响应[26-27]。Gammaproteobacteria中的Alteromonadales、Vibrionales和Unclassified Gammaproteobacteria是最早的响应者。早期研究也表明Alteromonadales可以对水体中的LDOM进行快速的响应[28]。此外,Alteromonadales成员也被报道是海洋颗粒有机物的最早定殖者[29-30]。研究结果也体现了这点,它们可以对SOM进行快速响应,并且占据优势地位。此外,在短期的培养过程中,Gammaproteobacteria内也出现了类群的演替,从培养早期的Alteromonadales、Vibrionales和Unclassified Gammaproteobacteria,变成后期的Legionellales。Alphaproteobacteria中的Rhodobacterales在培养的中期达到其相对丰度的最高值。Rhodobacterales类群生长迅速,通常对新鲜有机物质也能积极响应[32-33]。在我们的培养体系中,Alphaproteobacteria和Bacteroidetes等微生物类群没能竞争过Gammaproteobacteria,未在第一时间占领优势地位。Bacteroidetes中的Cytophagales和Flavobacteriales在培养后期有较高的相对丰度。Bacteroidetes被广泛报道具有降解高分子溶解有机物质的能力,也是浮游植物藻华期间中的主要响应类群[21, 33-35]。在培养的后期,Gammaproteobacteria的相对丰度有所下降(J4站为50.51%和SEATS站为57.48%),仍然是培养体系中的优势细菌类群。总的来说,在短期的培养过程中,Gammaproteobacteria是整个培养过程中最为优势的微生物类群。PCA结果体现了活性微生物群落结构在培养过程中的演替,这可能与体系中有机碳生物可利用性的变化有关。随着培养的进行,SOM中的LDOM逐步被利用,活性微生物群落结构也随之变化。这个结果很好地体现了不同可利用性有机物质和微生物群落之间的相互作用。
实验组中SOM脉冲式的加入提高了微生物群落的丰富度(Chao1指数),体现了微生物群落对新鲜有机物质的积极响应。Chao1指数对稀有类群较为敏感,计算时不考虑OTU的丰度和均匀度。然而香农指数对优势类群较为敏感,计算时需要考虑OTU丰度和均匀度,所以在两个站位的第6 h都出现了低值,对应于该时间点高丰度的Gammaproteobacteria。在培养后期,J4站位丰富度的逐渐下降,以及SEATS站位丰富度和多样性的显著降低,可能与体系中有机碳生物可利用性的降低有关。
4 结论海洋初级生产者产生的有机物质与异养细菌之间的相互作用是上层海洋物质和能量循环过程中的重要组成部分。本研究在南海寡营养环境考察了原位活性微生物群落对SOM的代谢利用以及演替过程。在9 d左右的培养过程中,有60%-73%的SOM被微生物代谢利用,说明SOM中的有机物质大部分都是属于LDOM或SLDOM。但是,在培养周期内,添加的SOM并未被全部降解,说明SOM中生物利用性较差的那部分需要微生物花费更多时间去降解。Gammaproteobacteria是响应SOM添加最快的微生物类群,并在培养体系中保持优势地位,体现了它们灵活和多样的生活方式。Alphaproteobacteria和Bacteroidetes也是培养体系内的主要活性微生物类群,Alphaproteobacteria在培养中期有较明显的响应,Bacteroidetes在培养后期有较明显的响应。丰富度(Chao1指数)在培养前期的升高,体现了微生物群落对SOM进行了积极的响应。PCA结果显示出两个站位对照组和实验组之间活性微生物群落结构的差异,并且实验组前期与后期活性微生物群落结构的差异,表明SOM的添加影响了原位活性微生物群落结构,并且随着体系中LDOM逐渐被利用,活性微生物群落结构也随之发生演替。本研究很好地体现了浮游植物来源有机物质和异养细菌之间的相互作用,可为深入理解原位环境异养细菌介导的生物地球化学循环过程提供线索。
| [1] |
Sabine CL, Feely RA, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305(5682): 367-371. DOI:10.1126/science.1097403 |
| [2] |
Levin LA, Le Bris N. The deep ocean under climate change[J]. Science, 2015, 350(6262): 766-768. DOI:10.1126/science.aad0126 |
| [3] |
Ogawa H, Tanoue E. Dissolved organic matter in oceanic waters[J]. Journal of Oceanography, 2003, 59(2): 129-147. DOI:10.1023/A:1025528919771 |
| [4] |
Field CB, Behrenfeld MJ, Randerson JT, et al. Primary production of the biosphere: Integrating terrestrial and oceanic components[J]. Science, 1998, 281(5374): 237-240. DOI:10.1126/science.281.5374.237 |
| [5] |
Mühlenbruch M, Grossart HP, Eigemann F, et al. Mini-review: phytoplankton-derived polysaccharides in the marine environment and their interactions with heterotrophic bacteria[J]. Environmental Microbiology, 2018, 20(8): 2671-2685. DOI:10.1111/1462-2920.14302 |
| [6] |
Azam F. Microbial control of oceanic carbon flux: the plot thickens[J]. Science, 1998, 280(5364): 694-696. DOI:10.1126/science.280.5364.694 |
| [7] |
Jiao NZ, Herndl GJ, Hansell DA, et al. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 2010, 8(8): 593-599. DOI:10.1038/nrmicro2386 |
| [8] |
Azam F, Fenchel T, Field JG, et al. The ecological role of water-column microbes in the sea[J]. Marine Ecology Progress Series, 1983, 10: 257-263. DOI:10.3354/meps010257 |
| [9] |
Sarmento H, Morana C, Gasol JM. Bacterioplankton niche partitioning in the use of phytoplankton-derived dissolved organic carbon: quantity is more important than quality[J]. The ISME Journal, 2016, 10(11): 2582-2592. DOI:10.1038/ismej.2016.66 |
| [10] |
Kirchman DL, Suzuki Y, Garside C, et al. High turnover rates of dissolved organic carbon during a spring phytoplankton bloom[J]. Nature, 1991, 352(6336): 612-614. DOI:10.1038/352612a0 |
| [11] |
Falkowski PG, Fenchel T, Delong EF. The microbial engines that drive Earth's biogeochemical cycles[J]. Science, 2008, 320(5879): 1034-1039. DOI:10.1126/science.1153213 |
| [12] |
Dyhrman ST, Ammerman JW, van Mooy BAS. Microbes and the marine phosphorus cycle[J]. Oceanography, 2007, 20(2): 110-116. DOI:10.5670/oceanog.2007.54 |
| [13] |
Hutchins DA, Fu FX. Microorganisms and ocean global change[J]. Nature Microbiology, 2017, 2(6): 17058. DOI:10.1038/nmicrobiol.2017.58 |
| [14] |
Flombaum P, Gallegos JL, Gordillo RA, et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(24): 9824-9829. DOI:10.1073/pnas.1307701110 |
| [15] |
de Martini F, Neuer S, Hamill D, et al. Clade and strain specific contributions of Synechococcus and Prochlorococcus to carbon export in the Sargasso Sea[J]. Limnology and Oceanography, 2018, 63(S1): S448-S457. DOI:10.1002/lno.10765 |
| [16] |
Fernández-Gómez B, Richter M, Schuler M, et al. Ecology of marine Bacteroidetes: a comparative genomics approach[J]. The ISME Journal, 2013, 7(5): 1026-1037. DOI:10.1038/ismej.2012.169 |
| [17] |
Su JN. Overview of the South China Sea circulation and its influence on the coastal physical oceanography outside the Pearl River Estuary[J]. Continental Shelf Research, 2004, 24(16): 1745-1760. DOI:10.1016/j.csr.2004.06.005 |
| [18] |
Deng WC, Peng LL, Jiao NZ, et al. Differential incorporation of one-carbon substrates among microbial populations identified by stable isotope probing from the estuary to South China Sea[J]. Scientific Reports, 2018, 8(1): 15378. DOI:10.1038/s41598-018-33497-6 |
| [19] |
Liu SL, Jiang ZJ, Wu YC, et al. Macroalgae bloom decay decreases the sediment organic carbon sequestration potential in tropical seagrass meadows of the South China Sea[J]. Marine Pollution Bulletin, 2019, 138: 598-603. DOI:10.1016/j.marpolbul.2018.12.009 |
| [20] |
Jiang ZJ, Zhao CY, Yu S, et al. Contrasting root length, nutrient content and carbon sequestration of seagrass growing in offshore carbonate and onshore terrigenous sediments in the South China Sea[J]. Science of the Total Environment, 2019, 662: 151-159. DOI:10.1016/j.scitotenv.2019.01.175 |
| [21] |
Zheng Q, Wang Y, Xie R, et al. Dynamics of heterotrophic bacterial assemblages within Synechococcus cultures[J]. Applied and Environmental Microbiology, 2018, 84(3): e01517-17. |
| [22] |
Zhao Z, Gonsior M, Luek J, et al. Picocyanobacteria and deep-ocean fluorescent dissolved organic matter share similar optical properties[J]. Nature Communications, 2017, 8: 15284. DOI:10.1038/ncomms15284 |
| [23] |
Zheng Q, Chen Q, Cai RH, et al. Molecular characteristics of microbially mediated transformations of Synechococcus- derived dissolved organic matter as revealed by incubation experiments[J]. Environmental Microbiology, 2019, 21(7): 2533-2543. DOI:10.1111/1462-2920.14646 |
| [24] |
Zhang Y, Zhao ZH, Dai MH, et al. Drivers shaping the diversity and biogeography of total and active bacterial communities in the South China Sea[J]. Molecular Ecology, 2014, 23(9): 2260-2274. DOI:10.1111/mec.12739 |
| [25] |
Herndl GJ, Reinthaler T. Microbial control of the dark end of the biological pump[J]. Nature Geoscience, 2013, 6(9): 718-724. DOI:10.1038/ngeo1921 |
| [26] |
Tada Y, Taniguchi A, Nagao I, et al. Differing growth responses of major phylogenetic groups of marine bacteria to natural phytoplankton blooms in the western North Pacific Ocean[J]. Applied and Environmental Microbiology, 2011, 77(12): 4055-4065. DOI:10.1128/AEM.02952-10 |
| [27] |
Sarmento H, Gasol JM. Use of phytoplankton-derived dissolved organic carbon by different types of bacterioplankton[J]. Environmental Microbiology, 2012, 14(9): 2348-2360. DOI:10.1111/j.1462-2920.2012.02787.x |
| [28] |
Pedler BE, Aluwihare LI, Azam F. Single bacterial strain capable of significant contribution to carbon cycling in the surface ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(20): 7202-7207. DOI:10.1073/pnas.1401887111 |
| [29] |
Lauro FM, McDougald D, Thomas T, et al. The genomic basis of trophic strategy in marine bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(37): 15527-15533. DOI:10.1073/pnas.0903507106 |
| [30] |
McCarren J, Becker JW, Repeta DJ, et al. Microbial community transcriptomes reveal microbes and metabolic pathways associated with dissolved organic matter turnover in the sea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(38): 16420-16427. DOI:10.1073/pnas.1010732107 |
| [31] |
Nelson CE, Wear EK. Microbial diversity and the lability of dissolved organic carbon[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(20): 7166-7167. DOI:10.1073/pnas.1405751111 |
| [32] |
Sheik AR, Brussaard CPD, Lavik G, et al. Responses of the coastal bacterial community to viral infection of the algae Phaeocystis globosa[J]. The ISME Journal, 2014, 8(1): 212-225. DOI:10.1038/ismej.2013.135 |
| [33] |
Cottrell MT, Kirchman DL. Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low- and high-molecular-weight dissolved organic matter[J]. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697. DOI:10.1128/AEM.66.4.1692-1697.2000 |
| [34] |
Teira E, Gasol JM, Aranguren-Gassis M, et al. Linkages between bacterioplankton community composition, heterotrophic carbon cycling and environmental conditions in a highly dynamic coastal ecosystem[J]. Environmental Microbiology, 2008, 10(4): 906-917. DOI:10.1111/j.1462-2920.2007.01509.x |
| [35] |
Teeling H, Fuchs BM, Becher D, et al. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom[J]. Science, 2012, 336(6081): 608-611. DOI:10.1126/science.1218344 |
 2020, Vol. 47
2020, Vol. 47