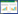扩展功能
文章信息
- 高珺珊, 薛亮, 左月婷, 张乐, 张菊梅, 吴清平
- GAO Jun-Shan, XUE Liang, ZUO Yue-Ting, ZHANG Le, ZHANG Ju-Mei, WU Qing-Ping
- 诺如病毒常见流行株胶体金免疫层析快速检测方法
- Colloidal gold immunochromatographic assay for rapid detection of Norovirus epidemic strains
- 微生物学通报, 2020, 47(8): 2665-2672
- Microbiology China, 2020, 47(8): 2665-2672
- DOI: 10.13344/j.microbiol.china.190883
-
文章历史
- 收稿日期: 2019-11-01
- 接受日期: 2020-04-10
- 网络首发日期: 2020-05-09
诺如病毒(Norovirus,NoV)属于杯状病毒科(Calicivirida)诺如病毒属,被认为是全球性非细菌性胃肠炎的主要病原之一[1],具有在环境中稳定性强、低剂量感染、传播途径多样化等特点,主要通过粪-口途径传播,也可以通过被病毒污染的食物和水源传播[2-3]。NoV可以分为GI−GVII共7个基因群(genogroup),引起人类感染的为GI、GII和GIV基因群,其中引起暴发流行的主要是GII基因群,常见的是GII.4型和GII.17型[3-7]。
NoV自发现以来在全球各地均有病例报道,每年造成约6.99亿感染和20多万人死亡[8]。2009年,荷兰NoV感染性胃肠炎的发病率为3 800/10万,病死率约为0.4/10万[9],美国疾病控制与预防中心(Centers for Disease Control and Prevention,CDC)的数据指出每年由NoV感染造成的急性胃肠炎达2 000万例[10]。近年来,作者团队研究结果表明,我国华南地区诺如病毒危害越来越严重[11-13]。广东、广西、江苏、河北等省也报道了NoV暴发事件[14]。万壮等[15]研究表明,2014年广州市共暴发疫情6起,记录942个病例。谢赟等[16]报道了2015−2016年河北省共发生8起NoV疫情,病原包括GII.2型、GII.4型和GII.17型。
NoV的检测方法包括电镜法、分子生物学检测方法及免疫检测方法。常规RT-PCR被公认为NoV检测的“金标准”,具有操作简单、灵敏度高、应用范围广等优点。早期的文献见寇晓霞等[17]报道。实时荧光定量PCR技术是目前大多数公共卫生和研究实验室使用较为广泛的NoV检测方法,Miura等[18]建立了一步法实时荧光定量RT-PCR方法,该方法包含分别针对NoV的3种基因群(GI、GII和GIV)的3对引物,具有特异性强、灵敏度高的特点。但在实际应用中这两种方法也存在检测时间长、检测仪器设备要求高、需要专业人员操作等诸多缺点。
胶体金免疫层析技术属固相免疫标记检测技术,将胶体金作为示踪物应用于抗原抗体反应,最常见的应用是胶体金免疫层析试纸条[19]。胶体金免疫层析试纸条在各个领域均有广泛应用,具有操作简单、检测时间短、无需专业人员操作等优点,特别适合临床检测及大规模流行病学调查。本研究利用一对NoV单克隆抗体研制一种适用于NoV主要流行株的胶体金免疫层析试纸条,为建立快速、广谱的NoV检测方法奠定基础。
1 材料与方法 1.1 抗体和样本鼠抗NoV单克隆抗体1B10、1D6由本实验室前期制备并保存,两株单抗都是以GII.4-2012型GZ2014-L307毒株(GenBank登录号KT202798)衣壳蛋白P颗粒作为免疫原制备的,浓度分别为5 mg/mL和2.2 mg/mL,每毫克抗体的效价均大于1×106。本研究中的临床粪便样本来源于中山大学附属第三医院,由作者实验室检测及分型鉴定[11-13],包括诺如病毒GII.4型、GII.2型以及GII.17型样本,此外还有轮状病毒(Rotavirus,RV)、星状病毒(Astrovirus,AsV)、腺病毒(Adenovirus,AdV)、札幌病毒(Sapovirus,SaV)、肠道病毒(Enterovirus,EV)的临床阳性样本。
1.2 主要试剂和仪器40 nm粒径的胶体金溶液,上海艾信生物有限公司;Goat Anti-Mouse IgG,北京博奥森生物技术有限公司。Millipore 2.5 cm硝酸纤维素膜(NC膜)、PVC底板、玻璃纤维膜、吸水纸,上海捷宁生物有限公司;切条机,得力公司。
1.3 粪便样本前处理取适量的粪便样本,用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的PBS溶液将样本稀释至10%−20% (质量体积比),混合均匀后,7 000 r/min离心5 min,吸取上清液分装保存于−80 ℃冰箱。
1.4 抗体标记胶体金最佳pH确定取6支EP管,分别加入1 mL的胶体金溶液,再依次加入5、6、7、8、9、10 μL的0.2 mol/L碳酸钾溶液(0.22 μm滤器过滤),混合均匀后加入10 μg单克隆抗体1B10,测定pH值,置于混匀仪上混匀1 h,之后10 000 r/min离心30 min。取出后根据管壁有无挂壁现象、上清液是否澄清透明、沉淀有无明显黑色颗粒物等判断最佳标记pH。
1.5 金标抗体最佳浓缩比例的选择取4支EP管,分别加入1 mL胶体金溶液,然后分别加入上一步确定的适量0.2 mol/L碳酸钾溶液,再加入10 μg的单克隆抗体,混匀仪上混匀1 h后加入100 μL 10% BSA溶液(0.22 μm滤器过滤)封闭1 h,10 000 r/min离心30 min,将上清舍弃,分别加入200、150、100、50 μL的复溶液[10%蔗糖、5%海藻糖、1%牛血清白蛋白(质量体积比),溶剂为0.02 mol/L的Tirs-HCl]复溶,充分溶解后的金标抗体均匀铺在玻璃纤维膜上,37 ℃烘干2 h以上制作金标垫,干燥后按检测线(test line,T线)、质控线(control line,C线)划线抗体浓度为1 mg/mL组装成试纸条。检测临床阳性样本,10 min后观察T、C线的颜色变化,确定金标抗体的最佳浓缩比例。
1.6 检测线包被浓度的确定将单抗1D6稀释成2.0、1.5、1.0、0.5、0.25 mg/mL依次划线,组装成试纸条,检测同一份临床阳性样本,10 min后观察检测线(T线)的显色情况,确定检测线的最佳包被浓度。
1.7 质控线抗体包被浓度的确定将羊抗鼠二抗稀释成2.0、1.5、1.0、0.5、0.25 mg/mL依次划线,组装成试纸条,检测同一份临床阳性样本,10 min后观察质控线(C线)的显色情况,确定质控线的最佳包被浓度。
1.8 试纸条的组装首先将NC膜固定到PVC底板上,依次划好T、C线,然后裁取24 mm样品垫、8 mm铺好金标抗体的玻璃纤维膜、32 mm吸水纸,三者从下到上依次重叠2 mm固定在PVC底板上,将底板上的耗材压紧固定,用切纸机将组装的试纸板切成4 mm宽的试纸条。
1.9 试纸条性能测试为了检测该方法的试验性能,需要进行一系列的评价,其中包括特异性试验、灵敏性试验、批间批内重复及保存期试验。
1.9.1 特异性试验利用建立好的方法组装成试纸条,对常见腹泻病毒(轮状病毒、星状病毒、腺病毒、札幌病毒、肠道病毒)阳性样本进行检测,判断本方法与以上病毒有无交叉反应。
1.9.2 灵敏性试验将病毒拷贝数为1.89×107 copies/μL的临床阳性样本从原液开始用蒸馏水倍比稀释,然后取120 μL上样,稀释比例依次为1:1、1:2、1:4、1:8、1:16、1:32、1:64,观察T线显色情况。当用肉眼无法观察到T线时的稀释度即为该方法的最低检出浓度。
1.9.3 批间、批内重复对GII型NoV临床阳性样本及未感染NoV的阴性样本进行批次间和批次内重复试验,观察T、C线的显色情况,确定本方法是否具有可重复性。
1.9.4 保存期试验将同一批次制备的试纸条装入铝箔袋密封后,分别于37 ℃ (加速老化)和室温(实时老化)保存一段时间。测试时间间隔为1周、1个月、2个月、3个月,记录各种情况下的T、C线显色情况,从而判断试纸条的保存期限。
1.9.5 试纸条的应用评价应用以上建立的胶体金试纸条检测方法对本实验室保存的24份临床粪便样本进行检测。同时进行荧光定量RT-PCR检测[20],对比两种方法的阳性符合率,从而对建立的胶体金试纸条方法进行评价。
2 结果与分析 2.1 金标抗体最佳pH确定经过试验,当0.2 mol/L碳酸钾溶液的加入量为8 μL以下时,胶体金溶液pH偏酸性,离心之后存在挂管壁现象,以复溶液溶解后有少许死金颗粒。当0.2 mol/L碳酸钾溶液加入量为10 μL时,胶体金溶液pH值约为8.0,离心之后上清澄清透明,无挂壁现象,以复溶液复溶后未见不溶解的死金颗粒。
2.2 金标抗体最佳浓缩比例的选择1 mL金标抗体离心沉淀后分别用50、100、150、200 μL复溶液复溶后铺于玻璃纤维膜,37 ℃干燥2 h,以T、C线划线抗体浓度为1 mg/mL组装试纸条。检测临床阳性样本,T、C线均有较清晰显色,且无较大差异,为提高本方法灵敏度选择金标抗体浓缩比例为10:1。
2.3 检测线包被浓度的确定单抗1D6稀释为2.0、1.5、1.0、0.5、0.25 mg/mL依次划线组装成试纸条,检测同一份临床阳性样本,结果检测线包被单抗浓度在0.5 mg/mL以上时T线显色均较为明显,而0.5 mg/mL以下T线显色减弱,因此选择T线抗体包被浓度0.5 mg/mL。
2.4 质控线抗体包被浓度的确定羊抗鼠二抗稀释成2.0、1.5、1.0、0.5、0.25 mg/mL依次划线组装成试纸条,检测同一份临床阳性样本,结果浓度为0.5 mg/mL及以上时,C线显色随包被浓度的变化并不明显,稀释至0.25 mg/mL显色有较微弱变淡,最终选择C线抗体包被浓度0.5 mg/mL。
2.5 试纸条性能测试 2.5.1 特异性试验利用上述建立好的胶体金试纸条检测方法组装一批试纸条,对实验室保存的轮状病毒、星状病毒、腺病毒、札幌病毒、肠道病毒临床阳性样本(样本浓度均大于1×107 copies/mL)进行检测,结果(图 1)与轮状病毒、星状病毒、腺病毒、肠道病毒均不存在交叉反应,与1份札幌病毒阳性样本反应呈弱阳性,但重复其他札幌病毒阳性样本均呈阴性。

|
| 图 1 诺如病毒胶体金试纸条的特异性试验结果 Figure 1 Specificity test of colloidal gold test strip for Norovirus 注:AsV:星状病毒;AdV:腺病毒;EV:肠道病毒;RV:轮状病毒;SaV:札幌病毒. Note: AsV: Astrovirus; AdV: Adenovirus; EV: Enterovirus; RV: Rotavirus; SaV: Sapovirus. |
|
|
取8个试纸条对倍比稀释后的临床阳性样本进行检测,结果如图 2所示,将病毒拷贝数为1.89×107 copies/μL的临床阳性样本稀释至32倍时,T线仍清晰可见,低于1:32时,T线也有显色,但较为微弱,表明本试验最低检出限为5.9×105 copies/μL。
|
| 图 2 诺如病毒胶体金试纸条的灵敏性试验结果 Figure 2 Sensitivity test of colloidal gold test strip for Norovirus |
|
|
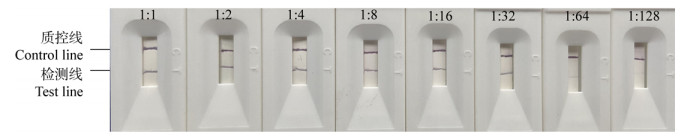
取6个同一批次、6个不同批次的试纸条分别对临床阳性样本和临床阴性样本进行检测,结果如图 3、4所示,同一批次内的试纸条与不同批次间试纸条的检测结果一致,T、C线显色清晰,无明显差距,表明本方法重复性较好。

|
| 图 3 诺如病毒胶体金试纸条的批间重复试验结果 Figure 3 Inter-assay repeatability test of colloidal gold test strip for Norovirus 注:1、2、3:检测临床阳性样本;4、5、6:检测临床阴性样本. Note: 1, 2, 3: Detection of clinical positive samples; 4, 5, 6: Detection of clinical negative samples. |
|
|
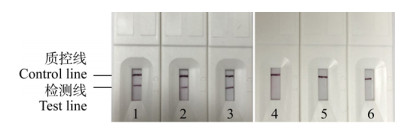
|
| 图 4 诺如病毒胶体金试纸条的批内重复试验结果 Figure 4 Intra-assay repeatability test of colloidal gold test strip for Norovirus 注:1、2、3:检测临床阳性样本;4、5、6:检测临床阴性样本. Note: 1, 2, 3: Detection of clinical positive samples; 4, 5, 6: Detection of clinical negative samples. |
|
|
结果表明37 ℃、室温存放1周、1个月、2个月、3个月T、C线显色清楚,依旧能够显示正确结果,但37 ℃存放3个月的试纸条胶体金释放速度减慢,存在释放不完全现象,但仍可指示正确结果。根据试纸条加速老化试验,37 ℃加速老化90 d相当于25 ℃存放一年,说明本方法制备的试纸条至少可以在25 ℃密封存放一年。
2.6 试纸条的应用评价同时应用已建立的胶体金试纸条检测方法和荧光定量RT-PCR法检测24份临床粪便样本,结果荧光定量RT-PCR法检出18份阳性,18份阳性样本中试纸条检出15份,3份未检出,两者的阳性符合率约为83% (15/18),试纸条检出的15份阳性样本中包括1株GII.2型、3株GII.17型以及11株GII.4型NoV,结果见表 1。
| 荧光定量RT-PCR Real-time quantitative RT-PCR |
胶体金试纸条 Colloidal gold test strip |
总计 Total |
|
| 阳性Positive | 阴性Negative | ||
| 阳性Positive | 15 | 3 | 18 |
| 阴性Negative | 0 | 6 | 6 |
| 总计Total | 15 | 9 | 24 |
NoV是全球食源性疾病和急性肠胃炎暴发的主要原因之一,严重危害人类健康[21]。NoV一年四季都有流行,感染高发期在秋冬季节,其暴发性流行多数发生在如学校、医院、邮轮等半封闭的场所,老人、儿童和一些免疫力低下者为主要易感人群,感染者会出现腹泻、脱水、呕吐等典型NoV感染的临床症状。在报道的食源性疾病暴发中,超过一半的病原体被确定为NoV[22]。快速的实验室诊断是NoV防控的重要工具。
胶体金标记抗体原理是利用一定pH值条件下带负电荷的金纳米粒子与蛋白质上带正电荷的残基之间的离子相互作用,以及蛋白质与金颗粒表面之间的疏水作用力,使蛋白质与金粒子牢牢结合,作为指示信号[23]。两者的结合主要与金颗粒的化学性质、蛋白质的生物活性、胶体金溶液的质量及标记的pH有关。在不同的pH值和不同的蛋白浓度下胶体金粒子与蛋白的结合效率不同[24-25]。一般选择用于标记的胶体金颗粒粒径在20−40 nm左右,因为20−40 nm的金颗粒较小,不易发生聚集,使用较小的金颗粒还可以降低检测时假阳性的概率。本方法建立过程中为保证可用于常见流行株的检测又控制假阳性的出现,通过降低灵敏度对方法做了一系列调整,我们选择40 nm的胶体金颗粒进行标记,标记缓冲液的pH值为8.0,为了达到最好的标记效果,采用过量法标记,抗体标记量为0.01 mg/mL。本试验的pH滴定试验并未使用传统的10% NaCl盐破坏法,由于前期试验表明盐破坏法颜色变化并不明显,所以本试验采用直接离心法,合适的pH条件下抗体与金颗粒的结合更牢固,不会出现死金颗粒和挂壁现象,通过离心后有无挂壁、死金等现象判断pH是否合适。
侧向流试纸条的材料主要包括玻璃纤维膜、硝酸纤维素膜、吸水纸和粘性PVC底板,其中PVC底板用于保证各耗材的紧密连接,吸水纸保证样品层析完全,玻璃纤维膜决定样品中杂质过滤效果,硝酸纤维素膜决定不同大小金颗粒的流速,流速直接影响抗原抗体结合时间及反应结果。在本研究的实际检测中,荧光定量检出3份阳性,试纸条未检出,其中2份病毒含量较低,低于最低检出限,1份拷贝数在本方法最低检出限以内,试纸条未检出原因可能由于粪便样本中复杂的杂质成分或pH对试纸条系统的影响。
NoV具有广泛的遗传多样性,中国大多数NoV的疫情基本都由GII.4型和GII.17型引起。基因型可以进一步分成不同的基因簇(gene cluster)或变异株,GII.4型NoV不断产生新的变异流行株,每产生一个新的流行株就会引发新一轮的全球流行[26-27]。本研究选用的两株单抗1B10、1D6与主要流行株GII.2、GII.4、GII.17以及常见的非主要流行株GII.3、GII.6有较好的反应性,并在前期试验中证明这两株单抗可作为配对抗体检测,完全满足本方法检测多样性的需求。本方法通过多次重复确定影响试验因素的各个节点的最佳条件,成功研制了特异性强、重复性好、保存期长的NoV试纸条检测方法。本研究在开始摸索中存在假阳性的情况,通过调节复溶液浓缩比例、金粒子大小、样品垫处理液成分等因素,解决了该问题。NoV检测中感染者的粪便和呕吐物常作为NoV检测的样本,但全粪便样品是用于检测NoV的优选临床标本,因为粪便样本中含有较呕吐物高的病毒滴度。然而,由于实际检测中样本中病毒含量各不相同,并且本研究所用的耗材均为常用型号,未进行优化。样本中病毒量不足时不可避免地存在一些漏检的现象。
综上所述,本研究的NoV胶体金检测试纸条经多种条件优化,能在10 min内完成样品检测,可用于几种常见NoV流行株的临床检测,具有稳定性好、保存期长、方便快捷的优点。
| [1] |
CDC, Norovirus worldwide[EB/OL]. [2018-06-01]. https://www.cdc.gov/norovirus/worldwide.html
|
| [2] |
Gray JJ, Kohli E, Ruggeri FM, et al. European multicenter evaluation of commercial enzyme immunoassays for detecting Norovirus antigen in fecal samples[J]. Clinical and Vaccine Immunology, 2007, 14(10): 1349-1355. DOI:10.1128/CVI.00214-07 |
| [3] |
Kroneman A, Vega E, Vennema H, et al. Proposal for a unified Norovirus nomenclature and genotyping[J]. Archives of Virology, 2013, 158(10): 2059-2068. DOI:10.1007/s00705-013-1708-5 |
| [4] |
Vinjé J. Advances in laboratory methods for detection and typing of Norovirus[J]. Journal of Clinical Microbiology, 2015, 53(2): 373-381. DOI:10.1128/JCM.01535-14 |
| [5] |
Xue L, Wu QP, Kou XX, et al. Complete genome analysis of a novel Norovirus GⅡ.4 variant identified in China[J]. Virus Genes, 2013, 47(2): 228-234. DOI:10.1007/s11262-013-0945-8 |
| [6] |
Xue L, Cai WC, Wu QP, et al. Comparative genome analysis of a Norovirus GⅡ.4 strain GZ2013-L10 isolated from South China[J]. Virus Genes, 2016, 52(1): 14-21. |
| [7] |
Xue L, Wu QP, Cai WC, et al. Molecular characterization of new emerging GⅡ.17 Norovirus strains from South China[J]. Infection, Genetics and Evolution, 2016, 40: 1-7. DOI:10.1016/j.meegid.2016.02.026 |
| [8] |
Mattison CP, Cardemil CV, Hall AJ. Progress on Norovirus vaccine research: public health considerations and future directions[J]. Expert Review of Vaccines, 2018, 17(9): 773-784. DOI:10.1080/14760584.2018.1510327 |
| [9] |
Verhoef L, Koopmans M, van Pelt W, et al. The estimated disease burden of Norovirus in The Netherlands[J]. Epidemiology and Infection, 2013, 141(3): 496-506. DOI:10.1017/S0950268812000799 |
| [10] |
Bean NH, Griffin PM. Foodborne disease outbreaks in the United States, 1973-1987: pathogens, vehicles, and trends[J]. Journal of Food Protection, 1990, 53(9): 804-817. DOI:10.4315/0362-028X-53.9.804 |
| [11] |
Xue L, Dong RM, Wu QP, et al. Molecular epidemiology of Noroviruses associated with sporadic gastroenteritis in Guangzhou, China, 2013-2015[J]. Archives of Virology, 2016, 161(5): 1377-1384. DOI:10.1007/s00705-016-2784-0 |
| [12] |
Xue L, Wu QP, Dong RM, et al. Genetic analysis of Noroviruses associated with sporadic gastroenteritis during winter in Guangzhou, China[J]. Foodborne Pathogens and Disease, 2013, 10(10): 888-895. DOI:10.1089/fpd.2013.1521 |
| [13] |
Xue L, Cai WC, Gao JS, et al. The resurgence of the Norovirus GⅡ.4 variant associated with sporadic gastroenteritis in the post-GⅡ.17 period in South China, 2015 to 2017[J]. BMC Infectious Diseases, 2019, 19(1): 696. |
| [14] |
Song XJ, Zhang J, Shi GQ. Epidemiological characteristics of acute gastroenteritis outbreaks caused by Norovirus in China, 2000-2013[J]. Disease Surveillance, 2017, 32(2): 127-131. (in Chinese) 宋晓佳, 张静, 施国庆. 2000-2013年我国诺如病毒感染性胃肠炎暴发流行病学特征分析[J]. 疾病监测, 2017, 32(2): 127-131. |
| [15] |
Wan Z, Huang Q, Zhang YH, et al. The estimated disease burden of Norovirus gastroenteritis in Guangzhou[J]. Chinese Journal of Disease Control & Prevention, 2016, 20(11): 1135-1138. (in Chinese) 万壮, 黄琼, 张永慧, 等. 广州市诺如病毒感染性胃肠炎疾病负担评估[J]. 中华疾病控制杂志, 2016, 20(11): 1135-1138. |
| [16] |
Xie Y, Liu YY, Yu QL, et al. Pathogenic characteristics of infectious diarrhea outbreak in a community in Hebei province[J]. Hebei Medical Journal, 2018, 40(17): 2688-2690. (in Chinese) 谢赟, 刘莹莹, 于秋丽, 等. 河北省某小区感染性腹泻暴发疫情的病原特征分析[J]. 河北医药, 2018, 40(17): 2688-2690. DOI:10.3969/j.issn.1002-7386.2018.17.033 |
| [17] |
Kou XX, Wu QP, Fan HY, et al. Detection of Norovirus in water by RT-PCR[J]. Microbiology China, 2007, 34(4): 650-653. (in Chinese) 寇晓霞, 吴清平, 范宏英, 等. 水体中诺瓦克病毒RT-PCR检测研究[J]. 微生物学通报, 2007, 34(4): 650-653. DOI:10.3969/j.issn.0253-2654.2007.04.008 |
| [18] |
Miura T, Parnaudeau S, Grodzki M, et al. Environmental detection of genogroup Ⅰ, Ⅱ, and Ⅳ Noroviruses by using a generic real-time reverse transcription-PCR assay[J]. Applied and Environmental Microbiology, 2013, 79(21): 6585-6592. DOI:10.1128/AEM.02112-13 |
| [19] |
Zhang LB, Zhang SS, Yang W, et al. Application of colloidal gold immunochromatography in food detection[J]. Agriculture of Jilin, 2018(8): 88. (in Chinese) 张来宾, 张珊珊, 杨文, 等. 胶体金免疫层析技术在食品检测中的应用[J]. 吉林农业, 2018(8): 88. |
| [20] |
Zhang L, Xue L, Gao JS, et al. Development of a high-efficient concentrated pretreatment method for Noroviruses detection in independent oysters: an extension of the ISO/TS 15216-2:2013 standard method[J]. Food Control, 2020, 111: 107032. DOI:10.1016/j.foodcont.2019.107032 |
| [21] |
Lopman BA, Steele D, Kirkwood CD, et al. The vast and varied global burden of Norovirus: prospects for prevention and control[J]. PLoS Medicine, 2016, 13(4): e1001999. DOI:10.1371/journal.pmed.1001999 |
| [22] |
Ahmed SM, Hall AJ, Robinson AE, et al. Global prevalence of Norovirus in cases of gastroenteritis: a systematic review and meta-analysis[J]. The Lancet Infectious Diseases, 2014, 14(8): 725-730. DOI:10.1016/S1473-3099(14)70767-4 |
| [23] |
Thobhani S, Attree S, Boyd R, et al. Bioconjugation and characterisation of gold colloid-labelled proteins[J]. Journal of Immunological Methods, 2010, 356(1/2): 60-69. |
| [24] |
Li JF, Zou MQ, Chen Y, et al. Gold immunochromatographic strips for enhanced detection of avian influenza and Newcastle disease viruses[J]. Analytica Chimica Acta, 2013, 782: 54-58. DOI:10.1016/j.aca.2013.04.022 |
| [25] |
Nakayama T, Zhao JZ, Takeuchi D, et al. Colloidal gold-based immunochromatographic strip test compromising optimised combinations of anti-S. suis capsular polysaccharide polyclonal antibodies for detection of Streptococcus suis[J]. Biosensors and Bioelectronics, 2014, 60: 175-179. DOI:10.1016/j.bios.2014.03.074 |
| [26] |
Chan MCW, Leung TF, Kwok AK, et al. Characteristics of patients infected with Norovirus GⅡ.4 Sydney 2012, Hong Kong, China[J]. Emerging Infectious Diseases, 2014, 20(4): 658-661. DOI:10.3201/eid2004.130564 |
| [27] |
Lu QB, Huang DD, Zhao J, et al. An increasing prevalence of recombinant GⅡ Norovirus in pediatric patients with diarrhea during 2010-2013 in China[J]. Infection, Genetics and Evolution, 2015, 31: 48-52. DOI:10.1016/j.meegid.2015.01.008 |
 2020, Vol. 47
2020, Vol. 47