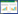扩展功能
文章信息
- 张宇婷, 聂麦茜, 尹秋月, 第五振军, 阴丹丹, 李连城, 刘洋
- ZHANG Yu-Ting, NIE Mai-Qian, YIN Qiu-Yue, DIWU Zhen-Jun, YIN Dan-Dan, LI Lian-Cheng, LIU Yang
- 荧光法快速检测活菌数的方法研究及应用
- Rapid detection of viable bacteria cells with a fluorescence-based method
- 微生物学通报, 2020, 47(8): 2652-2664
- Microbiology China, 2020, 47(8): 2652-2664
- DOI: 10.13344/j.microbiol.china.190826
-
文章历史
- 收稿日期: 2019-10-13
- 接受日期: 2020-01-08
- 网络首发日期: 2020-02-21
2. 陕西省膜分离重点实验室 陕西 西安 710055
2. Key Laboratory of Membrane Separation of Shannxi Province, Xi'an, Shaanxi 710055, China
细菌总数是国内外公认的饮用水、食品、医院及其科学研究过程中所涉及样品的卫生细菌学指标,其测定技术在食品卫生安全及疾病防治、环境监测中广泛应用。随着微生物资源开发与利用,所需检测微生物指标的样品范围和数量不断扩大。目前细菌总数检测方法主要有传统的平板菌落计数法[1]和比浊法,其操作步骤复杂,而且需培养24−48 h方能出结果,且因培养基中营养物质有限和好氧培养条件的特点,仅有一些细菌能生长而被检测到,其结果不能代表真正的细菌总数。近年来开发的新型检测技术以缩短检测时间、简化操作、降低检测成本、提高检测效率等优势而被广泛关注[2],如高光谱技术[3-5]、荧光定量PCR技术[6-7]、ATP生物发光技术[8-10]、流式细胞计数法[11-12]、3M测试片快速分析技术[13]、MTT法快速检测技术[14-15]、TTC显色法[16]、集合酶联反应技术[17-18]、介电谱技术[19-20]等。然而这些新型方法大多是通过实验室大型设备实现的,设备价格高,检测条件严格,不易实现现场快速检测。开发快速、便捷、灵敏的细菌总数检测方法具有重大的现实意义。
Calcein UltraGreen™ AM是一种疏水性化合物,可轻松通过活细胞膜,荧光染料的AM基团被活细胞中存在的细胞酯酶水解切断,在细胞内产生强荧光特性,该反应为不可逆反应,结合成功后,即使细胞死亡该荧光特性也会一直存在。然而酯酶活性与活细胞数成正比,因此,活细胞与由Calcein UltraGreen™ AM催化酯酶水解产生的荧光强度直接相关。该荧光染料的光谱特性为激发波长496 nm、发射波长524 nm,染色活动物细胞的条件为染料浓度在1−10 μmol/L、37 ℃下反应5−10 min,可以将浓度为106−108 cells/mL的活动物细胞准确染色。由于该染色条件是用于染色动物细胞,目前尚未有文献报道过应用该染料检测活菌数,因此需要建立其针对微生物细胞的探针检测条件。
本研究基于新型荧光染料Calcein UltraGreen™ AM的荧光特性及其在活细菌细胞内稳定的反应特性,并结合小型便捷式荧光仪,以开发兼有现场快速、便捷、灵敏的细菌总数检测方法为目的,研究并建立一种活细菌总数快速荧光检测法,且将方法应用于实际样品细菌总数的测定。
1 材料与方法 1.1 实验材料 1.1.1 菌株由本实验室分离并鉴定的铜绿假单胞菌NY3[21] (假单胞菌属,革兰氏阴性菌)、大肠杆菌(革兰氏阴性菌)、红平红球菌FF (革兰氏阳性菌)、芽孢杆菌(革兰氏阳性菌)、金黄色葡萄球菌(革兰氏阳性菌)、枯草芽孢杆菌(革兰氏阳性菌)。
1.1.2 培养基和试剂种子液培养基(g/L)[22]:NaCl 5.0,牛肉膏3.0,蛋白胨10.0,用蒸馏水定容至1 L,pH调节为7.8左右,1×105 Pa高压蒸汽灭菌30 min,备用。
固体培养基:1 L液体培养基中加入20 g琼脂。
无机盐培养基[23]:NH4NO3 1.0 g,1 mol/L MgSO4·7H2O 0.1 mL,1 mol/L CaCl2·2H2O 0.05 mL,磷酸盐缓冲溶液25 mL,微量元素1.0 mL (FeSO4·7H2O 4.5 g,ZnSO4·7H2O 0.148 g,MnSO4·H2O 0.258 g,CoCl2·6H2O 0.024 g,NiSO4·6H2O 0.022 g,CuCl2·2H2O 0.013 g,Na2MoO4·2H2O 0.1 g,H3BO3 0.062 g,溶于1 L蒸馏水),溶于1 L蒸馏水中,调节pH 8.0。
Tris-HCl缓冲溶液:1 mmol/L EDTA (pH 8.0)溶液与100 mmol/L Tris-HCl (pH 8.0)溶液制备缓冲液。
染料制备:将1 mg Calcein UltraGreen™ AM (AAT Bioquest®公司)溶解在330 μL二甲基亚砜(DMSO)中,制备5 mmol/L Calcein UltraGreen™ AM储备溶液。
1.1.3 主要仪器Qubit 3.0荧光定量仪,Thermo Fisher Scientific公司;流式细胞仪,碧迪医疗器械有限公司;精密pH计,上海仪电科学仪器股份有限公司;可见分光光度计,上海欣茂仪器有限公司。
1.2 荧光检测方法的建立 1.2.1 种子液的制备将铜绿假单胞菌NY3、大肠杆菌、红平红球菌FF、芽孢杆菌、金黄色葡萄球菌、枯草芽孢杆菌6种菌株分别接种于LB培养基中,于31 ℃、150 r/min摇床好氧振荡12−24 h,OD600值为1.80左右,备用。
1.2.2 菌悬液的制备取培养好的菌液10 mL,4 ℃、8 000 r/min离心15 min,弃上清液,收集细胞,用与上清液等体积的Tris-HCl溶液重悬洗涤3次,并测定OD600值。
1.2.3 细胞稀释梯度取处理后的菌悬液进行梯度稀释,稀释倍数分别为10−1、5×10−2、2.5×10−2、2×10−2、1.25×10−2、10−2、5×10−3、2.5×10−3、2×10−3、1.25×10−3、10−4、5×10−4、2.5×10−4、2×10−4、1.25×10−4、10−5、10−6、10−7、10−8。
1.2.4 染色反应的体系取重悬处理后菌悬液100 μL加到900 μL Tris-HCl溶液,再加入2 μL Calcein UltraGreen™ AM荧光染料混合均匀进行染色(染料浓度为10 μmol/L)。
1.2.5 平板计数取细菌浓度梯度为10−7、10−8、10−9倍数的菌悬液进行平板涂布。
1.3 染色条件的确定由于新型荧光染料Calcein UltraGreen™ AM用于染色活的动物细胞,尚未应用于染色活细菌的细胞,而动物细胞个体要远远大于细菌细胞个体,且两者的细胞结构也有所不同,动物细胞没有细胞壁而细菌细胞有细胞壁,所以两者的染色条件会有所不同。为更准确测定活菌数量,以FF菌为研究对象,选择对染色时间、染色温度、细胞浓度及染色pH等进行条件优化,确定Calcein UltraGreen™ AM荧光染料测定活细菌总数的反应条件。
1.3.1 染色温度、染色时间的优化取重悬处理后菌悬液(按1.2.2菌悬液的制备) 200 μL加到1 800 μL Tris-HCl溶液混合均匀制备成10−1菌悬液,再按上述稀释方法制备成10−2菌悬液,设置3组平行样,分别加入4 μL荧光染料混合均匀,染色温度为15、25、30、37 ℃,分别测定染色时间为5、10、15、20、30、45、60、75、85 min 9个时间的相对荧光强度值,讨论染色温度、染色时间对Calcein UltraGreen™ AM染色活细胞荧光强度的影响作用。
1.3.2 染色pH的优化向重悬处理后的菌沉淀中分别加入pH 6.5、7.0、7.5、8.0、8.5、9.0的Tris-HCl溶液,用移液枪吹打均匀,测其混合均匀的菌悬液pH,菌悬液的制备方法同1.2.2,稀释和染色方法同1.3.1,按照1.3.1确定的染色时间和染色温度,设置3组平行样,测定不同pH菌悬液的相对荧光强度值,讨论Tris-HCl溶液pH值对Calcein UltraGreen™ AM染色活细胞荧光强度的影响作用。
1.3.3 菌悬液OD600值与荧光值、活菌数的关系以及标准曲线的建立用Tris-HCl溶液调节重悬处理后菌悬液OD600值为0.01、0.02、0.04、0.05、0.06、0.08、0.10、0.20、0.40、0.50、0.60、0.80、1.00,菌悬液的制备方法同1.2.2,稀释和染色方法同1.3.1,平板计数同1.2.5,染色时间、染色温度和染色pH按照1.3.1和1.3.2确定的,设置3组平行样,测定不同OD600值菌悬液对应的相对荧光强度值并平板计数,确定菌悬液OD600值与相对荧光强度值、活菌数的关系曲线。对重悬处理后的菌悬液进行梯度稀释(按照1.2.2菌悬液的制备方法,按照1.2.3的细胞梯度稀释方法),对各浓度梯度菌悬液进行染色(染色反应体系同1.2.4,按照1.3确定的染色条件),设置3组平行样,测定不同稀释梯度菌悬液的相对荧光强度值和不同稀释梯度对应的活细菌数(按照1.2.5平板计数法),建立活细菌总数与相对荧光强度值的标准曲线。
1.3.4 荧光染料浓度的优化用Tris-HCl溶液调节重悬处理后菌悬液OD600值为0.052、0.101、0.202、0.477、0.806、1.191,菌悬液的制备方法同1.2.2,取处理后不同OD600值的菌悬液各500 μL,分别加入2.0、1.5、1.0、0.5、0.3、0.1 μL荧光染料混合均匀(即荧光染料浓度为20、15、10、5、3、1 μmol/L),各设置3组平行样,染色时间、染色温度和染色pH按照1.3.1和1.3.2确定的,测定不同浓度菌悬液加入不同荧光染料浓度的相对荧光强度值,讨论荧光染料浓度对Calcein UltraGreen™ AM染色活细胞荧光强度的影响作用。
1.4 细菌总数检测方法适用性评估对重悬处理后的菌悬液进行梯度稀释(按照1.2.2菌悬液制备方法,按照1.2.3的细胞梯度稀释方法),分别取各浓度梯度菌悬液100 μL加到900 μL Tris-HCl溶液,设置3组平行样,再加入2 μL Calcein UltraGreen™ AM荧光染料混合均匀进行染色(按照1.3确定的染色条件),测定不同稀释梯度菌悬液的相对荧光强度值和不同稀释梯度对应的活细菌数(按照1.2.5平板计数法),建立活细菌总数与相对荧光强度值的标准曲线。应用于革兰氏阳性菌红平红球菌FF、芽孢杆菌、金黄色葡萄球菌、枯草芽孢杆菌和革兰氏阴性菌铜绿假单胞菌NY3、大肠杆菌。
1.5 应用为验证建立荧光法的可靠性和实用性,将上述建立的染色方法应用于微生物降解油类污染物的培养液和固体菌剂发酵过程中活菌数的检测。
1.5.1 微生物降解油类污染物培养液中活菌数的检测于50 mL锥形瓶中加入16 mL无机盐培养基、2 g/L石油(从受试油污染土壤中提出)以及接种量为20%的FF菌种子液,组成石油降解体系,再加入0.5 g/L的丁二酸作为共存碳源,设置3组平行样。将降解体系置于31.5 ℃、150 r/min的恒温摇床上振荡,向生长4、6、8、10、12、24、36、48、72、96 h的降解液中加入15−20 mL石油醚将石油充分溶解,于4 ℃、10 000 r/min离心10 min,倒掉上层溶液,按照1.2.2的方法制备菌悬液,取处理好的菌悬液进行染色(染色方法同1.2.3,应用1.3确定的染色条件),测定染色后不同生长时间的菌悬液相对荧光强度值,根据1.4建立的FF菌活细菌总数与相对荧光强度值线性曲线,得出相对应的活菌数。
1.5.2 固体菌剂发酵过程中活菌数的检测称取5 g固体菌剂加到45 mL无菌水中,放入适量玻璃珠,在200 r/min振荡30 min后,静置15 min,取上清液,采用10倍稀释法将其用无菌Tris-HCl溶液稀释至浓度为10−3的菌悬液,固体菌剂中活细菌总数与相对荧光强度值的线性曲线建立方法同1.4。取稀释至浓度为10−4的菌悬液500 μL再加入1 μL Calcein UltraGreen™ AM荧光染料混合均匀进行染色,设置3组平行样,测定染色后菌悬液相对荧光强度值和平板计数(取菌悬液梯度为10−8、10−9倍数的菌悬液进行平板涂布)。
1.6 5种检测方法对实际样品中活细菌总数的比较测定以FF菌为研究对象,通过应用目前使用较多、较流行的活菌数检测方法,如平板计数法、比浊法、流式细胞法(2种染料)与本文建立的荧光法进行精密度、重复性、稳定性和回收率的对比,进一步验证建立荧光法的准确性和可靠性。
1.6.1 建立的荧光法测定用Tris-HCl溶液调节重悬处理后菌悬液OD600值为0.057、0.102、0.204、0.477 (超出仪器检测范围),菌悬液的制备方法同1.2.2,对上述不同浓度菌悬液进行染色(染色方法同1.2.4,按照1.3确定的染色条件),其中对OD600值为0.477的菌悬液稀释10倍后进行染色,各设置3组平行样,测定染色后的相对荧光强度值,应用1.3.3中建立的FF菌标准曲线得出相应活菌数。
1.6.2 平板计数法测定取1.6.1中不同OD600值的菌悬液进行10倍比稀释,各设置3组平行样,取稀释梯度为10−5、10−6、10−7的菌悬液进行平板涂布计数。
1.6.3 比浊法测定取1.6.1中不同OD600值的菌悬液各3份,应用1.3.3中建立的OD600值与活菌数的关系曲线得出相应的活菌数。
1.6.4 流式细胞法测定由于流式细胞仪的最佳检测范围数量级为103−106 CFU/mL[24],因此需要对1.6.1中不同OD600值的菌悬液稀释100倍后,分别使用Calcein UltraGreen™ AM荧光染料(染色方法同1.2.4,按照1.3确定的染色条件)和SYBR® GreenⅠ荧光染料[25] (取各浓度菌悬液495 μL加入5 μL的SYBR® GreenⅠ荧光染料混合均匀,水浴37 ℃染色10 min)进行染色,各设置3组平行样,用流式细胞仪测定染色后的活菌数,并换算为原始样品的活菌数。
1.7 方法学考察 1.7.1 精密度的测定准确吸取1.6.1中不同OD600值的菌悬液,分别按照1.6中的4种方法进行处理,然后在2 min内对同一样品液连续测定5次,计算测定结果的相对标准偏差(relative standard deviation,RSD)值。
1.7.2 重复性的测定准确吸取1.6.1中不同OD600值的菌悬液各5份,分别按照1.6中的4种方法进行处理并测定活菌数,计算测定结果的RSD值。
1.7.3 稳定性的测定准确吸取1.6.1中不同OD600值的菌悬液,分别按照1.6中的4种方法进行处理,每隔10 min测定一次,共测定6次,计算测定结果的RSD值。
1.7.4 回收率的测定准确吸取1.6.1中不同OD600值的菌悬液,以平板计数的结果作为3种浓度样品的实际活菌数,分别按照1.6中的4种方法进行处理,然后测定活菌数,并计算回收率。
2 结果与分析 2.1 染色温度、染色时间对染色效率的影响由于Calcein UltraGreen™ AM荧光染料染色活动物细胞的时间是在5−10 min,温度是在37 ℃,因此,为了确定荧光染料染色活细菌的染色条件,从而讨论染色温度和染色时间的变化对相对荧光强度值的影响,结果如图 1所示。
|
| 图 1 染色温度、染色时间对Calcein UltraGreen™ AM染色FF菌活细胞的相对荧光强度的影响作用 Figure 1 Effect of dyeing temperature and dyeing time on the relative fluorescence intensity of viable cells of bacteria FF by Calcein UltraGreen ™ AM 注:A:信号值与背景值的差值;B:背景值. Note: A: The difference between the signal value and the background value; B: The background value. |
|
|
由图 1可知,染色时间越长相对荧光强度值越大,染色时间在5−30 min范围内,4种温度条件下相对荧光强度值的增长均较平缓(斜率小),染色效果稳定,而且染色时间与相对荧光强度值呈线性相关性(R2>0.999)。当染色时间超过30 min,4种温度条件下相对荧光强度值随时间增加而增大,但“荧光强度-染色时间”曲线斜率增大,似乎提高了测定灵敏度,但由于荧光试剂在与活细胞染色完成后,荧光染料本身也开始释放荧光特性,导致相对荧光强度值开始剧增(图 1B),且染色时间与相对荧光强度值线性相关性较差,并且温度越高增加越明显,使被染色细胞自身所产的荧光受干扰,影响测定结果。染色后荧光试剂自身的荧光特性,甚至使得37 ℃、染色85 min样品溶液中相对荧光值已经超出了仪器的测定上限,染色时间在30 min以内即可。
为进一步确定该染色时间范围,另取3份细胞悬液进行染色实验。由表 1可知,染色时间越长、染色温度越高,实测的荧光强度值与用图 1A中曲线回归方程式换算的相对荧光强度值的相对标准偏差越大,说明染色时间越长,染色后荧光试剂自身荧光特性的干扰越大。
| 染色时间 Dyeing time (min) |
染色温度 Dyeing temperature (℃) |
相对荧光强度 Relative fluorescence intensity |
相对标准偏差 Relative standard deviation (%) |
|
| 实际检测值 Actual detection value |
线性方程换算 Linear equation conversion |
|||
| 20a | 15 | 3 304.66 | 3 284.52 | 0.43 |
| 25 | 4 795.76 | 4 760.93 | 0.52 | |
| 30 | 5 566.31 | 5 523.42 | 0.55 | |
| 37 | 6 701.07 | 6 622.36 | 0.84 | |
| 60b | 15 | 14 626.67 | 15 392.60 | 3.61 |
| 25 | 18 220.50 | 19 291.70 | 4.04 | |
| 30 | 21 017.40 | 22 442.60 | 4.64 | |
| 37 | 27 233.05 | 29 877.80 | 6.55 | |
| 注:a:图 1中染色时间在5−30 min时4种温度对应的染色时间与相对荧光强度值线性曲线方程;b:图 1中染色时间在30−85 min时4种温度对应的染色时间与相对荧光强度值线性曲线方程. Note: a: The linear curve equation of the dyeing time and relative fluorescence intensity values corresponding to the four temperatures when the dyeing time is 5−30 min in Figure 1; b: The linear curve equation of the dyeing time and relative fluorescence intensity values corresponding to the four temperatures when the dyeing time is 30−85 min in Figure 1. |
||||
由于细菌的细胞小于动物细胞且有细胞壁结构,为了保证能够最大限度地让荧光染料与细菌结合,同时避免染色后荧光试剂自身荧光特性的影响以及使染色效果更稳定和满足现场快速检测的需求,确定最佳染色时间范围为20−30 min,染色温度固定即可。
2.2 pH值对染色效率的影响为进一步建立细菌总数检测方法,改变染色pH值,固定染色时间为20 min,染色温度37 ℃,实验结果如图 2所示。由图 2可知,将FF菌细胞重悬于pH 8.0的Tris-HCl溶液时,染色后相对荧光强度值最大,表明染色效果最佳,测定灵敏度最高,结果也说明该染料不适于在偏酸性条件染色。

|
| 图 2 重悬FF菌的Tris-HCl溶液pH值对Calcein UltraGreen™ AM染色活细胞荧光强度的影响作用 Figure 2 Effect of pH value of Tris-HCl solution of FF strain on the fluorescence intensity of living cells stained with Calcein UltraGreen™ AM |
|
|
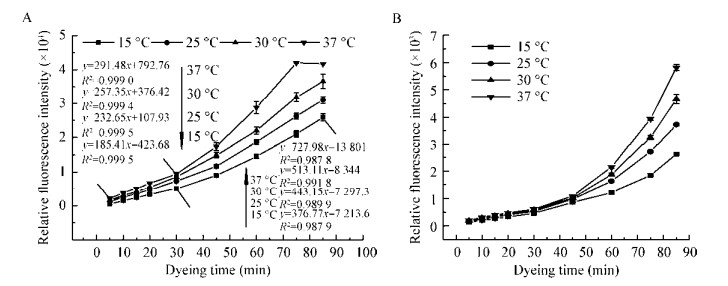
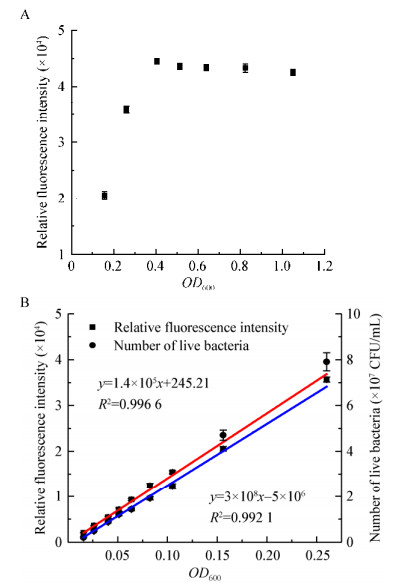
活体细菌细胞可相互作用,浓度越高相互间距离越近、相互影响越大。因此样品中细胞数量一定影响染色效果。用OD600值粗略反映细菌细胞数量,研究细胞浓度对染色效果的影响特征,重悬Tris-HCl溶液pH 8.0,固定染色时间为20 min,染色温度37 ℃,结果如图 3所示。从图 3A可知,FF菌悬液OD600值>0.30时的相对荧光强度值达到荧光定量仪检测上限,无法检测出实际相对荧光强度值,因此需要对菌悬液进行稀释。当OD600值在0.01−0.30范围时,OD600值与染色后FF菌悬液的相对荧光强度值之间呈良好线性关系(图 3B)。因此本方法适合于OD600值在0.01−0.30的样品中细菌总数的测定。
|
| 图 3 OD600值对Calcein UltraGreen™ AM染色活细胞荧光强度的影响 Figure 3 Effect of OD600 value on the fluorescence intensity of living cells stained with Calcein UltraGreen™ AM 注:A:高浓度FF菌悬液OD600值对荧光强度的影响;B:低浓度FF菌悬液的OD600值与相对荧光强度值、活菌数的线性关系. Note: A: Effect of high concentration FF suspension OD600 on fluorescence intensity; B: Linear relationship between OD600 and relative fluorescence intensity and total bacterial count of low concentration FF suspension. |
|
|
据文献可知OD600值与细菌数成正比[26],而且OD600值能在一定程度反映细菌数量,因此建立了OD600值与活菌数的线性曲线(图 3B),而OD600值与相对荧光强度值、活菌数均呈良好线性关系,因此可通过建立细菌总数-相对荧光强度的标准曲线(y=0.000 8x+475.97,R2=0.999 2)计算样品中活细菌总数。
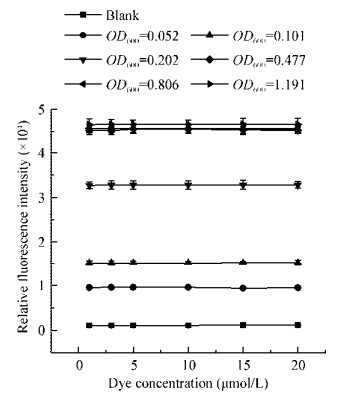
2.4 荧光染料浓度对染色效率的影响由于Calcein UltraGreen™ AM荧光染料染色活动物细胞的染料浓度为1−10 μmol/L,为进一步建立细菌总数检测方法以及讨论染料浓度对染色效率的影响,改变染料浓度和菌悬液OD600值,重悬Tris-HCl溶液pH 8.0,固定染色时间为20 min、染色温度37 ℃进行实验,结果如图 4所示。
|
| 图 4 Calcein UltraGreen™ AM染料浓度对染色FF菌活细胞的相对荧光强度的影响 Figure 4 Effect of Calcein UltraGreen™ AM concentration on the relative fluorescence intensity of stained FF live cells |
|
|
由图 4可知,随着Calcein UltraGreen™ AM染料浓度的不断增大,同一菌悬液OD600值所对应的相对荧光强度值不随染料浓度的增大而增大,说明染料浓度在1−20 μmol/L对染色效率无显著性影响;染料浓度相同时,随着菌悬液OD600值的增大,相对荧光强度值也随之增大,但当OD600值>0.30时,相对荧光强度值不随之增大,说明染料浓度的变化对高浓度菌悬液的相对荧光强度值影响不大,也同时验证了图 3A中当OD600值>0.30时的相对荧光强度值达到荧光定量仪检测上限,并非染料浓度过大造成。因此,只要固定染料浓度、染色温度和时间,即可快速检测样品中活细菌总数。
2.5 细菌总数测定方法适用性评估将上述建立的荧光检测方法应用于4株革兰氏阳性菌和2株革兰氏阴性菌活细胞检测中。按上述优化条件,细胞重悬于pH 8.0的Tris-HCl溶液,染色时间20 min,染色温度37 ℃,传统法测定的6种菌株的活菌数与相对荧光强度值的线性曲线如表 2所示。由于细菌的菌体大小和种类不同,加之所使用荧光仪具有检测上限,如图 1和图 3所示,所以针对每株菌检测范围及线性回归曲线斜率有一定差异。
| 细菌种类 Bacterial species |
菌体大小 Bacterial size (μm) |
检测上限 Detection limit (CFU/mL) |
检测下限 Detection limit (CFU/mL) |
标准曲线 Standard curve |
相关系数R2 Related system R2 |
| 金黄色葡萄球菌 Staphylococcus aureus |
Diameter 0.8 | 8.50×109 | 6.80×105 | y=3×10−6x+101.24 | 0.999 3 |
| 大肠杆菌 E. coli |
(1.1−1.5)×(2.0−6.0) | 7.06×109 | 3.53×105 | y=4×10−6x+423.97 | 0.999 1 |
| 红平红球菌FF Rhodococcus erythropolis FF |
(0.5−1.0)×23 | 1.00×108 | 1.00×105 | y=8×10−4x+475.97 | 0.999 2 |
| 铜绿假单胞菌NY3 Pseudomonas aeruginosa NY3 |
(1.5−5.0)×(0.5−1.0) | 1.08×109 | 2.70×105 | y=4×10−5x+724.97 | 0.995 8 |
| 枯草芽孢杆菌 Bacillus subtilis |
(0.5−2.5)×(1.2−10.0) | 5.03×108 | 2.01×105 | y=6×10−5x+221.07 | 0.999 0 |
| 芽孢杆菌 Bacillus |
6.15×108 | 1.23×105 | y=9×10−5x+221.29 | 0.998 5 |
由表 2可知,使用Calcein UltraGreen™ AM荧光染料染和荧光定量仪可检测105−109 CFU/mL范围内的活细菌数,而且相对荧光强度与活菌数呈良好的线性关系,6种菌株的线性相关曲线回归方程R2均大于0.99。但当活菌细胞低于105 CFU/mL时,相对荧光强度值与活细菌数无线性关系。在6种菌株中,金黄色葡萄球菌和大肠杆菌的细胞个体较小,当细菌数相同时所对应的相对荧光强度值则较小,因此,其线性回归方程斜率较小。
2.6 应用 2.6.1 微生物降解油类污染物培养液中活菌数的检测微生物代谢有机物过程常产生有机酸,研究表明,有机酸对微生物进一步降解石油烃有促进作用[27]。Nie等[28]研究发现小分子有机酸对石油烃类的降解有促进作用,而这种促进作用与细菌生长量是有相关性的。因此,本实验通过检测降解过程中的活菌数变化来判断丁二酸是否对FF菌降解油类污染物有促进作用。分别将FF菌接种于丁二酸与石油混合物为碳源和单独石油为碳源的培养液中,通过测定不同生长时间染色后FF菌悬液相对荧光强度值,再根据表 2中建立的FF菌回归方程换算得到相对应的活菌数,获得的FF菌生长曲线如图 5所示。

|
| 图 5 FF菌在不同碳源上的生长曲线 Figure 5 Growth of strain FF in cultures with different carbon source |
|
|
由图 5可知,FF菌在以丁二酸与石油的混合物为碳源时的活菌数高于其以石油为唯一碳源时的活菌数,说明丁二酸的共代谢作用极大地促进了FF菌在石油上的生长速率(活菌数最多),因此丁二酸对FF菌降解油类污染物是有促进作用的,这与Nie等[28]的研究结果一致。
微生物降解过程中对活细菌总数的检测是必不可少的,但目前活菌数的传统检测方法(如平板计数法)操作过程复杂,获得结果时间较长;比浊法结果粗略无法得知准确的活菌数,而且该油类污染物的降解液为黑色或其他有色溶液,溶液颜色对结果影响较大,无法直接使用比浊法(OD600值),而利用上述建立的荧光法,检测过程简单,检测时间缩短,能在30 min内得知结果,使得实验过程更加简捷,实用性更强。
2.6.2 固体菌剂发酵过程中活菌数的检测各种固体菌剂被广泛应用于环境治理、农业堆肥及其发酵中,在需要掌握固体菌剂发酵的成熟程度时,可以使用本文建立的方法,通过测定发酵过程中活菌数的变化趋势来判断。表 3是上述FF菌和其他菌株复合发酵(以麦麸为载体)过程中,随着成熟程度变化对固体菌剂中细菌数量的测定结果。由于是敞开体系的复合微生物发酵,因此,需要首先建立测定标准曲线。以Tris-HCl溶液为空白,得到活菌数-相对荧光强度值的线性曲线y=0.000 6x+ 306.42 (R2=0.999 7)。从测定结果明显看出,发酵时间越长,测定的相对荧光强度值则越大,说明活细菌数越多。固体菌剂发酵5 d活细菌总数由4.78×109 CFU/g增长到1.50×1010 CFU/g,当相对荧光强度无明显增长时,则可以判断已发酵成熟。由表 3可知,荧光法与平板计数法检测固体菌剂中活菌数结果一致,相对标准偏差在5%以内,而且荧光法测定活细菌数高于平板计数法,是因为平板计数所用的培养基并不适用于固体菌剂中所有细菌的生长,比如一些厌氧菌、放线菌等,而荧光法可以染色所有细菌,能够更加准确地反映活细菌的真实数量。
| 发酵天数 Fermentation days (d) |
活细菌数 Number of live bacteria (CFU/g) |
相对标准偏差 Relative standard deviation (%) |
|
| 荧光法 Fluorescence method |
平板计数法 Plate counting method |
||
| 1 | 4.78×109 | 4.47×109 | 4.73 |
| 2 | 6.53×109 | 6.19×109 | 3.82 |
| 3 | 1.07×1010 | 1.01×1010 | 4.24 |
| 4 | 1.26×1010 | 1.24×1010 | 0.87 |
| 5 | 1.50×1010 | 1.48×1010 | 1.19 |
活菌数的传统检测方法包括平板计数法和比浊法,也是目前微生物实验室中应用最为广泛的检测方法,通过应用建立的FF菌相对荧光强度值与活菌数的标准曲线(图 4)、OD600值与活菌数的线性曲线(图 3B)、流式细胞计数法与传统法所得结果的对比,来验证建立荧光法的准确性和可靠性,实验结果如表 4所示。
| 方法 Methods |
活菌数 Number of live bacteria (×107 CFU/mL) |
精密度 Precision RSD (%) |
重复性 Repeatability RSD (%) |
稳定性 Stability RSD (%) |
回收率 Recovery rate RSD (%) |
|||
| OD600=0.057 | OD600=0.102 | OD600=0.204 | OD600=0.477 | |||||
| 荧光法 Fluorescence method |
1.21±0.018b | 2.10±0.016c | 4.21±0.018b | 12.1±0.100c | 0.64e | 0.72e | 4.73c | 101.50±0.01c |
| 比浊法 Turbidimetric method |
1.16±0.105c | 2.79±0.204a | 5.59±0.167a | 14.0±0.208a | 6.41a | 4.9 b | 3.46d | 121.09±0.23a |
| 平板计数法 Plate counting method |
1.20±0.015b | 2.08±0.045c | 4.19±0.060b | 11.9±0.100c | 4.63c | 1.61d | 1.42e | 100.27±0.01c |
| 流式细胞法™ Flow cytometry method™ |
1.10±0.017d | 1.91±0.012d | 4.06±0.011c | 11.4±0.851d | 2.46d | 2.88 c | 5.44b | 94.17±0.05d |
| 流式细胞法® Flow cytometry method® |
1.54±0.212a | 2.33±0.326b | 3.97±0.518d | 12.6±0.658b | 5.35b | 11.35a | 12.57a | 112.23±0.15b |
| 注:™:用Calcein UltraGreen™ AM荧光染料染色;®:用SYBR® GreenⅠ荧光染料染色;表中不同字母表示差异性显著(P<0.05);差异性分析为相关指标同一列数据之间的比较. Note: ™: Stained with Calcein UltraGreen™ AM fluorescent dye; ®: Stained with SYBR® GreenⅠ fluorescent dye; Different letters in the table indicate significant differences (P<0.05); The difference analysis is the comparison between related indicators in the same column of data. |
||||||||
由表 4可知,5种测定方法中建立的荧光法与平板计数法对不同浓度、同一样品测得的活菌数没有显著性差异,而其他3种测定方法均有显著性差异(P<0.05),说明建立的荧光法具有较高的准确性;而流式细胞法较比浊法的准确性更好,且流式细胞法™比流式细胞法®的准确性更好,说明SYBR® GreenⅠ荧光染料的辨识度比本文所用Calcein UltraGreen™ AM荧光染料辨识度差。
方法学分析结果如表 4所示,5种测定方法中仅有荧光法精密度的RSD值小于1%,说明本文所用荧光定量仪的精密度较好,而比浊法的仪器精密度较差,流式细胞法的仪器精密度良好,且Calcein UltraGreen™ AM荧光染料比SYBR® GreenⅠ荧光染料的精密度要好;5种测定方法中荧光法、比浊法、流式细胞法™和平板计数法重复性的RSD值小于5%,在误差允许范围内,说明有较好的重现性,而流式细胞法®重现性较差,说明使用Calcein UltraGreen™ AM荧光染料比SYBR® GreenⅠ荧光染料的重复性较好;平板计数法在1 h内的稳定性最好,RSD值仅为1.63%,流式细胞法在1 h内的稳定性最差,其中使用SYBR® GreenⅠ荧光染料的RSD值可达到12.57%,而荧光法在30 min内的RSD值为1.33%,说明荧光法在30 min内基本稳定,且避免了图 1B中因为荧光染料自身释放荧光特性所产生的误差,因此在使用时要固定染色时间;5种检测方法的回收率结果显示,荧光法与平板计数法之间无显著性差异,说明荧光法的准确度更高。
综合表 4中5种测定方法的精密度、重复性、稳定性和回收率的相对标准偏差(RSD)值分析可知,在误差允许范围内,本文建立的荧光法较其他4种测定方法的结果更加准确、重现性更好、稳定性更高。
3 讨论与结论本研究建立了一种快速、简捷的荧光检测活细菌总数法,为了满足现场检测需求,该检测方法当染料浓度在1−20 μmol/L,仅需固定染色温度,染色时间范围20−30 min,以Tris-HCl (pH 8.0)溶液为空白,建立待测样品的相对荧光强度值与活菌数的线性曲线,即可进行活菌数快速检测。所用荧光定量仪适用于检测活菌数浓度在105−109 CFU/mL的菌悬液,建立的荧光检测方法在菌悬液OD600值为0.01−0.30的范围内,对于2种革兰氏阴性菌和4种革兰氏阳性菌都具有很好的适用性。通过建立的细菌总数-相对荧光强度线性曲线,可用于算出活细菌总数,从而控制接种量,使得实验的重复性更好。
将建立的荧光检测方法应用于FF菌降解石油过程中活菌数的检测,可以快速准确地获得降解过程中活菌数及其变化趋势,比传统检测方法更加准确简捷,实用性更高。将建立的荧光检测方法应用于固体菌剂发酵,能够快速、准确地检测固体菌剂发酵过程中活细菌总数,从而监测固体菌剂发酵过程是否成熟。
微生物发酵过程所接种的细菌细胞数量对于发酵过程的重现、稳定性、产品收获时间及其产品产量都是至关重要的[29],其他有关微生物实验研究中,也常需明确活细胞数量[30-31],因此,针对某待研究的纯种菌可如表 2所示,首先建立回归方程,用待测菌悬液染色后的相对荧光强度进行计算,可获得比使用OD600值(或其他纳米下)更准确、更快的活细菌数量(在30 min内)。
通过应用5种测定方法对实际样品中活菌数的检测对比,建立的荧光法检测结果更接近于平板计数法的检测结果,而且重复性、稳定性和准确性更好。
在世界范围内,活细菌数是食品、饮品、化妆品、环境及其医疗过程等[32-35]所涉及到的各种样品的一项必测指标,大多情况下需快检,且这种情况下所遇到的样品中微生物并非纯菌株。目前对于活菌数的荧光检测方法应用较多的是ATP荧光法和流式细胞计数法(flow cytometry,FC),但都存在一定的局限性。ATP荧光法的关键物质是萤火虫荧光素酶,而该酶对温度要求极高,当温度超过25 ℃时会影响酶活性,从而使得检测结果偏低,如若高温时间过长会直接导致检测失败[36]。流式细胞计数法的操作过程复杂,仪器参数设置较多,需要对样品进行预处理,检测成本高且无法满足现场快速检测的要求[37]。然而使用本文建立的方法时,受温度影响较小,无需对样品培养,直接原位染色,可实现快检。但是,该方法需要用实际样品中的微生物制作标准曲线。如若实际样品为液体且活菌数较低,浓缩后直接用无菌水稀释并染色,建立与表 2相似的标准曲线,然后进行测定和计算。当实际样品为固体时,将其中的活细菌释放于无菌水中,同样建立标准曲线,可实现活菌数的测定。由于同一种样品中细菌种群类似,因此,这样的标准曲线可提前制作,从而实现快检。
| [1] |
National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 4789.2-2016 National food safety standard microbiological inspection of foods Determination of total colonies[S]. Beijing: China Standard Press, 2016 (in Chinese) 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定[S].北京: 中国标准出版社, 2016 |
| [2] |
Zhou J, Yin JJ, Hou YZ, et al. Development of methods for rapid detection technology of total bacteria in food[J]. Food Research and Development, 2010, 31(12): 276-280. (in Chinese) 周钧, 尹建军, 侯玉柱, 等. 食品中细菌总数快速检测技术的研究进展[J]. 食品研究与开发, 2010, 31(12): 276-280. |
| [3] |
Wei J, Guo ZH, Xu J. Measurement of total viable count on chilled mutton surface based on hyperspectral technique and extreme learning machine[J]. Jiangsu Agricultural Sciences, 2018, 46(24): 211-214. (in Chinese) 魏菁, 郭中华, 徐静. 基于高光谱和极限学习机的冷却羊肉表面细菌总数检测[J]. 江苏农业科学, 2018, 46(24): 211-214. |
| [4] |
Wang W, Peng YK, Zhang XL. Study on modeling method of total viable count of fresh pork meat based on hyperspectral imaging system[J]. Spectroscopy and Spectral Analysis, 2010, 30(2): 411-415. (in Chinese) 王伟, 彭彦昆, 张晓莉. 基于高光谱成像的生鲜猪肉细菌总数预测建模方法研究[J]. 光谱学与光谱分析, 2010, 30(2): 411-415. |
| [5] |
Barbin DF, ElMasry G, Sun DW, et al. Non-destructive assessment of microbial contamination in porcine meat using NIR hyperspectral imaging[J]. Innovative Food Science & Emerging Technologies, 2013, 17: 180-191. |
| [6] |
Liu YY. Establishment of real-time PCR methods for detection of total bacteria in raw milk[D]. Changchun: Master's Thesis of Jilin University, 2014 (in Chinese) 刘艳艳.鲜乳细菌总数荧光定量PCR检测方法的建立[D].长春: 吉林大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10183-1014297606.htm |
| [7] |
Kim J, Lim J, Lee C. Quantitative real-time PCR approaches for microbial community studies in wastewater treatment systems: applications and considerations[J]. Biotechnology Advances, 2013, 31(8): 1358-1373. |
| [8] |
Paciello L, Falco FC, Landi C, et al. Strengths and weaknesses in the determination of Saccharomyces cerevisiae cell viability by ATP-based bioluminescence assay[J]. Enzyme and Microbial Technology, 2013, 52(3): 157-162. |
| [9] |
Gao HG, Peng F, Yu LL, et al. Application of ATP bioluminescence assay in rapid detection of total bacterial count in drinking water[J]. Occupation and Health, 2014, 30(10): 1325-1327. (in Chinese) 高红阁, 彭芳, 俞玲玲, 等. ATP生物发光法在快速检测饮用水菌落总数中的应用[J]. 职业与健康, 2014, 30(10): 1325-1327. |
| [10] |
Whiteley GS, Derry C, Glasbey T, et al. The perennial problem of variability in adenosine triphosphate (ATP) tests for hygiene monitoring within healthcare settings[J]. Infection Control & Hospital Epidemiology, 2015, 36(6): 658-663. |
| [11] |
Du JM. Comparison of real-time fluorescent quantitative PCR with urine flow cytometry UF-1000i bacteria count[D]. Taiyuan: Master's Thesis of Shanxi Medical University, 2018 (in Chinese) 杜建明.实时荧光定量PCR法与尿液流式细胞仪UF-1000i尿液细菌计数的比较研究[D].太原: 山西医科大学硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10114-1018961398.htm |
| [12] |
Zheng XL, Xiong ZQ, Wu JQ. The use of a simple flow cytometry method for rapid detection of spores in probiotic Bacillus licheniformis-containing tablets[J]. Food Science and Biotechnology, 2017, 26(1): 167-171. |
| [13] |
Hauge SJ, Østensvik Ø, Monshaugen M, et al. Enumeration of Escherichia coli in swab samples from pre- and post-chilled pork and lamb carcasses using 3M™ Petrifilm™ Select E. coli and Simplate® Coliforms/E. coli[J]. Meat Science, 2017, 130: 26-29. |
| [14] |
Wu YH, Tan SH, Fan CC, et al. Analysis of influencing factors on the bacterial cell counting with the MTT method[J]. Journal of Microbiology, 2011, 31(3): 67-72. (in Chinese) 吴窈画, 谈书华, 范超超, 等. MTT法检测细菌细胞数的主要影响因素分析[J]. 微生物学杂志, 2011, 31(3): 67-72. |
| [15] |
Grela E, Kozłowska J, Grabowiecka A. Current methodology of MTT assay in bacteria-A review[J]. Acta Histochemica, 2018, 120(4): 303-311. |
| [16] |
Wang XW, Zhang JW. Research on TTC application of the determination of the food aerobic plate count[J]. Journal of Liaoning University (Natural Science Edition), 2011, 38(1): 86-89. (in Chinese) 王晓文, 张俊伟. TTC应用于食品菌落总数测定的研究[J]. 辽宁大学学报:自然科学版, 2011, 38(1): 86-89. |
| [17] |
Wang D, Liu JH, Shi YY, et al. Establishment of PCR-ELISA method for detection of Escherichia coli O157:H7[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(6): 128-131. (in Chinese) 王丹, 刘金华, 史艳宇, 等. 大肠杆菌O157:H7 PCR-ELISA检测方法的建立[J]. 黑龙江畜牧兽医, 2014(6): 128-131. |
| [18] |
Youmans BP, Ajami NJ, Jiang ZD, et al. Development and accuracy of quantitative real-time polymerase chain reaction assays for detection and quantification of enterotoxigenic Escherichia coli (ETEC) heat labile and heat stable toxin genes in travelers' diarrhea samples[J]. The American Journal of Tropical Medicine and Hygiene, 2014, 90(1): 124-132. |
| [19] |
Zhu ZZ, Zhu XH, Kong FR, et al. A rapid method on identifying disqualified raw goat's milk based on total bacterial count by using dielectric spectra[J]. Journal of Food Engineering, 2018, 239: 40-51. |
| [20] |
Zhu ZZ, Zhu XH, Kong FR, et al. Quantitatively determining the total bacterial count of raw goat milk using dielectric spectra[J]. Journal of Dairy Science, 2019, 102(9): 7895-7903. |
| [21] |
Nie MQ, Yin XH, Ren CY, et al. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3[J]. Biotechnology Advances, 2010, 28(5): 635-643. |
| [22] |
Zhang B, Nie MQ, Nie HY, et al. The effects of pyocyanin on alkanes degradation by Pseudomonas aeruginosa NY3[J]. China Environmental Science, 2019, 39(7): 3088-3093. (in Chinese) 张波, 聂麦茜, 聂红云, 等. 绿脓菌素促进铜绿假单胞菌NY3降解烃的作用机制[J]. 中国环境科学, 2019, 39(7): 3088-3093. |
| [23] |
Nie HY. Studies on characteristics of the secretion of extracellular small active compounds by P. aeruginosa NY3 and their promotion mechanisms to the efficiency of biodegradation of hydrocarbon[D]. Xi'an: Doctoral Dissertation of Xi'an University of Architecture and Technology, 2017 (in Chinese) 聂红云.铜绿假单胞菌NY3胞外小分子活性物及其促进烃类降解的作用机制研究[D].西安: 西安建筑科技大学博士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10703-1017737334.htm |
| [24] |
Mei SL. Study on total plate count detection in bean products by flow cytometry[D]. Shanghai: Master's Thesis of Shanghai Normal University, 2019 (in Chinese) 梅仕良.豆制品中菌落总数的流式细胞术检测研究[D].上海: 上海师范大学硕士学位论文, 2019 http://cdmd.cnki.com.cn/Article/CDMD-10270-1019099531.htm |
| [25] |
Prest EI, Hammes F, Kötzsch S, et al. Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method[J]. Water Research, 2013, 47(19): 7131-7142. |
| [26] |
Wang J, Wang JX, Lin H, et al. Rapid detection of total bacterial number using NADH fluorescence method[J]. Microbiology China, 2009, 36(5): 773-779. (in Chinese) 王晶, 王静雪, 林洪, 等. NADH荧光法快速检测细菌总数[J]. 微生物学通报, 2009, 36(5): 773-779. |
| [27] |
Kazunga C, Aitken MD. Products from the incomplete metabolism of pyrene by polycyclic aromatic hydrocarbon-degrading bacteria[J]. Applied and Environmental Microbiology, 2000, 66(5): 1917-1922. |
| [28] |
Nie HY, Nie MQ, Xiao T, et al. Hexadecane degradation of Pseudomonas aeruginosa NY3 promoted by glutaric acid[J]. Science of the Total Environment, 2017, 575: 1423-1428. |
| [29] |
Hu GP, Shi XP, Guan BF, et al. Preparation and stability determination of bifenthrin degrading microbial inoculants[J]. Jiangsu Agricultural Sciences, 2017, 45(19): 257-260. (in Chinese) 胡桂萍, 石旭平, 管帮富, 等. 降解联苯菊酯微生物菌剂的制备及其稳定性测定[J]. 江苏农业科学, 2017, 45(19): 257-260. |
| [30] |
Yang YD, Wang ZM, Zeng ZH. Effects of long-term fertilization and irrigation on soil bacterial quantity, diversity and community structure[J]. Chinese Journal of Agricultural Sciences, 2018, 51(2): 290-301. (in Chinese) 杨亚东, 王志敏, 曾昭海. 长期施肥和灌溉对土壤细菌数量、多样性和群落结构的影响[J]. 中国农业科学, 2018, 51(2): 290-301. |
| [31] |
Luo LX, Liu H, Pei TQ, et al. Extracellular polymer, bacteria quantity and microbial community structure under membrane pollution[J]. Environmental Pollution & Control, 2014, 36(5): 59-63, 69. (in Chinese) 骆灵喜, 刘欢, 裴廷权, 等. 膜污染状态下的胞外聚合物、细菌数量及微生物群落结构研究[J]. 环境污染与防治, 2014, 36(5): 59-63, 69. |
| [32] |
Li L. Study on the actual situation of bacteria inspection in canned food[J]. Guide to Food Safety, 2019(36): 57. (in Chinese) 李丽. 罐头食品中细菌检验实况研究[J]. 食品安全导刊, 2019(36): 57. |
| [33] |
Chi SH. Determination of total bacteria in cosmetics[J]. Chemical Engineering Design Newsletter, 2019, 45(4): 55-156. (in Chinese) 迟双会. 化妆品中细菌总数的测定[J]. 化工设计通讯, 2019, 45(4): 155-156. |
| [34] |
Zhao YP. Determination of total bacteria in water[J]. Journal of Taiyuan Teachers College (Natural Science Edition), 2010, 9(4): 139-142. (in Chinese) 赵跃萍. 水中细菌总数的测定[J]. 太原师范学院学报(自然科学版), 2010, 9(4): 139-142. |
| [35] |
Zhang Y. Effects of intraoperative personnel flow on the number of bacteria in the air and wound infection in laminar flow clean operating room[J]. Nursing Practice and Research, 2019, 16(4): 115-118. (in Chinese) 张颖. 层流洁净手术室术中人员流动量对空气中细菌数及切口感染的影响[J]. 护理实践与研究, 2019, 16(4): 115-118. |
| [36] |
Zhang B, Liu Y, Li DY, et al. Application and limitation of ATP fluorescence method in the field of health[J]. Agricultural Processing, 2019(15): 74-77. (in Chinese) 张博, 刘阳, 李大玉, 等. ATP荧光法在卫生领域的应用及局限性[J]. 农产品加工, 2019(15): 74-77. |
| [37] |
Rybakowska P, Alarcón-Riquelme ME, Marañón C. Key steps and methods in the experimental design and data analysis of highly multi-parametric flow and mass cytometry[J]. Computational and Structural Biotechnology Journal, 2020, 18: 874-886. |
 2020, Vol. 47
2020, Vol. 47