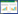扩展功能
文章信息
- 张新杰, 刘彦策, 钱欣雨, 肖生林, 于波, 董金皋, 郝志敏
- ZHANG Xin-Jie, LIU Yan-Ce, QIAN Xin-Yu, XIAO Sheng-Lin, YU Bo, DONG Jin-Gao, HAO Zhi-Min
- 弯曲平脐蠕孢拮抗细菌的筛选、鉴定及拮抗作用
- Isolation, identification and characterization of an antagonistic bacterium against Bipolaris papendorfii
- 微生物学通报, 2020, 47(8): 2417-2424
- Microbiology China, 2020, 47(8): 2417-2424
- DOI: 10.13344/j.microbiol.china.200173
-
文章历史
- 收稿日期: 2020-03-01
- 接受日期: 2020-04-24
- 网络首发日期: 2020-05-21
2. 河北农业大学植物保护学院 河北 保定 071001
2. College of Plant Protection, Hebei Agricultural University, Baoding, Hebei 071001, China
植物病害是降低农业生产能力的主要因素之一[1]。平脐蠕孢属(Bipolaris)真菌能引起许多禾本科植物的严重病害,导致叶斑、根腐、穗腐、种子变色、霉变等,造成巨大的经济损失;除引起植物病害外,其个别种类能够引起人或动物的病害[2-3]。弯曲平脐蠕孢是平脐蠕孢属真菌的一种,主要引起玉米弯孢叶斑病[4]。
作为世界三大谷类作物之一,玉米(Zea mays L.)在世界农业生产中占有举足轻重的作用,可以粮饲兼用。玉米是我国三大粮食品种之一,在玉米生产中,病虫害等多种因素严重制约着玉米的产量和品质。玉米病害已成为我国玉米种植业减产、减收的最主要问题,严重影响着玉米的产量[5]。玉米弯孢叶斑病是近年来发生在我国玉米生产上的一种新型病害[6]。该病发生在玉米成株期,主要危害叶片,有时也危害叶鞘和苞叶[7],是突发性病害,蔓延迅速,严重时叶部病斑密集成片,重病地块病株率及病叶率高达50%,已成为我国玉米产区的重要病害之一[8-9]。17世纪70–80年代我国出现有关玉米弯孢叶斑病的描述性记载,1956年国外出现该病发生的报道[10]。20世纪90年代以来,玉米弯孢叶斑病先后在辽宁、河南、河北、山东等多省暴发流行,造成严重玉米产量损失[11]。作为引起玉米弯孢叶斑病的主要病原,弯曲平脐蠕孢的防治迫在眉睫[12]。
由于化学杀菌剂引起的植物病原真菌耐药性增强,以及农药残留产生的环境污染等问题,农业病害的生物防治逐渐成为国内外研究的热点[13-16]。细菌由于种类多、分布广、繁殖速度快、易于人工培养扩繁、对植物的微生态比较适宜、既能防病又能促进植物生长等特点,成为生物防治的理想工具[17-18]。
目前成功应用于植物病害防治的生防细菌主要来自芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas);此外,沙雷氏菌属(Serratia)、土壤杆菌属(Agrobacterium)和巴氏杆菌属(Pasteuria)也常用作生防菌[17, 19-20]。例如,芽孢杆菌(Bacillus subtilis) A13菌系表现出对多种植物病原菌的抑菌效果,并且促进燕麦、胡萝卜和花生高效增产;芽孢杆菌Rb2和Rb6菌液浸种处理,对小麦苗期纹枯病表现出较高防效,其代谢产物浸种防效可达70%[18]。枯草芽孢杆菌B916发酵液对水稻纹枯病的防效可高达80%[21]。生防细菌在防治植物病害、提高农业产量方面获得了显著成就。
本研究从玉米田地表下土壤分离获得22株细菌菌株,通过平板对峙法从中筛选出一株对玉米弯孢叶斑病具有较高拮抗活性的菌株L-14,并对其抑菌机理进行了初步研究,以期获得该菌株的基本信息,丰富玉米叶斑病的生物防治资源,为新型抗菌药物的研究奠定理论基础,并为其实际应用提供基础平台。
1 材料与方法 1.1 供试菌株弯曲平脐蠕孢(Bipolaris papendorfii)、层出镰孢(Fusarium proliferatum)、禾谷镰孢(Fusarium graminearum)、灰葡萄孢(Botrytis cinerea)、大斑凸脐蠕孢(Exserohilum turcicum)均由本实验室保存。
1.2 培养基LB培养基(g/L):胰化蛋白胨10.0,酵母提取物5.0,NaCl 10.0,pH 7.0。1×105 Pa高压灭菌20 min,用于后续拮抗细菌的发酵。
PDA培养基(g/L):葡萄糖20.0,土豆200.0,琼脂糖13.0。1×105 Pa高压灭菌20 min,用于弯曲平脐蠕孢的培养。
1.3 主要试剂和仪器基因组DNA提取试剂盒,天根生化科技(北京)有限公司;2×PCR Mix,北京擎科生物技术有限公司;细菌理化性质检测试剂条,生工生物工程(上海)股份有限公司。PCR仪、凝胶成像系统,Bio-Rad公司;电泳仪EPS 300,上海天能科技有限公司;超净工作台,北京半导体设备一厂。
1.4 菌株的分离采取稀释法,将玉米田地表以下5-25 cm处土壤样品(1 g)用无菌水(10 mL)制备土壤稀释液(1 g/10 mL),分10倍浓度梯度涂布于LB固体培养基上,室温培养2 d。根据菌落形态,挑取不同类型单菌落在相同培养基平板上进行划线培养并纯化菌株。
1.5 弯曲平脐蠕孢拮抗菌株的筛选根据平板对峙法[22],将弯曲平脐蠕孢菌盘接种在PDA固体培养基中心,距离菌盘3 cm处接种已纯化的细菌,25 ℃黑暗连续培养15 d,观察抑菌效果。
1.6 拮抗细菌形态观察及生理生化特性分析对细菌菌落形态大小、菌落表面光泽、凹凸度、菌落边缘平整性以及透明度进行观察;通过结晶紫染色法对菌体及芽孢进行形态学观察。参照《常见细菌系统鉴定手册》[23]对菌株进行生理生化性质测定。
1.7 拮抗细菌16S rRNA基因检测采用SDS-CTAB法提取细菌基因组DNA[24]。以细菌基因组DNA为模板,通过PCR扩增菌株的16S rRNA基因,所用引物为27F (5′-AGAGTT TGATCCTGGCTCAG-3′)和1492R (5′-CTACGGC TACCTTGTTACGA-3′)。PCR反应体系(50 μL):27F (10 μmol/L) 1 μL,1492R (10 μmol/L) 1 μL,DNA模板2 μL,2×PCR Mix 25 μL,dd H2O 21 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1.5 min,共34个循环;72 ℃ 15 min,16 ℃ 10 min。
PCR扩增产物经纯化后送生工生物工程(上海)股份有限公司测序。将所测得的16S rRNA基因序列在GenBank数据库中,通过核酸BLASTn相似性比对,通过MEGA 5.0软件进行DNA多序列同源性分析,采用邻接法(neighbor-joining method)构建系统发育进化树,确定菌株的分类地位[25]。
1.8 拮抗细菌生长曲线的测定挑取单克隆接种于20 mL/50 mL LB培养液中,37 ℃、200 r/min振荡培养12 h后获得种子液。将菌株种子液按2%的接种量扩大培养至50 mL/250 mL基础培养液中,37 ℃、200 r/min继续振荡培养,每隔2 h取出2 mL菌液检测OD600吸光度。平行设置3组试验,获取数据后绘制菌株的生长曲线。
1.9 拮抗细菌对弯曲平脐蠕孢菌丝形态的影响采用平板对峙法,25 ℃恒温培养箱内将菌株与弯曲平脐蠕孢对峙培养,15 d后分别挑取抑菌圈边缘基内菌丝和气生菌丝进行显微观察。试验设置3个重复。
1.10 拮抗细菌对弯曲平脐蠕孢孢子萌发的影响取培养15 d的弯曲平脐蠕孢,向平皿中加入5.0 mL的无菌水,去尖枪头刮取病菌分生孢子制备孢悬液。取灭菌的凹玻片,加入弯曲平脐蠕孢孢悬液与细菌发酵粗提液以等体积混合制备混合液,以只加弯曲平脐蠕孢孢悬液为对照,25 ℃孵育4 h,观察孢子萌发情况。
1.11 拮抗细菌的抗菌谱测定通过平板对峙法,将筛选得到的14号菌株与直径为8 mm的供试植物病原真菌进行对峙培养,25 ℃恒温孵箱连续培养15 d后观察抑菌效果。每组试验均设置3次重复。
2 结果与分析 2.1 弯曲平脐蠕孢拮抗细菌的筛选从土壤中分离到22株细菌,通过平板对峙法检测每株菌对弯曲平脐蠕孢菌(B. papendorfii)的拮抗作用,发现菌株L-14对弯曲平脐蠕孢菌具有较明显的抑菌效果(图 1)。

|
| 图 1 弯曲平脐蠕孢菌与拮抗细菌的对峙培养 Figure 1 Screening of antagonistic bacteria against Bipolaris papendorfii |
|
|
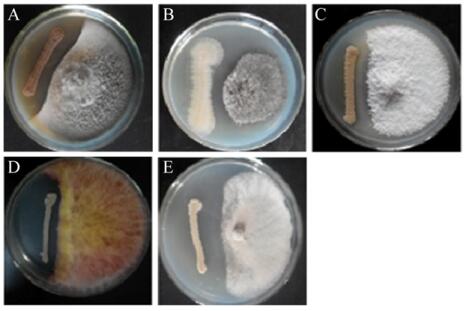
利用平板对峙法,发现菌株L-14具有较广的抗菌谱,表现出对层出镰孢(F. proliferatum)、大斑凸脐蠕孢(E. turcicum)、禾谷镰孢(F. graminearum)、弯曲平脐蠕孢菌(B. papendorfii)和灰霉病菌(B. cinerea)等5种植物病原真菌均有强烈的拮抗作用(图 2)。
|
| 图 2 菌株L-14的抗菌谱检测 Figure 2 Detection of antibacterial spectrum of strain L-14 注:A-E:弯曲平脐蠕孢菌、大斑凸脐蠕孢、层出镰孢、禾谷镰孢、灰霉病菌. Note: A-E: Bipolaris papendorfii, Exserohilum turcicum, Fusarium proliferatum, Fusarium graminearum, Botrytis cinerea. |
|
|
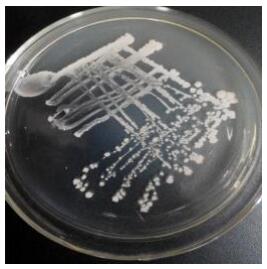
菌株L-14在LB固体培养基上呈现有光泽的白色菌落,菌落隆起但不明显,表面干燥且边缘不规则(图 3)。结晶紫染色表明其菌体呈直杆状,圆形芽孢,芽孢中生。因此,根据菌落形态初步鉴定菌株L-14为芽孢杆菌属(Bacillus sp.)。
|
| 图 3 菌株L-14的菌体形态 Figure 3 Morphological characteristics of strain L-14 |
|
|
参照《常见细菌系统鉴定手册》[23]鉴定方法,对菌株L-14进行生理生化鉴定,结果显示该菌株淀粉水解、明胶液化、柠檬酸盐利用、过氧化氢还原酶、V.P.测定等为阳性,与枯草芽孢杆菌具有相同的生理生化特性(表 1)。
| 测定指标Index | 菌株特性Characteristics |
| 淀粉水解Amylohydrolysis | + |
| 明胶液化Gelatin liquefaction | + |
| 油脂水解Oilhydrolysis | - |
| 吲哚产生Indole production | - |
| 柠檬酸盐利用Usage of citrate | + |
| 过氧化氢还原酶Hydrogen peroxide reductive enzyme | + |
| 甲基红Methyl red | - |
| V.P.测定VP reaction | + |
| 纤维素分解Cellulose decomposing | - |
| 分解葡萄糖Decomposition of glucose | + |
| 产酸Acid production | + |
| 产气Gas production | - |
| 注:+:阳性;-:阴性.Note: +: Positive; -: Negative. | |
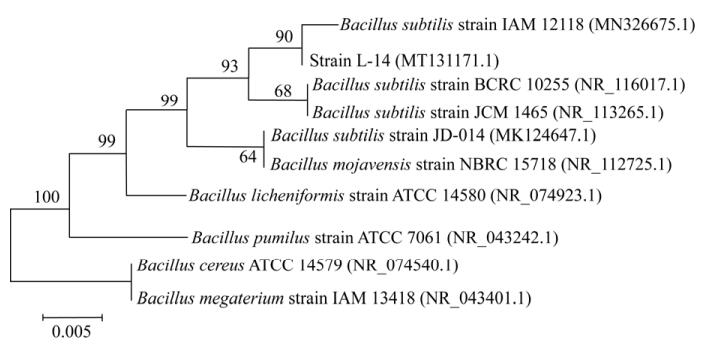
将菌株L-14的16S rRNA基因测序结果提交GenBank,获得登录号为MT131171,序列长度为1 417 bp。在NCBI数据库中对菌株16S rRNA基因序列进行BLASTn比对,比对结果显示菌株L-14与编号为ATCC 6633的枯草芽孢杆菌序列相似度高达100%。通过MEGA 5.0软件对相近序列构建系统发育树,结果显示菌株L-14与枯草芽孢杆菌可聚在同一进化分支上(图 4)。综上所述,通过菌落形态特征、生理生化指标分析以及分子进化分析,鉴定菌株L-14为枯草芽孢杆菌(B. subtilis)。
|
| 图 4 菌株L-14 16S rRNA基因序列系统发育树 Figure 4 Phylogenetic tree based on 16S rRNA gene sequence of strain L-14 注:参与比对序列的GenBank登录号列于括号中,分支处标注有自展值,标尺所示长度为0.005核苷酸置换率. Note: The GenBank accession numbers of aligned sequences are shown in the brackets. The bootstrap values are shown at the node. Bar 0.005 means the nucleotide substitution rate of 0.005. |
|
|
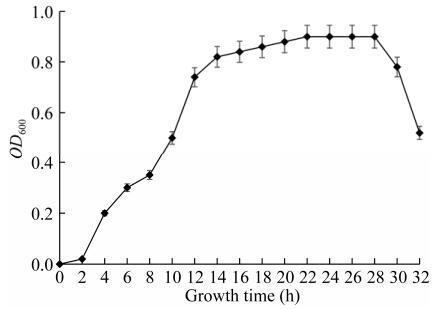
菌株L-14的生长曲线分布为:0-4 h为延迟期,4-12 h为菌体对数生长期,14-26 h为稳定期,26 h后菌体生长进入衰亡期(图 5)。因此取10 h的对数生长期发酵液作为种子液进行发酵试验。
|
| 图 5 菌株L-14的生长曲线 Figure 5 The growth curve of L-14 |
|
|
实验结果表明,菌株L-14发酵液的蛋白粗提物对弯曲平脐蠕孢气生菌丝形态无明显影响,但对基内菌丝影响显著。与未处理的基内菌丝作为对照,菌株L-14发酵液的蛋白粗提物处理的基内菌丝细胞膨大,呈现明显畸变的呈串珠状排列(图 6)。

|
| 图 6 菌株L-14粗蛋白对弯曲平脐蠕孢菌丝形态的影响 Figure 6 Effects of crude protein of strain L-14 on hyphae of Bipolaris papendorfii 注:A:未处理组作为对照;B:菌株L-14粗蛋白处理弯曲平脐蠕孢菌后. Note: A: Sample without treatment as control; B: Bipolaris papendorfii after treatment with crude protein of strain L-14. |
|
|
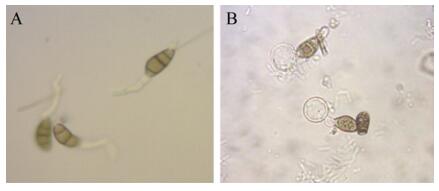
如图 7所示,菌株L-14发酵液蛋白粗提物能显著抑制弯曲平脐蠕孢分生孢子萌发。将未处理组作为对照,培养至20 h,对照组孢子已萌发,而菌株L-14发酵液蛋白粗提物处理组中的弯曲平脐蠕孢孢子末端仍呈现末端膨大,出现囊泡状结构,未正常萌发。
|
| 图 7 菌株L-14发酵粗提物对弯曲平脐蠕孢分生孢子萌发的影响 Figure 7 Effects of strain L-14 fermentation of crude extracts for the Bipolaris papendorfii conidial germination 注:A:未处理组作为对照;B:菌株L-14发酵粗提物处理弯曲平脐蠕孢菌后. Note: A: Sample without treatment as control; B: Bipolaris papendorfii conidial germination after treatment of strain L-14 fermentation of crude extracts. |
|
|
芽孢杆菌是自然界分布较为广泛的细菌,不仅存在于土壤、植物根际和体表,还是常见的植物内生细菌。研究表明,芽孢细菌不仅可促进植物生长,其产生的抗菌物质也已成功应用在植物病害防治领域[26]。芽孢杆菌对人畜无毒害作用、不污染环境、抗逆性极强,是目前极有应用前景的一类微生物。分离芽孢细菌拮抗植物病原菌物质并研究其拮抗机制,对植物病害防控具有重要的应用价值,而且为抗菌物质信号途径的基因克隆、进一步构建转基因工程菌以及应用菌株的改造奠定基础。
本研究筛选得到的弯曲平脐蠕孢拮抗细菌L-14为枯草芽孢杆菌(B. subtilis),其对层出镰孢(F. proliferatum)、玉米大斑病菌(S. turcica)、禾谷镰孢(F. graminearum)和灰霉病菌(B. cinerea)等均具有较好的拮抗活性,其胞外活性物质可导致弯曲平脐蠕孢菌丝及芽管膨大、畸形。而且,菌株L-14发酵液粗提物能导致弯曲平脐蠕孢的基内菌丝显著畸变,呈现无功能的串珠状,分生孢子萌发异常,阻断其附着胞的发育,推测菌株L-14的分泌物可能通过破坏弯曲平脐蠕孢的细胞壁完整性,造成其菌丝畸形及芽管无法正常延伸。有研究[27]表明,芽孢杆菌会通过影响真菌细胞壁,从而破坏其菌丝形态。孔建等[28]研究发现,来自枯草芽胞杆菌B-903的抗生素可溶解镰刀菌菌丝细胞壁,造成菌丝畸形。翟茹环等[29]曾报道枯草芽胞杆菌G8发酵滤液可使黄瓜菌核病菌菌丝溶解,造成原生质渗漏,形成空泡细胞。邢介帅等[30]发现枯草芽胞杆菌T2所产生的蛋白酶能显著降解棉花枯萎病菌细胞壁蛋白,产生畸形菌丝。Deleu等[31]研究表明枯草芽胞杆菌所产生的脂肽类抗菌物质能直接作用于病原菌细胞膜,改变细胞膜的结构,从而达到抑菌效果。冯俊涛等[32]利用枯茗酸抑制辣椒疫的研究中发现其作用靶点可能为细胞膜和细胞壁。对于菌株L-14的作用机理,我们将在进一步的实验中通过更多的生物化学实验及分子生物学方法加以验证。
| [1] |
Chen XR, Nan ZB, Yang CD, et al. Morphological and biological characteristics of three Bipolaris species isolated from grasses in Huanxian grassland, Gansu province[J]. Acta Prataclturae Sinica, 2003, 12(6): 86-92. (in Chinese) 陈秀蓉, 南志标, 杨成德, 等. 3种牧草根际平脐蠕孢形态和生物学特性[J]. 草业学报, 2003, 12(6): 86-92. DOI:10.3321/j.issn:1004-5759.2003.06.015 |
| [2] |
Deng H.Taxonomic studies of the Genus Bipolaris Shoemaker (Hyphomycetes) in China[D].Tai'an: Master's Thesis of Shandong Agricultural University, 2002(in Chinese) 邓晖.中国平脐里里蠕孢属(Bipolaris Shoemaker)的分类研究[D].泰安: 山东农业大学硕士学位论文, 2002 |
| [3] |
Guo YJ.Phylogenetic analysis of the Genera Bipolaris and Curvularia in China[D].Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2016(in Chinese) 郭玉杰.中国平脐蠕孢属和弯孢属真菌分子系统学研究[D].北京: 中国农业科学院硕士学位论文, 2016 |
| [4] |
Kuan CS, Yew SM, Toh YF, et al. Dissecting the fungal biology of Bipolaris papendorfii:from phylogenetic to comparative genomic analysis[J]. DNA Research, 2015, 22(3): 219-232. DOI:10.1093/dnares/dsv007 |
| [5] |
Sun Y, Liu B. Current status of biological control of corn diseases in China[J]. Henan Agriculture, 2016(26): 28. (in Chinese) 孙艳, 刘蓓. 我国玉米病害的生物防治现状[J]. 河南农业, 2016(26): 28. |
| [6] |
Li FH, Ye HZ, Wang YT, et al. The research progress of maize curvularia leaf spot disease[J]. Journal of Maize Sciences, 2004, 12(2): 97-101, 107. (in Chinese) 李富华, 叶华智, 王玉涛, 等. 玉米弯孢叶斑病的研究进展[J]. 玉米科学, 2004, 12(2): 97-101, 107. DOI:10.3969/j.issn.1005-0906.2004.02.030 |
| [7] |
Chang XM, Che ZQ, Gao JY. Research progress on prevent corn major diseases and insect pests using variety resistance[J]. Modern Agricultural Sciences and Technology, 2010(2): 92-93. (in Chinese) 常雪梅, 车兆秋, 高俊杨. 利用品种抗性防治玉米主要病虫害的研究进展[J]. 现代农业科技, 2010(2): 92-93. DOI:10.3969/j.issn.1007-5739.2010.02.058 |
| [8] |
Ma BC.Functional analysis of Clg2p, a Ras protein gene of Curvularia lunata[D].Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2014(in Chinese) 马炳辰.玉米弯孢叶斑病菌Ras同源蛋白Clg2p基因的功能研究[D].大庆: 黑龙江八一农垦大学硕士学位论文, 2014 |
| [9] |
Chen J, Yan HH, Gao ZG, et al. Identification techniques for physiological differentiation of Curvularia lunata in maize[J]. Acta Phytopathologica Sinica, 2003, 33(2): 121-125. (in Chinese) 陈捷, 鄢洪海, 高增贵, 等. 玉米弯孢叶斑病菌生理分化及鉴定技术[J]. 植物病理学报, 2003, 33(2): 121-125. DOI:10.3321/j.issn:0412-0914.2003.02.005 |
| [10] |
Gu YF, Zhang YF, Zhang XP. Isolation and identification of one anti-Rhizoctonis solani endophytic bacteria strain from corn and its antagonism and promoting research[J]. Microbiology China, 2008, 35(8): 1240-1245. (in Chinese) 辜运富, 张云飞, 张小平. 一株抗玉米纹枯病内生细菌的分离鉴定及其抗病促生作用[J]. 微生物学通报, 2008, 35(8): 1240-1245. DOI:10.3969/j.issn.0253-2654.2008.08.014 |
| [11] |
Chen MY, Xia YG, Chen WX. Occurrence and control of maize curvularia leaf spot disease[J]. Journal of Henan Agricultural Science, 2000(7): 19-20. (in Chinese) 陈梅英, 夏瑛光, 陈万先. 玉米弯孢菌叶斑病的发生与防治[J]. 河南农业科学, 2000(7): 19-20. DOI:10.3969/j.issn.1004-3268.2000.07.011 |
| [12] |
Guo YJ, Niu YC, Deng H. Bipolaris and Curvularia species associated with corn leaf spot in northern China[J]. Plant Protection, 2016, 42(5): 39-46. (in Chinese) 郭玉杰, 牛永春, 邓晖. 我国北方玉米上平脐蠕孢属和弯孢属真菌及其所致叶斑病[J]. 植物保护, 2016, 42(5): 39-46. DOI:10.3969/j.issn.0529-1542.2016.05.006 |
| [13] |
Zhao XL, Niu YC, Deng H. A survey of pathogenic fungi on five common gramineous weeds in Henan Province[J]. Plant Protection, 2013, 39(1): 128-132, 140. (in Chinese) 赵杏利, 牛永春, 邓晖. 河南省五种常见禾本科杂草病原真菌种类调查与部分菌株的致病性测定[J]. 植物保护, 2013, 39(1): 128-132, 140. DOI:10.3969/j.issn.0529-1542.2013.01.026 |
| [14] |
Geng RM, Zhang JP, Yu LQ. Isolation, identification and herbicidal activity of Bipolaris sp.and its safety on crops[J]. Acta Agriculturae Zhejiangensis, 2008, 20(6): 446-450. (in Chinese) 耿锐梅, 张建萍, 余柳青. 稻平脐蠕孢的分离、鉴定及对作物的安全性[J]. 浙江农业学报, 2008, 20(6): 446-450. DOI:10.3969/j.issn.1004-1524.2008.06.012 |
| [15] |
Zhao XL, Hu ZJ, Song P, et al. Pathogenic fungi on Avena fatua L.in wheat field of Henan Province[J]. Chinese Agricultural Science Bulletin, 2016, 32(15): 166-170. (in Chinese) 赵杏利, 胡镇杰, 宋鹏, 等. 河南麦田野燕麦病原真菌资源调查及致病性测定[J]. 中国农学通报, 2016, 32(15): 166-170. DOI:10.11924/j.issn.1000-6850.casb15100069 |
| [16] |
Wang GH, Raaijmakers JM. Antibiotics production by bacterial agents and its role in biological control[J]. Chinese Journal of Applied Ecology, 2004, 15(6): 1100-1104. (in Chinese) 王光华, Raaijmakers JM. 生防细菌产生的拮抗物质及其在生物防治中的作用[J]. 应用生态学报, 2004, 15(6): 1100-1104. DOI:10.3321/j.issn:1001-9332.2004.06.037 |
| [17] |
Li JZ, Wen CY. Research progress on bacteria for biological control of plant disease[J]. Journal of Henan Agricultural Sciences, 2015, 44(10): 1-7. (in Chinese) 李俊州, 文才艺. 植物病害生防细菌研究进展[J]. 河南农业科学, 2015, 44(10): 1-7. |
| [18] |
Yang XR, Liu SF, Sun SQ, et al. Research development on preventing soil-borne disease with anti-bacteria[J]. Tianjin Agricultural Sciences, 2008, 14(4): 38-42. (in Chinese) 杨秀荣, 刘水芳, 孙淑琴, 等. 生防细菌防治土传病害的研究进展[J]. 天津农业科学, 2008, 14(4): 38-42. DOI:10.3969/j.issn.1006-6500.2008.04.012 |
| [19] |
An X.Pesticide-degradation characteristics and degradation mechanism of biocontrol bacteria[D].Jinan: Master's Thesis of Shandong Normal University, 2010(in Chinese) 安霞.生防细菌的农药降解特性及其降解机制的研究[D].济南: 山东师范大学硕士学位论文, 2010 |
| [20] |
Xu YJ, Liu HL, Liu XJ, et al. Advance in research of the bacteria biological control for plant diseases[J]. Soybean Science & Technology, 2011(5): 18-22, 34. (in Chinese) 许彦君, 刘海龙, 刘新晶, 等. 细菌对植物病害生物防治研究进展[J]. 大豆科技, 2011(5): 18-22, 34. DOI:10.3969/j.issn.1674-3547.2011.05.006 |
| [21] |
Luo WF.Screening of biocontrol strain to Rhizoctonia solani and preliminary research on the mechanisms[D].Shenyang: Master's Thesis of Shenyang Agricultural University, 2018(in Chinese) 罗文芳.水稻纹枯病生防菌的筛选与作用机制的初步研究[D].沈阳: 沈阳农业大学硕士学位论文, 2018 |
| [22] |
Qiu FB, Li YJ, Zhang XX, et al. Identification and antibiotic activity of endophytic bacterium strain ge21 from ginseng root[J]. Microbiology China, 2010, 37(1): 43-47. (in Chinese) 邱服斌, 李雁津, 张晓霞, 等. 人参内生细菌ge21菌株的鉴定及抑菌活性测定[J]. 微生物学通报, 2010, 37(1): 43-47. |
| [23] |
Dong XZ, Cai MY. Manual of System Identification of Common Bacteria[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [24] |
Kim SB, Yoon JH, Kim HG, et al. A phylogenetic analysis of the genus Saccharomonospora conducted with 16S rRNA gene sequences[J]. International Journal of Systematic Bacteriology, 1995, 45(2): 351-356. DOI:10.1099/00207713-45-2-351 |
| [25] |
Saitou N, Nei M. The neighbor-joining method:A new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4(4): 406-425. |
| [26] |
Yao ZS, Chen ZY, Chen ZY, et al. Genetically marking of natural biocontrol bacterium Bacillus subtilis strains with green fluorescent protein gene[J]. Chinese Journal of Biotechnology, 2003, 19(5): 551-555. (in Chinese) 姚震声, 陈中义, 陈志谊, 等. 绿色荧光蛋白基因标记野生型生防枯草芽孢杆菌的研究[J]. 生物工程学报, 2003, 19(5): 551-555. DOI:10.3321/j.issn:1000-3061.2003.05.008 |
| [27] |
Qiu YX.Study on screening, identification and effect of efficient antagonistic bacteria against Botrytis cinerea[D].Shijiazhuang: Master's Thesis of Hebei Normal University, 2012(in Chinese) 仇艳肖.黄瓜灰霉病高效拮抗菌的筛选鉴定及其作用研究[D].石家庄: 河北师范大学硕士学位论文, 2012 |
| [28] |
Kong J, Zhao BG, Wang WX, et al. On the inhibitory action of Bacillus subtilis B-903 strain's antifungal substance on plant pathogenic fungi[J]. Acta Phytopathologica Sinica, 1995, 25(1): 69-72. (in Chinese) 孔建, 赵白鸽, 王文夕, 等. 枯草芽孢杆菌(Bacillus subtilis(Cohen)) B-903菌株抗菌物质对植物病原真菌的抑制作用[J]. 植物病理学报, 1995, 25(1): 69-72. |
| [29] |
Zhai RH, Shang YK, Liu F, et al. Characteristics and inhibitory action of antifungal protein produced by Bacillus subtilis strain G8[J]. Acta Phytophylacica Sinica, 2007, 34(6): 592-596. (in Chinese) 翟茹环, 尚玉珂, 刘峰, 等. 枯草芽孢杆菌G8抗菌蛋白的理化性质和抑菌作用[J]. 植物保护学报, 2007, 34(6): 592-596. DOI:10.3321/j.issn:0577-7518.2007.06.006 |
| [30] |
Xing JS, Li R, Zhao L, et al. Purification, characterization and antagonism of an extracellular protease Bacillus subtilis strain T2[J]. Acta Phytopathologica Sinica, 2008, 37(4): 377-381. (in Chinese) 邢介帅, 李然, 赵蕾, 等. 生防芽孢杆菌T2胞外蛋白酶的纯化及其抗真菌作用[J]. 植物病理学报, 2008, 37(4): 377-381. DOI:10.3321/j.issn:0412-0914.2008.04.007 |
| [31] |
Deleu M, Paquot M, Nylander T. Effect of fengycin, a lipopeptide produced by Bacillus subtilis, on model biomembranes[J]. Biophysical Journal, 2008, 94(7): 2667-2679. |
| [32] |
Feng JT, Han LR, Fan RJ, et al. Effects of cuminic acid on the growth and development of Phytophthora capsici leonian[J]. Scientia Agricultura Sinica, 2012, 45(13): 2628-2635. (in Chinese) 冯俊涛, 韩立荣, 范瑞娟, 等. 枯茗酸对辣椒疫霉病菌生长发育的影响[J]. 中国农业科学, 2012, 45(13): 2628-2635. |
 2020, Vol. 47
2020, Vol. 47