扩展功能
文章信息
- 姚稼灏, 薛雅鞠, 赵永亮, 纪秀玲, 任保增, 黄玉红
- YAO Jia-Hao, XUE Ya-Ju, ZHAO Yong-Liang, JI Xiu-Ling, REN Bao-Zeng, HUANG Yu-Hong
- 多孔纳米材料固定化酶研究进展
- Recent advances in immobilization of enzymes on porous nanomaterials
- 微生物学通报, 2020, 47(7): 2177-2192
- Microbiology China, 2020, 47(7): 2177-2192
- DOI: 10.13344/j.microbiol.china.200351
-
文章历史
- 收稿日期: 2020-04-08
- 接受日期: 2020-05-29
- 网络首发日期: 2020-06-04
2. 中国科学院过程工程研究所 北京 100190;
3. 郑州中科新兴产业技术研究院 河南 郑州 450000
2. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3. Zhengzhou Institute of Emerging Industrial Technology, Zhengzhou, Henan 450000, China
酶是一种生物催化剂,有催化效率高、专一性强、反应条件温和等优点。此外,与传统化学催化剂相比,酶来源于生物体内,种类繁多且反应时不需要官能团的保护和活化,更加经济、节能和高效,有助于实现化学品制造的绿色和可持续发展。近二十年来,酶催化技术被广泛应用于医药、生物、农业、国防、食品等领域[1-2]。尽管生物酶有很多优点,但是酶结构不稳定,在高温、高压、强酸、强碱和有机溶剂中容易失活,使其长期操作稳定性差,而且酶的回收和再利用困难,制约了其大规模的工业化应用。酶的固定技术可以克服这些问题,与游离酶相比,固定化有助于增强酶在苛刻环境中的稳定性,提高酶的催化活性和储存稳定性;另外,固定化酶可以更快速地从反应体系中分离出来,从而最大限度地减少或消除产物对酶的污染,促进了酶的有效回收和循环利用[3-4]。
酶的固定化方式主要分为3种:载体结合、包覆和交联(无载体)。载体结合是指酶与载体通过物理吸附、离子键、共价键等连接方式实现酶的固定,是最常用的固定方法[5]。包覆是将酶包埋在有机聚合物网络、无机物和杂化材料中,如硅基溶胶-凝胶和膜等,这种固定方法一般是通过载体材料与酶共沉淀的方式来实现[6]。交联是指使用双功能试剂把酶晶体[7]或酶聚集体[8]交联在一起制备无载体大颗粒,表 1总结了不同固定方法的优势和存在的问题。载体是影响酶固定效率和催化性能的主要因素,因此,制备高效可行的载体材料是固定化酶的关键。金属有机框架(metal organic framework,MOF)材料、共价有机框架(covalent organic framework,COF)材料、多孔微球等纳米材料具有良好的稳定性和机械强度,而且孔隙率高、比表面积大、表面易于修饰、成本低廉、原料易得、生物相容性好,已逐步开发并用于酶的固定化研究[10]。本文综述了MOF、COF等多孔纳米材料在酶固定化领域的研究和应用,分析了不同固定载体的特点,并讨论了固定化酶所面临的挑战和发展趋势。
| 方法 Method |
优势 Advantage |
缺陷 Defect |
参考文献 References |
| Adsorption | Low cost Simple operation |
Enzymes leak easily Not conducive to continuous operation |
[2] |
| Covalent bonding | High stability High load efficiency Continuous operation |
High fixed cost Damage of enzyme functional group |
[5] |
| Embedding | Simple process Immobilizable biomacromolecule Low cost |
Low mass transfer efficiency | [9] |
| Cross-linking | High stability No carrier needed |
High cost Reaction is hard to control Large enzyme demand |
[7-8] |
金属有机框架(MOF)是由金属中心和有机配体通过配位键连接而成的有拓扑结构的多孔纳米材料,具有高比表面积、孔隙率和结晶度,孔径和结构有序可调,金属节点、配体具有多样性且易于修饰,各种活性基团可以均匀分布在MOF的孔隙和表面,与生物分子相互作用,是酶固定化的极佳载体材料[11]。MOF不仅可以为生物分子创造稳定的微环境,提高其抗干扰性能,而且可以促进生物分子从产品中的分离和回收。酶和MOF的结合(酶@MOF)主要分为3种方式:(1)吸附;(2)共价连接;(3)原位包埋。
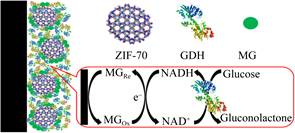
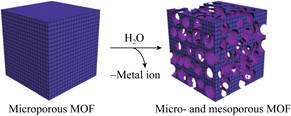
1.1.1 酶@MOF吸附固定吸附是指酶和MOF之间通过疏水作用、电荷作用、范德华力、氢键和π-π堆积等作用力相结合[12]。酶在MOF上吸附固定的位置取决于酶分子尺寸与MOF的孔径大小。当酶分子尺寸大于MOF的孔径时,通常被固定在载体的表面。如Ma等[13]用微孔ZIF-70 (直径≤2 nm)吸附葡萄糖脱氢酶和亚甲基绿(电催化剂)制备用于脑内葡萄糖检测的生物传感器,因葡萄糖脱氢酶的分子尺寸大于ZIF-70的孔径,使得酶分子被固定在ZIF-70外表面(图 1)。Zhao等[14]利用吸附法将分子尺寸大于MOF孔径的胰蛋白酶固定在聚多巴胺涂覆的磁性Cu基微孔HKUST-1表面上,MOF的磁性修饰加快了复合酶的分离和回收速度。尽管将酶固定在载体表面可提高酶的性能,但此固定方式同样使得生物酶分子和溶液环境直接接触,减弱了MOF的保护作用,不利于固定化酶的长期操作稳定性[11]。当MOF孔径大于酶分子尺寸时,酶@MOF吸附法可以将酶吸附到载体孔道的内部,材料孔壁的保护作用增强了酶的稳定性和循环使用性。Zhong等[15]利用吸附法将葡萄糖氧化酶固定到具有类似过氧化物酶活性的Zr基金属有机框架MOF-545孔内,在经历7 d的储存时间和5个反应循环后,分别保留了92%和71%的相对活性,这一结果验证了MOF-545孔壁对酶的稳定性和循环使用性具有保护作用。Zhong等[16]将十六烷基三甲基溴化铵和乙二胺四乙酸加入到硝酸铜和1, 3, 5-苯三甲酸的混合溶液中制备了孔径达到15.2–20.7 nm的介孔Cu-MOF载体,并利用吸附法将漆酶固定到Cu-MOF孔内,与几乎全部失活的游离酶相比,固定化酶在重复使用7次后,相对活性仍保持在50%以上,这一结果同样证明了Cu-MOF载体孔道对酶活性的保护作用。尽管孔径尺寸大的介孔MOF载体提高了酶的稳定性,但直接合成介孔MOF的制备过程复杂、反应成本高,不具有普遍适用性[17],基于此,研究人员在微孔MOF的基础上修饰改性制备了同样对酶具有保护作用但反应过程简单、成本较低的微介孔MOF。Kim等[18]以水作为溶解剂,对合成的微孔POST-66(Y)进行修饰,制备了具有微孔和介孔双级孔结构的载体材料(图 2),微介孔POST-66(Y)的介孔尺寸范围为3–20 nm,将辣根过氧化物酶(horseradish peroxidase,HRP)固定在孔内,固定化酶在二甲基亚砜等有机溶剂中显示出比游离HRP更好的稳定性,重复使用5次后仍可保持90%以上的相对活性。Pang等[19]以十六烷基三甲基溴化铵为结构导向剂合成了孔径范围为3.5–7.0 nm的两级微介孔Zr基金属有机框架MMU来吸附固定漆酶,负载量达到221.83 mg/g,同时增强了漆酶的pH、温度稳定性和循环使用性,储存1个月后仍可保持55.4%的初始活性。
吸附固定的特点是可以预先合成MOF,其合成条件不受目标酶的限制;此外,酶与MOF具有非特异性相互作用,因此可以使用不同类型的MOF作为固定化基质,如Ni-MOF[20]、MIL- 53(Al)[21]、UiO-66-NH2[22]等。通过吸附作用固定化酶的稳定性和活性得到改善。
1.1.2 酶@MOF共价连接固定共价连接是通过酶或MOF表面游离的–NH2和–COOH之间形成酰胺键,或者以戊二醛为交联剂,通过醛基和氨基之间的席夫碱反应来实现酶在MOF上的固定。酶-MOF之间形成的酰胺键通常需要羧酸活化分子如1-乙基-3-(3-二甲氨基丙基)碳化二亚胺[1-ethyl-3-(3-dimethylaminopropyl) carbodⅡmide,EDC]和N, N′二环己基碳化二亚胺(N, N′-dicyclohexylcarbodⅡmide,DCC)等对–COOH进行活化,加快反应进程[23]。
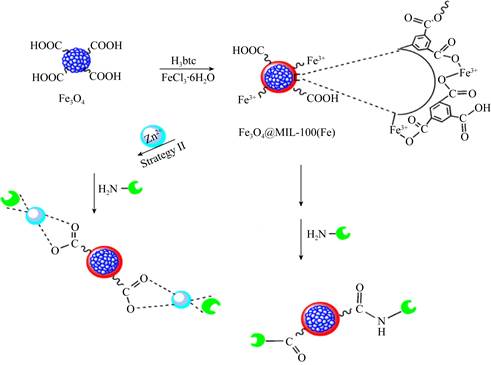
Mehta等[24]用氨基对苯二甲酸和氯化锆通过溶剂热法制备UiO-66-NH2,并用DCC对其进行羧基活化,活化后的MOF其羧基与有机磷酸水解酶的氨基之间形成酰胺键,实现对酶的共价连接固定;固定化酶催化活性比游离酶的活性提高了近40%,其储存稳定性也显著增强,在4 ℃条件下保存60 d后,仍保持其相对活性的80%,而游离酶几乎全部失活。Chen等[25]以戊二醛为交联剂通过醛基和用硫酸铵沉淀的猪胰脂肪酶(porcine pancreatic lipase,PPL)氨基之间的席夫碱反应,实现了PPL在UiO-66-NH2表面的共价固定,PPL@UiO-66-NH2的固载率为98.31 mg/g,同时提高了PPL的可重用性、储存稳定性和热稳定性。Nowroozi-Nejad等[26]对比了吸附和共价连接固定化酶的性能,他们制备了Fe-MIL-88NH2(A)用于荧光素酶的吸附固定,并用邻苯二甲醛修饰得到Fe-MIL-88NH2(B)用于酶的共价固定,通过研究两种固定化酶在不同条件下的催化活性,发现Fe-MIL-88NH2(B)的热稳定性和底物亲和力高于Fe-MIL-88NH2(A),这一结果表明共价连接的键合力更强,更有利于促进酶催化活性和稳定性的提高。Wang等[27]比较了共价连接(方法I)和金属离子亲和力相互作用(方法Ⅱ)对固定脂肪酶催化活性的影响(图 3),他们研究发现,尽管共价连接固定的酶负载率(83.48%)低于金属离子亲和力固定的酶负载率(87.20%),但是共价连接固定化酶在10个周期后的剩余活性(74.04%)高于金属离子亲和力固定酶的剩余活性(61.16%),这一结果进一步验证了共价连接固定酶增强了酶的相对稳定性。
通过共价连接的方法将酶固定到载体上,一方面提高了酶结构的刚性,减弱了外界环境对酶构象的破坏;另一方面,共价连接固定有助于加强酶活性位点朝向底物的取向程度,增大酶与底物之间接触的机会[24-25];而且与物理吸附相比,共价键键合力更强,酶的稳定性更高。但是,共价连接过程复杂、成本较高且固定过程中酶表面的一些官能团可能被破坏,影响酶的催化活性。
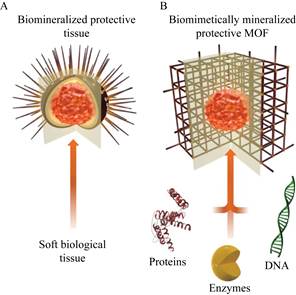
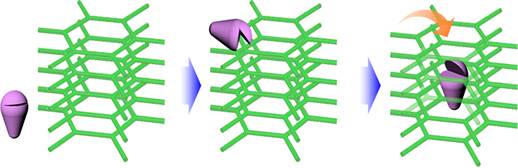
1.1.3 酶@MOF原位包埋固定原位包埋法通过酶溶液、金属离子和有机配体的共沉淀实现生物酶的固定,其不受酶分子尺寸的限制,是一种快速有效的固定方法。原位包埋法采用的MOF载体的形成机理如图 4所示,酶分子吸引金属阳离子和有机配体在其表面成核、结晶,形成的纳米外壳可保护其免受外界环境的影响,这和自然界生物矿化过程相似,因此该方法又被称为仿生矿化法[28-29]。
沸石咪唑酯框架材料(zeolitic imidazolate frameworks,ZIFs)因其合成条件温和、反应速度快、物理化学性能优异而被广泛用于酶的原位包埋[30]。Lyu等[31]首次将MOF材料ZIF-8和细胞色素C (cytochrome c,Cyt c)通过原位包埋的方法实现偶联,以甲醇为反应介质、聚乙烯吡咯烷酮为辅因子制备了Cyt c@ZIF-8,ZIF-8提高了Cyt c对底物H2O2的亲和力,固定化的Cyt c比游离Cyt c催化活性提高了10倍。Knedel等[32]利用原位包埋固定法将漆酶(laccase)、Zn2+和2-甲基咪唑在水溶液中搅拌5 min制备得到Laccase@ZIF-8,增强了漆酶在高温和有机溶剂中的稳定性。Feng等[33]利用原位包埋固定法将人免疫球蛋白多克隆抗体、山羊抗牛血清白蛋白多克隆抗体分别固定在ZIF-8和ZIF-90中,其固定效率高达99%以上,而且抗体在高温、有机溶剂中仍能保持活性。Rafiei等[34]将脂肪酶和微孔ZIF-67通过原位包埋法相偶联,制备的脂肪酶@ZIF-67用于大豆油与甲醇的酯交换反应,包封的脂肪酶在碱性和酸性区域中表现出更高的耐受性。总之,在原位包埋固定过程中形成的ZIFs外壳增强了酶在严苛环境中的稳定性。
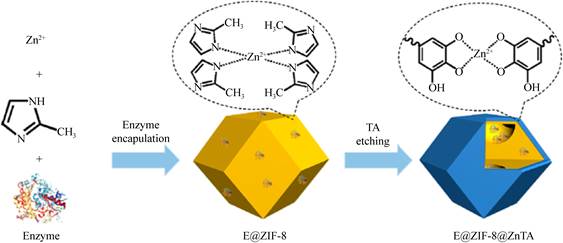
然而,ZIFs用于酶固定也面临以下问题:(1) ZIFs的微孔可能会阻碍底物分子与酶的接触,导致其活性下降[35];(2)在含水和酸性条件下,金属节点与有机配体间的配位键倾向于解离,导致酶的泄露[36]。针对以上问题,Sun等[37]提出了一种简便的多酚处理方法来原位包埋固定酶,实现酶活性和稳定性的提高(图 5),单宁酸(tannic acid,TA)涂覆后H+的释放将部分破坏Zn2+和2-甲基咪唑之间的配位键,形成ZIF-8@ZnTA内部多孔结构;另外,TA-Zn涂层中的多级孔结构和Zn-O配位键增强了ZIF-8@ZnTA的反应物扩散过程和抗水腐蚀稳定性,为基于一系列ZIF和多种酶的高性能生物催化剂的制备提供了一种简便而通用的方法。Wei等[38]在常温下采用机械研磨法将β-葡萄糖苷酶包埋在UIO-66-NH2中,同样增强了酶的稳定性,并且与ZIF-8相比,UIO-66-NH2在酸中更稳定,这为酶的原位包埋提供了新的思路。另外,晶态载体缺陷法也可有效提高复合酶的催化性能,Wu等[29]通过减小2-甲基咪唑和锌离子的摩尔比制备了具有无定形结构的ZIF材料(amorphous ZIF,aZIF),有机配体和金属离子的配位缺陷减小了材料的结晶度和有序性,从而产生介孔结构,促进了底物的扩散,酶通过原位包埋固定在aZIF中,其表观活性比传统ZIF-8提高了5–20倍。Hu等[39]采用微流控技术,在层流扩散梯度混合环境中合成了酶@ZIF复合材料,由于微通道中反应物比例连续变化,所得产物也显示出配位缺陷,因此产生介孔,减小了底物传质阻力,其活性比共沉淀制备的酶@ZIF复合物高出一个数量级,这种缺陷辅助合成方法为提高复合酶的活性提供了新的途径。
原位包埋法简单快捷,能够将酶分子固定在孔内,提高其稳定性。但这种方法要求MOF的合成条件温和,目前的研究主要集中于ZIFs系列[23],ZIFs在酸和水中的不稳定性和微孔结构限制了酶的连续操作和工业化应用,因此,仍需要进一步探索新的合成方法和载体材料。
综上所述,酶可通过吸附、共价连接和原位包埋的方式固定在MOF上。不同的固定方式有各自的特点,MOF材料通过提高酶结构的刚性、改变酶催化反应的微环境以及形成保护外壳来提高酶的稳定性和可循环利用性。然而金属中心和有机配体之间配位键的可逆性使大部分MOF材料在水中不稳定,易解聚且材料的直径、形貌和结构难以控制,影响了酶的长期操作稳定性和实际应用[40],因此,仍需要进一步优化现有MOF的结构或开发出更稳定的具有生物相容性的新品种MOF材料。表 2总结了近些年酶@MOF的固定化研究和应用。
| 酶 Enzyme |
载体材料 Carrier materials |
固定方法 Immobilization method |
应用 Application |
参考文献 References |
| Lysozyme | ZIF-8 | Adsorption | Hydrolysis of M. lysodeikticus | [41] |
| Laccase | MIL-53(Al) | Adsorption | Catalytically degrade of 5-chloro-2-(2, 4-dichlorophenoxy) phenol | [21] |
| Dehydrogenase | ZIF-70 | Adsorption | Detection of glucose in brain | [13] |
| HRP/Cyt c | Ni-MOF | Adsorption | The degradation of 2, 4-dichlorophenol and rifaximin in artificial wastewater |
[20] |
| Trypsin | HKUST-1 | Adsorption | Hydrolyzed cytochrome c | [14] |
| Cellulase | UiO-66-NH2 | Adsorption | Hydrolysis of cellulose into soluble sugars | [22] |
| Gox | HP-MOF | Adsorption | Biosensor | [17] |
| Lipase | MIL-101(Cr) | Covalent linkage | Hydrolysis p-nitrophenyl palmitate | [42] |
| OPH | UiO-66-NH2 | Covalent linkage | Hydrolysis of p-methyl-parathion | [24] |
| Luciferase | Fe-MIL-88NH2 | Covalent linkage | Detection ATP in the living organisms | [26] |
| RIgG | Cu-MOF | Encapsulation | Colorimetric immunoassay | [43] |
| Cyt c | ZIF-8 | Encapsulation | Catalyze H2O2 | [31] |
| Lipase | ZIF-67 | Encapsulation | Catalysts for esterification, transesterification | [34] |
| GOx | ZIF-8 | Encapsulation | Colorimetric and electrochemical glucose sensor | [44] |
| Glycosidases | UiO-66-NH2 ZIF-8, Zn-MOF-74 |
Encapsulation | Hydrolysis of one of cellobiose’s analogs | [38] |
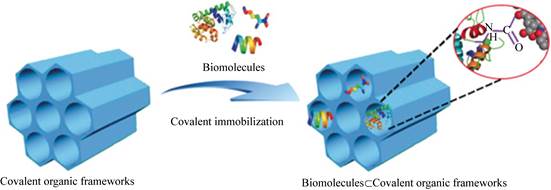
共价有机框架(COF)是一种新型的多孔有机聚合物,是有机结构单元通过共价键连接而成的有二维和三维拓扑结构的晶体材料,其主链主要由轻质元素(B、C、N、O、Si)组成,有孔隙结构可调节、比表面积大、化学和热稳定性好、质量轻、易于修饰等优点,被应用于催化、储能、光电器件、分离、传感和医药等领域,是潜在的酶固定化载体[45-48]。COF主要通过席夫碱反应合成,与MOF相比,COF材料性质更稳定且不含金属元素,可减小对生物分子的不良影响。COF和酶的结合可分为吸附和共价连接两种方式。
1.2.1 酶@COF吸附固定与MOF吸附固定酶相似,COF也通过静电吸引、疏水作用、范德华力、π-π堆积、氢键等作用力使酶吸附固定在COF的表面或孔内,酶@COF复合物是通过将合成的COF材料和酶溶液混合在一起搅拌、离心、洗涤干燥制得。Sun等[49]以二甲氧基对苯二甲酸(dimethoxyterephthaldehyde,DMTP)和1, 3, 5-三(4-氨基苯基苯) [1, 3, 5-tris (4-aminophenyl)benzene,TPB]为前体材料,通过席夫碱反应合成了介孔TPB-DMTP-COF (直径为3.3 nm),然后在室温下通过疏水作用将脂肪酶(lipase)吸附固定得到Lipase@TPB-DMTP-COF(图 6),COF孔径不变,孔隙体积由1.62 cm3/g降到0.59 cm3/g,证明酶是被固定在孔道中的,并且由于COF孔道的保护作用,固定化酶显示出更高的热稳定性和可循环性。Samui等[50]以三甲酰间苯三酚(triformylphloroglucinol,TP)和三聚氰胺(melamine,MM)为配体制得TPMM-COF,通过物理吸附的方法将α-淀粉酶固定得到α-淀粉酶@TPMM-COF,进一步研究发现在高温条件下α-淀粉酶@TPMM-COF的活性稳定性更高,这是因为TPMM-COF载体的保护作用减弱了高温对酶结构的破坏。Sun等[51]研究发现双级孔COF材料COF-ETTA-EDDA (孔径分别为13.9 Å和38.5 Å)固定化的酶比单级孔COF材料COF-PY-EDDA (孔径为31.4 Å)固定化的酶具有更高的底物亲和性和催化活性,这是因为在单级孔COF中酶和产物可能会阻塞孔道,导致底物和产物的传质速率变慢,而双级孔COF将酶固定在较大的六边形孔中,底物和产物在较小的三角孔中自由进出,通过增大扩散空间来减小传输限制。
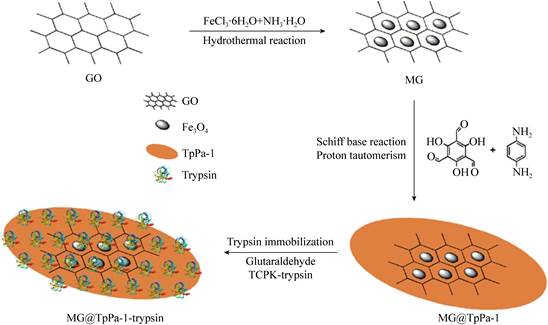
1.2.2 酶@COF共价连接固定共价连接固定酶的方式需要活化COF表面的–COOH或以戊二醛为交联剂,通过酶上的–NH2和载体上的–COOH或–CHO之间形成共价键实现对酶的固定。Zhang等[52]以均苯四甲酸二酐(pyromelliticdianhydride,PMDA)、2, 4, 6-三(4-氨基苯基)-1, 3, 5-三嗪[2, 4, 6-tris(4-aminophenyl)-1, 3, 5-triazine,TAPT]为前体合成PMDA-TAPT-COF (COF-1),用1-乙基-3-(3-二甲基氨基丙基)碳二酰亚胺和N-羟基琥珀酰亚胺对COF-1上的羧基进行活化后,通过与溶菌酶上的氨基结合形成酰胺键,实现溶菌酶在COF-1孔内的共价连接固定(图 7),进而提高了其在有机溶剂中的稳定性和可重复使用性。Wang等[53]将1, 3, 5-三甲酰间苯三酚(1, 3, 5-triformylphloroglucinol,Tp)、1, 4-二氨基苯(1, 4-diaminobenzene,Pa-1)和磁性石墨烯(magnetic graphene,MG)混合制备MG@TpPa-1,以戊二醛为交联剂将胰蛋白酶(trypsin)共价固定在COF上得到MG@TpPa-1-trypsin (图 8),其负载量高达268 μg/mg,而且能够快速终止反应,加速分离过程,此外,MG@TpPa-1-trypsin还改善了胰蛋白酶的水解效率,使其具有良好的可循环性和稳定性。MG@TpPa-1-trypsin具有高负载率和易分离特性是因为它结合了石墨烯和磁性材料的优势[54-55],我们认为这为COF材料的改性和优化提供了新的思路。
COF和酶之间的共价键结合与吸附作用相比,作用力更强,酶的负载率更高[52]。被COF固定的酶的热、化学、储存稳定性和可循环性显著提升[49-53]。另外,COF是有机配体单元通过共价键连接的,作用力强度大于MOF中的金属配位键,因此COF材料在水和酸碱中更稳定[49]。但是目前COF还无法实现对酶的原位包埋,这使其无法将一些生物大分子固定在孔内,而且在固定过程中,溶液环境或COF材料的孔道可能会破坏酶的结构而影响酶催化活性。总体上COF固定酶用于生物催化的研究与MOF相比还较少,需要进一步去探索和优化COF的结构、合成方法和固定条件。
1.3 酶-多孔微球多孔微球是一种具有纳米或微米结构的多孔球状载体,如纳米颗粒、二氧化硅基微球、藻酸盐基微球、壳聚糖和纤维素基微球等,因为其具有高比面积、高负载率和良好的生物相容性而成为酶固定化的研究热点之一,生物酶分子主要通过物理吸附、共价连接的方式固定在纳米微球上[56-59]。
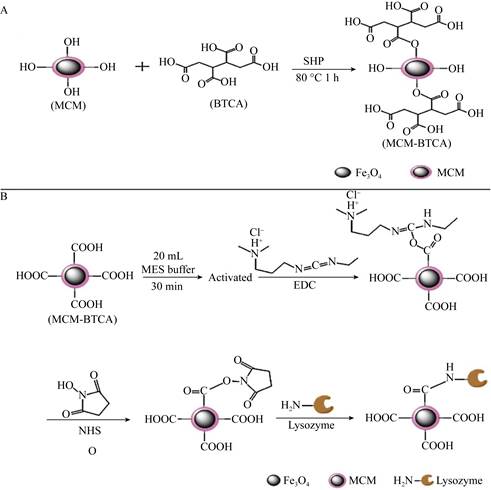
1.3.1 酶-多孔微球共价连接固定载体表面的醛基或羧基和酶表面游离的氨基之间形成共价键使酶固定在微球上。固定化提高了酶对高温和pH的耐受性、可重复使用性和储存稳定性。这是因为微球的保护作用可以减弱外界环境对酶结构的破坏,另外,载体与酶之间的相互作用可以提高酶的存活能力[60]。Xue等[61]以纤维素微球为基体,通过Fe3O4的修饰得到磁性纤维素微球(magnetic cellulose microspheres,MCMs),用多元羧酸1, 2, 3, 4-丁烷四甲酸修饰磁性微球表面,然后以1-乙基-3-(3′-二甲基氨基丙基)碳化二亚胺和N-羟基琥珀酰亚胺为活化剂通过酰胺化反应将溶菌酶共价固定在MCMs上(图 9),固载率为79.75±4.32 mg/g,固定化增强了酶对高温和pH的耐受性。Chen等[62]以甲基丙烯酸缩水甘油酯和烯丙基缩水甘油醚为单体,用反相悬浮聚合法在SiO2包覆的Fe3O4纳米颗粒表面制备出含环氧基团的磁性聚合物微球,以N, N-亚甲基双丙烯酰胺为交联剂将青霉素G酰基转移酶固定。Jiang等[63]采用类似的方法以戊二醛为交联剂将α-葡萄糖苷酶共价固定在涂覆聚酰胺的磁性微球上,复合材料具有优异的分散性和快速的磁分离性能,此外,酶的储存稳定性和可循环性也得到提高。Nartop等[64]以三(2-氨基乙基)胺聚合物和[2, 2′-联吡啶]-4, 4′-二甲醛为原料制备了聚合物微球TrisPS-pyr,进一步加入PtCl2制备得到含铂的聚合物微球TrisPS-pyr-Pt(Ⅱ),之后将TrisPS-pyr和TrisPS-pyr-Pt(Ⅱ)分别与乙酰胆碱酶共价结合;通过对比两种复合物的稳定性,发现TrisPS-pyr-Pt(Ⅱ)的固定化效果更好,这一结果证明了Pt(Ⅱ)的构象稳定性和电负性可提高载体的固定效率和可重复性,为酶的共价固定提供了新的思路。
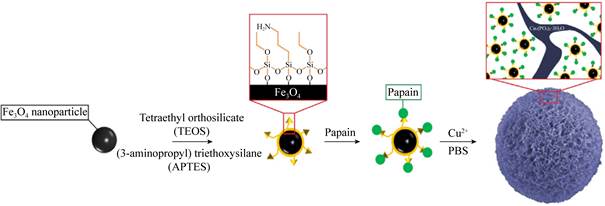
共价连接的方法固定效率高、稳定性强,适用于连续化反应,但需要对载体表面进行功能化修饰,这提高了反应成本,也可能破坏酶的构象。然而,物理吸附的方法相对成本较低,易于实施。Liu等[65]制备了直径为2-3 μm的多孔空心碳质微球(carbon microspheres,CMs),CMs通过吸附的方法分别将牛血清白蛋白、皱念珠菌脂肪酶、嗜热霉菌脂肪酶、过氧化氢酶、葡萄糖氧化酶、漆酶和葡萄糖苷酶固定在孔内,固定化酶显示出更高的催化活性和稳定性,这是因为酶和CMs之间较弱的物理相互作用最大程度地降低了酶的失活;另一方面,载体的外壳可以保护酶免受极端反应条件的影响,例如避免与有机溶剂的直接接触和溶液中离子的干扰。Feng等[66]将氨基功能化的磁性Fe3O4纳米颗粒和Cu3(PO4)2·3H2O纳米花相结合制备了纳米复合材料,通过表面吸附的方法将木瓜蛋白酶固定在颗粒表面,得到具有花状结构的磁性纳米木瓜蛋白酶复合物[papain-Cu3(PO4)2·3H2O-magnetic nanoflower,PCMN](图 10),固定化同样提高了酶的催化活性、热稳定性。磁性纳米生物复合材料在反应结束之后可以通过磁铁收集,减小了回收难度,降低了成本。Shi等[67]以相同的方法将脂肪酶固定在磁性二氧化硅纳米颗粒上,固定化增强了酶的可循环性,重复使用10次后,活性回收率仍保持在67%。虽然物理吸附法简便快捷,但吸附作用力弱,酶在循环利用过程中容易从载体上泄漏,另外,载体表面的亲水、疏水基团会影响酶的分散性和底物亲和性。
多孔微球载体来源丰富,既可以来自于自然界广泛存在的天然高分子聚合物(如甲壳素、壳聚糖、纤维素等),也可以通过化学方法有机合成,而且材料表面易于修饰。酶与多孔微球载体通过共价连接和物理吸附两种方式实现酶的固定化,借助微球载体的保护作用来减弱外界环境对酶多级结构的破坏,从而提高酶的稳定性。表 3总结了近几年多孔微球固定化生物分子的方法和应用。
| 生物分子 Biomolecules |
载体材料 Support materials |
固定方法 Immobilization method |
应用 Application |
参考文献 References |
| Amino acids | Aldehyde-containing microspheres (SMA-EMA) |
Covalent bonding | Green corrosion inhibitors for metals | [68] |
| β-D-galactosidase | Chitosan | Covalent bonding | Hydrolysis o-nitrophenyl-β-D-galactopyranoside |
[69] |
| Lipase | Fe3O4-PCPA-EGDE nanoparticles | Covalent bonding | Hydrolysis olive oil | [56] |
| Polygalacturonase | Calcium alginate microspheres | Covalent bonding | Apple juice clarificatin | [58] |
| YADH | Chitin-shellac microspheres | Covalent bonding | Convert alcohols to aldehydes or ketones | [60] |
| Nitrilase | Cellulose microspheres | Covalent bonding | Hydrolysis of mandelonitrile | [70] |
| Lipase | Fe3O4@SiO2 magnetic nanoparticles | Adsorption | Hydrolysis p-nitrophenyl palmitate | [67] |
| Papain | Magnetic nanoparticles | Adsorption | Hydrolyze allergenic proteins | [66] |
固定化酶因兼具游离酶的催化效率高、底物特异性强、节能环保等优点,同时改善了酶的催化稳定性和可循环性,从而得到了广泛的应用。下面将主要介绍固定化酶在医药、废水处理和生物传感领域的应用。
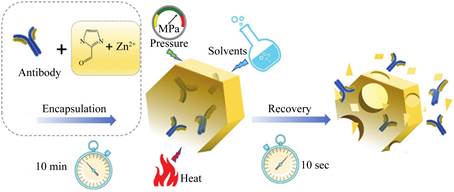
2.1 医药酶等生物分子作为高效催化剂可应用于医学研究和药品制造。Feng等[33]将人免疫球蛋白多克隆抗体、山羊抗牛血清白蛋白多克隆抗体封装在ZIFs中,利用MOF的不稳定性,抗体在酸性环境下可快速高效释放(图 11)。Chen等[62]用磁性纳米颗粒固定青霉素G酰基转移酶用于β-内酰胺类抗生素的生产。牛奶过敏蛋白是引起牛奶过敏的主要原因,去除牛奶过敏蛋白最常用的方法是蛋白酶水解。Feng等[66]用磁性纳米颗粒固定蛋白酶,不仅可以有效去除过敏蛋白,而且通过磁性能够快速回收蛋白酶,防止引入新的过敏蛋白。凝血和血栓形成是生物医学材料面临的最大挑战,当血液接触到异物表面时,免疫系统会对外来接触做出反应,使血小板粘附,导致血栓形成。Ji等[71]用多巴胺涂覆的聚砜(polysulfone,PSf)固定纳豆激酶和蚓激酶,固定酶的膜具有较低的血浆蛋白吸附率、溶血率、血小板粘附率和较长的凝血时间,可有效防止血栓的形成。总之,多孔纳米材料的固定化促进了酶在医药行业的工业化应用。
由于近些年来的水危机,污水处理已经引起外界的广泛关注,水中的有机污染物难降解,具有毒性和致癌性。酶作为一种环保高效的催化剂,可被用于处理废水中的有机污染物。Gao等[20]用多级结构的Ni基MOF固定辣根过氧化物酶和细胞色素C,可用于快速降解工业废水中的2, 4-二氯苯酚和利福昔明。Jia等[21]用介孔MOF-MIL-53(Al)固定化漆酶,可在120 min内去除99.24%的5-氯-2-(2, 4-二氯苯氧基)苯酚。Mehta等[24]用UIO-66-NH2固定有机磷酸水解酶,用于降解水中的有机磷农药。Nartop等[64]将乙酰胆碱酶共价固定在聚合物微球TrisPS-pyr上,用于处理废水中的有机磷酸盐和氨基甲酸酯。固定化增强了酶在污水环境中的稳定性,可有效回收和多次使用,促进了酶在废水处理领域的工业应用。
2.3 生物传感器生物传感器借助酶对底物的高选择性,可实现对目标分子快速灵敏的检测。Zhong等[15]将葡萄糖氧化酶固定在具有类似过氧化物酶活性的介孔Zr基MOF-545上得到模拟多酶系统,可用于葡萄糖快速检测的比色生物传感器,具有检测限低(0.28 μmol/L)和特异性高的特点。Nowroozi-Nejad等[26]用Fe-MIL-88NH2固定化的萤光素酶在Mg2+和分子氧存在下与底物反应生成光、氧化萤光素、CO2和AMP,用于检测生物体中的三磷酸腺苷(ATP)。Wu等[29]用无定形MOF载体固定葡萄糖氧化酶动态检测活细胞中的葡萄糖,用于区分正常细胞和癌细胞。Lyu等[31]用原位包埋法制备了Cyt c@ZIF-8复合材料,该复合物可用于过氧化氢和爆炸性有机过氧化物(如过氧化甲乙酮)的荧光检测。生物分子有手性亚基(即氨基酸)组成的天然构象,能够提供特定相互作用的两性特征,可以很好地区分对映异构体。Zhang等[52]将溶菌酶固定在PMDA-TAPT-COF上用于高效液相色谱,实现对手性物质的检测和分离。总之,固定化酶作为一种高效稳定的多相催化剂,在生物传感器领域有广阔的应用前景。
3 总结和展望本文综述了MOF、COF、多孔微球固定化酶的研究进展并分析了每种材料的特点。载体与酶的结合主要分为吸附、共价连接和原位包埋3种方式。固定化提高了酶的耐热性、耐酸碱性、稳定性以及可循环性,促进了酶的商业化应用。但大部分固定化酶的催化效率小于游离酶,其原因主要有3点:(1)载体的孔径限制会阻碍酶与底物之间的传质;(2)酶的固载率低;(3)在固定过程中酶的构象受到破坏。针对上述问题,我们可以从以下几方面考虑:(1)对载体修饰改性以形成分级多孔结构来减小阻力或功能化载体上的基团,促进底物和酶之间的相互作用;(2)建模和仿真模拟研究可以为酶和载体孔道之间的尺寸匹配提供理论依据,有助于调控和设计载体孔径,确定酶的最佳构型,提高负载率和催化活性;(3)加入离子液体也有利于复合酶催化性能的增强。早期,我们团队将甲酸脱氢酶(formate dehydrogenase,FDH)、甲醛脱氢酶、乙醇脱氢酶固定在再生纤维素薄膜上构筑多酶催化系统用于CO2到甲醇的转化,研究发现,在催化体系中添加20%的胆碱谷氨酸离子液体([CH][Glu])后,产量增加了3.5倍,分子模拟动力学显示水中的CO2很容易从酶活性位点中心扩散出去,而FDH在[CH][Glu]中的构象使CO2在酶活性位点附近停留的时间更长,二氧化碳的转化率也更高[72]。离子液体和载体的整合为提高固定化酶的催化效率提供了一条可行的途径。
另外,固定化酶技术的研究主要是在实验室规模上进行的,能否在实际应用中实现大规模连续化操作也是一个挑战。因此,对固定化酶反应器(如填充床反应器、磁稳定流化床反应器、微通道反应器等)的研究和固定化技术的创新也应是未来关注的方向[73]。
| [1] |
Sheldon RA, Woodley JM. Role of biocatalysis in sustainable chemistry[J]. Chemical Reviews, 2018, 118(2): 801-838. DOI:10.1021/acs.chemrev.7b00203 |
| [2] |
Cipolatti EP, Valério A, Henriques RO, et al. Nanomaterials for biocatalyst immobilization-state of the art and future trends[J]. RSC Advances, 2016, 6(106): 104675-104692. DOI:10.1039/C6RA22047A |
| [3] |
Zhai R, Yuan YF, Jiao FL, et al. Facile synthesis of magnetic metal organic frameworks for highly efficient proteolytic digestion used in mass spectrometry-based proteomics[J]. Analytica Chimica Acta, 2017, 994: 19-28. DOI:10.1016/j.aca.2017.08.048 |
| [4] |
Boudrant J, Woodley JM, Fernandez-Lafuente R. Parameters necessary to define an immobilized enzyme preparation[J]. Process Biochemistry, 2020, 90: 66-80. DOI:10.1016/j.procbio.2019.11.026 |
| [5] |
Jun LY, Yon LS, Mubarak NM, et al. An overview of immobilized enzyme technologies for dye and phenolic removal from wastewater[J]. Journal of Environmental Chemical Engineering, 2019, 7(2): 102961. DOI:10.1016/j.jece.2019.102961 |
| [6] |
Abdelhamid MAA, Yeo KB, Ki MR, et al. Self-encapsulation and controlled release of recombinant proteins using novel silica-forming peptides as fusion linkers[J]. International Journal of Biological Macromolecules, 2019, 125: 1175-1183. DOI:10.1016/j.ijbiomac.2018.12.160 |
| [7] |
Akkas T, Zakharyuta A, Taralp A, et al. Cross-linked enzyme lyophilisates (CLELs) of urease: A new method to immobilize ureases[J]. Enzyme and Microbial Technology, 2020, 132: 109390. DOI:10.1016/j.enzmictec.2019.109390 |
| [8] |
Park SH, Soetyono F, Kim HK. Cadaverine production by using cross-linked enzyme aggregate of Escherichia coli lysine decarboxylase[J]. Journal of Microbiology and Biotechnology, 2017, 27(2): 289-296. |
| [9] |
Hu YL, Dai LM, Liu DH, et al. Progress & prospect of metal-organic frameworks (MOFs) for enzyme immobilization (enzyme/MOFs)[J]. Renewable and Sustainable Energy Reviews, 2018, 91: 793-801. DOI:10.1016/j.rser.2018.04.103 |
| [10] |
Zdarta J, Meyer A, Jesionowski T, et al. A general overview of support materials for enzyme immobilization: characteristics, properties, practical utility[J]. Catalysts, 2018, 8(2): 92. DOI:10.3390/catal8020092 |
| [11] |
An HD, Li MM, Gao J, et al. Incorporation of biomolecules in Metal-Organic Frameworks for advanced applications[J]. Coordination Chemistry Reviews, 2019, 384: 90-106. DOI:10.1016/j.ccr.2019.01.001 |
| [12] |
Wu XL, Hou M, Ge J. Metal–organic frameworks and inorganic nanoflowers: a type of emerging inorganic crystal nanocarrier for enzyme immobilization[J]. Catalysis Science & Technology, 2015, 5(12): 5077-5085. |
| [13] |
Ma WJ, Jiang Q, Yu P, et al. Zeolitic imidazolate framework-based electrochemical biosensor for in vivo electrochemical measurements[J]. Analytical Chemistry, 2013, 85(15): 7550-7557. DOI:10.1021/ac401576u |
| [14] |
Zhao M, Zhang XM, Deng CH. Rational synthesis of novel recyclable Fe3O4@MOF nanocomposites for enzymatic digestion[J]. Chemical Communications, 2015, 51(38): 8116-8119. DOI:10.1039/C5CC01908G |
| [15] |
Zhong X, Xia H, Huang WQ, et al. Biomimetic metal-organic frameworks mediated hybrid multi-enzyme mimic for tandem catalysis[J]. Chemical Engineering Journal, 2020, 381: 122758. DOI:10.1016/j.cej.2019.122758 |
| [16] |
Zhong ZW, Pang SL, Wu YW, et al. Synthesis and characterization of mesoporous Cu-MOF for laccase immobilization[J]. Journal of Chemical Technology & Biotechnology, 2017, 92(7): 1841-1847. |
| [17] |
Liu X, Qi W, Wang YF, et al. A facile strategy for enzyme immobilization with highly stable hierarchically porous metal-organic frameworks[J]. Nanoscale, 2017, 9(44): 17561-17570. DOI:10.1039/C7NR06019J |
| [18] |
Kim Y, Yang T, Yun G, et al. Hydrolytic transformation of microporous metal-organic frameworks to hierarchical micro- and mesoporous MOFs[J]. Angewandte Chemie International Edition, 2015, 54(45): 13273-13278. DOI:10.1002/anie.201506391 |
| [19] |
Pang SL, Wu YW, Zhang XQ, et al. Immobilization of laccase via adsorption onto bimodal mesoporous Zr-MOF[J]. Process Biochemistry, 2016, 51(2): 229-239. |
| [20] |
Gao X, Ding Y, Sheng YD, et al. Enzyme immobilization in MOF-derived porous NiO with hierarchical structure: An efficient and stable enzymatic reactor[J]. ChemCatChem, 2019, 11(12): 2828-2836. DOI:10.1002/cctc.201900611 |
| [21] |
Jia YT, Chen YC, Luo J, et al. Immobilization of laccase onto meso-MIL-53(Al) via physical adsorption for the catalytic conversion of triclosan[J]. Ecotoxicology and Environmental Safety, 2019, 184: 109670. DOI:10.1016/j.ecoenv.2019.109670 |
| [22] |
Ahmed IN, Yang XL, Dubale AA, et al. Hydrolysis of cellulose using cellulase physically immobilized on highly stable zirconium based metal-organic frameworks[J]. Bioresource Technology, 2018, 270: 377-382. DOI:10.1016/j.biortech.2018.09.077 |
| [23] |
Lian XZ, Fang Y, Joseph E, et al. Enzyme-MOF (metal-organic framework) composites[J]. Chemical Society Reviews, 2017, 46(11): 3386-3401. DOI:10.1039/C7CS00058H |
| [24] |
Mehta J, Dhaka S, Paul AK, et al. Organophosphate hydrolase conjugated UiO-66-NH2 MOF based highly sensitive optical detection of methyl parathion[J]. Environmental Research, 2019, 174: 46-53. DOI:10.1016/j.envres.2019.04.018 |
| [25] |
Chen XX, Xue S, Lin YL, et al. Immobilization of porcine pancreatic lipase onto a metal-organic framework, PPL@MOF: A new platform for efficient ligand discovery from natural herbs[J]. Analytica Chimica Acta, 2020, 1099: 94-102. DOI:10.1016/j.aca.2019.11.042 |
| [26] |
Nowroozi-Nejad Z, Bahramian B, Hosseinkhani S. Efficient immobilization of firefly luciferase in a metal organic framework: Fe-MIL-88(NH2) as a mighty support for this purpose[J]. Enzyme and Microbial Technology, 2019, 121: 59-67. DOI:10.1016/j.enzmictec.2018.10.011 |
| [27] |
Wang JZ, Zhao GH, Yu FQ. Facile preparation of Fe3O4@MOF core-shell microspheres for lipase immobilization[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 69: 139-145. DOI:10.1016/j.jtice.2016.10.004 |
| [28] |
Liang K, Ricco R, Doherty CM, et al. Biomimetic mineralization of metal-organic frameworks as protective coatings for biomacromolecules[J]. Nature Communications, 2015, 6(1): 7240. DOI:10.1038/ncomms8240 |
| [29] |
Wu XL, Yue H, Zhang YY, et al. Packaging and delivering enzymes by amorphous metal-organic frameworks[J]. Nature Communications, 2019, 10(1): 5165. DOI:10.1038/s41467-019-13153-x |
| [30] |
Zhu GX, Zhang MZ, Bu Y, et al. Enzyme-embedded metal-organic framework colloidosomes via an emulsion-based approach[J]. Chemistry – An Asian Journal, 2018, 13(19): 2891-2896. DOI:10.1002/asia.201800976 |
| [31] |
Lyu FJ, Zhang YF, Zare RN, et al. One-pot synthesis of protein-embedded metal-organic frameworks with enhanced biological activities[J]. Nano Letters, 2014, 14(10): 5761-5765. DOI:10.1021/nl5026419 |
| [32] |
Knedel TO, Ricklefs E, Schlüsener C, et al. Laccase encapsulation in ZIF-8 metal-organic framework shows stability enhancement and substrate selectivity[J]. Chemistry Open, 2019, 8(11): 1337-1344. DOI:10.1002/open.201900146 |
| [33] |
Feng YF, Wang HR, Zhang SN, et al. Antibodies@MOFs: An in vitro protective coating for preparation and storage of biopharmaceuticals[J]. Advanced Materials, 2019, 31(2): e1805148. |
| [34] |
Rafiei S, Tangestaninejad S, Horcajada P, et al. Efficient biodiesel production using a lipase@ZIF-67 nanobioreactor[J]. Chemical Engineering Journal, 2018, 334: 1233-1241. DOI:10.1016/j.cej.2017.10.094 |
| [35] |
Zhang HF, Zhao M, Lin YS. Stability of ZIF-8 in water under ambient conditions[J]. Microporous and Mesoporous Materials, 2019, 279: 201-210. DOI:10.1016/j.micromeso.2018.12.035 |
| [36] |
Malekmohammadi M, Fatemi S, Razavian M, et al. A comparative study on ZIF-8 synthesis in aqueous and methanolic solutions: Effect of temperature and ligand content[J]. Solid State Sciences, 2019, 91: 108-112. DOI:10.1016/j.solidstatesciences.2019.03.022 |
| [37] |
Sun YY, Shi JF, Zhang SH, et al. Hierarchically porous and water-tolerant metal–organic frameworks for enzyme encapsulation[J]. Industrial & Engineering Chemistry Research, 2019, 58(28): 12835-12844. |
| [38] |
Wei TH, Wu SH, Huang YD, et al. Rapid mechanochemical encapsulation of biocatalysts into robust metal–organic frameworks[J]. Nature Communications, 2019, 10(1): 5002. DOI:10.1038/s41467-019-12966-0 |
| [39] |
Hu C, Bai YX, Hou M, et al. Defect-induced activity enhancement of enzyme-encapsulated metal—organic frameworks revealed in microfluidic gradient mixing synthesis[J]. Science Advances, 2020, 6(5): eaax5785. |
| [40] |
Gkaniatsou E, Sicard C, Ricoux R, et al. Metal–organic frameworks: a novel host platform for enzymatic catalysis and detection[J]. Materials Horizons, 2017, 4(1): 55-63. |
| [41] |
Liu G, Xu Y, Han YD, et al. Immobilization of lysozyme proteins on a hierarchical zeolitic imidazolate framework (ZIF-8)[J]. Dalton Transactions, 2017, 46(7): 2114-2121. DOI:10.1039/C6DT04582K |
| [42] |
Zare A, Bordbar AK, Jafarian F, et al. Candida rugosa lipase immobilization on various chemically modified Chromium terephthalate MIL-101[J]. Journal of Molecular Liquids, 2018, 254: 137-144. DOI:10.1016/j.molliq.2018.01.097 |
| [43] |
Wang CH, Gao J, Tan HL. Integrated antibody with catalytic metal-organic framework for colorimetric immunoassay[J]. ACS Applied Materials & Interfaces, 2018, 10(30): 25113-25120. |
| [44] |
Wang QQ, Zhang XP, Huang L, et al. GOx@ZIF-8(NiPd) nanoflower: An artificial enzyme system for tandem catalysis[J]. Angewandte Chemie International Edition, 2017, 56(50): 16082-16085. DOI:10.1002/anie.201710418 |
| [45] |
Waller PJ, Gándara F, Yaghi OM. Chemistry of covalent organic frameworks[J]. Accounts of Chemical Research, 2015, 48(12): 3053-3063. DOI:10.1021/acs.accounts.5b00369 |
| [46] |
Bisbey RP, Dichtel WR. Covalent organic frameworks as a platform for multidimensional polymerization[J]. ACS Central Science, 2017, 3(6): 533-543. DOI:10.1021/acscentsci.7b00127 |
| [47] |
Aiyappa HB, Thote J, Shinde DB, et al. Cobalt-modified covalent organic framework as a robust water oxidation electrocatalyst[J]. Chemistry of Materials, 2016, 28(12): 4375-4379. DOI:10.1021/acs.chemmater.6b01370 |
| [48] |
Xin YX, Wang C, Wang Y, et al. Encapsulation of an ionic liquid into the nanopores of a 3D covalent organic framework[J]. RSC Advances, 2017, 7(3): 1697-1700. DOI:10.1039/C6RA27213D |
| [49] |
Sun Q, Fu CW, Aguila B, et al. Pore environment control and enhanced performance of enzymes infiltrated in covalent organic frameworks[J]. Journal of the American Chemical Society, 2018, 140(3): 984-992. DOI:10.1021/jacs.7b10642 |
| [50] |
Samui A, Happy, Sahu SK. Integration of α-amylase into covalent organic framework for highly efficient biocatalyst[J]. Microporous and Mesoporous Materials, 2020, 291: 109700. DOI:10.1016/j.micromeso.2019.109700 |
| [51] |
Sun Q, Aguila B, Lan PC, et al. Tuning pore heterogeneity in covalent organic frameworks for enhanced enzyme accessibility and resistance against denaturants[J]. Advanced Materials, 2019, 31(19): e1900008. DOI:10.1002/adma.201900008 |
| [52] |
Zhang SN, Zheng YL, An HD, et al. Covalent organic frameworks with chirality enriched by biomolecules for efficient chiral separation[J]. Angewandte Chemie International Edition, 2018, 57(51): 16754-16759. DOI:10.1002/anie.201810571 |
| [53] |
Wang HP, Jiao FL, Gao FY, et al. Covalent organic framework-coated magnetic graphene as a novel support for trypsin immobilization[J]. Analytical and Bioanalytical Chemistry, 2017, 409(8): 2179-2187. DOI:10.1007/s00216-016-0163-z |
| [54] |
Xiong FF, Jiang LY, Jia Q. Facile synthesis of guanidyl-based magnetic ionic covalent organic framework composites for selective enrichment of phosphopeptides[J]. Analytica Chimica Acta, 2020, 1099: 103-110. DOI:10.1016/j.aca.2019.11.058 |
| [55] |
Soozanipour A, Taheri-Kafrani A. Enzyme immobilization on functionalized graphene oxide nanosheets: Efficient and robust biocatalysts[J]. Methods in Enzymology, 2018, 609: 371-403. DOI:10.1016/bs.mie.2018.06.010 |
| [56] |
Tang W, Chen C, Sun W, et al. Low-cost mussel inspired poly(Catechol/Polyamine) modified magnetic nanoparticles as a versatile platform for enhanced activity of immobilized enzyme[J]. International Journal of Biological Macromolecules, 2019, 128: 814-824. DOI:10.1016/j.ijbiomac.2019.01.161 |
| [57] |
Zhang Y, Yue Q, Zagho MM, et al. Core-shell magnetic mesoporous silica microspheres with large mesopores for enzyme immobilization in biocatalysis[J]. ACS Applied Materials & Interfaces, 2019, 11(10): 10356-10363. DOI:10.1021/acsami.8b18721 |
| [58] |
Deng ZY, Wang F, Zhou B, et al. Immobilization of pectinases into calcium alginate microspheres for fruit juice application[J]. Food Hydrocolloids, 2019, 89: 691-699. DOI:10.1016/j.foodhyd.2018.11.031 |
| [59] |
Li J, Ma J, Jiang T, et al. Combined membrane emulsification with biomimetic mineralization: Designing and constructing novel organic-inorganic hybrid microspheres for enzyme immobilization[J]. Composites Science and Technology, 2017, 141: 56-64. DOI:10.1016/j.compscitech.2017.01.008 |
| [60] |
Mei S, Han PP, Wu H, et al. One-pot fabrication of chitin-shellac composite microspheres for efficient enzyme immobilization[J]. Journal of Biotechnology, 2018, 266: 1-8. DOI:10.1016/j.jbiotec.2017.11.015 |
| [61] |
Xue F, Chen Q, Li YL, et al. Immobilized lysozyme onto 1, 2, 3, 4-butanetetracarboxylic (BTCA)-modified magnetic cellulose microsphere for improving bio-catalytic stability and activities[J]. Enzyme and Microbial Technology, 2019, 131: 109425. DOI:10.1016/j.enzmictec.2019.109425 |
| [62] |
Chen X, Yang L, Zhan WC, et al. Immobilization of penicillin G acylase on paramagnetic polymer microspheres with epoxy groups[J]. Chinese Journal of Catalysis, 2018, 39(1): 47-53. |
| [63] |
Jiang JB, Yu YJ, Wang LP, et al. Enzyme immobilized on polyamidoamine-coated magnetic microspheres for alpha-glucosidase inhibitors screening from Radix Paeoniae Rubra extracts accompanied with molecular modeling[J]. Talanta, 2019, 195: 127-136. DOI:10.1016/j.talanta.2018.11.009 |
| [64] |
Nartop D, Yetim NK, Özkan EH, et al. Enzyme immobilization on polymeric microspheres containing Schiff base for detection of organophosphate and carbamate insecticides[J]. Journal of Molecular Structure, 2020, 1200: 127039. DOI:10.1016/j.molstruc.2019.127039 |
| [65] |
Liu L, Sun YH, He LL, et al. Amphiphilic hollow carbonaceous microsphere-encapsulated enzymes: Facile immobilization and robust biocatalytic properties[J]. Enzyme and Microbial Technology, 2015, 79-80: 19-26. DOI:10.1016/j.enzmictec.2015.06.015 |
| [66] |
Feng N, Zhang HY, Li Y, et al. A novel catalytic material for hydrolyzing cow's milk allergenic proteins: Papain-Cu3(PO4)2·3H2O-magnetic nanoflowers[J]. Food Chemistry, 2020, 311: 125911. DOI:10.1016/j.foodchem.2019.125911 |
| [67] |
Shi Y, Liu W, Tao QL, et al. Immobilization of lipase by adsorption onto magnetic nanoparticles in organic solvents[J]. Journal of Nanoscience and Nanotechnology, 2016, 16(1): 601-607. |
| [68] |
Bao JP, Zhang HY, Zhao XH, et al. Biomass polymeric microspheres containing aldehyde groups: Immobilizing and controlled-releasing amino acids as green metal corrosion inhibitor[J]. Chemical Engineering Journal, 2018, 341: 146-156. DOI:10.1016/j.cej.2018.02.047 |
| [69] |
Flores EEE, Cardoso FD, Siqueira LB, et al. Influence of reaction parameters in the polymerization between genipin and chitosan for enzyme immobilization[J]. Process Biochemistry, 2019, 84: 73-80. DOI:10.1016/j.procbio.2019.06.001 |
| [70] |
Jamwal S, Dautoo UK, Ranote S, et al. Enhanced catalytic activity of new acryloyl crosslinked cellulose dialdehyde-nitrilase Schiff base and its reduced form for nitrile hydrolysis[J]. International Journal of Biological Macromolecules, 2019, 131: 117-126. DOI:10.1016/j.ijbiomac.2019.03.034 |
| [71] |
Ji MB, Chen XR, Luo JQ, et al. Improved blood compatibility of polysulfone membrane by anticoagulant protein immobilization[J]. Colloids and Surfaces B: Biointerfaces, 2019, 175: 586-595. DOI:10.1016/j.colsurfb.2018.12.026 |
| [72] |
Zhang ZB, Muschiol J, Huang YH, et al. Efficient ionic liquid-based platform for multi-enzymatic conversion of carbon dioxide to methanol[J]. Green Chemistry, 2018, 20(18): 4339-4348. DOI:10.1039/C8GC02230E |
| [73] |
Liu DM, Dong C. Recent advances in nano-carrier immobilized enzymes and their applications[J]. Process Biochemistry, 2020, 92: 464-475. DOI:10.1016/j.procbio.2020.02.005 |
 2020, Vol. 47
2020, Vol. 47