扩展功能
文章信息
- 董文玥, 姚培圆, 吴洽庆
- DONG Wen-Yue, YAO Pei-Yuan, WU Qia-Qing
- 纳米材料固定化酶的研究进展
- Research progress of immobilized enzyme on nanocarriers
- 微生物学通报, 2020, 47(7): 2161-2176
- Microbiology China, 2020, 47(7): 2161-2176
- DOI: 10.13344/j.microbiol.china.200318
-
文章历史
- 收稿日期: 2020-03-30
- 接受日期: 2020-06-08
- 网络首发日期: 2020-06-15
生物催化(biocatalysis)是指利用酶或有机体(细胞、细胞器等)作为催化剂实现化学转化的过程。酶作为高效的生物催化剂,具有反应条件温和、反应速率快、底物专一性强等优势,广泛应用于化工、食品、医药和环境等领域。许多天然酶的大规模制备比较困难,投入反应后较难回收再使用,而且稳定性和对环境的敏感性都极大地限制了其工业应用。为了弥补天然酶的缺陷,科研人员将酶固定在固相载体上以提高其稳定性,达到回收再使用的目的[1]。
由于酶固定化过程中所采用的固定化方法、载体等会在一定程度上导致酶失活,从而降低酶的催化性能。在过去20年中,科研人员致力于研究新的固定化载体以及更先进的固定化方法,使固定化材料的载酶能力、固定化酶活力和稳定性等方面得到了极大提高,也降低了酶的生产成本。这些载体和技术包括交联酶聚集体、多孔支持物和以纳米材料为载体的酶固定化[2]。纳米材料是指在三维空间中至少有一维处于纳米尺寸(0.1-100 nm)或由它们作为基本单元构成的材料,具有特殊的光学、磁学、电学等理化特性。与传统大尺寸材料相比,纳米材料还具有大比表面积、表面易于修饰、与酶分子大小相近等优点,作为一种新型的酶固定化载体在生物催化技术领域得到了广泛关注[3]。另外,计算机辅助设计也可能为纳米材料固定化酶的研究带来极大的便利,通过预测和分析进行有效的固定化酶设计与合成,使获得的生物催化剂在开发速度、生产成本和可操作性等方面具有独特的优势。
随着纳米技术的发展,一些无机纳米材料被发现具有类似酶的催化活性。这些纳米材料可以催化天然酶的底物反应,并且具有与天然酶相似的催化机制,因此被定义为纳米酶(nanozymes)[4]。目前已报道的纳米酶大多是金属氧化物、贵金属和碳基纳米材料,它们可以模拟一些酶的活性,例如氧化物酶、超氧化物酶、过氧化氢酶、超氧化物歧化酶和磷酸酶等[5-6],将纳米酶与生物酶的催化功能耦合是一个重要的发展方向。本文对近年来在纳米材料固定化酶领域所用的纳米载体材料和固定化方法进行了系统的介绍,阐述了纳米材料的结构和制备过程及其对固定化酶性能产生的影响,总结了纳米材料固定化酶的应用领域并展望了其前景。
1 固定化酶的纳米材料用于酶固定的纳米载体材料主要包括磁性纳米材料和非磁性纳米材料。目前,采用纳米材料进行酶的固定已取得了一系列研究成果(表 1),随着纳米技术的进一步发展,必将有更多的新材料被应用于酶的固定化。
| 酶 Enzyme |
载体 Carrier |
固定化方法 Immobilization method |
应用 Application |
参考文献 References |
| 脂肪酶 Lipase |
磁性纳米颗粒 Magnetic nanoparticles |
共价结合 Covalent binding |
鱼油水解 Fish oil hydrolysis |
[7] |
| 脂肪酶 Lipase |
金纳米颗粒 Gold nanoparticles |
物理吸附 Physical adsorption |
阿魏酸乙酯酯基交换 Transesterification of ferulic acid ethyl ester |
[8] |
| 脂肪酶 Lipase |
功能化介孔材料SBA-15 Functional mesoporous material SBA-15 |
物理吸附 Physical adsorption |
二酰基甘油合成 Synthesis of diacylglycerol |
[9] |
| 脂肪酶 Lipase |
壳聚糖-介孔氧化硅复合纳米材料 Chitosan-mesoporous silica hybrid nanomaterials |
共价结合 Covalent binding |
生物合成 Biosynthesis |
[10] |
| 脂肪酶 Lipase |
多金属有机框架 Polyoxometalate-metal organic framework |
包埋 Encapsulation |
肉桂酸酯化 Esterification of cinnamic acid |
[11] |
| 脂肪酶 Lipase |
介孔微孔泡沫塑料 Mesoporous microcellular foam |
瓶中船 Ship in a bottle |
(R, S)-α-四氢萘醇与醋酸乙烯酯的 对映选择性酯化 Enantioselective esterification of (R, S)-alpha-tetralol and vinyl acetate |
[12] |
| 醇脱氢酶 Alcohol dehydrogenase |
羧基石墨烯衍生物 Carboxyl graphene derivatives |
共价结合 Covalent binding |
二氧化碳还原为甲醇 Reduction of CO2 to methanol |
[13] |
| 醇氧化酶 Alcohol oxidase |
聚氟醚-g-聚乙二醇和多壁碳纳米管 Polyfluorene-g-poly(ethylene glycol) and multiwalled carbon nanotubes |
物理吸附 Physical adsorption |
生物传感器用于酒精饮料中乙醇 含量的分析 Biosensor for the analysis of ethanol contents in alcoholic drinks |
[14] |
| 甲酸脱氢酶 Formate dehydrogenase |
聚乙烯亚胺接枝的氧化石墨烯 Polyethylenimine-grafted graphene oxide |
物理吸附 Physical adsorption |
生物合成和生物传感 Biosynthesis and biosensing |
[15] |
| 半乳糖氧化酶 Galactose oxidase |
碳纳米管 Carbon nanotubes |
物理吸附 Physical adsorption |
生物传感器用于半乳糖血症 Biosensor for galactosemia |
[16] |
| 胆碱酯酶 Cholinesterase |
聚乙烯醇和聚丙烯酸-纳米硅复合材料 Nano-silicon with polyvinyl alcohol and polyacrylic acid composites |
物理吸附 Physical adsorption |
氯化乙酰胆碱水解 Decomposition of acetylcholine chloride |
[17] |
| 脲酶 Urease |
Fe3O4/MWCNT-聚苯胺纳米复合材料 Fe3O4/MWCNT-polyaniline nanocomposite film |
物理吸附 Physical adsorption |
生物传感器用于牛奶中尿素 的检测 Biosensor for detection of urea in milk samples |
[18] |
| 胆固醇氧化酶 Cholesterol oxidase |
金属有机框架 Metal-organic frameworks (MOFs) |
物理吸附 Physical adsorption |
生物传感器用于胆固醇检测 Biosensor for the determination of cholesterol |
[19] |
| 辣根过氧化物酶和细胞 色素C Horseradish peroxidase and cytochrome C |
金属有机框架 Metal-organic frameworks (MOFs) |
物理吸附 Physical adsorption |
废水中2, 4-二氯苯酚和利福昔明 的降解 Degradation of 2, 4-dichlorophenol and rifaximin in artificial wastewater |
[20] |
| 酪氨酸酶 Tyrosinase |
碳纳米管、氧化石墨烯、金纳米颗粒 和壳聚糖 Carbon nanotubes, graphene oxide, gold nanoparticles in chitosan |
物理吸附 Physical adsorption |
生物传感器用于黄曲毒素的检测 Biosensors for the determination of aflatoxin |
[21] |
| 漆酶 Laccase |
氧化石墨烯 Graphene oxide |
共价结合 Covalent binding |
有色废水中偶氮染料的生物 降解 Biodegradation of azo dyes in colored wastewater |
[22] |
| 漆酶 Laccase |
聚吡咯银纳米颗粒丝网印刷碳电极 纳米复合材料 Polypyrrole gold nanoparticle- screen-printed carbon electrode composite film |
物理吸附 Physical adsorption |
蜂胶中多酚的检测 Determination of polyphenols in propolis |
[23] |
| 漆酶 Laccase |
二硫化钼纳米薄片和金纳米颗粒 MoS2 nanosheets and gold nanoparticles |
物理吸附 Physical adsorption |
生物传感器用于儿茶酚的检测 Biosensors for the determination of catechol |
[24] |
| 过氧化氢酶 Catalase |
石墨烯 Graphene |
共价结合 Covalent binding |
生物合成 Biosynthesis |
[25] |
| 纤维素酶 Cellulase |
磁性纳米材料 Magnetic nanomaterials |
物理吸附 Physical adsorption |
纤维素水解 Hydrolysis of cellulose |
[26] |
| 葡萄糖氧化酶 Glucose oxidase |
碳纳米管 Carbon nanotubes |
物理吸附 Physical adsorption |
葡萄糖生物传感器 Glucose biosensor |
[27] |
| 环氧化物水解酶 Epoxide hydrolase |
介孔氧化硅 Mesoporous silica |
瓶中船 Ship in a bottle |
氧化苯乙烯外消旋物的拆分 Resolutions of racemic styrene oxide |
[28] |
| 腈水合酶 Nitrile hydratase |
金属有机骨架 MOF ZIF-67 Metal-organic frameworks MOF ZIF-67 |
包埋 Encapsulation |
烟酰胺的合成 Synthesis of nicotinamide |
[29] |
磁性纳米颗粒(magnetic nanoparticles,MNPs)具有良好的机械稳定性和大的比表面积,可以提高酶的负载率并减少固定化酶内部的传质阻力。同时,又可以在外加磁场下快速分离,极大地简化了固定化酶的回收再利用和酶促反应后产物的分离纯化。因此,磁性纳米材料作为载体在酶的固定化领域引起了极大的关注[30]。在各种磁性纳米材料中,Fe3O4由于其较高的磁饱和强度、良好的磁导向性、生物相容性、无毒性和价廉易得等优点,在固定化酶领域应用最普遍。以磁性纳米材料为载体进行酶的固定,有利于酶活力和稳定性的提高,对酶结构、功能和特异性等酶学性质有一定的影响。例如,Verma等[7]将重组枯草芽孢杆菌脂肪酶共价固定在磁性纳米颗粒上,酶与纳米颗粒的蛋白结合效率达到95%;研究发现,固定化酶的热稳定性是游离酶的两倍,在循环20个周期后,仍能保持50%以上的初始活性;与游离酶相比,固定化酶对二十二碳六烯酸的选择性提高了1.5倍,并保留了对二十碳五烯酸的选择性;通过透射电镜、圆二色谱等手段进行表征,研究磁性纳米颗粒对固定化酶二级结构的影响,结果表明,固定化酶仍保留了84%的天然α-螺旋结构,从而维持了酶的较高活性。
由于MNPs会在空气或酸性环境下发生氧化或溶解,而且MNPs之间的磁引力易于磁性粒子发生聚集,从而影响固定化酶的活性和分散性能,大大限制了其应用。为了克服这些因素的影响,提高固定化效果,通常需要对载体表面进行修饰,特别是以聚合物修饰的磁性纳米载体方面研究较多。高分子聚合物容易形成交联凝胶网络,从而把MNPs紧紧包裹在高分子微球中,有效阻止纳米粒子的团聚,提高了分散稳定性。Francolini等[31]将褶皱假丝酵母脂肪酶固定在长烷基链功能化聚丙烯酰胺涂覆的Fe3O4磁性纳米颗粒上,研究发现,聚合物涂层对MNPs与脂肪酶的亲和力有提高作用,并且固定化酶的活性及稳定性与烷基链的长度有关。
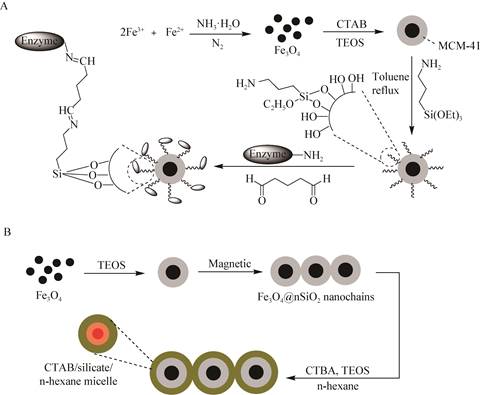
另外,在MNPs中导入或包覆硅基纳米材料形成核壳结构也是当前广泛使用的保护方法。Xie等[32]以磁性纳米颗粒Fe3O4为核心,在其表面包覆介孔材料MCM-41,得到具有核壳结构的纳米复合材料Fe3O4@MCM-41,通过戊二醛共价交联将褶皱假丝酵母脂肪酶固定在其表面(图 1A),表征结果显示,这种核壳结构的复合载体能够有效克服磁性纳米粒子之间强磁偶极-偶极相互作用。Wan等[33]通过磁场导向,合成了磁性Fe3O4纳米颗粒和二氧化硅在其界面生长包覆的一维纳米链,然后在正己烷存在下,通过十六烷基三甲基溴化铵与正硅酸四乙酯的界面共组装,进一步包覆上一层孔径可调的介孔二氧化硅,最终获得具有双壳层结构的磁性介孔二氧化硅纳米链Fe3O4@nSiO2@mSiO2 (图 1B);这种独特的双壳层结构更有利于负载贵金属和酶等,在外加动态磁场中能随着磁场方向的变化产生快速转动现象,加速了催化反应的进行。
非磁性纳米材料包括无机纳米颗粒、有机聚合物纳米材料和金属有机框架。无机纳米颗粒(nanoparticles,NPs)被广泛用于多种酶的固定化,常用到的无机纳米颗粒有纳米金、碳基纳米材料及介孔材料等[8, 15-16]。
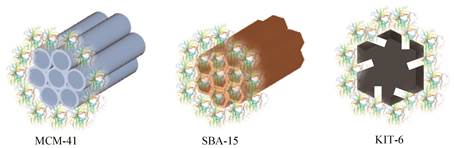
介孔材料是一种孔径在2-50 nm、具有巨大表面积和三维孔道结构的新型材料,其纳米尺寸孔径允许酶分子进入孔道,同时其功能性表面基团可以根据目标分子进行调节,作为酶的固定化载体表现出很高的优越性[34]。这类材料多为氧化物,如SiO2、Al2O3、TiO2、ZrO2等,通常是立方体或六棱柱结构。截至目前,介孔氧化硅研究最为广泛。用于酶固定化的介孔氧化硅材料主要有MCM-41、SBA-15、MSU-H、KIT-6和MCF等[35-37]。近年来,有许多研究发现介孔材料固定化酶能够提高酶的活性、稳定性以及底物特异性。
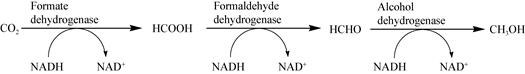
Shao等[38]为了实现碳酸酐酶在二氧化碳捕集过程中的应用,采用不同尺寸和孔径的介孔材料作为固定化碳酸酐酶的载体(图 2),实验结果表明,KIT-6、SBA-15和MCM-41固定化酶的半衰期分别是游离酶的3.0、2.8和2.0倍;当以SBA-15为载体时,由于材料的孔径略大于酶分子,碳酸酐酶能够同时吸附在材料表面和孔径中,使得酶加载量更高,而且在40 ℃维持6 d后仍保留98%的初始活力。甲醛脱氢酶能够将甲酸还原为甲醛,通过级联反应实现CO2到甲醇的转化(图 3),但是甲醛脱氢酶的活性较低,并且对底物/产物浓度和pH较为敏感;为了提高甲醛脱氢酶的催化性能,Gomes等通过物理吸附将甲醛脱氢酶固定在孔径分别为26.8 nm和36.9 nm的介孔MCF上,材料表面经辛基、巯基丙基或氯甲基功能化;研究发现,甲醛脱氢酶均能够成功固定在这两种材料上,酶负载量分别为300 mg/g和750 mg/g,然而仅有固定在较大孔径的甲醛脱氢酶保留了其催化活性,并且明显高于游离酶的活性,这可能是由于反应过程中酶结构的变化需要较大的孔径[39]。Coscolín等[40]从卡斯特湖的细菌中分离到一种酯水解酶EH1,其具有广泛的底物谱,能够转化72种酯但均无立体选择性;通过离子交换将该酶固定在氨基功能化的有序介孔材料SBA-15上,研究发现,固定化后该酯水解酶的底物范围缩减到17种酯,并且对(R)-4-氯-3-羟基丁酸乙酯具有立体选择性;这是由于固定在相似大小介孔中的酶分子结构可能发生改变并导致酶活性中心发生变化,进而影响底物在活性中心的构象;同时,通过阳离子相互作用将EH1固定在不同功能化的磁性微粒表面,产生了不同底物选择性的生物催化剂。因此,通过调控固定化策略和固定化材料的粒度、孔径、结构以及材料的功能化,可以设计不同底物选择性和立体选择性的生物催化剂。
|
| 图 3 酶级联反应催化CO2生成甲醇 Figure 3 Enzymatic cascade catalyzes CO2 into methanol |
|
|
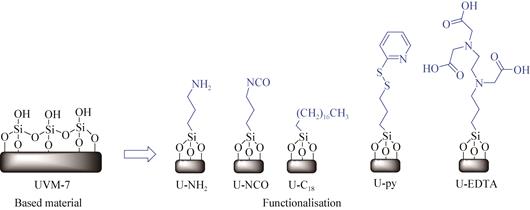
介孔硅表面很容易进行功能化,而且化合物种类繁多,如:有机聚合物、小分子化合物、金属离子和离子液体等[41]。通过引入-NH2、-SH、-CN、-Cl、-C6H5及不同链长烷基等有机功能基团到介孔材料上,这些基团提供了大量反应位点,可以与酶通过共价键或次级键连接,提高了载体对酶的负载量和固定化酶的稳定性,同时部分有机基团进入介孔孔道,使得孔径和孔容减少,防止酶的泄漏[42]。Muňoz-Pina等[43]将多酚氧化酶固定在介孔氧化硅UVM-7上,通过不同的官能团(即胺、羧酸、异氰酸酯、烷烃和吡啶)进行修饰,研究了其酶固定能力(图 4),除了羧酸官能团外,修饰后的介孔材料均得到了较高的酶负载能力和固定化速度。Zhao等[9]采用硅烷偶联剂对SBA-15进行功能化,将疏棉状嗜热丝孢菌脂肪酶(thermomyces lanuginosus lipase,TLL)固定在其表面以生产二酰基甘油(diacylglycerol,DAG);在无溶剂体系中,以母本SBA-15为载体的TLL介导的甘油溶解反应,DAG含量为54.77%±0.63%,三酰基甘油(triacylglycerol,TAG)转化率为77.75%±1.24%;然而,当助溶剂被引入反应体系时,固定化酶的性能却变差,经有机改性后,功能化SBA-15为载体的TLL固定化酶均表现出良好的性能,DAG含量 > 40%,TAG转化率 > 70%;苯基修饰SBA-15为载体的TLL中DAG含量较高,达59.19%±1.10%,在甘油溶解反应中表现出良好的可重复使用性,经过5次重复使用后,初始甘油溶解活性仍为95.21%±4.87%。
金纳米颗粒也是一类非常重要的纳米材料载体,在催化领域的研究引起了人们越来越大的兴趣,纳米金颗粒作为固定化酶载体具有以下优点:(1)制备方法简单、容易再生;(2)保留了Au良好的生物相容性,可以有效避免酶的失活;(3)酶分子中的氨基和半胱氨酸中的巯基可直接结合到金纳米粒子表面用于固定化酶。在金纳米颗粒上固定化酶的例子有:脂肪酶[8]、葡萄糖氧化酶[44]、纤维素酶[45]等。
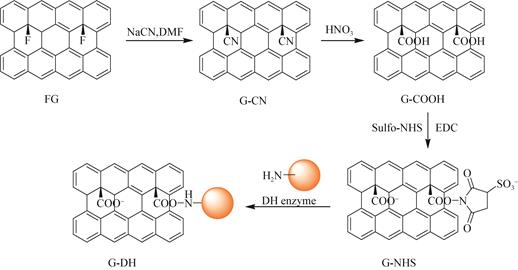
碳基纳米材料,如石墨烯和碳纳米管(carbon nanotubes,CNTs),由于具有耐高温、良好的导热性能、良好的生物相容性、化学惰性等优点,其固定化酶在生物传感器领域取得了广泛的应用。Wee等[46]利用CNTs在酶中的分散特性制备了高灵敏度的苯酚生物传感器:首先将CNTs分散在酪氨酸酶水溶液中,与酪氨酸酶分子进行吸附沉淀交联,获得的固定化酶与酶吸附和酶吸附/交联相比酪氨酸酶活性分别提高了10.5倍和5.4倍;在40 ℃孵育128 h后,其初始活性仍保持29%,而通过吸附和吸附/交联制备的固定化酶则无残留活力。石墨烯是一种具有二维蜂巢晶格结构、单原子厚度的碳基纳米材料,被认为是目前世界上最薄的材料,其表面有环氧基、羧基、羟基等一系列官能团,因此在水中有很好的分散性并易于化学修饰。Seelajaroen等[13]将甲酸脱氢酶、甲醛脱氢酶和醇脱氢酶共价结合在羧基石墨烯衍生物上(图 5),这种纳米级催化剂能够在无辅因子和高电流密度下将二氧化碳还原为甲醇,并且能够维持至少20 h而不会产生其他副产物。
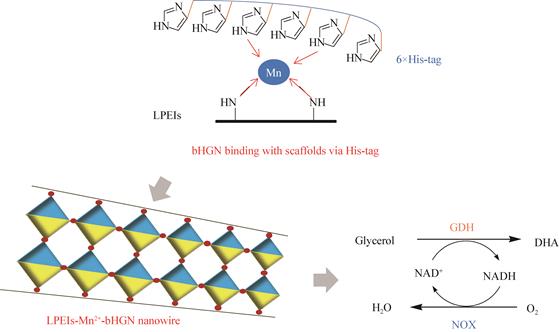
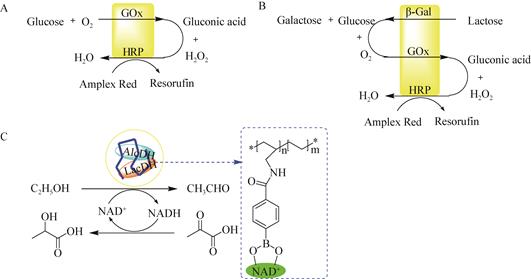
有机聚合物纳米材料具有稳定的形态结构,可通过选择聚合方式和聚合单体从分子水平上来设计合成和制备,而且易控制其尺寸大小和颗粒的均一性,使之在具有小尺寸效应、表面效应和量子隧道效应的同时,还具有其他特定功能,如温度、pH、电场和磁场等响应性,其制备方法包括乳液聚合法、分散聚合法、自组装法和分散共聚法。目前最常用的方法是利用反胶团进行聚合反应从而制备纳米级高分子载体,然后再通过共价交联或吸附的方法对酶进行固定化。如聚苯乙烯、聚甲基丙烯酸甲酯、聚丙烯酸酯、聚丙烯酰胺、聚脲-聚氨酯等已广泛用于酶的固定化[47-48]。Payentko等[17]通过溶胶-凝胶法制备由聚乙烯醇和聚丙烯酸组成的纳米聚合物,用于固定化胆碱酯酶,然后将其加入到二氧化硅颗粒和聚硅氧烷中,催化氯化乙酰胆碱水解反应;固定化酶的活性明显高于天然酶,使用高分散的二氧化硅制备的纳米复合材料中胆碱酯酶活性较高。Zhang等[49]以锰离子螯合线性聚乙烯亚胺(linear polyethylenimine,LPEI)为人工支架,通过多点配位作用自组装双功能氧化还原酶(甘油脱氢酶-NADH氧化酶),制备的LPEIs-Mn2+-bHGN纳米线具有高度有序的叶脉结构,可以防止酶亚基的分离,使酶的多聚体形式更稳定;与游离酶相比,固定化酶的生物活性提高了8.2倍,并能够有效地消除产物抑制(图 6)。
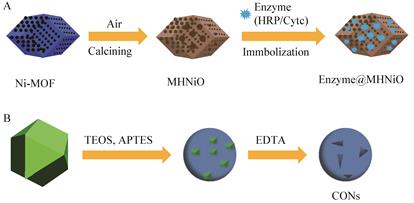
金属有机框架(metal-organic framework,MOF)是一种由金属离子或金属簇和有机配体之间的配位作用形成的一类多孔有机-无机杂化材料,具有高比表面积、可调的超高孔径、表面易功能化及高生物相容性等优点。利用MOF作为酶的固定载体是一种新兴的酶固定化技术,在生物催化、生物传感、纳米催化医学等领域有巨大的应用潜力[50]。Gao等[20]以Ni-MOF为前体,以氯化锌为活化剂,采用热分解法制备得到了同时包含介孔和微孔分层结构的NiO材料(MOF-derived porous NiO with hierarchical structure,MHNiO),将辣根过氧化物酶和细胞色素C分别固定到其介孔中,并将底物富集在微孔中,得到了具有高催化活性的酶反应器(图 7A),与相应游离酶相比,制备的酶反应器具有较高的热稳定性和重复使用性。Huo等[51]采用硬模板法制备了一种基于MOFs的新型多级结构纳米材料,称为开口有机硅纳米囊(crackled organosilica nanocapsules,CONs);纳米囊的开口有助于脂肪酶快速吸附于其内外表面,提高酶的负载率,疏水的-(CH2)3-SiO-增强了酶与纳米囊之间的相互作用,减少了酶的泄露(图 7B);在反应过程中,这种特有的结构还促进了反应物和产物的快速扩散,提升了酶促反应速率。
在酶的纳米材料固定化过程中,采用合理的计算辅助设计手段对于预测和阐释酶固定化效果具有指导作用。Zaboli等[52]利用分子动力学模拟研究了CNT和碳功能化的碳纳米管(functionalized carbon nanotubes,fCNT)对D-乳酸脱氢酶的吸附和构象的影响,与游离酶相比,固定化酶在高温下表现出更好的稳定性,更适合在工业上使用;研究表明,酶对CNT的吸附是通过范德华和pi-pi堆积相互作用介导的,而在酶对fCNT的吸附中,除了疏水相互作用外,还涉及到酶与fCNT官能团之间的氢键作用;通过二级结构分析表明,fCNT比CNT更能保护酶的构象。此外,通过模拟计算还有助于纳米材料固定化酶催化机制的解析。例如,Zhang等[53]采用分子动力学模拟研究固载于CNT上的嘉士伯啤酒酵母在水、乙腈、庚烷等溶剂中的变化,以探索酶在非水介质中的催化机制,结果表明,随着溶剂极性的降低,底物结合口袋两条β-链之间的距离明显增大,有利于底物的进入和结合,使得酶与CNT在庚烷中的底物结合能最高;蛋白结构网络分析进一步揭示,固定化对有机溶剂中酶活性中心的影响不依赖于酶的吸附程度,而取决于脱附程度,酶在水溶液中可以在几十纳秒内被CNT吸附,而在非极性的庚烷溶液中,由于吸附原子少、较小的接触面积和结合自由能,导致脱附程度增强,因此在脱附较强的庚烷中两条β-链之间的距离是最大的;此外,研究还发现了一些重要且保守的热残基与活性区域连接,如N248→Q245→L241和V198→V177→S224,说明它们在调节固定化酶的生物活性方面的重要性。
2 纳米级酶固定化方法Nelson等[54]首次将酶加载到炭的固体表面,截至目前已经开发了多种酶的固定化方法。将酶固定在纳米材料上的传统方法主要包括物理吸附、共价结合和包埋。物理吸附是最简单的一种固定化方法,酶与载体之间通过范德华力或离子键等相互作用进行连接,但这种连接极不稳定;共价结合是利用酶分子上的氨基、羧基或芳香环与载体上的某些基团形成共价键,使酶固定在载体上,形成的共价键较为牢固,具有更大的操作稳定性;包埋法是通过聚合作用在水相和水-油界面形成分散的纳米颗粒,使酶包埋在其中。这种方法的难点在于纳米颗粒大小的控制,以及每个颗粒中酶量的控制。因此,更先进的基于纳米尺度的固定化方法逐渐发展起来(图 8[55-56])。
2.1 单酶纳米颗粒2003年,Kim等[55]开发了一种独特的酶-聚合物纳米复合材料——单酶纳米颗粒(single enzyme nanoparticles,SENs),它是在酶分子表面包被上几纳米厚的有机-无机混合型聚合物网络;包埋过程由以下3步组成:(1)酶的表面修饰:酶表面氨基与丙烯酰氯反应引入乙烯基团;(2)改性后的酶通过增溶作用可以从水相进入有机相中,然后酶表面发生乙烯基聚合物的生长;(3)聚合物链聚合,使酶表面网络化,生成单分子酶纳米颗粒。SENs是一种最先进的技术,其允许单个酶分子在纳米尺度上交联聚合物基质得到固定化酶。由于能够直接控制酶周围的环境,从而增加了控制底物扩散的可能性,许多SENs表现出显著的稳定性,同时能够保持高的初始活性;此外,酶的活性可以根据需要通过外部材料层的调控来开启和关闭[57]。
Șahutoğlu等[58]成功制备了固定花斑漆酶的SENs,该酶通过丙烯酰氯修饰固定,然后在水相中原位聚合聚丙烯酰胺,得到的单个花斑漆酶纳米粒子直径小于50 nm,活性回收率为66.33%±2.57%;研究发现,游离酶和固定化酶的催化效率(kcat/Km值)相似,而固定化酶的Km值显著降低,表明酶固定化后对底物的亲和力增加;固定化酶和游离酶在60 ℃、240 min时表现出相似的热稳定性,固定化酶在室温下15 d后表现出更好的催化活性,酶的稳定性增加。
Hong等[59]对该方法进行了改进,开发了一种独特的酶-硅酸盐结合物材料,即单酶笼状纳米颗粒(single enzyme cage nanoparticles,SECNs),它由每个酶分子表面自组装的分子薄硅酸盐层组成,通过酶分子表面的二氧化硅聚合,用少量的表面活性剂将每个酶分子溶解在己烷中而合成;SECNs在具有最小底物扩散限制的水介质中具有接近天然酶的活性,在硅酸盐网的保护下具有很高的稳定性;由于其接近分子大小,SECNs还可以被吸附到介孔二氧化硅材料中,从而构建高活性且易于回收的酶系统,该系统可用于许多潜在的生物催化应用,如诊断、生物传感器、生物转化等。
2.2 “瓶中船”方法2007年,Kim等[56]制备了一种具有内孔(37 nm)和通道(13 nm)的分子筛载体(hierarchically-ordered mesocellular mesoporous,HMMS),他们采用先吸附后交联的方法将α-糜蛋白酶和脂肪酶固定于载体的内孔表面,不会从孔道泄漏出来。这种方法被形象地称为“瓶中船”(ship in a bottle)方法,或者NER (nanoscale enzyme reactor)方法。虽然这种方法在酶固定化方面有很大的潜力,但在过去的10年中,研究人员对其关注相对较少。Kim等[28]报道了一种磁分离高稳定的环氧化物水解酶(mugil cephalus epoxide hydrolase,McEH)生物催化剂体系,用于外消旋环氧化合物的对映选择性水解,他们将McEH蛋白吸附到具有瓶颈的介孔氧化硅中进行交联,有效地阻止了McEH在较大介孔中的浸出,获得了高负载和高稳定性的McEH系统,在介孔二氧化硅中预先加入的磁性纳米颗粒使得固定化McEH很容易被回收;将制备的McEH系统用于氧化苯乙烯外消旋物的拆分,在7次循环使用后仍保留超过50%的初始活性。Kamble等[12]通过在介孔MCF上吸附南极假丝酵母脂肪酶(Candida antarctica lipase,CALB),然后在孔内进行酶交联,制备了“瓶中船”结构的纳米级酶反应器,其能有效地防止酶浸出,从而提高热稳定性;将CALB/MCF用于(R, S)-α-四氢萘醇与醋酸乙烯酯的对映选择性酯化反应具有良好的催化性能。
3 应用 3.1 生物转化酶促生物转化因其底物专一性、对映选择性和温和的操作条件而成为合成化学和生物制造等领域的研究热点。与传统的固定化酶生物转化相比,纳米生物催化剂具有更高的酶负载率和稳定性,在各种生物转化体系中得到了广泛的应用。
脂肪酶是一种广泛应用的生物催化剂,能够催化酯化或酯交换反应,并有较宽的底物谱,在医药和精细化学品的合成领域具有广泛的应用前景。Nobakht等[11]以铁-羧酸盐包封羟基铝离子磷钨酸作为纳米金属有机骨架载体,对猪胰脂肪酶进行固定化,该固定化酶在70 ℃高温下仍保持很好的稳定性,并被用于肉桂酸酯化合成肉桂酸苄酯;在连续5轮催化合成肉桂酸苄酯的过程中,固定化酶保持了90.4%的初始活性,重复使用8次,收率达到80.0%。
腈水合酶因其在温和条件下合成有价值的酰胺类化合物而受到广泛关注,然而酶的稳定性差仍然是其工业应用的主要缺陷之一。Pei等[29]通过仿生矿化策略将重组的腈水合酶NHase1229包埋到基于钴的金属有机骨架MOF ZIF-67中,纳米催化剂NHase1229@ZIF-67对3-氰基吡啶的水合反应具有较高的催化活性,其比活性达到29.5 U/mg,热稳定性也有了显著提高;将其应用于烟酰胺的合成,表现出良好的循环性能,时空产率计算为110 g/(L·h)。
在生物催化中,很多复杂的反应都需要多个酶的级联反应催化得到,多酶生物催化成为近年来的一个热点研究方向,基于纳米生物催化的级联催化系统的研究也有一些报道[60-61]。Chen等[62]以纳米颗粒金属有机框架ZIF8-NMOFs作为微反应器,在其内部集成葡萄糖氧化酶和辣根过氧化物酶双酶系统,或者β-半乳糖甘酶、葡萄糖氧化酶和辣根过氧化物酶三酶系统,使得整个催化级联反应活性分别可以提高7.5倍和5.3倍;除此之外,通过NMOFs包裹乙醇脱氢酶、NAD+-聚合物以及乳酸脱氢酶,实现了偶联的生物催化级联反应,最终可以利用乙醇将丙酮酸还原成乳酸(图 9)。
自然界的氧化磷酸化是多种酶参与的级联反应,这些天然酶自身固有的特性导致在体外应用时面临巨大挑战,如催化活性对环境的敏感性、回收和再循环困难、制备和纯化的高成本以及较低操作稳定性等。Xu等[63]通过整合纳米酶与重组天然ATP合酶构筑氧化磷酸化微反应器,以葡萄糖为基本能量来源,实现体外氧化磷酸化,研究表明,这种负载在空心二氧化硅微球上的金纳米粒子兼具葡萄糖氧化酶和过氧化氢酶特性,将葡萄糖转化为葡萄糖酸使得周围pH值下降产生质子梯度差,推动ATP合酶将ADP与无机磷酸盐转化ATP;同时,这种金纳米粒子能够将产生的过氧化氢分解,消除其可能对ATP合酶活性的影响,组装形成的氧化磷酸化微反应器具有非常高的生物活性,转化效率可以达到4 920 nmol/(mg·h),与天然系统中酶的催化效率相当。
3.2 生物传感器生物传感器是一种对生物物质敏感并将其浓度转换为电信号进行检测的仪器,应用于疾病诊断和环境监测等领域。生物传感器主要由生物感应元件和信号传导器两部分组成,可以用来制作生物感应元件的物质包括酶、抗体、抗原、微生物、细胞、组织、核酸等生物活性物质,其主要功能是识别被测物质。在酶基生物传感器中,酶固定化是影响传感器性能的关键步骤,自引入纳米生物催化技术以来,酶基生物传感器的性能有了很大的提高。
Zhang等[24]以二硫化钼纳米薄片和金纳米颗粒为载体,将漆酶固定在其表面,制备了一种新型的漆酶生物传感器,用于儿茶酚的检测,实验结果表明,MoS2具有较大的比表面积和良好的生物相容性,为酶固定化提供了丰富的空间,而金纳米粒子增强了MoS2的导电性,提高了检测灵敏度。因为MoS2纳米薄片与金纳米粒子之间的协同效应,展现出良好的选择性、稳定性、可重复性和再现性。Bekmezci等[14]采用一步法合成了聚氟醚-g-聚乙二醇(PF-g-PEG),将多壁碳纳米管作为工作电极,在电极表面形成PF-g-PEG膜,最后将醇氧化酶固定在改性后的材料表面,可用于酒精饮料中乙醇含量的分析。
3.3 生物燃料电池生物燃料电池是一种利用酶或微生物作为催化剂将化学能转化为电能的装置。酶基生物燃料电池是以分离的酶为催化剂,由酶的阳极、电解质和酶的阴极组成。在阳极,酶氧化生物燃料,然后产生电子、质子和其他副产品,阳极产生的质子通过浓度梯度从电解质扩散到阴极,电子经过负载电路,然后在阴极与质子相遇。在阴极,质子和电子与氧结合,然后产生水。已有许多氧化还原酶被用于酶基生物燃料电池的阳极,如葡萄糖氧化酶、乙醇脱氢酶、醛脱氢酶、甲酸脱氢酶等,漆酶被广泛用作阴极[64](图 10)。但是基于酶的生物燃料电池仍然存在稳定性差和电密度低等缺点,从而限制了其应用。由于纳米结构材料具有高的比表面积和多孔性,有利于增加酶的负载以及电子的快速转移,因此纳米生物催化被认为是解决这一局限的关键方法[65]。此外,碳基纳米材料,如单壁碳纳米管和石墨具有良好的导电性,有助于提高电密度。

|
| 图 10 生物燃料电池原理图 Figure 10 Schematic of biofuel cell |
|
|
Rewatkar等[66]制备了一种3D打印石墨烯/聚乳酸电极,通过N, N-二甲基甲酰胺溶液处理,然后固定化葡萄糖氧化酶和漆酶,分别实现了生物阳极和生物阴极;通过性能评价,在40 mmol/L葡萄糖浓度下,生物阳极在0.5 V电压下达最大电流密度1.41 mA/cm2,生物阴极的在0.42 V电压下达最大电流密度0.216 mA/cm2;将制备的生物电极组装在流态电池中,具有良好的稳定性和较好的生物催化活性。
4 展望我们研究团队一直开展生物催化剂发现、改造及在手性精细化学品合成中的应用研究工作,如羰基还原酶[67-68]、腈水解酶[69]、醛缩酶[70]、亚胺还原酶[71]、单胺氧化酶[72]、D-氨基酸脱氢酶[73]等,深切感受到使用纳米材料固定化酶,在酶与底物及产物的分离、酶的生物相容性和稳定性等方面具有独特的优势。利用共固定化技术将多种生物催化剂共固定在纳米材料上来实现生物级联催化,已经应用于生物转化、生物电子学等领域。纳米材料与生物催化剂之间的相互作用还有待进一步的研究,如何平衡酶的活性、稳定性及酶的化学选择性和立体选择性仍然是纳米生物催化面临的一个重要问题,纳米酶与生物酶的协同组合及固定,对于克服各自的缺陷、发挥各自优势将大有作为。相信随着纳米技术、酶制备及固定化技术的发展,纳米生物催化技术必将得到快速发展并在生物化工、生物检测、能源等领域得到更广泛的应用。
| [1] |
Thangaraj B, Solomon PR. Immobilization of lipases - A review. Part I: Enzyme immobilization[J]. ChemBioEng Reviews, 2019, 6(5): 157-166. DOI:10.1002/cben.201900016 |
| [2] |
Wang MF, Qi W, Su RX, et al. Advances in carrier-bound and carrier-free immobilized nanobiocatalysts[J]. Chemical Engineering Science, 2015, 135: 21-32. |
| [3] |
Min K, Yoo YJ. Recent progress in nanobiocatalysis for enzyme immobilization and its application[J]. Biotechnology and Bioprocess Engineering, 2014, 19(4): 553-567. |
| [4] |
Gao LZ, Yan XY. Nanozymes: an emerging field bridging nanotechnology and biology[J]. Science China Life Sciences, 2016, 59(4): 400-402. |
| [5] |
Wu JJX, Wang XY, Wang Q, et al. Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes (II)[J]. Chemical Society Reviews, 2019, 48(4): 1004-1076. |
| [6] |
Gao LZ, Yan XY. Discovery and current application of nanozyme[J]. Progress in Biochemistry and Biophysics, 2013, 40(10): 892-902. 高利增, 阎锡蕴. 纳米酶的发现与应用[J]. 生物化学与生物物理进展, 2013, 40(10): 892-902. |
| [7] |
Verma ML, Rao NM, Tsuzuki T, et al. Suitability of recombinant lipase immobilised on functionalised magnetic nanoparticles for fish oil hydrolysis[J]. Catalysts, 2019, 9(5): 420. DOI:10.3390/catal9050420 |
| [8] |
Wang Y, Gao P, Xue Y, et al. Novozym435-gold nanoparticles biohybrids as an efficient catalyst for synthesis of ferulic acid starch ester[J]. Journal of Nanoscience and Nanotechnology, 2020, 20(2): 1066-1073. DOI:10.1166/jnn.2020.16926 |
| [9] |
Zhao XH, Zhao FH, Zhong NJ. Production of diacylglycerols through glycerolysis with SBA-15 supported Thermomyces lanuginosus lipase as catalyst[J]. Journal of the Science of Food and Agriculture, 2020, 100(4): 1426-1435. DOI:10.1002/jsfa.10140 |
| [10] |
Xiang XR, Suo HB, Xu C, et al. Covalent immobilization of lipase onto chitosan-mesoporous silica hybrid nanomaterials by carboxyl functionalized ionic liquids as the coupling agent[J]. Colloids and Surfaces B: Biointerfaces, 2018, 165: 262-269. |
| [11] |
Nobakht N, Faramarzi MA, Shafiee A, et al. Polyoxometalate-metal organic framework-lipase: An efficient green catalyst for synthesis of benzyl cinnamate by enzymatic esterification of cinnamic acid[J]. International Journal of Biological Macromolecules, 2018, 113: 8-19. DOI:10.1016/j.ijbiomac.2018.02.023 |
| [12] |
Kamble MP, Shinde SD, Yadav GD. Kinetic resolution of (R, S)-α-tetralol catalyzed by crosslinked Candida antarctica lipase B enzyme supported on mesocellular foam: A nanoscale enzyme reactor approach[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 132: 61-66. DOI:10.1016/j.molcatb.2016.06.013 |
| [13] |
Seelajaroen H, Bakandritsos A, Otyepka M, et al. Immobilized enzymes on graphene as nanobiocatalyst[J]. ACS Applied Materials & Interfaces, 2020, 12(1): 250-259. DOI:10.1021/acsami.9b17777 |
| [14] |
Bekmezci SA, Soylemez S, Yilmaz G, et al. A new ethanol biosensor based on polyfluorene-g-poly(ethylene glycol) and multiwalled carbon nanotubes[J]. European Polymer Journal, 2020, 122: 109300. DOI:10.1016/j.eurpolymj.2019.109300 |
| [15] |
Lin P, Zhang YH, Yao GX, et al. Immobilization of formate dehydrogenase on polyethylenimine-grafted graphene oxide with kinetics and stability study[J]. Engineering in Life Sciences, 2020, 20(3/4): 104-111. DOI:10.1002/elsc.201900134 |
| [16] |
Wayu MB, Pannell MJ, Labban N, et al. Functionalized carbon nanotube adsorption interfaces for electron transfer studies of galactose oxidase[J]. Bioelectrochemistry, 2019, 125: 116-126. |
| [17] |
Payentko V, Matkovsky A, Matrunchik Y. Composites of silica with immobilized cholinesterase incorporated into polymeric shell[J]. Nanoscale Research Letters, 2015, 10: 82. DOI:10.1186/s11671-015-0808-4 |
| [18] |
Singh AK, Singh M, Verma N. Electrochemical preparation of Fe3O4/MWCNT-polyaniline nanocomposite film for development of urea biosensor and its application in milk sample[J]. Journal of Food Measurement and Characterization, 2020, 14(1): 163-175. DOI:10.1007/s11694-019-00278-2 |
| [19] |
Zhao MY, Li Y, Ma XJ, et al. Adsorption of cholesterol oxidase and entrapment of horseradish peroxidase in metal-organic frameworks for the colorimetric biosensing of cholesterol[J]. Talanta, 2019, 200: 293-299. |
| [20] |
Gao X, Ding Y, Sheng YD, et al. Enzyme immobilization in MOF-derived porous NiO with hierarchical structure: An efficient and stable enzymatic reactor[J]. ChemCatChem, 2019, 11(12): 2828-2836. DOI:10.1002/cctc.201900611 |
| [21] |
Varlamova RM, Medyantseva EP, Khamidullina RR, et al. Amperometric tyrosinase biosensors based on nanomaterial-modified electrodes for aflatoxin M1[J]. Journal of Analytical Chemistry, 2019, 74(S1): 59-67. DOI:10.1134/S1061934819070189 |
| [22] |
Kashefi S, Borghei SM, Mahmoodi NM. Covalently immobilized laccase onto graphene oxide nanosheets: Preparation, characterization, and biodegradation of azo dyes in colored wastewater[J]. Journal of Molecular Liquids, 2019, 276: 153-162. DOI:10.1016/j.molliq.2018.11.156 |
| [23] |
Mohtar LG, Aranda P, Messina GA, et al. Amperometric biosensor based on laccase immobilized onto a nanostructured screen-printed electrode for determination of polyphenols in propolis[J]. Microchemical Journal, 2019, 144: 13-18. |
| [24] |
Zhang YN, Li X, Li DW, et al. A laccase based biosensor on AuNPs-MoS2 modified glassy carbon electrode for catechol detection[J]. Colloids and Surfaces B: Biointerfaces, 2020, 186: 110683. |
| [25] |
Barreca D, Neri G, Scala A, et al. Covalently immobilized catalase on functionalized graphene: effect on the activity, immobilization efficiency, and tetramer stability[J]. Biomaterials Science, 2018, 6(12): 3231-3240. DOI:10.1039/C8BM00850G |
| [26] |
Gaikwad S, Ingle AP, da Silva SS, et al. Immobilized nanoparticles-mediated enzymatic hydrolysis of cellulose for clean sugar production: A novel approach[J]. Current Nanoscience, 2019, 15(3): 296-303. DOI:10.2174/1573413714666180611081759 |
| [27] |
TermehYousefi A, Tanaka H, Bagheri S. Enhancement of glucose oxide electron-transfer mechanism in glucose biosensor via optimum physical chemistry of functionalized carbon nanotubes[J]. Reviews in Chemical Engineering, 2017, 33(2): 201-215. |
| [28] |
Kim YH, Lee I, Choi SH, et al. Enhanced stability and reusability of marine epoxide hydrolase using ship-in-a-bottle approach with magnetically-separable mesoporous silica[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 89: 48-51. |
| [29] |
Pei XL, Wu YF, Wang JP, et al. Biomimetic mineralization of nitrile hydratase into a mesoporous cobalt-based metal-organic framework for efficient biocatalysis[J]. Nanoscale, 2020, 12(2): 967-972. DOI:10.1039/C9NR06470B |
| [30] |
Bilal M, Zhao YP, Rasheed T, et al. Magnetic nanoparticles as versatile carriers for enzymes immobilization: A review[J]. International Journal of Biological Macromolecules, 2018, 120: 2530-2544. DOI:10.1016/j.ijbiomac.2018.09.025 |
| [31] |
Francolini I, Taresco V, Martinelli A, et al. Enhanced performance of Candida rugosa lipase immobilized onto alkyl chain modified-magnetic nanocomposites[J]. Enzyme and Microbial Technology, 2020, 132: 109439. |
| [32] |
Xie WL, Zang XZ. Immobilized lipase on core-shell structured Fe3O4-MCM-41 nanocomposites as a magnetically recyclable biocatalyst for interesterification of soybean oil and lard[J]. Food Chemistry, 2016, 194: 1283-1292. |
| [33] |
Wan L, Song HY, Chen X, et al. A magnetic-field guided interface coassembly approach to magnetic mesoporous silica nanochains for osteoclast-targeted inhibition and heterogeneous nanocatalysis[J]. Advanced Materials, 2018, 30(25): 1707515. |
| [34] |
Carlsson N, Gustafsson H, Thörn C, et al. Enzymes immobilized in mesoporous silica: A physical-chemical perspective[J]. Advances in Colloid and Interface Science, 2014, 205: 339-360. DOI:10.1016/j.cis.2013.08.010 |
| [35] |
Luo J, Li Q, Sun XT, et al. The study of the characteristics and hydrolysis properties of naringinase immobilized by porous silica material[J]. RSC Advances, 2019, 9(8): 4514-4520. |
| [36] |
Zhong NJ, Chen WL, Liu LY, et al. Immobilization of Rhizomucor miehei lipase onto the organic functionalized SBA-15: Their enzymatic properties and glycerolysis efficiencies for diacylglycerols production[J]. Food Chemistry, 2019, 271: 739-746. |
| [37] |
Agudelo NA, Escobar S, Tejada JC, et al. Understanding of the formation of mesocellular-like silica foam particles of nano size and its chemical surface to immobilization of Thermomyces lanuginosus lipase[J]. Microporous and Mesoporous Materials, 2020, 294: 109948. DOI:10.1016/j.micromeso.2019.109948 |
| [38] |
Shao PJ, Chen H, Ying Q, et al. Structure-activity relationship of carbonic anhydrase enzyme immobilized on various silica-based mesoporous molecular sieves for CO2 absorption into a potassium carbonate solution[J]. Energy & Fuels, 2020, 34(2): 2089-2096. |
| [39] |
Gomes MZDV, Palmqvist AEC. Immobilization of formaldehyde dehydrogenase in tailored siliceous mesostructured cellular foams and evaluation of its activity for conversion of formate to formaldehyde[J]. Colloids and Surfaces B: Biointerfaces, 2018, 163: 41-46. |
| [40] |
Coscolín C, Beloqui A, Martínez-Martínez M, et al. Controlled manipulation of enzyme specificity through immobilization-induced flexibility constraints[J]. Applied Catalysis A: General, 2018, 565: 59-67. |
| [41] |
Magner E. Immobilisation of enzymes on mesoporous silicate materials[J]. Chemical Society Reviews, 2013, 42(15): 6213-6222. |
| [42] |
Zou B, Hua Y, Cui FJ, et al. Effect of surface modification of low cost mesoporous SiO2 carriers on the properties of immobilized lipase[J]. Journal of Colloid and Interface Science, 2014, 417: 210-216. |
| [43] |
Muňoz-Pina S, Ros-Lis JV, Argüelles Á, et al. Influence of the functionalisation of mesoporous silica material UVM-7 on polyphenol oxidase enzyme capture and enzymatic browning[J]. Food Chemistry, 2020, 310: 125741. DOI:10.1016/j.foodchem.2019.125741 |
| [44] |
Li D, Fang Z, Duan HW, et al. Polydopamine-mediated synthesis of core-shell gold@calcium phosphate nanoparticles for enzyme immobilization[J]. Biomaterials Science, 2019, 7(7): 2841-2849. |
| [45] |
Poorakbar E, Shafiee A, Saboury AA, et al. Synthesis of magnetic gold mesoporous silica nanoparticles core shell for cellulase enzyme immobilization: Improvement of enzymatic activity and thermal stability[J]. Process Biochemistry, 2018, 71: 92-100. DOI:10.1016/j.procbio.2018.05.012 |
| [46] |
Wee Y, Park S, Kwon YH, et al. Tyrosinase-immobilized CNT based biosensor for highly-sensitive detection of phenolic compounds[J]. Biosensors and Bioelectronics, 2019, 132: 279-285. |
| [47] |
Garcia-Galan C, Barbosa O, Hernandez K, et al. Evaluation of styrene-divinylbenzene beads as a support to immobilize lipases[J]. Molecules, 2014, 19(6): 7629-7645. |
| [48] |
Dedisch S, Wiens A, Davari MD, et al. Matter-tag: A universal immobilization platform for enzymes on polymers, metals, and silicon-based materials[J]. Biotechnology and Bioengineering, 2020, 117(1): 49-61. |
| [49] |
Zhang YH, Chen KN, Zhang JN, et al. Preparation and evaluation of a polymer-metal-enzyme hybrid nanowire for the immobilization of multiple oxidoreductases[J]. Journal of Chemical Technology and Biotechnology, 2019, 94(3): 795-803. |
| [50] |
Huang SM, Kou XX, Shen J, et al. "Armor‐Plating" enzymes with metal–organic frameworks (MOFs)[J]. Angewandte Chemie International Edition, 2020, 59(23): 8786-8798. DOI:10.1002/anie.201916474 |
| [51] |
Huo Q, Zhao JJ, Li WR, et al. Crackled nanocapsules: the "imperfect" structure for enzyme immobilization[J]. Chemical Communications, 2019, 55(50): 7155-7158. DOI:10.1039/C9CC02797A |
| [52] |
Zaboli M, Raissi H, Zaboli M, et al. Stabilization of D-lactate dehydrogenase diagnostic enzyme via immobilization on pristine and carboxyl-functionalized carbon nanotubes, a combined experimental and molecular dynamics simulation study[J]. Archives of Biochemistry and Biophysics, 2019, 661: 178-186. |
| [53] |
Zhang LY, Li YZ, Yuan Y, et al. Molecular mechanism of carbon nanotube to activate Subtilisin Carlsberg in polar and non-polar organic media[J]. Scientific Reports, 2016, 6: 36838. |
| [54] |
Nelson JM, Griffin EG. Adsorption of invertase[J]. Journal of the American Chemical Society, 1916, 38(5): 1109-1115. |
| [55] |
Kim J, Grate JW. Single-enzyme nanoparticles armored by a nanometer-scale organic/inorganic network[J]. Nano Letters, 2003, 3(9): 1219-1222. |
| [56] |
Kim MI, Kim J, Lee J, et al. Crosslinked enzyme aggregates in hierarchically-ordered mesoporous silica: A simple and effective method for enzyme stabilization[J]. Biotechnology and Bioengineering, 2007, 96(2): 210-218. DOI:10.1002/bit.21107 |
| [57] |
Chapman R, Stenzel MH. All wrapped up: Stabilization of enzymes within single enzyme nanoparticles[J]. Journal of the American Chemical Society, 2019, 141(7): 2754-2769. DOI:10.1021/jacs.8b10338 |
| [58] |
Şahutoğlu AS, Akgül C. One-phase synthesis of single enzyme nanoparticles (SENs) of Trametes versicolor laccase by in situ acrylamide polymerisation[J]. Biocatalysis and Biotransformation, 2020, 38(1): 64-74. |
| [59] |
Hong SG, Kim BC, Bin Na H, et al. Single enzyme nanoparticles armored by a thin silicate network: Single enzyme caged nanoparticles[J]. Chemical Engineering Journal, 2017, 322: 510-515. DOI:10.1016/j.cej.2017.04.022 |
| [60] |
Giannakopoulou A, Patila M, Spyrou K, et al. Development of a four-enzyme magnetic nanobiocatalyst for multi-step cascade reactions[J]. Catalysts, 2019, 9(12): 995. DOI:10.3390/catal9120995 |
| [61] |
Wang GL, Li XQ, Cao GX, et al. A novel photoswitchable enzyme cascade for powerful signal amplification in versatile bioassays[J]. Chemical Communications, 2017, 53(81): 11165-11168. DOI:10.1039/C7CC05771G |
| [62] |
Chen WH, Vázquez-González M, Zoabi A, et al. Biocatalytic cascades driven by enzymes encapsulated in metal-organic framework nanoparticles[J]. Nature Catalysis, 2018, 1(9): 689-695. |
| [63] |
Xu YQ, Fei JB, Li GL, et al. Nanozyme-catalyzed cascade reactions for mitochondria-mimicking oxidative phosphorylation[J]. Angewandte Chemie International Edition, 2019, 58(17): 5572-5576. |
| [64] |
Fu LY, Liu JJ, Hu ZQ, et al. Recent advances in the construction of biofuel cells based self-powered electrochemical biosensors: A review[J]. Electroanalysis, 2018, 30(11): 2535-2550. DOI:10.1002/elan.201800487 |
| [65] |
Kim J, Jia HF, Wang P. Challenges in biocatalysis for enzyme-based biofuel cells[J]. Biotechnology Advances, 2006, 24(3): 296-308. |
| [66] |
Rewatkar P, Goel S. 3D printed bioelectrodes for enzymatic biofuel cell: Simple, rapid, optimized and enhanced approach[J]. IEEE Transactions on Nanobioscience, 2020, 19(1): 4-10. DOI:10.1109/TNB.2019.2941196 |
| [67] |
Chen X, Zhang HL, Maria-Solano MA, et al. Efficient reductive desymmetrization of bulky 1, 3-cyclodiketones enabled by structure-guided directed evolution of a carbonyl reductase[J]. Nature Catalysis, 2019, 2(10): 931-941. DOI:10.1038/s41929-019-0347-y |
| [68] |
Chen X, Zhang HL, Feng JH, et al. Molecular basis for the high activity and enantioselectivity of the carbonyl reductase from Sporobolomyces salmonicolor toward α‑haloacetophenones[J]. ACS Catalysis, 2018, 8(4): 3525-3531. |
| [69] |
Yu SS, Yao PY, Li JL, et al. Improving the catalytic efficiency and stereoselectivity of a nitrilase from Synechocystis sp. PCC6803 by semi-rational engineering en route to chiral γ-amino acids[J]. Catalysis Science & Technology, 2019, 9(6): 1504-1510. DOI:10.1039/c8cy02455c |
| [70] |
Chen QJ, Chen X, Feng JH, et al. Improving and inverting Cβ-stereoselectivity of threonine aldolase via substrate-binding-guided mutagenesis and a stepwise visual screening[J]. ACS Catalysis, 2019, 9(5): 4462-4469. |
| [71] |
Yao PY, Xu ZF, Yu SS, et al. Imine reductase-catalyzed enantioselective reduction of bulky α, β-unsaturated imines en route to a pharmaceutically important morphinan skeleton[J]. Advanced Synthesis & Catalysis, 2019, 361(3): 556-561. DOI:10.1002/adsc.201801326 |
| [72] |
Yao PY, Cong PQ, Gong R, et al. Biocatalytic route to chiral 2-substituted-1, 2, 3, 4-tetrahydroquinolines using cyclohexylamine oxidase muteins[J]. ACS Catalysis, 2018, 8(3): 1648-1652. DOI:10.1021/acscatal.7b03552 |
| [73] |
Cheng XK, Chen X, Feng JH, et al. Structure-guided engineering of meso-diaminopimelate dehydrogenase for enantioselective reductive amination of sterically bulky 2-keto acids[J]. Catalysis Science & Technology, 2018, 8(19): 4994-5002. |
 2020, Vol. 47
2020, Vol. 47