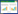扩展功能
文章信息
- 周杨, 万强, 蔡芷荷, 卢勉飞, 曲晓莹, 吴清平, 李健顺
- ZHOU Yang, WAN Qiang, CAI Zhi-He, LU Mian-Fei, QU Xiao-Ying, WU Qing-Ping, LI Jian-Shun
- 包装饮用水中铜绿假单胞菌快速检测试剂盒的研制与评价
- Development and evaluation of loop-mediated isothermal amplification-based kit for rapid detection of Pseudomonas aeruginosa in packaged drinking water
- 微生物学通报, 2020, 47(6): 1982-1992
- Microbiology China, 2020, 47(6): 1982-1992
- DOI: 10.13344/j.microbiol.china.190710
-
文章历史
- 收稿日期: 2019-08-28
- 接受日期: 2019-11-04
- 网络首发日期: 2019-11-22
2. 广东省微生物研究所 广东 广州 510070;
3. 广东环凯生物科技有限公司 广东 肇庆 526238
2. Guangdong Institute of Microbiology, Guangzhou, Guangdong 510070, China;
3. Guangdong Huankai Biological Science and Technology Company Limited, Zhaoqing, Guangdong 526238, China
铜绿假单胞菌(Pseudomonas aeruginosa)是一种假单胞菌属(Pseudomonas)需氧型革兰氏阴性菌,广泛分布于自然界,包括水、土壤、空气以及人、动物体内等。铜绿假单胞菌也是一种常见的水源性和食源性致病菌,可造成不同程度的人兽共患性传染疫情,其进入机体内经大量增殖后可生成诸如胞外酶、内毒素、肠毒素以及溶血素等多种有害物质,致使被感染人、动物的组织器官病变甚至坏死,进而引起急性胃肠炎、败血症和脑膜炎等病症,严重威胁生命健康[1-2]。
在人们日常生产生活中,铜绿假单胞菌在各类型水中均存在,且其对水处理中使用的消毒剂、紫外线等理化手段具有较强的抵抗力,因而容易通过饮水进入人体内造成感染。当前,各类包装饮用水与人们的日常生活息息相关,然而由于市场上出现的相关厂家众多、品类繁杂,其产品极易因生产环节不达标而受到铜绿假单胞菌的污染,直接影响到广大消费者的身体健康。据统计,目前国内外有关包装饮用水中检出铜绿假单胞菌的报道日趋增多,其受该菌污染的概率高达1.4%[3-6]。因此,有关包装饮用水中铜绿假单胞菌污染的问题越来越受到社会各界关注[7-12],我国在GB 19298-2014[13]中明确规定了包装饮用水需采用三级取样法抽样检测铜绿假单胞菌,而且必须参照GB 8538-2016[14]严格检测该菌,并明确规定各类抽检水样品中均不得检出。因此,在包装饮用水相关企业的生产活动中,对铜绿假单胞菌的监测至关重要。上述标准中给出的检测方法仍为传统的分离培养、形态学镜检观察以及生化鉴定等,且该类检测必须依托实验室并由专业人员完成,普遍存在耗时长、流程繁琐以及检测费用高等弊端,因而无法适应诸如基层单位和现场等的一些快速检测需求。
Notomi等[15]开发的环介导恒温扩增(loop- mediated isothermal amplification,LAMP)技术属于一种新型核酸体外等温扩增技术,其主要在两对特殊引物和Bst DNA聚合酶的共同作用下,在65 ℃左右的恒温条件下和1 h内完成相应的聚合酶链式反应,相较于诸如PCR等另外的分子检测方法,LAMP技术具有操作流程简便、灵敏度高、耗时短以及检测费用低等优势。本研究为适应当前包装饮用水市场的检测需求,研制了基于LAMP技术的铜绿假单胞菌快速检测试剂盒,并通过多项指标,如特异性、灵敏度、准确度、重复性、保质期以及运输稳定性等,评价了该试剂盒的实用效果。
1 材料与方法 1.1 菌株选用标准菌株包括铜绿假单胞菌(Pseudomonas aeruginosa) ATCC9027、铜绿假单胞菌(P. aeruginosa) ATCC15442、铜绿假单胞菌(P. aeruginosa) ATCC27853、铜绿假单胞菌(P. aeruginosa) CMCC(B)10104、粪链球菌(Enterococcus faecali) ATCC29212、产气荚膜梭菌(Clostridium perfringens) ATCC13124、阪崎克罗诺杆菌(Cronobacter sakazakii) ATCC29544、大肠埃希氏菌(Escherichia coli) ATCC25922、大肠埃希氏菌O157:H7 (E. coli O157:H7) NTCT12900、肠炎沙门氏菌(Samonella enteritidis) CMCC(B)50335、单核细胞增生李斯特菌(Listeria monocytogenes) CMCC(B)54007、产气肠杆菌(Enterobacter aerogenes) ATCC13048、痢疾志贺氏菌(Shigella dysenteriae) CMCC(B)51105、英诺克李斯特菌(L. innocua) ATCC33090、枯草芽孢杆菌(Bacillus subtilis) CMCC(B)63501、溶藻弧菌(Vibrio alginolyticus) ATCC33787、蜡样芽孢杆菌(Bacillus cereus) CMCC(B)63303、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica) CMCC(B)52204、金黄色葡萄球菌(Staphylococcus aureus) ATCC6538、空肠弯曲杆菌(Campylobacter jejuni) ATCC33291、表皮葡萄球菌(Staphylococcus epidermidis) CMCC(B)26069、白色念珠菌(Candida albicans) ATCC10231、肺炎链球菌(Streptococcus pneumoniae) CMCC(B)31001、弗氏柠檬酸杆菌(Citrobacter freundii) ATCC43864、奇异变形杆菌(Proteus mirabilis) CMCC(B)49005、副溶血性弧菌(V. parahaemolyticus) ATCC17802共26株。选用分离菌株包括62株P. aeruginosa、45株E. faecali、40株Salmonella、35株Y. enterocolitica、50株Bacillus、30株C. sakazakii、35株E. coli、35株V. parahaemolyticus、25株S. aureus以及40株C. jejuni共397株。以上所有菌株均由广东环凯微生物科技有限公司提供。
1.2 主要试剂和仪器铜绿假单胞菌快速检测试剂盒共5批次(批次分别为20180510、20180613、20180711、20180816和20180914)、无菌滤膜(直径47 mm,微孔径为0.45 μm)、CN琼脂、乙酰胺液体培养基、纳氏试剂、营养琼脂、金氏B培养基、氧化酶试剂以及铜绿假单胞菌增菌肉汤,均由广东环凯微生物科技有限公司提供。细菌基因组DNA提取试剂盒以及DNA Marker LD DSTM 2000,购自广州东盛生物科技有限公司。供试包装饮用水样品:在位于广东省和广西省的多家水厂抽样共99份,包括各类桶装饮用水61份(纯净水28份、矿泉水17份、山泉水16份)和各类瓶装饮用水38份(纯净水15份、矿泉水12份、山泉水11份)。
MFS系列微生物过滤检测系统,广东环凯微生物科技有限公司;PCR仪,Biometra公司;自动螺旋接种仪,Don Whitley Scientific公司;NanoPhotometer® N50型超微量分光光度计,Implen公司。
1.3 方法 1.3.1 LAMP反应体系优化根据已报道的铜绿假单胞菌特异性基因GbcA[16],经NCBI数据库搜索GbcA序列,通过NCBI BLAST进行序列比对,获取其高度保守区序列,将该保守序列导入软件Primer Explorer V5 (http://primerexplorer.jp/e/index.html),设计出4套LAMP引物组,分别记作引物组1、引物组2、引物组3和引物组4,每套均包括外引物F3/B3、内引物FIP/BIP和环引物LF/LB共3对,对比测试该4套引物组在不同氯化镁浓度反应体系中的扩增效率,从中选取一套最优的引物组,另外经Primer Premier 6.0软件设计相应的PCR反应引物PF/PR。取最优引物组,逐个测试LAMP反应体系中的各个参数,包括氯化镁浓度、dNTPs浓度、Bst DNA Polymerase浓度、甜菜碱浓度、反应温度以及反应时间,以获取最优反应体系。
1.3.2 试剂盒制备(1) 干粉试剂制备:将各个组分,包括Bst DNA聚合酶、dNTPs、引物和冻干保护剂充分混合均匀,分装于无菌容器中,并经液氮处理后快速冷冻,置于冷冻干燥机中根据常规程序进行干燥得到。(2)阳性对照干粉制备:将铜绿假单胞菌精提取基因组DNA溶液和冻干保护剂充分混合均匀,分装于无菌容器中,经以上冻干程序干燥得到。(3)阴性对照干粉制备:将非铜绿假单胞菌精提取基因组DNA溶液和冻干保护剂充分混合均匀,分装于无菌容器中,经以上冻干程序干燥得到。(4)复溶液制备:将相应浓度的MgSO4、Tris-HCl、(NH4)2SO4、Triton X-100和KCl充分混合均匀,分装于无菌容器中。(5)裂解液制备:将相应浓度的Tris-HCl (pH 8.5)、EDTA和SDS充分混合均匀,分装于无菌容器中[17]。(6)显色液制备:由相应含量的钙黄绿素和MnCl2混合得到,分装于容器中。本试剂盒即由上述6种容器组装而成(规格:24 Test/盒)。
1.3.3 各种DNA样品制备(1) 纯培养菌DNA样品制备:向30 μL裂解液中加入选取的各标准菌株和分离菌株纯菌培养物,充分悬浮后经99 ℃水浴10 min,12 000 r/min离心10 min,取上清即为相应的DNA粗提样品,−40 ℃保存备用。(2)包装饮用水样品DNA制备:参照GB 8538-2016[14],每份水样取250 mL在100级的洁净工作台进行过滤操作,将过滤后的滤膜置于铜绿假单胞菌增菌肉汤中,36±1 ℃培养11±1 h,取1 mL增菌液于无菌离心管中,6 000 r/min离心5 min,弃上清,加入30 μL裂解液,后续处理同以上纯培养菌DNA样品制备流程[17]。(3)精提取基因组DNA制备:取标准菌株ATCC9027纯菌培养物接种到100 mL铜绿假单胞菌增菌肉汤中,36±1 ℃培养24±2 h,取1 mL该增菌肉汤经细菌基因组DNA提取试剂盒提取基因组DNA。
1.3.4 特异性试验制备所有选取的标准菌株和分离菌株DNA样品,经本试剂盒测试,每份样品取3个平行测试。检测结果参照:反应产物呈现荧光绿色则铜绿假单胞菌检出为阳性;呈现浅橙红色为阴性。检测符合率=(阳性结果与实际相符合例数+阴性结果与实际相符合例数)/被检总例数×100%。
1.3.5 灵敏度试验向30 mL无菌生理盐水中加入P. aeruginosa ATCC9027新鲜培养物,充分悬浮得到该菌悬液,经无菌生理盐水进行梯度稀释(稀释倍数包括101、102、103、104、105、106、107及108倍),各取以上8个稀释梯度稀释液100 μL,分别进行螺旋计数;同时各取100 μL分别制备相应的DNA样品,制备方法为:各取以上8个稀释梯度稀释液100 μL于无菌PCR管中,6 000 r/min离心5 min,弃上清,后续操作参照1.3.3实际样品DNA制备。后各取以上DNA样品2 μL经本试剂盒测试,每份DNA样品取3个平行测试。比对本试剂盒测试结果与螺旋计数结果,计算最低检验限,其中,菌落计数方式参照GB 4789.2-2016[18]最低检验限(CFU)=本试剂盒能检测到阳性的最高稀释倍数的100 μL稀释液对应的含菌量/15 (期间每份样品只取2 μL检测,理论上为制备的30 μL总样品量的1/15)[17]。
1.3.6 与传统检测方法对比验证经1.3.3中方法制备相应的99份包装饮用水样品DNA,后经本试剂盒检测,且每份DNA样品取3个平行测试;同时根据GB 8538-2016[14],以上水样品经传统方法检测(包括过滤、产氨试验、氧化酶试验、金氏B培养基荧光试验以及绿脓菌素试验等过程),并比对以上二者检测结果。检出准确度=(该两种检测方法均为阳性样品例数+该两种检测方法均为阴性样品例数)/被检样品总例数×100%。
1.3.7 重复性试验取铜绿假单胞菌精提取基因组DNA,经无菌水进行梯度稀释(稀释倍数包括101、102、103、104、105、106、107、108倍),各取以上8个梯度稀释样品2 μL经本试剂盒依次测试,得出能检测出阳性的最低稀释梯度样品,计算其对应的基因组DNA浓度,并将其作为阳性样品,另外将试剂盒中阴性对照作为阴性样品,随机选取试剂盒12盒,于不同的操作环境下(包括不同人员、时间和仪器),经以上阴性、阳性样品测试,每份检测做10个平行,根据检测结果评判批内重复性。分别取5个批次的试剂盒,经以上阴性、阳性样品测试,每个批次内检测做10个平行,根据检测结果评判批间重复性。批间或批内检测重复率=批间或批内检测结果符合例数/被检总例数×100%[17]。
1.3.8 保质期试验随机选取本试剂盒5盒置于4 ℃环境保存,分别在保存1、3、6、9和12个月后取样,经1.3.7中测得的最低稀释梯度基因组DNA检测该试剂盒效力,每份检测做20个平行。检测效率=阳性例数/被检总例数×100%[17]。
1.3.9 稳定性试验随机选取本试剂盒5盒与冰袋同时置于泡沫盒中,并存放于42 ℃环境,分别在存放24、48、72和96 h后取样,经1.3.7中测得的最低稀释梯度基因组DNA检测其效力,以上每次检测做20个测试后判读结果。检测效率=阳性例数/被检总例数×100%。
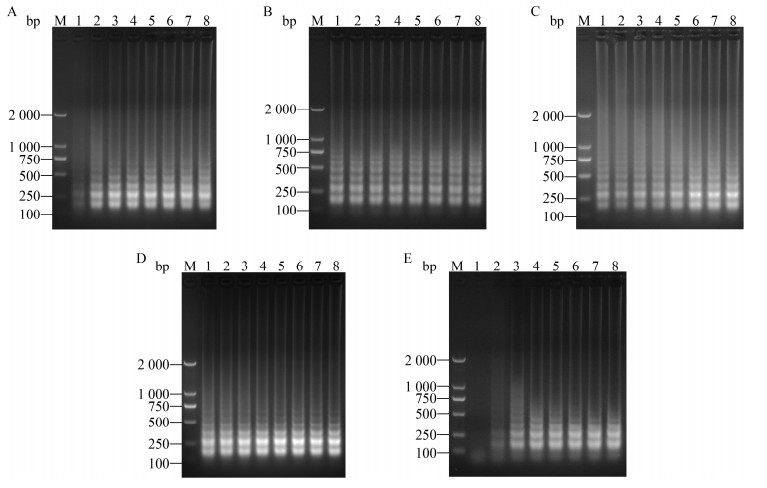
2 结果与分析 2.1 LAMP最优反应体系确立经测试实验,对设计的4套引物组分别测试,显示引物组3扩增效果最佳,见图 1,即确定引物组3为最优引物组,该引物组3和PCR引物组见表 1。经LAMP反应体系不同参数优化测试,最终选取氯化镁浓度为0.20 mmol/L、dNTPs浓度为0.5 mmol/L、Bst DNA Polymerase浓度为0.8 U/μL、甜菜碱浓度为1.75 mol/L、反应温度为63 ℃以及反应时间为50 min,分别见图 1C和图 2。得到最优的LAMP反应体系,包括:10×Buffer 2.5 μL,氯化镁(2 mmol/L) 2.5 μL,甜菜碱(12.5 mol/L) 3.5 μL,Bst DNA Polymerase (8 U/μL) 0.5 μL,dNTPs (10 mmol/L) 1.25 μL,FIP/BIP (10 μmol/L) 3 μL,FL/BL (10 μmol/L) 1 μL,F3/B3 (10 μmol/L) 1 μL,DNA样品2 μL,显色液5 μL,超纯水2.75 μL,总体积为25 μL,以上组分混匀后在金属浴中63 ℃反应50 min,反应结束后观察反应管产物颜色变化,其中,阳性样品呈现荧光绿色,阴性样品呈现浅橙红色(未变色),见图 3A。同时,经琼脂糖凝胶电泳检测观察,阳性样品呈现清晰的梯状条带,阴性样品未见明显条带,见图 3B。另外,PCR反应体系:10×PCR Buffer 2.5 μL,Taq DNA Polymerase (5 U/μL) 2 μL,dNTPs (10 mmol/L) 2.5 μL,引物混合物(PF/PR 0.5 μmol/L) 5 μL,DNA模板2 μL,超纯水11 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 60 s,72 ℃ 40 s,35个循环;72 ℃ 10 min。经琼脂糖凝胶电泳检测观察,阳性结果即在658 bp处出现明显特异性条带,阴性结果未见明显目的条带。另外,本试剂盒采用冻干干燥工艺制备生产,其各组分包括干粉试剂、阳性对照、阴性对照、复溶液、显色液、裂解液以及无菌水。

|
| 图 1 四套引物组在不同氯化镁浓度的反应体系中的测试电泳图 Figure 1 Electrophoretogram of four sets of primer groups efficiency test in reaction systems with different concentrations of MgCl2 注:1−8:氯化镁浓度分别为0.04、0.08、0.12、0.16、0.20、0.24、0.28和0.32 mmol/L;A–D:引物组1-4测试电泳图;M:DNA Marker LD DSTM 2000. Note: 1−8: The concentrations of MgCl2 are 0.04, 0.08, 0.12, 0.16, 0.20, 0.24, 0.28 and 0.32 mmol/L; A–D: Electrophoretogram of primer group 1-4 reaction efficiency test; M: DNA Marker LD DSTM 2000. |
|
|
| Primer name | Sequence (5′→3′) | |
| LAMP | FIP | CGGCCCATGAGCTTCTTGCTGTGGACGGCACCGTGTC |
| BIP | TCAAGAACCCCGACCTCGGCTCAAGTGGTCGCCCATGC | |
| LF | CCCTGCTTGCCGTCCAT | |
| LB | TCGATGCGCATCCTGCACC | |
| F3 | TGCGCAATCGCATCGTG | |
| B3 | TCCTGGGCGCTGATCG | |
| PCR | PF | AACAACCGCGAGTGCTACCA |
| PR | AGCTGCCGGCCACCTTGCGCA | |
|
| 图 2 不同组分和反应条件优化测试电泳图 Figure 2 Electrophoretogram of efficiency test in reaction systems with different components and conditions 注:A:不同dNTPs浓度测试电泳图,其中,1−8表示其分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 mmol/L;B:不同Bst DNA polymerase浓度测试电泳图,其中,1−8表示其分别为0.4、0.8、1.2、1.6、2.0、2.4、2.8和3.2 U/μL;C:不同甜菜碱浓度测试电泳图,其中,1−8表示其分别为0.25、0.50、0.75、1.00、1.25、1.50、1.75和2.00 mol/L;D:不同反应温度测试电泳图,其中,1−8表示其分别为58、59、60、61、62、63和64 ℃;E:不同反应时间测试电泳图,其中,1−8表示其分别为10、20、30、40、50、60、70和80 min;M:DNA Marker LD DSTM 2000. Note: A: Electrophoretogram of efficiency test in reaction systems with different concentrations of dNTPs, with 1−8 are represented by 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7 and 0.8 mmol/L; B: Electrophoretogram of efficiency test in reaction systems with different concentrations of Bst DNA polymerase, with 1−8 are represented by 0.4, 0.8, 1.2, 1.6, 2.0, 2.4, 2.8 and 3.2 U/μL; C: Electrophoretogram of efficiency test in reaction systems with different concentrations of betaine, with 1−8 are represented by 0.25, 0.50, 0.75, 1.00, 1.25, 1.50, 1.75 and 2.00 mol/L; D: Electrophoretogram of efficiency test in reaction systems with different temperature, with 1−8 are represented by 58, 59, 60, 61, 62, 63 and 64 ℃; E: Electrophoretogram of efficiency test in reaction systems with different times, with 1−8 are represented by 10, 20, 30, 40, 50, 60, 70 and 80 min; M: DNA Marker LD DSTM 2000. |
|
|

|
| 图 3 LAMP检测显色图(A)和电泳图(B) Figure 3 Results of color change (A) and electrophoretogram (B) of amplification product for LAMP-based detection method 注:M:DNA Marker LD DSTM 2000;+:阳性样品;–:阴性样品. Note: M: DNA Marker LD DSTM 2000; +: P. aeruginosa positive, –: P. aeruginosa negative. |
|
|
4株P. aeruginosa标准菌株样品和62株P. aeruginosa分离菌株样品反应产物均呈现出明显的荧光绿色,表示检测阳性;而其他357株菌株样品反应产物仍呈反应前的浅橙红色,表示检测阴性,以上所有检测符合率均为100%,具体见表 2。
| 菌株 Bacterial strain |
阳性结果例数(例) Positive cases (n) |
阴性结果例数(例) Negative cases (n) |
检测符合率 Coincidence rate (%) |
|
| Pseudomona aeruginosa standard strains | 4 | 0 | 100 | |
| Non-Pseudomona aeruginosa standard strains | 0 | 22 | 100 | |
| Pseudomona aeruginosa isolated strains | 62 | 0 | 100 | |
| Non-Pseudomona aeruginosa isolated strains | Enterococcus faecali | 0 | 45 | 100 |
| Salmonella | 0 | 40 | 100 | |
| Yersinia enterocolitica | 0 | 35 | 100 | |
| Bacillus | 0 | 50 | 100 | |
| Cronobacter sakazakii | 0 | 30 | 100 | |
| Escherichia coli | 0 | 35 | 100 | |
| Vibrio parahaemolyticus | 0 | 35 | 100 | |
| Staphylococcus aureus | 0 | 40 | 100 | |
| Campylobacter jejuni | 0 | 25 | 100 | |
| Total | 0 | 335 | 100 | |
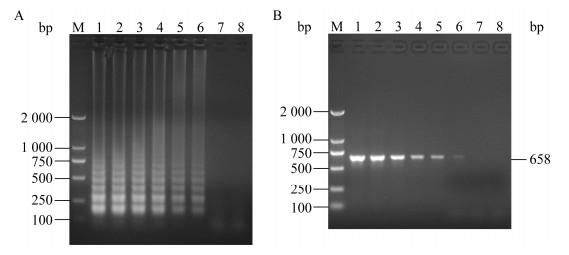
纯培养菌浓度在1.8×101−1.8×106 CFU/mL时,对应的检测管均呈现出明显的荧光绿色,而其他低浓度的检测管仍为反应前的浅橙红色,见图 4。同时经琼脂糖凝胶电泳检测以上反应产物,也显示呈现荧光绿色的反应管产物出现梯状条带,浅橙红色的反应管产物则未出现明显条带,见图 5A。另外,PCR检测结果显示,纯培养菌浓度在1.8×102−1.8×106 CFU/mL时出现大小为658 bp的产物条带,见图 5B。鉴于在1.3.3中描述为取1 mL增菌液制备包装饮用水样品DNA,即确定该LAMP试剂盒每Test对应的样品量为1 mL,因此综上确定其检验限可达到1.8×10 CFU/mL,其灵敏度比PCR检测高出1个数量级。

|
| 图 4 LAMP检测灵敏度显色图 Figure 4 Chromogenic results of pure cultures LAMP product for sensitivity test 注:1−8:纯培养菌计数浓度理论值分别为1.8×106、1.8×105、1.8×104、1.8×103、1.8×102、1.8×101、1.8×100和 < 1 CFU/mL. Note: 1−8: The concentrations of pure cultures are 1.8×106, 1.8×105, 1.8×104, 1.8×103, 1.8×102, 1.8×101, 1.8×100 and < 1 CFU/mL respectively. |
|
|
|
| 图 5 LAMP和PCR检测灵敏度电泳图 Figure 5 Electrophoretogram of pure cultures of LAMP and PCR product for sensitivity test 注:1−8:纯培养菌计数浓度理论值分别为1.8×106、1.8×105、1.8×104、1.8×103、1.8×102、1.8×101、1.8×100和 < 1 CFU/mL;A:LAMP检测灵敏度电泳图;B:PCR检测灵敏度电泳图;M:DNA Marker LD DSTM 2000. Note: 1−8: The concentrations of pure cultures are 1.8×106, 1.8×105, 1.8×104, 1.8×103, 1.8×102, 1.8×101, 1.8×100 and < 1 CFU/mL respectively; A: Electrophoretogram of LAMP product in sensitivity test; B: Electrophoretogram of PCR product in sensitivity test; M: DNA Marker LD DSTM 2000. |
|
|
所有桶装饮用水和瓶装饮用水样品合计检出准确度分别为98.4%和97.4%,具体见表 3。
| 样品 Sample |
检出数/被检样品总数(份/份) Positive cases/total cases of sample (n/n) |
检出准确度 Accuracy rate (%) |
|
| LAMP方法 LAMP method |
传统方法 Conventional method |
||
| 桶装饮用水Barreled drinking water | 7/61 | 6/61 | 98.4 |
| 纯净水Purified water | 2/28 | 2/28 | 100.0 |
| 矿泉水Mineral water | 3/17 | 2/17 | 94.1 |
| 山泉水Spring water | 2/16 | 2/16 | 100.0 |
| 瓶装饮用水Bottled drinking water | 2/38 | 1/38 | 97.4 |
| 纯净水Purified water | 0/15 | 0/15 | 100.0 |
| 矿泉水Mineral water | 1/12 | 0/12 | 91.7 |
| 山泉水Spring water | 1/11 | 1/11 | 100.0 |
不同操作环境下和不同批次试剂盒的检测重复率均为100%,见表 4和表 5。
| 操作条件 Operating conditions |
阴性样品 Negative sample |
阳性样品 Positive sample |
检测重复率 Accordance rate (%) |
|||
| 阳性例数(例) Positive cases (n) |
阴性例数(例) Negative cases (n) |
阳性例数(例) Positive cases (n) |
阴性例数(例) Negative cases (n) |
|||
| Personnel 1 | 0 | 10 | 10 | 0 | 100 | |
| Personnel 2 | 0 | 10 | 10 | 0 | ||
| Personnel 3 | 0 | 10 | 10 | 0 | ||
| Time 1 | 0 | 10 | 10 | 0 | 100 | |
| Time 2 | 0 | 10 | 10 | 0 | ||
| Time 3 | 0 | 10 | 10 | 0 | ||
| Instrument 1 | 0 | 10 | 10 | 0 | 100 | |
| Instrument 2 | 0 | 10 | 10 | 0 | ||
| Instrument 3 | 0 | 10 | 10 | 0 | ||
| 批次 Batches |
阴性样品 Negative sample |
阳性样品 Positive sample |
检测重复率 Accordance rate (%) |
|||
| 阳性例数(例) Positive cases (n) |
阴性例数(例) Negative cases (n) |
阳性例数(例) Positive cases (n) |
阴性例数(例) Negative cases (n) |
|||
| 20180510 | 0 | 10 | 10 | 0 | 100 | |
| 20180613 | 0 | 10 | 10 | 0 | 100 | |
| 20180711 | 0 | 10 | 10 | 0 | 100 | |
| 20180816 | 0 | 10 | 10 | 0 | 100 | |
| 20180914 | 0 | 10 | 10 | 0 | 100 | |
在42 ℃条件下储存不同时间后,经测试,试剂盒的检测效率均为100%,见表 6。
| 存放时间 Storage time (h) |
阳性例数:被检总例数(例/例) Positive cases:Total cases (n/n) |
检测效率 Detection efficiency (%) |
| 24 | 20:20 | 100 |
| 48 | 20:20 | 100 |
| 72 | 20:20 | 100 |
| 96 | 20:20 | 100 |
在4 ℃条件下储存不同时间后,经测试,试剂盒的检测效率均为100%,见表 7。
| 保存时间 Storage time (month) |
阳性例数:被检总例数(例/例) Positive cases:Total cases (n/n) |
检测效率 Detection efficiency (%) |
| 1 | 20:20 | 100 |
| 3 | 20:20 | 100 |
| 6 | 20:20 | 100 |
| 9 | 20:20 | 100 |
| 12 | 20:20 | 100 |
LAMP技术的整个反应体系中涉及到较多反应参数,且需要对其参数进行逐一优化,以期获取具有更高扩增效率的反应体系。本研究经详细测试,尤其是预先选取了多个铜绿假单胞菌相关的特异性基因(包括OprL[19]、ecfx[20]、ETA[21]和GbcA[16]),分别设计多套LAMP引物组,并逐一进行测试(OprL、ecfx和ETA基因LAMP引物组的测试结果未显示),对比其反应效果,确定GbcA基因对应的最佳引物组(其中还加入了两条环引物[22],旨在进一步提高其反应效率),保证了检测的高度特异性并获得了最优的LAMP反应体系,为本试剂盒的研制提供坚实基础。为方便检测结果判读,本研究仍采用钙黄绿素-MnCl2显色法[23-24],即在反应前加入相应的指示剂,盖紧反应管盖,反应后经肉眼观察其颜色变化便可判断阴性、阳性结果,具有价格低廉、观察简便、不易产生气溶胶污染以及检测结果可靠等优点。鉴于LAMP反应涉及到多种溶液试剂,且其部分组分需要冷冻储存(如dNTPs以及Bst DNA聚合酶等),加之由于LAMP反应的高灵敏度特性而必须预防气溶胶污染和假阳性等需要[25-26],本研究根据之前报道的试剂冷冻干燥工艺[23],经进一步完善该工艺后,将部分试剂进行干粉化处理。同时通过试验证实本试剂盒在4 ℃条件下能保存长达12个月,且在短期42 ℃条件下也可存放72 h以上,因此能适应常温长途运输,可实现不同地区现场应用。
在包装饮用水实际生产过程中,一般涉及到水源过滤消毒、管道设备清洗消毒、桶(瓶)和对应盖等包装材料的清洗消毒、灌装车间环境洁净度控制以及人员卫生管理等各个环节相互关联[27-28],因此在该过程中对铜绿假单胞菌污染的有效监测尤为重要。然而有关铜绿假单胞菌检测的标准方法涉及到水样抽滤、CN琼脂菌落形态观察、产氨试验、氧化酶试验以及金氏B培养基荧光试验等,该过程操作繁琐且耗时长达3−5 d,另外还需要配制各种培养基、试剂以及仪器等,造成检测成本较高。随着分子检测相关技术的发展,PCR方法被应用于检测铜绿假单胞菌[29-30],但其反应需要PCR仪,结果判读也需要较为繁琐的电泳过程,检测时间仍长达4−5 h。另外也有诸如反向斑点杂交法[31]、基因芯片法[32]等检测手段,但普遍表现出操作繁琐、经济成本高等弊端,因此均无法满足目前快速检测的需求。本试剂盒在恒温条件下完成反应测试,无需复杂仪器,整个操作流程从热裂解获取样品DNA、配制试剂、反应到获取结果可在1.5 h内完成,其检验限可达到1.8×10 CFU/mL,较PCR检测还要高出1个数量级,且在综合测试成本方面,本试剂盒检测明显低于标准方法检测。本研究中,经实际样品检测对比发现,对桶装饮用水样品,本试剂盒检测与标准方法检测合计检出率分别为11.5% (7/61)和9.8% (6/61);对瓶装饮用水样品,本试剂盒检测与标准方法检测合计检出率分别为5.3% (2/38)和2.6% (1/38)。总体上其检测结果与标准方法检测结果一致性较高,且其检出率略高于标准检测方法,这直接与本试剂盒使用操作简便、灵敏度高等特性相关,而标准检测方法也难以避免漏检的可能,因此显示出本试剂盒检测具有一定的优势。然而,鉴于本研究取样量较少,后续尚需更多的检测数据加以论证。综上所述,本试剂盒使用简便,检测灵敏度高,综合成本低,可快速完成对铜绿假单胞菌定性检测,符合当前行业的检测需求,使用前景可期。
| [1] |
Kirienko NV, Ausubel FM, Ruvkun G. Mitophagy confers resistance to siderophore-mediated killing by Pseudomonas aeruginosa[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(6): 1821-1826. DOI:10.1073/pnas.1424954112 |
| [2] |
Potron A, Poirel L, Nordmann P. Emerging broad-spectrum resistance in Pseudomonas aeruginosa and Acinetobacter baumannii: mechanisms and epidemiology[J]. International Journal of Antimicrobial Agents, 2015, 45(6): 568-585. DOI:10.1016/j.ijantimicag.2015.03.001 |
| [3] |
Stoler J, Ahmed H, Frimpong LA, et al. Presence of Pseudomonas aeruginosa in coliform-free sachet drinking water in Ghana[J]. Food Control, 2015, 55: 242-247. DOI:10.1016/j.foodcont.2015.02.038 |
| [4] |
Costa D, Bousseau A, Thevenot S, et al. Nosocomial outbreak of Pseudomonas aeruginosa associated with a drinking water fountain[J]. Journal of Hospital Infection, 2015, 91(3): 271-274. DOI:10.1016/j.jhin.2015.07.010 |
| [5] |
Luo SN, Dai YJ, Sun DF. Situation analysis of Pseudomonas aeruginosa in packaged drinking water in Guizhou province[J]. China Food Safety Magazine, 2017(3): 72-73. (in Chinese) 罗绍楠, 戴奕杰, 孙端方. 贵州省包装饮用水中铜绿假单胞菌污染情况分析[J]. 食品安全导刊, 2017(3): 72-73. |
| [6] |
Huang JF, Wang X, Liu P, et al. The analysis of Pseudomonas aeruginosain packaged drinking water[J]. The Food Industry, 2018, 39(1): 232-233. (in Chinese) 黄建锋, 汪新, 刘鹏, 等. 包装饮用水铜绿假单胞菌污染情况调查分析[J]. 食品工业, 2018, 39(1): 232-233. |
| [7] |
Chen S, Li H, Li DH, et al. Analysis of the contamination of barreled drinking water with P. aeruginosa[J]. Modern Preventive Medicine, 2015, 42(6): 1129-1130, 1135. (in Chinese) 陈松, 李红, 李德华, 等. 桶装饮用水中铜绿假单胞菌污染情况分析[J]. 现代预防医学, 2015, 42(6): 1129-1130, 1135. |
| [8] |
Zhong FF. Pollution and prevention of Pseudomonas aeruginosa in packaged drinking water[J]. Modern Food, 2017(1): 88-90. (in Chinese) 钟菲菲. 包装饮用水铜绿假单胞菌的污染与预防[J]. 现代食品, 2017(1): 88-90. |
| [9] |
Marzano MA, Ripamonti B, Balzaretti CM. Monitoring the bacteriological quality of Italian bottled spring water from dispensers[J]. Food Control, 2011, 22(2): 333-336. DOI:10.1016/j.foodcont.2010.06.014 |
| [10] |
Mena KD, Gerba CP. Risk assessment of Pseudomonas aeruginosa in water[A]//Whitacre DM. Reviews of Environmental Contamination and Toxicology Vol 201[M]. Boston, MA: Springer, 2009: 71-115
|
| [11] |
Zineba G, Hassan L, Mostafa M, et al. Virulence phenotype, physicochemical properties, and biofilm formation of Pseudomonas aeruginosa on polyethylene used in drinking water distribution systems[J]. Water Resources, 2015, 42(1): 98-107. DOI:10.1134/S0097807815010042 |
| [12] |
Wei L, Wu QP, Zhang JM, et al. The pollution survey of Pseudomonas aeruginosa in mineral water and spring water and the analyses of virulence genes and antibiotic resistance of the isolates[J]. Microbiology China, 2015, 42(1): 125-132. (in Chinese) 魏磊, 吴清平, 张菊梅, 等. 矿泉水和山泉水中铜绿假单胞菌污染调查及分离菌株毒力基因与耐药性分析[J]. 微生物学通报, 2015, 42(1): 125-132. |
| [13] |
National Health and Family Planning Commission of PRC. GB 19298-2014 National Food Safety Standard Packaged drinking water[S]. Beijing: China Standard Press, 2015 (in Chinese) 中华人民共和国国家卫生和计划生育委员会. GB 19298-2014食品安全国家标准包装饮用水[S].北京: 中国标准出版社, 2015 |
| [14] |
National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 8538-2016 National Food Safety Standard: examination method of drinking natural mineral water[S]. Beijing: China Standard Press, 2017 (in Chinese) 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 8538-2016食品安全国家标准饮用天然矿泉水检验方法[S].北京: 中国标准出版社, 2017 |
| [15] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [16] |
Wargo MJ, Szwergold BS, Hogan DA. Identification of two gene clusters and a transcriptional regulator required for Pseudomonas aeruginosa Glycine Betaine Catabolism[J]. Journal of Bacteriology, 2008, 190(8): 2690-2699. DOI:10.1128/JB.01393-07 |
| [17] |
Zhou Y, Wan Q, Cai ZH, et al. Evaluation of duplex PCR detection kit for detection of Cronobacter in food samples[J]. Microbiology China, 2019, 46(9): 2282-2291. (in Chinese) 周杨, 万强, 蔡芷荷, 等. 食品中克罗诺杆菌属双重PCR检测试剂盒的评价[J]. 微生物学通报, 2019, 46(9): 2282-2291. |
| [18] |
National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 4789.2-2016 National Food Safety Standard food microbiological examination: aerobic plate count[S]. Beijing: China Standard Press, 2017 (in Chinese) 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定[S].北京: 中国标准出版社, 2017 |
| [19] |
Feizabadi MM, Majnooni A, Nomanpour B, et al. Direct detection of Pseudomonas aeruginosa from patients with healthcare associated pneumonia by real time PCR[J]. Infection, Genetics and Evolution, 2010, 10(8): 1247-1251. DOI:10.1016/j.meegid.2010.08.008 |
| [20] |
Colinon C, Deredjian A, Hien E, et al. Detection and enumeration of Pseudomonas aeruginosa in soil and manure assessed by an ecfX qPCR assay[J]. Journal of Applied Microbiology, 2013, 114(6): 1734-1749. DOI:10.1111/jam.12189 |
| [21] |
Amini B, Kamali M, Salouti M, et al. Spectrophotometric, colorimetric and visually detection of Pseudomonas aeruginosa ETA gene based gold nanoparticles DNA probe and endonuclease enzyme[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 199: 421-429. DOI:10.1016/j.saa.2018.03.056 |
| [22] |
Dhama K, Karthik K, Chakraborty S, et al. Loop-mediated isothermal amplification of DNA (LAMP): a new diagnostic tool lights the world of diagnosis of animal and human pathogens: a review[J]. Pakistan Journal of Biological Sciences, 2014, 17(2): 151-166. DOI:10.3923/pjbs.2014.151.166 |
| [23] |
Zhou Y, Wan Q, Cai ZH, et al. Evaluation of loop-mediated isothermal amplification based kits for rapid detection of Escherichia coli O157:H7[J]. Microbiology China, 2017, 44(8): 1996-2004. (in Chinese) 周杨, 万强, 蔡芷荷, 等. 基于环介导恒温扩增技术的大肠杆菌O157:H7快速检测试剂盒的评价[J]. 微生物学通报, 2017, 44(8): 1996-2004. |
| [24] |
Zhou Y, Wan Q, Cai ZH, et al. Loop-mediated isothermal amplification-based rapid detection for Shigella dysenteriae in food samples[J]. Microbiology China, 2017, 44(9): 2247-2254. (in Chinese) 周杨, 万强, 蔡芷荷, 等. 环介导等温扩增技术在食品中痢疾志贺氏菌快速检测[J]. 微生物学通报, 2017, 44(9): 2247-2254. |
| [25] |
Wang DG, Wang YZ, Xiao FG, et al. A comparison of in-house Real-Time LAMP assays with a commercial assay for the detection of pathogenic bacteria[J]. Molecules, 2015, 20(6): 9487-9495. DOI:10.3390/molecules20069487 |
| [26] |
Niizuma T, Lee T, Kinoshita K, et al. False positive of an immunochromatography kit for detection of norovirus in neonatal feces[J]. Journal of Infection and Chemotherapy, 2013, 19(1): 171-173. DOI:10.1007/s10156-012-0439-y |
| [27] |
Xu XY, Chen Q, Liu Q, et al. Detection of Pseudomonas aeruginosa in packing drinking water production line[J]. Beverage Industry, 2018, 21(3): 14-18. (in Chinese) 许晓云, 陈倩, 刘琦, 等. 包装饮用水生产线中铜绿假单胞菌的检测与防控[J]. 饮料工业, 2018, 21(3): 14-18. DOI:10.3969/j.issn.1007-7871.2018.03.005 |
| [28] |
Liao ZY, Cao DL, Zhang H, et al. Current situation and existing problems of packaged drinking water industry in China[J]. Journal of Food Safety and Quality, 2017, 8(3): 737-741. (in Chinese) 廖振宇, 曹东丽, 张华, 等. 我国包装饮用水行业发展现状及存在的问题[J]. 食品安全质量检测学报, 2017, 8(3): 737-741. |
| [29] |
Jami AAG, Zahmatkesh RR. Fast and specific detection of Pseudomonas aeruginosa from other pseudomonas species by PCR[J]. Annals of Burns and Fire Disasters, 2016, 29(4): 264-267. |
| [30] |
Tartor YH, El-Naenaeey EY. RT-PCR detection of exotoxin genes expression in multidrug resistant Pseudomonas aeruginosa[J]. Cellular and Molecular Biology (Noisy-le-Grand, France), 2016, 62(1): 56-62. |
| [31] |
Sutcharitchan P, Saiki R, Fucharoen A, et al. Reverse dot-blot detection of Thai β-thalassaemia mutations[J]. British Journal of Haematology, 1995, 90(4): 809-816. DOI:10.1111/j.1365-2141.1995.tb05200.x |
| [32] |
Ting C, Jun A, Shun Z. Detection of the common resistance genes in Gram-negative bacteria using gene chip technology[J]. Indian Journal of Medical Microbiology, 2013, 31(2): 142-147. |
 2020, Vol. 47
2020, Vol. 47