扩展功能
文章信息
- 宋伟男, 吕建华, 贾传文, 李长田
- SONG Wei-Nan, LU Jian-Hua, JIA Chuan-Wen, LI Chang-Tian
- 桦褐孔菌发酵鸭跖草提取物对铜绿假单胞菌群体感应系统的影响
- Effects of Commelina communis extract fermented by Inonotus obliquus on quorum sensing system of Pseudomonas aeruginosa
- 微生物学通报, 2020, 47(6): 1910-1919
- Microbiology China, 2020, 47(6): 1910-1919
- DOI: 10.13344/j.microbiol.china.190861
-
文章历史
- 收稿日期: 2019-10-25
- 接受日期: 2019-12-12
- 网络首发日期: 2020-01-06
2. 吉林农业大学食药用菌教育部工程研究中心 吉林 长春 130118
2. Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, Jilin Agricultural University, Changchun, Jilin 130118, China
铜绿假单胞菌是一种重要的机会致病菌,会导致人体感染,甚至危及生命,尤其是在免疫功能受损的患者中[1],是造成许多感染的原因之一。铜绿假单胞菌形成的群体感应系统和生物膜可以一定程度上阻止一些抗生素对人体的免疫反应[2],给相关治疗带来麻烦。群体感应系统是通过分泌信号分子进行识别的细胞间相互交流通讯形式,可以协调基因的表达来决定细菌的多种行为[3]。铜绿假单胞菌毒力因子(如绿脓菌素、LasA蛋白酶、鼠李糖脂)等行为的表达均受到群体感应系统调控[4],这些毒力因子在持续性感染方面危害性更大,如囊性纤维化、心内膜炎、菌血症、伤口和烧伤感染以及尿路感染等,而群体感应系统在细菌控制毒力因子中起着重要作用[5],对群体感应系统的干预可能成为抑制铜绿假单胞菌感染的有效方法。然而治疗铜绿假单胞菌的生物膜感染非常困难,例如阿奇霉素(azithromycin,AZM)是一种大环内酯类抗生素,其通过阻断群体感应系统抑制铜绿假单胞菌生物膜的形成,但其产生的副作用也让人担忧[6]。因此迫切需要开发无副作用的铜绿假单胞菌抑制剂。
近年来,具有抑菌活性的中药成分越来越受到人们的关注。天然酚类化合物具有较高的抑菌和抗氧化活性,在医药、食品和工业中得到了广泛的研究和应用[7]。微生物固体发酵是生产酚类化合物的一种有效的技术,这项技术可以提高植物总酚含量而不与有机溶剂产生毒性反应,并且无需对生物材料进行生产和生物转化的预处理[8]。微生物固体发酵具有原料成本低、生产周期短、环境污染少的特点。鸭跖草(Commelina communis)是鸭跖草科鸭跖草属植物,资源丰富,在我国大部分省区均有分布,具有抑菌、抗氧化、抗病毒、降血糖等作用,常用于治疗风热感冒、高热不退、咽喉肿痛、水肿尿少等,现阶段对其抑菌成分的研究主要集中在酚类和黄酮类化合物[9]。桦褐孔菌是一种珍稀药用真菌,具有抑菌、抗癌、抗糖尿病、抗氧化、抗病毒等功能[10],桦褐孔菌固体发酵鸭跖草的过程有利于富集和增加酚类化合物的含量,从而提高发酵鸭跖草的抑菌活性。目前尚未有桦褐孔菌发酵鸭跖草对铜绿假单胞菌抑制作用以及群体感应系统影响的报道,深入探讨其抑制作用机理可为治疗临床细菌感染治疗提供新的策略方向。
本实验通过研究桦褐孔菌发酵提取物对铜绿假单胞菌群感效应系统的影响说明其抑制作用机制,进一步比较发酵鸭跖草前后提取物的酚类化合物的变化来分析抑菌活性变化的原因,为发酵中药资源技术的深度开发和利用提供理论依据。
1 材料与方法 1.1 材料桦褐孔菌(HMJAUL2013070602)、铜绿假单胞菌(ATCC27853)、金黄色葡萄球菌(ATCC25923)均由吉林农业大学食药用菌种保藏中心提供。鸭跖草购于安徽省亳州市药材市场,经吉林农业大学李长田教授鉴定。
二甲基亚砜(DMSO)、阿奇霉素、结晶紫、福林酚、没食子酸等均购于北京索莱宝科技有限公司;地衣酚购于上海源叶生物科技有限公司;甲醇、95%乙醇等其他使用试剂均为国产分析纯试剂。超声波清洗器,宁波新芝生物科技股份有限公司;生化培养箱,宁波赛福实验仪器有限公司;多功能酶标仪,BioTek公司;旋转蒸发仪,上海亚荣生化仪器厂;高效液相色谱,岛津公司;InertSustain C18色谱柱4.6 mm×250 mm×5 μm,日本GL科学公司。
马铃薯葡萄糖琼脂(PDA)培养基(g/L):马铃薯200.0 (切成块状煮沸30.0 min后用纱布过滤),葡萄糖20.0,琼脂18.0,加水至1 L;马铃薯葡萄糖肉汤(PDB)培养基(g/L):马铃薯200.0 (切成块状煮沸30.0 min后用纱布过滤),葡萄糖20.0,加水至1 L;鸭跖草固体培养基(g/L):鸭跖草(整棵包括茎和叶,粉碎) 100.0,水0.15 L (含水量60%);LB培养基(g/L):蛋白胨10.0,酵母粉5.0,氯化钠10.0,琼脂18.0 (固体培养基,液体培养基不加琼脂),加水至1 L。以上所有培养基灭菌条件均为1×105 Pa灭菌30 min。
1.2 收集和制备样本提取物 1.2.1 发酵处理桦褐孔菌菌株用PDA培养基转接2次,配制PDB种子培养基并接入复壮的桦褐孔菌母种,于25 ℃、150 r/min振荡培养5 d,作为发酵种子培养液。取3 mL发酵种子培养液,均匀接种到500 mL锥形瓶中的鸭跖草固体培养基中(接种面积50.2 cm2),25 ℃静置培养40 d,未接种的鸭跖草固体培养基用作对照,进行3次平行实验。
1.2.2 提取物制备将发酵与未发酵鸭跖草的样品干燥后研磨粉碎,用80%甲醇超声提取3次,然后用旋转蒸发仪浓缩,冷冻干燥后称重。将发酵鸭跖草提取物、未发酵鸭跖草提取物、阿奇霉素用0.1% DMSO溶解配制成200 g/L的溶液储存,存放–20 ℃冰箱中备用。使用前稀释成不同浓度的提取物,并用0.22 μm的有机滤膜过滤除菌。
1.3 铜绿假单胞菌菌种制备铜绿假单胞菌在LB固体培养基平板上活化37 ℃下静置培养15 h,采用划线法在LB固体培养基平板中划线挑取单个菌落接种于LB液体培养基中,37 ℃、220 r/min振荡培养20 h。
1.4 提取物最小抑菌浓度的测定参考李芳等[11]的实验方法进行改进,采用微量稀释法测定FCC、UCC和AZM对PA的最小抑菌浓度,浓度梯度分别为FCC:64、32、16、8、4、2、1 g/L;UCC:256、128、64、32、16、8、4 g/L;AMZ:2、1、0.5、0.25、0.125、0.062 5、0.031 25 g/L,将37 ℃、220 r/min培养15 h的铜绿假单胞菌按1%比例(OD600=0.1)接种到FCC、UCC和AMZ配制成的不同浓度梯度LB液体培养基中,混合均匀后于37 ℃培养箱静置培养24 h,并设立空白对照组。测定样本组各部分OD600值,与空白对照组比较,将抑制率达到80%的抑制浓度作为PA的MIC,进行3次平行实验。

|
(1) |
参考Banerjee等[12]的实验方法进行改进,将37 ℃、220 r/min培养15 h的铜绿假单胞菌按1%比例接种到添加不同浓度(1/16、1/8、1/4、1/2 MIC) FCC和UCC的LB液体培养基中,每孔取200 μL于96孔板中,37 ℃下静置培养24 h,无菌水清洗3次,加入100 μL 0.1%结晶紫染色15 min,再使用无菌水洗涤3次,并在室温下干燥30 min,每孔取100 μL 95%乙醇进行脱色处理,最后测定样品部分与空白对照组的OD595值,并根据公式(1)计算抑制率。每个浓度梯度设3次重复实验。
1.6 提取物对绿脓菌素的影响参考吴彬彬等[13]的实验方法进行改进,将37 ℃、220 r/min培养15 h的铜绿假单胞菌按1%比例(OD600=0.1)接种至含有(1/16、1/8、1/4、1/2 MIC) FCC和UCC和空白对照的LB液体试管培养基中,37 ℃、220 r/min摇床培养24 h后。将培养后的菌液12 000 r/min离心1 min,准确量取上清液3 mL,加入3 mL三氯甲烷充分混合均匀后5 000 r/min离心5 min,将三氯甲烷层转移至新的试管中,并加入600 μL 0.2 mol/L HCl后5 000 r/min离心5 min,测定样品与空白对照组的OD520值,根据公式(1)计算提取物对绿脓素的抑制率,每个浓度梯度设3次重复实验。
1.7 提取物对LasA蛋白酶活性的影响参考李芳等[11]的实验方法进行改进,通过PA上清液裂解煮沸的金黄色葡萄球菌菌体的能力来测量LasA蛋白酶的活性。将培养好的金黄色葡萄球菌菌体在沸水中煮沸后用12 000 r/min离心10 min,将溶液用10 mmol/L pH 4.5的Na2HPO4配制成OD600为0.8的菌体溶液。并取900 μL菌体溶液加入不同浓度的(1/16、1/8、1/4、1/2 MIC) FCC、UCC和空白对照组培养的PA上清液(同1.5项)混合均匀,在37 ℃水浴锅中温育并测定0、5、10、20、30、45、60 min时(反应一直持续) OD600值的平均变化值,根据公式(1)计算LasA蛋白酶活性的抑制率。测定样品OD600数值,与空白对照组OD600数值比较,每个浓度梯度设3次重复实验。
1.8 提取物对鼠李糖脂的影响参考Parai等[14]的实验方法进行改进,PA接种及处理同1.5,吸取600 μL PA上清液,加入乙醚多次萃取后,在超净工作台中用无菌风吹干,加入0.5 mL超纯水溶解,然后取100 μL加入900 μL的1.7%地衣酚溶液,在80 ℃恒温水浴锅中反应30 min,并设立空白对照组。测定样品部分与空白对照组的OD420值,根据公式(1)计算提取物对鼠李糖脂的抑制率,每个浓度梯度设3次重复实验。
1.9 发酵鸭跖草前后提取物的HPLC分析用高效液相色谱仪对发酵前后提取物的化学物质进行检测,系统配有CBM-20A系统控制器、SPD-20UV紫外可见光检测器、二元高压梯度泵、自动进样器、柱温箱和C18柱。洗脱方案:溶剂梯度流动相为超纯水(A)和乙腈(B),梯度设定为:0 min,10% B;5 min,10% B;10 min,25% B;19 min,50% B;25 min,75% B;30 min,95% B。流动相流量为1 mL/min,柱温为30 ℃,检测波长210 nm,进样量10 μL。进行3次平行实验。
1.10 发酵鸭跖草前后提取物的总酚含量测定参考Zhang等[15]的实验方法进行改进,通过Folin-Ciocalteu法测量发酵鸭跖草前后的总酚含量,在测试前将样品FCC和UCC用甲醇稀释至1 g/L,再将50 μL稀释的样品与100 μL Folin-Ciocalteu试剂一起25 ℃下温育5 min,然后加入0.3 mL 20%的Na2CO3和1.0 mL超纯水,充分摇匀混合物,室温下温育30 min后10 000 r/min离心1 min,将200 μL上清液移液到96孔板中,测定OD765的吸光度。以没食子酸(gallic acid,GA)为标准品绘制标准曲线(Y=0.016 7X+0.010 1,R2=0.999 4),提取物样品中的总酚含量表示为每克样品的酚类化合物相当于多少毫克没食子酸(mg-GA/g),进行3次平行实验。
1.11 统计分析实验数据采用Excel 2016进行统计分析,采用SPSS 20.0进行差异显著性分析,所有值均表示为平均值±标准偏差(cSD),组间差异比较采用单因素方差分析,采用t检验,P < 0.05具有统计学意义。
2 结果与分析 2.1 提取物最小抑菌浓度的测定如图 1所示,采用微量稀释法测定了FCC和UCC对铜绿假单胞菌的最低抑菌浓度。FCC的MIC值明显较低,为16 g/L,与UCC的MIC值64 g/L相比降低了400% (P < 0.05),FCC和UCC的MIC值远高于AMZ的MIC值0.062 5 g/L,此结果表明桦褐孔菌发酵显著增强了鸭跖草对铜绿假单胞菌的抑菌活性。

|
| 图 1 FCC、UCC和AZM对PA的最小抑菌浓度 Figure 1 Minimum inhibitory concentration of FCC, UCC and AZM in Pseudomonas aeruginosa 注:A:FCC;B:UCC;C:AZM. Control:空白对照组;平均值±标准偏差,实验重复次数:n=3;*:与空白对照组比较P < 0.05. Note: A: FCC; B: UCC; C: AZM. Control: Blank control group; X±SD, number of experimental repeats: n=3; *: P < 0.05 vs control group. |
|
|
生物膜是粘附在细菌细胞的表面密集种群,铜绿假单胞菌感染引起的疾病中大多与生物膜相关。Lahiri等[16]发现当生物膜形成时,由于其相对不渗透性会导致许多抗菌药物失效。铜绿假单胞菌ATCC27853是一种标准生物膜形成的细菌,如图 2所示,铜绿假单胞菌的正常生长没有受到影响,高浓度的提取物抑制PA菌株生物膜的能力相比空白对照组明显增强。提取物在1/2、1/4、1/8、1/16 MIC浓度下培养24 h后,相对于空白对照组,FCC的抑制率分别达到43.51%、29.29%、23.43%、5.23%,UCC的抑制率分别为41.00%、28.87%、22.91%、0.73% (P < 0.05)。FCC和UCC抑制率变化的结果表明其对铜绿假单胞菌生物膜的抑制率随提取物浓度的升高而升高,而PA生物膜的形成随提取物浓度的升高而降低,因此发酵鸭跖草前后提取物对铜绿假单胞菌的生物膜形成都具有良好的抑制作用,并且桦褐孔菌发酵提高了鸭跖草抑制生物膜形成的作用。

|
| 图 2 不同浓度FCC和UCC对PA生物膜形成的影响 Figure 2 Effect of FCC and UCC suppress the biofilm formation in Pseudomonas aeruginosa 注:Control:空白对照组;平均值±标准偏差,实验重复次数:n=3;*:与空白对照组比较P < 0.05. Note: Control: Blank control group; X±SD, number of experimental repeats: n=3; *: P < 0.05 vs control group. |
|
|
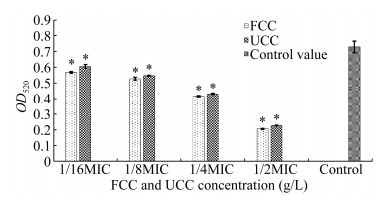
绿脓菌素是由铜绿假单胞菌分泌的一种毒力因子,参与细菌发病机制[12],实验测试了不同浓度提取物对铜绿假单胞菌中绿脓菌素产生的影响。如图 3所示,浓度梯度为1/2、1/4、1/8、1/16 MIC时对绿脓菌素产生具有明显的抑制作用,但没有影响铜绿假单胞菌的正常生长;当提取物浓度为1/2 MIC时,相对于空白对照组,FCC和UCC对于铜绿假单胞菌绿脓菌素的合成减少了71.74%和68.72% (P < 0.05);而在1/4、1/8、1/16 MIC时,FCC相对于空白对照组绿脓素合成分别减少了43.07%、27.71%、22.09%,UCC相对于空白对照组绿脓素合成分别减少了41.02%、24.42%、17.01%。结果表明,FCC和UCC对铜绿假单胞菌绿脓素的合成均具有抑制作用,抑制强度与提取物浓度呈现依赖性,桦褐孔菌发酵过程显著提高了鸭跖草抑制绿脓素合成的作用。
|
| 图 3 FCC和UCC对PA合成绿脓素的抑制作用 Figure 3 Effect of FCC and UCC on production of pyocyanin in Pseudomonas aeruginosa 注:Control:空白对照组;平均值±标准偏差,实验重复次数:n=3;*:与空白对照组比较P < 0.05. Note: Control: Blank control group; X±SD, number of experimental repeats: n=3; *: P < 0.05 vs control group. |
|
|
铜绿假单胞菌除了能够合成绿脓素外还会合成其他毒力因子,铜绿假单胞菌分泌的LasA蛋白酶在发病机理中起重要作用,尤其在急性感染中[17]。如图 4所示,FCC浓度在1/2 MIC时对LasA蛋白酶活性的抑制率达到87.25%,而UCC浓度在1/2 MIC时的抑制率为81.45%,因此,FCC裂解金黄色葡萄球菌的能力远高于UCC。在1/16、1/8、1/4 MIC的浓度时FCC与UCC的LasA蛋白酶活性相对于空白对照组分别被抑制了78.84%、51.59%、29.86%和71.59%、48.41%、17.10% (P < 0.05),且表现出对加入剂量呈依赖性的特点。结果表明FCC和UCC都对LasA蛋白酶活性有很强的抑制作用,桦褐孔菌发酵有助于提高鸭跖草对LasA蛋白酶的抑制活性。

|
| 图 4 FCC和UCC对PA LasA蛋白酶活性的抑制作用 Figure 4 Inhibition of FCC and UCC against LasA activity in Pseudomonas aeruginosa 注:Control:空白对照组;平均值±标准偏差,实验重复次数:n=3;*:与空白对照组比较P < 0.05. Note: Control: Blank control group; X±SD, number of experimental repeats: n=3; *: P < 0.05 vs control group. |
|
|
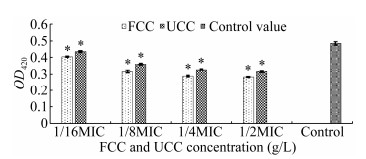
鼠李糖脂是铜绿假单胞菌产生的一个毒力因子,作为一种生物表面活性剂与群体运动和生物膜结构密切相关[18]。如图 5所示,相对于空白对照组,FCC在8、4、2、1 g/L分别使鼠李糖脂产量减少了41.53%、40.29%、34.50%和16.53%,而UCC在32、16、8、4 g/L分别使鼠李糖脂形成减少34.50%、32.44%、25.83%和9.92% (P < 0.05)。结果表明,FCC和UCC对鼠李糖脂的产量都有一定的抑制作用,抑制作用与提取物浓度呈现依赖性,而且桦褐孔菌发酵鸭跖草对于鼠李糖脂产量的抑制作用更加明显。另外,FCC和UCC对鼠李糖脂产量与PA生物膜形成的抑制率呈现出一定的相似性,由于鼠李糖脂是一种细菌生物表面活性剂,因而认为提取物减少鼠李糖脂产量促进了对PA生物膜形成的抑制作用。
|
| 图 5 FCC和UCC对PA鼠李糖脂产量的影响 Figure 5 Effect of FCC and UCC on the production of Pseudomonas aeruginosa rhamnolipid content 注:Control:空白对照组;平均值±标准偏差,实验重复次数:n=3;*:与空白对照组比较P < 0.05. Note: Control: Blank control group; X±SD, number of experimental repeats: n=3; *: P < 0.05 vs control group. |
|
|
用一定比例的甲醇提取通常是粗提取的第一步,80%甲醇提取可以从分离材料中获得大部分化学组分[19],所以选择80%甲醇提取物分析发酵前后鸭跖草的抑菌活性和主要化学成分变化。
为了研究发酵前后抑菌活性产生变化的原因,利用HPLC色谱图分析化学组分产生的变化。从图 6的色谱图中可以看出,在0−7 min和22−30 min时,FCC (A)相对于UCC (B)中的一些原始峰观察到改变,FCC色谱图在保留时间11−14 min和19−21 min,吸收峰明显丰富并产生了新的物质峰。结果表明桦褐孔菌发酵鸭跖草的过程可以促进改变化学物质的含量与新代谢物的产生,发酵导致化学组分的变化可能是引起鸭跖草抑菌活性增强的原因。

|
| 图 6 FCC和UCC的HPLC色谱图 Figure 6 HPLC chromatogram of FCC and UCC 注:A:FCC的色谱峰;B:UCC的色谱峰.实验重复次数:n=3. Note: A: FCC Chromatographic peaks; B: UCC Chromatographic peaks. Number of experimental repeats: n=3. |
|
|
植物中的酚类物质含量较高且具有很强的抑菌活性[20],通过HPLC色谱图分析发现发酵鸭跖草前后化学物质产生了很大变化,因而测定了发酵前后提取物的总酚含量。表 1结果显示发酵和未发酵提取物的总酚含量分别为197.64±0.48 mg-GAE/g和89.85±0.39 mg-GAE/g,发酵提取物中的总酚含量是未发酵的219.97% (P < 0.05)。发酵鸭跖草总酚含量的增加与Wang等[21]用米曲霉发酵天冬草来提高酚类物质的结果一致,表明发酵有利于提高鸭跖草酚类物质的含量,抑菌活性的提高可能与酚类化合物浓度提高有关,与Saleh等用真菌发酵来增强生姜的酚含量和抑菌活性的报道[22]一致。因此,桦褐孔菌发酵过程增加了鸭跖草中主要酚类化合物的浓度且可能与其抑菌活性提高有关。
| Sample name | Total phenolic content (mg-GAE/g) |
| FCC | 197.64±0.48a |
| UCC | 89.85±0.39b |
| 注:平均值±标准偏差,实验重复次数:n=3;不同上标(a、b)值的差异具有显著性P < 0.05. Note: X±SD, number of experimental repeats: n=3, Values with different superscripts (a, b) were significant different P < 0.05. |
|
铜绿假单胞菌对抗生素具有较高的多重耐药性,常常引起严重感染并对治疗产生巨大的困扰[23],因此急需开发新型的抑菌剂。群体感应系统通过调控铜绿假单胞菌毒力因子的形成而感染人体。群体感应系统调节毒力因子的表现如生物膜形成,以及绿脓素、LasA蛋白酶、鼠李糖脂和次级代谢产物的产生[24]。一些研究报道了小分子化合物和天然化合物具有针对群体感应的抑制活性,目的是开发新的抑菌策略[25],因此,获取较为安全的天然产物群体感应抑制剂成为研究热点。虽然现在已经开发出一些群体感应抑制剂,但是像FCC这样经过发酵作用显著提高群体感应抑制作用的研究少有报道。鸭跖草表现出生物活性多样、资源丰富的特点,有望成为天然抑菌剂的重要原料。
在利用桦褐孔菌固体发酵鸭跖草的过程中发现,其提取物对铜绿假单胞菌的抑菌活性得到显著提高,进一步对铜绿假单胞菌群体感应系统进行了研究。本实验从测定发酵前后鸭跖草提取物对PA生物膜形成和绿脓菌素合成、LasA蛋白酶活性、鼠李糖脂产量的抑制率出发,研究发酵前后鸭跖草提取物对铜绿假单胞菌群体感应系统产生的影响。实验结果表明,发酵和未发酵提取物对生物膜的形成、毒力因子的产生都具有良好的抑制作用,抑制率与提取物浓度呈现依赖性,但桦褐孔菌发酵过程显著增强了鸭跖草对铜绿假单胞菌群体感应系统的影响。
根据研究报道,酚类化合物具有多种生物功能,包括抑菌和抗氧化活性,利用发酵的过程可以提高植物中生物活性化合物的含量,用于增强植物的生物活性如抑菌活性[26]。本实验通过测定发酵前后提取物的总酚含量,以及分析HPLC色谱图化学物质的变化,探究抑制PA活性增加的原因。结果表明,桦褐孔菌发酵过程显著增加了酚类物质的含量,HPLC色谱图中物质峰的含量发生了改变并产生了新的物质峰,这些结果间接表明发酵过程增加的酚类物质是导致其抑菌活性增强的原因。
本实验结果表明通过桦褐孔菌固体发酵鸭跖草酚类物质含量明显增加以及化合物组分出现显著变化,这可能间接解释了抑菌能力有效增强的原因。另外,发酵提取物抑制铜绿假单胞菌的机制可能是通过抑制毒力因子的生成促使生物膜的形成受阻,影响了铜绿假单胞菌正常生长,从而产生了对铜绿假单胞菌的抑制作用,但由于其抑菌机制的复杂性,应用于临床治疗还需深入研究。综上所述,桦褐孔菌发酵鸭跖草在改善鸭跖草生物活性和增强抑制群体感应系统的能力方面有较高潜在的应用价值,桦褐孔菌固体发酵有望成为开发中药资源的重要途径和获得抗群体感应药物的新渠道。
| [1] |
Sharma G, Rao S, Bansal A, et al. Pseudomonas aeruginosa biofilm: potential therapeutic targets[J]. Biologicals, 2014, 42(1): 1-7. DOI:10.1016/j.biologicals.2013.11.001 |
| [2] |
Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm[J]. Science, 1998, 280(5361): 295-298. DOI:10.1126/science.280.5361.295 |
| [3] |
Zhang WW, Li CH. Exploiting quorum sensing interfering strategies in gram-negative bacteria for the enhancement of environmental applications[J]. Frontiers in Microbiology, 2016, 6: 1535. |
| [4] |
Jimenez PN, Koch G, Thompson JA, et al. The multiple signaling systems regulating virulence in Pseudomonas aeruginosa[J]. Microbiology and Molecular Biology Reviews, 2012, 76(1): 46-65. |
| [5] |
Willcox MDP, Zhu H, Conibear TCR, et al. Role of quorum sensing by Pseudomonas aeruginosa in microbial keratitis and cystic fibrosis[J]. Microbiology, 2008, 154(8): 2184-2194. DOI:10.1099/mic.0.2008/019281-0 |
| [6] |
Hoffmann N, Lee B, Hentzer M, et al. Azithromycin blocks quorum sensing and alginate polymer formation and increases the sensitivity to serum and stationary- growth-phase killing of Pseudomonas aeruginosa and attenuates chronic P. aeruginosa lung infection in Cftr−/− mice[J]. Antimicrobial Agents and Chemotherapy, 2007, 51(10): 3677-3687. DOI:10.1128/AAC.01011-06 |
| [7] |
Markom M, Hasan M, Daud WRW, et al. Extraction of hydrolysable tannins from Phyllanthus niruri Linn.: effects of solvents and extraction methods[J]. Separation and Purification Technology, 2007, 52(3): 487-496. DOI:10.1016/j.seppur.2006.06.003 |
| [8] |
Abdel-Aty AM, Salama WH, Fahmy AS, et al. Impact of germination on antioxidant capacity of garden cress: new calculation for determination of total antioxidant activity[J]. Scientia Horticulturae, 2019, 246: 155-160. DOI:10.1016/j.scienta.2018.10.062 |
| [9] |
Shiono M, Matsugaki N, Takeda K. Structure of commelinin, a blue complex pigment from the blue flowers of Commelina communis[J]. Proceedings of the Japan Academy, Series B, Physical and Biological Sciences, 2008, 84(10): 452-456. DOI:10.2183/pjab.84.452 |
| [10] |
Chen YQ, Li Y. Development of the study in Inonotus obliquus[J]. Microbiology China, 2005, 32(2): 124-127. (in Chinese) 陈艳秋, 李玉. 桦褐孔菌的研究进展[J]. 微生物学通报, 2005, 32(2): 124-127. DOI:10.3969/j.issn.0253-2654.2005.02.026 |
| [11] |
Li F, Huang WF, Duan QJ, et al. Effect of sodium houttuyfonate on quorum sensing system of Pseudomonas aeruginosa[J]. Chinese Traditional and Herbal Drugs, 2016, 47(24): 4388-4394. (in Chinese) 李芳, 黄卫锋, 段强军, 等. 鱼腥草素钠对铜绿假单胞菌群感效应系统影响的研究[J]. 中草药, 2016, 47(24): 4388-4394. DOI:10.7501/j.issn.0253-2670.2016.24.016 |
| [12] |
Banerjee M, Moulick S, Bhattacharya KK, et al. Attenuation of Pseudomonas aeruginosa quorum sensing, virulence and biofilm formation by extracts of Andrographis paniculata[J]. Microbial Pathogenesis, 2017, 113: 85-93. DOI:10.1016/j.micpath.2017.10.023 |
| [13] |
Wu BB, Wang WZ, Yan XQ, et al. Effects of plant fermentation extract (PFE) on biofilms of Pseudomonas aeruginosa[J]. Acta Microbiologica Sinica, 2016, 56(7): 1202-1210. (in Chinese) 吴彬彬, 王文昭, 颜晓庆, 等. 植物发酵液提取物对铜绿假单胞菌生物膜的作用[J]. 微生物学报, 2016, 56(7): 1202-1210. |
| [14] |
Parai D, Banerjee M, Dey P, et al. Effect of reserpine on Pseudomonas aeruginosa quorum sensing mediated virulence factors and biofilm formation[J]. Biofouling, 2018, 34(3): 320-334. DOI:10.1080/08927014.2018.1437910 |
| [15] |
Zhang L, Tu ZC, Yuan T, et al. Antioxidants and α-glucosidase inhibitors from Ipomoea batatas leaves identified by bioassay-guided approach and structure-activity relationships[J]. Food Chemistry, 2016, 208: 61-67. DOI:10.1016/j.foodchem.2016.03.079 |
| [16] |
Lahiri D, Dash S, Dutta R, et al. Elucidating the effect of anti-biofilm activity of bioactive compounds extracted from plants[J]. Journal of Biosciences, 2019, 44(2): 52. DOI:10.1007/s12038-019-9868-4 |
| [17] |
Kong KF, Jayawardena SR, Indulkar SD, et al. Pseudomonas aeruginosa AmpR is a global transcriptional factor that regulates expression of AmpC and PoxB β-lactamases, proteases, quorum sensing, and other virulence factors[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(11): 4567-4575. DOI:10.1128/AAC.49.11.4567-4575.2005 |
| [18] |
Gutierrez M, Choi MH, Tian BX, et al. Simultaneous inhibition of rhamnolipid and polyhydroxyalkanoic acid synthesis and biofilm formation in Pseudomonas aeruginosa by 2-bromoalkanoic acids: effect of inhibitor alkyl-chain- length[J]. PLoS One, 2013, 8(9): e73986. DOI:10.1371/journal.pone.0073986 |
| [19] |
Zhou SD, Xu X, Lin YF, et al. On-line screening and identification of free radical scavenging compounds in Angelica dahurica fermented with Eurotium cristatum using an HPLC-PDA-Triple-TOF-MS/MS-ABTS system[J]. Food Chemistry, 2019, 272: 670-678. DOI:10.1016/j.foodchem.2018.07.173 |
| [20] |
Balasundram N, Sundram K, Samman S. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1): 191-203. DOI:10.1016/j.foodchem.2005.07.042 |
| [21] |
Wang GH, Lin YM, Kuo JT, et al. Comparison of biofunctional activity of Asparagus cochinchinensis (Lour.) Merr. Extract before and after fermentation with Aspergillus oryzae[J]. Journal of Bioscience and Bioengineering, 2019, 127(1): 59-65. DOI:10.1016/j.jbiosc.2018.06.015 |
| [22] |
Saleh RM, Kabli SA, Al-Garni SM, et al. Solid-state fermentation by Trichoderma viride for enhancing phenolic content, antioxidant and antimicrobial activities in ginger[J]. Letters in Applied Microbiology, 2018, 67(2): 161-167. DOI:10.1111/lam.13003 |
| [23] |
Palleroni NJ. The Pseudomonas story[J]. Environmental Microbiology, 2010, 12(6): 1377-1383. DOI:10.1111/j.1462-2920.2009.02041.x |
| [24] |
El-Mowafy SA, Shaaban MI, Abd El Galil KH, et al. Sodium ascorbate as a quorum sensing inhibitor of Pseudomonas aeruginosa[J]. Journal of Applied Microbiology, 2014, 117(5): 1388-1399. DOI:10.1111/jam.12631 |
| [25] |
Bjarnsholt T, Jensen PØ, Jakobsen TH, et al. Quorum sensing and virulence of Pseudomonas aeruginosa during lung infection of cystic fibrosis patients[J]. PLoS One, 2010, 5(4): e10115. DOI:10.1371/journal.pone.0010115 |
| [26] |
Salah HA, Bassuiny RI, El-Khonezy MI, et al. Impact of solid state fermentation by Trichoderma spp. on phenolic content, antioxidant and antibacterial activities of curry leaf powder[J]. Journal of Food Measurement and Characterization, 2019, 13(2): 1333-1340. DOI:10.1007/s11694-019-00048-0 |
 2020, Vol. 47
2020, Vol. 47