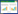扩展功能
文章信息
- 彭有胜, 谢诗慧, 吴晶, 李琛琛, 杨衍佑, 张军, 贾忠
- PENG You-Sheng, XIE Shi-Hui, WU Jing, LI Chen-Chen, YANG Yan-You, ZHNAG Jun, JIA Zhong
- 二芳基喹啉类化合物抗结核效果及安全性
- Anti-tuberculosis effect and safety of diarylquinoline compounds
- 微生物学通报, 2020, 47(6): 1901-1909
- Microbiology China, 2020, 47(6): 1901-1909
- DOI: 10.13344/j.microbiol.china.190718
-
文章历史
- 收稿日期: 2019-09-02
- 接受日期: 2019-12-18
- 网络首发日期: 2019-12-23
2. 兰州市第二人民医院 甘肃 兰州 730046;
3. 兰州市中医医院 甘肃 兰州 730050;
4. 兰州市医学会 甘肃 兰州 730030
2. The Second People's Hospital of Lanzhou City, Lanzhou, Gansu 730046, China;
3. The Traditional Chinese Medicine Hospital of Lanzhou City, Lanzhou, Gansu 730050, China;
4. Lanzhou Medical Association, Lanzhou, Gansu 730030, China
结核病是由结核分枝杆菌引起的一种慢性消耗性人畜共患病,是人类健康的主要威胁[1]。结核病是全人类十大死因之一,其死亡率在单一细菌性疾病中最高。每年仍有数以百万计的人患有结核病。2017年全球范围内有1 000万人患有结核病,其中成年男性580多万、妇女320多万,在艾滋病毒阴性者中造成了130多万人死亡,在艾滋病毒阳性者中有30万人死于结核病,已成为全世界传染病导致成人死亡的主要疾病之一[2-3]。现临床使用的抗结核药大多已超过半个世纪,而新药极其稀缺。贝达喹啉[4-5]是近年来第一个具有新的抗结核机制的二芳基喹啉类化合物,是近半个世纪来第一个治疗结核病的特效药,其作用机制是抑制结核分枝杆菌细胞壁中的ATP合成酶。但最近的临床实践表明,其能产生心率失常等较严重的不良反应[6]。因此本课题组对喹啉类化合物的结构加以改良,通过以芳胺为基础构建喹啉骨架,再以自由基正离子催化进行甘氨酸肉桂酯扩展来合成11种二芳基喹啉类化合物。经过初步药物筛选,得出抗结核效果最好的一种化合物编号为H2[7-8]。本试验首先对化合物H2进行结核分枝杆菌的药敏实验,判断其抑菌效果。继而进行小鼠体内急性毒性实验,初步探索其药物的安全性[9],以期为抗结核新药研发提供依据和奠定基础。
1 材料与方法 1.1 材料化合物H2由西北师范大学化工实验室提供,其分子结构见图 1。异烟肼(isoniazid,INH)、利福平(rifampicin,RFP)、乙胺丁醇(ethambutol,EMB),沈阳红旗制药有限公司;结核分枝杆菌标准菌株(H37Rv)、单耐药菌株(resistant-streptomycin,R-SM)、耐多药菌株[(multidrug-resistant,MDR) INH、RFP、EMB]、多耐药(streptomycin-isoniazid,SM-INH)菌株,兰州市肺科医院。隔水式培养箱,北京科伟永兴仪器有限公司;电子天平,上海箐海仪器有限公司;生物安全柜,上海力申科学仪器有限公司;BC5000血细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;E200MW光学显微镜,南京尼康江南光学仪器有限公司。昆明小鼠(体质量20±2 g,清洁级),兰州大学实验动物中心。
|
| 图 1 化合物H2的分子结构 Figure 1 The molecular structure of compound H2 |
|
|
按《结核病诊断实验室检验规程》[10]中INH 0.2 μg/mL、RFP 40 μg/mL、EMB 2 μg/mL的标准筛选耐药菌株,培养至对数生长期并挑取菌落,放入玻璃磨菌管中,置于振荡器上打磨呈乳酪样,以生理盐水稀释,通过与标准麦氏比浊管比浊,配成1 mg/mL的菌悬液。
1.2.2 抗结核活性化合物的筛选将1 mg/mL的H37Rv菌液稀释至10-2 mg/mL和10-4 mg/mL。分别用22 SWG标准接种环取一环(即0.01 mL)稀释后的菌液,采用划线法将菌液均匀接种于含不同二芳基喹啉类化合物的培养基[11]表面,37 ℃培养4周后报告结果。
1.2.3 测定化合物H2的最低抑菌浓度和最小杀菌浓度采用比例法[12]测定化合物H2的最低抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)。将1 mg/mL的耐药菌株菌液稀释至10-2 mg/mL和10-4 mg/mL后,分别接种于含化合物H2的培养基[11]表面,37 ℃培养4周后报告结果。
1.2.4 测定LD50试验取小鼠40只,按体质量、性别随机法分为5组,每组8只,雌雄各半。根据预实验,以1.26:1作为组间药物剂量比,剂量依次为:952.38、755.86、599.89、476.10、377.86 mg/kg。给药体积20 mL/kg。禁食(自由饮水) 16 h后灌胃给药,同时记录动物的即时反应并观察7 d,确定小鼠100%死亡率(P)的剂量(Dm)和0% (P)的剂量(Dn),单位为mg/kg。
1.2.5 毒性试验采用7 d喂养法[13],设3个剂量组:1/5 LD50 (高剂量组)、1/50 LD50 (中剂量组)、1/500 LD50 (低剂量组),另设空白对照组(等体积的去离子水)。将小鼠按体质量、雌雄各半随机分为4组,每组10只。禁食(不禁水) 12 h后给药,给药容量为20 mL/kg,1次/天,连续灌胃给药7 d,观察给药后至实验末期有无出现明显异常症状。第8天对所有小鼠通过摘眼球法采取外周血,剖检心、肝、肺、肾器官并称重,计算脏器系数(mg/g),制作组织切片,进行病理学观察。
2 结果与分析 2.1 抗结核活性筛选二芳基喹啉类化合物对H37Rv的作用效果见表 1。由表 1可以看出,11种二芳基喹啉类化合物中编号为H2的化合物耐药比为0,而其他化合物的耐药比皆大于1%。因此在11种化合物中仅H2对H37Rv敏感。
| 编号 No. |
化合物浓度/接菌量 Compound concentration (μg/mL)/Vaccination quantity (mg/mL) |
|||
| 2 μg/mL/10-4 mg/mL | 2 μg/mL/10-6 mg/mL | 20 μg/mL/10-4 mg/mL | 20 μg/mL/10-6 mg/mL | |
| H1 | 4+ | 4+ | 2+ | 1+ |
| H2 | 0 | 0 | 0 | 0 |
| H3 | 4+ | 2+ | 4+ | 2+ |
| H4 | 4+ | 3+ | 3+ | 2+ |
| H5 | 3+ | 2+ | 2+ | 1+ |
| H6 | 2+ | 2+ | 1+ | 1+ |
| H7 | 2+ | 2+ | 1+ | 1+ |
| H8 | 1+ | 1+ | 1+ | 1+ |
| H9 | 2+ | 1+ | 1+ | 1+ |
| H10 | 3+ | 3+ | 3+ | 2+ |
| H11 | 4+ | 3+ | 3+ | 3+ |
| Blank | 4+ | 4+ | 4+ | 3+ |
| 注:菌落能数清楚则用数字表示:0:培养基表面无菌落生长;1+:菌落占培养基表面积的1/4;2+:菌落占培养基表面积的1/2;3+:菌落占培养基表面积的3/4;4+:菌落铺满整个培养基表面. Note: It is showed by numbers if the number of colony can count. 0: No grown colony on the culture medium; 1+: Covered 1/4 above it; 2+: 1/2 of it; 3+: 3/4 of it; 4+: It’s all cover. |
||||
化合物H2与阳性对照药对不同结核分枝杆菌抑菌效果见表 2。由表 2可知,H2对H37Rv、R-SM、MOR、SM-INH的MIC均为0.1 μg/mL,MBC在0.1-0.25 μg/mL范围内,INH对H37Rv的MIC、MBC在0.1-0.25 μg/mL范围内,对R-SM的MBC为0.1-0.25 μg/mL。RFP对H37Rv的MBC在10-20 μg/mL范围内,对R-SM的MIC为10 μg/mL,对SM-INH的MIC在10 μg/mL左右。EMB对H37Rv的MIC为0.5 μg/mL,对MDR的MIC、MBC在0.5-1 μg/mL左右,对R-SM的MIC、MBC在0.5-1 μg/mL范围内。综上,H2对H37Rv的MIC与INH较相似,与其他阳性药相比,H2对耐药菌株仍有较好的抑菌效果。
| 药品 Drug |
浓度 Concentration (μg/mL) |
最终接种量 Vaccination quantity (mg/mL) |
菌株Strains | |||
| H37Rv | R-SM | MDR | SM-INH | |||
| H2 | 0.25 | 10-6 | 0 | 0 | 0 | 0 |
| 10-4 | 0 | 0 | 0 | 0 | ||
| 0.10 | 10-6 | 25 | 48 | 40 | 39 | |
| 10-4 | 61 | 83 | 70 | 83 | ||
| 0.05 | 10-6 | 1+ | 1+ | 1+ | 1+ | |
| 10-4 | 2+ | 2+ | 2+ | 2+ | ||
| INH | 0.25 | 10-6 | 0 | 0 | 4+ | 4+ |
| 10-4 | 0 | 0 | 4+ | 4+ | ||
| 0.10 | 10-6 | 1+ | 1+ | 4+ | 4+ | |
| 10-4 | 1+ | 1+ | 4+ | 4+ | ||
| 0.05 | 10-6 | 3+ | 3+ | 4+ | 4+ | |
| 10-4 | 3+ | 3+ | 4+ | 4+ | ||
| RFP | 20.00 | 10-6 | 0 | 0 | 4+ | 0 |
| 10-4 | 0 | 0 | 4+ | 1+ | ||
| 10.00 | 10-6 | 3+ | 1+ | 4+ | 3+ | |
| 10-4 | 3+ | 2+ | 4+ | 3+ | ||
| 5.00 | 10-6 | 4+ | 4+ | 4+ | 4+ | |
| 10-4 | 4+ | 4+ | 4+ | 4+ | ||
| EMB | 1.00 | 10-6 | 0 | 0 | 4+ | 20 |
| 10-4 | 0 | 0 | 4+ | 1+ | ||
| 0.50 | 10-6 | 4 | 1+ | 4+ | 2+ | |
| 10-4 | 34 | 2+ | 4+ | 3+ | ||
| 0.25 | 10-6 | 2+ | 4+ | 4+ | 3+ | |
| 10-4 | 3+ | 4+ | 4+ | 4+ | ||
| Blank | 10-6 | 4+ | 4+ | 4+ | 4+ | |
| 10-4 | 4+ | 4+ | 4+ | 4+ | ||
| 注:每种药物均为2倍稀释,包括0.05-40 μg/mL10个浓度.因部分浓度下药敏结果一致且相同,因此做了省略,仅呈现临界浓度范围的结果. Note: Each drugs are 2 times diluted, including 10 concentrations from 0.05 to 40 μg/mL. The results of drug sensitivity were consistent and identical under some concentrations so that some results were omitted, leading to the only critical concentrations range showed. |
||||||
首次给药后高剂量组少数实验动物出现原地转圈,停歇再转圈;中剂量组表现为精神状态不佳,原地伫立,散状分居,随后抱团生活;低剂量组没有较明显的表现,之后实验中上述反应消失。
2.3.2 半数致死量及其置信区间根据改良寇氏法公式[14],

|
由表 3可计算出LD50为582.77 mg/kg,95%置信区间为488.20-695.50 mg/kg。
| 组别 Group |
动物数 Animals |
剂量 Dose (mg/kg) |
饲喂方式 Feeding way |
死亡数 Deaths |
死亡率 Mortality(%) |
| 1 | 8 | 952.38 | Gavage | 8 | 100 |
| 2 | 8 | 755.86 | Gavage | 6 | 75.0 |
| 3 | 8 | 599.89 | Gavage | 5 | 62.5 |
| 4 | 8 | 476.10 | Gavage | 2 | 25.0 |
| 5 | 8 | 377.86 | Gavage | 0 | 0 |
药物对小鼠体质量变化见图 2,由图 2可知,高剂量组与空白组相比,第5天差异极显著(P < 0.01),第6天和第7天差异显著(P < 0.05),第1–4天和第8天无显著性差异(P > 0.05)。

|
| 图 2 同剂量药物对小鼠体质量影响 Figure 2 Effects of different doses of drugs on body weight of mice 注:不同组之间,不同大写字母表示差异极显著(P < 0.01),小写字母表示差异显著(P < 0.05). Note: Between groups, different capital letters mean very significant difference (P < 0.01), while lower case letters mean significant difference (P < 0.05). |
|
|
药物对小鼠外周血的影响见表 4,由表 4可知,与空白组相比,高剂量组红细胞计数(red blood cell,RBC)、血小板(platelet,PLT)、血小板比容(plateletocrit,PCT)差异显著(P < 0.05);与中剂量组相比,高剂量组PLT差异显著(P < 0.05);与低剂量组和中剂量组相比,高剂量组PCT差异显著(P < 0.05);血红蛋白(hemoglobin,HGB)、红细胞压积(hematocrit,HCT)、淋巴细胞百分数(lymphocyte ratio,LYM%)在空白组和剂量组之间无显著性差异(P > 0.05)。
| 组别 Group | HGB (g/L) | RBC (1012/L) | HCT (%) | PLT (109/L) | LYM (%) | PCT (%) |
| 空白组 Control group | 144.6±2.4 | 9.68±0.25a | 46.7±0.94 | 1 009±44.44a | 94.74±1.92 | 0.513±0.021a |
| 低剂量组 Low dose group | 141.7±4.2 | 9.81±0.18 | 47±0.94 | 1 048.9±38.1 | 92±1.2 | 0.519±0.023a |
| 中剂量组 Mid dose group | 149.3±2.58 | 10.25±0.24 | 47.9±0.8 | 1 008.3±29.04a | 93.16±2.01 | 0.508±0.028a |
| 高剂量组 High dose group | 143.08±4.47 | 10.33±0.17b | 45.83±1.24 | 1 167.42±50.19b | 90.02±1.84 | 0.613±0.033b |
| 注:同列间,不同大写字母表示差异极显著(P < 0.01),小写字母表示差异显著(P < 0.05). Note: In the same column, different capital letters mean very significant difference (P < 0.01), while lower case letters mean significant difference (P < 0.05). |
||||||
药物对小鼠脏器系数的影响见表 5,由表 5可知,与空白组相比,高剂量组肝脏系数差异极显著(P < 0.01),中剂量组有显著差异(P < 0.05);与低剂量组相比,高剂量组差异极显著(P < 0.01);与中剂量组相比,高剂量组差异显著(P < 0.05),其他各脏器系数在空白组和剂量组之间不存在显著性差异(P > 0.05)。
| 组别 Group |
脏器 Viscera |
|||
| 肺脏 Lung |
肝脏 Liver |
心脏 Heart |
肾脏 Kidney |
|
| 空白组 Control group |
8.15±0.22 | 48.37±1.13Aa | 4.77±0.13 | 13.05±0.5 |
| 低剂量组 Low dose group |
7.78±0.11 | 48.95±1.17Aa | 4.65±0.07 | 13.01±0.34 |
| 中剂量组 Mid dose group |
8.31±0.27 | 52.7±1.13b | 5.18±0.19 | 13.48±0.65 |
| 高剂量组 High dose group |
8.18±0.44 | 56.79±1.83Ba | 5.04±0.25 | 13.41±0.5 |
| 注:同列间,不同大写字母表示差异极显著(P < 0.01),小写字母表示差异显著(P < 0.05). Note: In the same column, different capital letters mean very significant difference (P < 0.01), while lower case letters mean significant difference (P < 0.05). |
||||
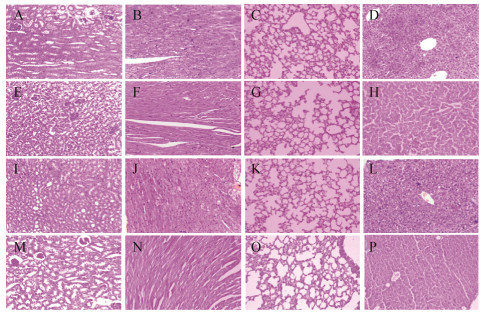
通过与对照组相比可知,药物对小鼠脏器的影响主要存在于肾脏(图中E、I、M)和肝脏(H、L、P),表现为肾组织有轻度炎症和水肿,以及肾小管上皮有轻度的水泡样变性,肝脏存在轻度的水肿和肝细胞的坏死;在心脏(F、G、N)、肺脏(G、K、O)均无明显的病理变化。药物对小鼠各脏器组织的影响见图 3。
|
| 图 3 药物对小鼠脏器影响的病理学观察(H.E 100×) Figure 3 The pathological observation on the effect of drugs on organs of mice (H.E 100×) 注:A、E、I、M:空白、低剂量、中剂量、高剂量组的肾脏;B、F、J、N:空白、低剂量、中剂量、高剂量组的心脏;C、G、K、O:空白、低剂量、中剂量、高剂量组的肺脏;D、H、L、P:空白、低剂量、中剂量、高剂量组的肝脏. Note: A, E, I and M represent the groups involve respectively low dose group, mid dose group and high dose group of kidney in the figure; The B, F, J and N represent the groups of heart; The C, G, K and O represent the groups of lung; The D, H, L and P represent the groups of liver. |
|
|
贝达喹啉作为一种全新抗结核作用机制的药物,对结核分枝杆菌有很好的抑菌效果,因此将此类药物加以改造和修饰对治疗结核病药物研发具有重大意义。本研究首次优化了二芳基喹啉类化合物的合成方法及路径,合成出的11种喹啉类化合物中,编号为H2的抑菌效果最为显著。通过比例法测定了化合物H2对耐药菌株的MIC、MBC,结果表明H2对R-SM、MDR和SM-INH的MIC均为0.1 μg/mL,MBC在0.1-0.25 μg/mL范围内;这与Lopez等描述的拉丁美洲地区贝达喹啉对结核分枝杆菌的MIC范围为0.003 9-0.25 μg/mL基本一致[15]。说明本试验利用的苯胺喹啉结构是一个有效母核,H2对结核分枝杆菌的抑菌效果和贝达喹啉相似。本试验还首次发现H2对H37Rv的MIC与INH较相似。与一线抗结核药物比较,H2的MBC和MIC都比较低,对耐药菌株有较好的抑菌效果。
急性毒性实验是药物进行后期实验的基础,对阐明其毒性作用、毒性靶器官具有重要意义,可为药物后期临床试验起始剂量的选择提供重要参考[16]。对于新化学物质的急性毒性,除测定LD50外,必须进行7 d喂养实验,这对亚急性和慢性毒性实验中的剂量可作出更为精确的估量,并对损害的组织器官进行更为充分的观察[13]。体质量可从整体上反应药物对动物机体的影响,是药物安全性评价的重要指标[17]。本试验中,与空白组相比,高剂量组在第5、6、7天时有显著性差异,其中第5天时体质量差异极显著(P < 0.01),第6、7天时差异显著(P < 0.05),说明该药物影响小鼠体重的增长,在体内短期的蓄积可能在第5天时毒性达到最高,之后逐渐减弱。
血常规作为医疗诊断过程中所需要的常规检查,其检测结果可为病理诊断提供依据[18-19]。本试验结果显示,在血液指标中,WBC、HGB、HCT、LYM%在空白组和剂量组之间无显著性差异(P > 0.05)。与空白组相比,高剂量组RBC、PLT、PCT差异显著(P < 0.05);与中剂量组相比,高剂量组PLT差异显著(P < 0.05);与低剂量组和中剂量组相比,高剂量组PCT差异显著(P < 0.05)。提示药物能增加小鼠血液黏滞度,有较高形成血栓和出血的概率[20]。血小板的增多可能伴有骨髓巨核细胞的异常增殖,并且会出现自发性出血症状,同时还会引起全身动脉中血栓的形成[21-22]。随着药物浓度的增加,对机体的伤害会愈加明显。器官系数作为毒副作用的重要指标,在一定程度上能反映试验动物的机体状态及内脏器官的病变。脏器系数增大,则提示脏器可能有水肿、充血或细胞增生肥大等;系数减小,则提示可能有萎缩等病变[23]。本试验结果表明,小鼠各脏器没有存在肉眼可见的病变,但与空白组和低剂量组相比,高剂量组肝脏系数差异极显著(P < 0.01);与中剂量组相比,高剂量组差异显著(P < 0.05),肺脏、心脏、肾脏各脏器系数在空白组和剂量组之间无显著性差异(P > 0.05),表明该药物可能会导致小鼠肝脏出现急性变化,且肝脏系数和药物浓度呈正相关。肝脏作为机体中最大、最复杂的器官,参与营养物质和大多数药物的代谢,在整体的生理活动中起着至关重要的作用[24]。肝脏正常生理功能一旦受到影响,将会导致机体出现营养不良甚至脏器功能衰竭等症状。如镜下所见,实验组小鼠肝脏组织有轻度的水肿和肝细胞的坏死,肾脏组织也存在轻度的水肿和炎症,证实了药物对肝脏和肾脏有不同程度的影响[25-26]。试验结果表明,药物H2和贝达喹啉对结核分枝杆菌的MIC基本类似,表现出较好的抑菌效果,具有较高的研究价值。但同时试验还存在一些不足,每种耐药类型的菌株选择比较少,这对于临床较广泛的耐药菌株而言,在阐明药物H2抗结核方面具有一定的局限性。由于贝达喹啉还没有真正作为一线抗结核药在临床上广泛使用,因此本试验选择现有一线抗结核药物作为对照,但这也缺少了药物H2和贝达喹啉在抗结核方面直接的联系。鉴于药物H2出现了毒性迹象,因此试验没有进行细胞毒性和心脏毒性试验,致使药物H2在细胞以及心脏毒性方面缺少科学研究的依据和探索。
药物安全性试验结果表明中剂量以上H2会导致小鼠外周血红细胞和血小板的增加,对肝脏和肾脏组织有轻度的损伤。后期试验将对H2展开进一步的结构修改与改造,以期提高其安全性,以便使药物H2在后期试验中的进行更具有实际意义。因此H2具有进一步开发、优化的研究价值,这为今后该药物的研发奠定了一定的基础,也为新抗结核化合物的开发提供了重要的参考价值。
| [1] |
Wang YD, Fan XY, Zhang YZ, et al. Preliminary study on immunogenicity of PPE protein family of Mycobacterium tuberculosis[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(S1): 269. (in Chinese) 王娅丹, 范小勇, 张耀洲, 等. 结核分支杆菌PPE蛋白质家族免疫原性初探[J]. 畜牧与兽医, 2012, 44(S1): 269. |
| [2] |
World Health Organization. Global tuberculosis report 2018[M]. Geneva: World Health Organization, 2018.
|
| [3] |
Wang XA. Investigation on the knowledge of tuberculosis patients in the first and second inpatients[J]. Forum on Grass-roots Medicine, 2010, 14(20): 636-637. (in Chinese) 王晓爱. 初次与再次住院结核病患者对疾病知识了解情况调查[J]. 基层医学论坛, 2010, 14(20): 636-637. |
| [4] |
Andries K, Verhasselt V, Guillemont J, et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis[J]. Science, 2005, 307(5707): 223-227. DOI:10.1126/science.1106753 |
| [5] |
Ying MF, Zhu JP, Ma K, et al. Mechanism and research progress of bedaquiline: a novel anti-tuberculosis drug[J]. Chinese Journal of New Drugs and Clinical Remedies, 2014, 33(5): 325-329. (in Chinese) 应苗法, 朱剑萍, 马珂, 等. 新型抗结核药物贝达喹啉的作用及其研究进展[J]. 中国新药与临床杂志, 2014, 33(5): 325-329. |
| [6] |
Deng TY. Advancement in drugs against tuberculosis[J]. Chinese Journal of New drugs and Clinical Remedies, 2017, 36(11): 629-634. (in Chinese) 邓体瑛. 抗结核药物研究进展[J]. 中国新药与临床杂志, 2017, 36(11): 629-634. |
| [7] |
Jia XD, Wang YX, Peng FF, et al. Catalytic sp3 C-H oxidation of peptides and their analogues by radical cation salts: from glycine amides to quinolines[J]. The Journal of Organic Chemistry, 2013, 78(18): 9450-9456. |
| [8] |
Wang YX. Study on c-h bond functional group reaction induced by free radical positive ion salt[D]. Lanzhou: Masterʼs Thesis of Northwest Normal University, 2014 (in Chinese) 王亚昕.自由基正离子盐诱导C-H键官能团化反应研究[D].兰州: 西北师范大学硕士学位论文, 2014 |
| [9] |
Chen H, Ma GP, Chen D, et al. Experimental study on acute toxicity of tortoise fruit lipid-lowering extract[J]. Fujian Journal of TCM, 2017, 48(4): 37-39. (in Chinese) 陈红, 马国萍, 陈丹, 等. 玳玳果降脂提取物急性毒性试验研究[J]. 福建中医药, 2017, 48(4): 37-39. |
| [10] |
Basic Professional Committee of China National Defense Tuberculosis Association. Test Procedures of TB Diagnostic Laboratory[M]. Shenzhen: China Education and Culture Press, 2006: 35-40. (in Chinese) 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程[M]. 深圳: 中国教育文化出版社, 2006: 35-40. |
| [11] |
Zhou WJ. Detection of the drug resistance gene of beda quinoline in the clinical specimens of tuberculosis[D]. Zunyi: Masterʼs Thesis of Zunyi Medical University, 2018: 13-16 (in Chinese) 周为静.抗结核新药贝达喹啉耐药基因在结核病临床标本中的检测[D].遵义: 遵义医科大学硕士学位论文, 2018: 13-16 |
| [12] |
Wang WN, Long B, Gao WF, et al. Comparing Analysis of MIC Microtiter and Lowenstein-Jensen DST of Mycobacterium tuberculosis[J]. Parasitoses and Infectious Diseases, 2019, 17(1): 52-54. (in Chinese) 王为娜, 龙波, 高文凤, 等. 微量MIC法和罗氏比例法对结核分枝杆菌药敏检测比对分析[J]. 寄生虫病与感染性疾病, 2019, 17(1): 52-54. |
| [13] |
Zhu MZ. Toxicology of Animal Foods[M]. Shanghai: Shanghai Science and Technology Publishing House, 1992: 40-41. (in Chinese) 朱模忠. 肉食品毒理学[M]. 上海: 上海科学技术出版社, 1992: 40-41. |
| [14] |
Zhang Q, Liu G, Ma XL, et al. Acute toxicity test of gamithromycin injection in mice[J]. Modern Animal Husbandry Science & Technology, 2017(3): 4-5. (in Chinese) 张倩, 刘刚, 马晓玲, 等. 加米霉素注射液对小鼠的急性毒性试验[J]. 现代畜牧科技, 2017(3): 4-5. |
| [15] |
Lopez B, Siqueira De Oliveira R, Pinhata JMW, et al. Bedaquiline and linezolid MIC distributions and epidemiological cut-off values for Mycobacterium tuberculosis in the Latin American region[J]. Journal of Antimicrobial Chemotherapy, 2019, 74(2): 373-379. DOI:10.1093/jac/dky414 |
| [16] |
Center for Drug Evaluation and Research. Guidance for Industry: Single Dose Acute Toxicity Testing for Pharmaceuticals[M]. Rockville: Center for Drug Evaluation and Research, 1996.
|
| [17] |
Wang JC, Zhu HL, Zhang C, et al. Effect of baicalein on body weight, organ coefficient and blood physiological parameters of rats induced by cadmium[J]. Chinese Journal of Veterinary Science, 2016, 36(12): 2150-2153. (in Chinese) 汪纪仓, 朱华丽, 张才, 等. 黄芩素对镉中毒大鼠体质量、器官系数和血液生理指标的影响[J]. 中国兽医学报, 2016, 36(12): 2150-2153. |
| [18] |
Cui YC, Mai ZH, Kulaixia A, et al. An experimental of mice acute toxicological test of Chinese herbal medicine compound additive[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(12): 3579-3586. (in Chinese) 崔耀成, 买占海, 库莱夏阿力别克, 等. 中草药复合添加剂的小鼠急性毒性试验[J]. 中国畜牧兽医, 2018, 45(12): 3579-3586. |
| [19] |
Zhong XQ. Factors affecting the blood test results of the investigation and analysis[J]. Contemporary Medicine, 2013, 19(5): 26-27. (in Chinese) 钟雪群. 影响血常规检测结果的因素调查分析[J]. 当代医学, 2013, 19(5): 26-27. |
| [20] |
Tang L. Clinical characteristics and curative effect analysis of patients with true polycythemia of different ages[J]. China's Naturopathy, 2019, 27(8): 80-82. (in Chinese) 唐莉. 不同年龄真性红细胞增多症患者的临床特点及疗效分析[J]. 中国民间疗法, 2019, 27(8): 80-82. |
| [21] |
Zhang J, Guo R, Li XH, et al. Analysis of clinical characteristics of patients with primary platelet hyperplasia complicated with coronary heart disease[J/OL]. China Journal of Modern Medicine, 2019. (2019-06-08). https://www.cnki.net/KCMS/detail/43.1225.R.20190627.1717.060.html (in Chinese) 张金, 郭荣, 李晓红, 等.原发性血小板增多症合并冠心病患者的临床特征分析[J/OL].中国现代医学杂志, 2019. (2019-06-08). https://www.cnki.net/KCMS/detail/43.1225.R.20190627.1717.060.html |
| [22] |
Li WW, Zhou ZJ, Lin YB, et al. Clinical analysis of interferon in the treatment of primary thrombocytopenia[J]. Contemporary Medicine, 2018, 24(11): 120-122. (in Chinese) 李雯雯, 周章军, 林雨标, 等. 干扰素治疗原发性血小板增多症的临床疗效分析[J]. 当代医学, 2018, 24(11): 120-122. |
| [23] |
Wei L, Zhang XF, Hao JH, et al. Measurement of organ coefficients and growth indices in KM mice[J]. Journal of Hebei North University (Natural Science Edition), 2019, 35(2): 1-4, 19. (in Chinese) 魏仑, 张晓芳, 郝建红, 等. 昆明小鼠主要脏器系数及生长指标的测定[J]. 河北北方学院学报:自然科学版, 2019, 35(2): 1-4, 19. |
| [24] |
Lu C. The Basis of Experimental Toxicology[M]. Translated by Lv BQ, Beijing: People's Health Publishing House, 1987: 210-211 (in Chinese) 鲁超.实验毒理学基础[M].吕伯钦, 译.北京: 人民卫生出版社, 1987: 210-211 |
| [25] |
Xu PP, Lin QC, Pan LD. Histopathological diagnosis on spleen-and-kidney-induced edema of Pelodiscus sinensis[J]. Journal of Fisheries of China, 2015, 39(7): 1054-1061. (in Chinese) 徐培培, 林启存, 潘连德. 中华鳖脾肾性水肿病病理学诊断[J]. 水产学报, 2015, 39(7): 1054-1061. |
| [26] |
Khoury EE, Kinaneh S, Aronson D, et al. Natriuretic peptides system in the pulmonary tissue of rats with heart failure: potential involvement in lung edema and inflammation[J]. Oncotarget, 2018, 9(31): 21715-21730. |
 2020, Vol. 47
2020, Vol. 47