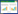扩展功能
文章信息
- 赵璐, 花蕾, 白芃, 刘静, 张勇, 郭敏, 李钊, 刘威
- ZHAO Lu, HUA Lei, BAI Peng, LIU Jing, ZHANG Yong, GUO Min, LI Zhao, LIU Wei
- 肠道微生物群加重黑腹果蝇盐胁迫反应
- Intestinal microbiota aggravates the salt stress response in Drosophila melanogaster
- 微生物学通报, 2020, 47(6): 1867-1875
- Microbiology China, 2020, 47(6): 1867-1875
- DOI: 10.13344/j.microbiol.china.190803
-
文章历史
- 收稿日期: 2019-10-07
- 接受日期: 2019-12-02
- 网络首发日期: 2020-01-06
2. 山西医科大学汾阳学院眼视光学系 山西 汾阳 032200;
3. 山西医科大学汾阳学院医学检验系 山西 汾阳 032200;
4. 山西医科大学汾阳学院基础医学部 山西 汾阳 032200
2. Department of Ophthalmology & Optometry Medical, Fenyang College, Shanxi Medical University, Fenyang, Shanxi 032200, China;
3. Department of Medical Laboratory Science, Fenyang College, Shanxi Medical University, Fenyang, Shanxi 032200, China;
4. Department of Faculty of Basic Medical, Fenyang College, Shanxi Medical University, Fenyang, Shanxi 032200, China
食盐是一类常见的中性盐,也是日常饮食最重要的调味品,其主要化学成分为氯化钠。NaCl在食物内以钠离子和氯离子形式存在,被肠道吸收和转运。如果体内缺盐,将会引起恶心、腹泻、心律不齐、肌肉痉挛等症状。然而高盐对机体产生一定的危害,诱发盐胁迫(salt stress),可直接损害消化道黏膜、升高血压[1]、增加肥胖风险[2]和加速衰老等。
人体肠道内栖息着很多细菌和其他微生物[3]。正常肠道菌群黏附定殖于人体肠道腔内并进行大量繁殖,形成一层“菌膜屏障”保护肠道。同时,肠道正常菌群还会对机体形成免疫刺激,不但使宿主产生广泛的免疫屏障,而且可以刺激宿主免疫系统的发育和细胞免疫的发生。研究发现,高盐饮食会使乳酸菌等有益细菌的数量减少;促进促炎性免疫细胞TH17细胞的生成;这些免疫细胞与高血压有关[4]。尽管研究已经发现肠道菌群对宿主具有保护作用,然而共生菌是否参与宿主盐胁迫应答仍然未知,其确切机制尚不清楚,亟需一个动物模型进行验证和探讨其机理。
黑腹果蝇(Drosophila melanogaster)作为宿主模型被广泛运用,具有很多优势:(1)正常果蝇肠道与人类具有相似的结构和功能,一些控制肠道发育及炎症反应的信号通路与调节基因具有保守性。(2)果蝇肠道共生有大量的微生物[5],并且容易建立起无菌和悉生动物模型。(3)果蝇还具有强大的遗传学工具,有利于阐释其作用机制。果蝇肠道菌随着果蝇状态而发生着动态变化,并影响着宿主的健康和寿命。例如,细菌载量会随着果蝇机体老化而剧烈增加,诱发肠道菌群失衡,导致肠道屏障功能紊乱,最终引发炎性状况[6]。研究发现,果蝇对高盐环境具有产卵避性反应[7]。此外,高盐饮食会破坏果蝇体内肠道微生物菌群的平衡,降低其存活率[8],但果蝇肠道菌群是否参与盐胁迫效应及其内在的影响机制仍然未知。
因此,本研究通过常规饲养果蝇和无菌果蝇,分析其在高盐条件下的存活率、生理变化和基因表达,探讨肠道微生物在盐胁迫反应过程中的作用及潜在的机理。
1 材料与方法 1.1 果蝇品系与培养方法黑腹果蝇(Drosophila melanogaster)品系Oregon R (OR),如无特别说明,所有果蝇均培养在温度25 ℃、相对湿度60%的恒温箱中,培养光周期为12 L:12 D[9]。通常情况下,果蝇饲养常用玉米-酵母培养基(g/L):葡萄糖63.20,酵母粉24.00,琼脂13.00,蔗糖31.60,CaCl2 0.83,玉米粉77.70,防腐剂(酒石酸钾钠8.80,尼泊尔丁酯14.70 mL)。
1.2 主要试剂和仪器次氯酸钠,Sigma-Aldrich公司;反转录试剂盒、TRIzol,Invitrogen公司;PowerSoil DNA分离试剂盒,MoBio公司;FastKing RT Kit (with gDNase),天根生化科技(北京)有限公司;RT-PCR试剂盒,TaKaRa公司;青/链霉素,华北制药公司;Walch消毒液,广州威莱公司;亮蓝食用色素,秀科生物公司。荧光定量PCR仪,Bio-Rad公司;核酸定量仪,北京普析通用公司。
1.3 无菌果蝇体系和悉菌果蝇体系的建立 1.3.1 无菌体系用酵母膏育肥果蝇,收集6-8 h内的果蝇胚胎,无菌水清洗胚胎表面,Walch消毒3次,1 min/次,次氯酸钠消毒1 min,1 000 r/min离心1 min,75%乙醇消毒2次,1 min/次,PBST清洗2次后将无菌胚胎转移至无菌培养基中,即可建立无菌果蝇[10]。
验证无菌体系:收集果蝇6-8 h的胚胎,严格消毒后取100 μL胚胎研磨液,涂NA板[8],37 ℃恒温培养箱培养24 h,观察无菌落生长可判断GF果蝇创建成功。如有菌落生成,弃去此批果蝇,重新收集和消毒胚胎。
1.3.2 悉生体系在无菌体系的基础上加入单株细菌或者多种菌,即为悉生果蝇体系。混合菌悉生果蝇处理方法:将普通饲养的果蝇成虫用75%乙醇消毒表面,无菌水清洗2次,研磨后注入无菌体系即可,又称为CR果蝇。
1.4 定量PCR解剖雌性CR果蝇肠道组织置于1 mL PBS中,对照组和实验组各40只。用PowerSoil DNA分离试剂盒提取基因组DNA,以β-Actin作为内参基因(引物:L:5′-TTGTCTGGGCAAGAGGATCAG-3′;R:5′-ACCACTCGCACTTGCACTTTC-3′),用通用引物16S (F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGTTACCTTGTTACGACTT-3′)检测果蝇肠道总菌量[11],得到Ct值,分析方法为∆Ct=Ct目的基因-Ct对照基因,相对表达量=2-∆∆Ct,实验重复次数n > 3。
1.5 果蝇运动能力装置的制备果蝇攀爬能力的测定:采用高度为35 cm的玻璃量筒,用不透明的厚层纸质将量筒分为上下两部分,中间为透明的缝隙,其中量筒的底座到透明缝隙的高度为14 cm。果蝇攀爬能力测定在黑暗环境中进行,在量筒最高处放置光源作为果蝇攀爬的吸引力。将每组果蝇分为5管,每管10只,将果蝇迅速转移到量筒内,轻轻振荡,将其沉于底部,用秒表测定前6只果蝇攀爬到透明缝隙的时间。奔跑能力的测定:装置由长度为26 cm的刻度吸管组成,刻度吸管的顶部采用海绵填塞。将刻度吸管放置于泡沫盒中央,泡沫盒外部用黑色的材料包裹。将每组果蝇分为5管,每管10只,将果蝇用漏斗转移到刻度吸管底部,轻轻振荡,将其沉于底部,用秒表测定前6只果蝇奔跑到刻度吸管顶部的时间。分别统计攀爬速度和奔跑速度作为运动能力衡量指标。
1.6 肠道载菌量的检测以2.4%的酵母食物培养果蝇,对CR成虫5-6 d的果蝇进行对照组和实验组肠道载菌量的检测。检测方法为:选取每组果蝇各10只置于含有75%无水乙醇的EP管内,体表消毒1 min,PBS洗2次,每次各1 min,加入200 μL PBS研磨,抽取100 μL作为原液。在NA板上进行浓度梯度稀释涂布,置于37 ℃培养36-48 h,计数培养基中的菌落数,其有效菌落数为30-300个,由此统计原液中每只果蝇体内的载菌量。
1.7 果蝇存活率的测定成虫5-6 d的果蝇经CO2麻醉后,分别挑取雌、雄性果蝇置于含有0.75 mol/L NaCl的食物培养基,每管20只。测定盐胁迫后6 d的存活率。
为了缓解盐胁迫对果蝇机体的影响,采用混合抗生素(0.14%青霉素+0.2%链霉素)进行干预。对照组采用正常食物。用移液枪加入100 μL混合抗生素溶液置于正常食物培养基,让果蝇饮用6 d后再用高盐处理,统计其存活率。
1.8 果蝇运动能力的测定果蝇经CO2麻醉后,挑取雌性果蝇置于含有0.75 mol/L NaCl的食物培养基,每管20只,采用运动能力测定装置测定盐胁迫后3 d的攀爬速度和奔跑速度。
1.9 染料渗透性实验为了检测高盐是否引起肠道屏障功能紊乱,采用染料渗透性实验进行统计分析[12]。先用添加了2.5%亮蓝食用色素的正常食物喂食果蝇9 h,高盐处理后,再用添加了2.5%亮蓝食用色素的正常食物喂食果蝇24 h,统计结果。如果肠道屏障功能完整,蓝色染料只局限分布于消化道;相反,如果肠道屏障功能破损,蓝色染料沿着破损的肠腔扩散到全身,形成一种全身变蓝的现象,称为“Smurf”现象。
1.10 实时定量PCR解剖雌性CR和GF果蝇肠道组织置于1 mL PBS中,对照组和实验组各40只。用FastKing RT Kit (with gDNase)提取肠道组织总RNA;反转录成cDNA[13]。以核糖体蛋白49基因(ribosomalprotein 49 gene,rp49)作为内参基因(引物:F:5ʹ-GACGCTT CAAGGGACAGTATCTG-3ʹ;R:5ʹ-AAACGCGGTT CAGCATGA-3ʹ),用引物对(F:5ʹ-CTGCACTGGAC TACTCCCACATCA-3';R:5ʹ-CGATCCTGCGACTG CCAAAGATTG-3ʹ)检测Attacin C表达水平,用引物对(F:5ʹ-CATTCCCCTGGACTCGCAC-3ʹ;R:5ʹ- TCGTGCGATTGGGTGGAC-3ʹ)检测Duox表达水平[14],得到Ct值,分析方法为∆Ct=Ct目的基因-Ct对照基因,相对表达量=2-∆∆Ct,实验重复次数n > 3。
1.11 数据分析与作图使用Excel软件整合分析数据,每组数据得平均值(mean)和标准误(SEM),用SPSS软件对各处理间的差异进行t检验分析。使用GraphPad和Adobe Illustrator软件制作相关图。
2 结果与分析 2.1 高盐增加果蝇肠道载菌量盐胁迫可引起肠道微生物菌群数量增加和组分改变,特别是肠道病原菌乘机过度增殖,即菌群紊乱。由于果蝇肠道微生物群结构简单和种类较少;目前所发现的细菌均可培养[15]。为此,本实验利用涂板计数法检测了高盐对果蝇肠道总菌量的影响[15]。结果发现,高盐处理后果蝇肠道载菌量显著增加(图 1A、B,P < 0.001),由对照组1.6×103 CFU/只增加到1.5×104 CFU/只(图 1B),约增加了10倍。以上数据表明高盐增加了肠道载菌量,提示高盐处理可能引起果蝇肠道菌群紊乱。
|
| 图 1 高盐增加果蝇肠道载菌量 Figure 1 High salt increases the total bacteria leading of Drosophila guts 注:A:CR果蝇(n=50)对照组和实验组用10-3倍稀释的果蝇匀浆液涂布NA培养基,测定肠道载菌量,显示代表性图像;B:CR果蝇对照组和实验组肠道载菌量数据统计;C:用qPCR法检测对照组和实验组细菌水平.图中数据为平均值±标准误;*: 0.01 < P < 0.05; ***: P < 0.001 (单样本t检验). Note: A: CR flies (n=50) in control group and experimental group were coated with the homogenate of flies with 1 000 dilution on NA plates and Intestinal microbial load was determined. Representative images are shown; B: The quantification of total bacterial load in guts; C: The bacterial levels of control group and experimental group were detected by qPCR. Values represent mean±SE; *: 0.01 < P < 0.05; ***: P < 0.001 (one-sample t-test). |
|
|
将20只雌、雄果蝇分别用0、0.5、0.75、1 mol/L NaCl处理,测定3 d内果蝇的存活率。结果与前人报道[8]一致,果蝇存活率随着NaCl浓度的增加而呈现下降的趋势(图 2A、B)。第3天0.75 mol/L处理的雌果蝇存活率仅为26%,而对照组为99% (图 2A,P < 0.001),雄果蝇存活率仅为14%,而对照组存活率为98% (图 2B,P < 0.001)。结果说明盐胁迫降低了果蝇的存活率。由于0.75 mol/L NaCl处理果蝇效果明显,且雌果蝇对高盐耐受性好,所以后续盐胁迫实验均选用0.75 mol/L NaCl处理雌果蝇。盐胁迫通常降低果蝇运动能力,可通过攀爬速度和奔跑速度反映。结果显示,果蝇在盐胁迫后攀爬速度为0.83 cm/s,对照组速度为1.26 cm/s (图 2C,P < 0.001),说明盐胁迫降低了果蝇的攀爬能力。同理,高盐处理的果蝇奔跑速度为0.65 cm/s,对照组速度为1.01 cm/s (图 2D,P < 0.001),说明盐胁迫降低了果蝇的奔跑能力。以上结果表明,盐胁迫导致果蝇存活率和运动能力下降。

|
| 图 2 盐胁迫降低果蝇存活率和运动能力 Figure 2 Salt stress reduced Drosophila survival rate and locomotion 注:A:雌性果蝇(n=100)用0、0.5、0.75、1 mol/L NaCl处理的存活率;B:雄性果蝇(n=100)用0、0.5、0.75、1 mol/L NaCl处理的存活率;C:果蝇(n=50)攀爬能力;D:果蝇(n=50)奔跑能力.图中数据为平均值±标准误;***: P < 0.001 (单样本t检验). Note: A: The survival rate of female flies (n=100) treated with 0, 0.5, 0.75, 1 mol/L NaCl; B: The survival rate of male flies (n=100) treated with 0, 0.5, 0.75, 1 mol/L NaCl; C: The climbing velocity of flies (n=50); D: The running velocity of flies (n=50). Values represent mean±SE; ***: P < 0.001 (one-sample t-test). |
|
|
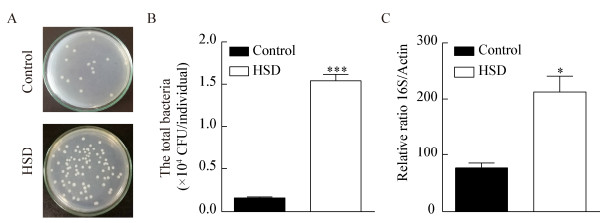
为了探讨肠道微生物是否参与了盐胁迫反应的应答,建立了无菌果蝇模型体系。对照组CR与GF果蝇的存活率分别为99%与100%;高盐处理后,CR与GF果蝇半数致死率分别为2.49 d和2.74 d,最大寿命分别为4 d和5 d (图 3A),提示肠道微生物参与盐胁迫反应的应答。为了进一步证实此结论,采用混合抗生素去除绝大部分的微生物,然后再用高盐处理。结果显示,经抗生素处理后果蝇半数致死率为2.84 d,最大寿命为6 d (图 3B)。高盐处理后,GF果蝇的攀爬速度是CR果蝇的1.42倍(图 3C,P < 0.01),且奔跑速度是CR果蝇的1.50倍(图 3D,P < 0.001)。以上数据均说明,肠道微生物加重了盐胁迫反应。
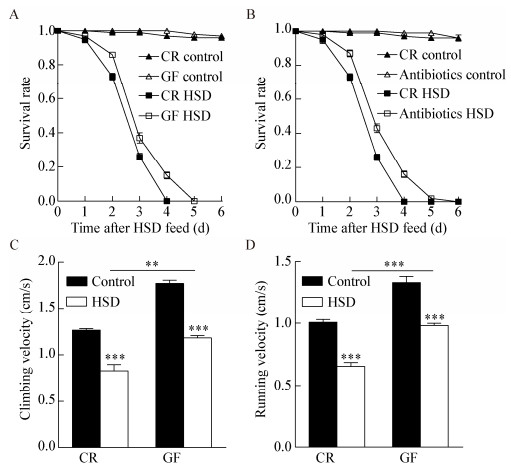
|
| 图 3 肠道微生物加重果蝇盐胁迫 Figure 3 Intestinal microbiota aggravate salt stress in Drosophila 注:A:CR与GF果蝇(n=100)在盐胁迫条件下的存活率;B:抗生素处理增加了盐胁迫处理果蝇(n=100)的存活率;C:CR与GF果蝇(n=50)在盐胁迫后的攀爬速度;D:CR与GF果蝇(n=50)在盐胁迫处理后的奔跑速度.图中数据为平均值±标准误;**:0.001 < P < 0.01;***:P < 0.001 (单样本t检验). Note: A: Survival rate of CR and GF flies (n=100) challenged with salt stress; B: Antibiotic treatment increased survival rate of salt-stressed flies (n=100); C: The climbing velocity of CR and GF flies (n=50) treated with salt stress; D: The running velocity of CR and GF flies (n=50) in case of salt stress. Values represent mean±SE; **: 0.001 < P < 0.01; ***: P < 0.001 (one-sample t-test). |
|
|
为了检测高盐饮食是否对肠道屏障功能产生影响,采用亮蓝色素染料渗透性实验进行检测。亮蓝色素染料是一种高分子物质,不能通过完整肠道屏障,仅仅局限于肠道内(图 4A),但其可经过破损的肠道屏障进入血淋巴,呈现全身变蓝的现象(图 4B),被称为“Smurf”。结果显示,CR组果蝇在高盐处理后出现Smurf的百分率为20% (图 4C),说明高盐引起肠道屏障功能紊乱。GF组果蝇在高盐处理后出现Smurf的百分率为12%,显著低于CR果蝇(P < 0.05),结果说明肠道菌群可加重高盐诱导的肠屏障功能紊乱。

|
| 图 4 肠道菌群加重高盐诱导的肠屏障功能紊乱 Figure 4 Intestinal flora exacerbate intestinal barrier dysfunction induced by high salt. 注:A和B:Smurf代表性图片;A:肠道屏障完整的果蝇;B:肠道屏障失调果蝇;C:CR和GF果蝇24 h内出现Smurf的统计.图中数据为平均值±标准误. *:0.01 < P < 0.05;**:0.001 < P < 0.01 (单样本t检验). Note: A and B: Representative images of Smurf; A: flies with intact intestinal barrier; B: flies with impaired intestinal barrier; C: The quantification of Smurf for 24 h in CR and GF flies. Values represent mean±SE. *: 0.01 < P < 0.05; **: 0.001 < P < 0.01 (one-sample t-test). |
|
|
果蝇的肠道免疫激活后,可诱导多种抗菌肽(antimicrobial peptides,AMPs)的分泌和活性氧自由基(reactive oxygen species,ROS)的产生,以帮助果蝇解除胁迫和提高存活率。通过实时定量PCR法检测高盐处理后Attacin-C(AMPs)与Duox (ROS)的表达水平,结果显示与对照组相比,高盐处理后Attacin-C、Duox的表达水平在CR、GF果蝇中增高,这符合预期结果,因为胁迫通常激活肠道免疫应答。然而与CR果蝇相比,GF果蝇Attacin-C的表达水平有更显著的升高,为CR果蝇表达量的2.4倍(图 5A,P < 0.01)。同理,GF果蝇Duox的表达水平也比CR果蝇显著升高,为CR果蝇表达量的1.7倍(图 5B,P < 0.01)。以上结果说明,肠道微生物抑制先天免疫活性和活性氧的产生,有损于机体对高盐应激的应答。
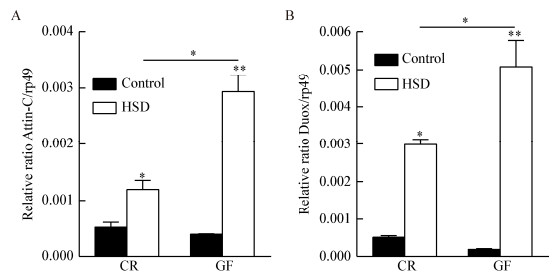
|
| 图 5 肠道微生物抑制先天免疫系统活性 Figure 5 Intestinal microbes inhibit innate immune system activity 注:A:CR和GF果蝇Attacin-C基因的相对表达量;B:CR和GF果蝇的Duox基因的相对表达量.图中数据为平均值±标准误. *:0.01 < P < 0.05;**:0.001 < P < 0.01 (单样本t检验). Note: A: Relative expression levels of Attacin-C in CR and GF flies treated with salt stress; B: Relative expression levels of Duox in CR and GF flies treated with salt stress. Values represent mean±SE. *: 0.01 < P < 0.05; **: 0.001 < P < 0.01 (one-sample t-test). |
|
|
肠道微生物群的组成自出生起就与宿主共同发育并调节其健康,主要受饮食因素的影响[16]。食物多样性与宿主菌群多样性密切相关,食物结构相似的个体其肠道菌群结构也相似[11]。我们研究发现,高盐增加了果蝇肠道载菌量(图 1)。为了进一步验证肠道微生物是否参与了盐胁迫反应的应答,我们建立了无菌果蝇模型体系。高盐处理后,与对照组相比,GF果蝇的存活率显著提高(图 3A),运动能力也显著提高(图 3C、D)。同时,采用抗生素干预后,CR果蝇的存活率也显著提高(图 3B)。据报道,高盐饮食会使小鼠体内肠道微生物群的组成发生明显的变化,特别是乳酸菌被抑制;对于人来说,高盐也会抑制肠道乳酸菌[4]。然而高盐饮食是否会导致果蝇体内以乳酸菌为主的肠道微生物群的组成成分发生明显变化,还有待进一步研究。
细菌负荷增加与肠道屏障功能障碍密切相关[11, 17]。肠道屏障的功能可以通过给果蝇喂食一种不可吸收的蓝色染料来检测[12]。如果肠道屏障功能正常,染料仍留在消化道内(图 4A)。相反,如果肠道屏障被破坏,染料就会穿过屏障并扩散到全身,这一过程被称为“Smurf” (图 4B)。我们发现盐胁迫下果蝇的运动能力显著降低,推测这可能与高盐导致的肌肉痉挛有关[18]。果蝇肠道屏障功能紊乱后,肠道微生物的水平明显增高,导致果蝇先天免疫系统的激活(图 5)。在果蝇体内,与免疫系统相关的信号通路有Toll通路与Imd通路[19],两种通路的主要功能是协调AMP基因的转录激活过程。AMP基因可以编码一些分子量较小的分泌肽消除体内的病原体[20]。我们发现,高盐处理后AMP基因中Attacin-C基因的相对表达量升高(图 5A)。活性氧(reactive oxygen species,ROS)是果蝇免疫系统中的另一个重要指标,ROS是由双氧化酶Duox产生的一种肠道烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶,参与肠道与微生物相互作用的多个方面[21]。高盐处理后,Duox基因的相对表达量升高(图 5B)。在CR果蝇中,由于果蝇肠道携带微生物菌群,具有较高的先天免疫活性,当盐胁迫作用于机体时,可能存在负反馈调节,抑制了过激的应答反应。在GF果蝇模型中,由于肠道内不携带微生物菌群,先天性免疫较低,而当盐胁迫作用于机体时,可迅速激活机体免疫活性而应答外界刺激。较高的免疫活性有效地抵御细菌感染,从而对机体发挥更大的保护作用。这一推论与我们的结果一致,在盐胁迫下,GF果蝇的寿命较长(图 3A)。
目前,盐胁迫主要用于研究高盐对细胞渗透压的作用,而没有研究其与肠道微生物群的相互作用。为了解决这个问题,我们利用果蝇作为宿主模型,研究了肠道微生物群在盐胁迫下对宿主的应答影响。本实验发现,肠道微生物加重黑腹果蝇盐胁迫反应,抑制高盐诱导的先天免疫系统活性,并且伴随着肠道菌群数量增加和肠道屏障功能紊乱,最终降低了果蝇存活率和运动能力(图 2)。肠道微生物群的失调与越来越多的人类疾病有关,高盐饮食是这些疾病发生的主要危险因素之一,未来的高盐研究应考虑监测微生物群,关注微生物靶向治疗。本研究为未来预防和治疗相关疾病提供了一个有研究价值的新方向。
| [1] |
Rucker AJ, Rudemiller NP, Crowley SD. Salt, hypertension, and immunity[J]. Annual Review of Physiology, 2018, 80: 283-307. |
| [2] |
Lanaspa MA, Kuwabara M, Andres-Hernando A, et al. High salt intake causes leptin resistance and obesity in mice by stimulating endogenous fructose production and metabolism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(12): 3138-3143. |
| [3] |
Cani PD. Human gut microbiome: hopes, threats and promises[J]. Gut, 2018, 67(9): 1716-1725. |
| [4] |
Wilck N, Matus MG, Kearney SM, et al. Salt-responsive gut commensal modulates TH17 axis and disease[J]. Nature, 2017, 551(7682): 585-589. |
| [5] |
Lee WJ, Brey PT. How microbiomes influence metazoan development: insights from history and Drosophila modeling of gut-microbe interactions[J]. Annual Review of Cell and Developmental Biology, 2013, 29: 571-592. |
| [6] |
Guo L, Karpac J, Tran S, et al. PGRP-SC2 promotes gut immune homeostasis to limit commensal dysbiosis and extend lifespan[J]. Cell, 2014, 156(1/2): 109-122. |
| [7] |
Gao L, Li Z, He XY, et al. Oviposition avoidance of Drosophila melanogaster to high salt and its biological significance[J]. Acta Entomologica Sinica, 2019, 62(1): 73-81. (in Chinese) 高露, 李钊, 赫晓媛, 等. 黑腹果蝇对高盐的产卵避性反应及其生物学意义[J]. 昆虫学报, 2019, 62(1): 73-81. |
| [8] |
Stergiopoulos K, Cabrero P, Davies SA, et al. Salty dog, an SLC5 symporter, modulates Drosophila response to salt stress[J]. Physiological Genomics, 2009, 37(1): 1-11. |
| [9] |
Liu W, Jiang FF, Bi XL, et al. Drosophila FMRP participates in the DNA damage response by regulating G2/M cell cycle checkpoint and apoptosis[J]. Human Molecular Genetics, 2012, 21(21): 4655-4668. |
| [10] |
Brummel T, Ching A, Seroude L, et al. Drosophila lifespan enhancement by exogenous bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(35): 12974-12979. |
| [11] |
Clark RI, Salazar A, Yamada R, et al. Distinct shifts in microbiota composition during Drosophila aging impair intestinal function and drive mortality[J]. Cell Reports, 2015, 12(10): 1656-1667. |
| [12] |
Rera M, Bahadorani S, Cho J, et al. Modulation of longevity and tissue homeostasis by the Drosophila PGC-1 homolog[J]. Cell Metabolism, 2011, 14(5): 623-634. |
| [13] |
Li YJ, Su WZ, Zhu XF, et al. Isolation of acetobacter orientalis and their promotion of the growth and development of Drosophila melanogaster[J]. Acta Microbiologica Sinica, 2017, 57(10): 1536-1545. (in Chinese) 李玉娟, 苏琬真, 朱旭峰, 等. 一株东方醋酸杆菌分离与其促进果蝇生长发育[J]. 微生物学报, 2017, 57(10): 1536-1545. |
| [14] |
Storelli G, Defaye A, Erkosar B, et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-Dependent nutrient sensing[J]. Cell Metabolism, 2011, 14(3): 403-414. |
| [15] |
Chandler JA, Lang JM, Bhatnagar S, et al. Bacterial communities of diverse Drosophila species: ecological context of a host-microbe model system[J]. PLoS Genetics, 2011, 7(9): e1002272. |
| [16] |
Pereira MT, Malik M, Nostro JA, et al. Effect of dietary additives on intestinal permeability in both Drosophila and a human cell co-culture[J]. Disease Models & Mechanisms, 2018, 11(12): dmm034520. |
| [17] |
Cheng J, Palva AM, De Vos WM, et al. Contribution of the intestinal microbiota to human health: From birth to 100 years of age[A]//Dobrindt U, Hacker JK, Svanborg C. Between Pathogenicity and Commensalism[M]. Berlin, Heidelberg: Springer, 2011.
|
| [18] |
Zhu WX. Sports and salt intake[J]. Sports Science Research, 1985(10): 38, 35. (in Chinese) 朱文雄. 体育运动和摄盐量[J]. 体育科研, 1985(10): 38, 35. |
| [19] |
Zhang MM, Chu Y, Zhao ZW, et al. Progress in the molecular mechanisms of the innate immune responses in insects[J]. Acta Entomologica Sinica, 2012, 55(10): 1221-1229. (in Chinese) 张明明, 初源, 赵章武, 等. 昆虫天然免疫反应分子机制研究进展[J]. 昆虫学报, 2012, 55(10): 1221-1229. |
| [20] |
Ransohoff RM, Brown MA. Innate immunity in the central nervous system[J]. Journal of Clinical Investigation, 2012, 122(4): 1164-1171. |
| [21] |
Kim SH, Lee WJ. Role of DUOX in gut inflammation: lessons from Drosophila model of gut-microbiota interactions[J]. Frontiers in Cellular and Infection Microbiology, 2014, 3: 116. DOI:10.3389/fcimb.2013.00116 |
 2020, Vol. 47
2020, Vol. 47