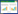扩展功能
文章信息
- 付嘉钰, 陈汭, 黄小波, 曹三杰, 文心田, 文翼平, 赵勤, 伍锐
- FU Jia-Yu, CHEN Rui, HUANG Xiao-Bo, CAO San-Jie, WEN Xin-Tian, WEN Yi-Ping, ZHAO Qin, WU Rui
- 1株猪δ冠状病毒N蛋白单克隆抗体制备与鉴定
- Preparation and identification of a monoclonal antibody against N protein of porcine deltacoronavirus
- 微生物学通报, 2020, 47(6): 1847-1856
- Microbiology China, 2020, 47(6): 1847-1856
- DOI: 10.13344/j.microbiol.china.190735
-
文章历史
- 收稿日期: 2019-09-07
- 接受日期: 2019-11-27
- 网络首发日期: 2020-01-02
2. 四川农业大学国家级动物类实验教学示范中心 四川 成都 611130;
3. 农业部兽用药物与兽医诊断技术四川科学观测实验站 四川 成都 611130
2. National Teaching and Experiment Center of Animal, Sichuan Agricultural University, Chengdu, Sichuan 611130, China;
3. Sichuan Science-observation Experimental Station of Veterinary Drugs and Veterinary Diagnostic Technology, Ministry of Agriculture, Chengdu, Sichuan 611130, China
猪δ冠状病毒,又称猪丁型冠状病毒(porcine deltacoronavirus,PDCoV),属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae) δ冠状病毒属[1-2],2012年由Woo等[3]首次在临床样品中检出。随后,于2014年在美国俄亥俄州的仔猪粪便及小肠样品中检出PDCoV[4]。同年,在中国3个省份(安徽、广西、湖北)的猪临床样本中也检测到了PDCoV的存在[5]。截至2017年12月,中国多个省份也报告了PDCoV造成仔猪死亡情况[6]。目前,PDCoV已在加拿大[7]、韩国[8]、泰国[9]以及越南[10]等越来越多的国家被报道,对养猪产业造成了影响。猪感染PDCoV的临床表现与猪轮状病毒(porcine rotavirus,PoRV)、传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)和猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)等猪病毒性腹泻病感染类似[11],以水样腹泻、呕吐、脱水等为典型特征[12]。除广泛肠道病变外,PDCoV还引起明显胃部病变以及轻微肺部病变,这两种病变均未在PEDV和TGEV中报道过[13]。由于PDCoV为新发的猪病毒性腹泻病病原,需深入研究并做好病毒防控措施以减轻其在猪场中造成的经济损失。
PDCoV为单股正链RNA病毒,基因组约为25.4 kb,是已知最小的冠状病毒[2]。PDCoV编码4种结构蛋白:纤突蛋白(spike protein,S)、核衣壳蛋白(nucleocapsid protein,N)、小膜蛋白(small membrane protein,sM或E)、膜蛋白(membrane protein,M)以及和2种非结构蛋白(non-structural protein,NSP) NSP6[11]和NSP7[2, 14]。N蛋白由病毒复制初期产生,在病毒RNA的复制和生产过程中发挥显著作用[15]。有研究表明,N蛋白在宿主细胞核中也存在,可能使细胞核仁生理周期发生紊乱,为病毒复制和重组创造有利的条件[16]。在受感染细胞中,N蛋白是表达量最高的病毒蛋白之一[17]。N蛋白的保守性强,常作为其他冠状病毒如猪流行性腹泻病毒、猪传染性胃肠炎病毒等[18]的诊断抗原。PDCoV N蛋白也可作为诊断抗原,张帆帆等[19]利用原核表达的PDCoV N蛋白为包被抗原,建立了PDCoV N蛋白的间接ELISA方法。
目前,关于PDCoV的来源尚不清楚,该病毒是否存在跨种传播风险也不明确,开展该病的感染机制研究、流行病学调查和建立临床诊断方法是急需解决的问题。因此,单克隆抗体在病毒研究方面具有重要价值。在PEDV N蛋白单克隆抗体研究中,Yang等[20]利用单克隆抗体3F12准确寻找到N蛋白一个表位N223-235,VAAKDALKSLGI;Wang等[21]利用两株单克隆抗体PN-D4和PN-D6找到两个其对应的表位18–133 aa和252–262 aa,为后续PEDV表位疫苗的设计奠定基础。Okda等[22]制备了PDCoV N蛋白的单克隆抗体并用于PDCoV的ELISA和细胞组织抗原检测。相对于PEDV N蛋白的研究,PDCoV N蛋白的研究目前还较少。因此,本研究以纯化后的重组N蛋白为免疫原,通过杂交瘤细胞技术,制备筛选获得一株效价最高的PDCoV N蛋白单克隆抗体并对其进行了鉴定和可用性评价,为后续开展PDCoV的诊断及N蛋白功能相关研究奠定了材料基础。
1 材料与方法 1.1 动物、毒株及质粒5–6周龄的雌性BALB/c小鼠购自成都达硕实验动物有限公司;猪δ冠状病毒(PDCoV) CHN-SC2015株(No. MK355396)由四川农业大学猪病研究中心保存;PDCoV重组质粒pET-28a-N由四川农业大学猪病研究中心构建保存。
1.2 主要试剂和仪器MontanideTM GEL 01 ST聚合物佐剂,SEPPIC公司;PEG1500,Sigma公司;50×HAT、100×HT,Gibico公司;小鼠Ig类/亚类鉴定试剂盒,洛阳佰泰科生物技术公司;Protein G预装柱,中科森辉微球技术(苏州)有限公司;OptimaxE90超速离心机,Beckman公司;FACSVerse流式细胞仪,BD公司。
1.3 PDCoV重组N蛋白的表达纯化将前期构建的pET-28a-N重组菌参照张雨迪[11]表达纯化方法,取1 mL未诱导阳性菌液接种至含50 μg/mL Kan+的LB液体培养基中(LB培养基g/L:酵母提取物5.0,胰蛋白胨10.0,NaCl 10.0),37 ℃、220 r/min培养至OD600为0.6,加IPTG至终浓度为0.8 mmol/L,30 ℃诱导表达4 h,12 000 r/min离心10 min,用超声破碎(300 W,超声2 s,停止3 s,共5 min)的方法破碎细菌,然后收集菌液中含有目的蛋白的上清液,在4 ℃、12 000 r/min离心10 min后用0.22 μm滤膜过滤、超滤柱浓缩、Ni+柱亲合层析纯化并鉴定,将洗脱峰回收液用MilliPore超滤管超滤纯化,并进行SDS-PAGE分析,用BCA蛋白浓度测定试剂盒测出蛋白浓度。
1.4 PDCoV重组N蛋白Western blot鉴定取pET-28a(+)空载、纯化的N蛋白进行SDS-PAGE分析,随后将蛋白转印到PVDF膜上,用含5%脱脂奶粉的PBST封闭1.5 h。使用制备的猪PDCoV全病毒血清作为一抗(1:200稀释),4 ℃孵育过夜后,PBST洗膜3次。使用HRP-山羊抗猪IgG作为二抗(1:5 000稀释),37 ℃孵育1 h,PBST洗膜3次后,通过DAB底物显色。
1.5 动物免疫以重组表达的PDCoV N蛋白为免疫原,与5倍稀释的MontanideTM GEL 01 ST聚合物佐剂等体积混合,经皮下多点注射免疫BALB/c小鼠,共免疫3次,每次免疫间隔2周,剂量为100 μg/只。三免后7 d用不加佐剂的N蛋白冲击免疫,3-5 d后取效价最高的小鼠脾细胞进行融合。每次免疫后7 d,采血用间接ELISA法检测抗体水平。
1.6 间接ELISA检测方法的建立利用棋盘法对最佳抗原包被浓度以及血清的最佳稀释比等条件进行优化。以空白孔调零,P/N≥2.1为阳性判定标准。
1.7 细胞融合与筛选细胞融合、阳性细胞筛选等方法均按照常规方法进行[23]。将SP2/0细胞与脾细胞在PEG1500作用下融合,融合后使用DMEM培养基(DMEM干粉13.5 g/L,NaHCO3 3.7 g/L,L-谷氨酰胺0.2 g/L)加入HAT及HT进行换液。待杂交瘤细胞生长至底面积1/3左右,吸取上清液,用间接ELISA方法测定其抗体效价。选择测定为强阳性的孔进行亚克隆筛选,获得能够分泌抗PDCoV N蛋白抗体杂交瘤细胞株。
1.8 单克隆抗体腹水制备、纯化及效价测定将BALB/c小鼠进行腹腔石蜡致敏,7 d后注射杂交瘤细胞制备腹水。将制备出的腹水单克隆抗体利用间接ELISA方法测定抗体效价,用1 μg PDCoV重组N蛋白作为包被抗原,封闭后将腹水单克隆抗体从1:10开始连续稀释测定抗体效价。利用硫酸铵盐析法对制备的腹水进行粗提,再使用Protein G亲和层析柱进一步纯化得到纯度较高的IgG抗体,并将纯化的单克隆抗体进行SDS-PAGE鉴定。
1.9 单克隆抗体特性鉴定 1.9.1 单克隆抗体亚类鉴定使用小鼠Ig类/单抗亚类检测试剂盒[11],将培养4-5 d的杂交瘤细胞培养上清进行单克隆抗体亚型鉴定。
1.9.2 单克隆抗体免疫活性鉴定分别将PDCoV重组蛋白N以及使用超速离心机浓缩后PDCoV CHN-SC2015株全病毒抗原进行SDS-PAGE电泳,并将蛋白条带转印至PVDF膜进行免疫印迹试验,其中一抗使用纯化的单克隆抗体(1:500),二抗使用羊抗鼠IgG/HRP (1:5 000)。
1.10 单克隆抗体可用性评价 1.10.1 细胞间接免疫荧光检测将PDCoV以MOI=0.1接种至铺满单层的LLC-PK细胞,培养48 h后以4E88阳性杂交瘤细胞培养上清为一抗(1:200),以FITC标记羊抗鼠IgG为二抗(1:500)进行间接免疫荧光的鉴定。
1.10.2 组织石蜡切片免疫荧光检测利用四川农业大学猪病研究中心PDCoV仔猪攻毒试验保留的攻毒7 d后空肠前端病变组织的石蜡切片,进行脱蜡并用EDTA (pH 8.0)抗原修复缓冲液进行抗原修复,10% BSA封闭,加入纯化后单克隆抗体为一抗(1:500),以CY3标记羊抗鼠IgG为二抗(1:500)孵育4 ℃过夜,用50%甘油缓冲液封片观察。
1.10.3 免疫组化检测利用四川农业大学猪病研究中心PDCoV仔猪攻毒试验保留的攻毒7 d后直肠组织的石蜡切片,进行脱蜡水化并利用柠檬酸钠缓冲液(pH 6.0)和EDTA (pH 9.0)进行抗原修复及消除内源性过氧化物酶活性。经5% BSA封闭、孵育单克隆抗体4E88 (1:500)为一抗和HRP-IgG (1:500)为二抗、DAB显色及复染细胞核等步骤,最后可检测出组织中病毒含量及分布。
1.10.4 流式细胞检测将PDCoV以MOI=0.1接种至铺满单层的LLC-PK细胞,培养48 h后出现病变,收集单细胞悬液并与单克隆抗体4E88冰上孵育30 min。PBS洗涤3次后,细胞悬液与FITC标记羊抗鼠IgG二抗(1:500)孵育。全部样品悬浮于PBS中,并使用流式细胞仪进行检测。流式细胞检测数据使用软件FlowJo software进行分析。
2 结果与分析 2.1 PDCoV重组N蛋白表达、纯化及鉴定利用Ni+亲和层析法对PDCoV重组N蛋白上清进行纯化,并用超滤管浓缩蛋白,经SDS-PAGE电泳鉴定,获得了纯度较高的重组N蛋白,蛋白大小与预期的相符,约为44 kD (加上标签大小) (图 1A)。将纯化后的N蛋白、pET-28a(+)空载转至PVDF膜上,以CHN-SC2015株免疫猪阳性血清作为一抗,以HRP-山羊抗猪IgG为二抗,进行Western blot分析。结果显示,纯化后的蛋白能与PDCoV阴性血清发生反应,表明纯化后的蛋白具有良好的免疫原性,利于后续单克隆抗体制备(图 1B)。
|
| 图 1 PDCoV重组N蛋白(PDCoV-rN) SDS-PAGE (A)及Western blot鉴定(B)图 Figure 1 SDS-PAGE (A) and Western blot (B) analysis of PDCoV recombinant N protein (PDCoV-rN) 注:M:蛋白非预染Marker;1:pET-28a(+)空载菌;2:未诱导的pET-28a-N重组菌;3:诱导后的pET-28a-N重组菌;4:破碎离心后的上清;5:纯化的PDCoV N蛋白. Note: M: Unstained protein Marker; 1: E. coli BL21 with empty vector pET-28a(+); 2: Uninduced E. coli BL21 with pET-28a-N; 3: Induced E. coli BL21 with pET-28a-N; 4: The supernatant obtained by centrifugation; 5: Purified PDCoV N protein. |
|
|
重组N蛋白浓度测定结果为0.78 mg/mL,通过棋盘法对条件进行优化,结果显示,包被抗原浓度1.0 μg/mL,待检血清稀释倍数为1:100时,P/N值高达17.675,其余条件参照张雨迪[11]建立的间接ELISA法。
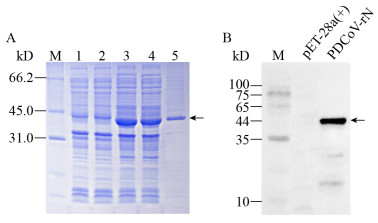
2.3 单克隆抗体腹水制备、纯化及效价测定细胞融合后,筛选获得一株效价最高的抗PDCoV N蛋白的杂交瘤细胞株,命名为4E88。在致敏小鼠腹部注射1×106个杂交瘤细胞后,观察到小鼠腹部明显隆起,收集腹水离心后的上清,进行间接ELISA效价测定为1:512 000 (图 2A)。腹水单克隆抗体经硫酸铵盐析法粗提后再用Protein G进一步提纯,SDS-PAGE鉴定结果显示,单克隆抗体4E88在约25 kD和56 kD出现明显两条带,即为单克隆抗体轻链和重链,证明得到了较纯单克隆抗体(图 2B)。
|
| 图 2 BALB/c小鼠腹水效价测定(A)及纯化(B)图 Figure 2 Titer determination (A) and purification (B) of BALB/c mice ascites 注:M:蛋白非预染Marker;1:未纯化的单克隆抗体;2:纯化后的单克隆抗体. Note: M: Unstained protein Marker; 1: Unpurified mAb; 2: Purified mAb. |
|
|
收集杂交瘤细胞4E88株细胞培养液上清,使用小鼠Ig类/亚类鉴定试剂盒测定单克隆抗体亚型,4E88株分泌的抗PDCoV N蛋白单克隆抗体的类型为IgG1型,轻链为κ链。
2.4.2 单克隆抗体免疫活性分析一抗使用纯化后的腹水(1:500稀释)、HRP标记的羊抗鼠IgG (1:5 000稀释)作为二抗分别与重组蛋白N以及超速离心后纯化的PDCoV全病毒进行免疫印迹分析,结果显示,在44 kD (加上标签大小)与38 kD左右处出现相应的印迹条带(图 3)。

|
| 图 3 单克隆抗体与纯化PDCoV和PDCoV-rN的反应 Figure 3 Reaction of mAb with purified PDCoV and PDCoV-rN 注:蛋白非预染Marker. Note: Unstained Protein Marker. |
|
|
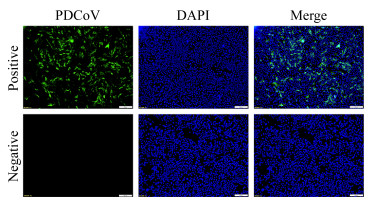
单克隆抗体对LLC-PK细胞中病毒的荧光检测结果显示(图 4),PDCoV感染的LLC-PK细胞中有明显的绿色荧光,而感染PDCoV的LLC-PK细胞则未见荧光,表明制备的单抗4E88可用于细胞病毒鉴定。
|
| 图 4 细胞的间接免疫荧光结果(100×) Figure 4 IFA result of cells (100×) Note: Bar: 100 μm. |
|
|
以单克隆抗体作一抗对PDCoV攻毒仔猪空肠前端病变组织进行组织荧光检测,试验结果表明,单克隆抗体4E88能够明显检测出攻毒猪受感染的肠道组织中PDCoV抗原分布及含量,抗原呈现出明显的红色荧光(图 5)。
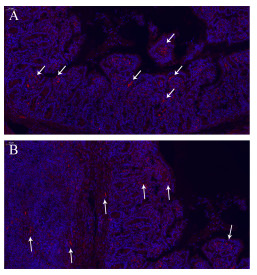
|
| 图 5 组织间接免疫荧光结果(100×) Figure 5 IFA result of tissue (100×) 注:A:空肠肠绒毛;B:空肠肠绒毛黏膜下层. Note: A: Jejunum villi; B: Submucosa of jejunum villi. |
|
|
PDCoV攻毒仔猪直肠以及阴性猪直肠免疫组化检测结果显示(图 6),单克隆抗体4E88能够检测出组织中PDCoV抗原,感染部分呈深褐色,说明4E88能够应用于免疫组化的检测,为PDCoV感染的临床诊断提供检测工具。

|
| 图 6 免疫组织化学检测PDCoV N蛋白结果(200×) Figure 6 Immunohistochemistry analysis of PDCoV N protein (200×) |
|
|
流式细胞检测结果显示(图 7),利用单克隆抗体4E88作为一抗,可以检测出PDCoV感染的LLC-PK细胞,并且在接毒细胞数量为1×106时,可检测出的阳性细胞比例为39.8%,表明单克隆抗体能够较好识别PDCoV感染的细胞。

|
| 图 7 流式细胞术检测单克隆抗体4E88识别PDCoV感染的LLC-PK细胞 Figure 7 Flow cytometry analysis of LLC-PK cells infected with PDCoV by monoclonal antibody 4E88 注:A:未加抗体检测的PDCoV感染细胞;B:单克隆抗体4E88检测的PDCoV感染细胞. Note: A: PDCoV infected cells with no antibody; B: PDCoV infected cells with mAb 4E88. |
|
|
δ冠状病毒属既包括哺乳动物冠状病毒,也包含鸟类冠状病毒,PDCoV作为研究δ冠状病毒的良好模型受到了广泛关注[12]。PDCoV不仅与其他猪腹泻病毒具有相似的临床症状,而且与哺乳仔猪多种腹泻病共感染的情况也加剧临床疾病严重程度[24]。据报道,在美国和加拿大293个腹泻猪样本中,RT-PCR检测出89个为PDCoV阳性,而阳性样本中又有78%为PEDV、PRoV混合感染[1, 7]。Luo等[25]通过原核表达的M蛋白作为检测抗原,建立了间接ELISA检测方法,但有研究报道PDCoV与PEDV M蛋白之间存在交叉反应[26]。冠状病毒N蛋白是一种磷酸化蛋白,能够稳定与病毒RNA结合形成螺旋结构核衣壳,参与病毒基因组转录与翻译,从而影响病毒复制[27-28]。据报道,PDCoV N蛋白抑制干扰素β产生并且干扰宿主抗病毒反应中猪视黄酸诱导基因Ⅰ (pig retinoic acid-inducible gene-Ⅰ,pRIG-Ⅰ)早期活化机制[29]。此外,N蛋白在宿主细胞内的表达量较多,且在不同的毒株中保守性高,可作为早期检测的理想靶点。本研究利用原核表达系统表达出PDCoV融合蛋白His-N,纯化后作为免疫原制备了PDCoV N蛋白单克隆抗体,为PDCoV诊断方法的建立及N蛋白功能研究奠定了基础。
3.2 BALB/c小鼠的免疫单克隆抗体是一种靶点特异性高的通用结合分子,是研究、诊断和治疗中不可缺少的工具。由动物免疫诱导的免疫反应是产生单克隆抗体的关键步骤之一,佐剂的使用对单克隆抗体的产生具有促进作用。在常见的免疫程序中一般使用弗氏完全与不完全佐剂进行免疫,但其本身对动物具有刺激性,常因免疫导致实验动物疼痛致死从而造成损失[11, 30]。本研究中运用的佐剂MontanideTM Gel 01 ST (Gel 01 ST)是研发用于动物的水性疫苗佐剂,有研究表明其含有分子质量相对较高的丙烯酸[31],能够明显地促进淋巴细胞增殖,具有良好的稳定性、副作用小[32]。Gel 01 ST应用的相关报道中,Arous等[33]证实Gel 01 ST佐剂与猪圆环病毒(porcine circovirus type 2,PCV2)灭活苗混合免疫小猪能增强抗PCV2抗体滴度;Xu等[34]通过Gel 01 ST佐剂与GI基因型JEV减毒株SCYA201201混合免疫小鼠的研究中发现,免疫组脾细胞增殖活性明显增高。本研究中采用Gel 01 ST佐剂与重组N蛋白抗原结合免疫BALB/c小鼠,具有较明显的免疫增强效果并且对小鼠刺激性小,3次免疫以后,小鼠血清效价测定可达40万倍以上,为后续单克隆抗体制备打下较好的基础。
3.3 细胞融合及杂交瘤细胞的筛选细胞融合是单克隆抗体制备的重要环节,其中SP2/0培养最为重要,由于SP2/0骨髓瘤细胞传代培养过程中会出现部分细胞返祖现象。因此,细胞融合前采用乔薪瑗等[35]的方法,用8-AG处理SP2/0骨髓瘤细胞,以维持瘤细胞对HAT培养基的敏感状态。除此之外,饲养层细胞的数量、状态对杂交瘤细胞影响较大。由于小鼠腹腔巨噬细胞能够分泌生长因子,而杂交瘤细胞生长需要这些因子以满足营养需求,所以需要制备饲养层细胞并将其数量控制在105个/mL左右[11]。
3.4 单克隆抗体识别天然蛋白在本研究中,使用阳性杂交瘤细胞株4E88制备的单克隆抗体作为一抗,使用Western blot检测单克隆抗体与PDCoV重组N蛋白以及病毒粒子中天然蛋白反应,结果表明,在38 kD处出现明显的条带,证明单克隆抗体4E88具有天然活性,为后续天然抗原的检测及功能研究提供有效的生物材料。
3.5 单克隆抗体的可用性单克隆抗体在病毒诊断、鉴定及治疗等方面都有广泛用途。本研究利用单克隆抗体4E88,在早期病毒细胞分离鉴定、免疫组织化学染色、间接免疫荧光试验、新鲜组织荧光抗体染色以及流式细胞筛选技术等试验中具有较好的抗原检测效果,表明制备的单克隆抗体4E88可应用于PDCoV抗原分子诊断及基础研究中。其中,组织间接免疫荧光及免疫组化的效果也可显示制备的单克隆抗体是研究PDCoV感染动物模型有效检测工具。在后续的研究中也可将制备的单克隆抗体应用于寻找抗原表位。
在目前的报道中,PDCoV单克隆抗体的运用在研究病毒蛋白的亚定位,以及NSP与宿主细胞的互作方面具有重要作用。例如,Fang等[36]运用杂交瘤技术获得两株能分泌特异性抗PDCoV NS6蛋白的杂交瘤细胞,并以这两种单克隆抗体检测出NS6蛋白定位分布于细胞质内,如内质网及高尔基体。此外,Okda等[22]制备出PDCoV N蛋白的单克隆抗体,利用荧光微球免疫测定在病毒分离过程中检测被感染细胞情况,该单克隆抗体还被运用在免疫组化上,用以检测实验感染猪肠道中病毒的分布情况,为研究病毒感染后宿主的组织病理变化奠定了基础。
现阶段虽然在PDCoV上单克隆抗体研究较少,但通过其他同属冠状病毒,如PEDV、TGEV等病毒单克隆抗体相关研究可提供借鉴。孙东波等[37]先后利用抗PEDV S蛋白的单克隆抗体对不同截段的S蛋白的免疫原性进行了研究,为研究S蛋白的抗原表位奠定了基础。随着对PDCoV的研究深入,这些研究必定对PDCoV感染的机制及其诊断、治疗以及防控有着重要的意义。
| [1] |
Jung K, Hu H, Saif LJ. Porcine deltacoronavirus infection: etiology, cell culture for virus isolation and propagation, molecular epidemiology and pathogenesis[J]. Virus Research, 2016, 226: 50-59. DOI:10.1016/j.virusres.2016.04.009 |
| [2] |
Chen Q, Gauger P, Stafne M, et al. Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets[J]. Virology, 2015, 482: 51-59. DOI:10.1016/j.virol.2015.03.024 |
| [3] |
Woo PCY, Lau SKP, Lam CSF, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and Deltacoronavirus[J]. Journal of Virology, 2012, 86(7): 3995-4008. DOI:10.1128/JVI.06540-11 |
| [4] |
Wang LY, Byrum B, Zhang Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerging Infectious Diseases, 2014, 20(7): 1227-1230. |
| [5] |
Dong N, Fang LR, Zeng SL, et al. Porcine deltacoronavirus in mainland China[J]. Emerging Infectious Diseases, 2015, 21(12): 2254-2255. DOI:10.3201/eid2112.150283 |
| [6] |
Wang M, Wang Y, Baloch AR, et al. Detection and genetic characterization of porcine Deltacoronavirus in Tibetan pigs surrounding the Qinghai-Tibet plateau of China[J]. Transboundary and Emerging Diseases, 2018, 65(2): 363-369. DOI:10.1111/tbed.12819 |
| [7] |
Marthaler D, Raymond L, Jiang Y, et al. Rapid detection, complete genome sequencing, and phylogenetic analysis of porcine deltacoronavirus[J]. Emerging Infectious Diseases, 2014, 20(8): 1347-1350. |
| [8] |
Lee S, Lee C. Complete genome characterization of Korean porcine deltacoronavirus strain KOR/KNU14-04/2014[J]. Genome Announcements, 2014, 2(6): e01191-14. |
| [9] |
Janetanakit T, Lumyai M, Bunpapong N, et al. Porcine deltacoronavirus, Thailand, 2015[J]. Emerging Infectious Diseases, 2016, 22(4): 757-759. |
| [10] |
Vui DT, Thanh TL, Tung N, et al. Complete genome characterization of porcine epidemic diarrhea virus in Vietnam[J]. Archives of Virology, 2015, 160(8): 1931-1938. DOI:10.1007/s00705-015-2463-6 |
| [11] |
Zhang YD. Construction of a prokaryotic expression recombinant S1 protein and an anti-recombinant S1 protein monoclonal antibody of porcine deltacoronavirus[D]. Yaan: Master's Thesis of Sichuan Agricultural University, 2017 (in Chinese) 张雨迪.猪δ冠状病毒(PDCoV)的S1蛋白原核表达与单克隆抗体制备[D].雅安: 四川农业大学硕士学位论文, 2017 |
| [12] |
Fang PX, Fang LR, Dong N, et al. Research advances in the porcine deltacoronavirus[J]. Chinese Journal of Virology, 2016, 32(2): 243-248. (in Chinese) 方谱县, 方六荣, 董楠, 等. 猪δ冠状病毒的研究进展[J]. 病毒学报, 2016, 32(2): 243-248. |
| [13] |
Ma YM, Zhang Y, Liang XY, et al. Origin, evolution, and virulence of porcine deltacoronaviruses in the United States[J]. mBio, 2015, 6(2): e00064-15. |
| [14] |
Woo PCY, Huang Y, Lau SKP, et al. Coronavirus genomics and bioinformatics analysis[J]. Viruses, 2010, 2(8): 1804-1820. DOI:10.3390/v2081803 |
| [15] |
Wang LY, Hayes J, Sarver C, et al. Porcine deltacoronavirus: histological lesions and genetic characterization[J]. Archives of Virology, 2016, 161(1): 171-175. DOI:10.1007/s00705-015-2627-4 |
| [16] |
Liu SX, Shi D, Chen JF, et al. Effects on host cell cycle by nucleoli localization signal peptides of porcine epidemic diarrhea virus nucleocapsid protein[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(3): 173-176. (in Chinese) 刘随新, 石达, 陈建飞, 等. 猪流行性腹泻病毒N蛋白核仁定位信号对宿主细胞周期的影响[J]. 中国预防兽医学报, 2013, 35(3): 173-176. DOI:10.3969/j.issn.1008-0589.2013.03.01 |
| [17] |
Proux K, Humbert F, Jouy E, et al. Improvements required for the detection of Salmonella Pullorum and Gallinarum[J]. Canadian Journal of Veterinary Research, 2002, 66(3): 151-157. |
| [18] |
Zúñiga S, Cruz JLG, Sola I, et al. Coronavirus nucleocapsid protein facilitates template switching and is required for efficient transcription[J]. Journal of Virology, 2010, 84(4): 2169-2175. DOI:10.1128/JVI.02011-09 |
| [19] |
Zhang FF, Song DP, Guo NN, et al. Establishment of a recombinant nucleoprotein-based ELISA for detection of antibodies against newly emerged porcine deltacoronavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(10): 795-799. (in Chinese) 张帆帆, 宋德平, 郭楠楠, 等. 以原核表达的猪δ冠状病毒N蛋白为包被抗原的间接ELISA方法的建立[J]. 中国预防兽医学报, 2016, 38(10): 795-799. |
| [20] |
Yang WT, Chen WW, Huang JL, et al. Generation, identification, and functional analysis of monoclonal antibodies against porcine epidemic diarrhea virus nucleocapsid[J]. Applied Microbiology and Biotechnology, 2019, 103(9): 3705-3714. DOI:10.1007/s00253-019-09702-5 |
| [21] |
Wang K, Xie C, Zhang JN, et al. The identification and characterization of two novel epitopes on the nucleocapsid protein of the porcine epidemic diarrhea virus[J]. Scientific Reports, 2016, 6: 39010. DOI:10.1038/srep39010 |
| [22] |
Okda F, Lawson S, Liu XD, et al. Development of monoclonal antibodies and serological assays including indirect ELISA and fluorescent microsphere immunoassays for diagnosis of porcine deltacoronavirus[J]. BMC Veterinary Research, 2016, 12: 95. DOI:10.1186/s12917-016-0716-6 |
| [23] |
Xu JW, Zhang XM, Wu ZX, et al. Preparation and identification of monoclonal antibodies against tree shrews CD3ε[J]. China Biotechnology, 2018, 38(4): 54-62. (in Chinese) 徐婧雯, 张雪梅, 吴忠香, 等. 抗树鼩CD3ε单克隆抗体的制备及生物学特性鉴定[J]. 中国生物工程杂志, 2018, 38(4): 54-62. |
| [24] |
Stevenson GW, Hoang H, Schwartz KJ, et al. Emergence of porcine epidemic diarrhea virus in the United States: clinical signs, lesions, and viral genomic sequences[J]. Journal of Veterinary Diagnostic Investigation, 2013, 25(5): 649-654. DOI:10.1177/1040638713501675 |
| [25] |
Luo SX, Fan JH, Opriessnig T, et al. Development and application of a recombinant M protein-based indirect ELISA for the detection of porcine deltacoronavirus IgG antibodies[J]. Journal of Virological Methods, 2017, 249: 76-78. DOI:10.1016/j.jviromet.2017.08.020 |
| [26] |
Gimenez-Lirola LG, Zhang JQ, Carrillo-Avila JA, et al. Reactivity of porcine epidemic diarrhea virus structural proteins to antibodies against porcine enteric coronaviruses: diagnostic implications[J]. Journal of Clinical Microbiology, 2017, 55(5): 1426-1436. DOI:10.1128/JCM.02507-16 |
| [27] |
Yang Y, Zhang L, Geng HY, et al. The structural and accessory proteins M, ORF 4a, ORF 4b, and ORF 5 of Middle East respiratory syndrome coronavirus (MERS-CoV) are potent interferon antagonists[J]. Protein & Cell, 2013, 4(12): 951-961. |
| [28] |
You J, Dove BK, Enjuanes L, et al. Subcellular localization of the severe acute respiratory syndrome coronavirus nucleocapsid protein[J]. Journal of General Virology, 2005, 86(12): 3303-3310. DOI:10.1099/vir.0.81076-0 |
| [29] |
Ji LK, Li SS, Zhu WX, et al. Porcine deltacoronavirus nucleocapsid protein suppressed IFN-β production by interfering porcine RIG-Ⅰ dsRNA-binding and K63-linked polyubiquitination[J]. Frontiers in Immunology, 2019, 10: 1024. DOI:10.3389/fimmu.2019.01024 |
| [30] |
Klimka A, Michels L, Glowalla E, et al. Montanide ISA 71 VG is advantageous to Freund's adjuvant in immunization against S. aureus infection of mice[J]. Scandinavian Journal of Immunology, 2015, 81(5): 291-297. DOI:10.1111/sji.12279 |
| [31] |
Jiang KF, Bai J, Li YF, et al. Screening and effective evaluation of encephalomycoarditis virus inactivated vaccine adjuvant[J]. Chinese Journal of Veterinary Science, 2015, 35(2): 242-246. (in Chinese) 蒋康富, 白娟, 李玉峰, 等. 脑心肌炎病毒灭活疫苗佐剂的筛选及其效力评价[J]. 中国兽医学报, 2015, 35(2): 242-246. |
| [32] |
Dong L, Xiong QY, Liu MJ, et al. Immune-enhancing activity comparison of different adjuvants on Mycoplasma hyopneumoniae inactivated vaccine[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(1): 67-70. (in Chinese) 董璐, 熊祺琰, 刘茂军, 等. 几种佐剂对猪支原体肺炎灭活疫苗的免疫增强作用比较[J]. 中国预防兽医学报, 2014, 36(1): 67-70. DOI:10.3969/j.issn.1008-0589.2014.01.17 |
| [33] |
Arous JB, Bertrand F, Gaucheron J, et al. Adjuvant formulations designed to improve swine vaccine stability: application to PCV2 vaccines[J]. Procedia in Vaccinology, 2013, 7: 34-39. DOI:10.1016/j.provac.2013.06.007 |
| [34] |
Xu YX, Wang Q, Wei BW, et al. Enhanced immune responses against Japanese encephalitis virus infection using Japanese encephalitis live-attenuated virus adjuvanted with Montanide GEL 01 ST in mice[J]. Vector-borne and Zoonotic Diseases, 2019, 19(11): 835-843. DOI:10.1089/vbz.2018.2419 |
| [35] |
Qiao XY, Li GW, Zhang GQ, et al. Production and identification of monoclonal antibodies against recombinant TGEV M protein[J]. Chinese Journal of Preventive Veterinary Medicine, 2007, 29(11): 874-878. (in Chinese) 乔薪瑗, 李桂伟, 张冠群, 等. 抗猪传染性胃肠炎M蛋白单克隆抗体的制备及部分特性鉴定[J]. 中国预防兽医学报, 2007, 29(11): 874-878. DOI:10.3969/j.issn.1008-0589.2007.11.011 |
| [36] |
Fang PX, Fang LR, Liu XR, et al. Identification and subcellular localization of porcine deltacoronavirus accessory protein NS6[J]. Virology, 2016, 499: 170-177. DOI:10.1016/j.virol.2016.09.015 |
| [37] |
Sun DB, Feng L, Shi HY, et al. Preparation and characterization of the monoclonal antibodies against neutralizing epitope region of PEDV S protein[J]. Chinese Journal of Preventive Veterinary Medicine, 2007, 29(11): 887-890. (in Chinese) 孙东波, 冯力, 时洪艳, 等. 猪流行性腹泻病毒S蛋白中和表位区单克隆抗体的制备与鉴定[J]. 中国预防兽医学报, 2007, 29(11): 887-890. DOI:10.3969/j.issn.1008-0589.2007.11.014 |
 2020, Vol. 47
2020, Vol. 47