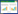扩展功能
文章信息
- 段晓霞, 格日乐其木格, 其其日力格, 邱崇顺, 芒来, 乌云达来
- DUAN Xiao-Xia, Gerelchimeg, Qiqirilige, QIU Chong-Shun, Mang lai, Wuyundalai
- 产碱性磷酸酶乳杆菌的筛选鉴定、酶的纯化及特性
- Screening, identification, purification and characterization of alkaline phosphatase from Lactobacillus
- 微生物学通报, 2020, 47(6): 1817-1827
- Microbiology China, 2020, 47(6): 1817-1827
- DOI: 10.13344/j.microbiol.china.190831
-
文章历史
- 收稿日期: 2019-10-15
- 接受日期: 2019-12-04
- 网络首发日期: 2020-01-06
2. 内蒙古农业大学动物科学学院 内蒙古 呼和浩特 010018;
3. 内蒙古自治区马属动物遗传育种与繁殖学重点实验室 农业农村部马属动物遗传育种与繁殖科学观测实验站 内蒙古农业大学马属动物研究中心 内蒙古 呼和浩特 010010
2. College of Animal Science, Inner Mongolia Agricultural University, Hohhot, Inner Mongolia 010018, China;
3. Inner Mongolia Key Laboratory of Equine Genetics, Breeding and Reproduction; Scientific Observing and Experimental Station of Equine Genetics, Breeding and Reproduction, Ministry of Agriculture and Rural Affairs; Equine Research Center of Inner Mongolia Agricultural University, Hohhot, Inner Mongolia 010010, China
磷酸酶通常是指能够在一定条件下催化正磷酸酯化合物水解的一类水解酶,根据作用时所需氢离子浓度值的不同可分为碱性磷酸酶(alkaline phosphatase,ALP)和酸性磷酸酶(acid phosphatase,AcPase)两大类[1]。碱性磷酸酶是一类在碱性条件下具有最佳活性的非特异性磷酸单酯酶[2],普遍存在于生物体内各组织器官及腺体和体液中,如血液、唾液等。在磷的生物地球化学循环过程中,ALP起到了极为重要的作用,在生物体内可直接参与磷酸基团的转移和代谢,维持体内适宜的钙磷比,且在蛋白质分泌、骨骼形成及脂质代谢中具有一定作用[3]。临床上血清ALP活性异常水平可作为多种疾病的诊断指标,如糖尿病、骨病、肝功能障碍或损失以及前列腺癌等[4-7]。提纯后的ALP常被用作核酸分析等研究中,也是电化学酶免疫分析和免疫传感器中的标记酶[8]。该酶可作为除草剂提高农作物产量,增强植物的抗逆性[9],也可以作为蛋白类食品中微生物的检测指标[10],从而保障食品安全。
早在20世纪50年代,国外就开始对产ALP的微生物有过报道,大多数分离自原核生物的酶,如枯草芽孢杆菌和大肠杆菌,其中关于大肠杆菌ALP的结构、功能及催化特性研究得最为清楚[11-12]。但我国目前对于ALP的研究多集中于哺乳动物、贝类、鱼类等[13-15],对微生物方面的研究较少。乳酸菌是一类可发酵碳水化合物并产生乳酸的革兰氏阳性细菌的总称[16-17],广泛存在于人体肠道内且具有重要的生理功能[18-19]。目前关于乳酸菌中ALP的研究鲜有报道。因此,本文以蒙古国酸马奶样品中分离筛选的乳酸菌为研究对象,从中筛选出一株产ALP且具有潜在益生作用的乳杆菌,并对ALP进行分离纯化和酶学特性研究,以期为ALP产生菌的研究提供新的思路,同时也为ALP的工业化生产和应用提供新的实验方法和材料。
1 材料 1.1 样品的采集酸马奶样品采集自蒙古国前杭爱省、后杭爱省、布尔干省、中央省4个不同地区。
1.2 培养基及主要试剂和仪器脱脂乳培养基、MRS液体培养基、MRS固体培养基、0.75% MRS-CaCO3培养基和HBI乳酸菌生化鉴定条,青岛高科技工业园海博生物技术有限公司;细菌基因组DNA提取试剂盒、DL2000 DNA Marker,天根生化科技(北京)有限公司;对硝基苯酚磷酸二钠(p-NPP)、对硝基苯酚(p-NP)、预染低分子量蛋白Marker、DEAE-52离子交换纤维素、Sephadex G-200葡聚糖凝胶,北京索莱宝科技有限公司。电热恒温培养箱,上海一恒科学仪器有限公司;YC-1数控层析冷柜,上海青浦沪西仪器厂。
2 方法 2.1 产碱性磷酸酶乳杆菌的筛选 2.1.1 产酶菌株的初筛采用稀释平板法分离乳酸菌,吸取1 mL酸马奶样品,用0.9% (质量比)灭菌后的生理盐水对样品梯度稀释,选用10-4、10-5、10-6这3个稀释度下的样品,分别涂布于MRS-CaCO3培养基平板上,37 ℃培养24-48 h,观察并记录菌落特征,挑取具有乳酸菌典型特征并伴有溶钙圈的菌落反复划线纯化,直至出现单个纯菌落。选取革兰氏染色为阳性、过氧化氢酶试验为阴性的菌株保藏备用。将纯化保藏后的单菌重新活化后于MRS固体培养基中划线培养,将浸有底物溶液(2 mg/mL p-NPP、1 mol/L pH 8.5的Tris-HCl溶液)的滤纸片贴于菌落上,置于37 ℃培养箱中3 min,挑选能让滤纸变黄的菌株用于复筛。
2.1.2 产酶菌株的复筛将初筛后的菌株接于MRS液体培养基中,37 ℃静置培养24 h,重复培养3代,4 ℃、12 000 r/min离心10 min后取上清液,测定胞外酶活。
将菌体沉淀用pH 10.5的10 mmol/L碳酸缓冲液洗涤3次,制成细胞悬液,冰浴条件下500 W超声破碎15 min (工作10 s,停止15 s),4 ℃、12 000 r/min离心10 min后取上清液测定胞内酶活,比较两种提取方法下菌株胞内和胞外酶活力大小,确定粗酶液提取方式后,选取酶活力最高的菌株作为供试菌株。
2.1.3 酶活力及酶蛋白含量的测定对硝基苯酚法制作酶活测定标准曲线[20],体系中含1 mL 10 mmol/L碳酸缓冲溶液(pH 10.5)、1 mL 5 mmol/L p-NPP (用含1 mmol/L MgCl2的碳酸缓冲溶液配制)、1 mL酶液、2 mL蒸馏水,混匀后于37 ℃下反应60 min,后加入3 mL 0.1 mol/L的NaOH (含5 mmol/L EDTA)终止反应。酶活力单位(U)定义为:37 ℃下每分钟水解底物p-NPP生成1 μmol p-NP所需的量为1个酶活力单位。
考马斯亮蓝法[21]制作酶蛋白含量测定标准曲线,以牛血清蛋白为对照,测定样品中酶蛋白含量。
2.2 菌株鉴定 2.2.1 形态学及生理生化鉴定观察目的菌株在MRS固体培养基上的生长状况和菌落形态,挑取单菌落进行革兰氏染色并镜检,根据乳酸菌生化鉴定条的使用说明书对实验菌株进行鉴定。鉴定结果参照《常见细菌系统鉴定手册》[22]及《伯杰细菌鉴定手册》[23]。
2.2.2 分子生物学鉴定按照DNA提取试剂盒中的步骤对菌株的基因组DNA进行提取,以乳酸菌通用引物27f (5′-AGA GTTTGATCCTGGCTCAG-3′)和1492r (5′-GGTTAC CTTGTTACGACTT-3′)为模板进行PCR扩增,PCR反应体系(50 μL):模板DNA 2 μL,上、下游引物(10 μmol/L)各2 μL,2×EasyTaq SuperMix 25 μL,ddH2O补足至50 μL。PCR反应条件:97 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,共30个循环;72 ℃ 10 min。
用1%琼脂糖凝胶电泳对PCR扩增产物进行检测后,送至生工生物工程(上海)股份有限公司测序,将所得序列在NCBI上进行BLAST分析比对,利用MEGA 5.0构建系统发育树[24]。
2.3 酶的分离纯化 2.3.1 硫酸铵分级沉淀将提取出的粗酶液采用硫酸铵分级沉淀的方法,4 ℃静置2 h,10 000 r/min离心20 min后,收集60%饱和度下的沉淀,并将活性沉淀物用尽可能少的浓度为50 mmol/L的Tris-HCl (pH 7.5)缓冲液溶解,于4 ℃下置于相同缓冲液中透析过夜,经Ba2+检测至透析液中无白色沉淀后,冷冻干燥,于-20 ℃保存备用。
2.3.2 DEAE-52离子交换层析取0.2 g冻干后的酶粉复溶于5 mL缓冲液中,充分溶解后用0.45 μm的滤膜过滤,上样于事先用缓冲液平衡好的DEAE-52离子交换层析柱(2.6×30 cm),用含0-1 mol/L NaCl的Tris-HCl缓冲液进行连续梯度洗脱,流速为0.5 mL/min,每管5 mL将洗脱液全部回收,测定各管的酶活力和蛋白含量,合并酶活力高的管数,4 ℃下透析除盐并冷冻干燥后,于-20 ℃保存备用。
2.3.3 Sephadex G-200凝胶过滤层析照2.3.2中的方法,将样品上样于Sephadex G-200凝胶过滤层析柱(1.6×60 cm),用含0.1 mol/L NaCl的Tris-HCl缓冲液洗脱该柱,流速为0.2 mL/min,每管收集3 mL,合并酶活力高的管数,透析除盐并冷冻干燥后,于-20 ℃保存备用。
2.3.4 酶的纯度鉴定及相对分子量测定采用SDS-PAGE电泳对纯化后的酶进行纯度鉴定,将已知分子量的标准蛋白的迁移率对分子量的对数作图得标准曲线,纯化产物在相同条件下电泳,根据其相对迁移率在标准曲线上求得分子量。
2.4 酶学性质的研究 2.4.1 ALP的适宜作用条件依照2.1.3中ALP酶活力测定的方法,设定一系列温度(27、32、37、42、47、52、57、62、67 ℃),其他条件均保持不变,测定不同温度下酶的相对活力,以酶活力最高值为100%。
将ALP分别置于50 mmol/L不同pH值(pH 7.0、7.5、8.0、8.5)的Tris-HCl缓冲液和10 mmol/L不同pH值(pH 9.0、9.5、10.0、10.5、11.0)的碳酸缓冲液中,其他条件均保持不变,测定不同pH值下酶的相对活力,以酶活力最高值为100%。
2.4.2 ALP的稳定性将酶液置于不同温度下保温1 h,取出后迅速冷却至室温,以不保温时的酶活力为100%,计算不同温度下酶的相对活力,以此确定该酶的热稳定性。
将酶液置于不同pH值下,于4 ℃放置1 h,以酶活力最高值为100%,计算不同pH值下酶的相对活力,以此确定该酶的pH稳定性。
2.4.3 金属离子和EDTA对ALP的影响向酶反应体系中加入不同浓度(1.0、2.0、3.0、4.0、5.0 mmol/L)的6种金属离子和EDTA与酶液等体积混合,测定酶活力,以不加入金属离子和EDTA时的酶活力为100%,计算在不同条件下酶的相对活力。
2.4.4 米氏常数Km和最大反应速率Vmax的测定配制不同浓度(3.33、1.67、1.11、0.83、0.67、0.56 mmol/L)的p-NPP,在37 ℃、pH 9.5的条件下测定不同浓度下的酶促反应速度,采用Lineweaver-Burk双倒数作图法,分别以p-NPP和速度的倒数为横、纵坐标,计算出ALP的米氏常数Km值和最大反应速率Vmax。
3 结果与分析 3.1 产碱性磷酸酶乳酸杆菌的筛选 3.1.1 产酶菌株的初筛通过平板涂布法和革兰氏染色、过氧化氢酶试验,对样品中分离得到的菌株进行筛选,共计78株乳酸菌。在MRS固体培养基中,将浸有底物溶液的滤纸片分别置于这78株乳酸菌上,根据显色是否明显对菌株的产酶能力进行初步判定,共筛选出16株产酶菌株,其中B4、H2、Q7、R5、T22、Z23显色明显,结果见表 1。
| Strains number | Result |
| B4 | +++ |
| B12 | ++ |
| D3 | + |
| E8 | + |
| H2 | +++ |
| H15 | ++ |
| J20 | ++ |
| P9 | + |
| P17 | + |
| Q7 | +++ |
| R5 | +++ |
| R14 | + |
| T22 | +++ |
| W19 | ++ |
| Z5 | ++ |
| Z23 | +++ |
| 注:+++:黄色极为明显;++:黄色较为明显;+:稍有黄色,但不明显. Note: +++: Yellow is very obvious; ++: Yellow is more obvious; +: Slightly yellow, but not obvious. |
|
通过对菌株B4、H2、Q7、R5、T22、Z23进行酶活测定,结果见图 1,各菌株胞内酶活均大于胞外酶活,其中菌株Z23胞内酶活最高,为2.35 U/mL,因此选取菌株Z23为本次实验的供试菌株,用于后续研究。

|
| 图 1 产酶菌株的复筛 Figure 1 Complex sieve of enzyme-producing strain |
|
|
菌株Z23在MRS固体培养基上生长良好,菌落直径1-2 mm,菌落呈圆形,颜色为乳白色,表面光滑不透明(图 2),革兰氏染色呈紫色,为革兰氏阳性菌,镜检为长杆或短杆状的规则杆菌(图 3),因此可初步鉴定为乳杆菌。

|
| 图 2 菌株Z23菌落形态 Figure 2 Colony morphology of strain Z23 |
|
|

|
| 图 3 菌株Z23革兰氏染色镜检结果(100×) Figure 3 Gram staining microscopy results of strain Z23 (100×) |
|
|
菌株Z23经乳酸菌生化鉴定条等生理生化鉴定实验,结果如表 2所示,参照《伯杰细菌鉴定手册》[23]中对乳杆菌的鉴定结果,初步鉴定为鼠李糖乳杆菌。
| Biochemical reaction | Results |
| Aesculin | + |
| Maltose | + |
| Salicin | + |
| Sucrose | + |
| Inulin | + |
| Raffinose | - |
| Cellobiose | + |
| Mannitol | + |
| Sorbitol | + |
| Starch hydrolysis test | - |
| Catalase test | - |
| Arginine ammonia production test | - |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. |
|
通过菌株Z23的16S rRNA基因序列分析得知序列长度为1 473 bp,经PCR扩增后,在1 500 bp左右出现特异性条带,这与电泳结果相一致。
利用MEGA 5.0构建系统发育树,如图 4所示,菌株Z23与Lactobacillus rhamnosus ATCC7469聚类,亲缘关系最近,相似性达100%,结合菌株形态学及生理生化特征,将菌株Z23鉴定为鼠李糖乳杆菌。

|
| 图 4 菌株Z23基于16S rRNA基因序列的系统发育树 Figure 4 The phylogenetic tree of strain Z23 based on 16S rRNA gene sequence 注:分支上的数字表示构建系统发育树时1 000次计算形成该节点的百分比;分支的长度代表进化距离,系数为0.01;括号内的序号为已知菌株的GenBank登录号. Note: Numbers at the branch nodes are bootstrap values, expressed as percentages of 1 000 replicates; The length of branch represents the evolutionary distance and the coefficient is 0.01; The number in parentheses is the GenBank accession number of a known strain. |
|
|
乳杆菌ALP粗酶液经DEAE-52离子交换层析纯化后,结果如图 5所示,通过含0-1 mol/L NaCl的Tris-HCl缓冲液梯度洗脱后,得到一个活力峰,集中在23-27管区域,且在280 nm下测得较高的光密度值,因此将该活力峰下的酶液收集于同一管中,冻干浓缩后备用。
|
| 图 5 DEAE-52离子交换层析 Figure 5 DEAE-52 ion-exchange chromatography |
|
|
将上述DEAE-52纯化冻干后的样品溶解,上样于Sephadex G-200凝胶层析柱,经0.1 mol/L NaCl的Tris-HCl缓冲液洗脱后,测定其酶活和280 nm下的蛋白含量,如图 6所示,出现一个活力峰,集中在9-12管区域,因此将该活力峰下的酶液收集于同一管中,冻干浓缩后备用。

|
| 图 6 Sephadex G-200凝胶过滤层析 Figure 6 Sephadex G-200 chromatography |
|
|
将菌株超声破碎后,提取出的粗酶液经硫酸铵分级沉淀、DEAE-52离子交换层析、Sephadex G-200凝胶过滤层析纯化后,结果如表 3所示,最终得到的乳杆菌ALP纯化产物比活力为180.27 U/mg,纯化倍数为48.37,酶活回收率为17.05%。
| Purification steps | Total protein (mg) | Total activity (U) | Specific activity (U/mg) | Purification (fold) | Recovery (%) |
| Crude extract | 998.40 | 3 721.42 | 3.73 | 1 | 100.00 |
| (NH4)2SO4 precipitation | 338.06 | 2 454.84 | 7.26 | 1.95 | 65.97 |
| DEAE-52 | 32.04 | 1 036.25 | 34.60 | 9.28 | 29.76 |
| Sephadex G-200 | 3.52 | 634.56 | 180.27 | 48.37 | 17.05 |
纯化后的ALP经SDS-PAGE检测显示为单一条带,结果如图 7所示,表明纯化后的ALP达到了电泳纯,蛋白标准曲线y=-1.577 1x+2.582 5 (R2=0.977 6),可得出ALP的亚基相对分子质量为46.7 kD。

|
| 图 7 ALP的SDS-PAGE电泳图 Figure 7 SDS-PAGE electrophoresis of ALP 注:M:蛋白质Marker;1:Sephadex G-200层析后的酶液. Note: M: Protein Marker; 1: The enzyme liquid after Sephadex G-200 chromatography. |
|
|
由图 8A可知,在温度为37 ℃时,酶活力数值最大;在温度为32-47 ℃时,酶的相对活力可达80%以上;当温度超过47 ℃时,酶相对活力急剧下降;当温度超过62 ℃,酶相对活力仅有30%左右。因此,ALP的最适作用温度在32-47 ℃之间,其中37 ℃为最佳作用温度。

|
| 图 8 ALP的最适温度及pH Figure 8 Optimum temperature and pH of ALP |
|
|
由图 8B可知,在pH 7.0-9.5之间,酶的相对活力逐渐增大;当pH为9.5时,酶活力数值最大,且当pH在9.0-10.0之间时,酶的相对活力可达90%以上。因此,ALP的最适作用pH在9.0-10.0之间,其中pH 9.5为最佳作用pH。
3.5.2 ALP的热稳定性及pH稳定性经不同温度保温后的酶液,结果如图 9A所示,以4 ℃下保存的酶活力最高值为100%,其余条件下测得的酶活力换算成酶相对活力。随着温度升高,酶相对活力逐渐降低;当温度超过47 ℃时,酶相对活力急剧下降;当温度超过62 ℃时,酶相对活力小于20%,且逐渐趋于平稳,由此可见酶在低温情况下有较好的稳定性,高温条件下稳定性差且易失活。

|
| 图 9 温度及pH对ALP稳定性的影响 Figure 9 Effects of temperature and pH on ALP stability |
|
|
经不同pH放置后的酶液,结果如图 9B所示,在pH为7.0-11.0之间时,酶相对活力呈现先增大后减小的趋势,当pH为9.5时,酶活力数值最大,酶活最为稳定,且pH在9.0-10.0之间时,酶的相对活力均在95%以上,因此,ALP的稳定性在pH 9.0-10.0之间,其中pH为9.5时稳定性最佳。
3.5.3 金属离子和EDTA对ALP的影响向体系中加入不同浓度的金属离子和EDTA,结果如表 4所示,随着浓度的增大,Mg2+和K+对ALP有明显的激活作用,Ba2+和Cu2+在低浓度时对ALP有激活作用,当浓度超过3 mmol/L时有抑制作用,Ca2+、Zn2+和EDTA对ALP有明显的抑制作用,其中EDTA对ALP的抑制作用最为明显。
| Metal ion and EDTA | Concentration(mmol/L) | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Mg2+ | 148.03±0.002 | 154.21±0.023 | 162.50±0.004 | 170.22±0.012 | 176.03±0.005 |
| K+ | 135.96±0.004 | 137.5±0.005 | 142.84±0.002 | 144.26±0.016 | 154.49±0.013 |
| Ba2+ | 121.21±0.005 | 111.38±0.002 | 106.43±0.011 | 99.96±0.003 | 90.28±0.004 |
| Cu2+ | 121.40±0.022 | 118.65±0.034 | 102.53±0.007 | 83.29±0.059 | 72.75±0.006 |
| Ca2+ | 76.97±0.018 | 60.91±0.024 | 57.22±0.005 | 55.06±0.021 | 50.14±0.003 |
| Zn2+ | 38.20±0.001 | 31.32±0.012 | 30.90±0.004 | 29.07±0.015 | 27.93±0.028 |
| EDTA | 35.57±0.006 | 21.49±0.011 | 16.67±0.008 | 11.25±0.014 | 6.49±0.055 |
以不同浓度的p-NPP为底物,与ALP反应的Lineweaver-Burk双倒数曲线结果见图 10,拟合曲线的线性回归方程为y=2.763 4x+0.808 9 (R2=0.996 2),其中-1/Km为横轴截距,1/Vmax为纵轴截距,计算得Km值为3.42 mmol/L,Vmax值为1.24 mmol/(Lmin)。
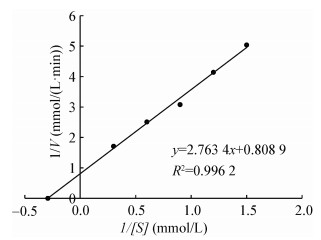
|
| 图 10 ALP的Lineweaver-Burk双倒数曲线图 Figure 10 Lineweaver-Burk double reciprocal graph of ALP |
|
|
本文以蒙古国酸马奶样品中筛选的78株乳酸菌为研究对象,以对硝基苯酚磷酸二钠为底物的平板筛选法筛选出6株产ALP活力较强的乳酸菌,通过测定酶活力大小对菌株复筛,最终得到一株酶活力最高(2.35 U/mL)的菌株Z23。通过菌株形态观察、生理生化鉴定及16S rRNA基因序列比对分析,最终将其鉴定为鼠李糖乳杆菌,大于已报道文献中鼠李糖乳杆菌ALP的酶活。王政[25]对接种5种乳酸菌的脱脂乳中磷酸酶活性大小测定表明,活性最高的为保加利亚乳杆菌、嗜热链球菌及鼠李糖乳杆菌,依次为0.081、0.0150、0.097 U/mL。高俊乾等[26]利用选择性平板初筛和酶活测定复筛,从土壤中筛选到一株高产ALP的菌株S377,利用传统鉴定方法最终鉴定为醋杆菌奥尔兰亚种(A. orleanensis)。Zhou等[27]利用有机磷培养基,结合平板计数法和活性鉴定法,筛选出6株产ALP的细菌,并研究了ALP与太湖沉积物中丰度的关系。因此,利用传统鉴定方法,将细菌选择性分离培养与活性测定相结合的方法,有利于人们对环境中产ALP细菌种类及功能特性的认识。
针对不同物种的特定组织部位,提取和纯化ALP的方法也有所差异。据研究报道,Asencio等[28]利用Triton X-114溶解细胞组分,进而释放螺旋藻膜中的ALP,并可除去粗提物中的色素。李红卫等[29]利用正丁醇抽提、硫酸铵沉淀、DEAE-52离子交换柱层析、Sephacryl S-200凝胶过滤层析法,从猪肌肉组织中提取并纯化ALP,最终纯化倍数可达57.34。本实验经一系列纯化过程后,成功分离纯化ALP,比活力为180.27 U/mg,纯化倍数为48.37,酶活回收率为17.05%。本研究在实验操作中将以往纯化过程中超滤浓缩步骤去掉,采用真空冷冻干燥后的酶粉上样纯化,有效减少了酶活损失,但在操作过程中由于温度控制较为严格,纯化收集时为保证纯度,只收集了活力峰的部分,因而仍有一部分酶活损失,纯化后的酶经SDS-PAGE电泳检测为单一条带,亚基相对分子质量为46.7 kD。舒彦芳等[30]从嗜盐古菌中纯化的ALP分子量大小为45 kD,与本文分析结果较为一致,但低于节肢动物[31]、昆虫[32]以及哺乳动物中的ALP[14, 29]。因此通过与实验数据对比,细菌中ALP的分子量低于动物中ALP的分子量。
由于生物体进化和基因选择性表达,不同来源的ALP在酶学性质上有着很大差异。本文实验结果表明,ALP的最适温度为37 ℃,在低温下稳定性高,随着温度升高,酶的相对活力逐渐降低,最适pH值为9.5,在pH值为9.0-10.0之间时,酶的相对活力可达90%以上,其原因可能是高温条件和过酸或过碱的条件均会使酶的构象发现变化,导致酶本身变性,影响酶与底物的结合能力,从而丧失催化功能[33]。ALP为金属酶,金属离子对维持其分子构相和活性有着密切关系,本实验研究表明Mg2+和K+对ALP有明显激活作用,Ba2+和Cu2+在低浓度时对ALP有激活作用,当浓度超过3 mmol/L时有抑制作用,此外Ca2+、Zn2+和EDTA对ALP均有强烈的抑制作用,这与Chu等[34]研究结果不同。此外,在酶促反应过程中,Km值作为酶的特征性物理量,值大小与酶的性质有关,Km值越小,底物与酶的亲和力越大,以不同浓度的p-NPP为底物,测得酶的Km值为3.42 mmol/L,Vmax值为1.24 mmol/(Lmin),说明底物与ALP有较强的亲和力。
5 结论酶可以调节代谢、控制生物体内各项生理活动,细菌的新陈代谢也在酶的催化作用下进行。本实验从蒙古国酸马奶样品中分离筛选出一株产碱性磷酸的乳杆菌,经生理生化鉴定及分子生物学鉴定为鼠李糖乳杆菌,酶活力达2.35 U/mL。通过硫酸铵分级沉淀、DEAE-52离子交换层析、Sephadex G-200凝胶过滤层析,从中成功分离纯化ALP,比活力为180.27 U/mg,纯化倍数为48.37,酶活回收率为17.05%,SDS-PAGE电泳检测为单一条带,其亚基相对分子质量为46.7 kD。该酶的最适温度为37 ℃,最适pH为9.5,在低温情况下和pH 9.0-10.0之间稳定性高。Mg2+和K+对ALP有明显激活作用,Ba2+和Cu2+在低浓度时对ALP有激活作用,高浓度时有抑制作用,Ca2+、Zn2+和EDTA对ALP有强烈的抑制作用,以不同浓度的p-NPP为底物,测得酶的Km值为3.42 mmol/L,Vmax值为1.24 mmol/(Lmin)。本实验结果为蒙古国酸马奶中益生菌的开发利用提供了新的微生物资源,同时也为今后碱性磷酸酶的工业化生产提供了切实可行的理论依据。
| [1] |
Liu Y, Tan YF, Li H. Screening, cloning and enzymatic characterization of phosphohydrolase from soil[J]. Journal of Henan Agricultural Sciences, 2014, 43(3): 70-74. (in Chinese) 刘悦, 覃炎峰, 李荷. 土壤磷酸酯酶基因的筛选、克隆及酶学性质分析[J]. 河南农业科学, 2014, 43(3): 70-74. |
| [2] |
Simopoulos TT, Jencks WP. Alkaline phosphatase is an almost perfect enzyme[J]. Biochemistry, 1994, 33(34): 10375-10380. |
| [3] |
Moss AK, Hamarneh SR, Mohamed MMR, et al. Intestinal alkaline phosphatase inhibits the proinflammatory nucleotide uridine diphosphate[J]. American Journal of Physiology- Gastrointestinal and Liver Physiology, 2013, 304(6): G597-G604. |
| [4] |
Mukaiyama K, Kamimura M, Uchiyama S, et al. Elevation of serum alkaline phosphatase (ALP) level in postmenopausal women is caused by high bone turnover[J]. Aging Clinical and Experimental Research, 2015, 27(4): 413-418. |
| [5] |
Ooi K, Shiraki K, Morishita Y, et al. High-molecular intestinal alkaline phosphatase in chronic liver diseases[J]. Journal of Clinical Laboratory Analysis, 2007, 21(3): 133-139. |
| [6] |
Sardiwal S, Magnusson P, Goldsmith DJA, et al. Bone alkaline phosphatase in CKD-mineral bone disorder[J]. American Journal of Kidney Diseases, 2013, 62(4): 810-822. |
| [7] |
Shi Y, Yang M, Liu L, et al. GTP as a peroxidase-mimic to mediate enzymatic cascade reaction for alkaline phosphatase detection and alkaline phosphatase-linked immunoassay[J]. Sensors and Actuators B: Chemical, 2018, 275: 43-49. |
| [8] |
Ma CB. Highly sensitive detection of alkaline phosphatase using molecular beacon probes based on enzymatic polymerization[J]. Molecular and Cellular Probes, 2012, 26(3): 113-115. |
| [9] |
Ram B, Fartyal D, Sheri V, et al. Characterization of phoA, a bacterial alkaline phosphatase for phi use efficiency in rice plant[J]. Frontiers in Plant Science, 2019, 10: 37. |
| [10] |
Zhang H. Evaluation and application of methods in detecting the activity of alkaline phosphatase and lactoperoxidase in dairy products[D]. Lanzhou: Master's Thesis of Lanzhou University, 2019 (in Chinese) 张昊.乳及乳制品中碱性磷酸酶和乳过氧化物酶活性检测方法的评估及应用[D].兰州: 兰州大学硕士学位论文, 2019 |
| [11] |
Kim EE, Wyckoff HW. Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis[J]. Journal of Molecular Biology, 1994, 218(2): 449-464. |
| [12] |
Gao MC, Li XM, Zhang RX, et al. Study on prokaryotic expression, purification and enzymatic activity of alkaline phosphatase from Escherichia coli ATCC 25922[J]. Journal of Northeast Agricultural University, 2010, 41(8): 48-53. (in Chinese) 高明春, 李雪萌, 张润祥, 等. 大肠杆菌菌株ATCC 25922碱性磷酸酶的原核表达、纯化及其活性研究[J]. 东北农业大学学报, 2010, 41(8): 48-53. |
| [13] |
Chen JB, Liu WC. Isolation and characterization of alkaline phosphatase from liver of muscovite duck[J]. Fujian Journal of Animal Husbandry and Veterinary Medicine, 2013, 35(3): 15-17. (in Chinese) 陈建斌, 刘伟昌. 番鸭肝脏碱性磷酸酶的分离及部分性质研究[J]. 福建畜牧兽医, 2013, 35(3): 15-17. |
| [14] |
Ma JH, Xue FL, Wang YF, et al. Purification and some characterization of phosphatase from grass carp (Ctenopharyngodon idellus)[J]. Fisheries Science, 2014, 33(8): 498-502. (in Chinese) 马金虎, 薛福来, 王一帆, 等. 草鱼肝胰脏碱性磷酸酶的分离纯化及性质的研究[J]. 水产科学, 2014, 33(8): 498-502. |
| [15] |
Sui JQ. Purification and characterization of alkaline phosphatase from Ruditapes philippinarum[D]. Qingdao: Master's Thesis of Ocean University of China, 2012 (in Chinese) 随建强.菲律宾蛤仔碱性磷酸酶的分离纯化和性质研究[D].青岛: 中国海洋大学硕士学位论文, 2012 |
| [16] |
Wu CJ, Dai CW, Li S, et al. Isolation and identification of a bacteriocin-producing lactic acid bacterium from Anhui local pickled vegetable[J]. China Food Additives, 2019, 30(7): 112-120. (in Chinese) 武昌俊, 戴陈伟, 李舜, 等. 一株安徽本地泡菜中产细菌素乳酸菌的筛选与鉴定[J]. 中国食品添加剂, 2019, 30(7): 112-120. |
| [17] |
Ghosh T, Beniwal A, Semwal A, et al. Mechanistic insights into probiotic properties of lactic acid bacteria associated with ethnic fermented dairy products[J]. Frontiers in Microbiology, 2019, 10: 502. |
| [18] |
Liu L, Li PL. Complete genome sequence of Lactobacillus paraplantarum L-ZS9, a probiotic starter producing class Ⅱ bacteriocins[J]. Journal of Biotechnology, 2016, 222: 15-16. |
| [19] |
Widyastuti Y, Rohmatussolihat, Febrisiantosa A. The role of lactic acid bacteria in milk fermentation[J]. Food and Nutrition Sciences, 2014, 5(4): 42817. |
| [20] |
Zhou XW. A study on microbial degradation of organophosphorus pesticides in some fermented foods[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2014 (in Chinese) 周欣伟.发酵食品中有机磷农药的微生物降解作用的研究[D].哈尔滨: 东北农业大学硕士学位论文, 2014 |
| [21] |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [22] |
Dong XZ, Cai MY. Mannual of Determinate Bacteriology[M]. Beijing: Science Press, 2001: 370-410. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 370-410. |
| [23] |
Buchanan RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984: 797-823 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所, 译. 8版.北京: 科学出版社, 1984: 797-823 |
| [24] |
Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. |
| [25] |
Wang Z. Microbial degradation of organophosphorus pesticides in fermented foods[D]. Wuhan: Master's Thesis of Hubei University of Technology, 2017 (in Chinese) 王政.发酵食品中有机磷农药的微生物降解研究[D].武汉: 湖北工业大学硕士学位论文, 2017 |
| [26] |
Gao JQ, Huang JY, Zhang JQ, et al. Isolation and identification of a high-yield Alkaline phosphatase strain and its optimization of medium formula[J]. Science and Technology of Food Industry, 2018, 39(12): 124-131. (in Chinese) 高俊乾, 黄俊元, 张君奇, 等. 一株高产碱性磷酸酶菌株的分离鉴定及其培养基配方优化[J]. 食品工业科技, 2018, 39(12): 124-131. |
| [27] |
Zhou C, Song CL, Huang DZ, et al. Isolation and characterization of organic phosphorus-mineralizing bacteria in sediment of a Chinese large shallow eutrophic lake (Lake Taihu)[J]. Geomicrobiology Journal, 2011, 28(8): 660-666. |
| [28] |
Asencio AD, Morte A, García-Carmona F, et al. Partial purification and characterization of a calcium-dependent alkaline phosphatase from the cyanobacterium Arthrospira platensis[J]. Journal of Phycology, 2012, 48(2): 347-354. |
| [29] |
Li HW, Wang KP, Wu Y, et al. Purification and properties of alkaline phosphatase from pig muscle tissue[J]. Journal of Hefei University of Technology (Natural Science), 2016, 39(4): 560-565. (in Chinese) 李红卫, 王开萍, 吴娱, 等. 猪肌肉组织中碱性磷酸酶的纯化及特性研究[J]. 合肥工业大学学报:自然科学版, 2016, 39(4): 560-565. |
| [30] |
Shu YF, Ma XH, Du SY, et al. Isolation, identification of a alkaline phosphatase-producing Archaea[J]. Journal of Anhui Agricultural Sciences, 2015, 43(12): 6-9. (in Chinese) 舒彦芳, 马小花, 杜诗熠, 等. 一株产碱性磷酸酶菌株的鉴定及酶的纯化[J]. 安徽农业科学, 2015, 43(12): 6-9. |
| [31] |
Homaei A. Purification and biochemical properties of highly efficient alkaline phosphatase from Fenneropenaeus merguiensis brain[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 118: 16-22. |
| [32] |
Da Silva G, Ramos LFC, dos Santos Seckler H, et al. Biochemical characterization of digestive membrane- associated alkaline phosphatase from the velvet bean caterpillar Anticarsia gemmatalis[J]. Archives of Insect Biochemistry and Physiology, 2019, 102(1): e21591. |
| [33] |
Han W, Xu XQ, Ye XY, et al. Purification and characterization of the alginate lyase isolated from marine[J]. Journal of Fuzhou University (Natural Science Edition), 2018, 46(1): 136-142. (in Chinese) 韩伟, 许鑫琦, 叶秀云, 等. 海洋来源褐藻胶裂解酶分离纯化及酶学性质研究[J]. 福州大学学报:自然科学版, 2018, 46(1): 136-142. |
| [34] |
Chu YH, Yu XX, Jin X, et al. Purification and characterization of alkaline phosphatase from lactic acid bacteria[J]. RSC Advances, 2019, 9(1): 354-360. |
 2020, Vol. 47
2020, Vol. 47