扩展功能
文章信息
- 武怡荷, 胡会玲, 陈书明, 张希春
- WU Yi-He, HU Hui-Ling, CHEN Shu-Ming, ZHANG Xi-Chun
- 四株儿茶酚类铁载体高产菌株产消化酶活性及其益生特性
- Digestive enzymes and probiotic properties of four bacteria with high yield catechol siderophore
- 微生物学通报, 2020, 47(6): 1807-1816
- Microbiology China, 2020, 47(6): 1807-1816
- DOI: 10.13344/j.microbiol.china.190720
-
文章历史
- 收稿日期: 2019-09-03
- 接受日期: 2020-01-13
- 网络首发日期: 2020-02-22
2. 山西中医药大学中药与食品工程学院 山西 晋中 030619
2. Institute of Pharmaceutical and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong, Shanxi 030619, China
儿茶酚类铁载体是由微生物分泌的一类低分子量高效铁螯合剂,其产生菌在胃肠道低铁(10-18-10-24 mol/L)环境中分布广泛[1]。儿茶酚类铁载体能够竞争性抑制机体胃肠道中含有类似铁元素吸收系统的致病菌,而且能为胃肠道中无法自身合成铁载体的益生菌提供铁元素而促进其生长,对胃肠道微生物的铁营养平衡及其生长代谢具有重要作用[2]。
胃肠道微生物是一个复杂且动态变化的群落,具有许多人体自身所不具备的代谢功能,能调控胃肠道微生物菌群平衡,对人体的营养与健康产生直接或间接的影响,且能在胃肠道中定殖并发挥相应的功能活性,是挖掘潜在益生菌的理想来源[3-5]。
实验室前期从一健康成人粪样中分离纯化、筛选鉴定得到8株人胃肠道源产儿茶酚类铁载体易培养微生物[6],本研究通过对其中4株儿茶酚类铁载体高产菌株的产酶活性及益生特性进行研究,以期为儿茶酚类铁载体及其高产菌株在食品、医药和工农业生产等领域的应用提供理论依据,对儿茶酚类铁载体及其产生菌的应用和胃肠道营养与健康的研究具有促进意义。
1 材料与方法 1.1 材料儿茶酚类铁载体高产菌株E. coli Gut 07、E. coli Gut 12、B. cereus Gut 16、E. coli Gut 20 (利用Rioux法定量测定儿茶酚类铁载体产量依次为:66.48±0.10、58.89±0.48、94.75±0.40、49.45±0.10 μmol/L;GenBank中的16S rRNA基因序列登录号依次为KU156684、KU156685、KU156688和KU156689),均由实验室从健康成人粪样中分离纯化得到[6]。
Ⅱ型胃粘蛋白,南京奥多福尼生物科技有限公司。分光光度计,尤尼柯仪器有限公司;恒温培养箱、全温振荡摇床,上海精宏仪器有限公司;酶标仪,BioTek公司。
MRS液体培养基参考文献[7],人工胃液(含胃蛋白酶0.3%,pH 2.0)、肠液(含胆盐0.3%,胰酶0.1%,pH 7.5)参考文献[8],蛋白酶、脂肪酶、淀粉酶、纤维素酶、植酸酶、乳糖酶、β-葡萄糖苷酶发酵培养基参考文献[9-14]。营养肉汤培养基(g/L):蛋白胨10.0,牛肉粉3.0,NaCl 5.0,pH 7.0。
1.2 4株高产菌株的产消化酶活性分析 1.2.1 粗酶液制备将4株儿茶酚类铁载体高产菌株分别接种于MRS液体培养基,37 ℃、150 r/min振荡培养18 h,取2 mL菌液分别接种于100 mL的蛋白酶、淀粉酶、脂肪酶、纤维素酶、植酸酶、乳糖酶、β-葡萄糖苷酶发酵培养基中,37 ℃、150 r/min振荡培养3 d,取2 mL发酵液于干净离心管中,12 000 r/min离心15 min,取其上清液即为相应的粗酶液。
1.2.2 消化酶活性测定(1) 蛋白酶活性测定
采用福林酚法测定4株菌的蛋白酶活性[15]。蛋白酶比活力定义为:37 ℃条件下,1 mL蛋白酶粗酶液水解酪蛋白每分钟产生1 μg酪氨酸所需的酶量,即为1个蛋白酶活力单位(U/mL)。
(2) 淀粉酶活性测定
采用3, 5-二硝基水杨酸显色法测定4株菌的淀粉酶活性。淀粉酶比活力定义为:40 ℃条件下,1 mL淀粉酶粗酶液水解可溶性淀粉每分钟释放1 mg还原糖的酶量,即为1个酶活力单位(U/mL)。
(3) 脂肪酶活性测定
根据改良对硝基苯酚棕榈酸酯(p-NPP)法测定4株菌的脂肪酶活性[16]。脂肪酶活力单位定义为:40 ℃条件下,1 mL脂肪酶粗酶液每分钟还原1 μmol对硝基苯酚所需要的酶液,即为1个酶活力单位(U/mL)。
(4) 纤维素酶活性测定
纤维素酶有3种组分,其酶活难以直接测定,本研究采用羧甲基纤维素钠(CMC-Na)法测定纤维素酶中的内切葡聚糖酶活性。纤维素酶活力单位定义为:40 ℃条件下,1 mL纤维素酶粗酶液每分钟降解释放1 mg还原糖所需的酶量,即为1个酶活力单位(U/mL)。
(5) 植酸酶活性测定
根据钒-钼酸铵法测定4株菌的植酸酶活性[17]。植酸酶活性单位定义为:37 ℃、pH 5.5的条件下,1 mL植酸钠底物溶液中每分钟释放1 μmol无机磷所用酶量,即为1个植酸酶活力单位(U/mL)。
(6) 乳糖酶活性测定
利用邻硝基苯酚-β-D-半乳糖苷(ONPG)法测定4株菌的乳糖酶活性[18]。乳糖酶比活力定义为:37 ℃条件下,1 mL粗酶液每分钟水解1 μmol邻硝基苯酚的酶量,即为1个酶活力单位(U/mL)。
(7) β-葡萄糖苷酶活性测定
根据对硝基苯酚-β-D葡萄糖苷法测定4株菌的β-葡萄糖苷酶活性[19]。β-葡萄糖苷酶比活力定义为:45 ℃条件下,1 mL β-葡萄糖苷酶粗酶液每分钟催化生成1 μmol对硝基苯酚所需的酶量,即为1个β-葡萄糖苷酶活力单位(U/mL)。
1.2.3 酶活计算酶比活力(U/mL)=X×N/(V×t)。其中,X为根据标准曲线计算得到酶解产物含量;N为粗酶液稀释倍数;V为粗酶液的体积;t为酶解反应时间。
1.3 菌株的耐酸耐胆盐能力分析参照王芬等[20]的方法,利用人工模拟胃、肠液连续培养法研究4株菌的耐酸耐胆盐能力。将4株儿茶酚类铁载体高产菌株分别接种到10 mL液体MRS培养基中,37 ℃、180 r/min振荡培养15 h,用MRS平板涂布法测定活菌数(下同),记为N0。取1 mL菌液接种到9 mL模拟胃液培养基中,于37 ℃、180 r/min振荡培养,根据平板计数法分别计算胃部培养3、6 h的活菌数,记为Nt。取胃部培养6 h的菌液1 mL接种到9 mL模拟小肠液培养基中,于37 ℃、180 r/min振荡培养,分别在培养3、6、18、24 h时,根据平板计数法计算小肠部不同培养时间的活菌数,记为Nt。
菌株存活率(%)=Nt/N0×100。其中,N0为初始活菌数;Nt为不同培养基不同培养时间的活菌数。
1.4 菌株粘附能力的分析 1.4.1 自凝集能力参照Grigoryan等[21]的方法测定4株菌的自凝集率。取5 mL于37 ℃、180 r/min振荡培养过夜的菌液,5 000 r/min离心10 min收集菌体沉淀,用无菌PBS缓冲液(pH 7.4)洗涤菌体沉淀2次,调节菌悬液使其在600 nm处的吸光值为0.8-1.0,记为A0。取10 mL菌悬液于15 mL试管中,室温下分别静置1、4、20 h,测定上层溶液在600 nm处的吸光值,记为At。菌株自凝集率计算公式:
菌株自凝集率(%)=(A0-At)/A0×100
其中,A0为t=0时测得的吸光值;At为t=1、4、20 h时测得的吸光值。
1.4.2 黏蛋白粘附能力参照文献[22-23]的试验方法研究4株菌的粘附能力。Jonsson等[22]研究发现通过在细菌生长培养基中加入粘蛋白来部分模拟肠道环境,粘液蛋白的存在增加了细菌与粘液的结合活性。因此,试验时可将活化后的4株儿茶酚类铁载体高产菌株在添加有0.1%Ⅱ型胃粘蛋白的营养肉汤培养基中37 ℃培养24 h,以增强结合活性,用于后续粘附试验。向96孔板中添加150 μL的粘蛋白溶液(100 μg/L的粘蛋白溶于50 mmol/L Na2CO3,pH 9.7),4 ℃孵化16 h,加入PBST (1%吐温-20,pH 7.4)缓冲液静置1 h,用PBST (0.05%吐温-20;pH 7.4)缓冲液冲洗2次,调节菌悬液至A595为0.5±0.02,记为A0。向处理过的孔中添加100 μL菌悬液,并在室温下孵育1 h。取灭菌后的PBST洗涤微孔3–5次以除去未粘附的细菌,晾干后,用酶标仪测定A595值,记为A1。每组设置3个重复。
粘附率(%)=A1/A0×100。其中,A0为粘附前测得的吸光值;A1为粘附后测得的吸光值。
1.4.3 表面疏水性采用碳羟化合物法(MATH)测定4株高产菌株的表面疏水性[24]。取37 ℃、180 r/min下振荡培养24 h的菌液5 mL,5 000 r/min离心10 min后弃上清,用PBS缓冲液洗涤菌体沉淀2次,以PBS缓冲液为空白对照,调节菌悬液至A580为0.8±0.1,记为A0。取1 mL二甲苯、乙酸乙酯、三氯甲烷溶液,分别与3 mL菌悬液混合,涡旋2 min,室温静置30 min分层。取水相测定580 nm处吸光值,记录为A,以PBS缓冲液为空白对照。
细菌表面疏水率(CSH%)=(A0-A)/A0×100。其中,A0为有机试剂与菌液混合前的菌液吸光值;A为有机试剂与菌液混合后的水相吸光值。
1.5 4株菌株的安全性分析 1.5.1 抗生素耐受性使用抗生素纸片试剂盒研究4株菌的抗生素耐受性。所用抗生素:青霉素(10 IU),苯唑西林(1 μg),氨苄西林(10 μg),羧苄青霉素(100 μg),氯噻酮(100 μg),头孢氨苄(30 μg),头孢唑啉(30 μg),头孢拉定(30 μg),头孢呋辛(30 μg),头孢他啶(30 μg),头孢三嗪(30 μg),头孢哌酮(30 μg),阿米卡星(30 μg),庆大霉素(120 μg),卡那霉素(30 μg),新霉素(30 μg),四环素(30 μg),多西环素(30 μg),米诺环素(30 μg),红霉素(15 μg)。取30 μL菌液均匀涂布在MRS固体培养基上,将抗生素纸片贴在培养基表面,每种抗生素3个平行,空白培养基抗生素纸片作为阴性对照,37 ℃静置培养24 h,测量抑菌圈直径。
1.5.2 急性毒性试验按照GB15193.3-2003寇氏(Korbor)法研究4株菌对小鼠经口的急性毒性[25]。将52只SPF级ICR小鼠(雌:雄=1:1,体重20-25 g)随机分为13组,试验组分别用4株菌的4.5×1011、4.5×109、4.5×107 CFU/mL 3个剂量组进行灌胃,灌胃剂量为20 mL/kg,对照组小鼠灌胃等量的生理盐水,每天相同时间连续灌胃1周,观察并记录小鼠每天的生长情况、采食量、体重及精神状态。
阳性细菌移位试验。最后一次灌胃结束后对小鼠禁食18 h,将小鼠麻醉称重后在超净工作台中对小鼠心脏穿刺取血100 μL,与生理盐水等量混合为血液样品;解剖小鼠,吸取5 μL小鼠组织液用无菌生理盐水稀释40倍为组织液样品;摘取小鼠肠系膜上的淋巴结,置于200 μL无菌生理盐水中充分混匀为淋巴结样品。将小鼠的血液、组织液和淋巴结样品涂布于MRS固体培养基表面,37 ℃培养24 h,观察培养基表面有无儿茶酚类铁载体高产菌株菌落生成,若无菌落生长说明未发生阳性细菌移位,反之说明发生移位。
取出小鼠的心、肝、脾、肾,将表面处理干净后称重,计算脏器指数。
脏器指数=脏器重量/小鼠体重。
1.6 数据处理与分析用SPSS 19.0软件进行ANOVA单因素方差统计分析,并用Duncan检验法做差异显著性分析,数据分析结果以平均值±标准偏差(X±SD)表示,P<0.05表示差异显著。
2 结果与分析 2.1 消化酶活性4株菌均能分泌到胞外不同种类的测试消化酶,这也说明胃肠道微生物产消化酶活性的互补性和组学特征。结果如表 1所示,B. cereus Gut 16除了能分泌4株菌均产生的淀粉酶、纤维素酶、植酸酶和β-葡萄糖苷酶外,还能分泌蛋白酶和脂肪酶,且淀粉酶和纤维素酶酶活显著高于其他菌株(P<0.05);E. coli Gut 20则能分泌脂肪酶和乳糖酶,且脂肪酶活性显著高于另一株具有脂肪酶活性的B. cereus Gut 16 (P<0.05),乳糖酶活性显著高于另两株具乳糖酶活性的E. coli Gut 07和E. coli Gut 12 (P<0.05);E. coli Gut 07和E. coli Gut 12分泌相同种类的消化酶,但不同的消化酶酶活性有显著差异(P<0.05)。
| 菌株 Strains |
蛋白酶 Protease |
淀粉酶 Amylase |
脂肪酶 Lipase |
纤维素酶 Cellulase |
植酸酶 Phytase |
乳糖酶 Lactase |
β-葡萄糖苷酶 β-Glucosidase |
| E.coli Gut 07 | - | 1.19±0.06b | - | 0.95±0.06c | 5.64±0.28a | 0.50±0.03b | 1.20±0.02c |
| E.coli Gut 12 | - | 0.87±0.15c | - | 1.14±0.03b | 3.61±0.12b | 0.55±0.03b | 1.05±0.07d |
| B.cereus Gut 16 | 6.46±0.59 | 2.30±0.25a | 2.54±0.10b | 1.51±0.10a | 1.22±0.54c | - | 1.34±0.02b |
| E.coli Gut 20 | - | 0.66±0.06c | 2.85±0.05a | 1.06±0.09bc | 5.20±0.26a | 0.87±0.03a | 1.48±0.08a |
| 注:-:无消化酶活性;同一列内含不同字母的数据有显著性差异(P<0.05). Note: -: No digestive enzyme activity; There were significant differences in data with different superscripts in the same column (P<0.05). |
|||||||
4株儿茶酚类铁载体高产菌株在人工模拟胃液和人工模拟肠液中生长良好,结果见图 1。在pH 2.0的人工模拟胃液中,4株菌的活菌数量显著降低(P<0.05),连续培养6 h后其存活率均在60%以上,E. coli Gut 12的存活率最高(80.00%±1.12%);4株菌在人工模拟肠液初期生长平缓,连续培养24 h后,4株菌的活菌数量均超过初始菌量,其中E. coli Gut 12的存活率最高(114.70%±2.59%)。本研究不仅证明该4株菌具有较强的耐酸耐胆盐能力,而且对胃蛋白酶、胰酶具有较强的耐受性。

|
| 图 1 4株高产菌株在人工模拟胃液(A,pH 2.0)和肠液(B,pH 7.5,胆盐浓度0.3%)中的存活率 Figure 1 Survival rate of four strains with high-yeild catechol siderophore in artificial gastric juice (A, pH 2.0) and intestinal juice (B, Bile salinity 0.3%) |
|
|
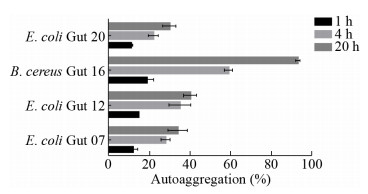
自凝集作用可使潜在益生菌在胃肠道环境中相互凝集,提高自身数量,同时可在胃肠道粘膜表面形成一层保护屏障,抑制致病微生物的定殖,对益生菌益生功能的发挥具有重要作用[26]。4株菌E. coli Gut 07、E. coli Gut 12、B. cereus Gut 16、E. coli Gut 20的自凝集率如图 2所示,随着时间的延长,4株菌的自凝集率均有提升,20 h时B. cereus Gut 16自凝集率最大(92.93%±1.14%)。
|
| 图 2 4株高产菌株自凝集率 Figure 2 The autoaggregation of high-yeilding strains of catechol siderophore |
|
|
4株菌E. coli Gut 07、E. coli Gut 12、B. cereus Gut 16、E. coli Gut 20的黏蛋白粘附率分别为34.61%±0.90%、26.20%±1.12%、56.67%±1.81%、34.15%±1.20%,B. cereus Gut 16的黏蛋白粘附率最高,显著高于其他3株菌(P<0.05)。
MATH法是以微生物对碳水化合物的粘附能力作为菌株表面疏水能力的衡量指标。4株菌对二甲苯、三氯甲烷、乙酸乙酯3种有机溶剂的表面疏水率如表 2所示。二甲苯为非极性溶剂,由表 2可知B. cereus Gut 16对二甲苯的表面疏水能力最大(57.68%±0.98%),显著高于其他3株菌(P<0.05),说明菌体表面极性与非极性残基的分布与微生物种属具有很大相关性;三氯甲烷为单极性电子受体有机溶剂,4株菌对三氯甲烷的表面疏水率均大于30%,无显著性差异(P>0.05),表明4株菌都可以作为电子供体;乙酸乙酯为单极性电子供体有机溶剂,E. coli Gut 07、E. coli Gut 12和E. coli Gut 20对乙酸乙酯具有较高的表面疏水率(42.16%-55.18%),属于强电子受体。
| 菌株 Strains |
二甲苯 C8H10 |
三氯甲烷 CHCl3 |
乙酸乙酯 CH3COOC2H5 |
| E.coli Gut 07 | 8.88±0.76cB | 39.26±0.57bA | 42.16±0.71aA |
| E.coli Gut 12 | 6.73±0.32cB | 46.78±1.00bA | 55.18±0.71aA |
| B.cereus Gut 16 | 57.68±0.98aA | 31.65±0.49bA | 21.79±0.76cB |
| E.coli Gut 20 | 5.72±0.49cB | 37.29±0.74bA | 47.87±0.23aA |
| 注:同一行含不同小写字母的数据有显著性差异(P<0.05);同一列含不同大写字母的数据有显著性差异(P<0.05). Note: Lowercase indicated that there were significant differences in data with different superscripts in the same line (P<0.05). Uppercase indicated that there were significant differences in data with different superscripts in the same column (P<0.05). |
|||
在所使用的20种常用抗生素中,E. coli Gut 07、E. coli Gut 12、E. coli Gut 20对盘尼西林、苯唑西林、四环素、多西环素和红霉素具有耐受性,对其他15种测试抗生素均敏感;B. cereus Gut 16对羧苄青霉素、阿米卡星、四环素和红霉素具有耐受性,对其他16种抗生素敏感。结果见表 3。
| 抗生素 Antibiotic |
E. coli Gut 07 |
E. coli Gut 12 |
B. cereus Gut 16 |
E. coli Gut 20 |
| 盘尼西林 Penicillin (10 IU) |
- | - | ++++ | - |
| 苯唑西林 Oxacillin (1 μg) |
- | - | +++ | - |
| 氨苄西林 Ampicillin (10 μg) |
++++ | ++++ | +++ | ++++ |
| 羧苄青霉素 Carbenicillin (100 μg) |
+++ | ++++ | - | ++ |
| 氯噻酮 Chlorthalidone (100 μg) |
+++ | +++ | ++++ | +++ |
| 头孢氨苄 Cephalexin (30 μg) |
+++ | +++ | ++ | +++ |
| 头孢唑啉 Cefazolin (30 μg) |
+++ | +++ | ++ | +++ |
| 头孢拉定 Cefradine (30 μg) |
+++ | +++ | ++ | ++ |
| 头孢呋辛 Cefuroxime (30 μg) |
++ | +++ | +++ | +++ |
| 头孢他啶 Ceftazidime (30 μg) |
+++ | ++ | ++ | +++ |
| 头孢三嗪 Ceftriaxone (30 μg) |
++++ | +++ | +++ | ++++ |
| 头孢哌酮 Cefoperazone (30 μg) |
++ | +++ | ++++ | ++++ |
| 阿米卡星 Amikacin (30 μg) |
++++ | ++ | - | + |
| 庆大霉素 Gentamicin (120 μg) |
++ | ++ | ++++ | ++ |
| 卡那霉素 Kanamycin (30 μg) |
++ | + | ++++ | ++ |
| 新霉素 Neomycin (30 μg) |
++ | ++ | +++ | ++ |
| 四环素 Tetracycline (30 μg) |
- | - | - | ++ |
| 多西环素 Doxycycline (30 μg) |
- | - | +++ | - |
| 米诺环素 Minocycline (30 μg) |
+ | + | + | + |
| 红霉素 Erythromycin (15 μg) |
- | - | - | - |
| 注:-:抑菌圈直径0-0.5 cm,耐受;+:抑菌圈直径0.5-1.0 cm,低敏;++:抑菌圈直径1.0-1.5 cm,中敏;+++:抑菌圈直径1.5-2.0 cm,高敏;++++:抑菌圈直径大于2.0 cm,极敏. Note: -: The diameter of bacteriostatic circle is 0-0.5 cm, resistance; +: The diameter of bacteriostatic circle is 0.5-1.0 cm, low sensitivity; ++: The diameter of bacteriostatic circle is 1.0-1.5 cm, intermediate; +++: The diameter of bacteriostatic circle is 1.5-2.0 cm, susceptible; ++++: The diameter of bacteriostatic circle is greater than 2.0 cm, extreme sensitivity. |
||||
4株高产菌株分高、中、低3个剂量组对小鼠连续灌胃1周后,各组小鼠的体重、摄食量、脏器系数情况如表 4所示。各组小鼠直至灌胃结束,摄食、饮水和排泄等一切正常,毛色正常,精神状况良好,未出现腹泻、中毒和死亡等病例,各剂量组与对照组小鼠体重增加量无显著性差异,说明4株菌对小鼠体重增长无显著影响。心脏指数能够反映小鼠身体健康状况,肝脏、肾脏和脾脏为体内重要的解毒排毒器官,其指数的变化能够反映灌胃菌株的毒性程度[27],试验结果显示各脏器指数均无显著性差异(P>0.05),说明4株菌对小鼠各脏器无毒性。各组小鼠的血液、组织液和淋巴结样品中均未出现菌落,即均未检测到菌株移位,试验结果呈阴性,说明4株儿茶酚类铁载体高产菌株不会对机体其他组织器官产生影响。结果表明,4株高产菌株在浓度低于4.5×1011 CFU/mL、灌胃剂量为20 mL/kg时对小鼠无急性毒性。
| 菌株 Strain |
剂量 Dose (CFU/mL) |
体重增重 Weight gain (g/mice) |
总摄食量 Total food intake (g) |
脏器系数Organindex(X±SD) | |||
| 心脏Heart | 脾脏Spleen | 肝脏Liver | 肾脏Kidney | ||||
| Normal control | 0 | 3.34±0.17a | 162.7 | 0.006 1±0.000 7a | 0.004 7±0.000 9a | 0.052 2±0.003 4a | 0.016 5±0.001 7a |
| E.coli Gut 07 | 4.5×1011 | 3.73±0.10a | 152.3 | 0.007 1±0.001 0a | 0.009 0±0.004 9a | 0.054 2±0.002 8a | 0.016 4±0.003 9a |
| 4.5×109 | 3.03±0.49a | 146.6 | 0.006 7±0.001 4a | 0.005 3±0.001 3a | 0.053 0±0.000 6a | 0.016 5±0.002 7a | |
| 4.5×107 | 3.38±0.84a | 156.8 | 0.007 0±0.001 0a | 0.008 3±0.006 1a | 0.053 9±0.004 2a | 0.017 8±0.003 1a | |
| E.coli Gut 12 | 4.5×1011 | 3.35±0.26a | 147.4 | 0.006 1±0.001 2a | 0.006 3±0.001 2a | 0.054 8±0.007 3a | 0.016 7±0.002 8a |
| 4.5×109 | 3.33±0.54a | 155.3 | 0.006 3±0.000 8a | 0.005 2±0.001 7a | 0.054 3±0.002 9a | 0.016 4±0.002 0a | |
| 4.5×107 | 3.28±0.59a | 148.0 | 0.006 5±0.000 7a | 0.009 6±0.005 0a | 0.058 1±0.003 1a | 0.015 7±0.002 9a | |
| B.cereus Gut 16 | 4.5×1011 | 3.40±0.22a | 157.9 | 0.007 5±0.001 0a | 0.005 6±0.001 1a | 0.059 7±0.003 5a | 0.016 8±0.003 0a |
| 4.5×109 | 3.25±0.47a | 161.2 | 0.006 6±0.000 6a | 0.010 3±0.010 2a | 0.051 9±0.006 8a | 0.016 2±0.001 5a | |
| 4.5×107 | 3.10±0.18a | 156.6 | 0.006 5±0.001 1a | 0.005 9±0.001 9a | 0.056 5±0.004 0a | 0.016 6±0.003 3a | |
| E.coli Gut 20 | 4.5×1011 | 3.18±0.29a | 159.5 | 0.007 2±0.001 1a | 0.005 7±0.001 2a | 0.056 6±0.001 6a | 0.016 5±0.001 9a |
| 4.5×109 | 3.03±0.19a | 170.1 | 0.006 1±0.001 1a | 0.006 1±0.003 3a | 0.057 4±0.002 6a | 0.017 4±0.003 7a | |
| 4.5×107 | 3.20±0.56a | 162.2 | 0.006 1±0.001 0a | 0.005 2±0.000 6a | 0.050 7±0.002 9a | 0.016 1±0.003 3a | |
| 注:实验组与对照组无显著性差异(P>0.05);同一列相同小写字母表示无显著性差异(P>0.05). Note: There were no significant differences between the control group and the groups fed with different concentrations of test bacterial strains (P>0.05). There were no significant differences in data with same superscripts in the same column (P>0.05). |
|||||||
本研究中的4株人胃肠道源儿茶酚类铁载体高产菌株产量大于其他研究中从湖水中筛选得到的高产铁载体荧光假单胞菌铁载体产量(15 μmol/L)[28],均分泌不同种类的消化酶,且具有益生特性,初步安全,可以成组方式开发其辅助消化的益生活性,发挥其促营养、保健康的作用。
人和哺乳动物缺少完整的产酶系统,胃肠道微生物菌群能够分泌多种与食物营养消化相关的酶,如蛋白酶、纤维素酶、淀粉酶、脂肪酶、植酸酶、β-葡聚糖酶等[29]。本试验中4株儿茶酚类铁载体高产菌株均产生分泌到胞外的消化酶,且不同菌株的产酶活性存在显著差异,具有显著的组学特征,有进一步了解其益生特性的必要。
益生菌生物学特性需要满足的条件有良好的耐酸耐胆盐能力、粘附定殖能力、生产性能等且对动物机体安全[30-31]。
在耐酸耐胆盐试验中,本研究的4株菌在人工模拟胃液中连续培养6 h后其存活率均在60%以上;在人工模拟肠液连续培养24 h后,4株菌的活菌数量均超过初始菌量,存活率较高,与其他耐酸耐胆盐研究结果[32]相比,4株儿茶酚类铁载体高产菌株的耐酸耐胆盐能力更强。
对益生菌粘附定殖能力的研究是评价益生菌生物学特性的重要指标。研究表明自凝集、黏蛋白粘附和表面疏水性都属于非特异性粘附,由菌株细胞壁表面成分及其所带电荷决定,微生物表面疏水性由菌体表面电荷及其极性与非极性残基的分布决定,因此可用于判断菌体在胃肠道中的粘附性能[33]。自凝集率和黏蛋白粘附能力较大的B. cereus Gut 16表现出了较强的表面疏水性能,由此推测菌株的自凝集率、黏蛋白粘附率和表面疏水率具有正相关性,与Feng等对11株益生菌表面特性的研究结果[34]一致;靳彩娟研究筛选得到的高粘附性乳酸菌对小肠粘液的最大粘附率为35.2%,与本研究中3株E. coli菌的粘附率相近,但显著低于B. cereus Gut 16[23],人胃肠道源微生物对黏蛋白具有特异性识别作用,出现该结果的原因可能为菌株来源不同。益生菌在胃肠道黏膜粘附定殖时,首先通过非特异性粘附作用附着在胃肠道上皮的粘液层,其次才是通过特异性粘附将菌体表面蛋白与胃肠道细胞表面受体蛋白相结合[35],还需进一步研究菌株对上皮细胞的粘附性,如Caco-2细胞等,才能够更充分地反映菌株在胃肠道环境中的粘附定殖能力。
近年来抗生素的滥用导致越来越多的胃肠道微生物出现耐药性[36],人类肠道共生菌可能充当与人类病原体中发现的抗生素抗性基因相似的基因库。与这些细菌相关的主要威胁是它们可以将抗药性基因转移给致病细菌。胃肠道环境中致病菌株吸收耐药基因后对后续的抗生素疗法将产生不利影响[37]。因此,在挖掘潜在益生菌时,必须对其抗生素耐受性进行客观评价。本研究结果中4株儿茶酚类铁载体高产菌株对大多数抗生素不具有耐受性,且在20 mL/kg灌胃剂量(4.5×1011 CFU/mL)下对小鼠无急性毒性,其在食品、医药、工农业生产等各行业的应用具有重要意义,可以对其进行下一步研究。
本试验4株菌能够在胃肠道中存活并定殖,对大多数抗生素不具耐受性且无急性毒性,多种产酶活性表明其在胃肠道中有利于食物的消化吸收,可作为潜在益生菌进行进一步的深入研究。
| [1] |
Golonka R, Yeoh BS, Vijay-Kumar M. The iron tug-of-war between bacterial siderophores and innate immunity[J]. Journal of Innate Immunity, 2019, 11(3): 249-262. |
| [2] |
Aguilera L, Toloza L, Giménez R, et al. Proteomic analysis of outer membrane vesicles from the probiotic strain Escherichia coli Nissle 1917[J]. Proteomics, 2014, 14(2/3): 222-229. |
| [3] |
Liu DH, Sun BL. Research on the correlation between gastrointestinal microbiota and human gastrointestinal system diseases[J]. Journal of Biology, 2019, 36(4): 1-6. (in Chinese) 刘德华, 孙宝林. 胃肠道微生物种群与人类消化系统疾病相关性研究进展[J]. 生物学杂志, 2019, 36(4): 1-6. |
| [4] |
Tan SD, Guo YX. Research progress on the relationship between inflammatory bowel disease and intestinal microecology[J]. Chinese Youjiang Medical Journal, 2019, 47(1): 73-76. (in Chinese) 谭舒丹, 郭瑜修. 炎症性肠病与肠道微生态关系的研究进展[J]. 右江医学, 2019, 47(1): 73-76. |
| [5] |
Shi YD, Ren Y, Sun H. Probiotics potential safety and countermeasures[J]. Feed Review, 2018(5): 43-46, 49. (in Chinese) 时云朵, 任燕, 孙豪. 益生菌潜在安全性的现状及对策[J]. 饲料博览, 2018(5): 43-46, 49. |
| [6] |
Gong Q, Zhang XC. Screening, identification of catechol siderophore-producing bacteria from human gastrointestinal tract[J]. Current Biotechnology, 2019, 9(1): 62-68. (in Chinese) 弓强, 张希春. 人胃肠道源儿茶酚类铁载体产生菌的筛选与鉴定[J]. 生物技术进展, 2019, 9(1): 62-68. |
| [7] |
Liu SJ. Experimental Technology of Food Microbiology[M]. Beijing: China Agricultural Science and Technology Press, 2000: 15-17. (in Chinese) 刘绍军. 食品微生物学实验技术[M]. 北京: 中国农业科技出版社, 2000: 15-17. |
| [8] |
National Pharmacopoeia Committee. Clinical Medication Instructions of Pharmacopoeia of the People's Republic of China: Volume of Chemical Drugs and Biological Products (2005 Edition)[M]. Beijing: People's Health Press, 2005. (in Chinese) 国家药典委员会. 中华人民共和国药典临床用药须知:化学药和生物制品卷(2005年版)[M]. 北京: 人民卫生出版社, 2005. |
| [9] |
Sun YH, Zhou KY, Xiong Z. Screening and identification of protease-producing bacterium from intestinal canal of Dendrolimu and liquid culture studies[J]. Chinese Agricultural Science Bulletin, 2012, 28(14): 18-21. (in Chinese) 孙佑赫, 周开艳, 熊智. 松毛虫肠道产蛋白酶菌株的筛选鉴定及培养条件研究[J]. 中国农学通报, 2012, 28(14): 18-21. |
| [10] |
Liu Z, Zhang YG, Zhang WW, et al. Screening of amylase-producing bacteria and optimization of the condition for enzyme production[J]. Feed Industry, 2012, 33(23): 27-30. (in Chinese) 刘震, 张永根, 张微微, 等. 淀粉分解菌的筛选及产酶条件的优化[J]. 饲料工业, 2012, 33(23): 27-30. |
| [11] |
Zhao W, Wang LQ, Zheng J, et al. Isolation, identification of lipase production strain and optimization of the fermentation condition[J]. Journal of Natural Science of Hunan Normal University, 2010, 33(3): 88-92. (in Chinese) 赵伟, 王俐琼, 郑甲, 等. 产脂肪酶菌株的分离、鉴定及其产酶条件优化[J]. 湖南师范大学自然科学学报, 2010, 33(3): 88-92. |
| [12] |
Lei ZY, He L, Wang ZY, et al. Study on isolation of cellulase-production strains from the digestive tract of grass carp and the conditions for cellulase production[J]. Journal of Microbiology, 2007, 27(4): 54-57. (in Chinese) 雷正玉, 何力, 王朝元, 等. 草鱼体内产纤维素酶菌株的筛选及产酶条件的研究[J]. 微生物学杂志, 2007, 27(4): 54-57. |
| [13] |
Huang CC. Screening of high yield strain of phytase and optimizating of its fermentation conditions[D]. Jinan: Master's Thesis of Shandong Institute of Light Industry, 2011 (in Chinese) 黄翠翠.植酸酶高产菌株的选育及其发酵条件的优化[D].济南: 山东轻工业学院硕士学位论文, 2011 |
| [14] |
Xu JL. Genetic engineering of lactoase production yeast strain and the production of lactoase by fermentation[D]. Qingdao: Doctoral Dissertation of Ocean University of China, 2012 (in Chinese) 徐金利.产乳糖酶酵母菌株的遗传改良和乳糖酶的发酵生产[D].青岛: 中国海洋大学博士学位论文, 2012 |
| [15] |
Wang BH, Wang JG, Lei CL. Inquisition of the midgut digestive enzyme activity difference between lab reared and feral Periplaneta americana[J]. Chinese Journal of Vector Biology and Control, 2007, 18(2): 95-97. (in Chinese) 王柏海, 王俊刚, 雷朝亮. 人工饲养和野生美洲大蠊消化酶活性差异研究[J]. 中国媒介生物学及控制杂志, 2007, 18(2): 95-97. |
| [16] |
Winkler UK, Stuckmann M. Glycogen, hyaluronate, and some other polysaccharides greatly enhance the formation of exolipase by Serratia marcescens[J]. Journal of Bacteriology, 1979, 138(3): 663-670. |
| [17] |
Tsang PWK, Fong WP, Samaranayake LP. Candida albicans orf19.3727 encodes phytase activity and is essential for human tissue damage[J]. PLoS One, 2017, 12(12): e0189219. |
| [18] |
Iqbal S, Nguyen TH, Nguyen HA, et al. Characterization of a heterodimeric GH2 β-galactosidase from Lactobacillus sakei Lb790 and formation of prebiotic galacto-oligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8): 3803-3811. |
| [19] |
Bagewadi ZK, Mulla SI, Ninnekar HZ. Purification and characterization of endo β-1, 4-D-glucanase from Trichoderma harzianum strain HZN11 and its application in production of bioethanol from sweet sorghum bagasse[J]. 3 Biotech, 2016, 6(1): 101. |
| [20] |
Wang F, Liu L, Li HT, et al. Screening for potential probiotics based on high α-glucosidase inhibitory activity[J]. Food Science, 2018, 39(16): 192-200. (in Chinese) 王芬, 刘鹭, 李函彤, 等. 具有α-葡萄糖苷酶抑制作用益生菌的筛选及特性分析[J]. 食品科学, 2018, 39(16): 192-200. |
| [21] |
Grigoryan S, Bazukyan I, Trchounian A. Aggregation and adhesion activity of Lactobacilli isolated from fermented products in vitro and in vivo: a potential probiotic strain[J]. Probiotics and Antimicrobial Proteins, 2018, 10(2): 269-276. |
| [22] |
Jonsson H, Ström E, Roos S. Addition of mucin to the growth medium triggers mucus-binding activity in different strains of Lactobacillus reuteri in vitro[J]. FEMS Microbiology Letters, 2001, 204(1): 19-22. |
| [23] |
Jin CJ. Screening, identification and surface hydrophobic properties of high adhesive Lactobacillu[D]. Yangzhou: Master's Thesis of Yangzhou University, 2013 (in Chinese) 靳彩娟.高粘附性乳酸菌的筛选、鉴定及其表面疏水特性研究[D].扬州: 扬州大学硕士学位论文, 2013 |
| [24] |
Yu XF, Chen ZQ, Dang XT, et al. Surface hydrophobicity and coherency of three stranis of Lactobacillus[J]. Journal of Anhui Agricultural Sciences, 2017, 45(22): 55-57. (in Chinese) 于小番, 陈忠琴, 党欣桐, 等. 3株乳杆菌表面疏水性及凝聚性研究[J]. 安徽农业科学, 2017, 45(22): 55-57. |
| [25] |
Procedures for toxicological assessment of food, Standardization Administration of China. GB 15193.1-2003 Procedures for toxicological assessment of food[S]. Beijing: China Standard Press, 2004 (in Chinese) 中华人民共和国卫生部, 中国国家标准化管理委员会. GB15193.1-2003食品安全性毒理学评价程序[S].北京: 中国标准出版社, 2004 |
| [26] |
Tuo YF, Yu HL, Ai LZ, et al. Aggregation and adhesion properties of 22 Lactobacillus strains[J]. Journal of Dairy Science, 2013, 96(7): 4252-4257. |
| [27] |
Liu Y, Zhang Y, Zhang HP. Evaluating methods of probiotic's safety in the world[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(6): 141-151. (in Chinese) 刘勇, 张勇, 张和平. 世界益生菌安全性评价方法[J]. 中国食品学报, 2011, 11(6): 141-151. |
| [28] |
Zhao X, Chen SX, Xie ZX, et al. Isolation, identification and over-siderophores production of Pseudomonas fluorescens sp-f[J]. Acta Microbiologica Sinica, 2006, 46(5): 691-695. (in Chinese) 赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691-695. |
| [29] |
Zheng T. Characterization and application to pig feedstuff of the enzymes from Aspergillus niger[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2006 (in Chinese) 郑腾.黑曲霉产酶特性研究及其酶制剂在猪饲料中的应用[D].南京: 南京农业大学博士学位论文, 2006 |
| [30] |
Zhao F, Li YQ, Li BC. Screening of probiotic Lactobacillus in simulated gastrointestinal environment[J]. Microbiology China, 2016, 43(6): 1396-1403. (in Chinese) 赵芳, 李艳琴, 李彬春. 模拟人体胃肠道环境筛选益生乳杆菌[J]. 微生物学通报, 2016, 43(6): 1396-1403. |
| [31] |
FAO/WHO. Guidelines for the evaluation of probiotics in food[R]. London Ontario, Canada: FAO/WHO, 2002
|
| [32] |
Shi XM, Chen JG, Li SY, et al. Mutation breeding of Lactobacillus plantarum CICC 6238 for γ-aminobutyric acid production and analysis of probiotic properties[J]. Food and Fermentation Industries, 2018, 44(8): 71-77. (in Chinese) 史晓萌, 陈建国, 李生有, 等. 产γ-氨基丁酸乳酸菌CICC 6238的诱变选育及益生特性分析[J]. 食品与发酵工业, 2018, 44(8): 71-77. |
| [33] |
Rokana N, Singh BP, Thakur N, et al. Screening of cell surface properties of potential probiotic Lactobacilli isolated from human milk[J]. Journal of Dairy Research, 2018, 85(3): 347-354. |
| [34] |
Feng YY, Qiao L, Liu R, et al. Potential probiotic properties of lactic acid bacteria isolated from the intestinal mucosa of healthy piglets[J]. Annals of Microbiology, 2017, 67(3): 239-253. |
| [35] |
Rinkinen M, Westermarck E, Salminen S, et al. Absence of host specificity for in vitro adhesion of probiotic lactic acid bacteria to intestinal mucus[J]. Veterinary Microbiology, 2003, 97(1/2): 55-61. |
| [36] |
Fang ZG, Wang JL, Cheng M. Distribution and drug resistance of 855 isolated gram-negative bacilli[J]. Journal of Bengbu Medical College, 2010, 35(8): 823-825. (in Chinese) 方自国, 汪金利, 程玫. 855株革兰阴性分离杆菌分布及耐药性分析[J]. 蚌埠医学院学报, 2010, 35(8): 823-825. |
| [37] |
Mathur S, Singh R. Antibiotic resistance in food lactic acid bacteria — a review[J]. International Journal of Food Microbiology, 2005, 105(3): 281-295. |
 2020, Vol. 47
2020, Vol. 47