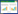扩展功能
文章信息
- 穆香轶, 张璇, 胡有贞, 关波, 陈国刚
- MU Xiang-Yi, ZHANG Xuan, HU You-Zhen, GUAN Bo, CHEN Guo-Gang
- 库尔勒香梨黑头病拮抗菌的筛选和鉴定
- Screening and identification of an antagonistic bacterium against blackhead disease of Korla fragrant pear
- 微生物学通报, 2020, 47(6): 1795-1806
- Microbiology China, 2020, 47(6): 1795-1806
- DOI: 10.13344/j.microbiol.china.190747
-
文章历史
- 收稿日期: 2019-09-14
- 接受日期: 2019-12-18
- 网络首发日期: 2019-12-23
库尔勒香梨(Korla fragrant pear)为新疆特色的传统优势梨品种,是我国超市占有率高、国产梨中销售价格较高的梨品种,也是我国主要的出口梨品种之一[1]。但由于其主产区新疆地处内陆腹地,85%的库尔勒香梨采收后入库储藏,造成果实品质下降[2],且易发多种病害如炭疽病、轮纹病、黑心病、锈斑病、黑头病等。其中黑头病是近年来新发现的一种库尔勒香梨采后病症,也有研究学者称其为顶腐病。本课题组前期从感病梨果上分离、并通过科氏法则验证了芸薹生链格孢菌(Alternaria brassicicola) XL2为黑头病的主要致病真菌。病原菌通过自然孔口侵入香梨果实,造成果肉呈现黑色蜂窝霉层状,且随着贮藏时间的延长,褐色霉层不断向果心延伸,并有黏稠黑汁物质流出[3]。据调查库尔勒香梨果实黑头病最高侵染率可达20%,给香梨采后贮藏造成很大损失,是香梨产业化亟待解决的问题[4]。
目前对库尔勒香梨采后保鲜以控制储运条件为主,包括化学保鲜法(如1-MCP熏蒸[5]、壳聚糖涂膜[6])、物理保鲜法(如气调[7]、低温等),对维持库尔勒香梨的品质有一定作用。然而,这些保鲜方法对于库尔勒香梨采后致病菌的防治效果非常有限,特别是由于安全性等原因,使用范围受到极大限制。因此,将生物防治方法应用在库尔勒香梨黑头病中,不仅环保健康,而且经济效益可观。生物防治主要是利用拮抗菌及其代谢产物防治植物病害,筛选高效的拮抗菌株是生物防治的前提[8]。果实表面的微生物种类极为丰富,且通过拮抗作用、竞争作用相互制约,是优质的拮抗菌资源库。本研究以新疆库尔勒香梨黑头病病原菌芸薹生链格孢菌(A. brassicicola) XL2为防治对象,从油桃表面筛选、鉴定出一株能够有效抑制该病原菌的拮抗菌株Y2,通过形态学、生理生化特征及16S rRNA基因序列分析鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis),并初步探索了其抑菌效果,以期为进一步探索库尔勒香梨采后生防保鲜技术的应用和研究提供参考依据,为微生物制剂的开发与应用提供理论基础与支持。
1 材料与方法 1.1 材料 1.1.1 供试菌株供试库尔勒香梨黑头病病原芸薹生链格孢菌(A. brassicicola) XL2由本课题组从保鲜冷库中储存的感病香梨上通过科氏法则分离获得,甘油冻存于-80 ℃冰箱。
1.1.2 培养基马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯葡萄糖水24.0,琼脂20.0,pH自然;LB培养基(g/L):氯化钠10.0,胰蛋白胨10.0,酵母提取物5.0,pH 7.2;1×105 Pa灭菌30 min。
1.1.3 主要试剂和仪器PCR引物由生工生物工程(上海)股份有限公司合成;2×PCR Mix,天根生化科技(北京)有限公司;DNA胶回收试剂盒,北京全式金生物技术有限公司。
LabCycler 48系列PCR仪,华粤行仪器有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司;倒置显微镜,普赫光电(上海)科技有限公司。
1.2 拮抗菌的分离、纯化取表面无损的新疆产番茄、油桃和小白杏果实,分别用无菌水于无菌条件下清洗果实表面5 min,清洗液按照平板稀释法涂布LB平板,37 ℃培养24 h后记录菌落直径达3 mm以上的细菌并筛选涂布。将所分离细菌在LB培养基上划线培养,选取单菌落接种至LB培养基37 ℃、200 r/min培养过夜,低温保存备用。
1.3 拮抗菌的筛选采用平板对峙法将分离纯化获得的菌株在PDA培养基上进行十字划线,将活化的芸薹生链格孢菌(A. brassicicola) XL2用打孔器移取直径6 mm的菌饼置于划线空白的中央进行对峙培养,重复4次。以只接A. brassicicola XL2的平板作为对照(CK),于28 ℃倒置培养4 d,观察抑菌情况,测量A. brassicicola XL2菌饼生长半径,统计生长抑菌率,计算公式如下:
抑菌率(%)=[CK平均菌落半径(mm)-处理组平均菌落半径(mm)]/CK平均菌落半径(mm)×100,筛选对测试菌有显著抑制作用的菌种进行第二轮筛选。
打孔移取直径6 mm的A. brassicicola XL2菌饼置于PDA培养基中央,在距离菌落边缘3 cm处上下左右4个方向放置直径5 mm的无菌滤纸,滴加10 μL初筛拮抗菌悬液,28 ℃倒置培养4 d,观察抑菌情况,选择拮抗效果最好的一株菌作为待选拮抗菌保存备用。
1.4 拮抗菌的鉴定 1.4.1 菌体形态及生理生化检测参照《常见细菌系统鉴定手册》观察菌株Y2的菌落形态,对其进行菌体革兰氏染色,测定酶活、碳源氧化等实验[9]。
1.4.2 拮抗菌的分子生物学鉴定以菌株Y2的DNA为模板,利用细菌通用引物27F (5′-CAGGCCTAACACATGCAAGTC-3′)和1492R (5′-GGGCGGWGTGTACAAGGC-3′)进行16S rRNA基因序列的PCR扩增[10]。PCR反应体系(20 µL):2×PCR Mix 10 μL,上、下游引物(10 μmol/L)各0.5 μL,模板DNA (100 mg/L) 1 μL,ddH2O 8 μL。PCR反应条件:95 ℃ 5min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 7 min。PCR产物纯化后送生工生物工程(上海)股份有限公司测序,返回测序结果后通过GenBank中核酸数据库进行比对,并利用软件MEGA 6.0构建系统发育树进行同源性分析。
1.5 拮抗菌的拮抗特性分析拮抗菌株的发酵液和无菌滤液制备:将拮抗菌株Y2的单菌落接种至LB液体培养基中,37 ℃、200 r/min振荡培养24 h作为种子液,将种子液按1% (体积比)的接种量转接至LB液体培养基中,37 ℃、200 r/min振荡培养48 h后即得Y2菌株的发酵液,随后将发酵液于10 000 r/min离心10 min,取上清液用0.45 μL无菌滤膜过滤,获得拮抗菌株Y2的无菌滤液。
1.5.1 无菌滤液的抑菌率测定将菌株Y2的无菌滤液分别按以下体积浓度:0.5%、1%、2%与温热的PDA培养基混合倒平板,不加无菌滤液的PDA作为对照(CK)。在混合培养基中央放置直径6 mm的A. brassicicola XL2菌饼,每个处理4个重复。28 ℃培养5 d,观察不同体积浓度滤液抑菌效果,测量菌落直径并计算菌丝生长抑制率,计算公式如下:
菌丝生长抑制率(%)=[(CK平均菌落直径(mm)-处理组平均菌落直径(mm)]/CK平均菌落直径(mm)×100。
1.5.2 无菌滤液对菌丝生长的影响将Y2无菌滤液与PDA培养基按2%浓度混匀倒平板,接种A. brassicicola XL2菌饼,以插片法将无菌盖玻片呈45度角斜插入培养基,28 ℃倒置培养3 d,待菌丝爬上盖玻片后镜检观察。以未混合无菌滤液的培养基作为对照。
1.5.3 拮抗菌对A. brassicicola XL2孢子萌发的影响将在PDA培养基28 ℃培养7 d的A. brassicicola XL2用无菌水冲洗,制备孢子悬浮液,用血球计数板计数,调整孢子浓度为106 CFU/mL,分别按照孢子悬浮液:无菌滤液/发酵液比例(体积比)为1:1配成混合溶液,无菌水代替无菌滤液作为空白对照(CK),28 ℃、120 r/min振荡培养24 h。每个处理重复3次。分别于0、6、12、24 h在显微镜镜检观察,孢子萌发形成的芽管长度大于孢子一半时视为萌发,计算孢子萌发抑制率,计算公式如下:
孢子萌发率=萌发孢子个数/总孢子数×100%。
1.6 库尔勒香梨黑头病抑菌实验选取大小、成熟程度和健康状态一致的库尔勒香梨,用无菌水(含有0.5%次氯酸钠)浸泡3 min,无菌水洗2 min,超净台晾干备用。接种材料分成两组,每组果实上均用直径6 mm的打孔器打4个5 mm深的伤口,其中一组4个孔分别接种10 μL A. brassicicola XL2孢子悬浮液(106 CFU/mL)、20 μL混合液[孢子悬浮液:Y2发酵液1:1 (体积比)]、10 μL Y2发酵液、10 µL无菌水;另一组4个孔分别接种10 μL A. brassicicola XL2孢子悬浮液(106 CFU/mL)、20 μL混合液[孢子悬浮液:Y2无菌滤液1:1 (体积比)]、10 μL Y2无菌滤液、10 μL无菌水。两组处理均置于干燥器中室温条件下[(20±2 ℃),RH 65%-70%]储藏5 d,每组处理4个重复,统计病斑直径。
1.7 数据处理与统计分析应用Origin 7.5分析处理数据并制图。采用单因素方差分析(One-Way ANOVA)结合t检验分析各组数据差异显著性。
2 结果与分析 2.1 拮抗菌株的筛选从新疆产番茄、油桃和小白杏果实表面共分离获得90株菌,通过平板对峙法初步筛选出显著拮抗库尔勒香梨黑头病的菌株20株(表 1),通过统计抑菌带宽度进行第二轮筛选,挑选出具有最强抑制效果的Y2菌株(图 1)作为后续研究对象。
| 菌株来源 Strain origin |
菌株编号 Strain No. |
病原菌生长半径 Growth radius ofpathogen (mm) |
抑菌率 Inhibition rate (%) |
| 油桃Nectarines | Y2 | 8.01±0.32 | 70.20 |
| 油桃Nectarines | Y27-1 | 14.31±0.28 | 46.78 |
| 油桃Nectarines | Y19 | 15.42±0.40 | 44.72 |
| 油桃Nectarines | Y14-1 | 14.98±0.40 | 44.27 |
| 油桃Nectarines | Y31 | 16.62±0.42 | 38.18 |
| 油桃Nectarines | Y27-2 | 16.77±0.22 | 37.62 |
| 油桃Nectarines | Y22 | 17.22±0.32 | 35.93 |
| 油桃Nectarines | Y29-1 | 17.45±0.35 | 35.08 |
| 油桃Nectarines | Y29-2 | 18.83±0.40 | 29.97 |
| 小白杏Apricot | X32 | 20.31±0.40 | 27.38 |
| 油桃Nectarines | Y13 | 21.12±0.40 | 24.44 |
| 小白杏Apricot | X5 | 22.41±0.40 | 22.95 |
| 小白杏Apricot | X16 | 22.67±0.40 | 21.83 |
| 小白杏Apricot | X39 | 22.74±0.40 | 16.72 |
| 小白杏Apricot | X8 | 23.46±0.36 | 14.18 |
| 小白杏Apricot | X7 | 24.22±0.36 | 13.94 |
| 圣女果Solanum lycopersicum | S24 | 24.96±0.36 | 13.22 |
| 小白杏Apricot | X1 | 25.03±0.36 | 11.77 |
| 小白杏Apricot | X37 | 25.66±0.36 | 11.34 |
| 圣女果Solanum lycopersicum | S6 | 25.79±0.36 | 10.17 |
|
| 图 1 菌株Y2对A. brassicicola XL2的拮抗作用 Figure 1 Inhibition of strain Y2 against A. brassicicola XL2 注:A:空白对照;B:Y2与A. brassicicola XL2的平板对峙. Note: A: CK; B: Inhibition of strain Y2 against A. brassicicola XL2. |
|
|
菌株Y2在LB培养基或PDA培养基上生长良好,菌落呈乳白色,干燥不透明,边缘不规则,不光滑,表面呈皱褶状凸起(图 2A),镜检菌体为杆状,革兰氏染色呈阳性(图 2B)。结合生理生化鉴定结果(表 2)将该菌初步鉴定为芽孢杆菌(Bacillus sp.)。

|
| 图 2 菌株Y2的形态 Figure 2 Morphology of strain Y2 注:A:菌株Y2的菌落形态;B:普通光学显微镜下的菌株Y2细胞形态(1 000×). Note: A: The colonial morphology of strain Y2; B: The cell morphology of strain Y2 under optical microscope (1 000×). |
|
|
| 酶活/碳源氧化 Enzymeactivity/Carbon source oxidation |
结果 Results |
| β-半乳糖苷酶β-galactosidase | + |
| 精氨酸双水解酶Arginine dihydrolase | - |
| 赖氨酸脱羧酶Lysine decarboxylase | - |
| 鸟氨酶脱羧酶Guanine decarboxylase | - |
| 明胶酶Gelatinase | + |
| 柠檬酸利用Citric acid utilization | - |
| H2S产生H2Sgeneration | - |
| 尿酶Urineenzyme | - |
| 色氨酸脱氨酶Tryptophan deaminase | + |
| 葡萄糖Glucose | - |
| 甘露醇Mannitol | W |
| 肌醇Inositol | - |
| 山梨醇Sorbitol | - |
| 鼠李糖Rhamnose | - |
| 蔗糖Sucrose | - |
| 密二糖Melibiose | - |
| 苦杏仁苷Amygdalin | + |
| 阿拉伯糖Arabiasugar | + |
| 注:+:阳性;-:阴性;W:弱阳性. Note: +: Positive; -: Negative; W: Weak positive. |
|
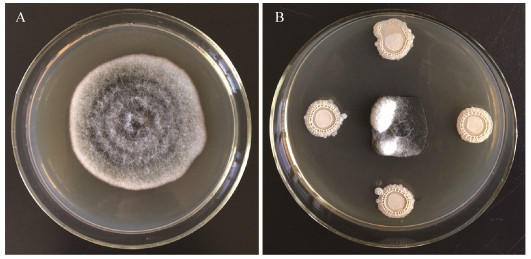
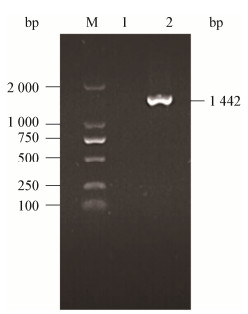
使用16S rRNA基因通用引物对菌株Y2的基因组进行PCR扩增,获得一条1 442 bp的扩增条带(图 3)。将所获序列提交至GenBank,登录号为MN493145,并进行BLAST比对,选取30株序列相似性最高的菌株构建Neighbor-Joining系统发育树(图 4)。结果显示菌株Y2与枯草芽孢杆菌沙漠亚种(Bacillus subtilis subsp. inaquosorum)相似性最高,达到99.93%,结合形态学特征、生理生化特性将菌株Y2鉴定为枯草芽孢杆菌(Bacillus subtilis)。
|
| 图 3 菌株Y2基于16S rRNA基因序列的PCR扩增 Figure 3 PCR amplification of strain Y2 based on 16S rRNA gene sequences 注:M:DL2000分子量标准;1:阴性对照;2:菌株Y2的PCR扩增结果. Note: M: DL2000 molecular weight marker; 1: Negative control; 2: PCR products amplified from the strain Y2 genome. |
|
|
|
| 图 4 菌株Y2基于16S rRNA基因序列构建的系统进化树 Figure 4 Phylogenetic tree based on 16S rRNA gene sequences of isolated strain Y2 注:括号内为参与比对的序列GenBank登录号;分支处标注有Bootstrap值;标尺所示长度为0.01核苷酸置换率. Note: The GenBank accession number of aligned sequences are shown in the brackets; The bootstrap percentages are shown at the nodes (based on 1 000 sampling); Bar 0.01 means the nucleotide substitution rate of 0.01. |
|
|
平板对峙实验(图 1)证明,菌株Y2对库尔勒香梨黑头病致病真菌A. brassicicola XL2具有明显抑制活性。无菌滤液浓度梯度平板抑制实验结果(图 5A)进一步验证了菌株Y2的发酵产物具有抑菌物质,对A. brassicicola XL2有显著抑菌效果。随着培养基中添加的菌株Y2无菌滤液浓度依次增加(0.5%-2%,体积比),接种的A. brassicicola XL2菌饼生长逐渐缓慢。培养5 d后,A. brassicicola XL2在含有2% Y2无菌滤液的培养基上菌落直径为17.98±3.11 mm,抑菌率达到70.96% (图 5B)。

|
| 图 5 不同浓度的Y2菌株无菌滤液对A. brassicicola XL2的拮抗效果 Figure 5 Inhibition effect on A. brassicicola XL2 by different concentration of cell-free filtrate of the strain Y2 注:A:A. brassicicola XL2在含有不同浓度Y2无菌滤液的PDA培养基上的生长表型,照片拍于接种后5 d;B:不同浓度Y2无菌滤液的抑菌率,柱形图上的不同字母表示差异显著,P<0.05. Note: A: growth phenotype of A. brassicicola XL2 on different concentration of cell-free filtrate of the strain Y2, pictures were taken after 120 h of incubation; B: Inhibition rate of cell-free filtrate of the strain Y2 on A. brassicicola XL2 growth. The different letters means significant difference, P < 0.05. |
|
|
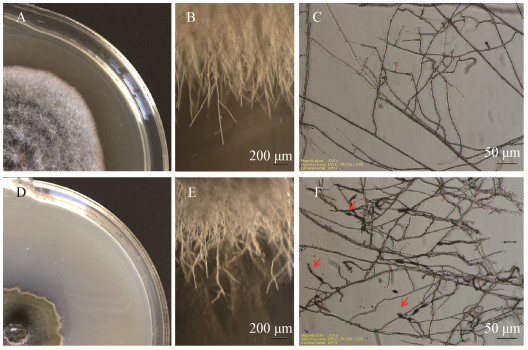
显微镜下观察添加了Y2无菌滤液的培养基上生长的A. brassicicola XL2。与对照菌落相比,添加Y2无菌滤液的A. brassicicola XL2菌落紧致不蓬松,边缘幼嫩菌丝扎入培养基,致使菌落无法延伸(图 6D);菌丝生长粗细不一,扭曲变形(图 6E);菌丝分枝较多,尖端多见帽状致密结构(图 6F)。
|
| 图 6 菌株Y2无菌滤液对A. brassicicola XL2菌丝生长的影响 Figure 6 Effect of cell-free filtrate of the strain Y2 on the hypha of A. brassicicola XL2 注:A、B、C:对照菌丝形态;D、E、F:添加1% Y2无菌滤液的菌丝形态;B和E为倒置显微镜拍照(4×);C和F为光学显微镜拍照(20×). F图中箭头标明菌丝尖端致密结构. Note: A, B, C, : CK; D, E, F: The mycelial morphology of A. brassicicola XL2 treated with 1% cell-free filtrate of the strain Y2; B, E: Inverted microscope (4×); C, F: Optical microscopy (20×). Arrow indicates dense structure of mycelium tips. |
|
|
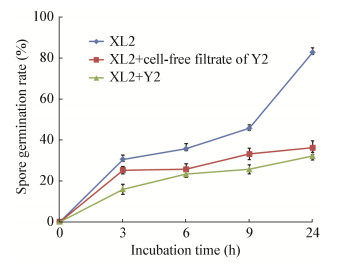
菌株Y2发酵液和无菌滤液对A. brassicicola XL2孢子萌发也有明显抑制作用。无菌水、Y2发酵液和无菌滤液处理的A. brassicicola XL2孢子萌发率随着时间延长均有所上升,但Y2发酵液和无菌滤液处理的上升趋势明显比无菌水处理的缓慢。不同处理下的孢子萌发率在24 h后差异最显著:无菌水处理孢子萌发率为82.7%,Y2发酵液和无菌滤液处理孢子萌发率仅分别为32.1%和36.2% (图 7)。
|
| 图 7 菌株Y2对A. brassicicola XL2孢子萌发的影响 Figure 7 Effect of strain Y2 on the spore germination of A. brassicicola XL2 |
|
|
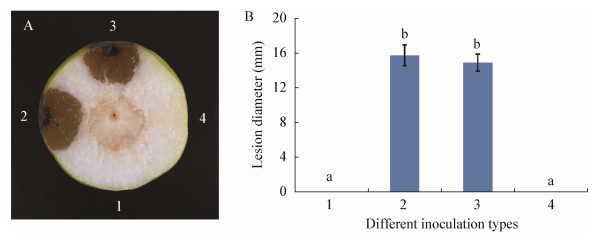
为了进一步了解菌株Y2在库尔勒香梨果实上的拮抗效果,将Y2发酵液和无菌滤液分别与A. brassicicola XL2孢子悬浮液混合接种到库尔勒香梨伤口,培养5 d后统计病斑直径。结果显示,仅接种A. brassicicola XL2孢子悬浮液的伤口病斑直径达16.86±1.21 mm,深度为15.23±1.47 mm;接种Y2菌株发酵液与A. brassicicola XL2孢子悬浮液的伤口病斑直径为10.51±0.29 mm,与对照相比抑制率为37.66%;深度为8.72±0.95 mm,与对照相比抑制率为42.74% (图 8A、B);而接种Y2无菌滤液与A. brassicicola XL2孢子悬浮液的伤口病斑直径为15.02±0.98 mm,深度为13.59±1.06 mm (图 9A、B)。另外,作为对照仅接种Y2菌株发酵液的伤口也会轻微致病。

|
| 图 8 菌株Y2发酵液在库尔勒香梨果实上的抑菌性 Figure 8 Pathogenic inhibition of the fermented product of strain Y2 on Korla fragrant pear 注:A:库尔勒香梨接种剖面图;B:不同接种方式的病斑直径统计. 1:CK;2:A. brassicicola XL2孢子悬浮液;3:A. brassicicola XL2孢子悬浮液+Y2菌株发酵液;4:Y2菌株发酵液.照片拍于接种后5 d;柱形图上的不同字母表示差异显著,P<0.05. Note: A: Cross-section view of Korla fragrant pear after inoculation; B: Radial lesion statistics of different inoculation types on Korla fragrant pear. 1: CK; 2: Conidial suspension of A. brassicicola; 3: Conidial suspension of A. brassicicola XL2+fermented product of strain Y2; 4: Fermented product of strain Y2. Pictures were taken after 5 d of incubation. The different letters means significant difference, P < 0.05. |
|
|
|
| 图 9 菌株Y2无菌滤液在库尔勒香梨果实上的抑菌性 Figure 9 Pathogenic inhibition of the cell-free filtrate of strain Y2 on Korla fragrant pear 注:A:库尔勒香梨接种剖面图;B:不同接种方式的病斑直径统计. 1:CK;2:A. brassicicola XL2孢子悬浮液;3:A. brassicicola XL2孢子悬浮液+Y2菌株无菌滤液;4:Y2菌株无菌滤液.照片拍于接种后5 d;柱形图上的不同字母表示差异显著,P<0.05. Note: A: Cross-section view of Korla fragrant pear after inoculation; B: Radial lesion statistics of different inoculation types on Korla fragrant pear. 1: CK; 2: Conidial suspension of A. brassicicola; 3: Conidial suspension of A. brassicicola XL2+cell-free filtrate of strain Y2; 4: Cell-free filtrate of strain Y2. Pictures were taken after 5 d of incubation. The different letters means significant difference, P < 0.05. |
|
|
生物防治是控制植物病害、减少化学农药污染的有效途径之一。本研究首次从新疆油桃果实表面筛选出一株能够显著抑制库尔勒香梨黑头病病原菌A. brassicicola XL2的拮抗菌株Y2。与传统的土壤来源生防菌相比,果实表面的生防菌与采后病原微生物的竞争中更占优势,也更易长期定殖生存[11]。菌株Y2经过形态观察、生理生化特性和16S rRNA基因序列分析被鉴定为枯草芽孢杆菌。目前芽孢杆菌是研究最多的生防菌候选菌,已有文献证明芽孢杆菌属中的许多种都具有合成抗菌活性物质——抗菌多肽的能力,而且绝大多数对人畜无害,具有较强的抗逆性和良好的环境适应性[12]。其中枯草芽孢杆菌由于其次级代谢产物多、对环境友好等优势成为生防菌关注的热点之一[13]。本研究从新疆油桃果实表面筛选获得的枯草芽孢杆菌Y2无菌发酵液能显著抑制A. brassicicola XL2在PDA培养基上的生长,造成A. brassicicola XL2菌丝分枝增多,尖端出现帽状致密结构。这与武自强[14]、葛康康等[15]报道的枯草芽孢杆菌无菌滤液引起病原菌菌丝隔膜增多、明显膨胀的研究结果略有不同,原因可能是由于微生物的多样性造成不同地区枯草芽孢杆菌的不同菌株其抗菌活性和抗菌特点均有较大差异。因此,尽管前人已有较多枯草芽孢杆菌的相关报道,但仍有必要对本研究筛选获得的菌株Y2进行拮抗机理的深入探索。
果实采后的生理变化及抗病特性使得生防菌的实际应用比拮抗筛选更为复杂,本研究将菌株Y2的发酵液和无菌滤液分别与A. brassicicola XL2孢子悬浮液混合培养,两种混合液均能明显抑制A. brassicicola XL2孢子萌发。然而在库尔勒香梨果实上进行黑头病的抑制实验结果表明,菌株Y2的发酵液能显著抑制A. brassicicola XL2孢子悬浮液在库尔勒香梨伤口上的致病性,病斑直径抑制率为37.66%,深度抑制率为42.74%;而菌株Y2的无菌滤液对库尔勒香梨果实上的A. brassicicola XL2抑制率远远低于Y2发酵液,对病原菌的致病性几乎没有影响。造成这一结果的原因可能是:(1)虽然菌株Y2能够产生能抑制A. brassicicola XL2生长的物质,但库尔勒香梨作为A. brassicicola XL2的亲和性寄主,果肉中的营养更适于其萌发生长,使菌株Y2无菌滤液中的抗菌物质对其生长的抑制效果十分有限;(2)菌株Y2发酵液引起果实轻微致病,诱导了果实自身的抗病性,从而产生强烈的抑菌效果。芽孢杆菌促进植物生长、诱导植物抗病性已有相关的研究报道:枯草芽孢杆菌M4能够诱导猕猴桃抗病相关的防御酶系活性变化以抵御病原菌的侵染[16];解淀粉芽孢杆菌GR53通过调节大白菜不同激素的水平(如水杨酸、茉莉酸和脱落酸含量),增加其对丝核菌病的抗性[17]。一些研究认为芽孢杆菌分泌的脂肽类物质能诱导植物产生抗病性,如解淀粉芽孢杆菌的表面活性素(surfactin)增加黑麦草对稻瘟病菌的抗性[18],枯草芽孢杆菌168过量表达表面活性素(surfactin)和泛革素(fengycin)诱导菜豆和番茄植株的系统抗性,从而提高了对灰霉菌侵染的抵抗能力[19]。但在本研究中,菌株Y2的无菌滤液并未提高库尔勒香梨果实的抗病性,而Y2的发酵液却使果实抗病性增强,说明菌株Y2对库尔勒香梨果实的抗性诱导主要是通过其在果实上造成轻微致病、而非产生的脂肽类物质诱导果实产生抗病性。这一结果与前人的研究略有出入,一方面可能与菌株Y2产生的抑菌物质有关,另一方面整株植物和采后果蔬的抗病系统不同,诱导抗性的激发子可能也有差异。
果蔬采后生物防控系统由拮抗菌、病原菌和寄主三者在外部环境的影响下相互制约,达到动态平衡,最终的拮抗效果往往与两两之间相互作用大相径庭。本研究筛选获得的菌株Y2能产生抑制库尔勒香梨黑头病致病菌A. brassicicola XL2的物质,但在梨果表面的拮抗效果却不理想,更多通过Y2菌体诱导果实自身抗性提高来抵御病原菌的侵染。因此,下一步工作应对菌株Y2的诱导抗性进行深入研究,为今后开发库尔勒香梨黑头病生防菌剂提供更多理论基础和新思路。
| [1] |
Jia XH, Jiang YB, Wang WH, et al. Current situation, existing problems and countermeasure of pear fruit sales in supermarket[J]. China Fruit and Vegetable, 2009(6): 50-52. (in Chinese) 贾晓辉, 姜云斌, 王文辉, 等. 超市梨果销售现状、存在问题与对策[J]. 中国果菜, 2009(6): 50-52. DOI:10.3969/j.issn.1008-1038.2009.06.042 |
| [2] |
Jia XH, Wang WH, Li SQ, et al. Causes of Black Spot on calyx end of Korla fragrant pear[J]. China Fruits, 2014(5): 75-78. (in Chinese) 贾晓辉, 王文辉, 李世强, 等. 新疆库尔勒香梨贮藏保鲜情况调查[J]. 中国果树, 2014(5): 75-78. |
| [3] |
Yang Q, Nan LJ, Jiang Y, et al. The active oxygen metabolism and mineral of Korla fragrant pear after the blackhead disease[J]. Food Science and Technology, 2017, 42(9): 21-25. (in Chinese) 杨琪, 南立军, 江英, 等. 库尔勒香梨黑头病发病后矿物质及活性氧代谢变化研究[J]. 食品科技, 2017, 42(9): 21-25. |
| [4] |
Jia XH, Wang WH, Li SQ, et al. Causes of occurrence of the calyx-end black spot on Korla fragrant pear[J]. Journal of Fruit Science, 2010, 27(4): 556-560. (in Chinese) 贾晓辉, 王文辉, 李世强, 等. 库尔勒香梨萼端黑斑病发生的原因[J]. 果树学报, 2010, 27(4): 556-560. |
| [5] |
Zhao XM, Yang YR, Li JK, et al. Effect of 1-methylcyclopropene treatment on postharvest changes in epicuticular wax of Korla fragrant pear fruits during ambient temperature storage[J]. Food Science, 2015, 36(18): 262-266. (in Chinese) 赵晓敏, 杨玉荣, 李建鲲, 等. 1-MCP处理对库尔勒香梨采后果皮蜡质变化的影响[J]. 食品科学, 2015, 36(18): 262-266. DOI:10.7506/spkx1002-6630-201518049 |
| [6] |
Shan CH, Tong JM, Tang FX. Study on the preservation of Korla fragrant pear by chitosan film at room temperature[J]. Food Research and Development, 2010, 31(2): 186-189. (in Chinese) 单春会, 童军茂, 唐凤仙. 常温下壳聚糖涂膜保鲜库尔勒香梨的研究[J]. 食品研究与开发, 2010, 31(2): 186-189. DOI:10.3969/j.issn.1005-6521.2010.02.054 |
| [7] |
Chen GG. Technology of controlled atmosphere storage and fresh-keeping of fragrant pear of Korla[J]. Storage and Process, 2004, 4(1): 34-35. (in Chinese) 陈国刚. 库尔勒香梨气调贮藏保鲜技术[J]. 保鲜与加工, 2004, 4(1): 34-35. DOI:10.3969/j.issn.1009-6221.2004.01.014 |
| [8] |
Zhang WW, Wang YL, Bi Y, et al. Screening and identification of an antagonistic strain against potato dry rot[J]. Microbiology China, 2018, 45(8): 1726-1736. (in Chinese) 张紊玮, 王艳玲, 毕阳, 等. 一株马铃薯干腐病拮抗菌的筛选、鉴定及其生物防效[J]. 微生物学通报, 2018, 45(8): 1726-1736. |
| [9] |
Dong XZ, Cai MY. Manual of Determinative Bacteriology[M]. Beijing: Science Press, 2001: 162. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 162. |
| [10] |
Liang YM, Zhang LQ, Wang YC, et al. Airborne microorganism pollution and its assessment in certain municipal solid waste landfill[J]. Ecology and Environmental Sciences, 2010, 19(5): 1073-1077. (in Chinese) 梁英梅, 张立秋, 王跃超, 等. 垃圾填埋场空气微生物污染及评价[J]. 生态环境学报, 2010, 19(5): 1073-1077. DOI:10.3969/j.issn.1674-5906.2010.05.014 |
| [11] |
Wang YW, Hu WB, Xu L. Identification of the antagonistic Bacillus strains on melon fruit surface[J]. Acta Phytopathologica Sinica, 2008, 38(3): 317-324. (in Chinese) 王奕文, 胡文兵, 许玲. 甜瓜果实表面生防芽孢杆菌的类群与鉴别[J]. 植物病理学报, 2008, 38(3): 317-324. DOI:10.3321/j.issn:0412-0914.2008.03.015 |
| [12] |
Yan Y, Liu YJ, Chen F. An overview of the application research of Bacillus subtilis[J]. Biology Teaching, 2019, 44(2): 2-3. (in Chinese) 闫杨, 刘月静, 陈芳. 枯草芽孢杆菌的应用现状概述[J]. 生物学教学, 2019, 44(2): 2-3. DOI:10.3969/j.issn.1004-7549.2019.02.001 |
| [13] |
Habib M, Bhat M, Dar BN, et al. Sweet cherries from farm to table: a review[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(8): 1638-1649. DOI:10.1080/10408398.2015.1005831 |
| [14] |
Wu ZQ, Ma R, You CJ, et al. Identification of antagonistic bacteria against Alternaria tenuissima, and its effect on antagonism[J]. Microbiology China, 2015, 42(7): 1321-1330. (in Chinese) 武自强, 马荣, 游崇娟, 等. 枣缩果病拮抗菌的鉴定及其拮抗效应[J]. 微生物学通报, 2015, 42(7): 1321-1330. |
| [15] |
Ge KK, Yao HW, Pan JL, et al. Identification and antibacterial effect of antagonistic bacteria of Carya cathayensis[J]. Journal of Northeast Forestry University, 2018, 46(1): 95-100. (in Chinese) 葛康康, 姚翰文, 潘佳亮, 等. 山核桃干腐病拮抗细菌的鉴定及其抑菌效果[J]. 东北林业大学学报, 2018, 46(1): 95-100. DOI:10.3969/j.issn.1000-5382.2018.01.019 |
| [16] |
Ren P, Ruan XW, Qin T. Study on defense enymes related to disease resistance of Kiwifruit induced by Bacillus subtilis M4[J]. Jiangsu Agricultural Sciences, 2017, 45(22): 111-113. (in Chinese) 任平, 阮祥稳, 秦涛. 枯草芽孢杆菌M4诱导猕猴桃抗病相关的防御酶系研究[J]. 江苏农业科学, 2017, 45(22): 111-113. |
| [17] |
Kang SM, Radhakrishnan R, Lee IJ. Bacillus amyloliquefaciens subsp. plantarum GR53, a potent biocontrol agent resists Rhizoctonia disease on Chinese cabbage through hormonal and antioxidants regulation[J]. World Journal of Microbiology and Biotechnology, 2015, 31(10): 1517-1527. DOI:10.1007/s11274-015-1896-0 |
| [18] |
Rahman A, Uddin W, Wenner NG. Induced systemic resistance responses in perennial ryegrass against Magnaporthe oryzae elicited by semi-purified surfactin lipopeptides and live cells of Bacillus amyloliquefaciens[J]. Molecular Plant Pathology, 2015, 16(6): 546-558. DOI:10.1111/mpp.12209 |
| [19] |
Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants[J]. Environmental Microbiology, 2007, 9(4): 1084-1090. DOI:10.1111/j.1462-2920.2006.01202.x |
 2020, Vol. 47
2020, Vol. 47