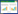扩展功能
文章信息
- 台莲梅, 姜小玉, 靳学慧, 张亚玲
- TAI Lian-Mei, JIANG Xiao-Yu, JIN Xue-Hui, ZHANG Ya-Ling
- 黑龙江省水稻穗褐变病病原菌的分离与鉴定
- Isolation and identification of pathogen causing rice panicle browning in Heilongjiang province
- 微生物学通报, 2020, 47(6): 1776-1786
- Microbiology China, 2020, 47(6): 1776-1786
- DOI: 10.13344/j.microbiol.china.190828
-
文章历史
- 收稿日期: 2019-10-14
- 接受日期: 2019-12-24
- 网络首发日期: 2020-02-23
2. 肇州县委组织部 黑龙江 大庆 166400
2. Organization Department of Zhaozhou County Party Committee, Daqing, Heilongjiang 166400, China
水稻穗褐变病(也称褐变穗、穗腐病、颖枯病、黑穗病)是近年来水稻生育后期穗部发生的一种病害,发病穗上谷粒常常褐变,对水稻产量和稻米品质都有很大的影响。该病在全国各稻区均有发生,且日趋严重,已成为影响水稻高产、稳产和优质的重要因素[1]。重病田块中丛发病率可达100%,穗发病率30%-95%,每穗病粒率30%-75%,受害稻穗结实率下降8%-10%。一般减产5%-10%,严重的达30%以上,甚至颗粒无收[2]。国内研究报道水稻穗褐变病主要由真菌引起,但各地的病原菌有所不同。黄世文等从杭州富阳水稻试验田穗腐病中主要分离到4种致病真菌,经鉴定为层出镰刀菌(Fusarium proliferatum)、细交链孢菌(Alternaria tenuis)、新月弯孢菌(Curvularia lunata)和澳大利亚平脐蠕孢菌(Bipolaris australiensis)[2]。费丹等报道安徽省引起水稻穗腐病的病原菌主要有层出镰刀菌(F. proliferatum)、细交链格孢菌(A. tenuis)、新月弯孢菌(C. lunata)、稻黑孢霉(Nigrospora oryzae)[3]。江西省引起水稻穗的褐变主要病原菌为厚垣镰刀菌(F. chlamydosporum)、细交链格孢菌(A. tenuissima)、香茅弯孢菌(C. cymbopogonis)和稻黑孢霉(N. oryzae)[4]。
水稻是黑龙江省主要的种植作物,种植面积居于第二位,水稻穗褐变病目前成为黑龙江省水稻生产中的主要病害,有逐年加重的趋势,影响水稻的产量和品质。2006年穆娟微等报道采集于佳木斯莲江口农垦水稻科研所试验区的水稻植株病穗,分离鉴定认为链格孢菌(A. alternate)是水稻穗褐变病的致病菌[5]。生产中该病害的防治主要依靠药剂,但防治效果一直不理想,本课题组在研究该病害的药剂筛选时,发现从水稻穗褐变的病穗中分离出多种菌,给研究工作带来困扰。为此,本研究对黑龙江省水稻种植区采集病样进行病原菌分离,以形态学为基础,结合分子生物学的方法对分离到的菌株进行鉴定,明确本地区水稻穗褐变的病原菌种类、优势种群及其年度间的差异,旨在为水稻穗褐变病防治提供科学依据。
1 材料与方法 1.1 样品供试病样:于水稻乳熟期至黄熟期从黑龙江省水稻各种植区采集水稻穗褐变的病样。
供试品种:空育131。
1.2 培养基、主要试剂和仪器PDA (g/L):马铃薯200.0,葡萄糖20.0,琼脂14.0。PSA (g/L):马铃薯200.0,蔗糖20.0,琼脂14.0。小麦粒培养基(g/L):小麦粒100.0。米饭培养基(g/L):大米3 000.0。Billai’s培养基(g/L):KH2PO4 1.0,KNO3 1.0,KCl 1.0,MgSO4·7H2O 0.5,淀粉0.2,葡萄糖0.2,蔗糖0.2,琼脂14.0。CMC (g/L):羧甲基纤维素钠15.0,NH4NO3 1.0,KH2PO4 0.5。异丙醇、异戊醇、氯仿,天津大茂化学试剂厂;Tris Base、EDTA-Na2、CTAB,宝泰克生物科技公司;PCR扩增引物,生工生物工程(上海)股份有限公司;Taq DNA聚合酶、DNA Marker 2000,TaKaRa公司;琼脂糖凝胶回收试剂盒,北京索莱宝科技有限公司。多功能生物显微镜,奥林巴斯株式会社;PCR扩增仪,Bio-Rad公司;低温高速离心机,赛多利斯(上海)贸易有限公司;凝胶成像仪,西蒙公司。
1.3 方法 1.3.1 水稻穗褐变病原菌的分离与纯化选取水稻穗褐变典型的病粒100个,按常规组织分离法分离[6],经预试验确定适宜消毒时间。为明确病粒带菌情况,将水稻病粒的颖壳和内部籽粒分开,分别用70%的酒精消毒5 s,再用漂白粉滤液消毒4 min,无菌水冲洗3次,置PDA平板培养基上(加入适量的链霉素),于25 ℃恒温培养箱中培养,菌落长出后,挑取边缘菌丝,再移接到PDA平板上培养。
在PDA平板培养基上产生分生孢子的分离菌,采用单孢进行纯化[6]。在PDA平板培养基上不产生孢子的分离菌,用CMC液体培养4 d产生大量孢子,进行单孢纯化。
1.3.2 致病性测定将水稻空育131进行育苗,秧苗3叶期时,移栽到桶里,常规管理,孕穗期末期将水稻植株移到室内为接菌备用。将分离的4株菌培养产孢后,用无菌水配成孢子悬浮液,浓度调为5×105个孢子/mL,在水稻抽穗扬花期用微量进样器将菌液从颖壳侧面上部注入颖壳内,至孢悬液刚刚溢出,每个处理接菌4穗,以接种无菌水的稻穗作为对照,接菌后套保鲜袋保湿12 h。每天观察发病情况,待穗发病后,取明显发病的籽粒重新分离病原菌,确定分离得到的病原菌是否为致病菌。
1.3.3 病原菌的鉴定(1) 病原菌的形态学鉴定
将分离菌用不同的培养基培养,观察描述菌落形态、菌落培养性状、质地、色泽等。于多功能生物显微镜上观察,测量分生孢子和分生孢子梗大小并拍照记录。根据《中国真菌志(链格孢属)》《水稻病原手册》《真菌鉴定手册》《中国真菌总汇》《常见镰刀菌鉴定指南》进行初步鉴定[7-11]。
(2) 病原菌的分子生物学鉴定
采用CTAB法提取菌株DNA,选用真菌通用引物ITS1 (5′-CCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)对菌株进行ITS序列扩增。PCR反应体系(25 μL):dNTP Mixture 4.0 μL、ITS1、ITS4 (10 μmol/mL)各1.0 μL、10×PCR buffer 5.0 μL、Taq DNA聚合酶0.25 μL、DNA 1.0 μL、ddH2O 12.75 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物经过1%琼脂糖凝胶进行电泳检测并回收,回收产物由北京奥科鼎盛生物科技有限公司进行测序。测序后通过NCBI数据库中进行BLAST比对,并提交至GenBank获得登录号,用MEGA7.0.26软件构建系统进化树。
1.3.4 不同地点水稻穗褐变病原菌的分离分离方法同1.3.1,分离出的菌初步纯化转接PDA平板培养基上,25 ℃恒温培养,培养7-10 d后,根据已鉴定出病菌的形态特征统计不同病原菌的数量。
2 结果与分析 2.1 病原菌的分离与致病性测定从水稻田间采集的病穗,经病菌的分离纯化得到4株主要分离物,根据菌落颜色、形态特征的不同,分别标为HBF、HBA、HBN、HBE。
水稻穗褐变田间主要发生在穗部,开始在水稻颖壳尖端或侧面出现淡褐色斑点,随着病斑扩大,变为深褐色或黑褐色不规则形,最后病斑扩展至整个谷粒(图 1A)。发病重的谷粒空瘪,结实率降低,稻米畸形变色,影响外观和品质。将4种分离物HBF、HBA、HBN、HBE在水稻抽穗扬花期对水稻穗进行回接致病性验证。接种12 h后,菌株HBF可见明显褐色病斑,菌株HBA可见褐色斑点,接种24 h后,菌株HBN、HBE可见斑点。接种7 d后,表现出与田间相同的症状(图 1B、C、D、E)。以无菌水接种的对照,未见病斑(图 1F)。从接种发病的穗上重新分离到该病原菌,证明分离物HBF、HBA、HBN、HBE是引起水稻穗褐变的病原菌。

|
| 图 1 水稻穗褐变田间发病症状及致病性测定结果 Figure 1 Symptoms of rice panicle browning in field and results of pathogenicity test 注:A:田间发病症状;B:接种HBF菌株7 d后的发病症状;C:接种HBA菌株7 d后的发病症状;D:接种HBN菌株7 d后的发病症状;E:接种HBE菌株7 d后的发病症状;F:无菌水接种未发病. Note: A: Symptoms in field; B: Symptoms on rice panicle at 7 days post inoculation (dpi) with HBF isolate; C: Symptoms on rice panicle at 7 dpi with HBA isolate; D: Symptoms on rice panicle at 7 dpi with HBN isolate; E: Symptoms on rice panicle at 7 dpi with HBE isolate; F: No visible symptom occurred on rice panicle inoculated with sterile water. |
|
|
将HBF菌株接种在PDA培养基、PSA培养基、小麦粒培养基、米饭培养基、Billai’s培养基培养。HBF菌株在PDA培养基上生长速度较快,气生菌丝较多、絮状,菌丝白色至紫红色,菌落中央菌丝黄色,菌落背面产生紫红色或暗红色色素(图 2A、B)。在PSA上气生菌丝棉絮状,白色至石竹紫,基物表面石竹紫。Billai’s上菌丝稀疏,草珠红,基物局部变粉红。米饭培养基上黄色。小型分生孢子少见,大型分生孢子在PDA培养基、PSA培养基上数量少,在Billai’s培养基、CMC培养基、麦粒培养基上产生大量大型分生孢子,形态较典型整齐,镰刀形,顶孢渐尖,基细胞足跟明显,多数3-5隔,大小(30.5-56.0) μm×(3.3-6.0) μm,单个孢子无色(图 2C)。厚垣孢子球形,产孢细胞单瓶梗(图 2D)。根据形态特征,将HBF菌初步鉴定为禾谷镰孢菌。
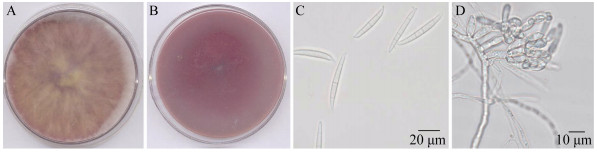
|
| 图 2 HBF菌株形态特征 Figure 2 Morphological characters of HBF strain 注:A:PDA培养菌落正面形态;B:PDA培养菌落背面;C:分生孢子;D:分生孢子梗及分生孢子. Note: A: Front morphology of colony on PDA; B: Back morphology of colony on PDA; C: Conidia; D: Conidiophore and conidia. |
|
|
HBF菌株PCR扩增及序列测定后,将ITS序列提交GenBank,获得其登录号为KU254606,在NCBI中进行ITS序列比对,HBF菌株与锐顶镰孢菌(Fusarium acuminatum)、禾谷镰孢菌(Fusarium graminearum)、黄色镰孢菌(Fusarium culmorum)序列相似性为99%,通过构建系统发育树,进行系统进化分析(图 3)。HBF菌株与这3种菌株聚在同一分支上,综合比较菌落的生长速度、颜色,孢子大小、形状和着生方式、足跟的有无等,HBF鉴定为禾谷镰孢菌。

|
| 图 3 基于ITS序列构建HBF菌株系统发育树 Figure 3 Phylogenetic tree of HBF strain based on ITS sequence 注:分支上的数据表示Bootstrap检验的支持百分率,自展支持值Bootstrap>50%的显示在各个进化分支节点上;括号内为GenBank序列号;图中标尺代表位点的碱基替代率. Note: The confidence values over 50% from 1 000 replicate bootstrap samplings are shown at each node. GenBank accession numbers are shown in the parentheses. Scale bar indicates the base substitution rate. |
|
|
HBA菌株在PDA培养基上平展,棉絮状,菌丝灰色至暗青褐色,背面黑色,气生菌丝发达,初无色或白色,后变为不同程度的黑褐色(图 4A、B)。在PCA培养基上菌丝稀疏,分生孢子梗单生,淡褐色或褐色,直或弯曲,分隔,大小(47-70) μm× (4.0-5.6) μm。分生孢子单生或短链生,倒梨形、倒棒状、卵形,褐色,表面光滑,具3-7个横隔膜和1-4个纵隔膜,分隔处略隘缩,大小(22.5-40.0) μm× (8.5-13.7) μm。短喙柱状,喙(0-19.5) μm× (2.5-4.5) μm (图 4C、D)。根据形态特征,将HBA菌株初步鉴定为链格孢菌。
|
| 图 4 HBA菌株形态特征 Figure 4 Morphological characters of HBA strain 注:A:PDA培养菌落正面形态;B:PDA培养菌落背面;C:PCA上产生的分生孢子;D:PCA上形成的分生孢子梗. Note: A: Front morphology of colony on PDA; B: Back morphology of colony on PDA; C: Conidia on PCA; D: Conidiophore on PCA. |
|
|
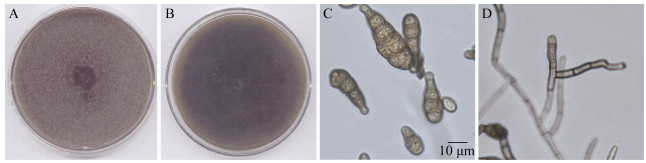
HBA菌株PCR扩增及序列测定后,将ITS序列提交GenBank,获得其登录号为KU254607,在NCBI中进行ITS序列比对,HBA菌株与链格孢属多个种的序列相似性为99%,通过构建系统发育树,进行系统进化分析(图 5)。HBA菌株与细极链格孢(Alternaria tenuissima)、链格孢(Alternaria alternata)、芸苔链格孢(Alternaria brassicae)、长柄链格孢(Alternaria longipes)在同一分支上。综合比较菌落的生长速度、颜色,分生孢子的大小、形状和着生方式,孢子梗的大小,喙的大小等,HBA鉴定为链格孢。
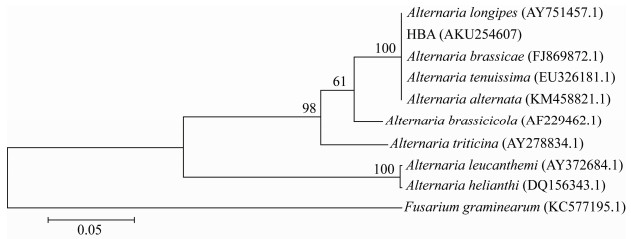
|
| 图 5 基于ITS构建HBA菌株系统发育树 Figure 5 Phylogenetic tree of HBA strain based on ITS sequence 注:分支上的数据表示Bootstrap检验的支持百分率,自展支持值Bootstrap>50%的显示在各个进化分支节点上;括号内为GenBank序列号;图中标尺代表位点的碱基替代率. Note: The confidence values over 50% from 1 000 replicate bootstrap samplings are shown at each node. GenBank accession numbers are shown in the parentheses. Scale bar indicates the base substitution rate. |
|
|
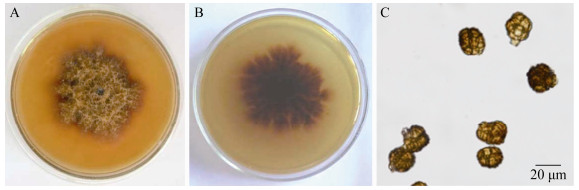
HBN在PDA培养基上,菌落初为白色,棉絮状,后渐变为黑色,生长较快(图 6A、B)。在PDA培养基上可大量产孢,分生孢子梗单生,直立,具隔膜,直径3.4-7.0 μm。分生孢子顶生在一个无色透明的瓶状细胞上,分生孢子扁球形或近球形,初呈黄褐色,后变为黑色,单胞,光滑,大小为(9.5-11.6) μm×(11-15.1) μm (图 6C)。

|
| 图 6 HBN菌株形态特征 Figure 6 Morphological characters of HBN strain 注:A:PDA培养菌落正面形态;B:PDA培养菌落背面;C:分生孢子梗及分生孢子. Note: A: Front morphology of colony on PDA; B: Back morphology of colony on PDA; C: Conidiophore and conidia. |
|
|
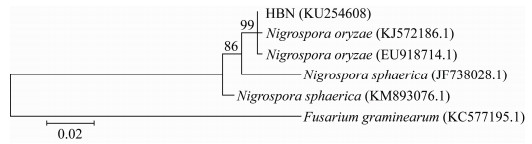
HBN菌株PCR扩增及序列测定后,将ITS序列提交GenBank,获得其登录号为KU254608,在NCBI中进行ITS序列比对,HBN菌株与稻黑孢霉(Nigrospora oryzae)登录号为EU918714.1和KJ572186.1,序列相似性为99%,通过构建系统发育树进行系统进化分析(图 7)。HBN菌株与Nigrospora oryzae在同一分支上,结合形态特征,HBN鉴定为稻黑孢霉。
|
| 图 7 基于ITS序列构建HBN菌株系统发育树 Figure 7 Phylogenetic tree of HBN strain based on ITS sequence 注:分支上的数据表示Bootstrap检验的支持百分率,自展支持值(Bootstrap)>50%的显示在各个进化分支节点上;括号内为GenBank序列号;图中标尺代表位点的碱基替代率. Note: The confidence values over 50% from 1 000 replicate bootstrap samplings are shown at each node. GenBank accession numbers are shown in the parentheses. Scale bar indicates the base substitution rate. |
|
|
HBE在PDA培养基上,菌落初白色,后逐渐变为正面黄色或橘黄色,菌落背面为黄褐色,生长后期分泌黄色或红褐色色素(图 8A、B)。有些菌株生长过程中在圆形菌落中可出现V形区域。在PDA上产生的分生孢子聚集成堆。分生孢子座褐色、黑色,散生或聚生。分子孢子球形、近球形,黄褐色或深褐色,网格状分生孢子,表面有疣瘤,孢子大小(14.4-19.9) μm×(16.0-22.5) μm,未成熟的孢子有淡色的柄细胞(图 8C)。
|
| 图 8 HBE菌株形态特征 Figure 8 Morphological characters of HBN strain 注:A:PDA培养菌落正面形态;B:PDA培养菌落背面;C:分生孢子. Note: A: Front morphology of colony on PDA; B: Back morphology of colony on PDA; C: Conidia. |
|
|
HBE菌株PCR扩增及序列测定后,将ITS序列提交GenBank,获得其登录号为KU254609,在NCBI中进行ITS序列比对,HBE菌株与5个黑附球(Epicoccum nigrum)菌株的序列覆盖率为99%,相似性达到100%。通过构建系统发育树,进行系统进化分析(图 9)。HBE菌株与Epicoccum nigrum在同一分支上,HBE鉴定为黑附球菌。

|
| 图 9 基于ITS序列构建HBE菌株系统发育树 Figure 9 Phylogenetic tree of HBE strain based on ITS sequence 注:括号内为GenBank序列号;图中标尺代表位点的碱基替代率. Note: GenBank accession numbers are shown in the parentheses. Scale bar indicates the base substitution rate. |
|
|
2013年、2014年和2016年从不同地点采集病穗,将水稻病粒的颖壳和内部籽粒分开分离病菌,分离出4种主要病原菌,不同年份、不同采集点病菌分离的比例差异明显(表 1、表 2)。
| 年份 Year |
采集点 Collectionpoint |
品种 Varieties |
病原菌出现的频率 Theisolation frequencies of pathogens (%) |
||||
| Fusariumgraminearum | Alternariaalternata | Nigrospora oryzae | Epicoccumnigrum | ||||
| 2013 | 同江市 Tongjiang city |
前进农场 Qianjinfarm |
空育131 Kongyu131 |
46.3 | 19.0 | 21.1 | 4.2 |
| 龙粳37 Longjing37 |
42.3 | 28.2 | 25.6 | 2.6 | |||
| 双鸭山市 Shuangyashancity |
853农场 853farm |
龙粳31 Longjing31 |
29.3 | 20.2 | 35.4 | 2.0 | |
| 红旗岭农场 Hongqilingfarm |
龙粳31 Longjing 31 |
44.4 | 17.2 | 30.3 | 1.0 | ||
| 2014 | 同江市 Tongjiang city |
前进农场 Qianjinfarm |
龙粳37 Longjing 37 |
8.8 | 58.9 | 15.3 | 11.2 |
| 鸡西市 Jixicity |
856农场 856farm |
龙粳31Longjing 31 | 5.0 | 60.0 | 11.7 | 8.3 | |
| 未知Unknown | 7.7 | 13.2 | 65.9 | 8.8 | |||
| 齐齐哈尔市 Qiqihaer city |
甘南县 Gannancounty |
未知Unknown | 9.3 | 37.3 | 21.3 | 25.3 | |
| 富裕县 Fuyucounty |
未知Unknown | 2.0 | 76.0 | 4.0 | 2.0 | ||
| 泰来县 Tailaicounty |
未知Unknown | 2.0 | 48.0 | 4.0 | 2.0 | ||
| 哈拉海农场 Halahaifarm |
未知Unknown | 14.3 | 27.1 | 14.3 | 18.6 | ||
| 伊春市 Yichuncity |
铁力农场 Tielifarm |
未知Unknown | 9.5 | 60.3 | 12.7 | 17.5 | |
| 2016 | 同江市 Tongjiangcity |
前进农场 Qianjin farm |
垦稻03-169 Kendao 03-169 |
4.4 | 24.4 | 50.0 | 8.0 |
| 双鸭山市 Shuangyashancity |
597农场 597 farm |
兴盛518 Xingsheng518 |
0.0 | 2.7 | 90.0 | 0.0 | |
| 垦稻3 Kendao3 |
0.0 | 10.0 | 84.0 | 0.0 | |||
| 虎林市 Hulincity |
854农场 854farm |
稼合1号 Jiahe 1 |
40.8 | 5.0 | 42.3 | 4.4 | |
| 鸡西市 Jixicity |
856农场 856 farm |
龙粳46 Longjing 46 |
0.0 | 32.6 | 18.4 | 28.0 | |
| 鹤岗市 Hegangcity |
普阳农场 Puyang farm |
龙粳46 Longjiang 46 |
46.5 | 2.4 | 78.1 | 12.5 | |
| 江滨农场 Jiangbin farm |
龙粳31 Longjing 31 |
12.1 | 12.5 | 72.8 | 18.0 | ||
| 年份 Year |
采集点 Collectionpoint |
品种 Varieties |
病原菌出现的频率 Theisolation frequencies of pathogens (%) |
||||
| Fusariumgraminearum | Alternariaalternata | Nigrosporaoryzae | Epicoccumnigrum | ||||
| 2013 | 同江市 Tongjiang city |
前进农场 Qianjin farm |
空育131 Kongyu131 |
45.0 | 26.7 | 1.7 | 11.7 |
| 龙粳37 Longjing37 |
49.3 | 34.3 | 1.7 | 6.0 | |||
| 双鸭山市 Shuangyashan city |
853农场 853 farm |
龙粳31 Longjing31 |
33.3 | 40.0 | 4.4 | 4.4 | |
| 红旗岭农场 Hongqiling farm |
龙粳31 Longjing 31 | 47.3 | 27.0 | 1.4 | 5.4 | ||
| 2014 | 同江市 Tongjiang city |
前进农场 Qianjin farm |
龙粳37 Longjing 37 | 6.9 | 50.0 | 8.3 | 4.6 |
| 鸡西市 Jixi city |
856农场 856 farm |
龙粳31 Longjing 31 | 4.3 | 58.6 | 21.4 | 5.7 | |
| 未知Unknown | 9.8 | 45.1 | 7.8 | 19.6 | |||
| 齐齐哈尔市 Qiqihaercity |
甘南县 Gannan county |
未知Unknown | 19.5 | 36.6 | 9.8 | 19.5 | |
| 富裕县 Fuyu county |
未知Unknown | 2.5 | 80.0 | 1.3 | 6.3 | ||
| 泰来县 Tailai county |
未知Unknown | 2.0 | 30.0 | 0.0 | 4.0 | ||
| 哈拉海农场 Halahai farm |
未知Unknown | 22.4 | 23.7 | 1.3 | 7.9 | ||
| 伊春市 Yichun city |
铁力农场 Tieli farm |
未知Unknown | 10.2 | 67.4 | 6.1 | 16.3 | |
| 2016 | 同江市 Tongjiang city |
前进农场 Qianjin farm |
垦稻03-169 Kendao 03-169 |
22.7 | 30.1 | 8.9 | 22.1 |
| 双鸭山市 Shuangyashan city |
597农场 597 farm |
兴盛518 Xingsheng 518 |
2.0 | 26.5 | 30.0 | 0.0 | |
| 垦稻3 Kendao3 |
0.0 | 34.1 | 4.4 | 4.0 | |||
| 虎林市 Hulin city |
854农场 854 farm |
稼合1号 Jiahe 1 |
37.1 | 33.0 | 1.3 | 33.0 | |
| 鸡西市 Jixi city |
856农场 856 farm |
龙粳46 Longjing 46 |
18.2 | 16.4 | 18.5 | 26.2 | |
| 鹤岗市 Hegang city |
普阳农场 Puyang farm |
龙粳46 Longjing 46 |
36.5 | 2.0 | 16.0 | 8.0 | |
| 江滨农场 Jiangbin farm |
龙粳31 Longjing 31 |
6.0 | 26.3 | 4.0 | 10.0 | ||
去除内部籽粒的褐变颖壳带菌分离结果见表 1。2013年禾谷镰孢(Fusarium graminearum)分离频率较高,为42.3%-46.3%,是优势病原菌,其次是稻黑孢霉(Nigrospora oryzae)和链格孢菌(Alternaria alternata),分离的频率分别为21.1%-35.4%、17.2%-28.2%,黑腐球菌(Epicoccum nigrum)分离的频率低于5%。2014年采集的病穗,链格孢菌数量较高,为27.1%-76.0%,是优势病原菌,其次是稻黑孢霉。黑附球菌在齐齐哈尔市的甘南县分离频率较高,为25.3%,禾谷镰孢分离比例总体较低;2016年采集的病穗,除856农场稻黑孢霉分离出的数量偏低,其他采集点分离出的数量均是最高,分离频率为42.3%-90.0%,是优势病原菌。虎林市的854农场和鹤岗市的普阳农场禾谷镰孢分离出的数量也较高,分别占40.8%和46.5%。
将去除病壳的籽粒进行病菌分离,结果见表 2。2013年禾谷镰孢分离频率最高,为29.3%-46.3%,其次是链格孢菌,分离的频率为26.7%%-40.0%;2014年链格孢菌分离频率最高,为23.7%-80.0%,其他3种菌的分离频率总体差异不大;2016年分离去壳籽粒,禾谷镰孢菌在前进农场、854农场和普阳农场分离频率较高分别为22.7%、37.1%、36.5%。链格孢菌在前进农场、597农场、854农场和江滨农场分离频率较高,分别为30.1%、34.1%、33.0%、26.3%。稻黑孢霉菌在597农场分离频率高,占50.0%,黑附球菌在虎林市854农场、鸡西市856农场分离频率高,分别为33.0%、26.2%。
3 讨论与结论对黑龙江省水稻主产区的水稻穗褐变病进行病原菌分离与鉴定,分离得到4种主要真菌,经鉴定和致病性验证确定禾谷镰孢、链格孢、稻黑孢霉和黑附球菌是主要致病菌,这与已报道的水稻穗褐变的病原菌不完全相同,不同地区差异较大。本研究确定的4种致病菌与黄世文等报道引起杭州水稻穗腐病(穗褐变)的4种致病菌层出镰刀菌、细交链孢菌、新月弯孢菌和澳大利亚平脐蠕孢菌完全不同[2]。这可能与病原菌的地域分布有关。本研究分离出的稻黑孢霉分离频率较高,并对水稻谷粒有致病性,是水稻穗褐变的主要致病菌之一,这与费丹和胡颂平等报道稻黑孢霉是引起安徽省、江西省水稻穗腐病的病原菌之一的结果一致[3-4]。张俊华等对黑龙江省主要水稻种植区的褐变穗采样进行病原菌分离,只证明链格孢菌是主要病原菌[12]。本研究确定禾谷镰孢、链格孢、稻黑孢霉和黑附球菌是引起水稻穗谷粒褐变的主要致病菌,这与张俊华等研究的结果不一致,可能与病穗取样年份、分离消毒时间不同、分离出病菌的比例不同有关。本研究首次确定禾谷镰孢、稻黑孢霉和黑附球菌是黑龙江省水稻穗褐变病的致病菌。在研究4种分离菌致病性验证试验中发现禾谷镰孢和链格孢引起穗褐变严重,有较强的致病性,稻黑孢霉和黑附球菌引起穗褐变较轻,说明致病性弱。有文献报道细菌颖壳伯克氏菌(Burkholderia glumae)也可引起稻穗谷粒褐变[4]。本研究在分离的过程中也有细菌的出现,但对水稻是否有致病性没有进一步研究,在将来的研究工作中可进行探讨。
2013年黑龙江东部水稻穗褐变发生严重,从2个市3个采集点分离病样,无论是颖壳还是去除颖壳的籽粒禾谷镰孢分离频率都是最高,是优势致病菌,病菌不仅侵染颖壳还能扩展到颖壳内部的籽粒,其次是链格孢菌分离频率较高。2014年水稻穗褐变的发生轻于2013年,从黑龙江各水稻种植区4个市8个采集点分离病样,链格孢菌分离频率均最高,是优势病原菌,稻黑孢霉菌于2013年和2016年采集病样分离颖壳,多数采集点分离出的频率较高,但去除颖壳的籽粒稻黑孢霉菌分离的频率明显降低,可能病菌主要侵染颖壳,很少扩展到内部籽粒。不同年份、不同地区分离病原菌的比率明显不同,可能与地理环境、气候变化有密切关系。
水稻穗褐变病(穗腐病)各地由不同病原菌引起,抗病育种工作者应针对当地主要病原种群进行育种。另外,今后应加强药剂筛选,筛选出对4种病原菌抑制效果较好的药剂,以期更好地防控水稻穗褐变病。
| [1] |
Li L, Liu LM, Wang GR, et al. Research progress of spikelet rot disease and bacterial panicle blight of rice[J]. Chinese Journal of Rice Science, 2015, 29(2): 215-222. (in Chinese) 李路, 刘连盟, 王国荣, 等. 水稻穗腐病和穗枯病的研究进展[J]. 中国水稻科学, 2015, 29(2): 215-222. DOI:10.3969/j.issn.1001-7216.2015.02.014 |
| [2] |
Huang SW, Wang L, Liu LM, et al. Isolation, identification and biological characters of pathogens of rice spikelet rot disease[J]. Chinese Journal of Rice Science, 2012, 26(3): 341-350. (in Chinese) 黄世文, 王玲, 刘连盟, 等. 水稻穗腐病病原分离、鉴定及生物学特性[J]. 中国水稻科学, 2012, 26(3): 341-350. |
| [3] |
Fei D, Tan GJ, Luo DH. Identification and characterization of rice spikelet rot disease pathogens in Anhui province[J]. Journal of Anhui Agricultural University, 2014, 41(5): 777-782. (in Chinese) 费丹, 檀根甲, 罗道宏. 安徽省水稻穗腐病病原鉴定及生物学特性研究[J]. 安徽农业大学学报, 2014, 41(5): 777-782. |
| [4] |
Hu SP, Yu J, Wei KF, et al. Studies on the biological characteristics and pathogenic identification of rice spikelet rot disease in Jiangxi province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(2): 234-242. (in Chinese) 胡颂平, 余建, 魏开发, 等. 江西水稻穗腐病病原菌鉴定及生物学特性研究[J]. 江西农业大学学报, 2019, 41(2): 234-242. |
| [5] |
Mu JW, Li P, Li DP, et al. New disease of rice-rice brown ear[J]. Modernizing Agriculture, 2005(10): 1-2. (in Chinese) 穆娟微, 李鹏, 李德萍, 等. 水稻新病害-水稻褐变穗[J]. 现代化农业, 2005(10): 1-2. DOI:10.3969/j.issn.1001-0254.2005.10.007 |
| [6] |
Fang ZD. Plant Disease Research Method[M]. 3rd ed. Beijing: China Agriculture Press, 1998: 137-338. (in Chinese) 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 137-138. |
| [7] |
Zhang TY. Flora Fungorum Sinicorum (Alternaria)[M]. Beijing: Science Press, 2003: 32-38. (in Chinese) 张天宇. 中国真菌志(链格孢属)[M]. 北京: 科学出版社, 2003: 32-38. |
| [8] |
Wei JC. Rice Pathogens Handbook[M]. Beijing: Science Press, 1975: 187-189. (in Chinese) 魏景超. 水稻病原手册[M]. 北京: 科学出版社, 1975: 187-189. |
| [9] |
Wei JC. Fungus Identification Handbook[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1979: 947. (in Chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 947. |
| [10] |
Dai FL. Sylloge Fungorum Sinicorum[M]. Beijing: Science Press, 1979: 539. (in Chinese) 戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979: 539. |
| [11] |
Wang GC, Zheng Z, Ye QM, et al. Guidelines for Identification of Common Fusarium[M]. Beijing: China Agriculture Science and Technology Press, 1996: 22-23, 35-44. (in Chinese) 王拱辰, 郑重, 叶琪明, 等. 常见镰刀菌鉴定指南[M]. 北京: 中国农业科技出版社, 1996: 22-23, 35-44. |
| [12] |
Zhang JH, Li YP, Han YT, et al. Study on pathogen identification and biological characteristics of rice brown panicle disease in Heilongjiang Province[J]. Journal of Northeast Agricultural University, 2018, 49(1): 27-38, 46. (in Chinese) 张俊华, 李云鹏, 韩雨桐, 等. 黑龙江省水稻褐变穗病病原鉴定及生物学特性研究[J]. 东北农业大学学报, 2018, 49(1): 27-38, 46. DOI:10.3969/j.issn.1005-9369.2018.01.004 |
 2020, Vol. 47
2020, Vol. 47