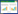扩展功能
文章信息
- 勾文君, 田源, 孔小勇, 吴菲菲, 方芳
- GOU Wen-Jun, Tian Yuan, Kong Xiao-Yong, Wu Fei-Fei, Fang Fang
- 洋河酒窖泥细菌群落结构与菌株产酸能力分析
- Bacterial composition in pit mud of Yanghe liquor and identification of acid producing bacteria
- 微生物学通报, 2020, 47(6): 1651-1661
- Microbiology China, 2020, 47(6): 1651-1661
- DOI: 10.13344/j.microbiol.china.190839
-
文章历史
- 收稿日期: 2019-10-17
- 接受日期: 2019-12-19
- 网络首发日期: 2019-12-23
2. 江南大学未来食品科学中心 江苏 无锡 214122;
3. 江苏洋河酒厂股份有限公司 江苏 宿迁 223800
2. Science Center for Future Foods, Jiangnan University, Wuxi, Jiangsu 214122, China;
3. Jiangsu Yanghe Distillery Company Limited, Suqian, Jiangsu 223800, China
浓香型白酒是我国三大基本香型白酒之一,具有入口甜、落口绵、窖香浓郁、绵柔甘洌、香味协调、尾净余长等特点[1-2]。自古以来就有“老窖出好酒”的说法,窖泥对浓香型白酒的品质和风味有重要的影响。窖泥细菌代谢产生的丁酸和己酸是浓香型白酒中四大有机酸中的两个重要有机酸[3],在酒中起到呈香、助香、减少酒体刺激以及缓冲平衡的作用[4-5]。因此,窖泥细菌的组成和数量是对浓香型白酒风味产生影响的因素之一[6-7]。解析浓香型白酒窖泥细菌组成及其随窖龄改变的变化规律,研究窖泥细菌产有机酸的特性,对于揭示窖泥微生物群落结构与功能及其在浓香型白酒生产中的应用具有重要意义。
浓香型白酒中的有机酸主要包括乙酸、乳酸、丁酸和己酸。与乙酸和乳酸合成相关的微生物主要来自酒醅[8]。丁酸和己酸对浓香型白酒的酒体和风味也有着重要影响。其中,己酸呈味助香,丁酸愉悦的水果香味能显著增强“窖香”。这两种有机酸主要由窖泥中瘤胃菌科(Ruminococcaceae)和梭菌科(Clostridiaceae_1)的细菌合成[8-9]。窖泥微生物不可培养和未识别菌属较多,而且存在相互影响或相互促进的同生、共生关系[10-12]。对不同窖龄窖泥微生物组成的研究发现,Ruminococcaceae是剑南春窖泥中的核心微生物,其丰度随着窖龄变化呈显著差异[13]。己酸菌是属于梭菌纲的细菌,其是合成浓香型白酒的主体呈香物质己酸乙酯前体己酸的主要微生物,在白酒生产中常通过人工窖泥的方法强化于窖泥中[14]。目前,阐明白酒发酵机制以及提高酒体品质的主要途径仍是分离得到纯培养物并对其代谢能力进行研究[15]。因此,在全面了解窖泥细菌组成的基础上,研究分离得到的功能微生物的产酸性能对阐明菌株的功能具有重要意义。
本研究以洋河酒厂生产浓香型白酒不同窖龄窖池的窖泥为研究对象,通过解析其微生物群落结构,分离厌氧细菌并研究其产丁酸和己酸的能力,以期对解析窖泥微生物与浓香型白酒中相关风味物质的合成奠定理论基础。
1 材料与方法 1.1 实验材料 1.1.1 窖泥研究所用窖泥样品取自江苏洋河酒厂股份有限公司,窖龄分别为3年(N3)、5年(N5)、20年(N20)。每个窖池的窖泥分别取自窖底和四壁,混合均匀后装入无菌袋,于-80 ℃冻存。每个窖龄的窖泥均取3口窖池作为平行样,分别用于微生物宏基因组的制备以及菌株的筛选分离。
1.1.2 培养基强化梭菌培养基(RCM)(g/L):蛋白胨10.0,牛肉浸粉10.0,酵母浸粉3.0,葡萄糖5.0,可溶性淀粉1.0,氯化钠5.0,L-半胱氨酸盐酸盐0.5,琼脂20.0,pH 6.8。
乙酸钠培养基(g/L):乙酸钠5.0,硫酸铵0.5,硫酸镁0.2,磷酸氢二钾0.4,酵母膏1.0,碳酸钙10.0,使用前加入2% (体积比)乙醇。
TSN培养基(g/L):胰蛋白胨15.00,酵母浸粉10.00,亚硫酸钠1.00,柠檬酸铁0.50,多粘菌素B 0.02,硫酸新霉素0.05,琼脂13.50,pH 7.2。
丁酸培养基(g/L):葡萄糖30.00,蛋白胨0.15,氯化钠5.00,硫酸镁0.10,牛肉膏8.00,氯化铁0.50,碳酸钙5.00,磷酸氢二钾1.00。
1.1.3 主要试剂和仪器丁酸、己酸、2-乙基丁酸标准品,Sigma-Aldrich公司;TrueSeq® DNA PCR-Free Sample Preparation建库试剂盒,Illumina公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;其他试剂购自国药集团化学试剂有限公司。厌氧培养罐及产气袋,三菱公司;高效液相色谱仪,安捷伦公司;气相色谱仪,岛津公司;PCR仪,Bio-Rad公司;HiSeq 2500 PE250仪,Illumina公司;NanoDrop 2000超微量分光光度计,Thermo Fisher公司。
1.2 窖泥细菌群落结构分析 1.2.1 窖泥细菌基因组DNA的制备与测序采用液氮研磨与试剂盒抽提相结合的方法对窖泥微生物宏基因组DNA进行制备[8]。称取3 g窖泥样品,液氮研磨至细粉状。加入10 mL预热至65 ℃的CTAB (溴化十六烷三甲基铵20 g/L,氯化钠81.82 g/L,1 mol/L pH 8.0的Tris-HCl 100 mL,0.5 mol/L EDTA 40 mL)抽提液,4 ℃、4 000 r/min离心10 min取上清液,加入等体积的苯酚氯仿异戊醇(V1:V2:V3=25:4:1)抽提,4 ℃、10 000 r/min离心10 min取上清液,加入0.6倍体积的异丙醇沉淀2 h,75%乙醇洗涤,加入50 μL ddH2O溶解,于-20 ℃保存。使用NanoDrop 2000超微量分光光度计测定DNA浓度及纯度,样品达到测序要求后送北京百迈客生物科技有限公司进行测定[16]。
采用细菌16S rRNA基因的V3-V4测序区域的通用引物341F (5′-CCTAYGGGRBGCASCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′)[8],根据选定的特定测序区域,利用带Barcode的特异引物进行PCR。PCR反应体系(20 μL):5×TransStart® FastPfu Buffer 4 μL,dNTPs (2.5 mmol/L) 2 μL,TransStart® FastPfu DNA Polymerase (2.5 U/μL) 0.5 μL,正、反向引物(10 μmol/L)各0.5 μL,样品DNA 2 μL,ddH2O 10.5 μL。PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。通过琼脂糖凝胶电泳检测PCR产物质量,根据产物浓度进行纯化,利用TrueSeq® DNA PCR-Free Sample Preparation建库试剂盒构建文库,最后通过HiSeq2500 PE250进行测序。
1.2.2 高通量测序数据处理与分析将下机数据通过Barcode和PCR扩增引物序列拆分为各样品的数据,去掉Barcode和引物序列,利用FLASH软件对所有样品的Read进行拼接,从而获得有效的序列文件[17],在此基础上对测序数据进行质控,得到合格的有效数据。利用UPARSE软件对上述获得的有效序列进行聚类,将相似度大于97%的序列聚集为操作分类单元(operational taxonomic unit,OTU)[18-19],通过Mothur方法与Silva的SSU rRNA数据库进行物种注释并计算样品的Chao1、Shannon和Goods-coverage指数[20]。对细菌间相关性分析则先将16S扩增子测序的种属数量标准化,然后进行Spearman秩相关分析并进行统计检验,计算出各个物种之间的相关性后,根据相关系数绝对值,从所有物种中挑选出相关性最高的前30组数据,基于Cytoscape绘制细菌间关系分析网络图[21]。
1.3 厌氧细菌的分离与鉴定称取10 g窖泥与100 mL TPS (胰蛋白胨10 g/L,酵母膏5 g/L,氯化钠10 g/L)混合,80 ℃热处理10 min以杀死非芽孢状态的菌体及其他营养细胞[22],室温放置20 min富集菌体,再置于80 ℃处理10 min,冷却至30-40 ℃,取1 mL菌液稀释涂布RCM、乙酸钠和TSN培养基,37 ℃厌氧培养2-5 d[23]。挑取不同形态的菌落划线分离3次后得到各菌株的单菌落用于后续分析。
使用细菌基因组DNA提取试剂盒提取细菌基因组DNA。用细菌16S rRNA基因的通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增体系(25 μL):2×ExTaq酶12.5 μL,ddH2O 11 μL,上、下游引物(10 μmol/L)各0.5 μL,模板DNA (10 ng/μL) 0.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共34个循环;72 ℃ 5 min。PCR产物纯化后送无锡天霖测序公司测序。将测序所得16S rRNA基因序列提交至GenBank进行BLAST比对,鉴定细菌的种属。
1.4 厌氧细菌产酸能力分析 1.4.1 细菌产己酸的定性分析菌株产己酸能力的定性分析采用硫酸铜显色法[24]。挑取单菌落接入RCM液体培养基,37 ℃静置厌氧培养12-18 h至OD600为0.9-1.1,以10%接种量接种至乙酸钠培养基,厌氧培养9 d。取2 mL培养液,加入2 mL 2%的硫酸铜溶液和1 mL乙醚,振荡摇匀后静置使之分层。观察乙醚层颜色,判断是否产己酸。如呈蓝色,表明有己酸合成。
1.4.2 有机酸定量分析将活化后的菌株以10%接种量接入乙酸钠液体培养基以及丁酸培养基分别厌氧发酵11 d和9 d。测定发酵液中己酸含量时,将发酵上清液经2 mol/L的硫酸酸化至pH为2.0后,4 ℃、10 000 r/min离心10 min,再用0.22 μm滤膜过滤。将前处理的发酵液与内标(0.1 g/L 2-乙基丁酸)以10:1的体积比混匀,利用气相色谱仪测定己酸含量[25]。用于测定丁酸的发酵上清液经0.22 μm滤膜过滤后与内标(0.1 g/L 2-乙基丁酸)以10:1的体积比混匀后测定。
气相色谱分析条件:色谱柱为HP-INNOWax Agilent 30 m×0.25 mm×0.25 μm;进样口温度:250 ℃;检测器温度:250 ℃;柱流速:恒流1.0 mL/min;分流模式:20:1;进样量:1 μL;柱温程序升温:(HP-INNOWax Agilent) 40 ℃ (保持1 min),以8 ℃/min升温至100 ℃ (保持1 min),再以6 ℃/min升温至220 ℃ (保持1 min)[26]。
2 结果与分析 2.1 浓香型白酒窖泥细菌群落结构解析 2.1.1 窖泥细菌α-多样性分析为了了解不同窖龄窖泥细菌的组成和多样性变化,研究利用高通量测序对窖龄分别为3、5、20年的窖泥样品进行细菌16S rRNA基因测序。分别从3、5、20年窖泥样品中读取到130 460、75 885、106 617条序列。三类窖泥中细菌OTU覆盖度均达到99.8%以上,表明所测样本物种丰富度较高,未被检测到的序列概率很低,基本可以客观反映窖泥样本中细菌群落的真实情况,满足后续细菌群落结构的分析。由表 1可知,3年窖龄窖泥细菌组成的OTU数量、Chao1指数、Shannon指数均最高,表明其细菌群落最为丰富;5年窖龄窖泥细菌群落组成趋于简单。随着窖龄的增加,上述表征细菌组成多样性的指数均呈现一个先降后增的趋势。这可能是因为新窖泥中含有较多杂菌,随着窖泥的初步老化成熟,杂菌减少,细菌多样性降低;而在不断的驯化以及菌群动态更替过程中,适应窖池环境的功能菌群逐渐被富集,窖泥细菌菌群多样性及丰度又有所增大[27-28]。
| 样品分组Sample group | 操作分类单元OTUs | 丰富度指数Chao1 index | 多样性指数Shannon index | 覆盖率Coverage (%) |
| N3 | 393 | 434.05 | 4.048 | 99.97 |
| N5 | 297 | 361.90 | 2.978 | 99.89 |
| N20 | 330 | 366.56 | 3.940 | 99.96 |
| Note: N3, N5, N20: Pit mud of 3 y, 5 y and 20 y. | ||||
为了分析窖龄对窖泥样品细菌组成的影响,基于Bray_curtis距离对其细菌群落进行主坐标轴分析(PCoA)[29]。结果如图 1所示,相同窖龄的窖泥均集中在一个簇,不同窖龄窖泥分布在不同的簇。这说明同一窖龄的窖泥细菌群落结构相似,不同窖龄窖泥之间存在差异,窖泥细菌群落结构组成与窖龄有显著的关系。因此,利用细菌群落组成特征对窖泥质量进行判定以及相关功能预测具有一定的科学依据。
|
| 图 1 窖泥细菌群落的主成分分析 Figure 1 Principal component analysis of bacterial communities in pit mud |
|
|
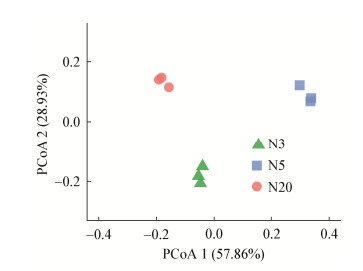
对窖泥细菌群落的组成分析表明,洋河酒窖泥中的细菌主要分布于梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、互营养菌纲(Synergistia)和芽孢杆菌纲(Bacilli) (图 2A)。窖泥中梭菌纲细菌丰度虽然随窖龄改变有一定变化,但仍然是窖泥细菌中的优势菌(丰度大于60%),说明其可在窖泥中长期定殖。芽孢杆菌纲细菌的丰度随窖龄增加而逐渐减少,这可能是窖池长期处于厌氧状态的驯化结果。此外,通过测序分析发现窖泥中细菌分别属于98个属,其中丰度大于0.1%的菌属有21个,己酸菌(Caproiciproducens)和梭菌(uncultured_bacterium_ f_Clostridiaceae_1)是其中的优势菌属(图 2B)。不同窖龄窖泥细菌群落组成在属分类水平上存在一定的差异。其中,3年窖龄窖泥优势细菌主要为:Caproiciproducens (14.52%),Proteiniphilum (10.10%),Fermentimonas (7.15%),Syntrophomonas (5.50%);5年窖龄窖泥中优势细菌主要为:Caproiciproducens (46.88%),Uncultured_bacterium_f_Clostridiaceae_1 (12.49%),Hydrogenispora (6.24%);20年窖龄的窖泥中优势细菌主要为:Caproiciproducens (14.65%),Uncultured_bacterium_f_Clostridiaceae_1 (16.21%),Fermentimonas (7.23%),Fastidiosipila (6.12%),Uncultured_bacterium_f_Marinilabiliaceae (5.60%),Ruminiclostridium (3.01%)。
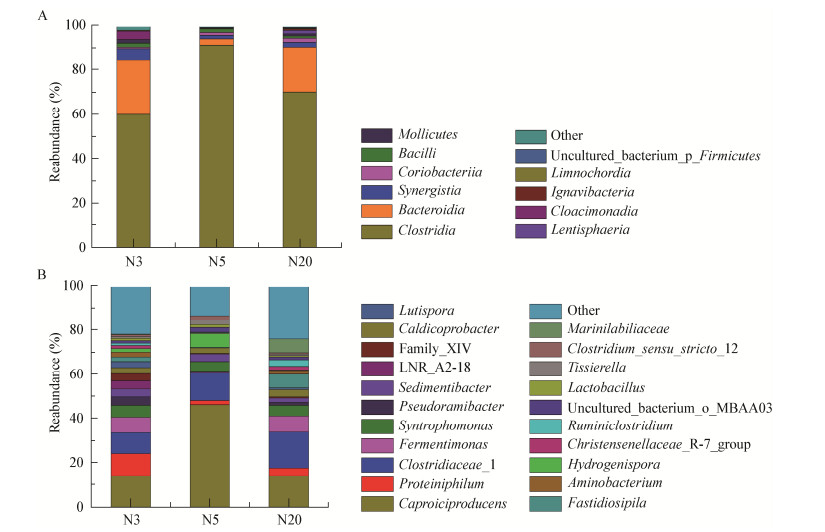
|
| 图 2 窖泥细菌群落在纲水平(A)和属水平(B)的结构分布 Figure 2 Distribution of bacterial communities at class level (A) and genus level (B) in pit mud |
|
|
窖泥中己酸菌(Caproiciproducens)的组成变化较为显著,其丰度在3、5年有显著增加,从14.52%增加到46.88%,20年时其丰度又降至14.65%。Caproiciproducens是能代谢产生氢气、乙醇、乙酸、丁酸和己酸的重要白酒功能菌,是浓香型白酒中的特征香味物质己酸乙酯的主要合成菌[30-32]。梭菌属(Clostridiaceae_1)微生物含量随着窖泥窖龄的增加逐步累积,不仅有利于白酒中特定风味物质的形成,还可以通过多样的菌群促进窖泥生态体系碳、氮及硫元素循环、维持窖泥微生物结构的稳定性[33]。此外,洋河酒窖泥中Hydrogenispora、Ruminiclostridium和Uncultured_bacterium_f_Lachnospiraceae等菌属在驯化过程中出现并逐渐成为占比较大的微生物菌群。这些微生物的出现和丰度上的增长可能与窖泥中存在梭菌相关。已有报道证实,Hydrogenispora、Ruminiclostridium和Uncultured_bacterium_f_Lachnospiraceae等菌属的细菌可将难利用的物质(如纤维素)转化为可利用的碳源(乙酸、丁酸、氢等),可能对梭菌属微生物的生长和增殖有一定的促进作用[34]。
2.2 窖泥细菌间关系分析窖泥微生物所处环境条件复杂多变,微生物为了生存和生长,在驯化过程中彼此之间形成了不同的关系以适应困难条件和环境的变化。为揭示白酒窖内发酵微生态体系中细菌间的这些关系,对包含3、5和20年窖龄窖泥的98个菌属中含量前30的菌属(分布于Bacilli、Bacteroidales、Ignavibacteria、Synergistia、Coribacteriia、Clostridiales、Bacteroidia 7个目)进行了Spearman秩相关性分析。结果表明,共存在76对正相关细菌和35对负相关细菌(图 3)。窖泥细菌间只存在正相关关系的细菌均属于梭菌目Clostridiales (uncultured_bacterium_f_Clostridiaceae_1、Lutispora、uncultured_bacterium_f_SRB2),此菌目中细菌占总菌丰度的70%,是窖泥中的绝对优势细菌,而与之相关联的细菌之间多为相互促进关系。由图 3可以看出瘤胃梭菌属(Ruminiclostridium)是窖泥中的核心细菌,并且与多个菌属呈正相关性,仅与Clostridium_sensu_stricto_12、Caproiciproducens及Tissierella呈负相关性。这可能是因为此属细菌可将纤维素及半纤维素分解为乙醇、乙酸和丁酸等含碳物质,可为其他微生物生长提供所需的碳源。此外,Clostridium_sensu_stricto_12和Caproiciproducens与其他细菌的负相关关系数显著多于正相关关系数;而Clostridium_sensu_stricto_12与Caproiciproducens之间则为相互促进的正相关性。
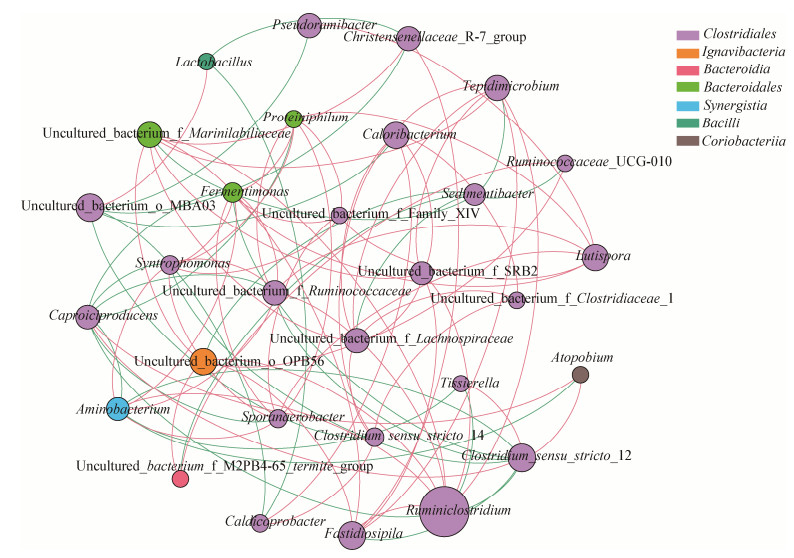
|
| 图 3 窖泥中主要细菌网络分析 Figure 3 Network analysis of the core bacteria in pit mud 注:图中颜色相同的圆形代表相同目水平中不同属的细菌,圆形面积表示菌的中心度,面积越大,中心度越大.连接线表示细菌之间的相互关系,红线代表正相关,绿线代表负相关. Note: The circles with the same color represent the bacteria of the genus level under the same order. The area of circle represents the centrality of the bacteria (larger area indicates more centralized). Lines connecting the circles represents the relationship between two bacteria. Red line represents a positive correlation, and the green line represents a negative correlation. |
|
|
浓香型白酒窖泥中与己酸和丁酸合成相关的细菌主要为梭菌[8, 22, 35],因此采用RCM、乙酸钠、TSN三种选择性培养基对窖泥中产酸厌氧细菌进行分离。从3、20年窖龄的窖泥中共分离得到20株细菌,经16S rRNA基因序列鉴定,分别是Muricomes intestine (10株)、Clostridium (9株)和Ruminococcus (1株),均属于梭菌目(Clostridiales)。对分离到的20株梭菌目细菌代谢特性的初步分析表明,Clostridium和Ruminococcus菌属的菌株产己酸,Muricomes intestini的有些菌株产己酸,有些菌株不产己酸;3、5和20年窖泥中分离到产己酸的细菌分别有5、4和7株(表 2)。
| 菌株编号Strain No. | 菌株Strains | 己酸Caproic acid |
| N5-10 | Clostridium tyrobutyricum | + |
| N20-3 | Clostridium tyrobutyricum | + |
| N3-t3 | Clostridium butyricum | + |
| N3-12 | Clostridium butyricum | + |
| N20-t1 | Clostridium butyricum | + |
| N20-4 | Clostridium butyricum | + |
| N20-5 | Clostridium butyricum | + |
| N3-4 | Clostridium sp. | + |
| N20-t8 | Clostridium sp. | + |
| N3-y2 | Muricomes intestini | + |
| N3-20 | Muricomes intestini | - |
| N3-27 | Muricomes intestini | - |
| N5-12 | Muricomes intestini | + |
| N5-18 | Muricomes intestini | + |
| N5-24 | Muricomes intestini | + |
| N20-1 | Muricomes intestini | - |
| N20-6 | Muricomes intestini | + |
| N20-11 | Muricomes intestini | + |
| N20-16 | Muricomes intestini | - |
| N3-1 | Ruminococcus sp. | + |
| 注:+/-:产/不产己酸. Note:+/-: Produces/does not produce caproic acid. | ||
为进一步了解窖泥细菌与浓香型白酒中某些有机酸合成的关系,比较了16株可合成己酸细菌的产丁酸和己酸的能力。结果表明,多个菌属的细菌均能合成丁酸和己酸,但它们合成这两类有机酸的能力差异显著。由图 4可知,Clostridium产丁酸和己酸的能力普遍强于M. intestini和Ruminococcus,不同Clostridium菌株生成丁酸和己酸的能力也有显著差异。本研究分离得到的Clostridium中,C. tyrobutyricum生成丁酸的能力最强,而产己酸能力最强的是C. butyricum。值得注意的是,M. intestini中N20-6合成己酸能力也较强。此外,产己酸和丁酸高的菌株分别来自于不同窖龄的窖泥,但在产丁酸能力较强(> 2 g/L)的6株菌中,4株分离自20年窖龄窖泥;己酸合成能力最强的4株菌也分离自20年窖龄窖泥。
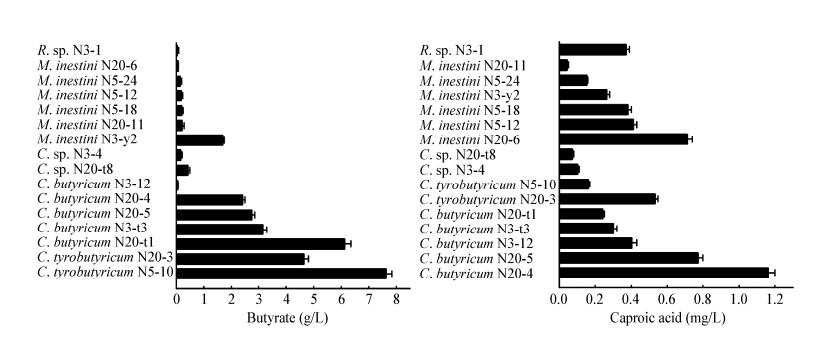
|
| 图 4 窖泥细菌产酸能力的比较 Figure 4 Comparison of acid production capacity of strains isolated from pit mud |
|
|
窖泥是浓香型白酒发酵过程中重要功能微生物栖息的主要生态环境之一,微生物在其中或与其接触的环境里进行的复杂的物质能量代谢可以为酒中风味物质的形成提供条件[36]。窖泥微生物对浓香型白酒特征风味有重要影响,因此,对其在白酒发酵过程中的群落结构、相互作用及其与产物之间关系的研究一直是理论研究的核心与热点[1, 13]。全面系统地解析窖泥微生物的组成结构,不仅可以通过微生物多样性判定或预测窖泥质量[37],还可为其优化和防止退化提供理论支撑[38]。本研究在解析洋河酒不同窖龄窖泥细菌组成演化的基础上,分析比较了窖泥细菌间的相互作用关系以及菌株产有机酸能力的特性,为进一步阐明浓香型白酒窖泥微生物功能奠定了基础。
洋河酒窖泥细菌集中分布在梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、互营养菌纲(Synergistia)和芽孢杆菌纲(Bacilli),这与任聪等报道的浓香型白酒窖泥中细菌主要是芽孢杆菌纲(Bacilli)与梭菌纲(Clostridia)有所不同[39],说明洋河酒窖泥细菌有一定的独特性。洋河酒窖泥上述4个纲细菌为所有窖龄窖泥样品共有,其含量占各自窖泥样品细菌总量的80%以上,覆盖了窖泥样品的大部分微生物,表明这4个纲的微生物可以反映绝大部分窖泥细菌的信息。梭菌纲(Clostridia)细菌代谢生成的丁酸及己酸[8, 22, 35]、拟杆菌纲(Bacteroidia)和互营养菌纲(Synergistia)微生物产生的乙酸、丙酸等物质对酒体形成起重要作用[13, 40]。己酸菌(Caproiciproducens)与梭菌(Clostridiaceae_1)都是窖泥中的重要功能微生物,其在洋河酒窖泥可识别细菌中含量最高,是窖泥中的优势菌属(图 2B)。这两个属的菌株不仅可为浓香型白酒中己酸乙酯的合成提供前体,还对维持窖内微生物结构的稳定有一定贡献[33]。氢孢菌属(Hydrogenispora)和梭菌纲的瘤胃梭菌属(Ruminiclostridium)在驯化过程中出现并逐渐成为占比较大的微生物菌属。采用Spearman秩相关性分析方法确定的窖泥细菌间网络关系表明,瘤胃梭菌属(Ruminiclostridium)与大多数优势细菌呈正相关性,是窖泥细菌中的核心菌属。虽然洋河酒窖泥中瘤胃梭菌含量比己酸菌低,但其也是窖泥中的优势菌属之一。通过菌株丰度界定的优势微生物是寻找核心微生物的方法之一。瘤胃梭菌能将纤维素及半纤维素分解为含碳物质,从而有利于其他微生物生长相关[34],暗示该类微生物可能有一定的调控菌群结构的能力。因此,虽然己酸菌在洋河酒窖泥中含量最高,瘤胃梭菌才是其核心微生物。通过对分离自洋河酒窖泥的20株细菌产酸能力分析发现,其中16株(80%)具有产丁酸和己酸的能力。由于培养条件和反应体系的不同,虽然这些菌株产丁酸和己酸的能力与已有研究[41-44]存在差异,本研究证实了其合成丁酸和己酸的能力以及菌株间产酸能力的差异性。
本研究在解析洋河酒不同窖龄窖泥细菌群落结构的基础上,对细菌间相互关系进行了初步分析,并比较了来源于不同窖泥的不同菌株产丁酸和己酸的能力。此研究结果是对分析酒醅中细菌与浓香型白酒中主要有机酸(乙酸、乳酸、丁酸和己酸)及其酯类(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)合成相关性研究[3, 8]的重要补充,对全面阐明参与浓香型白酒发酵的微生物多样性研究、解析风味物质形成机理具有重要意义。
| [1] |
Tang XH, Huang R, Wang SS, et al. Advances in research on microorganisms in pit mud of Luzhou-flavor Baijiu[J]. Liquor Making, 2019, 46(2): 12-14. (in Chinese) 唐贤华, 黄睿, 王思思, 等. 浓香型白酒窖泥微生物研究综述[J]. 酿酒, 2019, 46(2): 12-14. |
| [2] |
Dai JF, Luo Z, Wen CP, et al. Effects of different storage environment on the quality of strong-flavor Baijiu[J]. China Brewing, 2019, 38(5): 23-26. (in Chinese) 代金凤, 罗政, 文春平, 等. 不同贮藏环境对浓香型白酒品质的影响[J]. 中国酿造, 2019, 38(5): 23-26. |
| [3] |
Liu F, Zhou XH, Chen X, et al. Microbial community of fermented grains and its correlation with organic acids biosynthesis during Yanghe strong-aroma liquor manufacturing process[J]. Acta Microbiologica Sinica, 2018, 58(12): 2087-2099. (in Chinese) 刘凡, 周新虎, 陈翔, 等. 洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J]. 微生物学报, 2018, 58(12): 2087-2099. |
| [4] |
Du LQ, Rao JQ, Tang C, et al. Application of cellar functional microbes in Luzhou flavor liquor production[J]. Liquor Making, 2010, 37(6): 43-44. (in Chinese) 杜礼泉, 饶家权, 唐聪, 等. 窖泥功能菌在浓香型大曲酒生产中的应用[J]. 酿酒, 2010, 37(6): 43-44. |
| [5] |
Wang MY, Zhang WX. Analysis of microbial community structure in pit mud from two Chinese Luzhou-flavor liquor producing areas[J]. Microbiology China, 2014, 41(8): 1498-1506. (in Chinese) 王明跃, 张文学. 浓香型白酒两个产区窖泥微生物群落结构分析[J]. 微生物学通报, 2014, 41(8): 1498-1506. |
| [6] |
Zhang Q. Study on microbial community of mud in Luzhou-flavor liquor brewing[J]. Journal of Food Science and Biotechnology, 2019, 38(5): 160. (in Chinese) 张群. 浓香型白酒酿造用窖泥微生物群落研究[J]. 食品与生物技术学报, 2019, 38(5): 160. |
| [7] |
Liu M, Deng J, Xie J, et al. Screening of physicochemical quality indexes of pit mud based on correlation with microbial community structure[J]. Food Science, 2018, 39(19): 44-50. (in Chinese) 刘梅, 邓杰, 谢军, 等. 基于微生物群落结构相关的窖泥品质理化指标的筛选[J]. 食品科学, 2018, 39(19): 44-50. |
| [8] |
Liu F, Qiu YY, Zhou XH, et al. The correlation between organic acid producing bacteria and organic acids biosynthesis in fermented grains of Yanghe strong-aroma spirit[J]. Food and Fermentation Industries, 2018, 44(12): 22-29. (in Chinese) 刘凡, 仇钰莹, 周新虎, 等. 洋河浓香型白酒酒醅中产酸细菌与有机酸合成的相关性研究[J]. 食品与发酵工业, 2018, 44(12): 22-29. |
| [9] |
Hu XL, Du H, Ren C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2506-2515. |
| [10] |
Luo W, Zhang QY, Liao ZM, et al. Research on microbial composition of pit mud with different traits using high-throughput sequencing[J]. Food and Fermentation Industries, 2017, 43(9): 9-14. (in Chinese) 罗雯, 张倩颖, 廖作敏, 等. 基于高通量测序技术的不同性状窖泥微生物组成研究[J]. 食品与发酵工业, 2017, 43(9): 9-14. |
| [11] |
Hu C, Ying H, Xu DF, et al. Research on microflora in pit mud and its application[J]. Liquor-Making Science & Technology, 2005(3): 34-38. (in Chinese) 胡承, 应鸿, 许德富, 等. 窖泥微生物群落的研究及其应用[J]. 酿酒科技, 2005(3): 34-38. |
| [12] |
Li FL. Analysis of microbial communities and its effect on flavor substance of raw in Chinese Strong-flavor Liquor pit mud[D]. Zhengzhou: Master's Thesis of Zhengzhou University of Light Industry, 2017 (in Chinese) 李芳莉.浓香型白酒窖泥微生物群落结构分析及其对原酒风味物质的影响[D].郑州: 郑州轻工业学院硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10462-1017079048.htm |
| [13] |
Tao Y, Rui JP, Li JB, et al. Microbial community compositions and diversity in pit mud of Chinese Luzhou-flavor liquor[J]. CIESC Journal, 2014, 65(5): 1800-1807. (in Chinese) 陶勇, 芮俊鹏, 李家宝, 等. 浓香型白酒窖泥中细菌和古菌的组成与多样性[J]. 化工学报, 2014, 65(5): 1800-1807. |
| [14] |
Xie SC, Li L, Chen ZJ, et al. Investigation on the separation of microbes in Luzhou-flavor fermented grains and Luzhou-flavor distiller's grains[J]. Liquor-Making Science & Technology, 2009(1): 55-57. (in Chinese) 谢善慈, 李璐, 陈泽军, 等. 浓香型白酒糟醅微生物分离方法初探[J]. 酿酒科技, 2009(1): 55-57. |
| [15] |
Wang P, Wu Q, Jiang XJ, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J]. International Journal of Food Microbiology, 2017, 250: 59-67. |
| [16] |
Li LH. Diversity and metabolic characteristics of lactic acid bacteria and lactate-degrading bacteria in fermented grains of Luzhou-flavor liquor[D]. Wuxi: Master's Thesis of Jiangnan University, 2016 (in Chinese) 栗连会.泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D].无锡: 江南大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10295-1016265415.htm |
| [17] |
Mao YF, Yu WZ, Wang ZH, et al. Effects of applying vitamin B6 to soil on soil microbial diversity of apple orchard[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(2): 394-403. (in Chinese) 毛云飞, 于文章, 王增辉, 等. 土施维生素B6对苹果园土壤微生物多样性的影响[J]. 植物营养与肥料学报, 2018, 24(2): 394-403. |
| [18] |
Youssef N, Sheik CS, Krumholz LR, et al. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys[J]. Applied and Environmental Microbiology, 2009, 75(16): 5227-5236. |
| [19] |
Li J, Hu HW, Ma YB, et al. Long-term nickel exposure altered the bacterial community composition but not diversity in two contrasting agricultural soils[J]. Environmental Science and Pollution Research, 2015, 22(14): 10496-10505. |
| [20] |
Wang N, Liu T, Jin YZ, et al. Effects of Trichoderma on soil microbial diversity and strawberry growth and pathogenesis[J]. Jiangsu Agricultural Sciences, 2018, 46(18): 108-112. (in Chinese) 王宁, 刘铜, 靳亚忠, 等. 木霉菌对土壤微生物多样性及草莓生长和发病的影响[J]. 江苏农业科学, 2018, 46(18): 108-112. |
| [21] |
Deng Y, Jiang YH, Yang YF, et al. Molecular ecological network analyses[J]. BMC Bioinformatics, 2012, 13(1): 113. |
| [22] |
Yang JJ. Genetic diversity, phylogeny and acid ester production analysis of acid forming bacteria in different aged Luzhou Laojiao pit mud[D]. Chengdu: Master's Thesis of Sichuan Agricultural University, 2017 (in Chinese) 杨菁瑾.泸州老窖不同窖龄窖泥产酸细菌的分离鉴定与产酸产酯能力分析[D].成都: 四川农业大学硕士学位论文, 2017 |
| [23] |
Wen M, Wang KG. Comparison of different culture media for isolating Clostridium perfringens[J]. Chinese Journal of Veterinary Medicine, 2002, 38(12): 16-17. (in Chinese) 文明, 王开功. 几种分离产气荚膜梭菌培养基的比较[J]. 中国兽医杂志, 2002, 38(12): 16-17. |
| [24] |
Xie B, Zhou CB, Li F, et al. Study on the fermentation conditions of caproic acid[J]. Food and Fermentation Technology, 2016, 52(3): 56-59, 80. (in Chinese) 谢彪, 周昌豹, 李峰, 等. 己酸发酵条件研究[J]. 食品与发酵科技, 2016, 52(3): 56-59, 80. |
| [25] |
Yuan HW, Yang ZG, Lan ZX, et al. Determination of caproic acid and other organic acids in fermented liquid of caproic acid bacteria by GC[J]. Liquor-Making Science & Technology, 2018(3): 102-105. (in Chinese) 袁华伟, 杨泽刚, 兰著玺, 等. 气相色谱法测定己酸菌发酵液中的己酸等有机酸含量[J]. 酿酒科技, 2018(3): 102-105. |
| [26] |
Liao QJ, Guo Y, Zhou HL, et al. Determination method of caproic acid in caproic acid fermented liquid[J]. Liquor-Making Science & Technology, 2017(2): 118-119. (in Chinese) 廖勤俭, 郭艳, 周翰玲, 等. 己酸发酵液中己酸的检测方法[J]. 酿酒科技, 2017(2): 118-119. |
| [27] |
Zhang YG, Deng Y. Microbial structure and diversity of cellar mud at different winery cellar age based on high-throughput sequencing[J]. China Biogas, 2019, 37(3): 3-8. (in Chinese) 张应刚, 邓宇. 基于高通量测序的不同窖龄窖泥微生物结构与多样性分析[J]. 中国沼气, 2019, 37(3): 3-8. |
| [28] |
Huang YN, Xiong XM, Hu YL, et al. Bacterial community and diversity in pit mud of Baiyunbian liquor analyzed by PCR-DGGE and high-throughput sequencing[J]. Microbiology China, 2017, 44(2): 375-383. (in Chinese) 黄莹娜, 熊小毛, 胡远亮, 等. 基于PCR-DGGE和高通量测序分析白云边酒窖泥细菌群落结构与多样性[J]. 微生物学通报, 2017, 44(2): 375-383. |
| [29] |
Jiang XT, Peng X, Deng GH, et al. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J]. Microbial Ecology, 2013, 66(1): 96-104. |
| [30] |
Kim BC, Seung Jeon B, Kim S, et al. Caproiciproducens galactitolivorans gen. nov., sp. nov., a bacterium capable of producing caproic acid from galactitol, isolated from a wastewater treatment plant[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12): 4902-4908. |
| [31] |
Du LQ, Luo HB, Huang ZG, et al. Application of microbial communities technology to research on microorganism in pit mud[J]. Liquor Making, 2014, 41(4): 42-49. (in Chinese) 杜礼泉, 罗惠波, 黄治国, 等. 微生物群落相关技术在窖泥微生物研究中的应用[J]. 酿酒, 2014, 41(4): 42-49. |
| [32] |
Zhuang MY. The production mechanism of the fragrance in the Chinese spirit & the operation of the spirit brewing[J]. Sichuan Food and Fermentation, 2007, 43(2): 1-6. (in Chinese) 庄名扬. 中国白酒香味物质形成机理及酿酒工艺的调控[J]. 四川食品与发酵, 2007, 43(2): 1-6. |
| [33] |
Hu XL. Illuminating the correlation between anaerobic clostridial community diversity and quality of pit mud used for the production of Chinese strong-flavor liquor[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡: 江南大学博士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10295-1016030626.htm |
| [34] |
Yang ZM, Guo RB, Shi XS, et al. Bioaugmentation of Hydrogenispora ethanolica LX-B affects hydrogen production through altering indigenous bacterial community structure[J]. Bioresource Technology, 2016, 211: 319-326. |
| [35] |
Li CC. Diversity of Clostridia community and fermentation characteristics of Clostridia with high yield of butyric acid in Chinese Strong-flavor Liquor pit mud[D]. Zhengzhou: Master's Thesis of Zhengzhou University of Light Industry, 2018 (in Chinese) 李聪聪.浓香型白酒窖泥梭菌群落多样性及高产丁酸梭菌发酵特性研究[D].郑州: 郑州轻工业学院硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10462-1018223256.htm |
| [36] |
Shi S, Wang HY, Zhang WX, et al. Analysis of microbial communities characteristics in different pit mud of Luzhou-flavor liquor[J]. Liquor-Making Science & Technology, 2011(5): 38-41. (in Chinese) 施思, 王海英, 张文学, 等. 浓香型白酒不同-窖泥的微生物群落特征分析[J]. 酿酒科技, 2011(5): 38-41. |
| [37] |
Zhu XJ, Gu Y, Ren C, et al. Cultivating acidogenic microbiota from pit mud to rapidly evaluate the quality of pit mud[J]. Microbiology China, 2019, 46(4): 950-959. (in Chinese) 朱晓军, 辜杨, 任聪, 等. 厌氧产酸菌群培养技术在窖泥质量快速检测中的应用[J]. 微生物学通报, 2019, 46(4): 950-959. |
| [38] |
Guo Z, Ge DY, Shang XJ, et al. Comparative analysis on the diversity of bacterial microflora in degenerated and normal pit mud[J]. Science and Technology of Food Industry, 2018, 39(22): 93-98, 106. (in Chinese) 郭壮, 葛东颖, 尚雪娇, 等. 退化和正常窖泥微生物多样性的比较分析[J]. 食品工业科技, 2018, 39(22): 93-98, 106. |
| [39] |
Ren C, Gu Y, Du H, et al. Predicting dominant caproate-producing microbes by comparing the microbiotas between new-and aged- pit muds[J]. Food and Fermentation Industries, 2018, 44(12): 8-14. (in Chinese) 任聪, 辜杨, 杜海, 等. 基于新老窖泥的微生物菌群结构判定浓香型白酒生产中的主体己酸菌[J]. 食品与发酵工业, 2018, 44(12): 8-14. |
| [40] |
Liu QQ, Zheng JT, Liu HC. Isolation and characterization of a Bacteroides strain from tideland of east China sea[J]. China Biogas, 2013, 31(6): 3-8. (in Chinese) 刘全全, 郑经堂, 刘海昌. 一株拟杆菌的分离鉴定及代谢特征分析[J]. 中国沼气, 2013, 31(6): 3-8. |
| [41] |
Yuan HW, Zhao M, Jiang J, et al. Isolation and identification of a butyric acid-producing strain from pit mud and study on its growth performance[J]. Liquor- Making Science & Technology, 2017(5): 35-40. (in Chinese) 袁华伟, 赵猛, 蒋君, 等. 窖泥中产丁酸菌的筛选、鉴定及生长性能研究[J]. 酿酒科技, 2017(5): 35-40. |
| [42] |
Ji X, Xu Y, Mu XQ, et al. Improvement of caproic acid production in the mixed culture of Clostridium kluyveri and Saccharomyces cerevisiae[J]. Journal of Food Science and Biotechnology, 2017, 36(9): 922-926. (in Chinese) 嵇翔, 徐岩, 穆晓清, 等. 克氏梭菌和酿酒酵母混合培养提高己酸产量[J]. 食品与生物技术学报, 2017, 36(9): 922-926. |
| [43] |
Zhao DY, Cao JQ, Liu X, et al. Study on the key technology of the cultivation process of caproic acid bacteria[J]. Liquor Making, 2019, 46(2): 47-50. (in Chinese) 赵德义, 曹建全, 刘雪, 等. 己酸菌逐级扩大培养过程关键工艺研究[J]. 酿酒, 2019, 46(2): 47-50. |
| [44] |
Yang AH, Liu X, Zhang XM, et al. Improvement of the culture of functional bacteria in pit mud of Nongxiang Baijiu[J]. Liquor-Making Science & Technology, 2018(10): 120-125. (in Chinese) 杨爱华, 刘雪, 张学梅, 等. 浓香型窖泥功能菌的培养工艺改进试验[J]. 酿酒科技, 2018(10): 120-125. |
 2020, Vol. 47
2020, Vol. 47