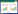扩展功能
文章信息
- 施笑笑, 王教瑜, 王艳丽, 孙国昌
- SHI Xiao-Xiao, WANG Jiao-Yu, WANG Yan-Li, SUN Guo-Chang
- 子囊菌交配型位点与交配型基因研究进展
- Mating type genes in ascomycetes: a review
- 微生物学通报, 2020, 47(5): 1572-1581
- Microbiology China, 2020, 47(5): 1572-1581
- DOI: 10.13344/j.microbiol.china.190682
-
文章历史
- 收稿日期: 2019-08-19
- 接受日期: 2019-11-04
- 网络首发日期: 2019-12-07
2. 省部共建农产品质量安全危害因子与风险防控国家重点实验室 浙江省农业科学院植物保护与微生物研究所 浙江 杭州 310021
2. State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-products, Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou, Zhejiang 310021, China
真菌种类多样、形态各异,是重要的真核生物类群。子囊菌门(Ascomycota)是真菌中最大的门,已知的子囊菌约64 000种,分为外囊菌亚门(Taphrinomycotina) [如裂殖酵母属(Schizosaccharomyces)]、酵母菌亚门(Saccharomycotina) [如酿酒酵母属(Saccharomyces)]、盘菌亚门(Pezizomycotina) [最大的亚门,包括粪壳菌纲(Sordariomycetes)、锤舌菌纲(Leotimycetes)、散囊菌纲(Eurotiomycetes)和座囊菌纲(Dothideomycetes)]等。酵母菌亚门的真菌多以出芽或分裂的形式生长,而大多数盘菌亚门真菌呈丝状。
真菌的生殖方式有无性生殖、有性生殖和准性生殖。对于大部分真菌来说,有性生殖可以清除有害突变,产生适应力更强的后代,是遗传重组的重要驱动力。与无性繁殖相比,真菌的有性生殖过程相对复杂,包括质配、核配、减数分裂3个阶段,最终形成有性孢子。子囊菌的有性生殖过程起始于两个性细胞产生的信息素的相互识别,信息素激活细胞表面受体,并通过G蛋白途径和MAPK途径进行传导;然后,在适当的环境条件下(温度、光照、营养胁迫),雌性交配型菌株开始分化出生殖结构——产囊体,产囊体顶部会形成受精丝(特化的菌丝),受精丝容易被雄性交配型的供体细胞(分生孢子或者菌丝)所吸引,并与之融合[1]。以粗糙脉孢菌(Neurospora crassa)为例[2-3],雄性菌株的小分生孢子所特有的信息素吸引雌性菌株的受精丝,两者相互接触完成细胞-菌丝融合之后,雄性细胞的细胞核经过菌丝迁移到雌性生殖结构,两种交配类型的细胞核都增殖、配对并迁移到双核子囊中进行融合,并开始一系列复杂的减数分裂和有丝分裂过程,最后形成子囊孢子。
根据自交是否可育,真菌的有性生殖方式分为同宗配合和异宗配合。同宗配合指由单个菌株就能完成有性生殖,异宗配合真菌的有性生殖过程需要两个性亲和菌株共同完成,而性亲和的菌株,需要具有不同的交配型(mating-type,MAT)。自然界中90%以上真菌为异宗配合[4]。控制真菌交配型的基因位点称为交配型位点,按照Turgeon等提出的命名系统,两种互补的交配型通常称为MAT1-1和MAT1-2[5]。交配型基因的出现是真菌进化过程中的重要事件。研究交配型基因的序列特征和在有性生殖过程中的功能及调控过程,对了解真菌的亲缘关系、同宗配合和异宗配合的演化过程以及真菌的进化与起源都具有重要意义。
1 MAT位点的分布与基因组成异宗配合包括二极性异宗配合和四极性异宗配合。二极性异宗配合子囊菌的交配型由一对基因位点决定,所以交配型只有两种;而四极性异宗配合子囊菌的交配型由两对基因位点决定,具有四种交配型(图 1A)。目前所知的子囊菌中大部分属于二极性异宗配合[6],如粗糙脉孢菌、稻瘟病菌(Magnaporthe oryzae)等。同宗配合的MAT位点分布主要有以下几种形式(图 1B):(1)两个MAT位点融合为一个位点,如旋孢腔菌(Cochliobolus homomorphus)[7];(2)两个交配型位点位于不同染色体上,如构巢曲霉(Aspergillus nidulans)和费氏新萨托菌(Neosartorya fischeri)[8];(3)自我受精的单性生殖方式,有性生殖过程只涉及一种交配型,如新生隐球菌(Cryptococcus neoformans)[7];(4)酿酒酵母(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomyces pombe)和乳酸克鲁维酵母(Kluyveromyces lactis)等子囊菌的两种交配型之间能够相互转化[9];(5)一个孢子中含有两个互补交配型的基因组,这种有性生殖类型也称为伪同宗配合或次级同宗配合,如柄孢壳菌(Podospora anserina)。

|
| 图 1 子囊菌交配型位点的分布 Figure 1 Distribution of MAT loci in Ascomycota |
|
|
单细胞子囊菌酿酒酵母存在a、α和a/α 3种状态的细胞。其中,a细胞含有MATa1基因,α细胞含有MATα1和MATα2基因,a/α细胞为二倍体,含有MATa1、MATα1和MATα2。MATa1基因编码蛋白a1能调控多种a细胞特异基因的表达。α细胞中,蛋白α1是正向调节因子,α2是负向调节因子[10],二者共同调控α细胞特异基因的表达。而在二倍体细胞中,a1和α2能够形成异源二聚体,使得二倍体细胞的基因表达呈现既非a也非α的特异性。裂殖酵母存在P、M两种细胞类型,其中,P细胞含有交配型位点mat1-P,编码Pc和Pi蛋白;M细胞含有交配型位点mat1-M,编码Mc和Mi蛋白。
与酿酒酵母和裂殖酵母不同,大部分盘菌亚门子囊菌MAT1-1位点含有3个基因:(1) MAT1-1-1,编码一个含α1结构域的蛋白[11];(2) MAT1-1-2,编码一个含HPG/PPF结构域的蛋白[12];(3) MAT1-1-3,编码一个含HMG结构域的蛋白[12] (图 2)。MAT1-2位点仅携带一个基因MAT1-2-1,编码一个HMG结构域蛋白[13]。其中,MAT1-2-1和MAT1-1-3都编码含HMG结构域蛋白,但不同的是MAT1-1-3的HMG结构域C端缺少保守序列PRkXseXrrR[14]。Martin等通过对MAT1-1-1和MAT1-2-1基因的序列、编码蛋白的二级、三级结构的预测与系统发育分析,认为α1结构域是由HMG结构域进化而来,也属于HMG蛋白家族[15]。

|
| 图 2 盘菌亚门交配型位点的基因组成 Figure 2 Distribution patterns of MAT genes in Pezizomycotina |
|
|
由于交配型研究起步很早,同时不同种类子囊菌交配型位点缺乏严格的序列相似性,因此交配型位点命名缺乏统一的规则。例如,与Turgeon等[5]的命名规则不同,酿酒酵母和构巢曲霉的交配型位点分别称为MATα和MATa,粗糙脉孢霉的交配型位点称为MATa和MATA[16]。不同真菌交配型位点所含有的基因个数和序列不尽相同,通常每个交配型位点包含1–3个基因,如MAT1-1位点编码MAT1-1-1、MAT1-1-2、MAT1-1-3,MAT1-2位点编码MAT1-2-1、MAT1-2-2。同样地,交配型基因的命名也不够规范。
为了更好地把握基因的本质特征,使子囊菌交配型基因的命名更加规范化,避免基因名称混用,Wilken等[17]根据序列的同源性及蛋白相似性,提出对部分盘菌亚门交配型基因的命名进行梳理。其中,交配型基因MAT1-1-1、MAT1-1-2、MAT1-1-3、MAT1-2-1的名称保持不变(表 1)。
| 交配型位点MAT loci | 盘菌亚门Pezizomycotina | 原始名称Original name | 建议名称Revised name |
| MAT1-1 | 座囊菌纲Dothideomycetes | MAT1-1-4 | MAT1-1-8 |
| 散囊菌纲Eurotiomycetes | MAT1-1-4 | MAT1-1-9 | |
| 散囊菌纲Eurotiomycetes (球孢子菌属Coccidioides sp.) |
MAT1-1-5 | COX13 | |
| MAT1-1-6 | APN2 | ||
| MAT1-2 | 粪壳菌纲Sordariomycetes (稻瘟病菌Magnaporthe oryzae) |
MAT1-2-2 | MAT1-2-6 |
| 粪壳菌纲Sordariomycetes (肉座菌目Hypocreales) |
MAT1-2-3 | MAT1-2-9 | |
| 锤舌菌纲Leotimycetes | MAT1-2-4 | MAT1-2-10 | |
| 散囊菌纲Eurotiomycetes (球孢子菌属Coccidioides sp.) |
MAT1-2-5 | COX13 | |
| 散囊菌纲Eurotiomycetes (球孢子菌属Coccidioides sp.) |
MAT1-2-6 | APN2 | |
| 锤舌菌纲Leotimycetes (假裸囊菌属Pseudogymnoascus sp.) |
MAT1-2-5 | MAT1-2-11 |
交配型位点对真菌性别的控制和遗传进化起着决定性作用。在异宗配合的子囊菌中,不同的MAT位点决定不同菌株的“性别” (交配型)。互补交配型菌株的参与才能形成子实体并产生子囊。除了具有相容的MAT位点,互补交配型的菌株还包含其他控制细胞特性、细胞融合以及双核合子形成的基因。在同宗配合的子囊菌中,MAT位点同样起着重要作用。同宗配合的子囊菌有性生殖过程同样形成产囊体。不同的是,同宗配合的子囊菌形成子实体和产生子囊不需要互补交配型菌株的参与。
Yun等提出将同宗配合菌株的MAT基因替代异宗配合菌株的MAT基因或异宗配合菌株的MAT基因替代同宗配合菌株的MAT基因,是否会导致有性生殖方式的改变[18]。此后,Lu等以3种旋孢腔菌C. heterostrophus、C. luttrellii和C. homomorphus为研究对象,将C. luttrellii (同宗配合)的MAT位点替代C. heterostrophus (异宗配合)的MAT位点可以顺利改变C. heterostrophus的交配方式,使之通过自交产生子囊壳、子囊和子囊孢子;反之,将来源于不同交配型C. heterostrophus菌株的MAT1-1-1和MAT1-2-1基因分别替代C. luttrellii的MAT位点,也能实现C. luttrellii的异宗配合,得到的两种含相反交配型基因的C. luttrellii菌株能够交配产生子囊壳和子囊孢子,但这两个含有C. heterostrophus MAT1-1-1或MAT1-2-1的C. luttrellii菌株同时也保留了部分同宗配合的特性,能自交产生少量的子囊壳和子囊孢子;用亲缘性较远的C. homomorphus (同宗配合)的MAT基因替代C. heterostrophus的MAT基因,也能实现C. heterostrophus通过自交产生子囊壳,但子囊壳数量很少,无法形成子囊和子囊孢子[19]。上述研究表明,不同配合方式子囊菌的MAT基因位点能导致异宗配合与同宗配合之间的相互转变,但子囊菌种类不同、亲缘关系不同,得到的结果也不同。这可能是因为虽然同为同宗配合(或异宗配合)的子囊菌,其MAT位点所含调控其配合方式的关键因子具有特异性,或者对异源下游基因的调控能力不同。此外,将来源于C. heterostrophus不同交配型的MAT基因插入到同一个C. heterostrophus MAT缺失突变体后,得到的转化子无法通过自交形成子囊和子囊孢子,表明同宗配合子囊菌的MAT位点可能含有某些特异的调控同宗配合过程的关键因子,而不是简单的两种互补交配型基因的叠加。可见,交配型位点对子囊菌的性别控制和配合方式起着关键作用,同时调控过程又相当复杂,可能是多个基因相互协调和相互竞争的结果。物种间的异源表达或不同交配型菌株间的交叉表达,是研究MAT位点功能和调控过程的有效手段,但截至目前,仅在包括上述的旋孢腔菌和脉孢菌、烟曲霉(Aspergillus fumigatus)等少数子囊菌中有相关报道,研究认为不同交配方式的脉孢菌之间无法实现同宗和异宗之间的转变[20],而烟曲霉(无性生殖)的MAT1-2基因能够促进构巢曲霉的有性生殖[21]。
4 MAT基因与信息素信号通路有性生殖过程起始于配偶识别,信息素在配偶识别中发挥关键作用。细胞表面受体感知信息素信号,并通过G蛋白通路和MAPK通路将信号向胞质和细胞核传递,最终调控下游基因的表达,完成有性生殖过程。研究认为,MAT基因位于信息素信号通路的下游[22]。目前,酵母细胞中的信息素信号通路研究最为深入,大部分子囊菌交配型基因的完整调控通路还未阐明。异宗配合的子囊菌中,信息素受体基因的表达对有性生殖过程极为重要,如粗糙脉孢菌中,信息素受体基因的缺失将影响有性生殖过程的顺利进行[22]。然而同宗配合的子囊菌中因为不需要配偶识别,信息素和信息素受体的作用不明显[23],如禾谷镰刀菌(Fusarium graminearum)中,编码信息素受体的基因对有性生殖并非必需[24]。
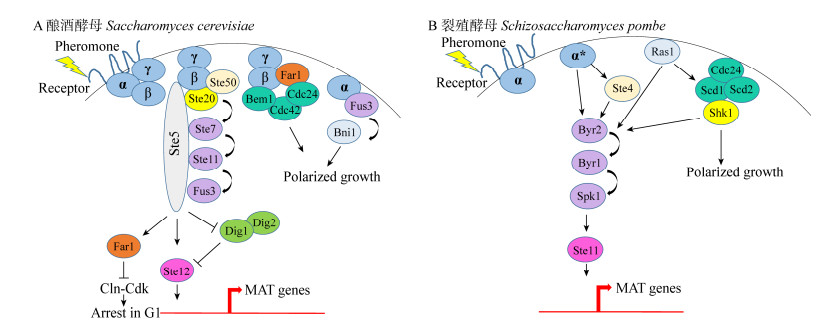
G蛋白复合物为异源三聚体,由α、β、γ亚基组成。信息素与细胞表面受体结合,激活与之耦联的G蛋白复合物,使其解离成Gα和Gβγ两种子复合物。酿酒酵母中Gβγ具有活性,而在裂殖酵母中发挥作用的是Gα亚基。在酿酒酵母细胞中(图 3A),随着信息素信号的出现,膜定位的Cdc42蛋白首先被激活,促进Ste20运动到膜上和Gβγ亚基相互作用[26]。Ste5支架蛋白通过Cdc24 (鸟苷酸交换因子)与Gβγ的相互作用在细胞膜上积累,并结合Ste4、Ste11-Ste7-Fus3[27-29]。Ste7磷酸化激活Fus3[30],被激活的Fus3蛋白从Ste5释放进入细胞核,通过磷酸化激活转录因子Ste12,Ste12与DNA结合,调控MAT基因表达从而影响有性生殖。Ste12能以同源二聚体[31]的形式与DNA结合,也可以与Mcm1或α1形成异源二聚体[32],甚至与Dig1/Dig2或Dig1/Tec1形成更复杂的复合物[33]再结合DNA。裂殖酵母信号传递的过程(图 3B)与酿酒酵母类似,Gα亚基被激活后,MAPK途径随之被激活。裂殖酵母的MAPK级联包括MAPKKK (Byr2)、MAPKK (Byr1)和MAPK (Spk1)。MAPK信号通路最后激活转录因子Ste11,进而调控MAT基因[34]。与酿酒酵母相比,裂殖酵母没有支架蛋白Ste5,所以目前尚不清楚裂殖酵母的Gα亚基如何将信号传递给MAPKKK(Byr2),有研究认为可能通过Ste4[35]。
有性生殖信息素调控网络也涉及酵母细胞的生长。酿酒酵母细胞中,Fus3磷酸化激活Far1,Far1通过调控相关蛋白干扰细胞周期[36]。Far1还作为Gβγ和Cdc24的支架蛋白,而Cdc24能够促进Cdc42的活化,这些蛋白共同影响细胞的极性生长[37]。激活的Fus3也和Gα亚基相互作用,参与调节细胞的生长[38]。裂殖酵母中Cdc42也是细胞生长的主要调控因子。Ras1是一种GTP酶,在裂殖酵母有性生殖过程中可能促进Byr2的活化,也在细胞生长过程中发挥作用,使细胞极化生长与信息素通路连接起来[39]。
近年来研究表明,信息素信号通路与子囊菌其他重要性状的调节通路存在交叉。白色念珠菌(Candida albicans)信息素信号不仅诱导细胞的极化生长,而且增加细胞对惰性表面的粘附能力,促进生物膜的建立,而生物膜能增强白色念珠菌在宿主中的交配能力,或者通过加快准性生殖的周期从而促进在宿主中的侵染速度[25]。植物病原真菌尖孢镰刀菌(Fusarium oxysporum)利用MAPK信号通路对植物分泌的Ⅲ类过氧化物酶作出应答,调控病菌对寄主的侵染[40]。尖孢镰刀菌Ste2基因与酵母细胞α信息素受体功能相同,Ste2的缺失影响尖孢镰刀菌对信息素类似物的响应,同时也影响病菌的致病性[25]。在水稻稻瘟病菌中,有一条与调控酵母有性生殖的MAPK通路同源的信号通路,该通路中的关键基因发生突变直接导致病菌侵染结构——附着胞形成的缺陷,严重影响致病性[41]。研究表明,这条MAPK通路参与病菌对寄主表面物理和化学信号的感知[42]。
5 MAT基因的功能MAT基因在不同子囊菌中的功能并不保守。在同宗配合的禾谷镰刀菌中,MAT1-1位点(MAT1-1-1,MAT1-1-2,MAT1-1-3)和MAT1-2位点(MAT1-2-1)都是产生可育的子囊壳所必需的,其中MAT1-1-1和MAT1-2-1作为两个位点中比较重要的基因,在有性过程刚开始的阶段,即从营养生长转向有性生长的过程中起作用,而MAT1-1-2和MAT1-1-3则是在有性生殖后期起作用,影响子囊的形成和子囊孢子的分化[14, 43]。同样作为同宗配合的大孢粪壳菌(Sordaria macrospora)中,MAT1-1-2是产生成熟子囊壳所必需的,说明MAT1-1-2基因参与了大孢粪壳菌有性生殖早期的原子囊腔形成阶段,但MAT1-1-1和MAT1-1-3并非必不可少,其相应的突变体仍能产生和野生型相同数量的子囊壳以及有活性的成熟子囊孢子[44]。对于异宗配合的粗糙脉孢菌和柄孢壳菌而言,MAT1-1-2是柄孢壳菌子囊壳形成必不可少的[45],而粗糙脉孢菌中MAT1-1-2(matA-2)或MAT1-1-3(matA-3)的缺失对有性生殖的影响很小,甚至在MAT1-1-2 (matA-2)和MAT1-1-3(matA-3)的双敲突变体中依然可育[46]。在稻瘟病菌(异宗配合)中,郭晓宇[47]发现MAT1-2-1对有性世代产生具有决定性的影响,突变体无法形成子囊壳,而MAT1-2-2对有性世代产生影响不大。
转录组分析为MAT基因的功能研究和上下游基因的发掘提供了重要的手段。大孢粪壳菌[44]、禾谷镰刀菌[48]、粗糙脉孢霉[49]和柄孢壳菌[50]等多种子囊菌中,MAT基因相关的转录组已有研究。Kim等[43]通过比较禾谷镰刀菌中不同突变体之间或突变体和野生型之间的转录,共找到1 245个表达差异的基因,通过对其中106个基因进行突变分析,明确了其中25个为有性生殖所必需,并且其中大部分受MAT1-1和MAT1-2的调控。然而在不同的子囊菌中,即使是最保守的交配型基因所调控的基因转录谱也有不同,这些表达差异基因涉及MAT基因的上游调控因子与下游靶标基因。不同物种中的同源基因所发挥的作用也有不同,如禾谷镰刀菌FGSG_01366基因是MAT基因的下游基因,受MAT基因调控[43],而FGSG_01366在柄孢壳菌中的同源基因是MAT基因FMR1和FPR1的上游调控因子[51]。MAT基因的靶基因既包括与交配型和有性生殖过程直接相关的基因,如白色念珠菌中交配型转化的基因就直接受MAT位点的调控,还包括其他非直接相关的基因,如在产黄青霉(Penicillium chrysogenum)中MAT1-1-1的转录靶点包括与无性生殖、形态发育、氨基酸代谢、铁代谢和次生代谢相关的基因[52]。
6 结语真菌种类繁多,从单细胞酵母到丝状真菌,再到高等的大型真菌,细胞结构多种多样,有单核、多核还有无隔菌丝。其生殖方式复杂多变,从无性生殖、有性生殖到准性生殖,同一种真菌有的3种生殖方式都存在,有的只有其中一种或两种。在不同的条件下,同种真菌会选择不同的生殖方式。这些因素都给真菌生殖机制和遗传变异研究带来很大的挑战。
交配型和交配型相关基因的研究是揭示真菌有性生殖机制的关键。自交配型位点被发现和鉴定以来,科学家进行了大量的研究,明确了其中一些基础性的问题,如MAT基因与交配型控制、MAT基因的信号通路及上下游基因等,但有关真菌的交配机制还存在很多悬而未决的问题。例如,从分子层面上来说,MAT位点大多编码不止一个基因,这些基因在有性生殖过程中所发挥的具体功能如何?是否每一个基因都对形成有性世代不可或缺?不同的真菌中这些基因的功能有哪些异同?从真菌的演化来看,同宗配合和异宗配合是否真的存在先后的问题?MAT基因进化的驱动力是什么?自然界中是否存在无性的真菌物种?是否也可以通过分子手段实现双性菌株的构建?这些问题都没有定论,值得进一步研究。
新的研究结果也不断提出了新的问题,如有性生殖信息素相关的信号通路表现出的一些新功能,包括与子囊菌生长及致病性的相互联系;同一个信号通路对信息素和植物表面物质均能做出反应,那么子囊菌是如何调控这个信号通路,使之协调工作的?近年来,本研究组对稻瘟病菌有性生殖的过程、交配型基因功能及与致病性之间的关系进行了探索,发现某些参与致病性的重要代谢过程影响病原菌有性世代的产生[53-55],但交配型基因本身对致病性的影响不大[47]。此外,转录组的深入分析发现在有性生殖周期中,除了基因转录谱和表达谱与营养生长过程有差异之外,还会产生完全不同的蛋白序列(数据待发表),而这些蛋白可能是通过全新的调控过程而产生的,内在机制目前还知之甚少。
有关真菌生殖方式的进化以及同宗配合和异宗配合的起源一直存在争议。早期研究认为不同的MAT基因来源于染色体上同一DNA保守区,这些区域发生定向或非定向突变,导致不同交配方式的产生,因此同宗配合和异宗配合为共同起源[56]。Krassowski等[57]对332种酵母基因组中的MAT位点进行分析,并根据MAT位点的组成推断有性生殖方式,发现这些酵母更倾向于进行同宗配合。从进化的角度看,这种偏向性可能有助于增加成功交配的机会,而更利于物种的繁衍和发展。最近也有研究支持子囊菌中的异宗配合起源于同宗配合[58]。因此,进一步围绕交配型基因开展有性生殖机制的深入研究,在不同的真菌中分析交配型基因的结构、功能和亲缘关系,对子囊菌生长发育和遗传进化的研究仍具有重要的意义。
| [1] |
Bistis GN. Physiological heterothallism and sexuality in Euascomycetes: a partial history[J]. Fungal Genetics and Biology, 1998, 23(3): 213-222. |
| [2] |
Kim H, Borkovich KA. A pheromone receptor gene, pre-1, is essential for mating type-specific directional growth and fusion of trichogynes and female fertility in Neurospora crassa[J]. Molecular Microbiology, 2004, 52(6): 1781-1798. DOI:10.1111/j.1365-2958.2004.04096.x |
| [3] |
Kim H, Borkovich KA. Pheromones are essential for male fertility and sufficient to direct chemotropic polarized growth of trichogynes during mating in Neurospora crassa[J]. Eukaryotic Cell, 2006, 5(3): 544-554. DOI:10.1128/EC.5.3.544-554.2006 |
| [4] |
Wang Q, Wang S, Liu XM, et al. Asexual and sexual evolution analysis of hyphomycetes fungi[J]. Journal of Fungal Research, 2017, 15(4): 213-221, 228. (in Chinese) 王群, 王石, 刘小缦, 等. 丝孢真菌无性与有性进化分析[J]. 菌物研究, 2017, 15(4): 213-221, 228. |
| [5] |
Turgeon BG, Yoder OC. Proposed nomenclature for mating type genes of filamentous ascomycetes[J]. Fungal Genetics and Biology, 2000, 31(1): 1-5. |
| [6] |
Gross A, Zaffarano PL, Duo A, et al. Reproductive mode and life cycle of the ash dieback pathogen Hymenoscyphus pseudoalbidus[J]. Fungal Genetics and Biology, 2012, 49(12): 977-986. DOI:10.1016/j.fgb.2012.08.008 |
| [7] |
Lin XR, Heitman J. Mechanisms of homothallism in fungi and transitions between heterothallism and homothallism[A]//Heitman J, Kronstad JW, Taylor JW, et al. Sex in Fungi: Molecular Determination and Evolutionary Implications[M]. Washington, DC: American Society for Microbiology, 2007: 35-57
|
| [8] |
Rydholm C, Dyer PS, Lutzoni F. DNA sequence characterization and molecular evolution of MAT1 and MAT2 mating-type loci of the self-compatible ascomycete mold Neosartorya fischeri[J]. Eukaryotic Cell, 2007, 6(5): 868-874. DOI:10.1128/EC.00319-06 |
| [9] |
Ni M, Feretzaki M, Sun S, et al. Sex in fungi[J]. Annual Review of Genetics, 2011, 45: 405-430. DOI:10.1146/annurev-genet-110410-132536 |
| [10] |
Bardwell L. A walk-through of the yeast mating pheromone response pathway[J]. Peptides, 2005, 26(2): 339-350. DOI:10.1016/j.peptides.2004.10.002 |
| [11] |
Herskowitz I. A regulatory hierarchy for cell specialization in yeast[J]. Nature, 1989, 342(6251): 749-757. DOI:10.1038/342749a0 |
| [12] |
Debuchy R, Turgeon BG. Mating-type structure, evolution, and function in Euascomycetes[A]//Kües U, Fischer R. Growth, Differentiation and Sexuality[M]. Berlin, Heidelberg: Springer, 2006: 293-323
|
| [13] |
Sugimoto A, Iino Y, Maeda T, et al. Schizosaccharomyces pombe ste11+ encodes a transcription factor with an HMG motif that is a critical regulator of sexual development[J]. Genes & Development, 1991, 5(11): 1990-1999. |
| [14] |
Zheng Q, Hou R, Zhan JY, et al. The MAT locus genes play different roles in sexual reproduction and pathogenesis in Fusarium graminearum[J]. PLoS One, 2013, 8(6): e66980. DOI:10.1371/journal.pone.0066980 |
| [15] |
Martin T, Lu SW, van Tilbeurgh H, et al. Tracing the origin of the fungal α1 domain places its ancestor in the HMG-box superfamily: implication for fungal mating-type evolution[J]. PLoS One, 2010, 5(12): e15199. DOI:10.1371/journal.pone.0015199 |
| [16] |
Glass NL, Staben C. Neurospora mating type symbol mt revised to mat[J]. Fungal Genetics Newsletter, 1997, 44: 64. |
| [17] |
Wilken PM, Steenkamp ET, Wingfield MJ, et al. Which MAT gene? Pezizomycotina (Ascomycota) mating-type gene nomenclature reconsidered[J]. Fungal Biology Reviews, 2017, 31(4): 199-211. DOI:10.1016/j.fbr.2017.05.003 |
| [18] |
Yun SH, Berbee ML, Yoder OC, et al. Evolution of the fungal self-fertile reproductive life style from self-sterile ancestors[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(10): 5592-5597. DOI:10.1073/pnas.96.10.5592 |
| [19] |
Lu SW, Yun SH, Lee T, et al. Altering sexual reproductive mode by interspecific exchange of MAT loci[J]. Fungal Genetics and Biology, 2011, 48(7): 714-724. DOI:10.1016/j.fgb.2011.04.006 |
| [20] |
Glass NL, Smith ML. Structure and function of a mating-type gene from the homothallic species Neurospora africana[J]. Molecular and General Genetics MGG, 1994, 244(4): 401-409. DOI:10.1007/BF00286692 |
| [21] |
Pyrzak W, Miller KY, Miller BL. Mating type protein Mat1-2 from asexual Aspergillus fumigatus drives sexual reproduction in fertile Aspergillus nidulans[J]. Eukaryotic Cell, 2008, 7(6): 1029-1040. DOI:10.1128/EC.00380-07 |
| [22] |
Kim H, Wright SJ, Park G, et al. Roles for receptors, pheromones, G proteins, and mating type genes during sexual reproduction in Neurospora crassa[J]. Genetics, 2012, 190(4): 1389-1404. |
| [23] |
Perkins DD. Mating-type switching in filamentous ascomycetes[J]. Genetics, 1987, 115(1): 215-216. |
| [24] |
Kim HK, Lee T, Yun SH. A putative pheromone signaling pathway is dispensable for self-fertility in the homothallic ascomycete Gibberella zeae[J]. Fungal Genetics and Biology, 2008, 45(8): 1188-1196. DOI:10.1016/j.fgb.2008.05.008 |
| [25] |
Bennett RJ, Turgeon BG. Fungal sex: the Ascomycota[J]. Microbiology Spectrum, 2016, 4(5): FUNK-0005-2016
|
| [26] |
Peter M, Neiman AM, Park HO, et al. Functional analysis of the interaction between the small GTP binding protein Cdc42 and the Ste20 protein kinase in yeast[J]. The EMBO Journal, 1996, 15(24): 7046-7059. DOI:10.1002/j.1460-2075.1996.tb01096.x |
| [27] |
Whiteway MS, Wu C, Leeuw T, et al. Association of the yeast pheromone response G protein beta gamma subunits with the MAP kinase scaffold Ste5p[J]. Science, 1995, 269(5230): 1572-1575. DOI:10.1126/science.7667635 |
| [28] |
Chol KY, Satterberg B, Lyons DM, et al. Ste5 tethers multiple protein kinases in the MAP kinase cascade required for mating in S. cerevisiae[J]. Cell, 1994, 78(3): 499-512. DOI:10.1016/0092-8674(94)90427-8 |
| [29] |
Marcus S, Polverino A, Barr M, et al. Complexes between STE5 and components of the pheromone-responsive mitogen-activated protein kinase module[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(16): 7762-7766. DOI:10.1073/pnas.91.16.7762 |
| [30] |
Good M, Tang G, Singleton J, et al. The Ste5 scaffold directs mating signaling by catalytically unlocking the Fus3 MAP kinase for activation[J]. Cell, 2009, 136(6): 1085-1097. DOI:10.1016/j.cell.2009.01.049 |
| [31] |
Dolan JW, Kirkman C, Fields S. The yeast STE12 protein binds to the DNA sequence mediating pheromone induction[J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(15): 5703-5707. DOI:10.1073/pnas.86.15.5703 |
| [32] |
Yuan YO, Stroke IL, Fields S. Coupling of cell identity to signal response in yeast: interaction between the α1 and STE12 proteins[J]. Genes & Development, 1993, 7(8): 1584-1597. |
| [33] |
Chou S, Lane S, Liu HP. Regulation of mating and filamentation genes by two distinct Ste12 complexes in Saccharomyces cerevisiae[J]. Molecular and Cellular Biology, 2006, 26(13): 4794-4805. DOI:10.1128/MCB.02053-05 |
| [34] |
Kjaerulff S, Lautrup-Larsen I, Truelsen S, et al. Constitutive activation of the fission yeast pheromone-responsive pathway induces ectopic meiosis and reveals Ste11 as a mitogen-activated protein kinase target[J]. Molecular and Cellular Biology, 2005, 25(5): 2045-2059. DOI:10.1128/MCB.25.5.2045-2059.2005 |
| [35] |
Ramachander R, Kim CA, Phillips ML, et al. Oligomerization-dependent association of the SAM domains from Schizosaccharomyces pombe Byr2 and Ste4[J]. Journal of Biological Chemistry, 2002, 277(42): 39585-39593. DOI:10.1074/jbc.M207273200 |
| [36] |
Pope PA, Bhaduri S, Pryciak PM. Regulation of cyclin-substrate docking by a G1 arrest signaling pathway and the Cdk inhibitor Far1[J]. Current Biology, 2014, 24(12): 1390-1396. DOI:10.1016/j.cub.2014.05.002 |
| [37] |
Valtz N, Peter M, Herskowitz I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones[J]. The Journal of Cell Biology, 1995, 131(4): 863-873. DOI:10.1083/jcb.131.4.863 |
| [38] |
Nern A, Arkowitz RA. A GTP-exchange factor required for cell orientation[J]. Nature, 1998, 391(6663): 195-198. DOI:10.1038/34458 |
| [39] |
Merlini L, Dudin O, Martin SG. Mate and fuse: how yeast cells do it[J]. Open Biology, 2013, 3(3): 130008. DOI:10.1098/rsob.130008 |
| [40] |
Turrà D, El Ghalid M, Rossi F, et al. Fungal pathogen uses sex pheromone receptor for chemotropic sensing of host plant signals[J]. Nature, 2015, 527(7579): 521-524. DOI:10.1038/nature15516 |
| [41] |
Xu JR, Hamer JE. MAP kinase and cAMP signaling regulate infection structure formation and pathogenic growth in the rice blast fungus Magnaporthe grisea[J]. Genes & Development, 1996, 10(21): 2696-2706. |
| [42] |
Liu H, Suresh A, Willard FS, et al. Rgs1 regulates multiple Gα subunits in Magnaporthe pathogenesis, asexual growth and thigmotropism[J]. The EMBO Journal, 2007, 26(3): 690-700. DOI:10.1038/sj.emboj.7601536 |
| [43] |
Kim HK, Jo SM, Kim GY, et al. A large-scale functional analysis of putative target genes of mating-type loci provides insight into the regulation of sexual development of the cereal pathogen Fusarium graminearum[J]. PLoS Genetics, 2015, 11(9): e1005486. DOI:10.1371/journal.pgen.1005486 |
| [44] |
Klix V, Nowrousian M, Ringelberg C, et al. Functional characterization of MAT1-1-specific mating-type genes in the homothallic ascomycete Sordaria macrospora provides new insights into essential and nonessential sexual regulators[J]. Eukaryotic Cell, 2010, 9(6): 894-905. DOI:10.1128/EC.00019-10 |
| [45] |
Arnaise S, Zickler D, Le Bilcot S, et al. Mutations in mating-type genes of the heterothallic fungus Podospora anserina lead to self-fertility[J]. Genetics, 2001, 159(2): 545-556. |
| [46] |
Ferreira AVB, Saupe S, Glass NL. Transcriptional analysis of the mtA idiomorph of Neurospora crassa identifies two genes in addition to mtA-1[J]. Molecular and General Genetics MGG, 1996, 250(6): 767-774. |
| [47] |
Guo XY. Role of mating-type genes in sexual reproduction and pathogenicity of Magnaporthe oryzae[D]. Jinhua: Master's Thesis of Zhejiang Normal University, 2018 (in Chinese) 郭晓宇.稻瘟病菌交配型基因在有性生殖和致病过程中的作用[D].金华: 浙江师范大学硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10345-1018276000.htm |
| [48] |
Sikhakolli UR, López-Giráldez F, Li N, et al. Transcriptome analyses during fruiting body formation in Fusarium graminearum and Fusarium verticillioides reflect species life history and ecology[J]. Fungal Genetics and Biology, 2012, 49(8): 663-673. DOI:10.1016/j.fgb.2012.05.009 |
| [49] |
Samils N, Gioti A, Karlsson M, et al. Sex-linked transcriptional divergence in the hermaphrodite fungus Neurospora tetrasperma[J]. Proceedings of the Royal Society B: Biological Sciences, 2013, 280(1764): 20130862. DOI:10.1098/rspb.2013.0862 |
| [50] |
Bidard F, Aït Benkhali J, Coppin E, et al. Genome-wide gene expression profiling of fertilization competent mycelium in opposite mating types in the heterothallic fungus Podospora anserina[J]. PLoS One, 2011, 6(6): e21476. DOI:10.1371/journal.pone.0021476 |
| [51] |
Ait Benkhali J, Coppin E, Brun S, et al. A network of HMG-box transcription factors regulates sexual cycle in the fungus Podospora anserina[J]. PLoS Genetics, 2013, 9(7): e1003642. DOI:10.1371/journal.pgen.1003642 |
| [52] |
Becker K, Beer C, Freitag M, et al. Genome-wide identification of target genes of a mating-type α-domain transcription factor reveals functions beyond sexual development[J]. Molecular Microbiology, 2015, 96(5): 1002-1022. DOI:10.1111/mmi.12987 |
| [53] |
Gu ZK, Li L, Wang JY, et al. Observation of sexual structure of Magnaporthe oryzae via calcofluor white and Nile red staining[J]. Chinese Journal of Rice Science, 2016, 30(6): 668-672. (in Chinese) 顾卓侃, 李玲, 王教瑜, 等. 利用卡氏白和尼罗红染色观察稻瘟病菌有性世代的结构[J]. 中国水稻科学, 2016, 30(6): 668-672. |
| [54] |
Guo XY, Li L, Dong B, et al. Lighting the cellular structures of sexual generation in Magnaporthe oryzae with fluorescent proteins and fluorescent dyes[J]. Chinese Journal of Cell Biology, 2018, 40(7): 1138-1145. (in Chinese) 郭晓宇, 李玲, 董波, 等. 利用荧光蛋白标记研究稻瘟病菌有性世代的细胞结构[J]. 中国细胞生物学学报, 2018, 40(7): 1138-1145. |
| [55] |
Wang JY, Li L, Chai RY, et al. Pex13 and Pex14, the key components of the peroxisomal docking complex, are required for peroxisome formation, host infection and pathogenicity-related morphogenesis in Magnaporthe oryzae[J]. Virulence, 2019, 10(1): 292-314. DOI:10.1080/21505594.2019.1598172 |
| [56] |
Turgeon BG, Bohlmann H, Ciuffetti L M, et al. Cloning and analysis of the mating type genes from Cochliobolus heterostrophus[J]. Molecular and General Genetics MGG, 1993, 238(1/2): 270-284. |
| [57] |
Krassowski T, Kominek J, Shen XX, et al. Multiple reinventions of mating-type switching during budding yeast evolution[J]. Current Biology, 2019, 29(15): 2555-2562. DOI:10.1016/j.cub.2019.06.056 |
| [58] |
Sun S, Lin XR, Coelho MA, et al. Mating-system evolution: all roads lead to selfing[J]. Current Biology, 2019, 29(15): R743-R746. DOI:10.1016/j.cub.2019.06.073 |
 2020, Vol. 47
2020, Vol. 47