扩展功能
文章信息
- 赵思崎, 王敬敬, 杨宗政, 李晴晴, 杨榕, 赵维, 徐松, 朱丹, 黄志勇
- ZHAO Si-Qi, WANG Jing-Jing, YANG Zong-Zheng, LI Qing-Qing, YANG Rong, ZHAO Wei, XU Song, ZHU Dan, HUANG Zhi-Yong
- 微生物复合菌剂的制备
- Preparation of microbial compound agents
- 微生物学通报, 2020, 47(5): 1492-1502
- Microbiology China, 2020, 47(5): 1492-1502
- DOI: 10.13344/j.microbiol.china.190700
-
文章历史
- 收稿日期: 2019-08-26
- 接受日期: 2019-12-09
- 网络首发日期: 2020-03-19
2. 中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室 天津 300308
2. Tianjin Key Laboratory for Industrial Biology System and Process Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
目前我国化肥和农药的过量使用,不仅造成了一系列生态环境的污染,而且严重危害人们健康及农业和社会的可持续化发展[1]。微生物菌剂是一种绿色环保、生态友好的肥料,具有增加土壤肥力、减少化肥和农药使用、净化和修复土壤、降低植物病害、提质增产、提高食品安全等特点,是实现农业可持续化发展的重要途径[2-4]。微生物菌剂在世界范围内已得到了广泛应用,如根瘤菌(Rhizobium sp.)、芽孢杆菌(Bacillus sp.)、假单胞菌(Pseudomonas sp.)等。
单一微生物菌剂存在功能单一、适应能力差等问题。将不同功能菌株组合得到比单一微生物菌剂促生能力更强、更稳定的微生物复合菌剂,是微生物菌剂发展的趋势[5]。近年来国内外已经研发了很多具有多功能性、优势互补的微生物复合菌剂。如Siddiqui等[6]利用荧光假单胞菌(Pseudomonas fluorescens)和根瘤菌(Rhizobium sp.)配制的复合菌剂防治豌豆枯萎病,与单一菌剂相比,豌豆枯萎病发病率显著降低。Bai等[7]利用苏云金芽孢杆菌(Bacillus thuringiensis)和慢生根瘤菌(Bradyrhizobium japonicum)在大田条件下共同接种,与单独接种慢生型大豆根瘤菌相比,明显提高了大豆植株根瘤数量、根瘤重量、苗重、根重和产量。目前,微生物复合菌剂的研究已经进入到产业化阶段,受到了国内外生物农业公司的重点关注。如王继雯等[8]施用M-14微生物复合菌剂能有效增加小麦生物量,与空白对照相比使小麦增产14.3%,与其他处理组相比胞囊线虫侵染率减少43.4%−70.8%。TJ Technology公司开发了一个名为QuickRoots的微生物复合菌剂,能够改善作物在苗期的营养元素供给,以小麦为例其增产量可达220−250 kg/ha左右;TJ Technology公司于2014年以3亿美元的价格将该技术转让给孟山都,此一例足以彰显微生物复合菌剂的应用潜力和市场规模[9]。
微生物复合菌剂的构建包括物种选择和物种整合,大多数研究选择两种或两种以上具有不同功能的菌株来构建复合菌剂[10],常用固氮菌(固氮螺旋菌或根瘤菌)和生物防治剂(假单胞菌或芽孢杆菌)进行构建复合菌剂[11-12],物种整合则是对复合菌剂中微生物的配比研究。目前国内外对微生物复合菌剂的构建方法主要有以下两种:(1)根据菌株的不同功能以1:1 (体积比或生物量比)的形式构建微生物复合菌剂。如Korir等[13]利用具有结瘤能力的根瘤菌与具有解磷能力的芽孢杆菌构建的复合菌剂,与接种单一的根瘤菌相比,复合菌剂增加了菜豆的结瘤和苗干重。Madhaiyan等[14]利用具有产IAA (indole-3-acetic acid)能力的米亚甲基杆菌(Methylobacterium oryzae)分别与具有固氮能力的巴西固氮螺菌(Azospirillum brasilense)和具有解无机磷能力的吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia)构建复合菌剂,结果表明均能促进番茄、水稻和辣椒在苗和根的生长并且促进植物对养分的吸收。Egamberdieva等[15]利用具有固氮结瘤作用的慢生根瘤菌(Bradyrhizobium japonicum) USDA 110与具有产IAA和溶磷作用的恶臭假单胞菌(Pseudomonas putida) TSAU1构建复合菌剂,结果表明与单独接种慢生根瘤菌相比,复合菌剂显著提高了盐胁迫下植物的氮、磷和可溶性叶蛋白的含量并促进了植物生长。徐伟慧等[16]筛选了多种西瓜根际促生菌,根据不同菌株的解有机磷、解无机磷、固氮和解钾能力进行配比,构建了3种微生物复合菌剂(R1、R2和R3),结果表明复合菌剂R2对西瓜根系具有最明显的促生效应。(2)以菌株的功能为基础,通过构建微生物复合菌剂数学模型对复合菌剂的物种配比进行研究,但此报道较少。如Wang等[10]根据土壤肥力、微生物活性和黄瓜养分需要量,构建了微生物复合菌剂数学模型。根据模型将3种菌(固氮菌、解磷菌和解钾菌)以2:1:2 (生物量比)的比例构成微生物复合菌剂(M1),然后不考虑微生物活性,以1:10:1 (生物量比)的比例构成微生物复合菌剂(M2),结果表明M1和M2均能显著提高黄瓜产量,且实验结果表明构建微生物复合菌剂时应考虑微生物活性。
以上两种微生物复合菌剂的构建方法对复合菌剂中物种的功能考虑较少,往往只考虑某个物种一种或两种促生特性进行构建复合菌剂,缺乏构建微生物复合菌剂数学模型预测植物生长的研究。本文拟以前期筛选到的一株可在大田实验中明显促进水稻生长的解淀粉芽孢杆菌(Bacillus amyloliquefaciens) FH-1[17],与实验室其他7株植物促生细菌按照生物量1:1的比例复配成微生物复合菌剂,利用盆栽实验筛选高效微生物复合菌剂,通过深入分析植物促生菌的多种促生特性与植物特征间的关系,构建复合微生物菌剂的数学模型,为微生物复合菌剂的研发提供一定的指导。
1 材料与方法 1.1 材料 1.1.1 材料来源试验菌株:8株植物促生细菌分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens) FH-1 (简称F)、蜡状芽孢杆菌(Bacillus cereus) LSI-1 (简称L)、芽孢杆菌(Bacillus sp.) JFH-1 (简称J)、芽孢杆菌(Bacillus sp.) IF-2 (简称I)、芽孢杆菌(Bacillus sp.) ZPC-1 (简称Z)、短波单胞菌(Brevundimonas sp.) NYM-3 (简称N)、不动杆菌(Acinetobacter sp.) KYM-3 (简称K)、假单胞菌(Pseudomonas sp.) G3-6 (简称G)[18],3株植物病原菌分别为立枯丝核菌(Rhizoctonia solani) F692、尖孢镰刀菌(Fusarium oxysporum) F678和禾谷镰刀菌(Fusarium graminearum) F679。菌株均由中国科学院天津工业生物技术研究所应用微生物生态工程实验室筛选、保藏。
供试土壤和植株品种:供试土壤为天津市东丽区华明镇的耕地土壤,土壤类型为黄壤。土壤性质为:有机质1.78%;全氮3.00 g/kg,全磷0.39 g/kg,全钾5.13 g/kg;速效氮37.33 mg/kg;速效磷9.57 mg/kg;速效钾61.84 mg/kg;pH 7.69。供试作物为水稻(内5优8015杂交稻),购自浙江农科种业有限公司。
1.1.2 培养基、主要试剂和仪器LB液体培养基、无机磷培养基、有机磷培养基、解钾培养基、阿须贝固氮培养基、PDA培养基、ADF培养基、CAS检测平板、CAS染液、Salkowski’s显色液等的配制参考文献[17-20]。所用试剂均为国产分析纯。恒温培养箱,上海新苗医疗器械制造有限公司;紫外可见分光光度计,岛津公司;人工智能气候培养箱,江南仪器厂。
1.2 方法 1.2.1 菌株培养将−80 ℃保藏的菌株按照5%的比例接种到LB液体培养基中,30 ℃、180 r/min培养24 h。
1.2.2 水稻盆栽实验盆栽实验根据文献[18-19]的方法进行改进。将水稻放入蒸馏水中,30 ℃静置孵育24 h,再将水稻转移到湿纱布中,30 ℃孵育24 h,直至水稻全部露白。将供试土壤在阴凉避光处晾干,过5 mm筛,取240 g供试土壤装入直径为8 cm的花盆中,每个花盆播种13粒露白的水稻种子,播种5 d出现1叶幼苗,移除生长不好的幼苗和花盆,最终保持每个花盆11颗长势基本均一的幼苗。复合菌剂的制备和施加根据Siddiqui等[6]和Korir等[13]的盆栽实验方法进行改进,各菌液活化24 h后分别以5%的接种量在LB培养基培养60 h后显微计数,再用自来水将菌液稀释至8×108 CFU/mL (稀释约250倍),复合菌剂为稀释后的15 mL F加15 mL其他菌液,施加菌剂满足1×108 CFU/g土壤。处理组:30 mL自来水作为空白对照(CK),30 mL F菌液为阳性对照,F和J (FJ)、F和L (FL)、F和N (FN)、F和I (FI)、F和K (FK)、F和G (FG)、F和Z (FZ),每个处理组设置4个重复。
出苗之前把培养箱内温度控制在30 ℃,1叶露尖保持白天28 ℃,晚上24 ℃;2叶期保持25 ℃,3叶期保持22 ℃,1 d光照时长为16 h,培养箱湿度为75%,并进行统一管理(每48 h浇水30 mL,随机转换花盆位置)。样品采集及植物特性分析:水稻盆栽实验样品采集时间为种植后16 d左右,在不损害植物根和苗的情况下,拔出植株进行后续测量。利用天平对每盆水稻苗的鲜重、干重进行测量,利用直尺对每盆水稻苗的苗高、根长进行测定。
1.2.3 菌株促生特性测定将LB活化培养的菌液,用生理盐水制成菌悬液,再将5 μL菌悬液分别接种到有机磷固体培养基、无机磷固体培养基、CAS检测平板、阿须贝固氮培养基和解钾培养基上,观察菌株是否具有解有机磷、解无机磷、产铁载体、固氮以及解钾的能力[19, 21]。
取菌液5 μL,接种在PDA平板上分别检测菌株对3种植物病原菌F692、F678、F679是否有拮抗作用[18]。拮抗能力测定公式:
拮抗能力(%)=(真菌群落直径−拮抗细菌处理的真菌群落直径)÷真菌群落直径×100。
取3 mL菌液12 000 r/min离心15 min,取2 mL上清液加入2 mL Salkowski’s比色液中,混匀,在暗处反应30 min后,测定其OD530值(以未接菌的LB液体培养基与等体积Salkowski’s比色液的混合液为对照),用于检测IAA产量[22]。本实验绘制了IAA标准曲线:y=0.015 9x+0.029 4,x代表IAA浓度数值(mg/L),y代表OD530。R2=0.994,说明绘制的标准曲线比较准确。
用ADF培养基培养菌株,参照Bradford法测定细菌细胞提取液中总蛋白质含量。以牛血清白蛋白和α-丁酮酸为标准物,分别制作标准曲线,参照Saleh等的方法测定ACC脱氨酶活力[23-25]。
1.2.4 数据统计分析与模型构建所有数据为均值±标准差。通过t检验分析不同菌剂间每盆水稻苗长、根长、鲜重和干重的差异显著性(P < 0.05)。复合菌剂促生特性为复配的两种菌株功能叠加的结果。通过偏相关分析检验菌剂解无机磷能力(inorganic phosphate solubilizing ability,IP)、产铁载体能力(siderophores production ability,SI)、产吲哚乙酸能力(indole-3-acetic acid producing ability,IAA)、产ACC脱氨酶能力(activity of ACC deaminase,ACC)和拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力(antagonistic ability against three plant pathogens,AP)与水稻特征(苗长、根长、干重和鲜重)的净相关性。根据菌剂促生特性与植物特征的偏相关性结果,构建微生物复合菌剂的数学模型,复合菌剂的构建和验证通过Excel 2016完成。所有统计分析均使用IBM SPSS statistic (Version 21.0)进行,所有作图均使用Origin 2016完成。
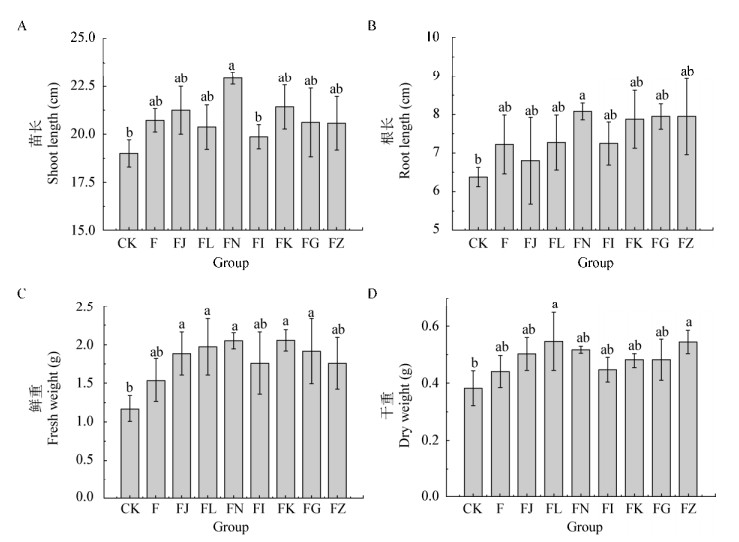
2 结果与分析 2.1 微生物复合菌剂的研制和筛选将复配的微生物复合菌剂进行盆栽筛选,结果如图 1所示,通过对每盆水稻的苗长、根长、鲜重和干重数据的综合分析发现,与CK相比,复合菌剂FN显著提升水稻的苗长20.79%、根长26.67%和鲜重74.84%,复合菌剂FL显著提升水稻的鲜重68.23%和干重43.14%,复合菌剂FJ、FK和FG显著提升水稻的鲜重分别为61.19%、75.48%和63.75%,复合菌剂FZ显著提升水稻的干重42.48% (P < 0.05)。与其他处理组相比,复合菌剂FN可提升水稻苗长7.12%−15.47%、根长1.64%−18.82%。除了复合菌剂FK,与其他处理组相比,复合菌剂FN可提升水稻鲜重3.93%−32.90%。除了复合菌剂FL和FZ,与其他处理组相比,复合菌剂FN可提升水稻干重3.48%−17.51%。综合上述,复合菌剂FN是7种微生物复合菌剂中综合效果较好的微生物复合菌剂。
|
| 图 1 不同菌剂对每盆水稻苗长(A)、根长(B)、鲜重(C)、干重(D)的生长影响 Figure 1 Effects of different microbial compound agents on shoot length (A), root length (B), fresh weight (C) and dry weight (D) of rice seedlings 注:不同的小写字母代表数据在不同处理组中水稻特征存在显著差异(P < 0.05). Note: Data followed by the different lowercase letters are significantly different due to rice characteristics of different groups at P < 0.05. |
|
|
将所有菌株的固氮、解有机和无机磷、解钾、产IAA、产铁载体、拮抗病原菌的能力进行测定,结果如表 1所示。所有菌株均不具有解有机磷的能力,除了菌株L和菌株I,其余6株菌均具有固氮、解钾和解无机磷的能力,这6株菌解无机磷的能力(D/d)在1.29−2.43之间,其中菌株F的解无机磷的能力最强。利用平板对峙方法检测菌株拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力,结果表明只有菌株F和J对3种植物病原菌有拮抗能力,拮抗能力在60.00%−68.29%之间,其中菌株J对禾谷镰刀菌的拮抗能力最强。采用Salkowski’s比色法测定菌株产IAA的能力,结果表明只有菌株N和G产IAA,产量分别为2.36 mg/L和12.81 mg/L。采用CAS检测法测定菌株产铁载体的能力,只有菌株F、N和L有产铁载体的能力(D/d),分别为2.38、2.48和1.83,其中菌株N产铁载体的能力最强。本实验中5株菌株具有产ACC脱氨酶能力,ACC脱氨酶比活力在0.01−0.042 U/mg之间,其中菌株F的ACC脱氨酶比活力最高。
| 促生特性 Growth promoting characteristics |
试验菌 Strains |
|||||||
| F | J | L | N | I | K | G | Z | |
| 固氮能力 Nitrogen fixing ability |
+ | + | - | + | - | + | + | + |
| 解钾能力 Potassium solubilizing ability |
+ | + | - | + | - | + | + | + |
| 解无机磷能力 Inorganic phosphate solubilizing ability (D/d) |
2.430±0.210 | 1.290±0.000 | - | 1.530±0.06 | - | 2.400±0.350 | 1.430±0.060 | 1.400±0.000 |
| 解有机磷能力 Organic phosphate solubilizing ability (D/d) |
- | - | - | - | - | - | - | - |
| 产铁载体能力 Siderophores production ability (D/d) |
2.380± 0.190 | - | 1.830±0.620 | 2.480±0.100 | - | - | - | - |
| 产IAA能力 Indole-3-acetic acid producing ability (mg/L) |
- | - | - | 2.360±0.140 | - | - | 12.810±0.330 | - |
| ACC脱氨酶比活力 Activity of ACC deaminase (U/mg) |
0.042±0.002 | 0.022±0.005 | - | 0.010±0.001 | - | - | 0.037±0.002 | 0.022±0.000 |
| 拮抗尖孢镰刀菌能力 Antagonistic ability against Fusarium oxysporum (%) |
65.690±1.698 | 60.000±0.000 | - | - | - | - | - | - |
| 拮抗禾谷镰刀菌能力 Antagonistic ability against Fusarium graminearum (%) |
62.750±1.700 | 68.290±0.000 | - | - | - | - | - | - |
| 拮抗立枯丝核菌能力 Antagonistic ability against Rhizoctonia solani (%) |
60.420±4.773 | 60.000±4.330 | - | - | - | - | - | - |
| 注:数据来自3个数据的平均值;+:代表有该能力;-:表示不具有该能力;D:溶解圈的直径;d:细菌群落直径;D/d:溶解能力. Note: Data are means (n=3); +: Means having the ability; -: Means having no the ability; D: diameter of solubilizing zone; d: Diameter of bacterial colony; D/d:Ability to dissolve. |
||||||||
进一步分析盆栽实验中8种菌剂的促生特性(复合菌剂促生特性为复配的两种菌株功能叠加的结果)与促生效果的相关性(n=8),经偏相关系数计算法可得,解无机磷能力(IP)与水稻幼苗的苗长、根长、鲜重和干重均呈正相关,其中IP对根长相关性r值最高,表现出显著正相关(P=0.023)。铁载体分泌能力(SI)与水稻幼苗的苗长、根长、鲜重和干重均呈正相关,其中SI对水稻根长相关性r值最高。拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力(AP)与水稻幼苗的苗长和鲜重呈正相关,与根长和干重呈负相关,其中AP对水稻根长相关性r绝对值最高,表现出显著负相关(P=0.015)。产ACC脱氨酶能力(ACC)与水稻幼苗的苗长和鲜重呈负相关,与根长和干重呈正相关,其中ACC对水稻根长相关性r值最高。产吲哚乙酸能力(IAA)与水稻幼苗的苗长和鲜重呈正相关,与根长和干重呈负相关,其中IAA对水稻干重相关性r绝对值最高(表 2)。
| 相关性 Correlation |
苗长 Shoot length |
根长 Root length |
鲜重 Fresh weight |
干重 Dry weight |
|
| IP | Pearson correlation coefficient | 0.785 | 0.977 | 0.812 | 0.111 |
| Significance (bilateral) | 0.215 | 0.023 | 0.188 | 0.889 | |
| SI | Pearson correlation coefficient | 0.789 | 0.869 | 0.754 | 0.791 |
| Significance (bilateral) | 0.211 | 0.131 | 0.246 | 0.209 | |
| AP | Pearson correlation coefficient | 0.376 | -0.985 | 0.452 | -0.446 |
| Significance (bilateral) | 0.624 | 0.015 | 0.548 | 0.554 | |
| ACC | Pearson correlation coefficient | -0.221 | 0.901 | -0.470 | 0.766 |
| Significance (bilateral) | 0.779 | 0.099 | 0.530 | 0.234 | |
| IAA | Pearson correlation coefficient | 0.112 | -0.654 | 0.493 | -0.731 |
| Significance (bilateral) | 0.888 | 0.346 | 0.507 | 0.269 | |
| 注:IP:解无机磷能力;SI:产铁载体能力;AP:拮抗3种植物病原菌能力;ACC:产ACC脱氨酶能力;IAA:产IAA能力. Note: IP: Inorganic phosphate solubilizing ability; SI: Siderophores production ability; AP: Antagonistic ability against three plant pathogens; ACC: Activity of ACC deaminase; IAA: Indole-3-acetic acid producing ability. |
|||||
通过菌剂促生特性与植物特征的相关性分析结果可知,菌剂促生特性与植物特征密切相关。据此,可构建复合菌剂的概念模型如下:
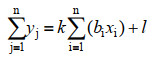
|
yj:植株特征;xi:菌株促生特性;bi:相关系数(某促生特性对所有植株特征的偏相关性r值之和);k:线性系数;l:线性截距。
根据本实验令:
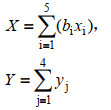
|
X:复合菌剂的促生能力;Y:复合菌剂的促生效果。
将本文实验所得偏相关系数带入方程式,得:
X=2.685×IP+3.203×SI−0.603×AP+48.8×ACC− 0.078×IAA,Y=SL+RL+FW+DW
IP:解无机磷能力;SI:产铁载体能力;AP:拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力;ACC:产ACC脱氨酶能力;IAA:产吲哚乙酸的能力;SL:苗长;RL:根长;FW:鲜重;DW:干重。所有具有单位的量除以自身的单位进行无量纲化,且复合菌剂促生特性需量化为同一数量级,以避免因单位的影响造成促生特性值过小或过大导致不能真实反映促生特性与植物特征的关系,则测定的ACC值均需除0.02 U/mg,IAA值均需除10 mg/L。2.685、3.203、−0.603、48.8、−0.078分别为IP、SI、AP、ACC、IAA对整个植株的影响系数。
从本实验8组数据中随机抽取5组复合菌剂的数据构建复合菌剂的促生能力与促生效果的一般线性模型,如图 2所示:Y=0.340 8X+23.963。经相关系数r检验,当α=0.05,n=5时,查得相关系数临界值rmin=0.878,所以r=0.945 > rmin,表明复合菌剂的促生能力与促生效果有很高的线性相关程度;F检验得F=25.13 > F0.05(1, 3)=10.13,即该方程具有显著的线性关系。以上两种检验均表明构建的一般线性模型具有意义,即复合菌剂促生能力值越大水稻生长得越好。
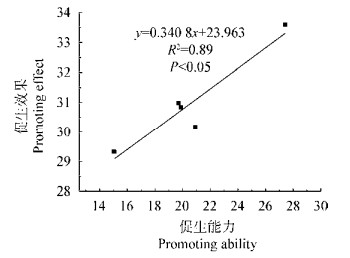
|
| 图 2 复合菌剂的促生能力与促生效果拟合的一般线性模型 Figure 2 The general linear model constructed by the plant growth promoting ability and the promoting effect of microbial compound agents |
|
|
上述结果表明可通过测定微生物菌剂的促生特性,预测微生物复合菌剂对盆栽水稻的促生效果。根据上述方程式可构建微生物复合菌剂数学模型如下:
Y=0.3408×(2.685×IP+3.203×SI−0.603×AP+48.8×ACC−0.078×IAA)+23.963
Y:水稻促生效果;IP:解无机磷能力;SI:产铁载体能力;AP:拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力;ACC:产ACC脱氨酶能力。
另外3组数据用以检验模型,结果如表 3所示,预测的结果与真值间的相对误差小于3%,说明模型对单菌剂和复合菌剂的预测准确率可达97%以上。
| Group | X | YP | YR | |ER| (%) | Accuracy (%) |
| FK | 21.50 | 31.29 | 31.84 | 1.73 | 98.27 |
| FJ | 18.46 | 30.25 | 30.44 | 0.62 | 99.38 |
| F | 15.06 | 29.09 | 29.93 | 2.81 | 97.19 |
| 注:X:菌剂的促生能力;YP:模型预测菌剂的促生效果;YR:菌剂实际的促生效果;ER:相对误差. Note: X: The growth promoting ability of microbial agents; YP: The effect of microbial agents promoting growth predicted by the model; YR: The actual growth promoting effect of microbial agents; ER: Relative error. |
|||||
通过对菌剂的促生特性和促生效果的偏相关性分析,发现无机磷降解能力(IP)、产铁载体能力(SI)和产ACC脱氨酶能力(ACC)与水稻生长呈正相关,而产吲哚乙酸能力(IAA)和拮抗3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)的能力(AP)与水稻生长呈负相关。因此我们推测微生物菌剂可能主要是通过无机磷降解能力(IP)、产铁载体能力(SI)和产ACC脱氨酶能力(ACC)促进水稻生长。无机磷降解能力(IP)、产铁载体能力(SI)和产ACC脱氨酶能力(ACC)促进植物生长的研究已有很多报道,Illmer等[26]早在1995年就提出无机磷降解能力(IP)促生机理,微生物通过呼吸作用释放的质子,可以显著促进土壤中无机磷的溶解,为植物提供更多的磷源,从而促进植物生长发育。植物促生菌可依靠铁载体与根际病原微生物争夺土壤中有限的铁营养,消耗土壤中仅存的微量可用铁,使病原菌类因缺铁而无法繁衍,形成优势群体,且植物利用微生物产生的铁载体螯合铁元素,可改善自身营养状况[27]。ACC脱氨酶具有抑制乙烯产生,促使根系伸长生长和增加植物生物量的优势[28]。吲哚乙酸(IAA)对植物促生作用的报道有很多,作用机理也较为明晰[29]。但也有一些报道与我们的结果一致,即微生物产吲哚乙酸会抑制植物的生长,如孟丽媛等[30]发现用半固体实验培养20株产IAA菌时,产IAA浓度低于8.54 mg/L的菌促进水稻生长,高于此浓度的菌抑制水稻生长。王欢等[18]发现筛选的解有机磷菌产吲哚乙酸(IAA)的能力(分泌量为9.27−14.72 mg/L)与盆栽黄瓜苗株高、根长等显著负相关。吲哚乙酸(IAA)的促生作用会受到浓度的影响,低浓度的IAA能促进植物生长,高浓度的IAA将会抑制植物生长[31]。但是产吲哚乙酸能力与作物负相关的具体原因还有待于进一步的研究。拮抗植物病原菌对植物促生作用的报道也有很多,如植物促生菌可产生一些抗菌活性物质,如脂多糖、氰化氢、吩嗪、硝吡咯菌素等拮抗植物病原菌,预防植物感病,促进作物生长[32]。可能因为本文盆栽实验中没有接种植物病原菌,所以显示不出拮抗3种病原菌能力(AP)对水稻抗病性以及促生作用。此外,菌剂促生特性在土壤这个复杂的生态系统中是否发挥作用会受到很多生物和非生物因素的影响,也可能因此显示不出产IAA和拮抗病原菌能力对水稻生长的促进作用。因此,要深入了解微生物复合菌剂的促生机制,还有待于进一步的研究。
微生物复合菌剂可提高单一微生物菌剂在农业中的应用可靠性和有效性,在世界范围内得到了广泛的应用[3, 10]。然而,目前对微生物复合菌剂构建方法的研究还不够深入。国内外对微生物复合菌剂的构建方法主要有以下两种:(1)大多根据菌株的不同功能以1:1 (体积比或生物量比)的形式构建微生物复合菌剂;(2)以菌株的功能为基础,通过构建微生物复合菌剂数学模型对复合菌剂的物种配比进行研究。目前微生物复合菌剂的两种主要构建方法对复合菌剂中物种的功能考虑较单一,往往考虑某个物种一种或两种促生特性进行复合菌剂构建,而事实上植物促生菌具有多种促生特性且共同决定植物的生长情况。本文的复合菌剂数学模型则考虑到菌株5种促生特性共同对盆栽水稻的影响,后续将考虑菌株更多的促生特性(如固氮能力、解钾能力等)用于优化模型。
本研究按照生物量1:1的比例复配成微生物复合菌剂,并假设复合菌剂促生特性为复配的两种菌株功能叠加的结果,探索菌剂促生特性与植株特征的相互关系。根据偏相关性结果可知菌剂促生特性与植物特征密切相关,据此构建复合菌剂的概念模型,即促生能力与促生效果方程。将本文实验所得结果带入概念模型,通过显著性检验可知方程(数学模型)具有显著意义。因此可根据菌种的促生特性,利用本文的数学模型调整复合菌剂的物种(其中的一种或两种),预测盆栽水稻生长,从而初步排除促生效果较差的复合菌剂,快速获取复合菌株的最佳搭配,节省一部分盆栽实验和一定的人力、物力,提高微生物复合菌剂的研发效率。目前尚未发现研究人员从菌株促生特性与植物特征出发构建微生物复合菌剂数学模型用以预测盆栽水稻生长的研究,所以本研究初步构建的模型,因考虑的因素较少可能存在一些缺陷,如实验中没有考虑土壤因素对复合菌剂活性的影响和菌株之间的相互关系对复合菌剂活性的影响等。要深入了解系统内复杂环境对复合菌剂活性的影响,还需要大量理论机理研究的支持。本文复合菌剂数学模型经过检验可适用于盆栽水稻,但可能不适用于其他作物和大田试验,如要构建模型用于其他作物或者大田试验,本文的概念模型则为合理构建微生物复合菌剂提供了一个全新的思路,只需通过实验获得菌剂促生特性与植物特征的相关系数(bi),再经过复合菌剂的促生能力与促生效果确定线性或非线性回归方程即可,因此本文对合理构建和开发复合菌剂仍然具有一定的指导作用。此外,将复合菌剂的促生效果与菌株各个促生特性进行多元非线性回归分析也可能会产生意想不到的效果,值得后续研究。本文筛选的复合菌剂FN具有较大的应用潜力,但还需通过田间试验进一步验证其促生效果的稳定性。
综上所述,本文将解淀粉芽孢杆菌(Bacillus amyloliquefaciens) FH-1与其他7株植物促生菌按照生物量1:1的比例复配成微生物复合菌剂,通过盆栽实验筛选出一种明显促进水稻生长的微生物复合菌剂FN。菌剂促生特性和水稻特征偏相关性结果表明,解无机磷能力(IP)、产铁载体能力(SI)和产ACC脱氨酶能力(ACC)在促进植物生长过程中可能发挥着比其他功能更重要的作用。根据菌株促生特性和植物特征的偏相关性结果构建了微生物复合菌剂数学模型,可为微生物复合菌剂的研发提供一定的指导。
| [1] |
Guo QR. Discussion on reducing pollution induced by methane, fertilizer and pesticide in rice with drip irrigation under mulch film[J]. Crop Research, 2012, 26(3): 278-281. (in Chinese) 郭庆人. 膜下滴灌水稻栽培技术对降低甲烷气体排放以及化肥、农药施用污染的探讨[J]. 作物研究, 2012, 26(3): 278-281. DOI:10.3969/j.issn.1001-5280.2012.03.18 |
| [2] |
Wang JJ, Wang H, Yin TT, et al. The persistence and performance of phosphate-solubilizing Gluconacetobacter liquefaciens qzr14 in a cucumber soil[J]. 3 Biotech, 2017, 7(5): 294. DOI:10.1007/s13205-017-0926-z |
| [3] |
Baez-Rogelio A, Morales-García YE, Quintero-Hernández V, et al. Next generation of microbial inoculants for agriculture and bioremediation[J]. Microbial Biotechnology, 2017, 10(1): 19-21. |
| [4] |
Berg G. Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture[J]. Applied Microbiology and Biotechnology, 2009, 84(1): 11-18. |
| [5] |
Li J, Jiang X, Li L, et al. Development of microbial fertilizer and maintaining of soil biological fertility[J]. Soil and Fertilizer Sciences in China, 2006(4): 1-5. (in Chinese) 李俊, 姜昕, 李力, 等. 微生物肥料的发展与土壤生物肥力的维持[J]. 中国土壤与肥料, 2006(4): 1-5. DOI:10.3969/j.issn.1673-6257.2006.04.001 |
| [6] |
Siddiqui ZA, Zehra N. Biocontrol of wilt disease complex of pea using Pseudomonas fluorescens and Rhizobium sp.[J]. Archives of Phytopathology and Plant Protection, 2012, 45(19): 2340-2346. DOI:10.1080/03235408.2012.727072 |
| [7] |
Bai YM, Zhou XM, Smith DL. Enhanced soybean plant growth resulting from coinoculation of Bacillus strains with Bradyrhizobium japonicum[J]. Crop Science, 2003, 43(5): 1774-1781. DOI:10.2135/cropsci2003.1774 |
| [8] |
Wang JW, Zhao JJ, Liu L, et al. Yield-increasing effect and resistance against wheat cereal cyst nematode of M-14 composite biological fertilizer[J]. Chinese Journal of Biological Control, 2016, 32(5): 676-680. (in Chinese) 王继雯, 赵俊伟, 刘莉, 等. M-14复合生物肥料抗小麦孢囊线虫及增产效果[J]. 中国生物防治学报, 2016, 32(5): 676-680. |
| [9] |
Bai Y, Qian JM, Zhou JM, et al. Crop microbiome: breakthrough technology for agriculture[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(3): 260-265. (in Chinese) 白洋, 钱景美, 周俭民, 等. 农作物微生物组:跨越转化临界点的现代生物技术[J]. 中国科学院院刊, 2017, 32(3): 260-265. |
| [10] |
Wang JJ, Li QQ, Xu S, et al. Traits-based integration of multi-species inoculants facilitates shifts of indigenous soil bacterial community[J]. Frontiers in Microbiology, 2018, 9: 1692. DOI:10.3389/fmicb.2018.01692 |
| [11] |
Figueiredo MVB, Burity HA, Martínez CR, et al. Alleviation of drought stress in the common bean (Phaseolus vulgaris L.) by co-inoculation with Paenibacillus polymyxa and Rhizobium tropici[J]. Applied Soil Ecology, 2008, 40(1): 182-188. DOI:10.1016/j.apsoil.2008.04.005 |
| [12] |
Atieno M, Herrmann L, Okalebo R, et al. Efficiency of different formulations of Bradyrhizobium japonicum and effect of co-inoculation of Bacillus subtilis with two different strains of Bradyrhizobium japonicum[J]. World Journal of Microbiology and Biotechnology, 2012, 28(7): 2541-2550. DOI:10.1007/s11274-012-1062-x |
| [13] |
Korir H, Mungai NW, Thuita M, et al. Co-inoculation effect of Rhizobia and plant growth promoting Rhizobacteria on common bean growth in a low phosphorus soil[J]. Frontiers in Plant Science, 2017, 8: 141. |
| [14] |
Madhaiyan M, Poonguzhali S, Kang BG, et al. Effect of co-inoculation of methylotrophic Methylobacterium oryzae with Azospirillum brasilense and Burkholderia pyrrocinia on the growth and nutrient uptake of tomato, red pepper and rice[J]. Plant and Soil, 2010, 328(1/2): 71-82. |
| [15] |
Egamberdieva D, Wirth S, Jabborova D, et al. Coordination between Bradyrhizobium and Pseudomonas alleviates salt stress in soybean through altering root system architecture[J]. Journal of Plant Interactions, 2017, 12(1): 100-107. DOI:10.1080/17429145.2017.1294212 |
| [16] |
Xu WH, Lv ZH, Shi YR, et al. Establishment of complex growth-promoting rhizobacteria for watermelon and promoting effect on watermelon roots[J]. Acta Agriculturae Zhejiangensis, 2018, 30(5): 778-786. (in Chinese) 徐伟慧, 吕智航, 史一然, 等. 西瓜复合根际促生菌剂构建与促生效应研究[J]. 浙江农业学报, 2018, 30(5): 778-786. |
| [17] |
Li QQ, Xu S, Zhao W, et al. Rhizosphere microbiome mediated growth-promoting mechanisms of Bacillus amyloliquefaciens FH-1 on rice[J]. Acta Microbiologica Sinica, 2019, 59(12): 2410-2426. (in Chinese) 李晴晴, 徐松, 赵维, 等. 根际微生物组介导的解淀粉芽孢杆菌FH-1对水稻的促生机制[J]. 微生物学报, 2019, 59(12): 2410-2426. |
| [18] |
Wang H, Wang JJ, Xu S, et al. Screening and growth promoting characteristics of efficient organophosphate- degradation bacteria[J]. Acta Microbiologica Sinica, 2017, 57(5): 667-680. (in Chinese) 王欢, 王敬敬, 徐松, 等. 有机磷降解菌的筛选及其促生特性[J]. 微生物学报, 2017, 57(5): 667-680. |
| [19] |
Yin TT, Wang JJ, Liu Y, et al. The screening of efficient phosphorus-solubilizing bacteria and the primary study on its mechanism of plant-growth-promoting[J]. Biotechnology Bulletin, 2015, 31(12): 234-242. (in Chinese) 银婷婷, 王敬敬, 柳影, 等. 高效解磷菌的筛选及其促生机制的初步研究[J]. 生物技术通报, 2015, 31(12): 234-242. |
| [20] |
Huang G, Gao H, Wang C, et al. ACC 30 strain with ACC deaminase activity: its isolation, identification and growth-promoting effect[J]. Microbiology China, 2013, 40(5): 812-821. (in Chinese) 黄盖, 高焓, 王琛, 等. ACC脱氨酶活性菌株ACC 30的分离、鉴定及其促生作用[J]. 微生物学通报, 2013, 40(5): 812-821. |
| [21] |
Wang JW, Zhen J, Xie BE, et al. Isolation and screening of organic phosphorus-solubilizing bacterium and its initial identification[J]. Henan Sciences, 2011, 29(1): 31-34. (in Chinese) 王继雯, 甄静, 谢宝恩, 等. 有机磷降解菌的分离筛选及初步鉴定[J]. 河南科学, 2011, 29(1): 31-34. DOI:10.3969/j.issn.1004-3918.2011.01.010 |
| [22] |
Wu X, Gan BC, Huang ZQ, et al. Screening and identification of A IAA biosynthesis strain and optimization of its culture conditions[J]. Journal of Sichuan Agricultural University, 2014, 32(4): 432-435, 461. (in Chinese) 吴翔, 甘炳成, 黄忠乾, 等. 一株产IAA菌株的筛选、鉴定及培养条件优化[J]. 四川农业大学学报, 2014, 32(4): 432-435, 461. DOI:10.3969/j.issn.1000-2650.2014.04.013 |
| [23] |
You H, Pu Q, Wen F, et al. Isolation and screening of bacteria strain with ACC deaminase activity and its effect on hairy root of Salvia miltiorrhiza[J]. Journal of Zhejiang Sci-Tech University (Natural Sciences), 2017, 37(5): 720-726. (in Chinese) 尤红, 普倩, 文芳, 等. ACC脱氨酶菌株的分离筛选及对丹参毛状根的影响[J]. 浙江理工大学学报:自然科学版, 2017, 37(5): 720-726. |
| [24] |
Saleh SS, Glick BR. Involvement of gacS and rpoS in enhancement of the plant growth-promoting capabilities of Enterobacter cloacae CAL2 and UW4[J]. Canadian Journal of Microbiology, 2001, 47(8): 698-705. DOI:10.1139/w01-072 |
| [25] |
Chen X, Liu XY, Zhang XY, et al. Phytoremediation effect of Scirpus triqueter inoculated plant-growth-promoting bacteria (PGPB) on different fractions of pyrene and Ni in co-contaminated soils[J]. Journal of Hazardous Materials, 2017, 325: 319-326. DOI:10.1016/j.jhazmat.2016.12.009 |
| [26] |
Illmer P, Schinner F. Solubilization of inorganic calcium phosphates—Solubilization mechanisms[J]. Soil Biology and Biochemistry, 1995, 27(3): 257-263. DOI:10.1016/0038-0717(94)00190-C |
| [27] |
Liang JG, Shi YF, Zhu LH. Study on the mechanism of plant root circumference promoting bacteria[J]. Modern Agricultural Science and Technology, 2008(17): 133-135. (in Chinese) 梁建根, 施跃峰, 竺利红. 植物根围促生细菌作用机制的研究[J]. 现代农业科技, 2008(17): 133-135. DOI:10.3969/j.issn.1007-5739.2008.17.087 |
| [28] |
Yao JP, Yao T, Wang XL. Research progress and application of 1-aminocyclopropane-1-carboxylate deaminase[J]. Biotechnology, 2010, 20(2): 87-91. (in Chinese) 姚军朋, 姚拓, 王小利. ACC脱氨酶的应用研究进展与评述[J]. 生物技术, 2010, 20(2): 87-91. |
| [29] |
Mo YW, Li XJ, Wang H, et al. Effect of Auxin treatment on root hair formation and aquaporins genes expression in root hair of rice[J]. Scientia Agricultura Sinica, 2015, 48(21): 4227-4239. (in Chinese) 莫亿伟, 李夏杰, 王海, 等. IAA对水稻根毛形成与水通道蛋白基因表达关系的研究[J]. 中国农业科学, 2015, 48(21): 4227-4239. DOI:10.3864/j.issn.0578-1752.2015.21.004 |
| [30] |
Meng LY, Li B, Sun LN, et al. Evaluation of physiological activities of plant growth-promoting rhizosphere bacteria of rice[J]. Soils and Fertilizers Sciences in China, 2014(1): 90-94. (in Chinese) 孟丽媛, 李冰, 孙乐妮, 等. 水稻根际促生细菌促生生理活性评价[J]. 中国土壤与肥料, 2014(1): 90-94. |
| [31] |
Liu JY, Cui SS, Han GM, et al. The physiological activities and growth-promoting effects of cotton PGPR[J]. Soils and Fertilizers Sciences in China, 2013(6): 88-92. (in Chinese) 刘静洋, 崔松松, 韩国民, 等. 棉花根际细菌的生理活性和促生效果[J]. 中国土壤与肥料, 2013(6): 88-92. |
| [32] |
Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1327-1350. |
 2020, Vol. 47
2020, Vol. 47