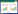扩展功能
文章信息
- 黄家庆, 叶菁, 李艳春, 林怡, 刘岑薇, 王义祥
- HUANG Jia-Qing, YE Jing, LI Yan-Chun, LIN Yi, LIU Cen-Wei, WANG Yi-Xiang
- 生物炭对猪粪堆肥过程中细菌群落结构的影响
- Effect of biochar on bacteria community structure of pig manure composting
- 微生物学通报, 2020, 47(5): 1477-1491
- Microbiology China, 2020, 47(5): 1477-1491
- DOI: 10.13344/j.microbiol.china.190603
-
文章历史
- 收稿日期: 2019-07-23
- 接受日期: 2020-01-06
- 网络首发日期: 2020-02-20
2. 福建省红壤山地农业生态过程重点实验室 福建 福州 350013
2. Fujian Key Laboratory of Agricultural Ecological Process of Red Soil Mountain, Fuzhou, Fujian 350013, China
堆肥化处理能有效利用农业有机废弃物,广泛应用在禽畜粪便的处理,通过高温好氧发酵将有机废弃物降解成可以利用的有机肥,实现畜禽粪便无害化处理[1-3]。堆肥化生产的有机肥应用于种植业,不仅提高土壤肥力和节约化肥,还能促进养种结合,实现循环农业的持续发展[4]。作为养猪大国,如何经济有效地处理猪粪便制约着养猪业的发展。由于猪粪便含大量的有机质和微量元素,这为堆肥化处理猪粪便提供了坚实的基础[5-7]。
堆肥化处理主要依靠细菌、真菌、放线菌等自然微生物对有机物进行降解,最终形成腐殖质[8]。堆肥化过程中微生物的代谢活动非常活跃,累积的产热能够迅速持久地升高堆体温度,来源不同的堆肥及其不同的时期,微生物数量、种群结构和代谢强度有很大的差别,从而影响堆肥转化效率[9-14]。堆肥化过程中降解有机质的主体是微生物,细菌数量所占比例最大,放线菌次之,真菌的数量最少;随着堆体温度的升高,最高温度能达到60−70 ℃并持续1−2 d,随后进入堆肥高温期(50−60 ℃)并持续大约15 d,不耐热的微生物被抑制甚至被杀灭,大量嗜热和耐热的微生物持续得到壮大[15-20],微生物数量和群落结构就会发生显著改变。在堆肥的中后期,堆体温度会下降到稍高于室温并保持相对稳定,在开放的环境和空气对流的情况下,空气原有的微生物和堆肥扩散到空气中的微生物就会重新进入堆肥中,此时微生物的数量和群落结构会再一次发生显著改变。研究堆肥过程中微生物数量和群落的动态变化规律,对调控堆肥化过程和提高腐熟程度显得尤为重要[21-22]。
生物炭(biochar,BC)是指生物质在完全无氧或缺氧条件下,经高温裂解产生的一种富含碳、高度芳香化和高稳定性的多孔固体颗粒物质,其含有大量的碳和营养元素,可溶性极低,有丰富的孔隙结构和表面含氧活性基团、极高的比表面积、较强的阳离子交换能力和稳定的化学性质,是一种具备很强吸附能力的多功能材料,广泛应用于农业、工业和环境领域[21-28]。添加生物炭的禽畜粪便能够加速有机物的降解[29]。生物炭和猪粪混合能产生更好的营养成分,可作为土壤改良剂使用[30]。一定范围内,随着生物炭添加量的增加,微生物的数量和活性都显著提高[31]。添加2%生物炭到农田土壤,细菌和真菌的丰度均呈现增加趋势[32]。当生物炭含量为10%时,生物膜上硝化细菌和反硝化细菌数量最大[33]。已经完成的早期实验发现,堆肥的温度和生物炭添加量有一定的关系[20]。测定猪粪堆肥温度变化的过程中发现,在堆肥的高温期(4−20 d),3%生物炭添加量的堆体温度波动较大,而6%生物炭添加量的堆体温度波动较小;在堆肥的温度稳定期(21−40 d),3%生物炭添加量的堆体温度是最高的,其次是6%生物炭添加量的堆体温度[20]。在堆肥的温度稳定期,堆体温度越高说明堆肥细菌的活力和代谢活动保持得越强。基于本研究所长期的实际农业操作,收集到批次不同的新鲜猪粪和来源不同的生物炭按一定比例进行混合,以3%−6%质量比的生物炭添加猪粪中能加速堆肥化进程,提高堆肥的肥力,尤其将堆肥化后得到的有机肥施放到茶园、盐碱化的果园和番薯种植地,对改良土壤能取得较好的效果。由于这些添加生物炭的猪粪堆肥作为有机肥连续多年施入菜园土壤和茶园土壤,生物炭含量逐年累积,过高的生物炭含量并不利于土壤细菌等微生物和植物的生长[31-33]。目前,生物炭对猪粪堆肥细菌群落结构的影响尚未见相关报道。本研究根据实验的分析需要并结合实际情况,通过在猪粪堆肥中混合不同比例的生物炭(以3%递增,即0%、3%、6%、9%),利用Illumina MiSeq高通量测序技术研究堆肥高温期和温度稳定期细菌群落结构的动态变化规律,同时分析堆肥细菌与环境因子的关系,为生物炭和猪粪堆肥的应用提供参考。
1 材料与方法 1.1 样品采集生猪新鲜粪便和菌渣采自福建省福清市某猪场,花生壳生物炭购自河南商丘三利新能源有限公司。猪粪便、菌渣和生物炭的基本性质:碳氮比(C/N)为28.39;含水率为50%−55%[20]。
1.2 主要试剂和仪器Phanta Max Super-Fidelity DNA Polymerase,南京诺唯赞生物科技有限公司;细菌基因组DNA提取试剂盒、土壤基因组DNA提取试剂盒、Universal DNA纯化回收试剂盒,天根生化科技(北京)有限公司。超净工作台,苏州净化设备有限公司;电泳仪,北京六一仪器厂;凝胶成像系统,Siemon公司;台式冷冻离心机,Eppendorf公司;−80 ℃超低温冰箱、超微量紫外分光光度计,Thermo公司;PCR仪,Applied Biosystems公司;超纯水系统、电子天平,Sartorius公司。
1.3 试验设计试验共设4个处理(T1、T2、T3和T4),生物炭添加量(按质量百分比)分别是0%、3%、6%和9%。猪粪便、菌渣和生物炭混合后的碳氮比(C/N)均为28.39,初始含水率为50%−55%。为保证4个处理在堆肥化前基本性质的一致性,需要对猪粪便、菌渣和生物炭的混合物分别进行3个重复,共准备12个混合物。当12个混合物的碳氮比和含水率分别是28.3和50%−55%时,说明猪粪便、菌渣和生物炭已经充分混合,消除了可能由操作引起的错误,此时在3个重复中随机选一个混合物进入下一步的堆肥化处理,一共选取4个混合样。堆肥采用自制的强制通风静态反应箱对各处理进行好氧发酵,总体积1 200 L。通风采用时间控制法。堆肥前1−7 d,鼓风机每30 min鼓风30 min,第8−25天,鼓风机每隔1 h鼓风30 min,第26−40天,鼓风机每隔75 min鼓风30 min。利用数显温度计测量和记录空气环境和堆体的温度,每天测定3次取平均值,堆肥共持续40 d。整个堆肥过程中温度的变化如图 1所示[20]。分别在堆肥的高温期(4−20 d)和温度稳定期(21−40 d)采集堆肥样品用于细菌群落结构变化的测定,一共收集8个样品,样品编号分别是堆肥高温期的T1-1、T2-1、T3-1、T4-1和堆肥温度稳定期的T1-2、T2-2、T3-2、T4-2。
|
| 图 1 不同堆肥处理温度的变化 Figure 1 Changes of temperature in different composting treatments 注:CK:堆肥期间的气温;T1、T2、T3、T4:生物炭添加量为0%、3%、6%和9%的堆肥温度.下同. Note: CK: The environmental temperature during the composting; T1, T2, T3 and T4: The composting temperatures with biochar content of 0%, 3%, 6% and 9% respectively. The same below. |
|
|
按照细菌基因组DNA提取试剂盒的说明书提取细菌的总DNA,通过1%琼脂糖凝胶电泳鉴定所提取基因组DNA的完整性,用NanoDrop超微量紫外分光光度计选取DNA纯度和浓度较高的样品作为模板,采用引物338F (5′-ACTCCTACGGGA GGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′) PCR扩增细菌16S rRNA基因。PCR反应条件:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 1 min 30 s,35个循环;72 ℃ 10 min;16 ℃保温。PCR反应体系:2×Phanta Max Buffer 25 μL,dNTPs (10 mmol/L) 1 μL,上、下游引物(10 μmol/L)各2 μL,Phanta Max Super-Fidelity DNA Polymerase (1 U/μL) 1 μL,细菌DNA模板1 μL (< 50 ng),补足ddH2O至50 μL。扩增后得到的PCR产物利用2%琼脂糖凝胶电泳进行检测,并使用Universal DNA纯化回收试剂盒回收,将PCR产物送至上海美吉生物医药科技有限公司进行Illumina PE文库的构建和基于Illumina MiSeq平台进行高通量测序和分析。
1.5 数据分析与处理本文进行的数据分析均基于上海美吉生物医药科技有限公司所提供的云服务(https://www.i-sanger.com)进行。基于Illumina分析平台对Fasta等相关文件进行原始数据的过滤处理、提取非重复序列来降低冗余的计算量、去除没有重复的单序列、优化得到的序列和去除嵌合体序列。根据不同的相似度水平对所有序列进行操作分类单元(operational taxonomicunit,OTU)划分,用97%相似水平的OTU进行统计分析。序列比对后按照97%相似性水平进行OTU聚类,得到OTU的代表序列,所用软件Usearch (version 7.1)。将所有优化序列Map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。采用R语言进行数据整理,差异显著性检验(Duncan法)和相关性分析(Pearson相关检验),并绘制相关图表。利用Mothur (version 1.30.1)软件做Rarefaction分析,抽平计算多样性指数(Chao1、Ace、Shannon、Simpson和Coverage)和绘制Shannon-Wiener曲线。利用QIIME软件绘制稀释曲线(rarefaction curve)、主成分分析(principal component analysis,PCA),绘制相关性热图(heatmap)。根据UniFrac算法,利用Fast UniFrac计算样本间距离矩阵绘制热图等。其他的数据分析软件和算法参考上海美吉生物医药科技有限公司官方网站的说明。所有样品的原始序列已经提交至NCBI SRA (https://www.ncbi.nlm.nih.gov/sra/),登录号为PRJNA589225。
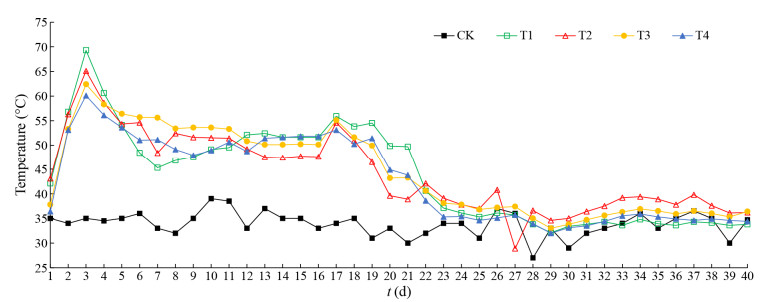
2 结果与分析 2.1 稀释性曲线稀释曲线反映样品的测序深度和比较样品中细菌的丰富度,可以用来评价测序量是否足以覆盖所有类群。从图 2可以看出,8条样品的OTU稀释曲线基本趋于平缓,并已经达到平台期;文库的覆盖率达到99% (表 1),绝大多数细菌类群已包括在本文库中。说明样本的OTU覆盖度已经饱和,实际测序量足以覆盖样品中所有的细菌类型,能够真实地反映细菌之间的相对比例关系和细菌群落的多样性。
|
| 图 2 相似度为0.97条件下堆肥处理的OTU稀释曲线 Figure 2 The OTUs rarefaction curves of the composting treatments at cut off level of 3% |
|
|
| 样品编号 Treatment No. |
序列数 Reads |
操作分类单元 OTUs |
ACE指数 ACE index |
Chao1指数 Chao1 index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
覆盖率 Coverage (%) |
| T1_1 | 30 482 | 629 | 715 | 735 | 4.04 | 0.057 0 | 99.60 |
| T1_2 | 30 482 | 627 | 709 | 732 | 4.32 | 0.032 4 | 99.60 |
| T2_1 | 30 482 | 692 | 755 | 754 | 4.62 | 0.026 7 | 99.65 |
| T2_2 | 30 482 | 653 | 724 | 714 | 4.05 | 0.059 9 | 99.64 |
| T3_1 | 30 482 | 654 | 717 | 715 | 4.42 | 0.034 1 | 99.67 |
| T3_2 | 30 482 | 520 | 615 | 607 | 4.07 | 0.038 4 | 99.63 |
| T4_1 | 30 482 | 680 | 733 | 748 | 4.73 | 0.020 3 | 99.68 |
| T4_2 | 30 482 | 643 | 725 | 723 | 4.47 | 0.029 9 | 99.61 |
| 注:T1_1、T2_1、T3_1、T4_1分别代表 4个堆肥处理的高温期;T1_2、T2_2、T3_2、T4_2分别代表 4个堆肥处理的稳定期. Note: T1_1, T2_1, T3_1 and T4_1 represent the high-temperature period of four composting treatments, respectively. T1_2, T2_2, T3_2 and T4_2 represent the stable-temperature period of four composting treatments, respectively. |
|||||||
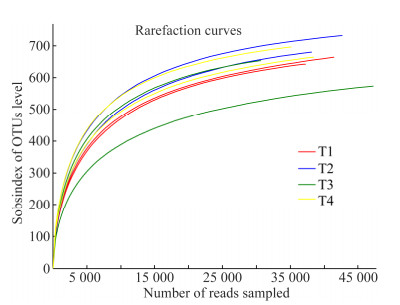
利用Venn图可以直观表现各样品间OTU重叠情况,并反映出不同处理样品间共有和特有的OTU数目(图 3)。结合OTU所代表的细菌,可以找到不同处理的核心细菌。对4个堆肥处理进行细菌类群分析(OTU分析),如图 3所示:T1、T2、T3和T4处理分别得到了748、779、732和751个OTU。有638个OTU为4个处理共有,共有菌群所占T1、T2、T3和T4的比例分别为85.29%、81.90%、87.16%和84.95%,这表明4个处理的整体细菌类群比较一致,但是各个处理之间也有所差异。T1、T2、T3和T4各自独有的OTU分别只有10、3、4和2,说明4个处理独有细菌的比例很低。T1与T2、T3、T4分别共有的OTU有12、4、7个;T2与T3、T4分别共有的OTU有7、18个;T3和T4相互之间共有的OTU有2个;T1、T2和T3相互之间共有的OTU有30;T1、T2和T4相互之间共有的OTU有37个;T1、T3和T4相互之间共有的OTU有13个;T2、T3和T4相互之间共有的OTU有37个,这表明4个处理相互之间共有的细菌比例也很低。猪粪堆肥添加生物炭后仍能保持堆肥细菌结构的稳定性,但也因生物炭添加量的不同,4个处理相互之间产生了细菌结构的差异,这就需要研究生物炭添加量和堆肥细菌变化的关系,有助于了解不同处理中所含的主要细菌类型及其生态功能。
|
| 图 3 不同处理中共有和独有OTU数目的Venn图 Figure 3 The venn diagram based on common or unique OTUs number in the different treatments 注:序列按相似度高于0.97进行OTU聚类,图中数字为各处理中的OTU数量. Note: The sequences are clustered according to the similarity above 0.97, the number in the figures is the OTUs amount. |
|
|
用ACE和Chao1指数表示细菌群落的丰富度,用Shannon和Simpson指数表示细菌群落的多样性。如表 1所示,ACE、Chao1和Shannon指数在堆肥高温期的值比温度稳定期高。在堆肥高温期,随着生物炭添加量的增加,ACE、Chao1和Shannon指数出现升高的趋势;但在堆肥温度稳定期,随着生物炭添加量的增加,ACE、Chao1和Shannon指数呈下降的趋势。说明生物炭对猪粪堆肥细菌群落的丰富度和多样性均产生影响,堆肥高温期的细菌丰富度和多样性要大于温度稳定期,并且随着生物炭的添加量增加,细菌的丰富度和多样性也要增加。
2.4 细菌群落β-多样性分析根据Bray-curtis距离算法,对细菌进行非度量多维尺度(non-metric multidi-mensional scaling,NMDS)分析(图 4)。生物炭添加量和堆肥温度在维度NMDS1和维度NMDS2能够很好地被区分开,几乎平均分布在4个象限。其中Stress值为0.077,很好地证明了数据的可靠性,实验样本能真实地反映不同堆肥处理的细菌群落组成。
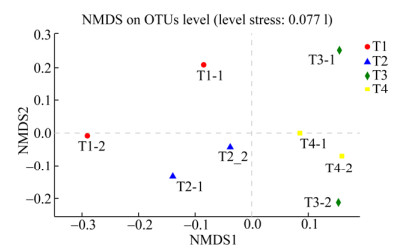
|
| 图 4 基于相似性 > 97%的OTU水平上非度量多维度分析 Figure 4 NMDS plot on OTUs level (similarity over 97%) |
|
|
主坐标分析(principal co-ordinates analysis,PCoA)是一种非约束性的数据降维分析方法,通过分析不同样品群落组成,从而显示样品间的差异和距离,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映样品间差异的2个特征值,样品物种组成越相似,反映在PCoA图中的距离越近。通过对生物炭添加量和堆肥温度的细菌群落进行PCoA分析(图 5),将多维的细菌变量降维成2个变量,其中第一主坐标(PC1)的贡献率为49.67%,第二主坐标(PC2)的贡献率为25.96%,二者累积贡献率为75.63%。从图 5中可以看出,堆肥温度不同,4个处理的细菌相距较远,尤其是T1-1和T1-2、T3-1和T3-2相距最远,2个堆肥温度相互之间的细菌群落差异很大;生物炭添加量不同,4个处理的细菌相距也较远,但T1-1和T3-1、T1-2和T3-2有聚合的趋向,并且分布在同一个象限内,生物炭添加量使堆肥细菌群落结构既有相似性又有差异性。

|
| 图 5 不同样品微生物菌群基于门水平丰度的PCoA分析 Figure 5 Principal co-ordinates analysis (PCoA) of microbial community based on phylum abundance among different samples |
|
|
Heatmap图以颜色深浅直观显示数据值的大小,颜色越红代表相对丰度越高,并将数据进行样本间丰度相似性分块聚类,对高丰度和低丰度的细菌进行分别聚合,通过颜色变化和聚合程度反映细菌种群结构的相似性和差异性。
根据颜色变化可知(图 6),细菌种群在属水平上的丰度受到生物炭添加量和堆肥温度的影响。根据红色的深浅变化,可以看出Anaerolineaceae、Chryseolinea、Nonomuraea、Steroidobacter、Bacillus、Longispora和Rhodothermaceae是猪粪堆肥丰度最高的细菌类群,并且相互聚合在一起,但其丰度在生物炭添加量和堆肥温度不同时有明显的变化;生物炭添加量不同时,Streptomyces、Ruminofilibacter和Sporacetigenium的丰度出现明显的增减变化,并且聚合在一起。堆肥温度不同时,Luteimonas、Luteivirga、Streptomyces和Silanimona的丰度出现明显的增减变化,并且聚合在一起。从总体看,生物炭添加量和堆肥温度对猪粪堆肥细菌的丰度均产生明显的影响。
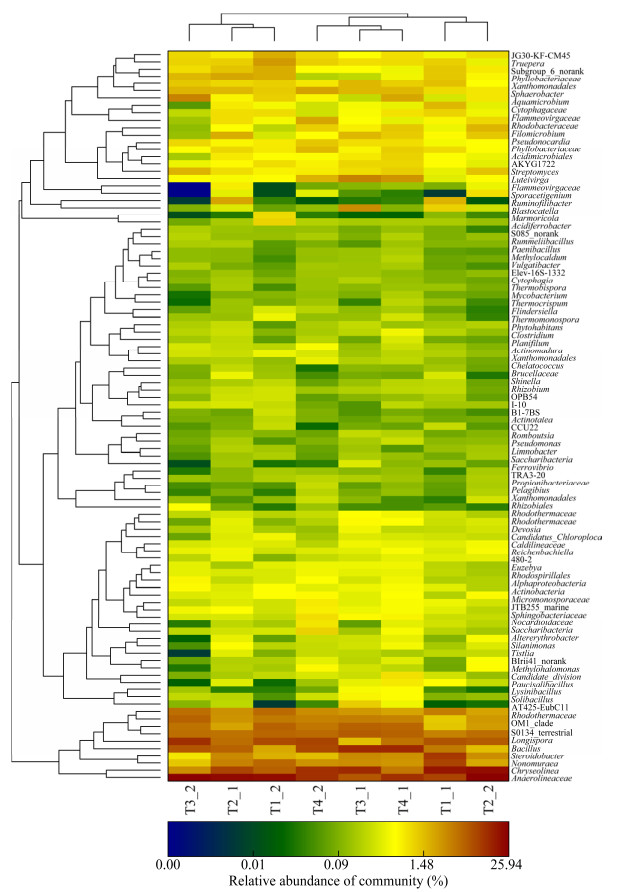
|
| 图 6 细菌群落在属水平上的群落Heatmap图和聚类树分析 Figure 6 The community heatmap of bacteria at the genus level and clustering tree analysis 注:图中显示细菌在属分类(y轴)在每个样品(x轴)中的相对丰度;颜色条代表相对丰度大小,热图下侧和右侧分别为样品名称和物种名称,左侧和上侧分别为物种聚类树和样本聚类树.热图中颜色的深浅分别代表物种丰度的高低, 正下面颜色的梯度变化表示不同的细菌相对丰度. Note: The relative percentage of genus classification of bacteria (y axis) within each sample (x axis clustering) was shown. Colour bars represent the relative percentage, the bottom and the right side of the heat map are the sample name and species name respectively, the left and the upper side are the species clustering tree and the sample clustering tree respectively. The shade of color represents the abundance of species. The relative values for bacterial family are indicated by color intensity with the legend indicated at the top left corner. |
|
|
从细菌的多样性上看,所得到的细菌中高丰度(深红色)的细菌只有9个,极低丰度(深蓝色)的细菌只有2个,大部分细菌的丰度在0.001%−1%。说明对猪粪堆肥起主要作用的优势细菌只有少数几个,其他细菌对猪粪堆肥则没有产生显著的影响,猪粪的堆肥化过程中应该对高丰度的细菌加以研究。
2.6 细菌在门和属水平上的群落结构分布在门水平上可将猪粪堆肥的细菌划分成10大类群(图 7),主要的细菌有(相对丰度 > 1%) Proteobacteria (OTU38,23.620%)、Actinobacteria (OTU15,23.502%)、Bacteroidetes (OTU48,23.037%)、Chloroflexi (OTU32,10.915%)、Gemmatimonadetes (OTU69,7.355%)、Firmicutes (OTU31,7.322%)、Acidobacteria (OTU152,1.447%)和Deinococcus- Thermus (OTU286,1.306%),共8个菌,合计占比达到98.504%,其他细菌占比均低于1%。生物炭添加量和堆肥温度对占比最大的Actinobacteria影响不明显;Firmicutes的占比随着生物炭添加量的增加而增加,在堆肥高温期的占比明显高于堆肥温度稳定期;Chloroflexi在堆肥温度稳定期的占比明显高于堆肥高温期;生物炭添加量和堆肥温度不同时,Chloroflexi、Bacteroidetes、Proteobacteria、Gemmatimonadetes、Acidobacteria和Deinococcus- Thermurn所占的比例出现无规律的增减波动。可见,在门水平上生物炭添加量和堆肥温度对堆肥细菌群落结构有明显的影响。
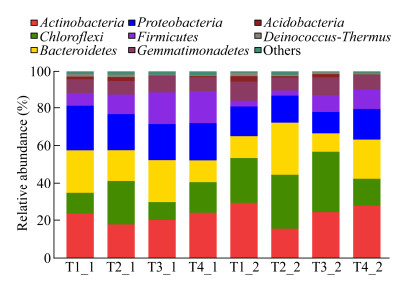
|
| 图 7 各处理在门分类水平上细菌群落组成及其相对丰度 Figure 7 Composition and relative abundance of bacteria groups among different treatments at phylum level |
|
|
在属水平上可将猪粪堆肥的细菌划分成9大类群(图 8),主要的细菌有(相对丰度 > 1%) Chryseolinea (OTU11,17.371%)、Subgroup_6_norank (OTU662,13.122%)、Steroidobacter (OTU484,10.281%)、Anaerolineaceae (OTU383,8.624%)、Nonomuraea (OTU407,8.448%)、Longispora (OTU205,6.804%)、Bacillus (OTU489,3.900 7%)、Sporacetigenium (OTU726,1.722%)、Luteimonas (OTU159,1.591%)、Phyllobacteriaceae (OTU599,1.421%)、Truepera (OTU139,1.306%)、Rhodothermaceae (OTU508,1.181%)和Aquamicrobium (OTU103,1.076%)共13个菌,合计占比达到76.487 7%,其他细菌占比均低于1%。Anaerolineaceae和Longispora在堆肥温度稳定期的占比明显高于堆肥高温期;Bacillus在堆肥高温期的占比明显高于堆肥温度稳定期,并且随着生物炭添加量的增加而明显增加。Nonomuraea的占比随着生物炭添加量的增加而急剧减少。总的来看,生物炭添加量和堆肥温度不同,堆肥细菌的占比有明显的增减变化。
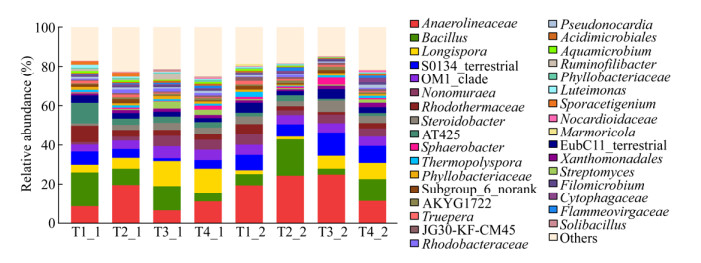
|
| 图 8 各处理在属分类水平上细菌群落组成及其相对丰度 Figure 8 Composition and relative abundance of bacteria groups among different treatments at genus level |
|
|
另外,细菌群落结构分布图显示丰度最高的细菌也是群落Heatmap图丰度最高的细菌,两者到得的结果基本一致,从而得到猪粪堆肥丰度最高的细菌。
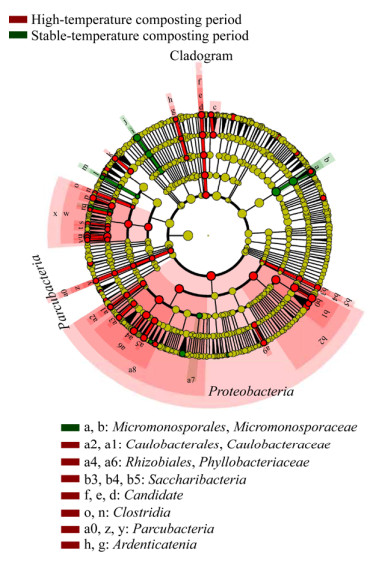
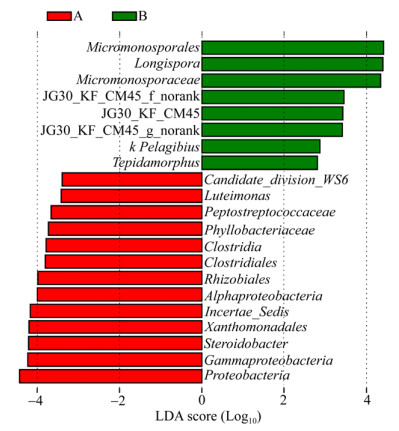
2.7 LEfSe分析有差异的细菌种群LEfSe (linear discriminant analysis effect size)分析用非参数因子克鲁斯卡尔-沃利斯秩和验检[non-parametric factorial Kruskal-Wallis (KW) sum-rank test]找到与丰度有显著差异的细菌种群,并按照不同的分组进行线性判别分析(linear discriminant analysis,LDA),找出对样本产生显著影响的细菌,从而估算每个组分丰度对差异效果影响的大小。结果显示,猪粪堆肥高温期和温度稳定期的细菌群落结构有很大的差异,有差异的细菌达到85个。使用缺省对数值将猪粪堆肥的804个细菌种群分成堆肥高温期和堆肥温度稳定期,进化分支图清晰显示LDA值高于3.5的分类单元(图 9)。堆肥高温期含有70种细菌,其中有7个LDA值接近4,分别是Rhizobiales、Incertae_Sedis、Proteobacteria、Alphaproteobacteria、Xanthomonadales、Gammaproteobacteria和Steroidobacter。堆肥温度稳定期含有15种细菌,其中有3个LDA值接近4,分别是Micromonosporales、Longispora和Micromonosporaceae。LEfSe结果也显示(图 10),在堆肥高温期起主要作用的细菌是Parcubacteria、Caulobacterales、Caulobacteraceae、Rhizobiales、Phyllobacteriacea、Saccharibacteria、Candidate、Ardenticatenia和Clostridia,其中Rhizobiales、Phyllobacteriaceae和Clostridia的LDA值大于3.5。在堆肥温度稳定期起主要作用的细菌是Micromonosporales和Micromonosporaceae,这2个细菌的LDA值均大于3.5。说明猪粪堆肥的细菌种群在堆肥高温期参与堆肥转化的过程,而且堆肥高温期的细菌多样性要显著高于堆肥温度稳定期。
|
| 图 9 基于两种堆肥温度的微生物类群分析 Figure 9 Indicator microbial groups within the two types of compost temperature with LDA values higher than 4 注:统计两个分组中有显著差别的细菌类群,通过LDA分析(线性回归分析)获得相应的LDA值. Note: The bacterial groups with significant differences between the two groups were statistically analyzed, and the corresponding LDA values were obtained by LDA analysis (linear regression analysis). |
|
|
|
| 图 10 基于细菌种类组成的LEfSe分析 Figure 10 LEfSe analysis based on bacterial species composition 注:聚类树中2个分组以红色和绿色表示,红色和绿色节点分别表示起到重要作用的细菌类群,黄色节点则表示没有起到重要作用的细菌类群;细菌名称显示在右侧图中,丰度最高的细菌种群以颜色代表差异(红色表示堆肥高温期,绿色表示堆肥稳定期);每个圆的直径与分类单元的丰度成正比,圆圈代表从域到属的系统发育水平,标签显示细菌门和属的水平. Note: The clustering tree, the two groups are shown in red and green, red and green nodes representing that play an important role in the bacterial groups respectively, and yellow nodes representing the bacterial groups that do not play an important role in the two groups. The names of the bacteria are shown in the right diagram. Differences are represented in the color of the most abundant class (Red indicates the maximum temperature of the compost, and green indicates the stable temperature of the compost). Each circle's diameter is proportional to the taxon's abundance. Circles represent phylogenetic levels from domain to genus inside out. Labels are shown of the phylum and genus levels. |
|
|
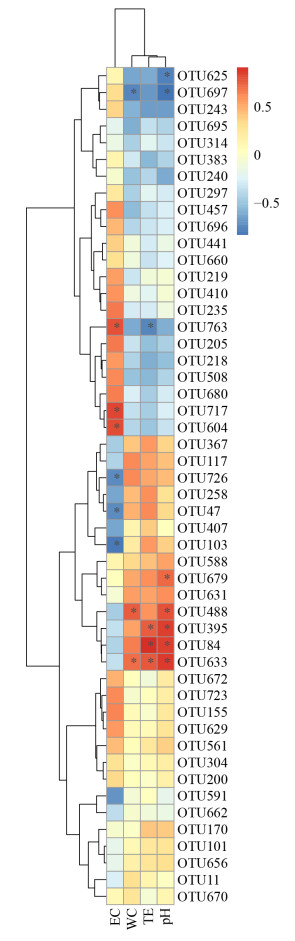
选取OTU水平上丰度靠前的细菌进行Heatmap相关性分析,通过计算环境因子与所选OTU之间的相关性(Pearson系数),将获得的数值直观地显示在Heatmap图中,并对环境因子和细菌类群进行聚类分析,展现不同细菌类群对堆肥环境的适应性(图 11)。结果显示,堆肥电导率(electrical conductivity,EC)、含水量(water content,WC)、温度(temperature,TE)、酸碱度(power of hydrogen,pH)与部分细菌有显著的相关关系(P < 0.05)。仅与pH负相关的有Gemmatimonadetes (OTU625)和Longispora (OTU679)。仅与EC负相关的有Sporacetigenium (OTU726)、Luteimona (OTU47)和Aquamicrobium (OTU103);正相关的有Filomicrobium (OTU717)和Gemmatimonadetes (OTU604)。Thermomicrobia (OTU763)与TE负相关却与EC正相关。Longispora (OTU697)与WC和pH均负相关,β-Proteobacteria (OTU488)与WC和pH均正相关。Phyllobacteriaceae (OTU395)和Bacterium (OTU84)与TE和pH均正相关。Rhodothermaceae (OTU633)与TE、WC和pH正相关。β-Proteobacteria (OTU488)、Rhodothermaceae (OTU633)、Phyllobacteriaceae (OTU395)和Bacterium (OTU84)在分布上聚合在一起,是与WC、TE和pH相关性最高的细菌。高丰度的细菌Anaerolineaceae (OTU383,8.624%)、Chryseolinea (OTU11,17.371%)、Longispora (OTU205,6.804%)、Nonomuraea (OTU407,8.448%)、Rhodothermaceae (OTU508,1.181%)、Subgroup_6_norank (OTU662,13.122%)、Aquamicrobium (OTU103,1.076%)和Sporacetigenium (OTU726,1.722%)也与TE、EC、WC和pH有相关性,但相关性均未达到显著水平(P < 0.05)。此结果说明,含水率、电导率、温度和pH能对猪粪堆肥的细菌产生影响,但对堆肥高丰度的细菌则无显著影响。
|
| 图 11 Heatmap相关性分析 Figure 11 The heatmap correlationship analysis 注:R值在图中以不同颜色展示;*:P < 0.05. Note: R values are shown with different colors in the figure; *: P < 0.05. |
|
|
由Venn图得知T1−T4细菌的占比为81.90%−87.16%,细菌类群基本保持一致,但从4个处理交叉和独有的细菌数目以及PCoA分析和细菌群落组成分析发现,各个处理之间已经产生了差异。这就需要分析生物炭添加量和堆肥温度对猪粪堆肥细菌群落的影响。随着生物炭用量的增加,堆肥高温期的细菌多样性和丰度随之增加,但堆肥温度稳定期的细菌多样性和丰度却出现下降。
堆肥的种类对细菌的种群和代谢强度有很大的影响,从而影响堆肥的转化效率[9-14]。除了研究堆体温度对细菌的影响外,也要考虑猪粪堆肥外加生物炭后对堆肥转化效果的影响。生物炭具有吸附能力并含有大量营养元素[23-28],广泛应用于改善堆肥条件和提高堆肥效率[34]。猪粪堆肥的主要细菌受生物炭添加量和堆肥温度的影响,Streptomyces、Ruminofilibacter和Sporacetigenium受生物炭添加量的影响最大,Luteimonas、Luteivirga、Streptomyces和Silanimonas受堆肥温度的影响最大。Actinobacteria受生物炭添加量和堆肥温度的影响不明显。随着生物炭添加量和堆肥温度的增加,Firmicutes和Bacillus的占比增加;随着堆肥温度的下降,Anaerolineaceae和Longispora的占比增加;随着生物炭添加量的增加,Nonomuraea占比急剧下降。从Heatmap图和细菌群落组成分析得知,生物炭添加比例是3%和6%时,Actinobacteria、Proteobacteria、Chloroflexi和Firmicutes在各处理间的差异最大。
猪粪堆肥的高温阶段是有机质腐化最快的时期,对堆肥转化起作用的细菌数量和种类迅速增加,细菌、真菌和放线菌等微生物的代谢活动使堆体的温度持续上升并维持很长时间[8, 35-38]。堆体最高温度(60−70 ℃)持续1−2 d后,便进入持续15 d的堆肥高温期(50−60 ℃),不耐热的微生物被抑制或杀灭,耐热或嗜热的微生物则迅速壮大起来[15-20]。虽然在空气对流和鼓风机的作用下,空气的细菌源源不断地进入猪粪堆肥,但由于堆体的温度维持在50−60 ℃长达15 d[20],不耐热的细菌会被长时间抑制。此时细菌的数量和群落结构必然发生显著改变,对猪粪堆肥转化起作用的细菌就会大量产生。猪粪堆肥在第21天时进入堆肥温度稳定期并持续20 d,此时堆体的温度下降到稍高于室温。在鼓风机和空气对流的作用下,空气原有的细菌和猪粪扩散到空气中的细菌就会重新进入猪粪堆肥中。不耐热的细菌重新得到生长,嗜热的细菌受抑制,已经大量增殖的细菌要和重新得到生长的细菌竞争生长资源,会出现相互抑制的现象[21-22]。此时细菌的数量和群落结构又会发生显著改变。添加生物炭的猪粪堆肥在堆肥高温期和堆肥温度稳定期细菌群落结构的差异显得十分重要。堆肥高温期有70个细菌,高丰度的细菌有7个;而堆肥温度稳定期仅有15个细菌,高丰度的细菌也仅有3个。对猪粪堆肥转化起显著作用的细菌,堆肥高温期有9个,其中有3个是高丰度细菌,Proteobacteria的占比高达23.620%,而堆肥温度稳定期仅有2个细菌。可见,猪粪堆肥高温期的细菌群落多样性要明显高于堆肥温度稳定期,部分高丰度的细菌在猪粪堆肥高温阶段参与了堆肥转化过程。
猪粪堆肥高温期和温度稳定期的电导率、含水率、温度和pH的变化能影响猪粪堆肥细菌的生长,但不能显著影响堆肥高丰度细菌的生长。这说明猪粪堆肥添加生物炭添后,堆肥物料的理化性质发生了改变,生物炭为堆肥细菌提供了合适的生长环境,从而降低了环境因子对堆肥细菌的不利影响。
| [1] |
Sundberg C, Yu D, Franke-Whittle I, et al. Effects of pH and microbial composition on odour in food waste composting[J]. Waste Management, 2013, 33(1): 204-211. |
| [2] |
Wang X, Selvam A, Lau SSS, et al. Influence of lime and struvite on microbial community succession and odour emission during food waste composting[J]. Bioresource Technology, 2018, 247: 652-659. |
| [3] |
Zhang JC, Zeng GM, Chen YN, et al. Effects of physico-chemical parameters on the bacterial and fungal communities during agricultural waste composting[J]. Bioresource Technology, 2011, 102(3): 2950-2956. |
| [4] |
Zhang XC, Deng S, Wang XD. Impact of decay promoting agent on maturity changes during composting of livestock and poultry manure[J]. Chinese Journal of Environmental Engineering, 2015, 9(2): 888-894. (in Chinese) 张雪辰, 邓双, 王旭东. 快腐剂对畜禽粪便堆肥过程中腐熟度的影响[J]. 环境工程学报, 2015, 9(2): 888-894. |
| [5] |
Li RH, Wang JJ, Zhang ZQ, et al. Nutrient transformations during composting of pig manure with bentonite[J]. Bioresource Technology, 2012, 121: 362-368. |
| [6] |
Ren XN, Awasthi MK, Wang Q, et al. New insight of tertiary-amine modified bentonite amendment on the nitrogen transformation and volatile fatty acids during the chicken manure composting[J]. Bioresource Technology, 2018, 266: 524-531. |
| [7] |
Gabhane J, William SPMP, Bidyadhar R, et al. Additives aided composting of green waste: Effects on organic matter degradation, compost maturity, and quality of the finished compost[J]. Bioresource Technology, 2012, 114: 382-388. |
| [8] |
Tang L. The Effects of Composting conditions on carbon losses and humus formation during the composting process[D]. Hangzhou: Master's Thesis of Hangzhou Normal University, 2016 (in Chinese) 唐璐.不同堆肥条件对堆肥过程中碳素损失及腐殖质形成的影响研究[D].杭州: 杭州师范大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10346-1016083114.htm |
| [9] |
Niu JL, Gao JX, Li YM, et al. Evaluation of the role of microorganisms in composting[J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 185-189. (in Chinese) 牛俊玲, 高军侠, 李彦明, 等. 堆肥过程中的微生物研究进展[J]. 中国生态农业学报, 2007, 15(6): 185-189. |
| [10] |
Guo MY. Research progress of enzyme activity in composting process[J]. Guangdong Chemical Industry, 2018, 45(1): 106-107. (in Chinese) 郭梅莹. 堆肥过程中的酶活性研究进展[J]. 广东化工, 2018, 45(1): 106-107. |
| [11] |
Zhang HB, Men HB, Shen YJ, et al. Research progress on microbial aerobic composting[J]. Journal of Agricultural Science and Technology, 2017, 19(3): 1-8. (in Chinese) 张海滨, 孟海波, 沈玉君, 等. 好氧堆肥微生物研究进展[J]. 中国农业科技导报, 2017, 19(3): 1-8. |
| [12] |
Ma LH. Study on microbial mechanism of nitrogen transformation during cow manure composting[D]. Yangling: Master's Thesis of Northwest A & F University, 2009 (in Chinese) 马丽红.牛粪高温堆肥化中氮素转化的微生物机理研究[D].杨凌: 西北农林科技大学硕士学位论文, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10712-2010049932.htm |
| [13] |
Lu YX, Gao P, Cui XW, et al. Study on nitrogen transformation and related microbial community changes during the composting process of Chinese medicinal herbal residues[J]. Research of Agricultural Modernization, 2018, 39(3): 527-534. (in Chinese) 鲁耀雄, 高鹏, 崔新卫, 等. 中药渣堆肥过程中氮素转化及相关微生物菌群变化的研究[J]. 农业现代化研究, 2018, 39(3): 527-534. |
| [14] |
Li LZ. Dynamic changes of culturable microbial community and their degradation abilities in thermophilic stage of cow manure composting[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2012 (in Chinese) 李凌之.牛粪高温堆肥中可培养高温微生物种群变化及特性研究[D].南京: 南京农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284603.htm |
| [15] |
Haruta S, Nakayama T, Nakamura K, et al. Microbial diversity in biodegradation and reutilization processes of garbage[J]. Journal of Bioscience and Bioengineering, 2005, 99(1): 1-11. |
| [16] |
Farhat A, Manai I, Gtari M, et al. Effect of enhancing nutrient balance in anaerobic digester feedstock by co-substrate addition on the microbial diversity and energy production from municipal sewage sludge[J]. Journal of Bioscience and Bioengineering, 2018, 126(4): 497-506. |
| [17] |
Liu J, Li W, Xu XH, et al. Effect of cellulose-decomposing strain on microbial community of cow manure compost[J]. Environmental Science, 2011, 32(10): 3073-3081. (in Chinese) 刘佳, 李婉, 许修宏, 等. 接种纤维素降解菌对牛粪堆肥微生物群落的影响[J]. 环境科学, 2011, 32(10): 3073-3081. |
| [18] |
Xu J, Xu XH. Effect of Streptomyces griseorubens C-5 on lignocellulose degradation and microbial community metabolic of compost[J]. Acta Energiae Solaris Sinica, 2018, 39(2): 285-291. (in Chinese) 徐杰, 许修宏. Streptomyces griseorubens C-5对堆肥木质纤维素降解及微生物群落代谢的影响[J]. 太阳能学报, 2018, 39(2): 285-291. |
| [19] |
Song GG, Fu MY, Zeng L. Research on microorganism quantity change of swine manure and living refuse mix compost[J]. Journal of University of South China (Science and Technology), 2008, 22(2): 24-27. (in Chinese) 宋光桃, 付美云, 曾雷. 猪粪与生活垃圾混合堆肥的微生物数量变化研究[J]. 南华大学学报:自然科学版, 2008, 22(2): 24-27. |
| [20] |
Li B, Ye J, Liu CW, et al. Effects of biochar addition on carbon transformation during composting of pig manure[J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3511-3518. (in Chinese) 李波, 叶菁, 刘岑薇, 等. 生物炭添加对猪粪堆肥过程碳素转化与损失的影响[J]. 环境科学学报, 2017, 37(9): 3511-3518. |
| [21] |
Zhang J, Sun ZY, Zhong XZ, et al. Maturity and microbial community structure dynamics during simulated windrow composting of solid fraction of dairy manure[J]. Chinese Journal of Applied & Environmental Biology, 2016, 22(3): 423-429. (in Chinese) 张晶, 孙照勇, 钟小忠, 等. 奶牛粪条垛式模拟堆肥腐熟度及微生物群落结构变化[J]. 应用与环境生物学报, 2016, 22(3): 423-429. |
| [22] |
Cao Y, Chang ZZ, Huang HY, et al. Chemical and biological changes during early stage of composting of different animal wastes[J]. Journal of Agro-Environment Science, 2015, 34(11): 2198-2207. (in Chinese) 曹云, 常志州, 黄红英, 等. 畜禽粪便堆肥前期理化及微生物性状研究[J]. 农业环境科学学报, 2015, 34(11): 2198-2207. |
| [23] |
Gou MM, Qu ZY, Wang F, et al. Progress in research on biochar affecting soil-water environment and carbon sequestration-mitigating emissions in agricultural fields[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(7): 1-12. (in Chinese) 勾芒芒, 屈忠义, 王凡, 等. 生物炭施用对农业生产与环境效应影响研究进展分析[J]. 农业机械学报, 2018, 49(7): 1-12. |
| [24] |
Kong SF, Yao XC, Zhang JY, et al. Review of characteristics of biochar and research progress of its applications[J]. Ecology and Environment Sciences, 2015, 24(4): 716-723. (in Chinese) 孔丝纺, 姚兴成, 张江勇, 等. 生物质炭的特性及其应用的研究进展[J]. 生态环境学报, 2015, 24(4): 716-723. |
| [25] |
Yao LD, Cheng GH, Wang LX, et al. Effects of biochar application to microorganisms in soil[J]. Environmental Chemistry, 2015, 34(4): 697-704. (in Chinese) 姚玲丹, 程广焕, 王丽晓, 等. 施用生物炭对土壤微生物的影响?[J]. 环境化学, 2015, 34(4): 697-704. |
| [26] |
Xie ZB, Liu Qi, Xu YP, et al. Advances and perspectives of biochar research[J]. Soils, 2011, 43(6): 857-861. (in Chinese) 谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J]. 土壤, 2011, 43(6): 857-861. |
| [27] |
Ran ZX. Research progress in preparation methods of biochar based fertilizers and application in agricul-ture[J]. Anhui Agricultural Science Bulletin, 2019, 25(9): 116-118. (in Chinese) 冉宗信. 生物炭基肥料的制备方法及其在农业中的应用研究进展[J]. 安徽农学通报, 2019, 25(9): 116-118. |
| [28] |
Chen WF, Zhang WM, Meng J. Biochar and agro-ecological environment: review and prospect[J]. Journal of Agro-Environment Science, 2014, 33(5): 821-828. (in Chinese) 陈温福, 张伟明, 孟军. 生物炭与农业环境研究回顾与展望[J]. 农业环境科学学报, 2014, 33(5): 821-828. |
| [29] |
Dias BO, Silva CA, Higashikawa FS, et al. Use of biochar as bulking agent for the composting of poultry manure: effect on organic matter degradation and humification[J]. Bioresource Technology, 2010, 101(4): 1239-1246. |
| [30] |
Zhang ZH, Yuan QX, Dai P. Biochar fertilizer utilization characteristics of mixed pyrolysis of livestock manure and straw[J]. Journal of Huazhong Agricultural University, 2019, 38(1): 133-138. (in Chinese) 张子豪, 袁巧霞, 代佩. 畜禽粪便与秸秆混合热解制备生物炭研究[J]. 华中农业大学学报, 2019, 38(1): 133-138. |
| [31] |
Steiner C, Teixeira WG, Lehmann J, et al. Long term effects of manure, charcoal and mineral fertilization on crop production and fertility on a highly weathered Central Amazonian upland soil[J]. Plant and Soil, 2007, 291(1/2): 275-290. |
| [32] |
Bamminger C, Zaiser N, Zinsser P, et al. Effects of biochar, earthworms, and litter addition on soil microbial activity and abundance in a temperate agricultural soil[J]. Biology and Fertility of Soils, 2014, 50(8): 1189-1200. |
| [33] |
Liu J, Han SQ, Qi JH, et al. Influence of biochar content on in-situ denitrification of sediment and microbial activity[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(1): 106-110. (in Chinese) 刘杰, 韩士群, 齐建华, 等. 生物碳含量对底泥活化原位脱氮及微生物活性的影响[J]. 江苏农业学报, 2016, 32(1): 106-110. |
| [34] |
Li RH, Zhang GJ, Zhang ZQ, et al. Improving pig manure and rice husk compost technology and quality by wood charcoal addition[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(16): 230-238. (in Chinese) 李荣华, 张广杰, 张增强, 等. 添加木炭改善猪粪稻壳好氧堆肥工艺及质量[J]. 农业工程学报, 2014, 30(16): 230-238. |
| [35] |
Gao W, Zheng GD, Gao D, et al. Transformation of organic matter during thermophilic composting of pig manure[J]. Environmental Science, 2006, 27(5): 986-990. (in Chinese) 高伟, 郑国砥, 高定, 等. 堆肥处理过程中猪粪有机物的动态变化特征[J]. 环境科学, 2006, 27(5): 986-990. |
| [36] |
Wang RY, Zhou T, Wan K, et al. Dynamic transformation of physical and chemical properties during different composting of garden wastes[J]. Tianjin Agricultural Sciences, 2017, 23(11): 96-99. (in Chinese) 王瑞莹, 周童, 万可, 等. 不同类型园林废弃物堆肥过程中理化性质的动态变化[J]. 天津农业科学, 2017, 23(11): 96-99. |
| [37] |
Castaldi P, Alberti G, Merella R, et al. Study of the organic matter evolution during municipal solid waste composting aimed at identifying suitable parameters for the evaluation of compost maturity[J]. Waste Management, 2005, 25(2): 209-213. |
| [38] |
Zhang L, Sun XY. Addition of fish pond sediment and rock phosphate enhances the composting of green waste[J]. Bioresource Technology, 2017, 233: 116-126. |
 2020, Vol. 47
2020, Vol. 47