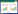扩展功能
文章信息
- 赵林, 付贵萍, 武金发, 庞伟程, 莫少聪, 祝子旺
- ZHAO Lin, FU Gui-Ping, WU Jin-Fa, PANG Wei-Cheng, MO Shao-Cong, ZHU Zi-Wang
- 一株耐盐的卓贝儿氏菌(Zobellella sp.)的分离鉴定及其硝酸盐还原能力
- Isolation, identification and nitrate reduction ability of a salt-tolerant strain of Zobellella sp.
- 微生物学通报, 2020, 47(5): 1354-1365
- Microbiology China, 2020, 47(5): 1354-1365
- DOI: 10.13344/j.microbiol.china.190515
-
文章历史
- 收稿日期: 2019-06-19
- 接受日期: 2019-12-05
- 网络首发日期: 2020-01-03
2. 深圳市海洋生物资源与生态环境重点实验室 广东 深圳 518055
2. Shenzhen Key Laboratory of Marine Bioresource and Eco-environmental Science, Shenzhen, Guangdong 518055, China
海水养殖水体中,氮元素常以-3至+5各价态在生物与非生物之间存在,各价态形式的氮在水体内不断迁移转化,形成一个复杂的动态循环[1]。硝态氮(NO3--N)是养殖水体中一种常见的氮赋存形式,在厌氧条件下极易被还原[2]。由于微生物种类和氧(O2)条件的差异,NO3--N还原可分为同化还原和异化还原途径。同化还原途径是微生物利用NO3--N合成细胞物质,整个过程既无NO2--N的积累,也无NH4+-N的产生。异化还原过程可根据产物的不同分为两种途径,一种途径以N2O、N2为产物,称为反硝化;另一种途径以NH4+-N为产物,称为硝酸盐异化还原为氨(dissimilatory nitrate reduction to ammonium,DNRA)[3-6]。
传统观点认为在低氧或无氧条件下,NO3--N易被环境中的厌氧反硝化细菌还原[3]。但近年来,在污水处理领域有大量关于好氧反硝化细菌的报道。好氧反硝化细菌不仅可以促进水体中的反硝化作用达到NO3--N的去除,更无需严格的厌氧环境[7]。相较于厌氧反硝化细菌,好氧反硝化细菌具有两大优势:(1)好氧反硝化细菌能在有氧条件下进行反硝化,使得硝化过程和反硝化过程能够在同一反应器中同步进行,节省反应空间和工程建设成本[8];(2)硝化和反硝化过程产生的酸碱相互抵消,基本无需调节系统pH,可大幅度降低运行成本[9]。除此之外,好氧反硝化细菌具有耐盐能力强,生长速度快,反硝化效率高等优点[10]。因此,近年来国内外众多学者开展了耐盐好氧反硝化细菌的研究工作,司圆圆等[11]从虾池过滤口筛选出一株脱氮性能较高的好氧反硝化细菌X12,其在最适脱氮条件下对亚硝态氮的去除率高达96.5%;石小彤等[12]从对虾养殖池底泥中分离出一株好氧反硝化细菌F1,初步鉴定为盐单胞菌(Halomonas sp.),该菌能在好氧条件下,40 h内高效地将硝酸盐浓度由442.28 mg/L降至58.28 mg/L,亚硝酸盐浓度由32.79 mg/L降至0.98 mg/L;无独有偶,唐婧等[13]从处理高盐废水的活性污泥中也分离出一株好氧反硝化细菌F10,该菌为盐单胞菌(Halomonas sp.),在盐度为3%的反硝化培养基中24 h内对NO3--N的去除率高达92.6%,36 h基本完全去除;He等[14]从污水处理厂筛选出一株好氧反硝化细菌TJPU04,经鉴定其是假单胞菌(Pseudomonas sp.)的一种,此外具有耐盐性能的好氧反硝化微生物类群还包括:陶厄氏菌(Thauera sp.)[15]、产碱杆菌(Alcaligenes sp.)[16]、气单胞菌(Aeromonass sp.)[17]、肠杆菌(Enterobacter sp.)[18]和不动杆菌(Acinetobacter sp.)[19]等。随着研究的逐渐深入,有学者发现某些好氧反硝化细菌还同时存在硝酸盐异化还原为氨(DNRA)的作用,其主要分为两个步骤:(1)硝酸盐还原为亚硝酸盐;(2)亚硝酸盐再进一步被还原为铵。反硝化和DNRA过程是硝态氮异化还原过程的重要环节,两者在底物和发生环境等方面较为相似,在同一菌株内存在两种途径更是罕见。因此,开展同种菌株的硝态氮异化还原机制及其影响因素的研究,对于加深氮素转化规律的认识,丰富生物脱氮理论和技术有着重要意义。
本实验从处理海水养殖污水的秋茄型人工湿地小试系统中优选出一株高效的具有好氧反硝化和DNRA能力的细菌,通过形态、生理生化特征和16S rRNA基因测序对其进行了鉴定,并考察了不同条件下菌株的生长和异化硝酸盐还原特性,以期为含盐废水生物脱氮工艺提供高效的微生物资源和最佳工艺运行参数。
1 材料与方法 1.1 样品的来源富集用的样品来源于实验室处理高盐污水的红树人工湿地小试系统的中上层基质[7]。
1.2 培养基富集培养基(g/L):葡萄糖1.00,CH3COONa 2.50,KH2PO4 2.00,MgSO4-7H2O 0.05,FeSO4-7H2O 0.02,CaCl2 0.02,NaCl 10.00-30.00,pH 7.60-8.20。102.80-122.90 kPa灭菌30.00 min,冷却后添加一定体积用0.22 μm微孔滤膜[20]过滤除菌的NaNO3溶液作为唯一氮源,其中NaNO3质量浓度为1.50 g/L。
分离培养基(g/L):胰蛋白胨10.00,酵母提取物5.00,NaCl 30.00,琼脂粉15.00,pH 7.30-7.50。102.80-122.90 kPa灭菌30.00 min。
反硝化基础培养基(g/L):CH3COONa 1.54,MgSO4-7H2O 0.10,K2HPO4-3H2O 6.00,KH2PO4 1.50,NaCl 30.00,微量元素[21] 2.00 mL,pH 7.30-7.50,102.80-122.90 kPa灭菌30.00 min,冷却后添加质量浓度为1.44 g/L过滤除菌的KNO3作为唯一氮源。
1.3 主要试剂和仪器硝普钠、苯酚、磺胺,国药集团化学试剂有限公司;其余化学试剂均为国产分析纯;Omega-GEN试剂盒,Omega Bio-Tek公司;细菌通用PCR引物、DNA Marker和Taq DNA聚合酶,广州艾基生物技术有限公司。
流动注射分析仪,Dechem-Tech.GmbH公司;PCR仪,Applied Biosystems公司;凝胶成像系统,上海复日科技有限公司;Sunrise酶标仪,帝肯(上海)贸易有限公司;高分辨扫描电镜,FEI公司;荧光倒置显微镜DMI1,莱卡公司。
1.4 耐盐菌株的富集和分离富集驯化:取盐度为1.80%的人工湿地系统基质为供筛土壤,去除植物根系及杂物,研磨后风干1-2 d。取10 g风干样本接种于200 mL的富集培养基中,28 ℃、180 r/min振荡培养,当80%的NaNO3消耗完后,以1%的体积转接至新鲜培养基中,进行二次富集[22]。前后共转接富集3次,其中培养基含盐量由10 g/L逐步提高到30 g/L。
分离纯化:富集培养后,采用梯度稀释平板涂布法,在分离培养基上进行单菌落的纯化与分离。
1.5 菌株的鉴定采用Omega-GEN试剂盒提取细菌A63全基因组DNA,并采通用引物27F (5′-AGAGTTTGA TCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTG TTACGACTT-3′)对DNA进行扩增[23]。PCR反应条件:95 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,32个循环;72 ℃ 10 min。扩增产物经2%琼脂糖凝胶电泳确定条带后交由广州艾基生物有限公司进行序列测定。将序列信息提交GenBank核酸信息库进行BLAST比对,利用MEGA 7.0软件,采用Neighbor-Joining法构建菌株的系统发育树[24]。
1.6 菌株的硝酸盐还原性能优化实验以硝酸盐(200 mg/L)为唯一氮源,采用单一变量方法在反硝化基础培养基中测定菌株在不同类型和分子量碳源(葡萄糖、蔗糖、甘露糖、乙酸钠、草酸钠和柠檬酸钠)、不同盐度(0%、1.0%、2.0%、3.0%、4.0%、5.0%、7.0%、10.0%)、不同初始C/N (2.0、4.0、6.0、8.0、10.0)、不同初始pH值(5.0、6.0、6.5、7.0、7.5、8.0、9.0、10.0)和不同温度值(20.0、25.0、27.0、30.0、33.0、35.0、40.0),160 r/min振荡培养48 h的氮代谢情况,取样测定培养液中剩余的NO3--N、NO2--N浓度和NH4+-N的生成量,分析不同条件下的总氮(total nitrogen,TN)去除效率和DNRA效率,每组实验做3个重复。
1.7 最佳脱氮性能实验把菌株A63用LB液体培养基进行扩培,4 ℃、8 200×g离心5 min收集对数生长期的细菌,用无菌人工海水重悬,调节OD600至1.5±0.05,以2%的接种量接种到反硝化基础培养基中,在以乙酸钠为唯一碳源的最优条件下进行培养,每隔6 h取样检测NO3--N、NO2--N和NH4+-N浓度,绘制氮代谢曲线并对该菌的脱氮性能进行分析。
2 结果与讨论 2.1 耐盐好氧反硝化菌株A63的分离及鉴定通过富集、分离,共得到3株耐盐并能高效去除NO3--N的细菌,选取一株优势菌株作为后续实验菌株,并命名为A63。如图 1所示,菌株A63为革兰氏阴性细菌,在扫描电子显微镜下观察其呈杆状,长约1.5-2.5 μm,宽0.6-0.8 μm (图 1B),37 ℃下培养24-48 h,在琼脂平板上产生直径为0.15-0.40 mm的圆形白色菌落,并且表面光滑,边缘整齐(图 1A)。为了分类鉴定A63菌株,通过PCR的方法获得了一个1 381 bp的16S rRNA基因片段,并对其进行了序列测定。相关序列信息已上传至GenBank数据库,并获得登录号:MN093321。利用MEGA 7.0软件[23],以Neighbor- Joining法构建菌株的系统发育树,如图 2所示。结果表明,菌株A63与菌株Zobellella denitrificans strain F13-1 (CP012621)有99.5%的相似性,结合细胞的形态特征,可初步确定菌株A63为卓贝儿氏菌(Zobellella sp.)。

|
| 图 1 菌株A63的形态特征 Figure 1 Morphological characteristics of strain A63 |
|
|
|
| 图 2 菌株A63基于16S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree of strain A63 based on the partial 16S rRNA gene sequence 注:括号中的序号表示该菌在GenBank数据库中的登录号;分支点上的数字表示置信度;标尺代表遗传变异系数. Note: The serial number in parentheses indicates GenBank accession number; The number at the branch represents the confidence interval; The scale represents the coefficient of genetic variation. |
|
|
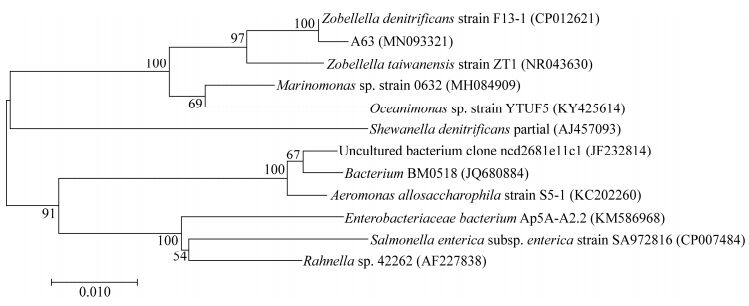
碳源的化学结构和分子量对反硝化效率有着重要影响[25],不同类型碳源对微生物的DNRA过程也有着不同影响。如图 3所示,在以柠檬酸钠为唯一碳源时,好氧反硝化作用最强,TN去除率高达97%,基本无NO2--N积累,仅有6.05 mg/L的NH4+-N生成,这说明柠檬酸钠作为唯一碳源能有效提供A63细菌反硝化所需的电子,促进反硝化脱氮作用,与此同时DNRA作用也不强烈;当碳源为蔗糖时,TN去除效果有所下降,脱氮率仅为50.5%,反应结束有30.7%的NO3--N未降解,基本无NO2--N积累,但有34.1 mg/L的NH4+-N生成,这说明在蔗糖作为唯一碳源下,菌株A63的DNRA作用有所增强;当碳源为乙酸钠时,TN去除率进一步下降(31.9%),反应结束后有大量NO2--N积累和部分NH4+-N的生成,分析认为乙酸钠为易被降解的小分子有机碳源,能够快速地被微生物利用,导致培养后期碳源不足,硝酸盐还原过程无法进行;当唯一碳源为葡萄糖和甘露糖时,TN去除效果最差,脱氮率仅为15.3%和18.0%,反应结束后分别有71.3%和71.5%的NO3--N未降解,虽然仅有少量NO2--N积累,但有较多NH4+-N的生成。唐婧等[13]从处理高盐废水的生物接触氧化池的活性污泥中分离得到的一株好氧反硝化假单胞菌F10,研究发现其在以乙酸钠为碳源时反硝化效果最好,脱氮率达92.71%,且只有微量NO2--N积累。此外,安健等[26]研究发现,耐盐好氧反硝化菌YX-16在小分子碳源乙酸钠的生长环境下降解速率高于大分子碳源蔗糖的生长环境;但我们的研究发现A63在以柠檬酸钠或蔗糖微碳源的生长环境中脱氮效率均高于小分子碳源乙酸钠的生长环境,这是因为不同种菌株对同种碳源的利用度往往不同,导致即使在同种碳源下反硝化效率各不相同。我们的研究与司圆圆等[11]对耐盐好氧反硝化细菌X12的研究发现较为相似,X12在以柠檬酸钠、葡萄糖和乙酸钠为唯一碳源时均能进行好氧反硝化,且在以柠檬酸钠为碳源时的脱氨效率大于95.0%,显著高于以乙酸钠为碳源时的脱氮效率。综上所述,A63的反硝化脱氮和DNRA作用受有机碳源的调控,在盐度为3.0%,C/N为6.0,pH 7.0,温度为35.0 ℃的实验条件下,其最适反硝化碳源为柠檬酸钠。
|
| 图 3 不同碳源下菌株A63的异化硝酸盐还原特性 Figure 3 Dissimilation nitrate reduction characteristics of strain A63 under different conditions |
|
|
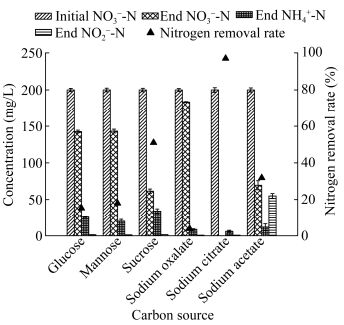
碳源对A63生长的影响方面分析结果如图 4所示。在以蔗糖为唯一碳源时,菌株生长快速,接种6 h后OD600达到最高值,为1.34,随后有所下降,进入稳定期,这是因为蔗糖是菌株较易利用的简单分子,同时降解速率较快,导致在反应后期碳源几乎被完全利用;在以柠檬酸钠为唯一碳源时,菌株生长效果最佳,接种18 h后进入稳定期,OD600达1.38;在以乙酸钠为碳源时,菌株在接种12 h后进入稳定期,OD600在0.78左右波动,长势一般;在以葡萄糖和甘露糖为碳源时,接种12 h后OD600达到最大值,分别为0.85和0.73,随后进入衰亡期,这是因为葡萄糖和甘露糖是易于生物降解的有机物,反应后期碳源不能满足菌株生长的需求,导致菌株死亡;以草酸钠为碳源时,菌株生长效果最差,生长趋势始终平缓,接种48 h后OD600仅为0.24。因此,结合菌株A63的生长曲线和脱氮效果,确定在盐度为3%,C/N为6,pH 7.0,温度为35 ℃的实验条件下,其最适碳源为柠檬酸钠。有机碳源作为反硝化细菌生长过程中必需的能源,不同的化学结构和分子量会影响微生物体内的一系列酶促反应,导致微生物在不同种碳源环境中有不同的生长速率[27-28]。柠檬酸钠作为一种小分子碳源在为A63提供有效的反硝化电子供体的同时,还能被其同化吸收,是菌株A63生长和进行反硝化的一种有利碳源。
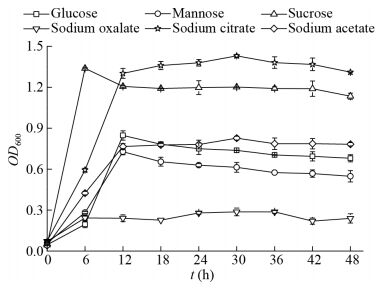
|
| 图 4 不同碳源对菌株A63生长的影响 Figure 4 Effects of different carbon sources on the growth of strain A63 |
|
|
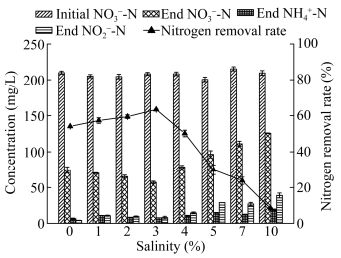
含盐废水的盐度范围广,一般在1%-20%之间,因此确定菌株A63的最适盐度范围对其应用至关重要。从图 5可知,在盐度为0%时,菌株A63能进行生长和氮代谢,接种48 h后TN去除率达54.1%,且DNRA作用也较弱,仅有6.42 mg/L NH4+-N生成;盐度逐步提高到1.0%、2.0%和3.0%时,TN去除率在逐渐提高,分别为57.3%、59.4%和63.4%,且存在一定量的NO2--N积累和NH4+-N的生成;随着盐度进一步升高到4.0%、5.0%、7.0%和10.0%,TN去除率开始逐渐下降,分别为50.2%、30.0%、23.8%和8.2%,且存在大量NO2--N的积累,DNRA作用也随着盐度升高明显增强,在盐度为10%时,反应结束生成了18.97 mg/L的NH4+-N。由此可见,菌株A63在淡水和盐度为1.0%-10.0%的环境中都能生长并发挥脱氮作用,且随盐度升高,其反硝化脱氮效率先升高后逐渐降低,DNRA作用逐渐增强。菌株A63的适宜盐度为3.0%,在适宜盐度下脱氮效果不够理想的主要原因是碳源的不足限制了反硝化的进行。唐婧等[13]对假单胞菌(Halomonas sp.)的一株耐盐好氧反硝化细菌F10的研究也有类似发现,随着盐度的升高F10脱氮效率呈先升高后降低的趋势,其在盐度为0%、10%和13%时几乎未生长。虽然本研究的菌株A63在盐度为0%环境下具有一定的脱氮能力,但在盐度为10%时菌株生长缓慢,TN去除率仅为8.2%。菌株A63虽具有良好的耐盐能力,但不适宜在高盐环境中生长和降解污染物。综上可知,菌株A63的适宜反硝化盐度为3.0%,且低盐度更有利于A63反硝化脱氮过程的发生。
|
| 图 5 不同盐度(以NaCl计)下菌株A63的异化硝酸盐还原特性 Figure 5 Dissimilation nitrate reduction characteristics of strain A63 under different salinity (measured by NaCl) |
|
|
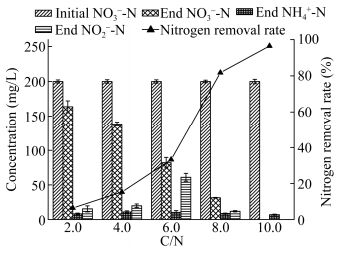
我国的化工废水、养殖废水和部分城市污水的C/N都比较低,实际处理过程中往往需要投加有机碳源来提高C/N以实现氮的高效去除[29-31]。考察2.0、4.0、6.0、8.0、10.0五个不同C/N比条件下,菌株A63的硝酸盐异化还原性能。结合图 6可知,当C/N比从2.0提高到10.0,TN去除率也在逐步提高,从6.38%增加到96.5%。当C/N比为2.0、4.0、6.0、8.0时,接种48 h后均有一定NO2--N积累和NH4+-N生成,其中C/N比为6.0时,NO2--N积累最显著,NH4+-N生成量也最大,反应结束分别有60.99 mg/L和12.6 mg/L。有关研究表明,仅有效C作为限制因子时,反硝化过程比DNRA更具有竞争性,随着C源的添加能有效促进反硝化过程的发生[32]。当C/N比提高到10.0时,仅有7.1 mg/L NH4+-N生成,无NO2--N的积累。张翠月等[33]研究了不同C/N条件下好氧反硝化菌群LHJ-1的脱氮性能,结果发现随着C/N从4.0上升到16.0,TN和NO3--N的去除率同步升高,这与A63随着C/N的升高所表现出的反硝化脱氮特性相一致。由上可知,A63的好氧反硝化作用在电子受体充分的环境中占具优势,而其DNRA作用在低C/N环境中更具优势。从实验可知,以乙酸钠为碳源,在盐度为3.0%,pH 7.0,温度为35.0 ℃的实验条件下,菌株A63最佳反硝化脱氮C/N为10.0。对于特定菌株,应根据其新陈代谢特征和面临的环境因素选择合适的C/N比。
|
| 图 6 不同C/N比下菌株A63的异化硝酸盐还原特性 Figure 6 Dissimilation nitrate reduction characteristics of strain A63 under different carbon-nitrogen ratio |
|
|
pH过高或过低均会对菌株的硝酸盐的异化还原过程产生严重影响。考察5.0、6.0、6.5、7.0、7.5、8.0、9.0、10.0八个不同初始pH值对菌株A63硝酸盐异化还原性能的影响。由图 7可知,在pH为5.0、6.0和6.5的弱酸性条件下,菌株A63的脱氮效果很差,TN去除率仅为3.8%、5.3%和24.1%,反应结束有80%-90%左右的NO3--N剩余及10 mg/L左右的NH4+-N生成;在初始pH为7.0和7.5时,TN去除率进一步提高到49.3%和最高点54.1%,且仅有极少量NO2--N积累,DNRA作用也相对较弱,仅有约7.0 mg/L的NH4+-N生成;随着pH进一步提高到8.0和9.0,TN去除率下降到30%左右,且NO2--N积累量迅速提高到26.0 mg/L左右,但NH4+-N的生成量依然较低;当pH提到10.0时,TN去除率进一步下降到14.3%,且依然有大量NO2--N的积累。前人的研究表明好氧反硝化细菌对中性和弱碱性环境适应性较强,脱氮效果较好[34-35]。在pH 7.0-10.0范围内,DNRA作用不强烈,仅有少量NH4+-N生成,这说明在中性和碱性环境下A63的DNRA作用不强烈,且菌株A63在碱性条件下的脱氮率远高于酸性环境,这是因为在氧化还原电位处于还原态时反硝化反应才能进行,而pH值对氧化还原电位有直接影响,当pH值过低时,培养基中的H+浓度增加,氧化还原电位提高,同时酶活性大大降低,影响反硝化效果[36]。由于反硝化与DNRA过程中亚硝态氮还原酶(Nir)不同,pH通过对Nir活性的影响可导致二者呈现出不同的竞争优势[37]。低pH会显著降低反硝化速率;而高pH能促进DNRA作用;DNRA作用相对增强的同时,反硝化程度会削弱[38]。但本研究中细菌A63在碱性环境下的DNRA作用也并未有所增强,这与以往的研究有所不同。由本结果分析可知,pH值的变化对菌株A63的氮代谢特性影响很大,其适宜脱氮pH范围为7.0-7.5。细菌A63在中性和弱碱性条件下的脱氮率显著高于弱酸性环境,这与目前大多数好氧反硝化细菌的研究结果相似。Yang等[34]从松花江筛选到一株好氧反硝化细菌Janthinobacterium sp. M-11,该菌在中性和弱碱性(pH 7.0-9.0)条件下的脱氮效率显著高于弱酸性环境(pH 5.0-7.0);无独有偶,司圆圆等[11]对好氧反硝化细菌X12的研究也有此发现,该菌在pH为7.0时反硝化脱氮效率最高,随着pH逐渐提高到8.2,脱氮效率逐渐降低,但始终高于pH为5.6和6.2时的脱氮效率。

|
| 图 7 不同初始pH下菌株A63的异化硝酸盐还原特性 Figure 7 Dissimilation nitrate reduction characteristics of strain A63 under different initial pH |
|
|
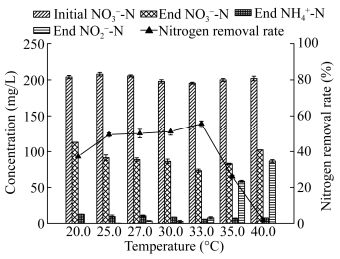
温度对反硝化细菌的生物量和介导反硝化过程所需酶的活性有着重要影响,进而影响其反硝化效率,多数反硝化细菌的最适生长温度是20.0-35.0 ℃[26]。选取20.0、25.0、27.0、30.0、33.0、35.0和40.0 ℃ 7个不同温度对A63的硝酸盐异化还原性能进行了研究。结果如图 8所示,温度小于33.0 ℃时,随着温度的升高,TN去除率逐渐提高,33.0 ℃达到最高55.7%,这主要是因为随着温度的逐渐升高,介导反硝化过程有关酶的活性逐渐增加,导致反硝化效率逐渐提升;当温度逐渐大于适宜温度33.0 ℃时,TN去除率显著下降,这一方面是因为温度“过高”,导致相关酶的活性降低,反硝化效率降低;另一方面是因为菌株A63在前期增殖较快,消耗了大量有机碳源,导致后期反硝化效果不完全,积累了大量NO2--N;当温度进一步提高到40.0 ℃时,NO2--N的积累量高达86.66 mg/L,TN去除率仅为1.8%。司圆圆等[11]对好氧反硝化细菌X12的研究发现,当温度小于30.0 ℃时,随温度上升TN去除效率逐步提高,至30 ℃时达到最高为96.5%,此后随着温度的升高,TN去除效率有所下降,这主要是因为菌株随温度升高增殖较快,提前达到对数期,菌株竞争性地利用营养物质,导致反硝化速率下降。此外,我们发现在不同温度条件下,DNRA作用都有发生,且低温和高温等不利生境更有利于DNRA作用的表达,这可能是因为受到温度的胁迫,细菌的一种自发行为。研究表明,当温度偏离33.0 ℃时(30.0 ℃或35.0 ℃),脱氮效果都有所降低,温度的变化直接影响微生物的酶活、生长速度,导致不同温度下菌株A63硝酸盐异化还原特性的差异。由以上分析可知,以乙酸钠为碳源,在盐度为3.0%,C/N为6.0,pH 7.0的实验条件下,菌株A63的适宜脱氮温度范围为30.0-35.0 ℃。
|
| 图 8 不同温度下菌株A63的异化硝酸盐还原特性 Figure 8 Dissimilation nitrate reduction characteristics of strain A63 under different temperatures |
|
|
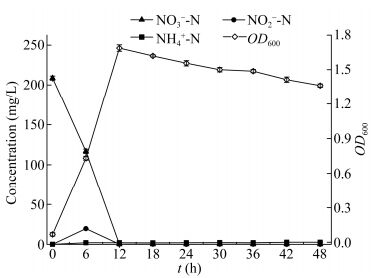
通过上述单因子研究,以乙酸钠为碳源时,菌株A63的适宜脱氮条件为:C/N值为10.0,盐度为3.0%,pH为7.0-7.5,温度为30.0-35.0 ℃。以乙酸钠为碳源,对最适条件下A63的脱氮性能进行了研究。结果如图 9所示,菌株A63生长速度快,接种6 h后即进入对数生长期,12 h后OD600达到最大值1.69,培养液中NO3--N浓度从208.8 mg/L降至0,TN去除率高达99%,培养过程中检测到少量NH4+-N (2 mg/L),且仅在6 h检测到19.51 mg/L NO3--N,随后再无NO3--N检出。这说明在最佳条件下,菌株A63的DNRA作用较弱,反硝化作用得到了加强,能在短时间内完成反硝化脱氮。
|
| 图 9 最佳条件下菌株A63的生长曲线及反硝化脱氮性能 Figure 9 Growth curve and denitrification performance of strain A63 under the optimum conditions |
|
|
在自然界中反硝化菌和DNRA菌协同竞争,它们可以在多种生境中共存,有相同的电子受体,利用碳源氧化提供的电子,共同还原基质硝酸盐。这种竞争机制受周围环境因子的制约和相关微生物的影响,属于此消彼长的关系[1]。一般认为DNRA作用在氮源缺乏、碳源丰富而不稳定的偏碱性环境中更容易发生,且随着盐度、温度的升高而增强。但在同一好氧菌株内两种异化硝酸盐还原途径的关系如何还未知。目前仅有李小义等[22]利用测序技术对分离的一株好氧反硝化菌F13-1的基因组经行了研究,发现其具有反硝化和DNRA的完整基因,但各种环境因子对菌株反硝化和DNRA过程的影响还不清楚。本研究中发现菌株A63在适宜的生长环境中DNRA作用基本不表达,而在“逆境”(如高盐度、低pH、低C/N、低温和高温)中DNRA作用显著。由于DNRA作用是以NO3--N为底物形成NH4+-N的还原过程,硝化过程是以NH4+-N为底物形成NO3--N的氧化过程,而A63的好氧反硝化是以NO3--N为底物最终形成N2的还原过程,推测DNRA作用很有可能是菌株A63处于“逆境”中的一种生存策略,把NO3--N还原为NH4+-N,再由环境中的其他氨氧化微生物把NH4+-N氧化为NO3--N供自身生长代谢。菌株A63的DNRA和好氧反硝化氮代谢途径与环境因子及实际环境中其他微生物的相互关系还需要进行深入的研究。
3 结论本研究从红树林人工湿地小试系统基质中富集分离到菌株A63,结合形态学特征及16S rRNA基因序列分析,初步鉴定其为卓贝尔氏菌(Zobellella sp.)。随后对该菌的反硝化特性和DNRA特性进行了初步研究。结果表明:
(1) 菌株A63生长条件广泛,在盐度0%-10.0%,pH值5.0-10.0,温度20.0-40.0 ℃范围内均能生长。菌株A63最适反硝化碳源为柠檬酸钠,以乙酸钠为碳源时,适宜脱氮盐度为3.0% (以NaCl计),pH为7.0-7.5,温度为30.0-35.0 ℃,C/N值为10.0。
(2) 菌株A63在不利生存环境下DNRA作用明显,其在高盐度、低C/N、弱酸性和低温等“逆境”条件下DNRA作用显著。
(3) 菌株A63脱氮效率高,在以乙酸钠为碳源的最优条件下,菌株A63在12 h内基本能把208.8 mg/L的NO3–-N去除完全,TN去除率高达99%以上,菌株A63在含盐废水的生物脱氮中具有巨大的应用价值。
| [1] |
Murphy AE, Anderson IC, Smyth AR, et al. Microbial nitrogen processing in hard clam (Mercenaria mercenaria) aquaculture sediments: the relative importance of denitrification and dissimilatory nitrate reduction to ammonium (DNRA)[J]. Limnology and Oceanography, 2016, 61(5): 1589-1604. |
| [2] |
Preena PG, Manju NJ, Deepesh V, et al. Genetic diversity of nitrate reducing bacteria in marine and brackish water nitrifying bacterial consortia generated for activating nitrifying bioreactors in recirculating aquaculture systems[J]. Aquaculture Research, 2017, 48(12): 5729-5740. |
| [3] |
Sun YH, De Vos P, Willems A. Influence of nitrate and nitrite concentration on N2O production via dissimilatory nitrate/nitrite reduction to ammonium in Bacillus paralicheniformis LMG 6934[J]. Microbiology Open, 2018, 7(4): e00592. |
| [4] |
Tao YL, Wen DH. Dissimilatory nitrate reduction to ammonium: the potential and impacts in estuarine regions[J]. Microbiology China, 2016, 43(1): 172-181. 陶怡乐, 温东辉. 细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响[J]. 微生物学通报, 2016, 43(1): 172-181. |
| [5] |
Yang S, Wu SJ, Cai YJ, et al. The synergetic and competitive mechanism and the dominant factors of dissimilatory nitrate reduction processes: a review[J]. Acta Ecologica Sinica, 2016, 36(5): 1224-1232. 杨杉, 吴胜军, 蔡延江, 等. 硝态氮异化还原机制及其主导因素研究进展[J]. 生态学报, 2016, 36(5): 1224-1232. |
| [6] |
Chen T, Li JF, Zou ZJ, et al. Effects of redox potential and pH on the effect of dissimilatory nitrate reduction to ammonium in bioretention system[J]. Science Technology and Engineering, 2018, 18(4): 368-373. 陈韬, 李剑沣, 邹子介, 等. 氧化还原电位和pH对生物滞留系统硝酸盐异化还原为氨作用的影响[J]. 科学技术与工程, 2018, 18(4): 368-373. |
| [7] |
Fu GP, Yu TY, Huangshen LK, et al. The influence of complex fermentation broth on denitrification of saline sewage in constructed wetlands by heterotrophic nitrifying/aerobic denitrifying bacterial communities[J]. Bioresource Technology, 2018, 250: 290-298. |
| [8] |
Huang TL, Guo L, Zhang HH, et al. Nitrogen-removal efficiency of a novel aerobic denitrifying bacterium, Pseudomonas stutzeri strain ZF31, isolated from a drinking-water reservoir[J]. Bioresource Technology, 2015, 196: 209-216. |
| [9] |
Ji B, Yang K, Zhu L, et al. Aerobic denitrification: a review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
| [10] |
Wang ZC, Gao MC, She ZL, et al. Effects of salinity on performance, extracellular polymeric substances and microbial community of an aerobic granular sequencing batch reactor[J]. Separation and Purification Technology, 2015, 144: 223-231. |
| [11] |
Si YY, Chen XH, Xu KH, et al. Isolation and denitrification characteristics of salt-tolerant aerobic denitrifying bacterial strain X12[J]. Agricultural Engineering, 2017, 7(2): 68-71. 司圆圆, 陈兴汉, 许开航, 等. 耐盐好氧反硝化细菌X12的分离及反硝化特性[J]. 农业工程, 2017, 7(2): 68-71. |
| [12] |
Shi XT, Li YQ, Xing GW, et al. Screening and primary identification of an aerobic denitrifier isolate with salt tolerance[J]. Biotechnology Bulletin, 2013(3): 175-180. 石小彤, 李彦芹, 邢国伟, 等. 一株耐盐好氧反硝化细菌的分离筛选及鉴定[J]. 生物技术通报, 2013(3): 175-180. |
| [13] |
Tang J, Xiao YN, Qu SS, et al. Identification and denitrification characteristics of a strain of halophilic denitrifying bacteria[J]. Chinese Journal of Environmental Engineering, 2014, 8(12): 5499-5506. 唐婧, 肖亚男, 屈姗姗, 等. 一株耐盐好氧反硝化细菌的分离鉴定及其脱氮特性[J]. 环境工程学报, 2014, 8(12): 5499-5506. |
| [14] |
He XL, Sun Q, Xu TY, et al. Removal of nitrogen by heterotrophic nitrification–aerobic denitrification of a novel halotolerant bacterium Pseudomonas mendocina TJPU04[J]. Bioprocess and Biosystems Engineering, 2019, 42(5): 853-866. |
| [15] |
Yao S, Ni JR, Chen Q, et al. Enrichment and characterization of a bacteria consortium capable of heterotrophic nitrification and aerobic denitrification at low temperature[J]. Bioresource Technology, 2013, 127: 151-157. |
| [16] |
Geed SR, Prasad S, Kureel MK, et al. Biodegradation of wastewater in alternating aerobic-anoxic lab scale pilot plant by Alcaligenes sp. S3 isolated from agricultural field[J]. Journal of Environmental Management, 2018, 214: 408-415. |
| [17] |
Chen MX, Wang WC, Feng Y, et al. Impact resistance of different factors on ammonia removal by heterotrophic nitrification–aerobic denitrification bacterium Aeromonas sp. HN-02[J]. Bioresource Technology, 2014, 167: 456-461. |
| [18] |
Fu GP, Han JY, Yu TY, et al. The structure of denitrifying microbial communities in constructed mangrove wetlands in response to fluctuating salinities[J]. Journal of Environmental Management, 2019, 238: 1-9. DOI:10.1016/j.jenvman.2019.02.029 |
| [19] |
Zhan H, Wang GJ, Chen CX. Identification and denitrification ability of an aerobic denitrifier[J]. Journal of Tianjin Agricultural University, 2017, 24(2): 44-48. 战海, 王广军, 陈成勋. 一株好氧反硝化细菌的分离鉴定及反硝化能力初测[J]. 天津农学院学报, 2017, 24(2): 44-48. |
| [20] |
Xu JZ, Chen B, Du BH, et al. Isolation and biological characteristics of a Stenotrophomonas maltophilia[J]. Biotechnology Bulletin, 2019, 35(3): 71-77. 徐敬昭, 陈贝, 杜秉海, 等. 一株嗜麦芽寡养单胞菌的分离及其生物学特性[J]. 生物技术通报, 2019, 35(3): 71-77. |
| [21] |
Yang HF, Tang JY, Hu AH, et al. Identification and denitrification characteristics of a denitrifier[J]. Chinese Journal of Environmental Engineering, 2014, 8(1): 366-371. 杨浩锋, 唐佳玙, 胡安辉, 等. 一株反硝化细菌的分离鉴定及其反硝化特性[J]. 环境工程学报, 2014, 8(1): 366-371. |
| [22] |
Li XY, Wang LP, Lai QL, et al. Preliminary study on aerobic denitrification characteristics of Zobellella sp. F13-1[J]. Journal of Applied Oceanography, 2016, 35(1): 122-129. 李小义, 王丽萍, 赖其良, 等. 一株卓贝尔氏菌F13-1好氧反硝化特性及其反硝化基因的初步研究[J]. 应用海洋学学报, 2016, 35(1): 122-129. |
| [23] |
Fu GP, Zhao L, Huangshen LK, et al. Isolation and identification of a salt-tolerant aerobic denitrifying bacterial strain and its application to saline wastewater treatment in constructed wetlands[J]. Bioresource Technology, 2019, 290: 121725. DOI:10.1016/j.biortech.2019.121725 |
| [24] |
Ahmadi M, Jorfi S, Kujlu R, et al. A novel salt-tolerant bacterial consortium for biodegradation of saline and recalcitrant petrochemical wastewater[J]. Journal of Environmental Management, 2017, 191: 198-208. |
| [25] |
Xu ZS, Dai XH, Chai XL. Effect of different carbon sources on denitrification performance, microbial community structure and denitrification genes[J]. Science of the Total Environment, 2018, 634: 195-204. DOI:10.1016/j.scitotenv.2018.03.348 |
| [26] |
An J, Song ZF, Yang XL, et al. Characteristics of aerobic denitrifying strain YX-6 and identification[J]. Journal of Fishery Sciences of China, 2010, 17(3): 561-569. 安健, 宋增福, 杨先乐, 等. 好氧反硝化细菌YX-6特性及鉴定分析[J]. 中国水产科学, 2010, 17(3): 561-569. |
| [27] |
Han YH, Zhang WX, Zhuang ZG, et al. Isolation and characterization of the salt-tolerant aerobic denitrifying bacterial strain A-13[J]. Acta Microbiologica Sinica, 2013, 53(1): 47-58. 韩永和, 章文贤, 庄志刚, 等. 耐盐好氧反硝化菌A-13菌株的分离鉴定及其反硝化特性[J]. 微生物学报, 2013, 53(1): 47-58. |
| [28] |
Fu LJ, Guo DZ, Shi CL, et al. Effect of carbon source and C/N ratio on heterotrophic denitrification of pure culture[J]. Rural Eco-Environment, 2005, 21(2): 42-45. 傅利剑, 郭丹钊, 史春龙, 等. 碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J]. 农村生态环境, 2005, 21(2): 42-45. |
| [29] |
Zhang YM, Wang XC, Cheng Z, et al. Effect of fermentation liquid from food waste as a carbon source for enhancing denitrification in wastewater treatment[J]. Chemosphere, 2016, 144: 689-696. |
| [30] |
Kim H, Kim J, Shin SG, et al. Continuous fermentation of food waste leachate for the production of volatile fatty acids and potential as a denitrification carbon source[J]. Bioresource Technology, 2016, 207: 440-445. |
| [31] |
Hang QY, Wang HY, Chu ZS, et al. Application of plant carbon source for denitrification by constructed wetland and bioreactor: review of recent development[J]. Environmental Science and Pollution Research, 2016, 23(9): 8260-8274. DOI:10.1007/s11356-016-6324-y |
| [32] |
Shan J, Yang PP, Shang XX, et al. Anaerobic ammonium oxidation and denitrification in a paddy soil as affected by temperature, pH, organic carbon, and substrates[J]. Biology and Fertility of Soils, 2018, 54(3): 341-348. |
| [33] |
Zhang CY, Ding Y, Huang MS. Screening of heterotrophic nitrification-aerobic denitrifying bacteria and its nitrogen removal characteristics[J]. Journal of East China normal University (Natural Science), 2018(6): 22-31, 87. 张翠月, 丁钰, 黄民生. 异养硝化-好氧反硝化细菌的筛选及其脱氮性能研究[J]. 华东师范大学学报:自然科学版, 2018(6): 22-31, 87. |
| [34] |
Yang M, Lu DW, Qin BD, et al. Highly efficient nitrogen removal of a coldness-resistant and low nutrient needed bacterium, Janthinobacterium sp. M-11[J]. Bioresource Technology, 2018, 256: 366-373. |
| [35] |
Zhang HH, Zhao ZF, Li SL, et al. Nitrogen removal by mix-cultured aerobic denitrifying bacteria isolated by ultrasound: performance, co-occurrence pattern and wastewater treatment[J]. Chemical Engineering Journal, 2019, 372: 26-36. |
| [36] |
Xu ZS, Dai XH, Chai XL. Effect of influent pH on biological denitrification using biodegradable PHBV/PLA blends as electron donor[J]. Biochemical Engineering Journal, 2018, 131: 24-30. |
| [37] |
Zhang JB, Lan T, Müller C, et al. Dissimilatory Nitrate Reduction to Ammonium (DNRA) plays an important role in soil nitrogen conservation in neutral and alkaline but not acidic rice soil[J]. Journal of Soils and Sediments, 2015, 15(3): 523-531. |
| [38] |
Fernandes SO, Bonin PC, Michotey VD, et al. Nitrogen-limited mangrove ecosystems conserve N through dissimilatory nitrate reduction to ammonium[J]. Scientific Reports, 2012, 2: 419. |
 2020, Vol. 47
2020, Vol. 47