扩展功能
文章信息
- 张萌萌, 姜宁, 张爱忠
- ZHANG Meng-Meng, JIANG Ning, ZHANG Ai-Zhong
- 肠道微生物对肠道屏障功能完整性的维护机制研究概况
- Maintenance mechanism of intestinal barrier function integrity by intestinal microbes
- 微生物学通报, 2020, 47(3): 933-940
- Microbiology China, 2020, 47(3): 933-940
- DOI: 10.13344/j.microbiol.china.190608
-
文章历史
- 收稿日期: 2019-07-24
- 接受日期: 2019-10-21
- 网络首发日期: 2019-11-29
肠道稳态是由肠道粘膜屏障、肠道内环境及其代谢物相互作用而形成的动态平衡状态,具有防止病原体入侵、维护肠道健康的功能。肠道微生物是肠道复杂的生态系统,从动物出生后肠道微生物逐渐形成复杂的消化和代谢功能,具有多样化和稳定性的特性。该群体间进行的共生、拮抗、竞争以及直接或间接参与的抗菌化合物的合成展现出多重抗感染、抗炎和免疫调节的作用,对肠内稳态具有决定性作用[1]。这些关系的微小改变都有利于机体内部或外部肠道病原体的增殖,促使炎症反应或稳态失衡,导致胃肠道或全身感染[2]。
本文从肠道微生物群形成及其与肠道屏障功能的相互作用对抗肠道病原体等方面阐述其作用机制,为调控肠道微生物系统维护肠道健康的治疗思路和方法提供了理论参考依据。
1 肠道微生物及其威胁 1.1 肠道微生物肠道微生物基本上是生物体外来的物质,因逐渐适应宿主肠道环境,进而具备肠道共生特性,按照生理功能分为共生菌、病原菌和条件致病菌。
肠道中存在数量巨大和种类众多的菌群,初步评估人体微生物(主要肠道菌群)数量是体细胞数量的1–2倍[3],但大多数不能体外培养;健康个体95%以上的微生物主要由厚壁菌门、拟杆菌门,放线菌门和变形菌门组成。动物出生后肠道会迅速被肠道共生菌所栖息,小肠主要以厚壁菌门、放线菌门和芽孢杆菌纲为主,而结肠以拟杆菌们和毛螺菌科为优势菌群[4]。同时在肠道中有明显的层次性,腔菌群浅层主要为好氧菌(肠球菌和大肠埃希菌),易损伤不定殖,深层主要为兼性厌氧菌(拟杆菌和链球菌),消耗游离氧维持厌氧环境,部分致病性;膜菌群主要为专性厌氧菌(双歧杆菌和乳杆菌),通过粘附方式结合于上皮细胞,抑制病原菌的粘附定殖。
菌群的组成和数量受到诸多因素的影响,比如分娩方式、食物和环境,特别是分娩过程会首先影响幼崽肠道菌群的类型。正常分娩过程中链球菌、埃希氏菌属、克雷伯氏菌和大肠杆菌在肠道内首先定殖,通过降低氧气水平为双歧杆菌、乳酸菌和拟杆菌属在内的其他厌氧菌群建立有利的环境,并使厌氧菌占据主导地位[5],而剖腹产早期肠道微生物群倾向于皮肤附着菌群和环境菌群[6]。
近期研究表明,人为干预下剖腹产幼崽肠道双歧杆菌、乳酸菌和拟杆菌水平可以达到正常分娩幼崽的水平[7],但后期对宿主健康的影响还需要进一步研究。研究发现在脐带血、羊水、胎粪、胎盘和胎膜中都检测并分离了来自母体肠道的菌种,且在母婴中并没有发现任何感染或炎症的症状[8-9]。这是否可以说明肠道菌群的定殖在未分娩时已经开始还需要进一步的证实。
1.2 肠道病原菌威胁肠道微生物群通常以互利共生或同食共生的关系在生物体进行定殖,其中最普遍的是乳酸杆菌和双歧杆菌[10]。威胁肠道健康的致病性或潜在致病微生物定殖在宿主中可能引发炎症、致癌或传染性疾病。病原体会诱发腹泻性疾病,并伴有脱水和器官的衰竭。此外,肠道病原体释放毒素,穿透粘液层,粘附于肠上皮细胞,破坏肠道的免疫系统,甚至易位到体循环中,损伤机体的整体免疫。
最具威胁性的肠道病原体包括志贺氏菌、空肠弯曲菌、耶尔森氏菌、产生毒素的霍乱弧菌、导致分泌性腹泻的大肠杆菌和引起肠道热的副溶血性弧菌。在条件性致病菌中有两个典型菌群:产生心内膜炎的肠球菌和伪膜性肠炎的艰难梭菌,均因长期使用抗生素后致使菌群失调,产生耐药性而大量繁殖[11]。
2 肠道微生物促进肠道完整性的途径肠道内微生物呈现了明显的定殖分布。微生物与肠道粘膜的粘附、嵌合和结合,组成有一定规律的菌膜屏障结构,通过竞争病原菌的粘膜位点定殖、竞争营养物质摄入以及产生代谢物抑制病原菌、促进上皮细胞增殖分化或激活肠道粘膜免疫等方式抑制肠道内病原菌的过度繁殖和易位,降低炎症反应和氧化应激。
2.1 竞争粘膜位点定殖,形成菌膜屏障益生菌通过消耗营养物质竞争粘膜定殖位点、抑制病原菌定殖。细菌表面的结构可以决定菌的定殖能力,其表面层蛋白或S层蛋白具有粘附、聚集、调节T细胞免疫及抗原变异的作用。研究发现,鼠李糖乳杆菌的菌毛中含有宿主粘液结合蛋白,这可能与其竞争粘膜位点定殖的行为有关[12]。乳杆菌通过表面的S层蛋白可以粘附宿主肠道上皮细胞的表面,竞争性抑制肠道病原微生物的入侵和定殖[13]。
益生菌也通过产生代谢产物发挥肠道屏障作用。双歧杆菌产生的磷壁酸与上皮细胞特异性结合,产生细胞外糖苷酶降解肠道粘膜蛋白低聚糖和乳酸系列Ⅰ型糖鞘脂,抑制病原菌在肠道的定殖[14]。部分益生菌可以产生有机酸,降低肠道pH值,同时促进肠道蠕动,排出定殖的病原菌,从而维护肠道菌群的生态平衡[14]。
2.2 促进上皮细胞增殖分化上皮细胞的持续性产生、迁移和凋亡为微生物的附着和持久性提供了动态的屏障,同时,微生物的定殖对肠道生理过程及粘膜防御机制的发育和功能具有重大的影响。
动物从出生到断奶期间肠绒毛和隐窝细胞伴随着微生物的定殖逐渐成熟,逐步分化成各种成熟的上皮细胞,如肠绒毛细胞、杯状细胞、潘氏细胞或肠内分泌细胞。肠道上皮细胞将机体同外部环境分离,避免致病性细菌、病毒或致病性真菌等抗原的侵入。研究表明,定殖的微生物可以控制细胞分化的周期和隐窝细胞增殖基因的表达,进而影响上皮细胞的数量[15];同时,微生物也可以通过诱导神经递质和固有层细胞释放细胞因子作用于上皮细胞的更新来影响上皮细胞的数量[16-17]。比如,鼠李糖乳杆菌分泌的可溶性蛋白p75和p40通过激活PI3/Akt信号通路,刺激肠道上皮细胞分泌保护性热应激蛋白Hsp72和Hsp25,促进肠道细胞的增殖,同时抑制由TNF诱导的细胞凋亡[18-19]。鼠李糖乳杆菌也可以诱导粒细胞集落刺激因子(G-CSF)的大量分泌,进而抑制TNF-α介导的凋亡前体p38的活化,表现出特异性的抗细胞凋亡的作用[20]。
微生物的定殖不仅促进细胞的增殖,同时也是正常肠道发育和发挥功能的必需部分。无菌小鼠具有较小的肠道质量和表面积,表现出较短的绒毛和较浅的隐窝,细胞增殖和沿隐窝到绒毛轴的迁移率降低[21]。同样在常规培养抗生素处理的小鼠结肠中发现,细胞增殖率降低,隐窝含有较少的细胞。在果蝇试验中发现乳酸杆菌可以通过释放活性氧调节肠道干细胞的增殖[22]。
2.3 增强肠道粘膜免疫反应肠道粘膜免疫系统在对共生菌的免疫耐受和病原微生物的免疫应答中处于动态平衡状态。肠道上皮敏感细胞群(M细胞和潘氏细胞)作为肠道粘膜的“监视者”,通过模式识别受体(pattern recognition receptor,PRR)识别微生物结构成分-病原体相关分子模式(pathogen-associated molecular patterns,PAMP),迅速感应菌群的变化,促进M细胞和潘氏细胞分泌抗菌肽清除病原微生物,或通过信号传递免疫细胞、树突状细胞、自然杀伤细胞和巨噬细胞,促进T细胞与B淋巴细胞分化成熟,诱导巨噬细胞分泌IL-10和TGF-β等抗炎因子释放,诱导树突状细胞分泌IL-12和IL-10等细胞因子,调节Th17/Tregs、Th1/Th2平衡,提高肠道粘液中可溶性免疫球蛋白的水平;同时,促炎性因子(IL-5、IL-6、IL-8、IL-17、IL-21、IL-22和IFN-γ)将嗜中性粒细胞募集到入侵部位响应肠道微生物的变化,维护肠道相对稳态(图 1)。
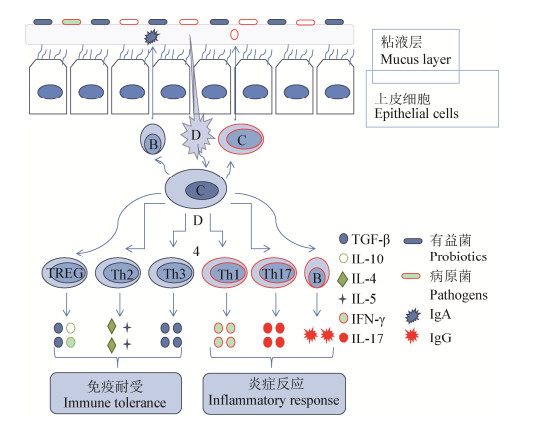
|
| 图 1 肠道微生物进行免疫调节的方式 Figure 1 Mechanism of immunoregulation of intestinal microbes |
|
|
肠道微生物对宿主的调控不仅仅直接参与宿主的免疫系统,还能通过肠道微生物产生的小分子次级代谢产物循环作用于人体各个部位,甚至产生的这些代谢产物在血液中的浓度可以达到或超过药物剂量达到的水平,如细菌素、次级胆汁酸、短链脂肪酸和抗菌肽(图 2)。

|
| 图 2 肠道微生物间接进行免疫调节的方式 Figure 2 Indirect immunomodulation of intestinal microbes |
|
|
细菌素是细菌分泌的一类由基因编码、核糖体合成、对同种或种属关系较近的细菌具有抑制作用的多肽或蛋白质,主要通过与细胞膜受体特异性结合形成孔道或溶解细胞膜对细菌进行抑制[23]。
细菌素分为两类,Ⅰ类含有羊毛硫氨酸,Ⅱ类不含有羊毛硫氨酸。Ⅰ类细菌素依靠与靶细胞膜之间静电力发挥作用,通过吸附到靶细胞壁肽聚糖的前体物(脂质Ⅱ)形成细菌素脂质Ⅱ复合物,插入到致病菌胞膜中,形成孔洞致使内容物流出;Ⅱ类细菌素主要通过N端β折叠区域PA-1识别结合胞膜甘露糖磷酸转移酶系统N端的胞外环,疏水性C-末端结构域渗透进入靶细胞膜,致使细胞膜形成孔洞[24]。细菌素的产生显著抑制单核细胞增生李斯特菌、沙门氏菌、耐万古霉素的肠球菌和其他病原体的定殖[25]。乳杆菌科和双歧杆菌科是主要产生细菌素的菌种。人类共生菌群中的有益菌,有望被用于上皮细胞的外表面产生细菌素并抑制细菌感染[26]。尽管越来越受到关注,但细菌素的研究受到了非标准化和动物模型结果不一致的阻碍。
3.2 次级胆汁酸胆汁酸对维持健康的肠道微生物组成、平衡的脂质和碳水化合物代谢、维持胰岛素敏感和先天免疫均发挥着重要作用。胆汁酸是由肠道微生物群控制的机体必需抗微生物剂,通过损伤细胞膜或激活,涉及导管素调节的维生素D受体和法尼醇X受体发挥作用[27]。动物体内含量最高的两种初级胆汁酸为胆酸和鹅脱氧胆酸,对应的次级胆汁酸为脱氧胆酸和石胆酸。胆汁酸经由细胞色素P450介导的胆固醇的氧化而合成,在肝脏中与甘氨酸和牛磺酸耦合,耦合形式的胆汁酸在小肠被肠道微生物(拟杆菌、梭菌、乳酸菌、双歧杆菌和李斯特菌)产生的胆酸盐水解酶水解成游离形式的胆汁酸,紧接着又通过7-α脱羟基作用生成次级胆汁酸[27]。
在无菌和经抗生素处理的小鼠体内,初级胆汁酸显著增加,次级胆汁酸含量下降明显,说明肠道菌群对维持胆汁酸的多样性起着核心作用[28]。次级胆汁酸通过其受体(如TGR5、FXR、PXR)调控脂质信号通路和免疫系统[29]。次级胆汁酸与TGR5受体结合而激活巨噬细胞,诱导部分促炎M1巨噬细胞向抗炎M2巨噬细胞极化,致使IL-10/IL-12比率升高,IL-10随后抑制促炎性因子(如TNF-α和IL-6)表达[30]。在相对低浓度(< 50 μmol/L)条件下,次级胆汁酸与免疫因子结合,通过降低促炎细胞因子的表达水平在结肠中发挥作用[31]。胆汁中的胆盐可以溶解细菌胞壁,增加细菌膜的通透性,致使菌膜裂解、细胞死亡,抑制肠道内病原菌的繁殖和生长[32]。但异常高的次级胆汁酸浓度会对结肠粘膜产生过多的不利影响,如氧化应激、DNA损伤、细胞凋亡和炎症反应等[30]。
3.3 短链脂肪酸(short-chain fatty acids,SCFA)结肠内微生物通过酵解肠道内难以消化的碳水化合物产生短链脂肪酸,拟杆菌门主要产生乙酸和丙酸,厚壁菌门主要产生丁酸,SCFA具有改善肠道炎症和发挥免疫以及抗肿瘤的作用[33]。
短链脂肪酸的浓度沿着大肠变化,盲肠和近段结肠中浓度最高,而远端结肠浓度最低,结肠中短链脂肪酸浓度可以达到100 nmol/L,并通过消耗可发酵纤维增强其浓度[34]。乙酸、丙酸和丁酸在一定程度上被上皮细胞代谢以提供能量使正常结肠细胞增殖,降低上皮细胞通透性并维持上皮细胞完整性,同时降低结肠的pH值阻止病原菌的定殖,其中,丁酸在维持结肠健康和调节细胞生长和分化中起着最重要的作用[35]。短链脂肪酸直接调节由T细胞和B细胞介导的抗原特异性适应性免疫,还通过抑制组蛋白去乙酰化酶活性促进肠道中抗炎调节性T细胞的活化和产生,但其对T细胞介导的免疫反应产生抗炎或促炎作用,这取决于其产生的浓度和免疫环境[36-37]。
在细胞内,丁酸浓度低于0.5 mmol/L时,丁酸满足细胞的能量需求并刺激正常结肠细胞的增殖;当浓度在0.5-5.0 mmol/L范围并超过其能量需求时,除取决于细胞类型外,丁酸可作为组蛋白去乙酰化酶抑制剂[38-39]。丁酸盐在生理相关的细胞内浓度为0.5-5.0 mmol/L时,以p53依赖性和非依赖性方式诱导细胞周期停滞和凋亡[38]。丁酸抑制组蛋白去乙酰化酶并允许组蛋白高度乙酰化致使许多基因进行转录,包括p21/Cip1和细胞周期蛋白D3;诱导细胞周期蛋白依赖性激酶进行抑制蛋白p21/Cip1可以导致细胞周期G1期细胞停滞[39]。此外,丁酸处理增加非癌细胞存活信号ERK1/2的磷酸化,也会降低癌细胞中p-ERK1/2的表达[40]。研究发现,浓度为0.5 mmol/L或更高时,丁酸盐通过增加抗转移基因(如金属蛋白酶)的表达和抑制促转移基因的激活来抑制癌细胞的迁移和侵袭率[41]。
3.4 抗菌肽抗菌肽是一类具有杀菌、抗炎和促进机体修复等特性的先天免疫效应分子。肠道内产生的抗菌肽主要有α-防御素、β-防御素、Cathelicidins、C型凝集素(再生胰岛衍生蛋白家族)、核糖核酸酶和溶菌酶等;抗菌肽的抗菌机制主要分为胞膜作用和胞内作用,除抗菌活性外,内源性抗菌肽还具有免疫调节活性,参与调节先天性和适应性免疫应答,是机体防御外来物质入侵的重要介质,同时也是机体适应环境产生的免疫活性分子[42]。
在无菌小鼠中发现部分抗菌肽的产生需要微生物源的信号,如防御素、再生胰岛衍生蛋白3γ和血管生成素的表达量在无菌小鼠体内较常规饲养小鼠相对较低,同时发现多形拟杆菌和无害李斯特菌是诱导血管生成素、Cathelicidin和防御素等抗菌肽的主要菌种[43-44]。抗菌肽的释放还可被病原体(螺杆菌,志贺氏菌)下调或被某些益生菌(乳酸菌,双歧杆菌)上调。革兰氏阴性和阳性菌的胞壁酰二肽配体可以激活细胞内病原体识别受体核苷酸寡聚化结构域,诱导来自潘氏细胞抗菌肽的释放,在缺失核苷酸寡聚化结构域的小鼠肠道内几乎没有检测到抗菌肽存在,而且肠道菌群结构发生严重改变[45]。同时,微生物信号也可以通过非病原体识别受体依赖机制诱导抗菌肽的表达,比如合成的短链脂肪酸丁酸上验证可以诱导抗菌肽的表达,增强机体免疫性能[46]。
4 小结与展望肠道微生物参与了营养吸收、物质代谢,促进机体发育,维持宿主健康。在机体的免疫防御功能中,不仅局限于增强肠道粘膜屏障功能,还可以调节宿主的整体免疫,从而有效地抑制了病原微生物的威胁。
肠道微生物在肠道功能维护中的调节机制涉及多种信号通路及分子机制,目前的研究多限于对独立细胞、受体或分子观察,但具体的信号路径还需要进一步明确。加强对肠道微生物与肠道屏障功能关系的研究,有助于了解肠道炎症性疾病发病机制,为临床上治疗肠道炎症性疾病提供新的思路,同时为预防肠道疾病的发生提供新的策略。
| [1] |
Yoon MY, Lee K, Yoon SS. Protective role of gut commensal microbes against intestinal infections[J]. Journal of Microbiology, 2014, 52(12): 983-989. DOI:10.1007/s12275-014-4655-2 |
| [2] |
Liu JL. Advances in gut microbiota and hepatocellular carcinoma[J]. Chinese Journal of Cancer Biotherapy, 2018, 25(11): 1185-1190. (in Chinese) 刘军灵. 肠道微生物稳态与肝癌关系的研究进展[J]. 中国肿瘤生物治疗杂志, 2018, 25(11): 1185-1190. DOI:10.3872/j.issn.1007-385X.2018.11.018 |
| [3] |
Hanage WP. Microbiology: microbiome science needs a healthy dose of scepticism[J]. Nature, 2014, 512(7514): 247-248. DOI:10.1038/512247a |
| [4] |
Frank DN, Amand ALS, Feldman RA, et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(34): 13780-13785. DOI:10.1073/pnas.0706625104 |
| [5] |
Houghteling PD, Walker WA. Why is initial bacterial colonization of the intestine important to infants' and children's health?[J]. Journal of Pediatric Gastroenterology and Nutrition, 2015, 60(3): 294-307. DOI:10.1097/MPG.0000000000000597 |
| [6] |
Rutayisire E, Huang K, Liu YH, et al. The mode of delivery affects the diversity and colonization pattern of the gut microbiota during the first year of infants' life: a systematic review[J]. BMC Gastroenterology, 2016, 16: 86. DOI:10.1186/s12876-016-0498-0 |
| [7] |
Dominguez-Bello MG, de Jesus-Laboy KM, Shen N, et al. Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer[J]. Nature Medicine, 2016, 22(3): 250-253. DOI:10.1038/nm.4039 |
| [8] |
Jiménez E, Fernández L, María ML, et al. Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section[J]. Current Microbiology, 2005, 51(4): 270-274. DOI:10.1007/s00284-005-0020-3 |
| [9] |
Mueller NT, Bakacs E, Combellick J, et al. The infant microbiome development: mom matters[J]. Trends in Molecular Medicine, 2015, 21(2): 109-117. DOI:10.1016/j.molmed.2014.12.002 |
| [10] |
O'Callaghan A, van Sinderen D. Bifidobacteria and their role as members of the human gut microbiota[J]. Frontiers in Microbiology, 2016, 7: 925. |
| [11] |
Perez-Lopez A, Behnsen J, Nuccio SP, et al. Mucosal immunity to pathogenic intestinal bacteria[J]. Nature Reviews Immunology, 2016, 16(3): 135-148. DOI:10.1038/nri.2015.17 |
| [12] |
Kankainen M, Paulin L, Tynkkynen S, et al. Comparative genomic analysis of Lactobacillus rhamnosus GG reveals pili containing a human- mucus binding protein[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(40): 17193-17198. DOI:10.1073/pnas.0908876106 |
| [13] |
Hynönen U, Palva A. Lactobacillus surface layer proteins: structure, function and applications[J]. Applied Microbiology and Biotechnology, 2013, 97(12): 5225-5243. DOI:10.1007/s00253-013-4962-2 |
| [14] |
Xing XW, Tao JH, Jiang S, et al. The impacts of intestinal microflora on the structure and functions of intestinal mucosal barrier: research progress[J]. Chinese Journal of Microecology, 2018, 30(6): 725-730. (in Chinese) 邢肖伟, 陶金华, 江曙, 等. 肠道菌群影响黏膜屏障结构与功能的研究进展[J]. 中国微生态学杂志, 2018, 30(6): 725-730. |
| [15] |
Rakoff-Nahoum S, Kong Y, Kleinstein SH, et al. Analysis of gene-environment interactions in postnatal development of the mammalian intestine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(7): 1929-1936. DOI:10.1073/pnas.1424886112 |
| [16] |
Hyland NP, Cryan JF. Microbe-host interactions: influence of the gut microbiota on the enteric nervous system[J]. Developmental Biology, 2016, 417(2): 182-187. DOI:10.1016/j.ydbio.2016.06.027 |
| [17] |
Obata Y, Pachnis V. The effect of microbiota and the immune system on the development and organization of the enteric nervous system[J]. Gastroenterology, 2016, 151(5): 836-844. DOI:10.1053/j.gastro.2016.07.044 |
| [18] |
Tao Y, Drabik KA, Waypa TS, et al. Soluble factors from Lactobacillus GG activate MAPKs and induce cytoprotective heat shock proteins in intestinal epithelial cells[J]. American Journal of Physiology-Cell Physiology, 2006, 290(4): C1018-C1030. DOI:10.1152/ajpcell.00131.2005 |
| [19] |
Yan F, Cao HW, Cover TL, et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth[J]. Gastroenterology, 2007, 132(2): 562-575. DOI:10.1053/j.gastro.2006.11.022 |
| [20] |
Yan F, Polk DB. Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells[J]. The Journal of Biological Chemistry, 2002, 277(52): 50959-50965. DOI:10.1074/jbc.M207050200 |
| [21] |
Sommer F, Nookaew I, Sommer N, et al. Site-specific programming of the host epithelial transcriptome by the gut microbiota[J]. Genome Biology, 2015, 16: 62. DOI:10.1186/s13059-015-0614-4 |
| [22] |
Jones RM, Luo LP, Ardita CS, et al. Symbiotic lactobacilli stimulate gut epithelial proliferation via Nox-mediated generation of reactive oxygen species[J]. EMBO Journal, 2013, 32(23): 3017-3028. DOI:10.1038/emboj.2013.224 |
| [23] |
Kuang Z, Li XY, Xu CX, et al. Research progress of bacteriocins from lactic acid bacteria and its application in aqua culture and processing[J]. Science and Technology of Food Industry, 2019, 40(4): 292-298. (in Chinese) 匡珍, 李学英, 徐春霞, 等. 乳酸菌细菌素研究进展及其在水产养殖和加工中的应用[J]. 食品工业科技, 2019, 40(4): 292-298. |
| [24] |
Zhang XN, Shang YN, Chen J, et al. Mechanism of bacteriocins from Lactobacillus and their applications in meat products[J]. Food Research and Development, 2018, 39(11): 192-199. (in Chinese) 张晓宁, 尚一娜, 陈境, 等. 乳酸菌细菌素的作用机制及在肉制品中的应用[J]. 食品研究与开发, 2018, 39(11): 192-199. DOI:10.3969/j.issn.1005-6521.2018.11.036 |
| [25] |
Zhu S, Zhang AZ, Jiang N, et al. Bacteriocins and their application in animal production[J]. Chinese Journal of Animal Nutrition, 2014, 26(2): 327-333. (in Chinese) 朱双, 张爱忠, 姜宁, 等. 细菌素及其在动物生产中的应用[J]. 动物营养学报, 2014, 26(2): 327-333. DOI:10.3969/j.issn.1006-267x.2014.02.006 |
| [26] |
Hols P, Ledesma-García, Gabant P, et al. Mobilization of microbiota commensals and their bacteriocins for therapeutics[J]. Trends in Microbiology, 2019, 27(8): 690-702. DOI:10.1016/j.tim.2019.03.007 |
| [27] |
Martin G, Kolida S, Marchesi JR, et al. In vitro modeling of bile acid processing by the human fecal microbiota[J]. Frontiers in Microbiology, 2018, 9: 1153. DOI:10.3389/fmicb.2018.01153 |
| [28] |
Wahlström A, Kovatcheva-Datchary P, Ståhlman M, et al. Induction of farnesoid X receptor signaling in germ-free mice colonized with a human microbiota[J]. Journal of Lipid Research, 2017, 58(2): 412-419. DOI:10.1194/jlr.M072819 |
| [29] |
Gadaleta RM, Oldenburg B, Willemsen ECL, et al. Activation of bile salt nuclear receptor FXR is repressed by pro-inflammatory cytokines activating NF-κB signaling in the intestine[J]. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 2011, 1812(8): 851-858. DOI:10.1016/j.bbadis.2011.04.005 |
| [30] |
Jia W, Xie GX, Jia WP. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(2): 111-128. |
| [31] |
Ward JBJ, Lajczak NK, Kelly OB, et al. Ursodeoxycholic acid and lithocholic acid exert anti-inflammatory actions in the colon[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2017, 312(6): G550-G558. DOI:10.1152/ajpgi.00256.2016 |
| [32] |
Hu HL, Gao M. Research advance in intestinal barrier function and evaluation index[J]. Chinese Journal of Animal Science, 2012, 48(17): 78-82. (in Chinese) 胡红莲, 高民. 肠道屏障功能及其评价指标的研究进展[J]. 中国畜牧杂志, 2012, 48(17): 78-82. DOI:10.3969/j.issn.0258-7033.2012.17.021 |
| [33] |
McNabney SM, Henagan TM. Short chain fatty acids in the colon and peripheral tissues: A focus on butyrate, colon cancer, obesity and insulin resistance[J]. Nutrients, 2017, 9(12): 1348. DOI:10.3390/nu9121348 |
| [34] |
van Der Beek CM, Canfora EE, Kip AM, et al. The prebiotic inulin improves substrate metabolism and promotes short-chain fatty acid production in overweight to obese men[J]. Metabolism, 2018, 87: 25-35. DOI:10.1016/j.metabol.2018.06.009 |
| [35] |
Rivière A, Selak M, Lantin D, et al. Bifidobacteria and butyrate-producing colon bacteria: importance and strategies for their stimulation in the human gut[J]. Frontiers in Microbiology, 2016, 7: 979. |
| [36] |
Wang X, Zhang MM, Jiang N, et al. Sodium Phenylbutyrate ameliorates inflammatory response induced by Staphylococcus aureus lipoteichoic acid via suppressing TLR2/NF-κB/NLRP3 pathways in MAC-T cells[J]. Molecules, 2018, 23(12): 3056. DOI:10.3390/molecules23123056 |
| [37] |
Bach Knudsen KE, Lærke HN, Hedemann MS, et al. Impact of diet-modulated butyrate production on intestinal barrier function and inflammation[J]. Nutrients, 2018, 10(10): 1499. DOI:10.3390/nu10101499 |
| [38] |
Perego S, Sansoni V, Banfi G, et al. Sodium butyrate has anti-proliferative, pro-differentiating, and immunomodulatory effects in osteosarcoma cells and counteracts the TNFα-induced low-grade inflammation[J]. International Journal of Immunopathology and Pharmacology, 2018. DOI:10.1177/0394632017752240 |
| [39] |
Davie JR. Inhibition of histone deacetylase activity by butyrate[J]. The Journal of Nutrition, 2003, 133(7): 2485S-2493S. DOI:10.1093/jn/133.7.2485S |
| [40] |
Zeng HW, Taussig DP, Cheng WH, et al. Butyrate inhibits cancerous HCT116 colon cell proliferation but to a lesser extent in noncancerous NCM460 colon cells[J]. Nutrients, 2017, 9(1): 25. DOI:10.3390/nu9010025 |
| [41] |
Emenaker NJ, Calaf GM, Cox D, et al. Short-chain fatty acids inhibit invasive human colon cancer by modulating uPA, TIMP-1, TIMP-2, mutant p53, Bcl-2, Bax, p21 and PCNA protein expression in an in vitro cell culture model[J]. The Journal of Nutrition, 2001, 131(11): 3041S-3046S. DOI:10.1093/jn/131.11.3041S |
| [42] |
Zhang MM, Jiang N, Zhang AZ, et al. Feed additives affect endogenous antimicrobial peptide expression and immunoregulatory mechanisms[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 91-96. (in Chinese) 张萌萌, 姜宁, 张爱忠, 等. 饲料添加剂影响内源性抗菌肽表达和免疫调节机制[J]. 动物营养学报, 2019, 31(1): 91-96. |
| [43] |
Chen BR, Ni X, Sun R, et al. Commensal bacteria-dependent CD8αβ+ T cells in the intestinal epithelium produce antimicrobial peptides[J]. Frontiers in Immunology, 2018, 9: 1065. DOI:10.3389/fimmu.2018.01065 |
| [44] |
Eckmann L. Sensor molecules in intestinal innate immunity against bacterial infections[J]. Current Opinion in Gastroenterology, 2006, 22(2): 95-101. DOI:10.1097/01.mog.0000208458.38772.2a |
| [45] |
Hancock REW, Diamond G. The role of cationic antimicrobial peptides in innate host defences[J]. Trends in Microbiology, 2000, 8(9): 402-410. DOI:10.1016/S0966-842X(00)01823-0 |
| [46] |
Robinson K, Ma X, Liu YL, et al. Dietary modulation of endogenous host defense peptide synthesis as an alternative approach to in-feed antibiotics[J]. Animal Nutrition, 2018, 4(2): 160-169. |
 2020, Vol. 47
2020, Vol. 47




