扩展功能
文章信息
- 杜晓雨, 赵恺, 赵志敏, 赵吉
- DU Xiao-Yu, ZHAO Kai, ZHAO Zhi-Min, ZHAO Ji
- 枯草芽孢杆菌微生态制剂发酵研究进展
- Progress on Bacillus subtilis microbial ecological agents by fermentation
- 微生物学通报, 2020, 47(3): 903-914
- Microbiology China, 2020, 47(3): 903-914
- DOI: 10.13344/j.microbiol.china.190586
-
文章历史
- 收稿日期: 2019-07-18
- 接受日期: 2019-11-13
- 网络首发日期: 2019-11-25
2. 内蒙古大学 蒙古高原生态学与资源利用教育部重点实验室 内蒙古 呼和浩特 010021
2. Key Laboratory of Ecology and Resource Use of the Mongolia Plateau, Ministry of Education, Inner Mongolia University, Hohhot, Inner Mongolia 010021, China
抗生素在畜禽养殖业中的作用主要包含两方面:一为其药物属性,二为其促生长剂属性。然而,在抗生素的长期使用过程中,因其使病原菌产生抗药性,且产生残留污染等缺陷,使其应用日渐受限。因此,开发绿色、有效的抗生素替代品对于养殖业发展、人类健康具有重要意义。微生态制剂历经数十年发展,作为促生长饲料添加剂替代抗生素具有很大潜力[1-2]。1994年在德国召开会议,将微生态制剂定义修订为:是含活菌和/或死菌包括其组分和产物的细菌制品,经口或其他黏膜途径投入,旨在改善黏膜表面微生物或酶的平衡,或者刺激特异性或非特异性免疫机制[3-4]。微生态制剂作用机理包括调节胃肠道微生态平衡、增强机体免疫性能、合成各种有益的物质,从而对动物健康生长起到促进作用[2, 5-6]。
对于微生态制剂菌种的选择,除考虑其对宿主生长是否有利外,还需考虑其安全性及对环境的适应性,特别是耐热耐酸性和耐胆汁盐等对不良环境的耐受性,使菌种能通过胃进入肠道后仍保持活性,从而在指定位点存活并发挥作用[7]。微生态制剂常用菌种及特点见表 1。
| 菌种 Strains |
特点 Characteristics |
机理 Mechanism |
参考文献 References |
| 乳酸菌 Lactic acid bacteria |
Facultative anaerobe, lactic acid production, adjust pH | Prevent the colonization of pathogenic microorganisms; maintain micro-ecological balance in the digestive tract; improve feed utilization; regulate body immune response | [8-10] |
| 酵母菌 Yeast |
Unicellular eukaryote, facultative anaerobe, fungi | Rich in enzymes; cell wall contains a variety of active substances; stimulate and enhance body immunity; contain various trace elements | [11-14] |
| 双歧杆菌 Bifidobacterium |
Gram positive anaerobic bacteria, dominant microflora | Synthesize vitamins to promote body’s absorption of minerals; produce organic acids to stimulate intestinal peristalsis; purify the intestinal environment; stimulate body immune response | [15-17] |
| 芽孢杆菌 Bacillus |
Gram positive aerobic bacteria, produce spores | Produce spores in severe environments; produce a variety of digestive enzymes; consume oxygen in the intestinal environment; maintain anaerobic environment | [18-23] |
枯草芽孢杆菌属于需氧菌,进入肠道后可以消耗肠道内氧气,造成低氧环境,有利于厌氧菌的生长,从而调节肠道微生态平衡;并且枯草芽孢杆菌代谢产物中含有蛋白酶、淀粉酶等酶类,有助于提高饲料转化率,便于动物吸收利用;枯草芽孢杆菌还可以刺激动物的免疫器官,增强机体免疫能力[3]。更重要的是,枯草芽孢杆菌可产生芽孢。芽孢具有极强的抗逆性,能经受多种环境,包括高温、紫外线、多种溶剂、酸、碱、酶和烷基化试剂等刺激[24-26],使得其在通过干燥、制剂等生产过程和经过胃环境后仍保持活性及在贮藏期内有较高的稳定性。因此,枯草芽孢杆菌微生态制剂具有广阔的发展空间,且提高芽孢率是改善其产品品质的重要途径。
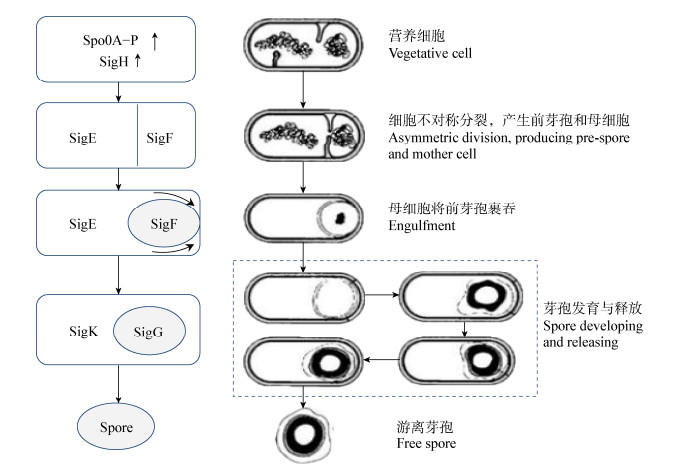
2.1 芽孢形成的关键调节因子及过程芽孢是细菌营养体的休眠体,往往在不利于菌体生长的环境中产生[21]。芽孢形成过程是数百个基因协同作用的复杂过程,研究指出Spo0A和Sigma因子(SigH、SigF、SigE、SigK和SigG)是影响芽孢形成的主要调控因子,DNA结合蛋白Spo0A是细胞从营养生长期进入芽孢形成时期的关键应答调节蛋白,Spo0A磷酸化状态(Spo0A−P)对Sigma因子的转录过程起着重要的调控作用,进而调控芽孢形成[27]。如图 1所示,当外界环境适宜芽孢形成时,Spo0A含量和磷酸化水平提高并达到一定阈值,进而影响并提高SigH表达量,在Spo0A−P和SigH共同作用下,细胞发生不对称分裂,产生前芽孢和母细胞;前芽孢和母细胞基因表达程序不同,但互相影响:首先前芽孢中SigF活化,在其影响下母细胞中SigE活化;在SigF和SigE共同调控下发生裹吞作用,前芽孢被母细胞吞入胞内;随后,前芽孢中SigG活化,母细胞中SigK活化,在SigF和SigG作用下,前芽孢发育为成熟芽孢;在SigE和SigK作用下,母细胞则形成芽孢衣和皮层等保护性结构并最终裂解,释放出成熟的芽孢[27, 30]。
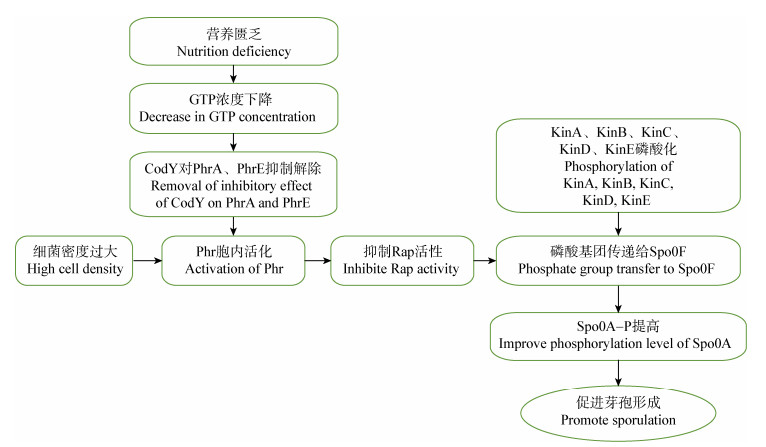
2.2 芽孢形成关键因子Spo0A磷酸化的影响因素当Spo0A的含量和磷酸化水平达到一定阈值芽孢才开始形成。枯草芽孢杆菌中,Spo0A磷酸化过程是由5种组氨酸蛋白激酶KinA、KinB、KinC、KinD、KinE和2种磷酸传递蛋白Spo0F和Spo0B组成的磷酸中继转移系统完成的[28, 31]。如图 2所示,当外界环境利于芽孢形成时,5种组氨酸蛋白激酶之一自我磷酸化,磷酸化的蛋白激酶将磷酸基团传递给磷酸传递蛋白Spo0F,再通过Spo0B将磷酸基团传递给Spo0A,进而导致Spo0A活化;当细胞密度过大时,磷酸酶调节蛋白Phr被寡肽通透酶运回胞内并活化,导致磷酸酶Rap活性被抑制,进而使得Spo0F的磷酸化水平提高,最终导致Spo0A磷酸化水平提高[32]。胞内三磷酸鸟苷GTP水平是表征营养状况的重要指标,转录调控因子CodY在枯草芽胞杆菌中是一种GTP结合蛋白[33]。营养匮乏时,GTP的浓度下降,解除了CodY对PhrA、PhrE的抑制作用,从而使Spo0F的磷酸化水平升高,最终导致Spo0A磷酸化水平提高[34]。因此,细胞密度与营养状况是影响Spo0A磷酸化的关键因素,环境中细胞密度过大和营养匮乏促进Spo0A磷酸化水平提高,进而调控芽孢形成。
3 枯草芽孢杆菌微生态制剂生产工艺 3.1 枯草芽孢杆菌菌株选育高活性枯草芽孢杆菌菌株是保证微生态制剂品质的重要前提。枯草芽孢杆菌筛选可依据形态特性、产酶能力、抑菌能力和抗逆性分析等方法在动物肠道、土壤等环境中分离,并进行分子生物学及生理生化鉴定,以挑选出益生性能优良的菌株。艾文豪[35]从土壤中初步筛选菌株并进行鉴定,依据耐受性、抑菌能力进一步筛选出益生潜力强的枯草芽孢杆菌菌株并制成冻干粉制剂,添加到家兔日粮中观察其对生产性能、健康状况的影响,结果显示添加枯草芽孢杆菌制剂的试验组家兔体重上升、腹泻情况减少,表明筛选出的枯草芽孢杆菌对家兔具有良好的促生长作用。王苇[36]通过生化反应和分子生物学方法从土壤样品中筛选并鉴定枯草芽孢杆菌,通过小鼠安全性评价,将得到的菌株用于肉鸡生产,观察菌株对肉鸡生化及免疫指标的影响,结果显示添加枯草芽孢杆菌的试验组肉鸡甘油三酯、总胆固醇含量下降,血清中总蛋白、IgA和IgG含量提高,有效提高肉鸡的免疫力。利用基因工程技术对枯草芽孢杆菌进行改造获得性能优良的菌株,是针对性较强且高效的方法之一。杨明明[37]利用基因工程技术,通过优化启动子和表达宿主,构建了枯草芽孢杆菌高效表达系统,实现了β-半乳糖苷酶等基因在枯草芽孢杆菌中的高效表达,有助于提高饲料利用率。刘项羽[38]从富含纤维素、半纤维素的土壤中筛选得到一株产β-甘露聚糖酶活力高的枯草芽孢杆菌,随后将其β-甘露聚糖酶基因克隆到Bacillus subtilis 168菌株中进行表达,并利用重叠PCR技术进行耐酸性改造,得到一株β-甘露聚糖酶高效表达且耐酸性加强的重组菌株,为其工业化利用奠定基础。
3.2 发酵工艺有效生物量是表征微生态制剂品质的重要指标。如何获得有效生物量更高的产品是饲用微生态制剂生产中的核心问题。目前,应用于微生态制剂生产的发酵工艺主要有3种:液态发酵、固态发酵和液固两相发酵,其内涵及特点见表 2。
| 发酵类型 Fermentation type |
原料 Substrates |
内涵 Connotation |
优点 Advantages |
缺点 Disadvantages |
参考文献 References |
| 液态发酵 Submerge fermentation |
Carbon sources such as monosaccharides, disaccharides; nitrogen sources such as peptone, yeast extract; inorganic salt; water; etc | Containing free water; involving gas-liquid two phases | Short fermentation period; easy control and scale-up | Large quantity of waste water; difficulties in separation and purification; higher costs | [23, 39-40] |
| 固态发酵 Solid-state fermentation |
Bran, soybean meal, straw, water, etc | No free water; involving solid-liquid-gas three phases | Cheap raw materials; low moisture content; simple post-processing; no wastewater discharge | Long fermentation period; difficulties in heat and mass transfer | [41-43] |
| 液固两相发酵 Solid-submerge fermentation |
Both submerge and solid-state fermentation substrates | Combined with submerge and solid-state fermentation | Short fermentation period; large microbial cell number; high microbial activity | Long lag phase; easy to infect; higher cost | [44-45] |
液态发酵是将活化菌种接种到发酵罐中进行液体培养的方法,一般流程为菌种接种、发酵罐培养、过滤、浓缩、干燥从而得到菌剂。该方法的优点为液体环境有利于菌体、底物、产物以及热量的扩散,使得发酵在均质均热的条件下进行;发酵过程速度快,周期短;便于监测和控制;易扩大培养规模[23]。缺点为液体培养基的水分多,使得有价值的大分子物质浓度低,产生的废液也多;后续分离纯化困难,成本较高[23, 39]。李明华等[40]用麸皮浸取液、蛋白胨、酵母浸粉等制成的液体发酵培养基制备枯草芽孢杆菌微生态制剂,探究其对雏鸡生产性能的影响,结果表明加入枯草芽孢杆菌微生态制剂的试验组日均增质量和日均采食量均高于对照组,而且料重比也显著降低(P < 0.05)。
3.2.2 固态发酵固态发酵是一种培养基呈固态、培养基中没有或几乎没有流动水、利用自然底物作为碳源和能源或利用惰性底物作为支持物的发酵过程。该方法的优点为培养基简单且来源广泛,利用自然底物如麸皮、豆粕等作碳源和氮源;后处理加工方便,往往无需分离提纯;含水率低,无大量废水排放,清洁环保[23];缺点为固态发酵传热困难,菌体生长不均匀,存在热量和质量梯度,从而限制发酵水平,发酵周期较长[41-43]。卢龙娣[3]系统优化了枯草芽孢杆菌Y31固体培养基组成,发现麸皮、豆粕分别为最佳碳源和氮源,进一步通过单因素试验优化了发酵温度、装料量、含水率、接种量等条件,发现最优条件为发酵温度37 ℃,装料量160 g/L,料水比1:0.8,接种量10%;在优化后的培养基和固态发酵条件下,枯草芽孢杆菌产芽孢量达到1.70×1010个/g。固态发酵是利用木质纤维素等可再生资源的重要途径之一,其作为一种清洁生产技术,通过考虑生物、化学、传质、传热等因素,优化发酵反应器,将产品质量控制在最佳水平,具有广阔的应用前景。针对固态发酵传热困难,我们分析对比了浅盘式固态发酵反应器、转鼓及搅拌式固态发酵反应器、流化床式固态发酵反应器等优缺点,发明了气相双动态固态发酵变频压力脉动方法[41]。脉动频率是周期刺激强化固态发酵过程的重要参数,科学确定脉动频率对于提高传热效率、强化微生物代谢以及节约能耗具有重要意义。基于微生物在不同发酵时期动态产热规律,对微生物代谢、脉动频率、蒸发散热和空气热交换等过程进行系统分析和计算,建立了热量平衡模型,进而科学指导变频压力脉动、强化发酵过程传热及微生物代谢。同等能耗下,变频压力脉动发酵基质温度上升幅度较对照组降低40.5%,发酵水平提高9.2%[23, 41]。我们针对固态发酵存在热量和质量梯度问题,运用近红外光谱比较了气相双动态固态发酵与静置通风固态发酵热质传递及发酵情况,研究发现静置通风固态发酵过程中,基质温度最高上升9.5 ℃,发酵7 d基质上、中、下三层产量比值为1:0.90:0.78,气相双动态固态发酵过程中,基质温度最高上升3.9 ℃,发酵5 d基质上、中、下三层产量比值为1:0.95:0.89,结果表明气相双动态通过压力脉动产生周期刺激及空气内循环,有效强化热质传递,降低热量和质量梯度,且缩短发酵周期28.6%,有效提高发酵水平和效率[42]。
3.2.3 液固两相发酵液固两相发酵指的是先通过液态发酵,快速培养大量高活力菌体,然后通过无菌输送将高活力菌体接种到固态培养基进行发酵[44]。该方法的优点为结合了液体发酵周期短、菌量大和固态发酵成本低、菌体活力高的优势,同时也回避了液态发酵后期处理复杂的问题。缺点为从液态到固态,菌体可能会因为培养基差异过大导致延滞期过长,进而降低发酵效率。宋漳等[45]通过对绿僵菌液固两相发酵技术进行研究,优化发酵过程和培养基配方,发现液体种子发酵周期72 h,固态发酵周期11 d,发酵产物在35 ℃下烘干24 h后,含水率达12%,活孢率达83.39%。
3.3 提高芽孢率工艺优化 3.3.1 培养基前处理活菌数和芽孢率是表征枯草芽孢杆菌微生态制剂品质的两个重要参数。优化培养基和发酵过程,提高枯草芽孢杆菌活菌数和芽孢率,是微生态制剂生产过程的重要目标[46-47]。
固态发酵清洁环保,生产微生态制剂后处理简单,是生产微生态制剂的有效方式。固态基质营养可及性往往劣于液态发酵,因此固态培养基前处理十分必要。对于纯种固态发酵而言,培养基灭菌是重要环节,我们对比了多种灭菌方式,如干热灭菌、湿热灭菌、臭氧灭菌、微波灭菌等,分析了多种灭菌方式的优缺点,发现固态发酵热力灭菌的难点在于固态基质传热慢加剧了杀灭微生物与减少营养物质破坏之间的矛盾,从而影响发酵水平和效率[48]。汽爆是一种有效的固态基质前处理手段,在木质纤维素生物炼制中广泛使用[49]。对固态培养基进行汽爆灭菌前处理,将灭菌和前处理整合为一个单元操作,不仅提高灭菌效率,而且有利于改善固态基质理化特性,促进发酵水平提高;研究发现,汽爆灭菌促进原料中大分子物质降解,如纤维素降解为葡萄糖,有效释放营养成分,同时由于汽爆灭菌所需强度较低(1.5×105 Pa灭菌5 min或7.3×105 Pa灭菌2 min),高效液相结果发现并未有抑制物产生,未产生毒性效应[48]。此外,汽爆灭菌可提高基质比表面积,改善基质多孔特性;低场核磁研究结果表明,汽爆灭菌与常规蒸汽灭菌(1.0×105 Pa灭菌20 min)相比,固态基质分子水平上暴露出亲水基团,在三维结构水平上扩大了孔隙,为微生物细胞提供了更有效的生长空间[50]。汽爆灭菌与常规蒸汽灭菌(1.0×105 Pa灭菌20 min)相比,固态基质中葡萄糖含量提高1.57倍,木糖含量提高92.9%,枯草芽孢杆菌固态发酵活菌数提高2.83倍,且有效缩短灭菌时间,提高固态发酵效率[48, 50]。
3.3.2 两段式发酵枯草芽孢杆菌营养体细胞生长和芽孢形成所需的最佳环境不同,芽孢往往在不利于菌体生长的严峻环境中更易产生,因而两段式发酵是提高枯草芽孢杆菌活菌数和芽孢率的有效手段。即在第一阶段构建适宜菌体快速生长的最佳环境,促进产生更多的菌体;第二阶段改变条件,在有助于芽孢形成的最佳环境下诱导芽孢形成[51]。Zhang等[52]采用两段式培养优化枯草芽孢杆菌芽孢形成,通过单因素和正交试验分析指出初始葡萄糖浓度是影响芽孢形成的显著因素,并对两段发酵的温度、转速、pH进行了优化,芽孢率较优化前提高1.43倍。我们[53]对枯草芽孢杆菌固态发酵进行了两段式发酵研究,并从基质特性及微生物生长代谢角度探究了两段式发酵对菌体生长及芽孢形成的影响机制,发现两段式发酵过程中固态培养基性质得以改善,微生物对培养基中葡萄糖的利用效果加强,同时培养基中产生更多适合微生物生长代谢的有效空间;结果显示,优化后的两段式发酵中,微生物生长受到刺激,衰退期延迟,芽孢率增大,从而有效提升芽孢数量,改善微生态制剂品质。综上,两段式发酵培养符合芽孢杆菌的生长特点,对提高活菌数和促进芽孢形成均有积极作用。
3.3.3 干燥过程干燥是微生态制剂发酵的重要后处理环节,对于保证菌剂稳定性、后续贮存及运输具有重要意义。干燥通常需采用高温、真空、冷冻、辐射等方式进行[54],而这些干燥方式对枯草芽孢杆菌生长环境而言均比较严峻。因此,干燥很有可能影响芽孢形成,进而影响微生态制剂品质。刘振华[55]对比研究了高温常压干燥(80 ℃)、冷冻干燥(真空度4 Pa,温度35 ℃)和喷雾干燥(进风口温度180 ℃,出风口温度85 ℃)对多粘类芽孢杆菌活菌数的影响,结果显示喷雾干燥和冷冻干燥后多粘类芽孢杆菌活菌数比高温常压干燥后高1 000多倍,表明菌体在高温常压干燥过程中大量死亡;喷雾干燥和冷冻干燥制剂的活菌数无明显差异,表明对多粘类芽孢杆菌而言喷雾干燥和冷冻干燥过程中菌体损伤相近。
黄小琴等[56]对比了65 ℃真空干燥、80 ℃常压干燥和冷冻干燥对枯草芽孢杆菌固态发酵产物的影响,发现发酵产物经冷冻干燥和65 ℃真空干燥后,活菌数与干燥前差异不显著,且显著高于80 ℃常压干燥,该研究表明菌体对低温耐受力较强,而对高温耐受力较差,菌体在高温条件下更易死亡。综上,干燥对芽孢杆菌制剂有效生物量有重要影响,研究干燥对芽孢形成及其性质的系统影响机制并指导调控,对于改善微生态制剂品质具有重要意义。
4 枯草芽孢杆菌微生态制剂应用枯草芽孢杆菌微生态制剂目前已应用于家禽、家畜以及水产养殖等领域,见表 3。枯草芽孢杆菌制剂可调节家禽肠道菌群平衡,提高饲料利用率,增强免疫功能,有效促进家禽生长,提高产蛋率和蛋质量。Sen等[57]发现枯草芽孢杆菌作为家禽生产中常用的益生菌,可产生能抵抗高温及其他恶劣环境的芽孢,将枯草芽孢杆菌LS1-2以0.3% (质量比)添加入肉鸡日粮中,有效发挥促生长作用。张名爱等[58]研究了低铜饲粮添加枯草芽孢杆菌对5−16周龄五龙鹅肠道发育、微生物菌群结构及血清酶活性的影响,结果显示添加枯草芽孢杆菌的试验组的绒腺比和空肠绒毛高度极显著高于对照组(P < 0.01),空肠肠壁厚度显著高于对照组(P < 0.05)。由此可见,低铜饲粮添加枯草芽孢杆菌能够促进五龙鹅肠道发育,维护机体健康。蒋一秀等[59]探讨了枯草芽孢杆菌对如皋黄鸡肠道pH值、养分表观消化率及粪便中氨气和硫化氢释放量的影响,结果显示各试验组的氮、磷表观消化率与对照组相比均有所提高,各试验组粪便中氨气和硫化氢释放量均呈下降趋势,研究表明在饲料中添加枯草芽孢杆菌可以有效促进家禽对饲料中氮、磷的消化吸收,减少粪便中氨气、硫化氢的释放量,从而减轻环境污染。
| 应用领域 Application area |
作用机理 Mechanisms |
作用效果 Effects |
作用对象 Objects |
参考文献 References |
| 家禽 Poultry |
Regulate micro-ecological balance of gastrointestinal tract; secrete enzymes; improve immunity | Increase feed utilization rate; increase poultry weight; increase egg production and improve egg quality | Broiler, laying hens, meat duck, etc | [57-59] |
| 家畜 Livestock |
Biological oxygenation, advantageous to growth of anaerobic bacteria; secrete enzymes; promote digestion; improve feed conversion rate | Accelerate growth rate; improve disease resistance; reduce feed-to-meat ratio; improve milk quality; reduce cost | Piglets, cow, sheep, etc | [60-62] |
| 水产养殖 Aquaculture |
Decompose organic pollutants, purify water; regulate micro-ecological balance | Decompose organic pollutants; reduce nitrogen content in water; increase survival rate | Fish, shrimp, crab, etc | [63-64] |
枯草芽孢杆菌微生态制剂在家畜饲养方面也有积极作用,可促进家畜生长,提高抗病能力。在猪饲料中加入枯草芽孢杆菌可提高生长速度、改善饲料利用率、预防疾病发生、提高动物免疫力。祝天龙等[60]研究了枯草芽孢杆菌对仔猪免疫性能的综合影响,测定仔猪血清中IgG、IgA、IgM的含量以及补体C3、C4水平,发现添加枯草芽孢杆菌制剂后,仔猪血清中IgG、IgA含量和补体C3、C4水平均有明显提高,而IgM含量虽未明显提高,但表现出增长趋势(P < 0.05)。胡红莲等[61]研究了奶牛日粮中添加枯草芽孢杆菌微生态制剂的应用效果,发现添加枯草芽孢杆菌菌剂可有效提高奶牛产奶量,并且对牛的细菌性腹泻有很好的治疗和预防作用,且使牛奶卫生指标得到改善,经济收益率提高。贺长青等[62]研究了枯草芽孢杆菌对肥育猪血浆生化和免疫指标及粪便菌群的影响,分别设置了饲喂基础饲粮的对照组(A组),以及分别在基础饲粮中添加100 mg/kg和200 mg/kg枯草芽孢杆菌菌剂的试验组(B、C组),结果显示C组肥育猪血浆免疫球蛋白A含量和猪圆环病毒抗体水平较对照组极显著提高(P < 0.01),B、C组粪便中双歧杆菌相对含量较对照组显著提高(P < 0.05),由此可见,饲粮中添加枯草芽孢杆菌可增强机体免疫功能,优化肠道菌群,改善机体代谢。
枯草芽孢杆菌可在水产养殖池中大量繁殖,消耗水中氨氮,又可分解池底残饵和排泄物,从而能够净化水质,优化养殖水体环境,保持养殖池内微生态平衡。赵玉超等[63]研究了枯草芽孢杆菌对三疣梭子蟹饲养效果的影响,结果显示枯草芽孢杆菌可显著提高三疣梭子蟹血淋巴中的碱性磷酸酶活力(P < 0.05),有效提高三疣梭子蟹存活率,且显著降低养殖水体中氨氮和亚硝态氮含量,进而起到净化水质的作用。姚清华等[64]研究了枯草芽孢杆菌对黑仔期菲律宾鳗鲡生长性能的影响及其在饲料中的最适添加量,以鱼体增重率为评价指标,建立回归方程,预测枯草芽孢杆菌添加量为2.50%,活菌数达5×108 CFU/g时,黑仔期菲律宾鳗鲡达最大理论增重率90.95%;研究表明枯草芽孢杆菌能促进鱼体生长,提高饲料转化率,而对鱼体组成没有影响。
5 枯草芽孢杆菌微生态制剂展望枯草芽孢杆菌微生态制剂目前虽应用较为广泛,但提高其固态发酵活菌数特别是芽孢率仍是今后需不断努力的方向,值得深入研究:
(1) 枯草芽孢杆菌芽孢形成的分子生物学机制目前已形成基本理论,但其中关键调控因子和信号传递等方面还需深入研究。探究不同工艺及参数与枯草芽孢杆菌微生态制剂有效生物量、芽孢形成相关调控基因的关系,在分子机制上进一步解释生产工艺对芽孢形成的影响,为提高微生态制剂芽孢率、进一步提高枯草芽孢杆菌制剂产品质量提供理论基础。
(2) 枯草芽孢杆菌制剂生产工艺中,对发酵条件、干燥过程分别有较系统研究。然而,工艺顶层设计,如发酵、干燥一体化系统优化仍比较缺乏,距实现枯草芽孢杆菌微生态制剂高效生产尚有差距。结合枯草芽孢杆菌代谢特点,将各单元操作系统优化耦合,研发枯草芽孢杆菌微生态制剂包括前处理、发酵、干燥、存储运输、监测在内的一体化系统工艺及设备,提升枯草芽孢杆菌微生态制剂技术经济性,使其更好地在实际生产中发挥作用。
| [1] |
Huang WQ, Zhang HP. Microecologics as the alternatives to antibiotics in feed: research progress[J]. Chinese Journal of Microecology, 2015, 27(4): 488-494. (in Chinese) 黄卫强, 张和平. 饲用微生态制剂替代抗生素的研究进展[J]. 中国微生态学杂志, 2015, 27(4): 488-494. |
| [2] |
Patel R, Dupont HL. New approaches for bacteriotherapy: prebiotics, new-generation probiotics, and synbiotics[J]. Clinical Infectious Diseases, 2015, 60(S2): S108-S121. |
| [3] |
Lu LD. Studies on screening, identification, solid-state fermentation optimization and application effect of Bacillus from chicken intestines[D]. Fuzhou: Master's Thesis of Fujian Normal University, 2010 (in Chinese) 卢龙娣.鸡源性益生芽孢杆菌的筛选鉴定、固体发酵的优化及其应用效果的研究[D].福州: 福建师范大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10394-1011062090.htm |
| [4] |
Xiao FY, Song XK, Hao YR. An overview of animal probiotics research[J]. Poultry Science, 2009(9): 42-44. (in Chinese) 肖发沂, 宋希坤, 郝永任. 动物微生态制剂研究概述[J]. 家禽科学, 2009(9): 42-44. |
| [5] |
Liu KZ, Wang JW, Zhou ML, et al. Direct-fed microbes and reduction of enteric methane emissions from ruminants[J]. Microbiology China, 2017, 44(2): 465-472. (in Chinese) 刘凯珍, 王继文, 周美丽, 等. 微生态制剂与反刍动物甲烷减排[J]. 微生物学通报, 2017, 44(2): 465-472. |
| [6] |
Wu LG. Research progress on feed microecological preparations[J]. Feed and animal husbandry, 2013(7): 48-50. (in Chinese) 邬立刚. 饲用微生态制剂研究进展[J]. 饲料与畜牧, 2013(7): 48-50. |
| [7] |
Yu L, Ma LN, Du Y, et al. The progress of microbial modulator research[J]. Chinese Journal of Microecology, 2012, 24(1): 84-86. (in Chinese) 于莲, 马丽娜, 杜妍, 等. 微生态制剂研究进展[J]. 中国微生态学杂志, 2012, 24(1): 84-86. |
| [8] |
Li J, Gao PF, Zhao SP, et al. Application research of probiotics Lactic acid bacteria on improvement of dairy milk production[J]. China Dairy Cattle, 2014(17): 33-36. (in Chinese) 李晶, 高鹏飞, 赵树平, 等. 乳酸菌微生态制剂在提高奶牛产奶量方面的应用研究[J]. 中国奶牛, 2014(17): 33-36. |
| [9] |
Ma C, Gao PF, Zhang HP. Progress in application of Lactobacillus in dairy cattle nutrition and disease diagnosis and treatment[J]. Chinese Journal of Animal Science, 2014, 50(24): 31-36. (in Chinese) 马晨, 高鹏飞, 张和平. 乳酸菌在奶牛营养与疾病诊疗中的应用研究进展[J]. 中国畜牧杂志, 2014, 50(24): 31-36. |
| [10] |
Zhao SP, Gao PF, Bao WC, et al. Research progress of Lactic acid bacteria in ruminant application[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(3): 130-132. (in Chinese) 赵树平, 高鹏飞, 包维臣, 等. 乳酸菌在反刍动物应用中的研究进展[J]. 畜牧与兽医, 2015, 47(3): 130-132. |
| [11] |
Geng CY, Ren LP, Zhou ZM, et al. Yeast preparation: application effects in ruminants and possible mechanisms[J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1011-1020. (in Chinese) 耿春银, 任丽萍, 周振明, 等. 反刍动物酵母菌制剂应用的效果及可能作用机制[J]. 动物营养学报, 2015, 27(4): 1011-1020. |
| [12] |
Dai JT, Yang LY, Bai WS, et al. Effect of yeast on the performance of blue-breasted chicken[J]. Shanghai Livestock and Veterinary Communication, 2017(4): 34-35. (in Chinese) 戴剑涛, 杨亮宇, 白文顺, 等. 酵母菌对青花鸡生产性能的影响[J]. 上海畜牧兽医通讯, 2017(4): 34-35. |
| [13] |
Zhong WG, Qi HW, Zhao YM. Application of yeast preparation to regulate ruminant production and rumen ecology[J]. Chinese Journal of Animal Science, 2018, 54(8): 26-30. (in Chinese) 仲伟光, 祁宏伟, 赵玉民. 酵母菌制剂在调控反刍动物生产性能和瘤胃生态中的应用[J]. 中国畜牧杂志, 2018, 54(8): 26-30. |
| [14] |
Zhong WG, Qi HW, Yan XG, et al. Yeast preparation: application in regulating development of rumen and immunity of calves[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2085-2089. (in Chinese) 仲伟光, 祁宏伟, 闫晓刚, 等. 酵母菌制剂在调控犊牛瘤胃发育及免疫功能方面的应用[J]. 动物营养学报, 2018, 30(6): 2085-2089. |
| [15] |
Wang Y. Quantitative analysis of effects of probiotics on intestinal flora based on qPCR technique[D]. Tianjin: Master's Degree Thesis of Tianjin University of Commerce, 2018 (in Chinese) 王泳.基于qPCR技术定量分析益生菌制剂对肠道菌群的影响[D].天津: 天津商业大学硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10069-1018185853.htm |
| [16] |
Wu J, Su CP, Wang XC, et al. The regulated effect of Lactobacillus and Bifidobacterium preparation of mice intestinal flora disequilibrium model[J]. Science Technology and Engineering, 2013, 13(16): 4497-4500. (in Chinese) 伍静, 苏春萍, 王显超, 等. 乳酸菌和双歧杆菌制剂对小鼠肠道菌群失调模型的调节作用[J]. 科学技术与工程, 2013, 13(16): 4497-4500. |
| [17] |
Zuo JD, Liu GH, Yuan KT. Effects of supplemented Bifidobacterium and Lactobacillus acidophilus triple living bacteria preparation on intestinal flora after intestinal surgery[J]. China Modern Medicine, 2017, 24(5): 25-27. (in Chinese) 左继东, 刘冠环, 袁凯涛. 补充双歧杆菌与鼠李糖乳杆菌三联活菌制剂对肠道手术后肠道菌群的影响[J]. 中国当代医药, 2017, 24(5): 25-27. |
| [18] |
Peng YD, Kang KL, Qu XY, et al. Effects of Bacillus subtilis on growth performance, slaughter performance, serum antioxidant indexes and intestinal morphology of Shimen chickens[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2119-2126. (in Chinese) 彭豫东, 康克浪, 曲湘勇, 等. 枯草芽孢杆菌对石门土鸡生长性能、屠宰性能、血清抗氧化指标和肠道形态的影响[J]. 动物营养学报, 2019, 31(5): 2119-2126. |
| [19] |
Luo YZ, Shen XN, Zhou DR, et al. Application of Bacillus lichen preparation in freshwater aquaculture pond[J]. Scientific Fish Farming, 2019(1): 18-19. (in Chinese) 罗毅志, 沈学能, 周冬仁, 等. 地衣芽孢杆菌制剂在淡水养殖池塘中的应用[J]. 科学养鱼, 2019(1): 18-19. |
| [20] |
Wang CL, Song SZ, Lang X, et al. Effects of Bacillus subtilis additive and echinacea extractive on gastrointestinal development and their content distribution in fattening lambs[J]. China Herbivore Science, 2018, 38(5): 13-18. (in Chinese) 王彩莲, 宋淑珍, 郎侠, 等. 枯草芽孢杆菌制剂和紫雏菊提取物对育肥羔羊胃肠道发育及其内容物分布的影响[J]. 中国草食动物科学, 2018, 38(5): 13-18. |
| [21] |
Tang HQ, Wang ZH, Pan KC, et al. Effect of recombinant Bacillus subtilis SE1 on the growth, antioxidant capacity and immune function of broilers[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(3): 248-252. (in Chinese) 唐慧琴, 王振华, 潘康成, 等. 重组枯草芽孢杆菌SE1制剂对肉鸡生长、抗氧化能力及免疫功能的影响[J]. 中国预防兽医学报, 2018, 40(3): 248-252. |
| [22] |
Li XD, Zhao CA. Analysis of the effect of Bacillus subtilis preparation on feeding fattening sheep[J]. China Animal Industry, 2018(1): 65-66. (in Chinese) 李象鼎, 赵仓安. 枯草芽孢杆菌制剂饲喂育肥羊效果分析[J]. 中国畜牧业, 2018(1): 65-66. |
| [23] |
Zhao ZM. Steam explosion sterilization of solid state medium and fermentation process intensification[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2016 (in Chinese) 赵志敏.固态培养基汽爆灭菌及发酵过程强化[D].北京: 中国科学院大学博士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-80041-1016215117.htm |
| [24] |
Shobharani P, Padmaja RJ, Halami PM. Diversity in the antibacterial potential of probiotic cultures Bacillus licheniformis MCC2514 and Bacillus licheniformis MCC2512[J]. Research in Microbiology, 2015, 166(6): 546-554. |
| [25] |
Zhou M, Diao QY, Zhang NF, et al. Application of microecological preparations in animal nutrition and feed[J]. Feed Research, 2012(1): 17-20. (in Chinese) 周盟, 刁其玉, 张乃峰, 等. 微生态制剂在动物营养与饲料的应用[J]. 饲料研究, 2012(1): 17-20. |
| [26] |
de Veen HVBV, Xie HY, Esveld E, et al. Inactivation of chemical and heat-resistant spores of Bacillus and Geobacillus by nitrogen cold atmospheric plasma evokes distinct changes in morphology and integrity of spores[J]. Food Microbiology, 2015, 45: 26-33. |
| [27] |
Narula J, Devi SN, Fujita M, et al. Ultrasensitivity of the Bacillus subtilis sporulation decision[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(50): E3513-E3522. |
| [28] |
Tan IS, Ramamurthi KS. Spore formation in Bacillus subtilis[J]. Environmental Microbiology Reports, 2014, 6(3): 212-225. |
| [29] |
Piggot PJ, Hilbert DW. Sporulation of Bacillus subtilis[J]. Current Opinion in Microbiology, 2005, 7(6): 579-586. |
| [30] |
Fimlaid KA, Shen A. Diverse mechanisms regulate sporulation sigma factor activity in the Firmicutes[J]. Current Opinion in Microbiology, 2015, 24: 88-95. |
| [31] |
Liu Y, Qin YC, Pan BH. Several crucial events in sporulation of Bacillus subtilis[J]. Chinese Bulletin of Life Sciences, 2005, 17(4): 360-363. (in Chinese) 刘燕, 秦玉昌, 潘宝海. 枯草芽孢杆菌(Bacillus subtilis)在芽孢形成过程中的几个关键事件[J]. 生命科学, 2005, 17(4): 360-363. |
| [32] |
Jiang M, Grau R, Perego M. Differential processing of propeptide inhibitors of Rap phosphatases in Bacillus subtilis[J]. Journal of Bacteriology, 2000, 182(2): 303-310. |
| [33] |
Huang K, Jin X, Mei F, et al. Construction and identification of Bacillus thuringiensis strain YBT-881-L1 by overexpressing CodY[J]. Biotechnology Bulletin, 2011(12): 181-187. (in Chinese) 黄凯, 金鑫, 梅菲, 等. 过表达CodY蛋白的苏云金芽胞杆菌基因工程菌YBT-881-L1的构建及特性鉴定[J]. 生物技术通报, 2011(12): 181-187. |
| [34] |
Feng J, Wu H, Wang BB, et al. Advances in research on global regulatory factor CodY of probiotics[J]. Food and Fermentation Industries, 2016, 42(10): 227-233. (in Chinese) 冯佳, 吴昊, 王斌斌, 等. 全局调控因子CodY在益生菌中的研究进展[J]. 食品与发酵工业, 2016, 42(10): 227-233. |
| [35] |
Ai WH. Screening of Bacillus subtilis and probiotic potential evaluation[D]. Tai'an: Master's Thesis of Shandong Agricultural University, 2015 (in Chinese) 艾文豪.枯草芽孢杆菌的筛选和益生菌潜力评价[D].泰安: 山东农业大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10434-1015308755.htm |
| [36] |
Wang W. The study on selection of excellent Bacillus subtilis and determining its' growth performance and some biological indexes to Broiler[D]. Shihezi: Master's Thesis of Shihezi University, 2014 (in Chinese) 王苇.枯草芽孢杆菌优良菌株的筛选及其对肉鸡生长性能和部分生化及免疫学指标影响的研究[D].石河子: 石河子大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/article/cdmd-10759-1015512627.htm |
| [37] |
Yang MM. Study on key expression elemens and expression system in Bacilius subtilis[D]. Yangling: Doctoral Dissertation of Northwest A & F University, 2013 (in Chinese) 杨明明.枯草芽孢杆菌关键遗传调控元件及表达系统的研究[D].杨凌: 西北农林科技大学博士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10712-1014162976.htm |
| [38] |
Liu XY. Construction, alteration of acid-resistance and optimization of β-mannanase production by recombinant Bacilius subtilis[D]. Wuxi: Master's Thesis of Jiangnan University, 2012 (in Chinese) 刘项羽.产β-mannanase重组枯草芽孢杆菌的构建、耐酸性改造及发酵研究[D].无锡: 江南大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/article/cdmd-10295-1012329528.htm |
| [39] |
Ou WJ, Lv YJ, Wang ZR. Effects of fermented liquid feed on the performance of weaner piglets[J]. Modern Animal Husbandry, 2019, 3(2): 12-16. (in Chinese) 欧维金, 吕玉金, 王泽仁. 发酵液态饲料对断奶仔猪生产性能的影响[J]. 现代牧业, 2019, 3(2): 12-16. |
| [40] |
Li MH, Meng XM, Xu SL, et al. Preparation of Bacillus subtilis microecological preparation and its effect on performance of chicks[J]. Feed Research, 2014(11): 1-4, 7. (in Chinese) 李明华, 孟秀梅, 徐生林, 等. 枯草芽孢杆菌微生态制剂的制备及其对雏鸡生产性能的影响[J]. 饲料研究, 2014(11): 1-4, 7. |
| [41] |
Zhao ZM, Wang L, Chen HZ. Variable pressure pulsation frequency optimization in gas double-dynamic solid-state fermentation (GDSSF) based on heat balance model[J]. Process Biochemistry, 2015, 50(2): 157-164. |
| [42] |
Chen HZ, Zhao ZM, Li HQ. The effect of gas double-dynamic on mass distribution in solid-state fermentation[J]. Enzyme and Microbial Technology, 2014, 58-59: 4-21. |
| [43] |
Li XQ. Research and application analysis of solid-state fermentation engineering technology[J]. Science & Technology Information, 2019, 17(11): 219-220. (in Chinese) 李雪琪. 固态发酵工程技术的研究应用分析[J]. 科技资讯, 2019, 17(11): 219-220. |
| [44] |
Xu SR, Chen X, Wu YP. Application of the mechanism of sporulation in production of pharmaceutical probiotics[J]. Journal of Food Science and Biotechnology, 2007, 26(4): 121-126. (in Chinese) 徐世荣, 陈骧, 吴云鹏. 细菌芽孢形成机制在微生态制剂生产中的应用[J]. 食品与生物技术学报, 2007, 26(4): 121-126. |
| [45] |
Song Z, Ye XZ, Ye B. Solid-submerge fermentation of Metarhizium anisopliae[J]. Journal of Fujian College of Forestry, 2012, 32(2): 163-168. (in Chinese) 宋漳, 叶小真, 叶斌. 液固两相法培养金龟子绿僵菌的研究[J]. 福建林学院学报, 2012, 32(2): 163-168. |
| [46] |
McClure EL, Charles S, Wong S. Solid phase microextraction of macrolide, trimethoprim, and sulfonamide antibiotics in wastewaters[J]. Journal of Chromatography A, 2007, 1169(1/2): 53-62. |
| [47] |
Guo XL, Di YN, Wang Y. Optimization of sporulation conditions of Bacillus subtilis[J]. Soils and Fertilizers Sciences in China, 2012(3): 99-103. (in Chinese) 郭夏丽, 狄源宁, 王岩. 枯草芽孢杆菌产芽孢条件的优化[J]. 中国土壤与肥料, 2012(3): 99-103. |
| [48] |
Zhao ZM, Wang L, Chen HZ. A novel steam explosion sterilization improving solid-state fermentation performance[J]. Bioresource Technology, 2015, 192: 547-555. |
| [49] |
Zhao JY, Chen HZ. Correlation of porous structure, mass transfer and enzymatic hydrolysis of steam exploded corn stover[J]. Chemical Engineering Science, 2013, 104: 1036-1044. |
| [50] |
Zhao ZM, Wang L, Chen HZ. Physical structure changes of solid medium by steam explosion sterilization[J]. Bioresource Technology, 2016, 203: 204-210. |
| [51] |
Sen R, Babu KS. Modeling and optimization of the process conditions for biomass production and sporulation of a probiotic culture[J]. Process Biochemistry, 2005, 40(7): 2531-2538. |
| [52] |
Zhang YC, Jia JH, Zheng Y, et al. Optimization of sporulation conditions of Biocontrol bacteria B579 by two-step control strategy[J]. Agricultural Science & Technology, 2011, 12(2): 249-252. |
| [53] |
Zhao ZM, Xi JT, Xu JF, et al. Enhancement of Bacillus subtilis growth and sporulation by two-stage solid-state fermentation strategy[J]. Processes, 2019, 7(10): 644. |
| [54] |
Luo M, Zhang GR, Luo YJ, et al. Effects of different drying methods on the quality of plum[J]. Food and Fermentation Industries, 2018, 44(10): 152-159. (in Chinese) 罗鸣, 张桂容, 罗钰婕, 等. 不同干燥方式对青梅品质的影响[J]. 食品与发酵工业, 2018, 44(10): 152-159. |
| [55] |
Liu ZH. Preparation, process optimization and scale up for wettable powder formulations of Paenibacillus polymyxa and Bacillus marinus[D]. Shanghai: Doctoral Dissertation of East China University of Science and Technology, 2011 (in Chinese) 刘振华.多粘类芽孢杆菌和海洋芽孢杆菌可湿性粉剂的研制及其加工工艺的优化与放大[D].上海: 华东理工大学博士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10251-1012250623.htm |
| [56] |
Huang XQ, Liu Y, Zhou XQ. Study on solid fermentation and drying process of Bacullus subtilis strain Bs2004[J]. Modern Agricultural Science and Technology, 2011(1): 186-187, 190. (in Chinese) 黄小琴, 刘勇, 周西全. 枯草芽孢杆菌Bs2004固体发酵与干燥工艺研究[J]. 现代农业科技, 2011(1): 186-187, 190. |
| [57] |
Sen S, Ingale SL, Kim YW, et al. Effect of supplementation of Bacillus subtilis LS 1-2 to broiler diets on growth performance, nutrient retention, caecal microbiology and small intestinal morphology[J]. Research in Veterinary Science, 2012, 93(1): 264-268. |
| [58] |
Zhang MA, Yang WJ, Zhang ZN, et al. Effects of diet with low copper level and adding Bacillus subtilis on intestinal development, microbial community structure and serum enzyme activity of wulong geese aged from 5 to 16 weeks[J]. Chinese Journal of Animal Nutrition, 2017, 29(9): 3175-3183. (in Chinese) 张名爱, 杨文娇, 张泽楠, 等. 低铜饲粮添加枯草芽孢杆菌对5–16周龄五龙鹅肠道发育、微生物菌群结构及血清酶活性的影响[J]. 动物营养学报, 2017, 29(9): 3175-3183. |
| [59] |
Jiang YX, Li SM, Fan JM, et al. Effect of Bacillus subtilis on pH value of intestinal tract, utilization efficiency of nutrient, ammonia and hydrogen sulfide released from faeces of Rugao yellow chicken[J]. China Poultry, 2018, 40(19): 32-35. (in Chinese) 蒋一秀, 李尚民, 范建华, 等. 枯草芽孢杆菌对如皋黄鸡肠道pH值、养分表观消化率及粪便中氨气和硫化氢释放量的影响[J]. 中国家禽, 2018, 40(19): 32-35. |
| [60] |
Zhu TL, Li K, Shao Q, et al. Effect of Bacillus subtilis preparation on growth and immunity of piglets[J]. Feed Research, 2015(3): 26-31. (in Chinese) 祝天龙, 李奎, 邵强, 等. 枯草芽孢杆菌制剂对仔猪生长及免疫的影响[J]. 饲料研究, 2015(3): 26-31. |
| [61] |
Hu HL, Zhang B, Gao M. Effect test of Bacillus subtilis microecological preparation in dairy cow diet[J]. Feed Industry, 2011, 32(18): 52-55. (in Chinese) 胡红莲, 张博, 高民. 枯草芽孢杆菌型微生态制剂在奶牛日粮中应用效果试验[J]. 饲料工业, 2011, 32(18): 52-55. |
| [62] |
He CQ, Zhu J, Kuang YH, et al. Effects of Bacillus subtilis on plasma biochemical and immune indices and fecal microflora of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3260-3267. (in Chinese) 贺长青, 朱瑾, 匡佑华, 等. 枯草芽孢杆菌对肥育猪血浆生化和免疫指标及粪便菌群的影响[J]. 动物营养学报, 2019, 31(7): 3260-3267. |
| [63] |
Zhao YC, Pang Y, Cui XY, et al. Effects of Bacillus subtilis on immunization indicators, growth performance and culture water quality of Portunus trituberculatus[J]. Journal of Southern Agriculture, 2017, 48(10): 1899-1905. (in Chinese) 赵玉超, 逄颖, 崔晓宇, 等. 枯草芽孢杆菌对三疣梭子蟹免疫指标、生长性能及养殖水质的影响[J]. 南方农业学报, 2017, 48(10): 1899-1905. |
| [64] |
Yao QH, Wang BZ, Guo QX, et al. Effects of Bacillus subtilis on growth performance, body composition and digestive enzymes activity of Philippine eel black fry, Anguill marmorata[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12): 177-184. (in Chinese) 姚清华, 王宝珍, 郭清雄, 等. 枯草芽孢杆菌对黑仔期菲律宾鳗鲡生长、体成分和消化酶活性的影响[J]. 中国食品学报, 2016, 16(12): 177-184. |
 2020, Vol. 47
2020, Vol. 47