扩展功能
文章信息
- 王雅蓉, 朱明星, 张帆, 杨婷婷, 贾琴琴, 王秀青
- WANG Ya-Rong, ZHU Ming-Xing, ZHANG Fan, YANG Ting-Ting, JIA Qin-Qin, WANG Xiu-Qing
- c-di-GMP的磷酸二酯酶PA4781在抗菌肽Merecidin抑制铜绿假单胞菌生物被膜中的作用
- The role of c-di-GMP phosphodiesterase PA4781 in the inhibition of Pseudomonas aeruginosa biofilm by the antimicrobial peptide merecidin
- 微生物学通报, 2020, 47(3): 868-879
- Microbiology China, 2020, 47(3): 868-879
- DOI: 10.13344/j.microbiol.china.190754
-
文章历史
- 收稿日期: 2019-09-18
- 接受日期: 2020-01-10
- 网络首发日期: 2020-01-14
2. 宁夏医科大学科技中心 宁夏 银川 750004;
3. 宁夏医科大学总医院外科学研究室 宁夏 银川 750004
2. Science and Technology Center of Ningxia Medical University, Yinchuan, Ningxia 750004, China;
3. Department of Surgery, General Hospital of Ningxia Medical University, Yinchuan, Ningxia 750004, China
铜绿假单胞菌是院内获得性感染发病率很高的革兰氏阴性杆菌。铜绿假单胞菌感染后通常会伴有生物被膜的产生,生物被膜是由细菌及自身产生的蛋白质、多糖等成分包绕而成,很容易附着在生物材料或者黏膜表面[1],由于生物被膜的产生使其对常规抗生素产生抵抗力,并且生物被膜的保护使得细菌逃避宿主免疫系统的攻击。如铜绿假单胞菌生物被膜胞外多聚基质中的藻酸盐能够保持生物被膜结构的稳定性[2],增强细菌黏附性,提高对于附着物的附着能力,增强细菌耐药性,因而消除生物被膜一直是人们在积极探索的内容。
抗菌肽是先天免疫效应分子,本研究使用的抗菌肽为Merecidin (或命名为17BIPHE2),氨基酸序列为GBKRLVQRLKDBLRNLV,是抗菌肽LL-37的衍生肽。其中L为D型氨基酸,B为联苯苯丙氨酸,分子量为2 561.866[3]。Merecidin相比LL-37溶血活性和对人体毒性更低,而抗菌活性有所提高[4-5]。我们前期研究表明,Merecidin具有抗肿瘤的作用[6],并且能够抑制金黄色葡萄球菌以及铜绿假单胞菌生物被膜[7]。
本研究就抗菌肽Merecidin对铜绿假单胞菌生物被膜作用机制进一步探究。在Merecidin抑制铜绿假单胞菌生物被膜的基础上,对经过抗菌肽处理的生物被膜原核转录组进行测序分析,测序分析结果显示抗菌肽作用后与对照组相比PA4781基因表达量明显上调。Real-time PCR实验也验证了这一结果的正确性。
PA4781是c-di-GMP的磷酸二酯酶。c-di-GMP作为细菌的第二信使分子,与相应的受体分子结合接受信号传导,进而影响下游靶点的功能[8]。c-di-GMP主要调控细菌的运动性、生物膜的形成等生理过程[9]。c-di-GMP由含GGDEF蛋白质结构域的环化酶合成,而含有EAL和HD-GYP结构域的磷酸二酯酶参与其水解[10-11]。c-di-GMP是一个可以介导细菌由生物被膜生长模式向游离运动状态转变的关键分子[11]。c-di-GMP水平升高,生物被膜形成增强,c-di-GMP水平下降致使生物被膜形成缺陷[12]。PA4781和PA4108在铜绿假单胞菌中能够编码含有HD-GYP结构域的蛋白[13]。
因PA4781在抗菌肽Merecidin作用下表达上调,因而猜想抗菌肽Merecidin可能会通过影响PA4781表达进而影响细菌第二信使分子c-di-GMP相关调控系统使得生物被膜的产生受到抑制。因而将PA4781过表达以及敲除,并在不同浓度的抗菌肽Merecidin的作用下观察其生物学功能变化情况,如生物被膜厚度、生物被膜重要组分胞外多糖藻酸盐的变化情况等,以期探索抗菌肽Merecidin对铜绿假单胞菌生物被膜的抑制机制。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒铜绿假单胞菌PA03为临床分离株,由宁夏医科大学总医院实验中心提供,成膜能力较强,PA4781过表达株pMP2444-PA4781由实验室保存。实验所用菌株及质粒详见表 1。
| 菌株和质粒 Strains and plasmids |
来源 Source |
| Pseudomonas aeruginosa (PA03) | Laboratory stock (Clinical isolates) |
| PA4781 overexpression strain (pMP2444-PA4781) | Laboratory stock |
| pnCasPA-BEC | Addgene |
| DH10B competent Cells | Thermo Fisher Scientific |
氨基酸序列为GBKRLVQRLKDBLRNLV,由吉尔生化(上海)有限公司合成,纯度达95%以上,灭菌ddH2O作为其溶剂。
1.1.3 主要试剂和仪器及培养基庆大霉素、氨苄青霉素,北京Solarbio公司;Prime STAR HS (Premix)、T4 PNK,TaKaRa公司;限制性内切酶Bsa I、高效连接酶T4 DNA Ligase,NEB公司;藻酸盐标准品,Sigma公司;DNA回收试剂盒、质粒提取试剂盒、DNA marker,北京天根生化科技有限公司。
Multiskan GO全波长酶标仪,Thermo Fisher Scientific公司;双光束紫外可见光光度计,北京普析通用仪器有限责任公司;生物电泳图像分析系统,复日科技有限公司;电转化仪,Bio-Rad公司。
SOC (super optimal broth with catabolite repression)培养基:在950 mL纯水中加入蛋白胨20.0 g,酵母粉5.0 g,氯化钠0.5 g,再加入10 mL 250 mmol/L氯化钾,定容至1 L,1×105 Pa灭菌30 min,冷却至室温后加入20 mL 1 mol/L葡萄糖,溶液使用前加入5 mL灭菌的2 mol/L氯化镁。
TSB (tryptic soy broth)培养基(g/L):胰蛋白胨17.0,大豆蛋白胨3.0,氯化钠5.0,磷酸氢二钾2.5,葡萄糖2.5,pH 7.2。TSA (tryptic soy agar)即在TSB中添加琼脂(20 g/L)。
1.1.4 PCR引物根据靶基因PA4781序列和CasOT软件筛选sgRNA靶序列,得到了3个sgRNA序列,并设计每个sgRNA的退火引物对;敲除质粒筛选时菌检下游引物为PA-BEC-R。根据NCBI (www.ncbi.nlm.nih.gov)网站提供的铜绿假单胞菌PA4781基因序列,设计引物对pari1-F和pair1-R,用来扩增PA4781基因片段,详见表 2。引物合成由生工生物工程(上海)股份有限公司完成,基因测序由金唯智生物科技(天津)有限公司完成。
| 引物名称 Primers name |
序列 Sequence (5′→3′) |
用途 Usage |
| pari1-F | CTCCAGCGTCTTCAATACGGA | PA4781 amplification |
| pair1-R | GGCAAACGCCGTGCCGAGCACA | PA4781 amplification |
| sgRNA-1 | GCCCGAGCAGGAACTCGTGCTGG | Target sequence 1 |
| sgRNA-2 | GAGCAACAGGGCCTGGCCCTGG | Target sequence 2 |
| sgRNA-3 | GCGCCAGCTGCAACAGTTGCAGG | Target sequence 3 |
| PA4781-sgRNA-F1 PA4781-sgRNA-R1 | GTGGGCCCGAGCAGGAACTCGTGC AAACGCACGAGTTCCTGCTCGGGC | Annealing primer 1 |
| PA4781-sgRNA-F2 | GTGGGAGCAACAGGGCCTGGCCCT | Annealing primer 2 |
| PA4781-sgRNA-R2 | AAACAGGGCCAGGCCCTGTTGCTC | |
| PA4781-sgRNA-F3 | GTGGGCGCCAGCTGCAACAGTTGC | Annealing primer 3 |
| PA4781-sgRNA-R3 | AAACGCAACTGTTGCAGCTGGCGC | |
| PA-BEC-R | CTCGTGCGGTTCAATGCGA | Colony PCR primer |
PA4781基因的敲除选择pnCasPA-BEC系统,该系统由胞苷脱氨酶APOBEC1和Cas9蛋白融合而成,是一种单碱基基因编辑系统,该系统通过脱氨反应将靶基因中特定氨基酸密码子如CAA、CAG中的C碱基突变为T,其互补链上相应的G突变为A,通过突变提前产生终止密码子TAA、TAG,从而提前将靶基因的转录翻译过程终止,达到敲除基因的效果[14]。
1.2.1 sgRNA的设计及相关引物合成根据目的基因PA4781序列和CasOT软件筛选出候选sgRNA靶序列,同时希望预期产生的突变位于sgRNA靶序列第2–8个碱基处,靶序列上需有氨基酸Q或W的sgRNA靶位点[14],设计的具体序列见表 2。
1.2.2 sgRNA载体构建、转化及转化筛选sgRNA载体构建:(1) sgRNA引物对的退火连接:PA4781-sgRNA-F (100 μmol/L) 1 μL,PA4781-sgRNA-R (100 μmol/L) 1 μL,10×T4 Ligation Buffer 1 μL,T4 PNK (10 U/μL) 0.5 μL,ddH2O 6.5 μL,总体积10 μL。PCR反应条件:37 ℃ 30 min,95 ℃ 5 min之后取出放于室内自然降温至25 ℃,产物于–20 ℃中保存。(2) pnCasPA-BEC质粒载体与sgRNA退火产物做连接反应,首先用限制性内切酶Bsa I对pnCasPA-BEC质粒上的Bsa I酶切位点进行特异性的切割,形成与sgRNA两端互补的黏性末端,酶切体系(50 μL):10×Buffer 5 μL,pnCasPA-BEC 15 μL,Bsa I 1 μL,ddH2O 29 μL。37 ℃反应3 h之后置于65 ℃ 15 min灭活内切酶。(3)将酶切后的质粒纯化回收,回收后的质粒与sgRNA退火产物进行连接,连接体系(20 μL):10×T4 DNA Ligase Buffer 2 μL,退火后的sgRNA 4 μL,酶切后的质粒pnCasPA-BEC 2 μL,T4 DNA Ligase 1 μL,ddH2O 11 μL。25 ℃连接反应3 h,获得连接产物。
连接产物的转化:将上述获得的连接产物转化至DH10B感受态细胞中。从–80 ℃冰箱中取出100 μL DH10B感受态细胞,将其置于冰上缓慢融化,加入连接产物6 μL,轻轻吹打混匀,冰浴30 min;冰浴结束之后将菌液放入42 ℃水浴中热激45 s,立即放入冰浴中2 min;加入提前预热于37 ℃的SOC培养基900 μL,于37 ℃恒温摇床150 r/min振荡45 min,将菌液于室温下5 000 r/min离心5 min弃尽上清;取100 μL新鲜LB培养基将菌体打散,均匀涂布于含有庆大霉素抗性的平板表面;平板可先正向37 ℃放置0.5 h,待液体吸收完毕,再倒置37 ℃培养过夜。
转化筛选:挑选过夜培养转化平板上的单克隆菌落于含50 μg/mL庆大霉素的LB液体培养基中在37 ℃、220 r/min条件下培养过夜。之后进行菌落PCR验证。将退火后的sgRNA双链引物对定向亚克隆到pnCasPA-BEC载体上,PCR筛选的引物为以3个sgRNA正向引物和PABEC IDR,对克隆进行PCR筛选,PCR所用模板为煮沸法制得:取20 μL菌液,加入100 μL ddH2O,低火煮沸10 min,4 ℃、12 000×g离心10 min,取上清作为模板。菌落PCR体系(50 μL):模板2 μL,PA4781F (10 μmol/L) 1 μL,PA-BEC-R (10 μmol/L) 1 μL,Prime STAR HS (Premix) 25 μL,ddH2O 21 μL。PCR反应条件:98 ℃ 30 s;98 ℃ 10 s,62 ℃ 5 s,72 ℃ 10 s,30个循环;72 ℃ 7 min。对菌检结果为阳性的菌株提取重组质粒DNA,按照质粒小提试剂盒的使用说明操作,送金唯智生物科技(天津)有限公司进行测序分析,结果测序正确的命名为PA4781 sgRNA-F1、PA4781 sgRNA-F2、PA4781 sgRNA-F3,重组质粒−20 ℃保存。
1.2.3 PA03菌株电转感受态制备[15]复苏PA03菌株于无抗性的LB固体平板上,37 ℃倒置培养约16 h。挑取单个菌落于5 mL新鲜的LB液体培养基中,37 ℃、180 r/min培养过夜(12–14 h)。将培养过夜的菌液按照1:100的比例接入100 mL新鲜的LB培养基中,放大培养至OD600为0.6–0.8之间,此时细菌处于对数生长期。将菌液放于冰上预冷约0.5 h,并不间断摇晃菌液。离心机4 ℃预冷,将预冷的菌液倒入离心管中,利用天平两两配平,4 ℃、5 000 r/min离心12 min,弃上清,首先加入预冷的双蒸水充分悬浮洗涤,4 ℃、5 000 r/min离心12 min,弃上清,再用10%甘油重复上述步骤清洗2次。根据最后一次离心后剩余的菌体加入10%预冷的甘油(大约1 mL),吹打混匀之后分装感受态细胞,100 μL每管直接进行转化实验或者放入–80 ℃冰箱保存。
制备电转感受态细胞所有物品均用双蒸水洗涤并高压蒸汽灭菌,使用前预冷。所有步骤均应在冰上进行。
1.2.4 敲除质粒的电转化及验证将PA4781 sgRNA (F1、F2、F3)重组质粒分别电转入铜绿假单胞菌PA03感受态细胞,将PA4781基因扩增出来通过Sanger测序观察靶点位置碱基突变情况。在含庆大霉素(60 μg/mL)的LB平板上培养过夜后,挑取平板上单克隆菌落于含庆大霉素(60 μg/mL)的LB培养基中,37 ℃、180 r/min振荡培养12 h,煮沸法提取菌液DNA作为模板。PCR反应体系(25 μL):模板1 μL,pair1-F (10 μmol/L) 0.5 μL,pair1-R (10 μmol/L) 0.5 μL,ddH2O 10.5 μL,Prime STAR HS (Premix) 12.5 μL。PCR反应条件:98 ℃ 30 s;98 ℃ 10 s,61 ℃ 5 s,72 ℃ 10 s,26个循环;72 ℃ 7 min。先取2.5 μL进行1.5%琼脂糖凝胶电泳检测。选择PCR产物大小符合PA4781基因1 182 bp的、并且条带单一的PCR产物进行测序。将成功进行敲除的菌株命名为pnCasPA-BEC-ΔPA4781。
1.3 结晶紫法定量检测Merecidin在不同浓度作用下正常株、过表达株、敲除株生物被膜的变化情况复苏PA03株、过表达株pMP2444-PA4781、敲除株pnCasPA-BEC-ΔPA4781于TSA培养基37 ℃倒置培养,15 h后挑取单个菌落,在TSB培养基中37 ℃、180 r/min振荡过夜,pMP2444-PA4781、pnCasPA-BEC-ΔPA4781为维持质粒稳定需在培养基中添加抗生素。培养过夜后,取1%菌液放大培养约2.5 h,调整菌液浓度至0.5麦氏浊度,用TSB继续稀释菌液100倍后,每孔200 μL接种至96孔培养板中,以空白TSB培养基作为空白对照,以不加药的PA03株、过表达株pMP2444-PA4781、敲除株pnCasPA-BEC-ΔPA4781为阴性对照。
Merecidin药物稀释:抗菌肽保存于–20 ℃冰箱中,取出后室温平衡5 min,进行称量,称取1 mg抗菌肽加入100 μL灭菌ddH2O,此时抗菌肽Merecidin为3 900 μmol/L,取该溶液进行稀释,最终使得加入的孔内菌液药物浓度分别为24、48、72 μmol/L。
培养24 h之后轻轻吸去培养基,用PBS冲洗2次,动作轻柔以防生物被膜洗去,晾干之后每孔加入甲醇200 μL固定15 min。固定结束后弃去甲醇晾干,加入0.1%结晶紫200 μL染色5 min,结束后弃去结晶紫,流水下冲洗多余染料,自然晾干。每孔加入33%冰乙酸,酶标仪高速振荡15 min后测波长595 nm处的光密度,培养基空白孔做以上同样的处理。实验重复3次。
1.4 不同浓度抗菌肽Merecidin作用下受试菌生物被膜藻酸盐产生量变化情况生物被膜中藻酸盐含量采用对羟基联苯溶液显色法[16-17],首先根据藻酸盐标准品制得藻酸盐标准曲线方程:y=0.000 7x–0.003 1,R2=0.980 5。用上述方法获得0.5麦氏浊度的PA03株、过表达株pMP2444-PA4781、敲除株pnCasPA-BEC-ΔPA4781菌液,并将其稀释100倍,作为工作浓度。实验设空白培养基组、不含药阴性对照组、抗菌肽Merecidin 48、72 μmol/L处理组,每组4个复孔。无菌细胞爬片置于24孔板,加入稀释好的工作浓度菌液1 mL,抗菌肽处理组在加入菌液后并加入不同浓度的抗菌肽溶液使其终浓度为48、72 μmol/L,37 ℃培养24 h后取出爬片,用4 ℃ PBS轻柔洗去爬片上的浮游菌,将爬片弄碎放入试管,加入2.4 mL硫酸和硼酸钠的混合物(于冰水混合物中操作),混匀后100 ℃煮沸5 min,4 ℃放置,之后加入40 μL 1%对羟基联苯溶液进行显色,混匀后检测520 nm处吸光度值,减去空白对照,以藻酸盐标准品的标准曲线所得公式计算出黏附在爬片上各组生物被膜藻酸盐含量。以各菌株阴性对照组藻酸盐产生量为100%,计算不同浓度抗菌肽作用后各菌株藻酸盐产生的百分率。实验重复3次。
1.5 数据处理采用SPSS 22.0统计软件进行统计分析。数据采用均数±标准差表示,采用单因素方差分析(one-way ANOVO),P < 0.05认为差异有统计学意义。
2 结果与分析 2.1 敲除载体构建 2.1.1 sgRNA设计依据软件CasOT[18]设计靶向PA4781基因的sgRNA序列。在CasOT里面遵循降低脱靶几率的原则,原核生物基因组一般较小,脱靶率相对较低,位于CDS区5′端的靶点是选择的重点。之后利用单碱基基因编辑系统的原理,在靶点处进行分析,靶位点中有氨基酸为Q (密码子为CAG、CAA)者,这样的靶点更具有意义,能够使得预期产生的突变密码子处于所构建靶点的第2−8个碱基。本实验构建的3个靶基因所处的位置如图 1所示。
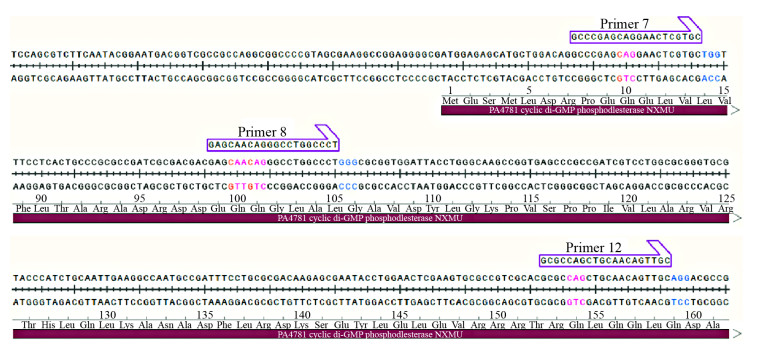
|
| 图 1 sgRNA靶基因在基因组中的位置 Figure 1 Genome location of PA4781 sgRNA target 注:Primer 7:sgRNA-1靶点;Primer 8:sgRNA-2靶点;Primer 12:sgRNA-3靶点;红色部分为预期突变子产生的位置. Note: Primer 7 is sgRNA-1, Primer 8 is sgRNA-2, and Primer 12 is sgRNA-3. The red part is the position where the expected mutant is produced. |
|
|
因pncasPA-BEC载体中不含靶点sgRNA引物,因此阴性质粒不能够PCR出产物。阳性克隆菌的PCR产物大小为350 bp,复核预期的PCR产物大小。如图 2A所示,3个靶点分别挑取3个单克隆菌落进行筛选,获得1个sgRNA-1阳性菌落,sgRNA-2、sgRNA-3各2个阳性菌落,送检测序正确的3个靶点质粒分别命名为PA4781 sgRNA-F1、PA4781 sgRNA-F2、PA4781 sgRNA-F3。图 2B为PA4781 sgRNA-F1、PA4781 sgRNA-F2、PA4781 sgRNA-F3 3个靶点的质粒提取图。
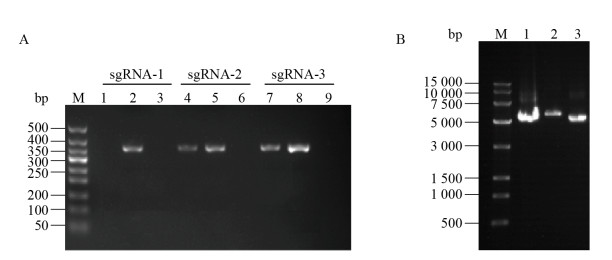
|
| 图 2 sgRNA载体菌检PCR筛选(A)和sgRNA质粒纯化(B) Figure 2 PCR screening for positive sgRNA plasmid subclone (A) and purification of sgRNA expressing plasmid (B) 注:A:DNA分子量标准500 bp. B: DNA分子量标准15 000 bp;1:PA4781 sgRNA-F1质粒;2:PA4781 sgRNA-F2质粒;3:PA4781 sgRNA-F3质粒. Note: A: The DNA molecular weight standard is 500 bp. B: DNA molecular weight standard of 15 000 bp; 1: PA4781 sgRNA-F1 plasmid; 2: PA4781 sgRNA-F2 plasmid; 3: PA4781 sgRNA-F3 plasmid. |
|
|
将3个重组质粒电转化入铜绿假单胞菌PA03感受态细胞中,筛选转化平板上面的单个转化克隆,扩增目的片段PA4781,并用1.5%凝胶电泳鉴定,如图 3所示,条带单一,符合目的片段大小(1 182 bp),单碱基突变在琼脂糖电泳上面看不出变化,因此将剩余的PCR产物送去金唯智生物科技(天津)有限公司进行Sanger测序鉴定。
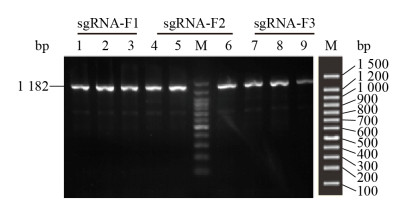
|
| 图 3 铜绿假单胞菌单克隆菌PCR扩增PA4781 Figure 3 PCR amplification of Pseudomonas aeruginosa monoclonal strain PA4781 注:M:DNA分子量标准1 500 bp;1、2、3源于PA4781 sgRNA-F1质粒转化克隆;4、5、6源于PA4781 sgRNA-F2质粒转化克隆;7、8、9源于PA4781 sgRNA-F3质粒转化克隆. Note: M: The DNA molecular weight standard is 1 500 bp; 1, 2, 3 are derived from the PA4781 sgRNA-F1 transformant; 4, 5, 6 are derived from the PA4781 sgRNA-F2 transformant; 7, 8, and 9 are derived from the PA4781 sgRNA-F3 transformant. |
|
|
Sanger测序分析发现,PA4781 sgRNA-F1、PA4781 sgRNA-F2电转后,转化平板上面的菌落均未发现靶点附近有任何单碱基突变。这可能跟靶点序列位置的二级结构以及其位于基因组中的空间位置有关,导致该靶点位置无法进行有效的基因编辑。PA4781 sgRNA-F3转化平板上挑取的菌落,3株均发现在sgRNA靶点位置出现预期突变,如图 4所示,在进行序列比对时发现PA4781 sgRNA-F3靶点位置出现了一个碱基突变即C→T,其相应的密码子由原来的CAG转变为终止密码子TAG,符合图 1中所设计的PA4781 sgRNA-F3靶点位置的预期突变,提前终止PA4781的转录翻译过程,达到PA4781敲除的目的,将该株菌命名为pnCasPA-BEC-ΔPA4781。图 4对比如下:PA03中标记为红色的碱基C,在突变体中转变为T。
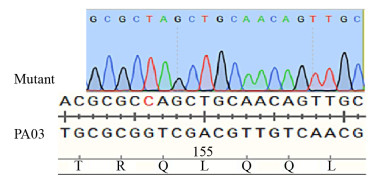
|
| 图 4 单碱基基因编辑系统pnCasPA-BEC编辑基因组C突变为T Figure 4 The base editor pnCasPA-BEC enabled highly efficient C/T conversion 注:PA03菌株中PA4781基因被pnCasPA-BEC system系统有效突变. PA03中标红的碱基,在突变体中突变为T. Note: The PA4781 gene of the P. aeruginosa PA03 strain was effectively inactivated by the pnCasPA-BEC system. The base C of the red color in PA03 was mutated to T in the mutant. |
|
|
结晶紫是一种碱性染料,能够结合生物被膜表面带负电荷的分子和胞外基质多糖组分,通过测定吸光度来用于生物被膜形成能力的鉴定。PA03、过表达株pMP2444-PA4781、敲除株pnCasPA-BEC-ΔPA4781,分别被24、48、72 μmol/L的Merecidin处理,24 h后结晶紫染色定量生物被膜生成量。24 μmol/L处理组3组无明显差异,48 μmo/L和72 μmol/L处理组过表达菌株pMP2444-PA4781生物被膜明显低于正常株和敲除株,说明抗菌肽Merecidin作用下PA4781作用更加明显,敲除株pnCasPA-BEC-ΔPA4781在高药物浓度下生物被膜还是会减少,说明高浓度的Merecidin能够刺激PA4781发挥部分作用。图 5A为OD595值,结晶紫染色如图 5B所示。
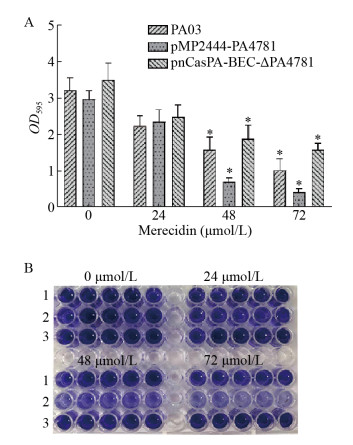
|
| 图 5 结晶紫染色定量受试菌生物被膜形成能力 Figure 5 Crystal violet staining identify the ability of biofilm formation 注:A:结晶紫定量染色检测生物被膜,*:P < 0.05. B:结晶紫染色观察生物被膜,1:PA03;2:pMP2444-PA4781;3:pnCasPA-BEC-ΔPA4781. Note: A: Quantitative detection of biofilm by crystal violet staining, *: P < 0.05. B: Observation of biofilm by crystal violet staining, 1: PA03; 2: pMP2444-PA4781; 3: pnCasPA-BEC-ΔPA4781. |
|
|
PA03、过表达株pMP2444-PA4781、敲除株pnCasPA-BEC-ΔPA4781被48、72 μmol/L的Merecidin处理,24 h为初期黏附阶段,24 h后通过对羟基联苯法测定藻酸盐变化情况。如图 6所示,显示随着抗菌肽Merecidin浓度升高受试菌藻酸盐含量下降,过表达pMP2444-PA4781组在抗菌肽Merecidin作用下藻酸盐产生量明显低于PA03与敲除株pnCasPA-BEC-ΔPA4781,抗菌肽Merecidin在72 μmol/L作用下抑制率可达65%。
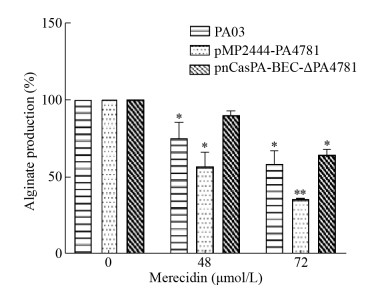
|
| 图 6 Merecidin对受试菌生物被膜藻酸盐产生的影响 Figure 6 Effect of merecidin on Pseudomonas aeruginosa biofilm alginate 注:*:P < 0.05;**:P < 0.01. Note: *: P < 0.05; **: P < 0.01. |
|
|
铜绿假单胞菌广泛分布于自然环境中,作为条件致病菌,是免疫力低下患者以及重症患者院内感染的主力军[19]。因铜绿假单胞菌容易形成多重耐药以及生物被膜,造成铜绿假单胞菌感染后病情总是反复,迁延不愈[20]。生物被膜的形成大致分三步:初期黏附,逐渐成熟,后期扩散。生物被膜具有自身的生物结构特征,形成过程中细菌产生各种基质作为保护屏障,比如多糖藻酸盐、Psl、Pel、蛋白质等,增强细菌适应环境的能力、抗生素抗性,逃避宿主免疫监视[21-22]。生物被膜的形成一直是研究的热点,研究者们希望能够找到抑制生物被膜的手段。
c-di-GMP信号系统调节细菌毒力、生物被膜等生物学性状[23-24]。最近还有学者发现c-di-GMP的免疫刺激和免疫调节特性,支持其作为疫苗佐剂的潜在应用[25]。c-di-GMP通过与转录调节因子比如FleQ等的相互作用,调节基因表达影响生物被膜多糖组分的Pel的转录,从而对生物被膜的形成产生影响[8]。高水平的c-di-GMP促进无梗细胞生长,而低水平与浮游生物的存在相关[8, 26]。越来越多的证据表明,c-di-GMP通过与效应蛋白等受体分子结合,从而调控细菌胞外多糖、鞭毛生物合成及毒力的产生[26-27]。生物被膜的组分中含有胞外多糖,其中藻酸盐、Psl、Pel是最主要的[28]。研究表明,藻酸盐的生物合成受到细菌第二信使分子c-di-GMP的调控[29],c-di-GMP结合Alg44这一藻酸盐合成重要的蛋白,这是藻酸盐合成的重要途径[30]。细胞内c-di-GMP水平升高导致Psl多糖以及其它生物被膜组分升高[31]。FleQ除了影响鞭毛基因的表达,其作为铜绿假单胞菌的转录调节因子,还能够抑制Pel基因的转录,而这种抑制作用会被高浓度的c-di-GMP解除[8]。
铜绿假单胞菌PAO1基因组编码两种具有HD-GYP结构域的蛋白(PA4108,PA4781)和第3种含有关键残基变异结构域(YN-GYP)的蛋白(PA2572)[13],PA4108、PA4781和PA2572的突变对铜绿假单胞菌的生物膜形成和结构有明显的影响。HD-GYP是参与细菌第二信使分子c-di-GMP水解的蛋白质结构域[32]。在霍乱弧菌(Vibrio cholerae) El Tor体内HD-GYP蛋白的过表达降低了c-di-GMP的细胞内浓度,减少了胞外多糖的产生和生物膜形成[33]。Ueda等[34]研究酪氨酸磷酸酶TpbA与胞外DNA关系时表明,突变铜绿假单胞菌酪氨酸磷酸酶TpbA后c-di-GMP的浓度上升,诱导生物膜形成大量增加,胞外DNA与c-di-GMP浓度呈相反的趋势,突变PA4781后胞外DNA下降。课题组前期已经发现抗菌肽Merecidin作用后能够抑制铜绿假单胞菌生物被膜[7],本实验通过抗菌肽Merecidin作用前后铜绿假单胞菌转录组的测序分析,得到若干个差异表达基因,其相关的信号通路都可能与抗菌肽Merecidin抑制铜绿假单胞菌生物被膜有关。其中PA4781作为细菌第二信使分子的磷酸二酯酶,编码的蛋白具有HD-GYP结构域,参与c-di-GMP的降解,并且在抗菌肽Merecidin作用下高表达,我们猜想抗菌肽Merecidin可能通过上调PA4781基因进而影响细菌第二信使分子c-di-GMP信号系统来抑制生物被膜。
细菌对抗生素越来越多耐药性的出现,希望找到其它对抗细菌的手段。抗菌肽广泛存在于自然界生物体内,从昆虫到哺乳动物体内均可分离,不仅具有抗菌作用,还能够作为先天免疫系统的一部分调节宿主细胞功能[35]。实验所用抗菌肽Merecidin为抗菌肽Cathelicidin家族肽中的唯一成员LL-37的截短肽,它更加稳定、有效、毒性更低[36]。Merecidin单独使用和与抗生素联用研究均显示出很好的抗细菌生物被膜的作用[37-38]。
实验通过高表达、敲除PA4781,同时加上抗菌肽的作用来验证我们的猜想。为敲除该基因,实验使用的是由CRISPR RNA引导的胞嘧啶单碱基基因编辑系统pnCasPA-BEC[14],由失活的Cas9蛋白与胞苷脱氨酶APOBEC1形成融合蛋白复合物,可以通过Cas9/sgRNA复合物将脱氨酶导向任何基因组基因座,sgRNA与目的基因互补配对,在不产生双链DNA断裂、不降低菌落转化效率的情况下,在靶位点进行碱基C–T的单碱基编辑。利用该系统靶向编辑PA4781基因,PA4781转录提前终止,PA4781失活。该系统已在金葡等细菌中得到很好地验证[39]。
本研究用抗菌肽Merecidin 24、48、72 μmol/L处理PA03菌株、PA4781过表达株和PA4781敲除株后,用结晶紫染色法测定细菌生物被膜形成能力,对羟基联苯法测定生物被膜藻酸盐含量,发现抗菌肽Merecidin作用下,过表达株效果最为明显,生物被膜以及生物被膜中的藻酸盐过表达菌株明显低于PA03菌株以及PA4781敲除株,表明抗菌肽Merecidin存在下,细菌体内过量表达的P4781继续发挥其功能降解c-di-GMP,减少生物被膜形成;敲除株发现产生物被膜以及藻酸盐的能力弱于正常株,表明利用pnCasPA-BEC单碱基编辑系统使PA4781基因失活后,在抗菌肽作用下还是有部分PA4781基因功能被激活,从而继续行使其功能。
本研究主要是根据前期试验结果对抗菌肽Merecidin抑制铜绿假单胞菌生物被膜机制的研究做一个铺垫,发现PA4781基因在抗菌肽Merecidin作用下表达上调,降解细菌第二信使分子c-di-GMP从而产生抑制生物被膜的作用,因而下一步将会进行抗菌肽作用后细菌第二信使分子相关其他功能的检测,继续探究抗菌肽Merecidin抑制生物被膜和细菌第二信使分子之间的联系。
| [1] |
Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms[J]. The Lancet, 2001, 358(9276): 135-138. DOI:10.1016/S0140-6736(01)05321-1 |
| [2] |
Xu BJ, Soukup RJ, Jones CJ, et al. Pseudomonas aeruginosa AmrZ binds to four sites in the algD promoter, inducing DNA-AmrZ complex formation and transcriptional activation[J]. Journal of Bacteriology, 2016, 198(19): 2673-2681. DOI:10.1128/JB.00259-16 |
| [3] |
Wang GS, Hanke ML, Mishra B, et al. Transformation of human cathelicidin LL-37 into selective, stable, and potent antimicrobial compounds[J]. ACS Chemical Biology, 2014, 9(9): 1997-2002. DOI:10.1021/cb500475y |
| [4] |
Mishra B, Wang G. Individual and combined effects of engineered peptides and antibiotics on Pseudomonas aeruginosa biofilms[J]. Pharmaceuticals, 2017, 10(3): E58. |
| [5] |
Wang XQ, Mishra B, Lushnikova T, et al. Amino acid composition determines peptide activity spectrum and hot-spot-based design of merecidin[J]. Advanced Biosystems, 2018, 2(5): 1700259. DOI:10.1002/adbi.201700259 |
| [6] |
Zhan SS, Li J, Yang TT, et al. Antimicrobial peptide merecidin induces apoptosis in human lung adenocarcinoma cell line A549[J]. Basic & Clinical Medicine, 2019, 39(4): 473-477. (in Chinese) 战仕胜, 李军, 杨婷婷, 等. 抗菌肽merecidin诱导人肺腺癌细胞系A549凋亡[J]. 基础医学与临床, 2019, 39(4): 473-477. DOI:10.3969/j.issn.1001-6325.2019.04.005 |
| [7] |
Hui LY. The Inhibition of Staphylococcus aureus and Pseudomonas aeruginosa biofilms by antimicrobial peptide 17BIPHE2[D]. Yinchuan: Master's Thesis of Ningxia Medical University, 2017 (in Chinese) 回丽媛.抗菌肽17BIPHE2抑制金黄色葡萄球菌及铜绿假单胞菌生物被膜作用的研究[D].银川: 宁夏医科大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10752-1017839262.htm |
| [8] |
Hickman JW, Harwood CS. Identification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor[J]. Molecular Microbiology, 2008, 69(2): 376-389. DOI:10.1111/j.1365-2958.2008.06281.x |
| [9] |
Jung H I, Kim Y J, Lee Y J, et al. Mutation of the cyclic di-GMP phosphodiesterase gene in Burkholderia lata SK875 attenuates virulence and enhances biofilm formation[J]. Journal of Microbiology, 2017, 55(10): 800-808. DOI:10.1007/s12275-017-7374-7 |
| [10] |
Christen M, Christen B, Folcher M, et al. Identification and characterization of a cyclic di-GMP-specific phosphodiesterase and its allosteric control by GTP[J]. Journal of Biological Chemistry, 2005, 280(35): 30829-30837. DOI:10.1074/jbc.M504429200 |
| [11] |
Simm R, Morr M, Kader A, et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility[J]. Molecular Microbiology, 2004, 53(4): 1123-1134. DOI:10.1111/j.1365-2958.2004.04206.x |
| [12] |
Hickman JW, Tifrea DF, Harwood CS. A chemosensory system that regulates biofilm formation through modulation of cyclic diguanylate levels[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(40): 14422-14427. DOI:10.1073/pnas.0507170102 |
| [13] |
Ryan RP, Lucey J, O'Donovan K, et al. HD-GYP domain proteins regulate biofilm formation and virulence in Pseudomonas aeruginosa[J]. Environmental Microbiology, 2009, 11(5): 1126-1136. DOI:10.1111/j.1462-2920.2008.01842.x |
| [14] |
Chen WZ, Zhang Y, Zhang YF, et al. CRISPR/Cas9-based genome editing in Pseudomonas aeruginosa and cytidine deaminase-mediated base editing in Pseudomonas species[J]. iScience, 2018, 6: 222-231. DOI:10.1016/j.isci.2018.07.024 |
| [15] |
Dorella FA, Estevam EM, Cardoso PG, et al. An improved protocol for electrotransformation of Corynebacterium pseudotuberculosis[J]. Veterinary Microbiology, 2006, 114(3/4): 298-303. |
| [16] |
Cheng HJ, Zhang CF, Wang CZ, et al. Effect of houttuyfonate sodium on alginate synthesis of Pseudomonas aeruginosa biofilms[J]. Chinese Traditional Patent Medicine, 2013, 35(3): 455-460. (in Chinese) 程惠娟, 张昌峰, 汪长中, 等. 鱼腥草素钠对铜绿假单胞菌生物被膜藻酸盐合成的影响[J]. 中成药, 2013, 35(3): 455-460. DOI:10.3969/j.issn.1001-1528.2013.03.006 |
| [17] |
Cui DQ. Biofilm production of Pseudomonas aeruginosa under different levels of environmental oxygen[D]. Beijing: Doctoral Dissertation of Chinese Academy of Medical Science & Peking Union Medical College, 2009 (in Chinese) 崔冬清.氧浓度变化对铜绿假单胞菌生物被膜生成的影响[D].北京: 中国医学科学院博士学位论文, 2009 http://www.cnki.com.cn/Article/CJFDTotal-ZYKX201003016.htm |
| [18] |
Xiao A, Cheng ZC, Kong L, et al. CasOT: a genome-wide Cas9/gRNA off-target searching tool[J]. Bioinformatics, 2014, 30(8): 1180-1182. DOI:10.1093/bioinformatics/btt764 |
| [19] |
Savoia D. New perspectives in the management of Pseudomonas aeruginosa infections[J]. Future Microbiology, 2014, 9(7): 917-928. DOI:10.2217/fmb.14.42 |
| [20] |
Ovortrup K, Hultqvist LD, Nilsson M, et al. Small molecule anti-biofilm agents developed on the basis of mechanistic understanding of biofilm formation[J]. Frontiers in chemistry, 2019, 7: 742. DOI:10.3389/fchem.2019.00742 |
| [21] |
Franklin MJ, Nivens DE, Weadge JT, et al. Biosynthesis of the Pseudomonas aeruginosa extracellular polysaccharides, alginate, Pel, and Psl[J]. Frontiers in Microbiology, 2011, 2: 167. |
| [22] |
Mulcahy LR, Isabella VM, Lewis K. Pseudomonas aeruginosa biofilms in disease[J]. Microbial Ecology, 2014, 68(1): 1-12. |
| [23] |
Yang FH, Xue DR, Tian F, et al. Identification of c-di-GMP signaling components in Xanthomonas oryzae and their orthologs in Xanthomonads involved in regulation of bacterial virulence expression[J]. Frontiers in microbiology, 2019, 10: 1402. DOI:10.3389/fmicb.2019.01402 |
| [24] |
Wei Q, Zhang ZQ, Luo J, et al. Insulin treatment enhances Pseudomonas aeruginosa biofilm formation by increasing intracellular cyclic di-GMP levels, leading to chronic wound infection and delayed wound healing[J]. American journal of translational research, 2019, 11(6): 3261-3279. |
| [25] |
Karaolis DKR, Means TK, Yang D, et al. Bacterial c-di-GMP is an immunostimulatory molecule[J]. The Journal of Immunology, 2007, 178(4): 2171-2181. DOI:10.4049/jimmunol.178.4.2171 |
| [26] |
Lee VT, Matewish JM, Kessler JL, et al. A cyclic-di-GMP receptor required for bacterial exopolysaccharide production[J]. Molecular Microbiology, 2007, 65(6): 1474-1484. DOI:10.1111/j.1365-2958.2007.05879.x |
| [27] |
Liang ZX. The expanding roles of c-di-GMP in the biosynthesis of exopolysaccharides and secondary metabolites[J]. Natural Product Reports, 2015, 32(5): 663-683. DOI:10.1039/C4NP00086B |
| [28] |
Goltermann L, Tolker-Nielsen T. Importance of the exopolysaccharide matrix in antimicrobial tolerance of Pseudomonas aeruginosa aggregates[J]. Antimicrobial agents and chemotherapy, 2017, 61(4): e02696-16. |
| [29] |
Zhou E, Seminara AB, Kim SK, et al. Thiol-benzo-triazolo-quinazolinone inhibits Alg44 binding to c-di-GMP and reduces alginate production by Pseudomonas aeruginosa[J]. ACS Chemical Biology, 2017, 12(12): 3076-3085. DOI:10.1021/acschembio.7b00826 |
| [30] |
Merighi M, Lee VT, Hyodo M, et al. The second messenger bis-(3′-5′)-cyclic-GMP and its PilZ domain-containing receptor Alg44 are required for alginate biosynthesis in Pseudomonas aeruginosa[J]. Molecular Microbiology, 2007, 65(4): 876-895. DOI:10.1111/j.1365-2958.2007.05817.x |
| [31] |
Irie Y, Borlee BR, O'Connor JR, et al. Self-produced exopolysaccharide is a signal that stimulates biofilm formation in Pseudomonas aeruginosa[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(50): 20632-20636. DOI:10.1073/pnas.1217993109 |
| [32] |
Zheng Y, Tsuji G, Opoku-Temeng C, et al. Inhibition of P. aeruginosa c-di-GMP phosphodiesterase RocR and swarming motility by a benzoisothiazolinone derivative[J]. Chemical science, 2016, 7(9): 6238-6244. DOI:10.1039/C6SC02103D |
| [33] |
Hammer BK, Bassler BL. Distinct sensory pathways in Vibrio cholerae El Tor and classical biotypes modulate cyclic dimeric GMP levels to control biofilm formation[J]. Journal of Bacteriology, 2009, 191(1): 169-177. DOI:10.1128/JB.01307-08 |
| [34] |
Ueda A, Wood TK. Tyrosine phosphatase TpbA of Pseudomonas aeruginosa controls extracellular DNA via cyclic diguanylic acid concentrations[J]. Environmental Microbiology Reports, 2010, 2(3): 449-455. DOI:10.1111/j.1758-2229.2010.00171.x |
| [35] |
Lee MW, Lee EY, Ferguson AL, et al. Machine learning antimicrobial peptide sequences: Some surprising variations on the theme of amphiphilic assembly[J]. Current Opinion in Colloid & Interface Science, 2018, 38: 204-213. |
| [36] |
Wang GS, Narayana JL, Mishra B, et al. Design of antimicrobial peptides: Progress made with human cathelicidin LL-37[A]//Antimicrobial Peptides[M]. Singapore: Springer, 2019: 215-240
|
| [37] |
Su YJ, Wang HJ, Mishra B, et al. Nanofiber dressings topically delivering molecularly engineered human cathelicidin peptides for the treatment of biofilms in chronic wounds[J]. Molecular Pharmaceutics, 2019, 16(5): 2011-2020. DOI:10.1021/acs.molpharmaceut.8b01345 |
| [38] |
Mishra B, Golla RM, Lau K, et al. Anti-staphylococcal biofilm effects of human cathelicidin peptides[J]. ACS Medicinal Chemistry Letters, 2016, 7(1): 117-121. |
| [39] |
Gu TN, Zhao SQ, Pi YS, et al. Highly efficient base editing in Staphylococcus aureus using an engineered CRISPR RNA-guided cytidine deaminase[J]. Chemical Science, 2018, 9(12): 3248-3253. DOI:10.1039/C8SC00637G |
 2020, Vol. 47
2020, Vol. 47




