扩展功能
文章信息
- 官妍, 吴嘉迪, 李杰, 许锦涛, 石晶金
- GUAN Yan, WU Jia-Di, LI Jie, XU Jin-Tao, SHI Jing-Jin
- 十二烷基苯磺酸钠对引发内置物感染表皮葡萄球菌生物被膜的作用
- Effect of sodium dodecyl benzene sulfonate on biofilm of Staphylococcus epidermidis with infection of the implant
- 微生物学通报, 2020, 47(3): 860-867
- Microbiology China, 2020, 47(3): 860-867
- DOI: 10.13344/j.microbiol.china.190652
-
文章历史
- 收稿日期: 2019-08-06
- 接受日期: 2019-10-22
- 网络首发日期: 2019-11-22
2. 江苏海洋大学药学院 江苏 连云港 222005;
3. 上海交通大学医学院附属国际和平妇幼保健院 上海 200030
2. School of Pharmacy, Jiangsu Ocean University, Lianyungang, Jiangsu 222005, China;
3. International Peace Maternal and Child Health Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200030, China
目前,越来越多的临床危重患者,依赖于各种医用材料(内置导管、假体、人工关节及人工心脏瓣膜等)的使用来维系生命与健康。随着植入性医用材料的大比例使用,由细菌生物被膜导致的感染性疾病逐渐显现出来。表皮葡萄球菌(Staphylococus epidermidis)作为人体皮肤与黏膜的重要共生菌之一,通常不致病,但可通过附着于植入体内的人工材料表面产生生物被膜而致病,是导致院内感染的重要病原菌。细菌生物被膜是细菌为了适应周围环境而形成的一种生存方式[1],是细菌附着在有生命或无生命体表面,被自身分泌的胞外黏质物(extracellular polymeric substance,EPS)所包裹、具有高度组织化的多细胞群体结构[2]。被生物被膜所包裹的细菌呈现出对抗生素、抗体、免疫细胞等杀菌物质的高度抗性[3],常规的抗生素治疗并不能彻底杀灭生物被膜内的细菌,这些存活的耐药菌在适宜条件下又可以游离出来,在机体其它部位定殖并形成新的感染灶,导致感染反复迁延,给临床治疗带来了很大的困难。
表面活性剂的清洁、杀菌作用早为人所熟知,其又是一种带电荷、有亲水和疏水双重功效、可以改变两相性质的物质,因而可在医用材料的界面处发生定向吸附,从而大幅提高抑菌效果,阻止细菌的粘附和成膜。由于细菌生物被膜显示负电性,就可能与带电荷的表面活性剂相互作用,影响EPS的结构和功能,从而导致生物被膜的瓦解。表面活性剂这些独特的性质使其成为潜在的抗细菌生物被膜的治疗制剂或者辅助治疗制剂,这对于抗生素不敏感生物被膜菌的防治有很重要的意义。
十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS)是阴离子型表面活性剂,被广泛应用于家庭用洗涤剂和农药用乳化剂、分散剂等领域,其之所以能获得广泛应用主要因为其毒理学上的安全性[4],但SDBS的抑菌效果远不如阳离子型表面活性剂,相关临床应用较少。前期我们已发现SDBS对产膜表皮葡萄球菌的初始粘附有明显的抑制作用[5]。本研究通过SDBS分别对表皮葡萄球菌生物被膜的清除效率、生物被膜内细菌代谢和形成生物被膜的关键物质多糖胞间黏附素(polysaccharide intercellular adhesion,PIA)产生影响的研究,探究其对表皮葡萄球菌生物被膜的清除和破坏作用,拓展SDBS在医疗上更多的用途,为更好地控制由表皮葡萄球菌生物被膜所引起的内置物感染,提供新的思路和可行方法。
1 材料与方法 1.1 材料 1.1.1 菌株ATCC 35984 (生物被膜表型和PIA表型均为阳性)由复旦大学上海医学院瞿涤教授惠赠;ATCC 12228 (生物被膜表型和PIA表型均为阴性)购自中国食品药品检定研究院。
1.1.2 培养基及主要试剂和仪器刚果红培养基(g/L):刚果红0.8,脑心浸液干粉47.0,蔗糖36.0,琼脂粉20.0;胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB),杭州微生物试剂有限公司;MH(B)培养基,北京奥博星生物技术有限责任公司。
SDBS、琼脂粉,国药集团化学试剂有限公司;万古霉素标准品,中国食品药品检定研究院;XTT,生工生物工程(上海)股份有限公司;丙酮,国药集团化学试剂有限公司;甲萘醌,上海笛柏生物科技有限公司;N-(2-羟乙基)哌嗪-N-(2-乙磺酸),无锡市亚泰联合化工有限公司;GH溶液:N-(2-羟乙基)哌嗪-N-(2-乙磺酸) 2.38 g溶于10 mL水中,再加入右旋葡萄糖0.20 g振荡溶解。
激光共聚焦电子显微镜,Olympus公司;酶标仪,LabServ公司;96孔微量培养板,Corning公司。
1.2 方法 1.2.1 SDBS对表皮葡萄球菌MIC的测定利用MH(B)培养基,通过连续稀释法[6]使每个试管2 mL培养基中的SDBS被依次稀释为512、256、128、64、32、16、8、4、2、1 mg/L,再向试管中各加入0.5 Mc (麦氏单位) ATCC 35984菌液200 μL,在37 ℃恒温静置培养24 h;与阴性对照管(仅含有培养基,未加菌液)和阳性对照管(加菌的生长对照)对比,得出SDBS对ATCC 35984的MIC。同样方法测定阳性对照药万古霉素对ATCC 35984的MIC。
1.2.2 SDBS对表皮葡萄球菌生物被膜清除效率的测定参照文献[1, 7]方法,向96孔板中加入100 μL 0.5 Mc的ATCC 35984,于37 ℃培养24 h后,取出96孔板,弃去菌液和培养基,用PBS缓冲液清洗3次,依次加入SDBS (浓度为4、2、1、1/2、1/4 MIC)、阳性对照药万古霉素(浓度为4、2、1、1/2、1/4 MIC) (每个浓度均设8个复孔),于37 ℃分别培养6、12、24 h后取出,用PBS清洗3次,加XTT溶液(用林格液溶解XTT,用丙酮溶解维生素K3,取微量维生素K3溶液加到XTT溶液中,并经孔径为0.22 μm的滤膜过滤),37 ℃避光培养2 h,测各孔OD630值。另设空白对照孔(只加培养基)、阴性对照孔(未加入制剂的生物被膜生长对照)。
1.2.3 SDBS对表皮葡萄球菌生物被膜内细菌代谢(酶活力)的影响参照文献[8],将37 ℃、120 r/min培养过夜的ATCC 35984菌液用TSB稀释至0.5 Mc,取菌液接种入96孔板中,每孔100 μL;37 ℃培养24 h,弃去培养基及悬浮菌,用PBS清洗3次。用TSB对倍稀释SDBS、万古霉素,分别加入SDBS(浓度为64、32、16、8、4、2、1、1/2 MIC),阳性对照药万古霉素(浓度为64、32、16、8、4、2、1、1/2 MIC) (每个浓度设8个复孔) 100 μL,37 ℃继续培养48 h。加入XTT溶液(林格液稀释为0.5 g/L,0.22 μm孔径的滤膜过滤除菌,临用前加VK3) 100 μL,37 ℃避光培养2 h,测各孔OD630值。另设空白对照孔(只加培养基)、阴性对照孔(未加入制剂的生物被膜生长对照)。
1.2.4 激光共聚焦显微镜观察SDBS对表皮葡萄球菌生物被膜的清除效率吸取500 μL 0.5 Mc的ATCC 35984加入到激光共聚焦显微镜专用培养皿凹槽中,于37 ℃培养24 h。弃去悬浮菌和培养基,用PBS清洗一次,吸取SDBS (浓度为4、2、1 MIC)、阳性对照药万古霉素(浓度为4、2、1 MIC)各500 μL分别加入到各培养皿凹槽中,37 ℃分别培养6、12、24 h。设置阴性对照。
各组样本培养到规定时间后,弃去上层培养基,用无菌PBS洗去未粘附的浮游菌。吸取FUN1染液(4 μL FUN1染料加入10 mL GH溶液中)加入培养皿中,每个培养皿各加入1 mL。37 ℃避光染色30 min后,以激光共聚焦显微镜进行3D扫描(激发波长532 nm,发射波长640 nm)。先用100倍低倍镜观察生物被膜完整程度,然后设定Z轴,选用200倍视野连续扫描8层并拍照;每组平行测3次。
1.2.5 SDBS对PIA形成的影响参照文献[9]用TSB分别稀释SDBS(浓度为1、1/2 MIC)、阳性对照药万古霉素(浓度为1、1/2 MIC) 1 mL于试管中,均加入经37 ℃、120 r/min摇床增菌过夜的ATCC 35984 (0.5 Mc) 50 μL (5%的接种量)。取37 ℃分别培养4、8、12、16、20、24 h等时间段的菌液,分别分区划线在刚果红培养基[10]上,置37 ℃培养24 h后,室温放置24 h,观察菌落颜色。另设阳性对照和阴性对照,未经处理ATCC 35984和ATCC 12228菌液分区划线在刚果红培养基上,37 ℃培养24 h后,室温放置24 h,观察菌落颜色。
1.2.6 数据处理采用SPSS Statistics软件进行单因素方差分析,两样本间进行t检验,数据以平均值±标准差(X±SD)表示,P < 0.05代表差异有统计学意义。
2 结果与分析 2.1 SDBS对表皮葡萄球菌MIC的测定由于SDBS、万古霉素的终浓度呈递减趋势,其对ATCC 35984的抑制作用也呈递减状态,与阴性对照管和阳性对照管相比,可得出SDBS对ATCC 35984的MIC为64 mg/L;万古霉素对ATCC 35984的MIC为8 mg/L。
2.2 SDBS对表皮葡萄球菌生物被膜清除的效率与未加表面活性剂的阴性对照组相比,SDBS的终浓度依次为256、128、64、32、16 mg/L (4、2、1、1/2、1/4 MIC)时,在6、12、24 h等时间段对ATCC 35984已形成的生物被膜均有清除作用,12、24 h等时间段对ATCC 35984的生物被膜清除效率极为显著(P < 0.001),清除率最高可达86.77%。具体结果见图 1、表 1。
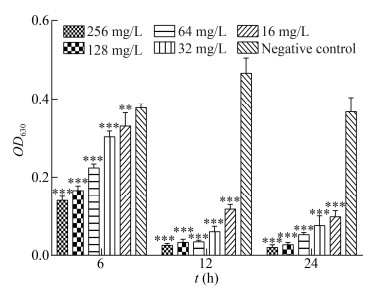
|
| 图 1 不同浓度的SDBS对表皮葡萄球菌生物被膜的清除作用(X±SD,n=8) Figure 1 Scavenging effects of different concentrations of SDBS on the biofilm of Staphylococcus epidermidis (X±SD, n=8) 注:与阴性对照组相比,***代表P < 0.001,**代表P < 0.01. Note: Compared with the negative control group, *** represents P < 0.001, ** represents P < 0.01. |
|
|
| Time (h) | Concentrations of SDBS (mg/L) | ||||
| 256 | 128 | 64 | 32 | 16 | |
| 6 | 55.92 | 49.79 | 36.18 | 17.59 | 11.11 |
| 12 | 86.77 | 85.24 | 84.94 | 80.00 | 68.12 |
| 24 | 85.49 | 83.73 | 77.51 | 71.78 | 66.27 |
| 注:清除率=(对照组OD630−实验组OD630)/对照组OD630×100%. Note: Clearance rate=(control group OD630−experimental group OD630)/control group OD630×100%. | |||||
与阴性对照组相比,万古霉素的终浓度分别为32、16 mg/L (4、2 MIC)在6 h对ATCC 35984已形成的生物被膜有较明显的清除作用(P < 0.001);其中浓度为32 mg/L (4 MIC)万古霉素在6、12、24 h对ATCC 35984的生物被膜清除作用均很显著(P < 0.001),但清除率最高只达到34.87%,8 mg/L (MIC)以下浓度的万古霉素在作用12、24 h时甚至促进了生物被膜菌的生长,具体机制尚不清楚。结果见图 2、表 2。
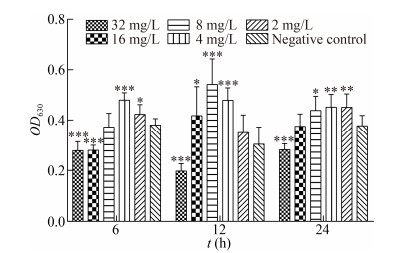
|
| 图 2 不同浓度万古霉素对表皮葡萄球菌生物被膜的清除作用(X±SD,n=8) Figure 2 Scavenging effects of different concentrations of vancomycin on the biofilm of Staphylococcus epidermidis (X±SD, n=8) 注:与阴性对照组相比,***代表P < 0.001,**代表P < 0.01,*代表P < 0.05. Note: Compared with the negative control group, *** represents P < 0.001, ** represents P < 0.01, and * represents P < 0.05. |
|
|
与阴性对照孔相比,浓度为4 096、2 048、1 024、512、256、128、64 mg/L (64、32、16、8、4、2、1 MIC)的SDBS,对ATCC 35984生物被膜内细菌的代谢有极显著影响(P < 0.001);浓度为32 mg/L (1/2 MIC)时,对ATCC 35984生物膜内细菌的代谢也有显著影响(P < 0.05),说明SDBS在亚抑菌浓度下即可影响生物被膜内细菌细胞的酶活力,显著抑制细胞代谢。结果见图 3。
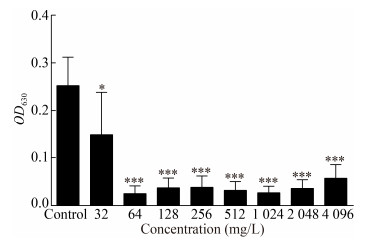
|
| 图 3 不同浓度SDBS对ATCC 35984生物被膜内细菌代谢的影响(X±SD,n=8) Figure 3 Effects of different concentrations of SDBS on bacterial metabolism in ATCC 35984 biofilm (X±SD, n=8) 注:与阴性对照组相比,***代表P < 0.001,*代表P < 0.05. Note: Compared with the negative control group, *** represents P < 0.001, * represents P < 0.05. |
|
|
与阴性对照孔相比,浓度为512、256、128、64、32、16 mg/L (64、32、16、8、4、2 MIC)的万古霉素,对ATCC 35984生物被膜内细菌的代谢有极显著影响(P < 0.001);浓度为8、4 mg/L (1、1/2 MIC)时,对ATCC 35984生物膜内细菌的代谢无明显影响(P > 0.05),说明万古霉素在2 MIC以上浓度时才可显著抑制生物被膜内细菌的代谢,结果见图 4。
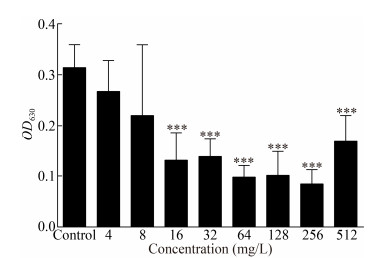
|
| 图 4 不同浓度万古霉素对ATCC 35984生物被膜内细菌代谢的影响(X±SD,n=8) Figure 4 Effects of different concentrations of vancomycin on bacterial metabolism in ATCC 35984 biofilm (X±SD, n=8) 注:与阴性对照组相比,***代表P < 0.001. Note: Compared with the negative control group, *** represents P < 0.001. |
|
|
| Time (h) | Concentrations of vancomycin (mg/L) | ||||
| 32 | 16 | 8 | 4 | 2 | |
| 6 | 26.81 | 26.46 | 2.28 | 0.00 | 0.00 |
| 12 | 34.87 | 0.00 | 0.00 | 0.00 | 0.00 |
| 24 | 25.39 | 0.00 | 0.00 | 0.00 | 0.00 |
| 注:清除率=(对照组OD630−实验组OD630)/对照组OD630×100%. Note: Clearance rate=(control group OD630−experimental group OD630)/control group OD630×100%. | |||||
以激光共聚焦显微镜选用200倍视野连续扫描8层并拍照,每组平行测3次,所得结果见图 5、6。如图 5、6所示,当细菌生物被膜完整,被膜内细菌正常存活时,图片上荧光强烈;而当生物被膜被破坏,被膜内细菌死亡或受损时,则图片所显示的荧光变弱或消失。通过观察发现,SDBS对ATCC 35984形成的生物被膜的清除效果明显强于万古霉素。
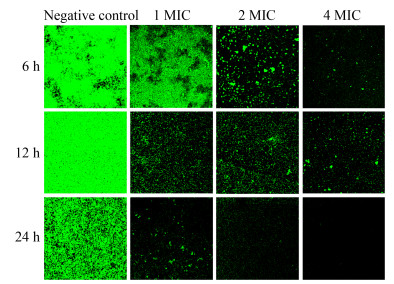
|
| 图 5 激光共聚焦电子显微镜观察SDBS对ATCC 35984生物被膜的清除作用(200×) Figure 5 Scavenging effects of SDBS on ATCC 35984 biofilm observed by laser confocal electron microscope (200×) |
|
|
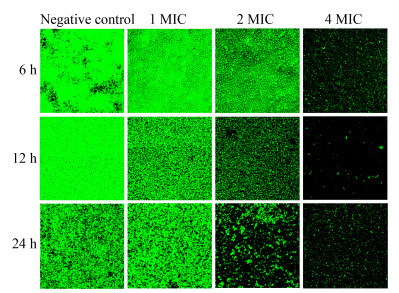
|
| 图 6 激光共聚焦电子显微镜观察万古霉素对ATCC 35984生物被膜的清除作用(200×) Figure 6 Scavenging effects of vancomycin on ATCC 35984 biofilm observed by laser confocal electron microscopy (200×) |
|
|
与阳性对照ATCC 35984产膜菌株和阴性对照ATCC 12228不产膜菌株相比(图 7),SDBS浓度为64、32 mg/L (1、1/2 MIC),分别作用4、8、12、16、20、24 h时,ATCC 35984在刚果红培养基上的菌落颜色均为黑色,说明在1 MIC以下浓度的SDBS并不能显著影响PIA的形成,结果见图 8。万古霉素浓度为8、4 mg/L (1、1/2 MIC),作用4、8、12、16 h时ATCC 35984在刚果红培养基上的菌落颜色均为黑色,20、24 h时菌落颜色为红色,说明万古霉素在作用较长时间后可影响PIA的形成,结果见图 9。
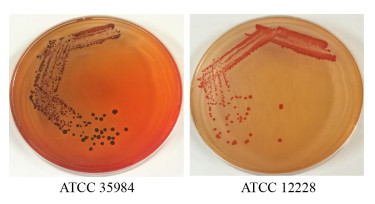
|
| 图 7 PIA阳性菌株与PIA阴性菌株在刚果红培养基上菌落颜色对照 Figure 7 Colony color comparison of PIA positive strains and PIA negative strains on Congo red medium |
|
|

|
| 图 8 SDBS作用后ATCC 35984在刚果红培养基上菌落颜色 Figure 8 Colony color of ATCC 35984 on Congo red medium after SDBS treatment |
|
|
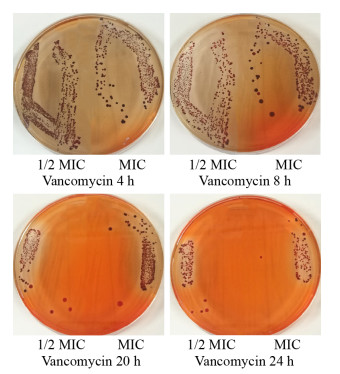
|
| 图 9 万古霉素作用后ATCC 35984在刚果红培养基上菌落颜色 Figure 9 Colony color of ATCC 35984 on Congo red medium after vancomycin |
|
|
目前已知细菌通过粘附(adherence)、聚集(accumulation)、成熟(maturation)、脱落(detachment) 4个阶段形成生物被膜[11],初始粘附与相互聚集是生物被膜形成最重要的两个阶段,其中PIA是细菌生物被膜形成聚集阶段所必需的物质[12]。
临床治疗感染性疾病首选用药为抗生素,抗生素虽有起效迅速、效果明显的优势,但其易诱导产生耐药性和毒性大的缺点也不容忽视。因生物被膜内的细菌比游离个体细菌的耐药性增加1 000−1 500倍,单用任何一种抗生素均不能完全清除膜内细菌,因此传统抗生素治疗内置物感染常常失败,只有联合使用抗生物被膜和抗菌的药物才能有效杀灭细菌生物被膜内的细菌[13]。以往也有利用中药及有效成分作用于细菌生物被膜的报道和研究,但中药作用缓慢、抗菌力较弱,对细菌生物被膜菌的作用效果不很理想。
阴离子表面活性剂具有生产工艺成熟、原料易得、适用范围广等诸多优点,特别是毒理学上的安全特性使其广泛应用于日用化学品、农业、工业清洗、纺织印染等诸多领域。物竞化学品数据库有关SDBS安全说明,在健康危害一栏显示:本品基本无毒,其浓溶液对皮肤有一定刺激作用。目前未见职业中毒报道[4]。十二烷基苯磺酸及其钠盐是目前生产工艺最成熟、年产量最大的阴离子表面活性剂,具有很强的脱脂能力,且泡沫高、成本低、渗透力好。因此低毒价廉且具有一定抑菌能力的SDBS引起了我们的关注。
通过XTT减低法定量检测发现,浓度为256、128、64、32 mg/L (4、2、1、1/2 MIC)的SDBS,在6、12、24 h对ATCC 35984清除作用极显著(P < 0.001),并且作用时间越长效果越佳,作用12、24 h时,清除生物被膜效率均达66%以上,激光共聚焦电子显微镜定性检测也呈现了相同的趋势,其清除效果强于万古霉素。但我们也发现XTT减低法与激光共聚焦电子显微镜测得的结果并不完全一致,可能与激光共聚焦显微镜观察点较少、生物被膜不够均一有关。
浓度为64 mg/L (1 MIC)以上的SDBS对ATCC 35984生物被膜内细菌的代谢有极显著影响(P < 0.001);浓度为32 mg/L (1/2 MIC)时,对ATCC 35984生物被膜内细菌的代谢也存在显著影响(P < 0.05),表现出SDBS对生物被膜很好的渗透性和对细菌酶活力的抑制作用。与阳性对照药万古霉素相比,SDBS抗生物被膜内细菌代谢的总体效果更加优良。
在刚果红培养基实验中,浓度为64、32 mg/L (1、1/2 MIC)时,SDBS对ATCC 35984 PIA的合成并无明显抑制作用,提示SDBS对表皮葡萄球菌生物被膜形成的聚集阶段关键物质PIA的形成没有显著的影响,推测SDBS可能是通过其他途径去影响或破坏表皮葡萄球菌的生物被膜。Izano等[14]研究了同为阴离子型表面活性剂的十二烷基硫酸钠(sodim dodecyl sulfate,SDS)对伴放线杆菌生物被膜的作用,认为SDS能影响蛋白质的折叠结构,因而可引起生物被膜基质中蛋白质变性,导致细菌生物被膜分离,这为我们进一步探究SDBS对表皮葡萄球菌生物被膜的作用提供了参考。
通过本研究,结合前期对SDBS抗表皮葡萄球菌初始粘附影响的研究[5],我们发现SDBS在抗细菌初始粘附、抗膜内细菌代谢、清除生物被膜等方面效果突出。本研究证实了SDBS对引起医院内感染的表皮葡萄球菌生物被膜抑制及清除的作用,希望能为临床防治由表皮葡萄球菌生物被膜引起的临床内置物感染提供理论及实践的参考。
| [1] |
Krasteva PV, Fong JCN, Shikuma NJ, et al. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP[J]. Science, 2010, 327(5967): 866-868. DOI:10.1126/science.1181185 |
| [2] |
Nobile CJ, Mitchell AP. Microbial biofilms: e pluribus unum[J]. Current Biology, 2007, 17(10): R349-R353. DOI:10.1016/j.cub.2007.02.035 |
| [3] |
Bogdan M, Drenjancevic D, Harsanji drenjancevic I, et al. In vitro effect of subminimal inhibitory concentrations of antibiotics on the biofilm formation ability of Acinetobacter baumannii clinical isolates[J]. Journal of Chemotherapy, 2018, 30(1): 16-24. DOI:10.1080/1120009X.2017.1378835 |
| [4] |
WUJING chemical database[DB/OL]. http://www.basechem.org/.2019-06-22) (in Chinese) 物竞化学品数据库[DB/OL]. http://www.basechem.org/. 2019-06-22 |
| [5] |
Guan Y, Dong SZ, Shi JJ, et al. A preliminary study on the influence of SDBS on Staphylococcus epidermidis adhesion in the process of producing biofilm[J]. Chinese Journal of Microecology, 2016, 28(2): 133-137. (in Chinese) 官妍, 董仕政, 石晶金, 等. 十二烷基苯磺酸钠对产膜表皮葡萄球菌黏附作用影响初探[J]. 中国微生态学杂志, 2016, 28(2): 133-137. |
| [6] |
Shen GX, Xu W. Microbiology and Immunology[M]. 8th ed. Beijing: People's Medical Publishing House, 2016: 308-309. (in Chinese) 沈关心, 徐威. 微生物学与免疫学[M]. 8版. 北京: 人民卫生出版社, 2016: 308-309. |
| [7] |
Tong JP, Wang ZS, Wang Y, et al. Observation of Staphylococcus biofilm with silver staining method[J]. Journal of Dalian Medical University, 2009, 31(5): 613-615. (in Chinese) 佟金平, 王镇山, 王燕, 等. 银染法观察葡萄球菌生物被膜[J]. 大连医科大学学报, 2009, 31(5): 613-615. |
| [8] |
Guan Y, Li C, Shi JJ, et al. Effect of combination of sub-MIC sodium houttuyfonate and erythromycin on biofilm of Staphylococcus epidermidis[J]. China Journal of Chinese Materia Medica, 2013, 38(5): 731-735. (in Chinese) 官妍, 李春, 石晶金, 等. 亚抑菌浓度鱼腥草素钠及与红霉素联合对表皮葡萄球菌生物被膜的作用[J]. 中国中药杂志, 2013, 38(5): 731-735. |
| [9] |
Wu XY, Chen JS, Ni KX. Influence of biofilm formation by Staphylococcus epidermidis on laboratory identification and drug resistance[J]. Chinese Journal of Health Laboratory Technology, 2008, 18(6): 1112-1114. (in Chinese) 吴晓艳, 陈劲松, 倪侃翔. 表皮葡萄球菌生物膜形成对实验室检测及耐药性的影响[J]. 中国卫生检验杂志, 2008, 18(6): 1112-1114. DOI:10.3969/j.issn.1004-8685.2008.06.060 |
| [10] |
Guan Y, Xu YH, Wang CZ, et al. Detection and drug resistance of biofilm-producing strains of Staphylococcus epidermidis clinically isolated: a comparative analysis[J]. Chinese Journal of Microecology, 2010, 22(7): 626-627, 630. (in Chinese) 官妍, 徐元宏, 汪长中, 等. 临床分离的表皮葡萄球菌产膜株检出方法及耐药性比较[J]. 中国微生态学杂志, 2010, 22(7): 626-627, 630. |
| [11] |
Li XH, Kim SK, Lee JH. Anti-biofilm effects of anthranilate on a broad range of bacteria[J]. Scientific Reports, 2017, 7(1): 8604. DOI:10.1038/s41598-017-06540-1 |
| [12] |
Jeng WY, Ko TP, Liu CI, et al. Crystal structure of IcaR, a repressor of the TetR family implicated in biofilm formation in Staphylococcus epidermidis[J]. Nucleic Acids Research, 2008, 36(5): 1567-1577. DOI:10.1093/nar/gkm1176 |
| [13] |
Wallwork B, Coman W, Mackay-Sim A, et al. A double-blind, randomized, placebo-controlled trial of macrolide in the treatment of chronic rhinosinusitis[J]. Laryngoscope, 2006, 116(2): 189-193. DOI:10.1097/01.mlg.0000191560.53555.08 |
| [14] |
Izano EA, Wang H, Ragunath C, et al. Detachment and killing of Aggregatibacter actinomycetemcomitans biofilms by dispersin B and SDS[J]. Journal of Dental Research, 2007, 86(7): 618-622. DOI:10.1177/154405910708600707 |
 2020, Vol. 47
2020, Vol. 47




