扩展功能
文章信息
- 赵欣宇, 国果, 苏佩佩, 杨隆兵, 朱丽娟, 田竺青, 付萍, 彭建
- ZHAO Xin-Yu, GUO Guo, SU Pei-Pei, YANG Long-Bing, ZHU Li-Juan, TIAN Zhu-Qing, FU Ping, PENG Jian
- 家蝇抗菌肽AMP-17对白色念珠菌菌丝的抑制作用
- Inhibitory effect of housefly antimicrobial peptide AMP-17 on hyphae of Candida albicans
- 微生物学通报, 2020, 47(3): 843-851
- Microbiology China, 2020, 47(3): 843-851
- DOI: 10.13344/j.microbiol.china.190597
-
文章历史
- 收稿日期: 2019-07-22
- 接受日期: 2019-11-22
- 网络首发日期: 2019-12-19
2. 贵州医科大学环境污染与疾病监控教育部重点实验室 贵州 贵阳 550025;
3. 贵州医科大学食品科学学院 贵州 贵阳 550025
2. Key Laboratory of Environmental Pollution Monitoring and Disease Control (Guizhou Medical University), Ministry of Education, Guiyang, Guizhou 550025, China;
3. School of Food Science, Guizhou Medical University, Guiyang, Guizhou 550025, China
白色念珠菌(Candida albicans)是黏附在人体口腔、上呼吸道、阴道等处的一种常见的机会性致病真菌,随着临床抗生素、免疫抑制剂等的大量使用,白色念珠菌已逐渐成为院内感染的重要病原体之一。在美国,念珠菌属是引起院内感染的第四大致病菌,死亡率高达50%[1]。白色念珠菌的生长具有二相性,既可以酵母相的方式生长也可以菌丝相的方式生长,其中菌丝相具有较强的黏附和侵袭能力,菌丝可以通过释放水解酶来破坏宿主细胞从而达到致病目的[2],进而引起皮肤、黏膜等处的浅表性感染甚至危及生命的系统性感染[3-4]。
虽然抗真菌治疗手段较多,但临床上预防和治疗白色念珠菌病的药物非常有限[5]。当前临床上使用的抗真菌药物多为单靶点抗代谢的化学合成药物,极易产生耐药[6]。此外,抗真菌药物的不良反应限制了药物的应用[7]。因此寻找新型药源、研发安全有效的抗真菌感染药物已刻不容缓。抗菌肽(antimicrobial peptide,AMPs)是一类由生物体免疫防御系统产生的天然抗菌分子,是生物体抵御病原体感染的一类天然多肽,具有抗菌谱广、毒性低,不易产生耐药等优点,是极具发展前景的新一代“抗生素”。有研究发现抗真菌肽MAF-1A作用于白色念珠菌后可明显抑制芽生孢子的生成和芽管的形成[8]。乳球菌产生的抗菌肽Nisin Z不仅能抑制白色念珠菌的生长,还能阻断白色念珠菌由酵母态向菌丝态的转化[9]。目前抗菌肽已经在试验和临床诊治中取得良好效果,充分说明抗菌肽已经是研究和开发新型抗真菌药物的一个有效途径[10-11]。
自2000年以来,课题组以病媒昆虫家蝇为研究对象,采用生物化学及分子生物学方法从蝇体内分离纯化或克隆表达了多个抗菌肽分子[12-13]。AMP-17是课题组从微生物诱导的家蝇转录组数据库筛选到一条特异性高表达基因,其功能在GenBank上尚无注释,是一未知功能基因。我们利用基因工程技术,采用原核表达系统克隆表达获得重组AMP-17蛋白,体外研究显示重组蛋白具有显著的抗真菌效果,特别是对白色念珠菌具有较强的抗菌活性[14],理化特性研究显示,AMP-17重组蛋白具有较强的热稳定性,耐高温及反复冻融,高浓度下对人红细胞基本没有溶血性(另文报道),提示了其潜在的药物价值。然而AMP-17对临床株白色念珠菌的抗菌效果及能否干扰念珠菌菌丝的形成尚不清楚。因此本研究从AMP-17作用后白色念珠菌的形态转化方面着手,探讨AMP-17对白色念珠菌菌丝的作用,为进一步研究抗菌肽对生物被膜的影响提供前期的数据支持,也为抗菌肽的应用提供一定的实验依据。
1 材料与方法 1.1 材料 1.1.1 菌种白色念珠菌标准株ATCC10231 (Candida albicans ATCC10231),由贵州医科大学微生物学教研室惠赠,支气管冲洗液分离株16102及16138、支气管肺泡灌洗液分离株16105、粪便分离株16111及16214、口腔分离株16228、胸水分离株16230、痰液分离株16229、16255和16162以及近平滑念珠菌ATCC22019 (C. parapsilosis ATCC22019)由北京大学人民医院皮肤科真菌保藏室惠赠。
1.1.2 培养基沙氏葡萄糖琼脂培养基(SDA)、沙氏葡萄糖肉汤培养基(SDB)、LB液体培养基,上海博微生物科技有限公司;RPMI 1640培养基,GIBCO公司。
1.1.3 主要试剂和仪器溴化乙锭(EB)、十二烷基硫酸钠(SDS)、考马斯亮蓝R-250、异丙基硫代半乳糖苷(IPTG),贵州爱瑞特生物科技有限公司;His* Bind Purification Kit,Novagen公司;血细胞计数板、尿素、卡那霉素,贵州索莱宝贸易有限公司;氟康唑(fluconazole,FLC),Sigma公司;胎牛血清,杭州四季青生物工程公司;PBS缓冲液,HyClone公司;实验用水均为Milli-Q超纯水。
超净工作台,苏州净化设备有限公司;冷冻高速离心机,Eppendorf公司;超声波破碎仪,新芝公司;稳压稳流电泳仪,GE公司;YS100普通光学显微镜、倒置荧光显微镜,Nikon公司;超微量微孔板分光光度计,Biotek公司。Milli-Q超纯水仪,MilliPore Pharmacia公司。
1.2 方法 1.2.1 菌液的制备实验所用白色念珠菌菌种于30%的甘油中,在超低温冰箱中保存,用接种环取适量菌液,在沙氏固体平板上三区划线,37 ℃恒温培养24 h后,选择直径大于1 mm的菌落至SDB培养基中37 ℃、220 r/min振荡培养18 h,连续传代2次,使菌株处于最佳生长状态,血细胞计数板计数,SDB或RPMI 1640培养液(含胎牛血清)稀释至1.0×106 CFU/mL备用。
1.2.2 家蝇抗菌肽AMP-17的制备参照课题组前期制备方法[14-16]纯化重组AMP-17蛋白。具体方法如下:挑取前期已经制备好的pET-28a(+)-(AMP-17)-BL21进行PCR鉴定,取鉴定为阳性的菌液进行诱导表达,然后使用超声波破碎仪破碎已完成诱导表达的菌液,收集菌体沉淀,尿素溶解破包涵体,根据His* Bind Purification Kit蛋白纯化说明书纯化重组AMP-17蛋白。
1.2.3 AMP-17对白色念珠菌最小抑菌浓度(MIC)的测定参照美国临床实验室标准化委员会(CLSI)所采用微量液体稀释法的评判标准为本实验评判标准。将100 μL不同浓度的AMP-17与100 μL SDB稀释的菌液(2×103 CFU/mL)于96孔板中充分混匀,使药物终浓度分别为80、40、20、10、5、2.5 μg/mL,另设不含药物的阴性对照孔,96孔板置于湿盒内37 ℃培养48 h后,通过肉眼未能观察到细菌生长的药物最低浓度即为所测菌的最低抑菌浓度(minimal inhibitory concentration,MIC)。同时根据NCCLS M27-A方案,采用C. parapsilosis ATCC22019为质控菌株,以FLC检测其MIC,当MIC处于0.5−4.0 μg/mL时,认定实验数据可靠,实验重复3次。
1.2.4 AMP-17对白色念珠菌生长曲线的影响根据11株白色念珠菌对AMP-17的敏感程度(MIC测定结果)选取其中3株绘制AMP-17作用后的生长曲线。将100 μL SDB稀释的菌液加入96孔板,然后将100 μL终浓度为20 μg/mL的AMP-17加入其中,放入恒温培养箱37 ℃培养,每隔4 h用分光光度计测定其吸光度OD562值。以取样时间为X轴、OD562值为Y轴绘制白色念珠菌的生长曲线。以1 μg/mL的FLC为药物对照组,超纯水为阴性对照组,设置3个平行重复。
1.2.5 AMP-17对白色念珠菌芽生孢子生成的影响将不同浓度的AMP-17与SDB稀释的标准株ATCC10231菌液充分混匀,使药物终浓度分别为10、20、40 μg/mL。以下实验均选取白色念珠菌标准株ATCC10231进行。37 ℃、180 r/min恒温振荡培养,分别于培养1、2、4、6 h后,用移液器取适量菌液于玻片上,显微镜下观察并随机计数100个细胞中产生芽生孢子的数量,芽生孢子萌发率=(芽生孢子数量/白色念珠菌数)×100%。以FLC为药物对照组(终浓度为1 μg/mL及CLSI推荐微量液体稀释法M27-2A中MIC最大使用浓度100 μg/mL)、超纯水为阴性对照组,每组重复实验3次,下同。
1.2.6 AMP-17对白色念珠菌芽管形成的影响取500 μL RPMI 1640培养液(含10%胎牛血清)稀释的菌液与500 μL终浓度分别为10、20、40 μg/mL的AMP-17混匀,37 ℃、180 r/min恒温振荡培养,待反应0、1、2、4、6 h取出,用移液器取适量菌液于玻片上显微镜下观察并随机计数100个细胞中产生芽管的数量,芽管形成率=(芽管数量/白色念珠菌数)×100%。
1.2.7 酵母相到菌丝相转化情况将不同浓度的AMP-17与RPMI 1640培养液(含15%胎牛血清)稀释的菌液充分混匀,使药物终浓度分别为10、20、40 μg/mL。37 ℃恒温培养3、6、9、12、24 h后取出,在倒置荧光显微镜下观察菌丝形成情况并拍照。
1.2.8 菌丝相向酵母相的转化情况将RPMI 1640培养液(含15%胎牛血清)稀释的菌液于37 ℃恒温培养箱中静置培养6 h,然后加入不同浓度的AMP-17,使药物终浓度分别为10、20、40 μg/mL。继续放入恒温培养箱中培养,以加入AMP-17时为零点,每隔3 h取出,在倒置荧光显微镜下观察并拍照。
1.2.9 数据处理及统计学分析所有数据应用SPSS17.0统计软件分析处理,计量资料以均数±标准差(X±SD)表示,组间差异比较采用单因素方差分析检验(P < 0.05)。
2 结果与分析 2.1 AMP-17对白色念珠菌最小抑菌浓度(MIC)的测定AMP-17对支气管肺泡灌洗液分离株16105的MIC为10 μg/mL,对粪便分离株16214的MIC为40 μg/mL,对支气管冲洗液分离株16102和16138、粪便分离株16111、口腔分离株16228、胸水分离株16230、痰液分离株16229、16255和16162的MIC均为20 μg/mL。FLC对质控菌C. parapsilosis ATCC22019的MIC为1 μg/mL,处于正常范围内。
2.2 AMP-17对白色念珠菌生长曲线的影响根据2.1中11株白色念珠菌对AMP-17的敏感程度,选取MIC不同的3株绘制生长曲线,所加入的AMP-17浓度均为20 μg/mL。结果显示对照组与实验组菌体的生长周期大致相同,但与未加入AMP-17的对照组相比,白色念珠菌的生长整体延后,在相同的时间点上,实验组菌液的OD562值均低于对照组(图 1)。3株白色念珠菌所抑制的菌体数量为:16015 > ATCC10231 > 16214。说明AMP-17可以抑制白色念珠菌的生长。
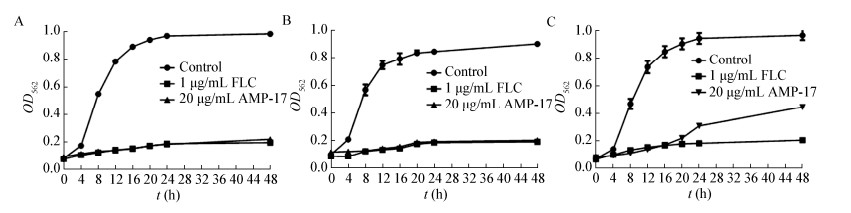
|
| 图 1 白色念珠菌生长曲线 Figure 1 Growth curve of Candida albicans 注:A:白色念珠菌16105;B:白色念珠菌ATCC10231;C:白色念珠菌16214. Note: A: Candida albicans 16105; B: Candida albicans ATCC10231; C: Candida albicans 16214. |
|
|
在SDB培养基中培养1 h后,对照组有25%的白色念珠菌细胞长出芽生孢子,随着时间的延长生成量明显增加,培养6 h后芽生孢子萌发率达61%。而经不同浓度的AMP-17作用后,各时间点的芽生孢子生成率均显著低于对照组(P < 0.05),尤其是40 μg/mL的AMP-17组,6 h后芽生孢子生成率仅15%。让人惊奇的是,实验过程中发现1 μg/mL的FLC抑制效果并不显著,因此将FLC浓度加大到100 μg/mL,但在此高浓度下,FLC抑制芽生孢子的生成率仍低于10 μg/mL的AMP-17。结果提示AMP-17对芽生孢子生成的抑制作用明显强于FLC (表 1)。
| 分组 Groups |
芽生孢子生成率 The rate of blastospore formation (%) |
||||
| 0 h | 1 h | 2 h | 4 h | 6 h | |
| Control | 1.67±0.58 | 25.67±1.53 | 41.67±2.08 | 51.67±1.53 | 61.0±1.0 |
| 10 μg/mL AMP-17 | 1.67±0.58 | 16.0±1.0*▲ | 21.67±2.08*▲ | 25.67±2.08*▲ | 30.67±1.15*▲ |
| 20 μg/mL AMP-17 | 2.00±1.00 | 14.33±1.53*▲ | 16.67±2.08*▲ | 20.00±2.65*▲ | 28.33±1.53*▲ |
| 40 μg/mL AMP-17 | 1.33±0.58 | 10.33±1.53*▲ | 12.33±2.08*▲ | 14.33±2.08*▲ | 15.00±2.00*▲ |
| 1 μg/mL FLC | 1.67±0.58 | 23.33±0.58 | 39.00±2.65 | 48.67±1.53 | 53.00±2.65* |
| 100 μg/mL FLC | 1.33±0.58 | 20.67±2.08 | 24.0±2.0* | 31.00±1.00* | 37.67±1.53* |
| 注:*与阴性对照组比较P < 0.05;▲与100 μg/mL FCL对照组比较P < 0.05. Note: *Compared with negative control P < 0.05; ▲Compared with 100 μg/mL FLC control P < 0.05. | |||||
白色念珠菌细胞在含有10%胎牛血清的RPMI 1640培养液中培养1 h后,对照组即可产生芽管,随着培养时间延长芽管数量增加,6 h后芽管形成率可达97% (图 2A),各实验组芽管形成率显著低于对照组,尤其是40 μg/mL的AMP-17组,芽管形成缓慢,培养6 h后芽管形成率仅为6%,且形成的芽管长度较短,仅为菌体的1−2倍(图 2B)。结果显示实验组芽管的形成显著低于100 μg/mL的阳性药物FLC (P < 0.05) (表 2)。
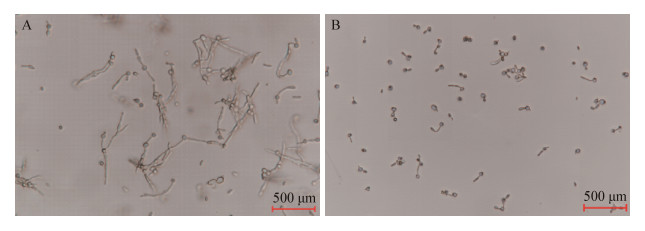
|
| 图 2 AMP-17对白色念珠菌芽管形成的影响 Figure 2 Effects of AMP-17 on Candida albicans germ tube formation 注:A:正常组6 h (400×);B:40 μg/mL AMP-17作用6 h (400×). Note: A: Control 6 h (400×); B: 40 μg/mL AMP-17 group for 6 h (400×). |
|
|
| 分组 Groups |
芽管形成率 The rate of germ tube formation (%) |
||||
| 0 h | 1 h | 2 h | 4 h | 6 h | |
| Control | 0 | 23.67±1.53 | 69.67±1.53 | 94.33±0.58 | 96.67±0.58 |
| 10 μg/mL AMP-17 | 0 | 17.33±0.85* | 21.0±1.0*▲ | 34.33±0.58*▲ | 46.67±1.53*▲ |
| 20 μg/mL AMP-17 | 0 | 3.67±0.58*▲ | 15.33±1.58*▲ | 19.33±0.58*▲ | 27.33±0.58*▲ |
| 40 μg/mL AMP-17 | 0 | 0.67±0.58*▲ | 1.33±0.58*▲ | 3.67±0.58*▲ | 6.00±1.00*▲ |
| 1 μg/mL FLC | 0 | 23.00±1.00 | 66.33±1.53 | 92.00±1.00* | 94.67±1.53 |
| 100 μg/mL FLC | 0 | 16.67±0.58* | 40.33±0.58* | 70.33±0.58* | 76.33±1.53* |
| 注:*:与阴性对照组比较P < 0.05,▲:与100 μg/mL FCL对照组比较P < 0.05. Note: *: Compared with negative control P < 0.05, ▲: Compared with100 μg/mL FLC control P < 0.05. | |||||
白色念珠菌细胞在含有15%胎牛血清的RPMI 1640培养液中培养3 h后,对照组即有部分细胞开始形成芽管结构,24 h即可形成由菌丝组成的比较致密的生物被膜。低浓度的AMP-17即能显著抑制菌丝的形成,培养24 h后各AMP-17处理组的白色念珠菌细胞均不能形成菌丝,仅能见部分芽管结构。说明AMP-17能够有效地抑制白色念珠菌由酵母相转化为菌丝相,抑制效果较阳性药物FLC明显(图 3)。

|
| 图 3 酵母相到菌丝相转化情况 Figure 3 The transformation from yeast phase to mycelial phase 注:以上所有图片标尺长度均为200 μm (400×). Note: The length of all the above picture surveyor's rod are 200 μm (400×). |
|
|
白色念珠菌细胞在含有15%胎牛血清的RPMI 1640培养液中培养6 h后,可以看到明显的菌丝生长。经10 μg/mL AMP-17作用后,能够抑制菌丝继续生长发育,即最初形成的菌丝依旧存在,但不能够使已形成的菌丝转化为酵母相。而AMP-17在20 μg/mL和40 μg/mL时,除了可以完全抑制菌丝的生长外,还能促使部分已形成的菌丝转化为酵母相。阳性药物FLC组可抑制已形成的菌丝进一步发育,但不能促使已形成的菌丝转化为酵母态(图 4)。

|
| 图 4 菌丝相到酵母相转化情况 Figure 4 The transformation from mycelial phase to yeast phase 注:以上所有图片标尺长度均为200 μm (400×). Note: The length of all the above picture surveyor's rod are 200 μm (400×). |
|
|
白色念珠菌是一种重要的条件致病菌,临床较为常见,本研究选取10株临床株以及1株标准株ATCC10231进行MIC测定,结果表明支气管肺泡灌洗液中的白色念珠菌对AMP-17更为敏感,即治疗效果更好。根据对AMP-17的敏感程度分别选取支气管肺泡灌洗液分离株16105、粪便分离株16214以及标准株ATCC10231绘制生长曲线,结果表明AMP-17可以抑制白色念珠菌的生长。
白色念珠菌的生长方式为出芽繁殖,即先产生芽生孢子,随后芽生孢子脱离母体,发育成新个体,当机体免疫能力下降或抵抗力降低时,芽生孢子可发育为芽管进而形成菌丝,具有致病性[4, 17-18]。因此芽生孢子的形成可以直接反映白色念珠菌的生长繁殖情况[19],抑制芽生孢子的形成可有效地控制白色念珠菌的繁殖,抑制芽管的形成可防止其进一步发育为菌丝,从而达到减低白色念珠菌致病性的目的。课题组前期研究[16]发现AMP-17可以通过破坏菌体细胞壁完整性,干扰细胞膜结构等方式发挥抗真菌效果。本研究观察到AMP-17作用后白色念珠菌的芽生孢子及芽管均比对照组要明显减少,推测可能是AMP-17通过影响菌体细胞壁及细胞膜的正常生理功能,致使菌体不能正常出芽繁殖。
白色念珠菌的生长具有二相性,即酵母相与菌丝相的转化,菌丝相具有较强的黏附和侵袭能力[20],菌丝的发育是白色念珠菌最重要的致病性特征,抑制菌丝发育可降低白色念珠菌的毒力[21]。在芽管形成实验中所用的培养基为含胎牛血清的RPMI 1640培养液,不同于培养芽生孢子的SDB培养基。血清芽管实验可以判断AMP-17能否抑制白色念珠菌芽管的生成,若不能形成芽管,以酵母相形式存在的白色念珠菌则不具备侵袭能力,且没有菌丝则不能进一步形成耐药性较强的生物被膜结构,从而在白色念珠菌被膜形成的初始阶段成功地进行了阻断[22]。通过显微镜观察到AMP-17可较好地抑制菌丝的生长,并成功地阻止了白色念珠菌酵母相向菌丝相转化,从而降低白色念珠菌的毒力,也对白色念珠菌菌丝继续发育形成生物被膜起到很好的抑制作用。
AMP-17既然可以抑制白色念珠菌酵母相向菌丝相转化,那对于已经形成的菌丝是否也会有一定的影响呢?对此我们将白色念珠菌于含15%胎牛血清的RPMI 1640培养液中培养6 h,使其可以完全形成菌丝,然后加入不同浓度的AMP-17,结果显示低浓度的AMP-17能够抑制已经形成的菌丝继续生长发育,即最初形成的菌丝依旧存在,但不能够使已形成的菌丝转化为酵母相。高浓度的AMP-17则可以完全地抑制菌丝的生长,且能够使新生的酵母相细胞停止向菌丝相的转化以及能够使部分已形成的菌丝转化为酵母相。
本研究结果表明,AMP-17不仅能够很好地抑制芽生孢子的生成及芽管的形成,而且可以较好地抑制白色念珠菌菌丝的生长。AMP-17对白色念珠菌酵母态的MIC值是FLC的20倍,即AMP-17对酵母态的抗菌活性要弱于FLC,但低浓度(20 μg/mL)的AMP-17对芽生孢子和芽管形成的抑制效果较高浓度(100 μg/mL)的FLC明显。这为抗菌肽临床治疗白色念珠菌提供了可靠的实验依据,对开发抗真菌药物具有重要意义。
| [1] |
Mayer FL, Wilson D, Hube B. Candida albicans pathogenicity mechanisms[J]. Virulence, 2013, 4(2): 119-128. DOI:10.4161/viru.22913 |
| [2] |
Dalle F, WäChtler B, L'Ollivier C, et al. Cellular interactions of Candida albicans with human oral epithelial cells and enterocytes[J]. Cellular Microbiology, 2010, 12(2): 248-271. DOI:10.1111/j.1462-5822.2009.01394.x |
| [3] |
Moran C, Grussemeyer CA, Spalding JR, et al. Comparison of costs, length of stay, and mortality associated with Candida glabrata and Candida albicans bloodstream infections[J]. American Journal of Infection Control, 2010, 38(1): 78-80. DOI:10.1016/j.ajic.2009.06.014 |
| [4] |
Moyes DL, Runglall M, Murciano C, et al. A biphasic innate immune MAPK response discriminates between the yeast and hyphal forms of Candida albicans in epithelial cells[J]. Cell Host & Microbe, 2010, 8(3): 225-235. |
| [5] |
Wang N, Han Q, Sang JL. Morphological types and pathogenicity of Candida albicans[J]. Bulletin of Bioloy, 2015, 50(10): 3-8. (in Chinese) 王娜, 韩琦, 桑建利. 白色念珠菌的形态类型及致病性[J]. 生物学通报, 2015, 50(10): 3-8. |
| [6] |
Hingston CD, Hingston EJ, Wise MP. Impact of nystatin on Candida and the oral microbiome[J]. Critical Care, 2012, 16(4): 440. DOI:10.1186/cc11360 |
| [7] |
Pfaller MA. Antifungal drug resistance: mechanisms, epidemiology, and consequences for treatment[J]. The American Journal of Medicine, 2012, 125(S1): S3-S13. |
| [8] |
Luo ZH, Wu JW, Fu P, et al. Effect of synthetic musca domestica antifungal peptide-1A (MAF-1A) on pathogenicity of Candida albicans[J]. Journal of Third Military Medical University, 2013, 35(20): 2203-2207. (in Chinese) 罗振华, 吴建伟, 付萍, 等. 人工合成家蝇抗真菌肽MAF-1A对白色念珠菌致病性的影响[J]. 第三军医大学学报, 2013, 35(20): 2203-2207. |
| [9] |
Le Lay C, Akerey B, Fliss I, et al. Nisin Z inhibits the growth of Candida albicans and its transition from blastospore to hyphal form[J]. Journal of Applied Microbiology, 2008, 105(5): 1630-1639. DOI:10.1111/j.1365-2672.2008.03908.x |
| [10] |
Maisetta G, Grassi L, Di Luca M, et al. Anti-biofilm properties of the antimicrobial peptide temporin 1Tb and its ability, in combination with EDTA, to eradicate Staphylococcus epidermidis biofilms on silicone catheters[J]. Biofouling, 2016, 32(7): 787-800. DOI:10.1080/08927014.2016.1194401 |
| [11] |
Batoni G, Maisetta G, Esin S. Antimicrobial peptides and their interaction with biofilms of medically relevant bacteria[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2016, 1858(5): 1044-1060. DOI:10.1016/j.bbamem.2015.10.013 |
| [12] |
Fu P, Wu JW, Gao S, et al. The recombinant expression and activity detection of MAF-1 fusion protein[J]. Scientific Reports, 2015, 5: 14716. DOI:10.1038/srep14716 |
| [13] |
Wang T, Xiu JF, Zhang YC, et al. Transcriptional responses of Candida albicans to antimicrobial peptide MAF-1A[J]. Frontiers in Microbiology, 2017, 8: 894. DOI:10.3389/fmicb.2017.00894 |
| [14] |
Guo G, Tao RY, Li Y, et al. Identification and characterization of a novel antimicrobial protein from the housefly Musca domestica[J]. Biochemical and Biophysical Research Communications, 2017, 490(3): 746-752. DOI:10.1016/j.bbrc.2017.06.112 |
| [15] |
Yang LB, Guo G, Ma HL, et al. Optimization of prokaryotic expression conditions and antifungal activity detection of antibacterial peptide AMPs17 protein in Musca domestica[J]. China Biotechnology, 2019, 39(4): 24-31. (in Chinese) 杨隆兵, 国果, 马慧玲, 等. 家蝇抗菌肽AMPs17蛋白原核表达条件的优化及其抗真菌活性检测[J]. 中国生物工程杂志, 2019, 39(4): 24-31. |
| [16] |
Ma HL. The mechanism of antibacterial peptide AMP-17 from Musca domestica against Candida albicans[D]. Guiyang: Master's Thesis of Guizhou Medical University, 2019 (in Chinese) 马慧玲.家蝇抗菌肽AMP-17抗白色念珠菌机制研究[D].贵阳: 贵州医科大学硕士学位论文, 2019 http://cdmd.cnki.com.cn/Article/CDMD-10660-1019152996.htm |
| [17] |
Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in combined medical-surgical intensive care units in the United States[J]. Infection Control & Hospital Epidemiology, 2000, 21(8): 510-515. |
| [18] |
Kumamoto CA, Vinces MD. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence[J]. Cellular Microbiology, 2005, 7(11): 1546-1554. DOI:10.1111/j.1462-5822.2005.00616.x |
| [19] |
Lee J, Hwang JS, Hwang IS, et al. Coprisin-induced antifungal effects in Candida albicans correlate with apoptotic mechanisms[J]. Free Radical Biology and Medicine, 2012, 52(11/12): 2302-2311. |
| [20] |
Carlisle PL, Banerjee M, Lazzell A, et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(2): 599-604. DOI:10.1073/pnas.0804061106 |
| [21] |
Tao L, Zhang YL, Fan SR, et al. Integration of the tricarboxylic acid (TCA) cycle with cAMP signaling and Sfl2 pathways in the regulation of CO2 sensing and hyphal development in Candida albicans[J]. PLoS Genetics, 2017, 13(8): e1006949. DOI:10.1371/journal.pgen.1006949 |
| [22] |
Liu LB, Liu Q, Liu XY, et al. Inhibition of litsea cubeba oil on biofilm initial formation stage of Candida albicans[J]. International Journal of Laboratory Medicine, 2017, 38(20): 2850-2851. (in Chinese) 刘林波, 刘琦, 刘晓莺, 等. 山苍子精油对白色念珠菌生物被膜芽管形成的抑制作用研究[J]. 国际检验医学杂志, 2017, 38(20): 2850-2851. DOI:10.3969/j.issn.1673-4130.2017.20.019 |
 2020, Vol. 47
2020, Vol. 47




