扩展功能
文章信息
- 孙银玲, 陈丽艳, 陈继亮, 王萍, 曹阳, 丁纯洁, 王伟明
- SUN Yin-Ling, CHEN Li-Yan, CHEN Ji-Liang, WANG Ping, CAO Yang, DING Chun-Jie, WANG Wei-Ming
- 参豉对气虚血瘀模型大鼠肠道微生物及其代谢多样性的影响
- Effect of Shenchi on intestinal microbiota and their metabolism diversity in rats with qi deficiency and blood stasis
- 微生物学通报, 2020, 47(3): 829-842
- Microbiology China, 2020, 47(3): 829-842
- DOI: 10.13344/j.microbiol.china.190607
-
文章历史
- 收稿日期: 2019-07-24
- 接受日期: 2019-11-22
- 网络首发日期: 2019-11-29
参豉为人参与大豆经微生物发酵而成的新型豆豉,是依据宋徽宗赵佶所著《圣济总录》中的阿胶饮方,根据淡豆豉的发酵原理,以种植人参和东北小粒黄豆作为发酵基质,采用自淡豆豉中分离获得的优势益生菌株进行纯种发酵制备而成。参豉的纤溶酶活性与豆豉相比明显提高,并且经过发酵能够实现人参皂苷的体外生物转化,有利于人体吸收以提高生物利用度,增强其益气作用;同时参豉为经益生菌发酵而成的特殊发酵食品,对肠道微生物具有调节作用(已接收,待发表)。
健康成年人的肠道栖息着大约1014数量级微生物,依据其需氧程度不同可以分为厌氧菌、兼性厌氧菌、需氧菌,其中90%−99.9%为兼性厌氧菌或厌氧菌。已知肠道菌群主要包括肠杆菌属、肠球菌属、双歧杆菌属、乳酸菌属、拟杆菌属、荚膜梭菌属等至少14个菌属。它们与人体之间的关系错综复杂,参与机体营养物质的消化吸收、生物拮抗、免疫等生命活动,贯穿于人体各种生理活动和病理过程。因此宿主及饮食等外环境变化,易引起肠道微生物失调[1-2]。此外,劳倦内伤、年老体弱、气血不足等易导致气虚血瘀,使血液运行无力,瘀血停滞于体内,进而阻滞肠腑气机运转,肠络失和,肠道传导失司,最终导致便秘、溃疡性结肠炎等疾病,同时也会引起肠道菌群发生改变[3-5]。
Biolog-ECO微孔板是用于检测微生物群体代谢功能多样性的方法之一,主要基于微生物群体的生物和生化特性,根据微生物对羧酸、糖类、氨基酸、大分子聚合物、胺类和其他类等31种碳源的利用情况进行分析,从而快速表征样品中微生物群体的生态状况[6-7]。利用Biolog-ECO系统研究肠道微生物对特定碳源代谢能力的变化,可以了解参豉对气虚血瘀模型大鼠肠道微生物的菌群结构及其代谢是否具有调控作用。本文结合《保健食品检验与评价技术规范》2003版中“调节肠道菌群功能”的技术评价规范[8],选取6种人体常驻菌为目标菌用以考察参豉对气虚血瘀模型大鼠肠道菌群的调节作用[9],研究结果将有助于阐明参豉对哺乳动物肠道微生物菌群数量及微生物代谢多样性的影响,揭示其作用机理,为参豉的应用奠定基础。
1 材料与方法 1.1 动物清洁级Wistar大鼠60只,雌雄各半,体质量260±20 g,由黑龙江省哈尔滨医科大学实验动物学部提供。许可证号SCXK (黑) 2013-001。
1.2 药物参豉:以种植人参和大豆作为发酵基质,采用本实验室前期自淡豆豉中分离获得的优势益生菌株进行纯种发酵而成,−20 ℃保存备用。结合前期研究结果考虑纤溶酶活性受热降解,选择新鲜参豉匀浆后给药。取适量参豉与生理盐水按照质量比1:1的比例匀浆,配制成50% (质量体积比)的参豉母液,−20 ℃保存备用。
人参(5年生,2017年采收)购自吉林省百济堂参业有限公司,经黑龙江省中医药科学院王伟明研究员鉴定为五加科植物人参(Panax Ginseng C.A.Mey.)的干燥根。黄豆为黑龙江省农业科学院种植,经黑龙江省中医药科学院王伟明研究员鉴定为豆科植物大豆(Glycine max (L.) Merr.)的干燥成熟种子。菌种经中国工业微生物菌种保藏管理中心鉴定为枯草芽孢杆菌枯草亚种(Bacillus subtilis subsp. subtilis)。
补阳还五汤(记载于清代王清任所著《医林改错》,为治疗气虚血瘀证经典方剂):黄芪(生) 120 g,当归尾6 g,赤芍5 g,地龙3 g,川芎3 g,红花3 g,桃仁3 g。均购自黑龙江省中医医院。按上述配比,称取适量药物,加10倍量水常规煎煮2次,每次1 h,合并煎液,浓缩至生药浓度为2 g/mL,−20 ℃保存备用。
1.3 培养基、主要试剂及仪器Biolog-ECO Microplate,Biolog公司;类杆菌-胆汁-七叶苷琼脂(BBE),伊红美蓝琼脂(EMB),LBS琼脂(LBS),莫匹罗星锂盐改良MRS培养基(MRS),Pfizer肠球菌选择性琼脂(PSE),胰胨-亚硫酸盐-环丝氨酸琼脂基础(TSC),分别用于脆弱拟杆菌、肠杆菌、乳酸菌、双歧杆菌、肠球菌及产气荚膜梭菌的数量测定,以上培养基均购自青岛海博生物技术有限公司。动物饲料由黑龙江省中医药科学院动物实验中心提供。
Biolog微生物自动分析仪,Biolog公司;厌氧培养箱,上海跃进医疗器械有限公司;生物安全柜,北京东联哈尔仪器制造有限公司;菌落计数/显微细胞分析仪,杭州迅数科技有限公司。
1.4 方法 1.4.1 动物分组及造模方法60只大鼠适应性饲养7 d后,随机分为空白组、模型组、参豉高、中、低剂量组、补阳还五汤组,共6组,每组10只,雌雄各半,分笼饲养。
在中医理论指导下,结合现代医学技术及研究方法,建立气虚血瘀动物模型。除空白组外,其他各组每天进行力竭游泳实验,将大鼠置于水深35±5 cm,水温15±2 ℃,直径90 cm的桶中进行游泳,以每组大鼠自然沉降没入水中3–5 s不能自主上浮为其疲惫标准。当全组有50%出现自然沉降时,停止游泳捞出,使之暴露于空气中自然晾干,连续造模60 d。每日力竭游泳后各组给予正常饮食量的1/2 (饲料按照每天每只大鼠40 g/kg体重喂养)[10-15]。
1.4.2 给药方法采用造模与给药同时进行的方法,每日灌胃给药1次,连续造模给药60 d,空白组和模型组给予生理盐水,其余各组按大鼠临床等效用药剂量给药,即参豉高、中、低剂量分别为每日6、3、1.5 g/kg体重(其中参豉中剂量为成人每日用量),阳性对照组为补阳还五汤每日13 g/kg体重[16-17]。
1.5 检测指标及方法 1.5.1 大鼠粪便样本的采集及处理大鼠造模给药60 d,腹主动脉取血后立即处死大鼠,无菌条件下采集各组大鼠结肠段粪便。并在无菌条件下称取粪便样品1 g,加入10 mL无菌生理盐水,涡旋振荡使微生物分散均匀,1 000×g离心5 min,取上清液倍比稀释为浓度10−2−10−5 g/mL,制备菌悬液。
1.5.2 肠道6种常驻菌分析6种选择性培养基按照提供的说明配制、灭菌后倾注培养皿中备用。选择合适的稀释度,采用涂布法计数,好氧菌如肠杆菌及肠球菌培养48 h计数,厌氧菌如脆弱拟杆菌、乳酸杆菌、双歧杆菌及产气荚膜梭菌培养72 h计数[9, 18]。计算每克粪便中含有菌落数CFU/g。
1.5.3 Biolog-ECO分析采用含有31种碳源的Biolog-ECO微孔板分析肠道微生物代谢多样性,通过检测氧化还原指示剂的吸光度变化来反映微生物对底物的利用程度。微生物在碳源代谢过程中产生自由电子,与四唑紫产生特定的颜色反应,颜色的深度可以反映微生物的碳源利用程度。不同的微生物能够利用不同的碳源,即不同的代谢功能。肠菌混悬液制备方法同1.5.1,取10−3 g/mL浓度的菌悬液迅速接种至Biolog-ECO微孔板中(每孔150 μL),于37 ℃恒温厌氧培养24、48、72、96、120、144、168 h,利用Biolog微生物鉴定系统读取数据。
1.6 统计学方法(1) 参豉对气虚血瘀证模型大鼠肠道微生物的代谢活性用每孔平均颜色变化率(AWCD)来描述,计算公式如下:

|
式中,Ci为各碳源孔在590 nm下的吸光度值与750 nm下吸光度值的差值;R为ECO板对照孔的吸光度值,n为Biolog-ECO微孔板的C源数目31[19-20]。
(2) 基于Biolog-ECO微孔板培养48 h的数据,计算微生物代谢功能多样性指数研究微生物群体的多样性[1, 7, 19, 21-22]。
Shannon指数(H′):衡量微生物群体的丰富度和均匀度。
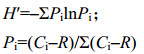
|
Pi为第i (1–31)孔中的吸光度值与所有孔的总吸光度值之比。
Shannon均匀度(E):根据Shannon指数计算的均匀度。
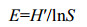
|
式中,S表示碳源(31个碳源)代谢孔的数目,即颜色变化的孔的数量(Ci−R > 0,则表示该孔碳源被利用,为反应孔)。
Simpson多样性指数(D):表示最常见物种丰度的敏感性。

|
McIntosh指数(U):评估微生物群体集合的多样性。

|
式中,ni表示第i孔的相对吸光度值(Ci−R)。
数据用Microsoft Excel 2007计算AWCD值及多样性指数,GraphPad Prism 6作图,SPSS 24.0软件系统进行聚类分析和主成分分析(principal component analysis,PCA),所有数据均为3次重复的平均值。
2 结果与分析 2.1 气虚血瘀模型大鼠的观察指标在造模过程中,模型大鼠在单次游泳力竭后表现出明显的气虚症状,可见呼吸急促,气喘,没有反抗能力,不去理毛,站立不稳、左右摇晃等。用于实验的大鼠应在每次游泳后出现明显的力竭情况,使其出现“劳则耗气”久而成虚的病理特征[14]。以体征、体质量及耐疲劳时间作为指标评价模型,模型组与空白组相比,皮毛杂乱且黯淡枯槁、爪甲色淡、舌质黯紫,体质量增长速度显著变慢(P < 0.05),耐疲劳时间明显缩短(P < 0.05);给药组与模型组相比毛色、爪甲、舌质色泽接近空白组,体质量及耐疲劳时间与空白组无显著性差异。
2.2 参豉对肠道6种常驻菌属的影响肠道微生物在6种选择性培养基的生长情况及菌落形态如图 1和表 1所示。
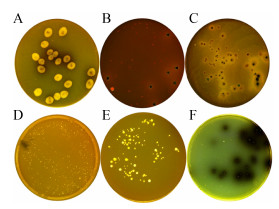
|
| 图 1 肠道微生物在不同选择性培养基的菌落形态 Figure 1 Colony morphology of intestinal microbes on different selective media 注:A:类杆菌−胆汁-七叶苷琼脂(BBE);B:伊红美蓝琼脂(EMB);C:胰胨-亚硫酸盐-环丝氨酸琼脂基础(TSC);D:莫匹罗星锂盐改良MRS培养基(MRS);E:LBS琼脂(LBS);F:Pfizer肠球菌选择性琼脂(PSE). Note: A: BBE agar (BBE); B: Eosin-methylene blue agar (EMB); C: Tryptose sulfite-cyloserine agar base (TSC); D: Li-mupirocin MRS medium, modified (MRS); E: LBS agar (LBS); F: Pfizer Enterococcus selective agar (PSE). |
|
|
| 菌属 Culture type |
培养基 Culture medium |
菌落形态 Colonial morphology |
| 拟杆菌属 B. fragilis |
类杆菌-胆汁-七叶苷琼脂 BBE |
(1)菌落略圆形, 较大且边缘不规则, 菌落表面乳白色, 微凸起, 表面光滑有光泽, 中心处有红褐色斑点 (1) The colonies are close to round, large and irregular in edge. The surface of the colony is milky white, slightly convex, smooth and shiny, there are reddish-brown spots at the center (2)菌落圆形, 较小, 白色, 菌落周围有深褐色光圈, 凸起, 表面光滑有光泽, 不透明 (2) The colonies were round, small, white, and with a dark brown aperture around them, the colonies were convex, smooth, shiny surface and opaque |
| 肠杆菌属 Enterobacter |
伊红美蓝琼脂 EMB |
(1)菌落圆形, 紫黑色, 并带有绿色金属光泽, 表面凸起 (1) The colonies were round and convex, that was purple-black, with a green metallic luster (2)菌落圆形, 粉红色, 或中心为黑色, 表面凸起, 不透明 (2) The colonies were round, pink, or black in the center, with a raised surface and opaque (3)菌落近圆形, 边缘不规则, 无色或近琥珀色 (3) Colonies nearly round, irregular edges, colorless or near amber |
| 产气荚膜梭菌属C. perfringens | 胰胨-亚硫酸盐-环丝氨酸琼脂基础 TSC |
(1)菌落圆形, 黑色, 微凸起, 周围有不透明的晕 (1) The colonies were round, black, slightly raised, with opaque halo around them (2)菌落圆形, 乳白色, 微凸起, 菌落中心为黑色, 不透明 (2) The colonies were round, milky white, slightly raised, opaque and the center of the colony is black (3)菌落圆形, 乳白色, 微凸起 (3) The colonies were round, milky white, and slightly |
| 双歧杆菌属 Bifidobacterium |
莫匹罗星锂盐改良 MRS培养基 MRS |
菌落圆形, 白色, 较小, 微凸起, 不透明 Colony round, white, small, slightly raised, opaque |
| 乳酸菌属Lactobacillus | LBS琼脂 LBS |
菌落圆形, 白色, 微凸起, 不透明 Colony round, white, slightly raised, opaque |
| 肠球菌属Enterococci | Pfizer肠球菌选择性琼脂 PSE |
菌落圆形, 白色或深褐色, 周围有黑色的晕, 半透明 The colony is round, white or dark brown with a black halo around it and translucent |
采用稀释平板菌落计数法对大鼠肠道内6种常驻菌进行分析,结果如表 2所示。(1)气虚血瘀模型大鼠肠道内乳酸菌、双歧杆菌及肠球菌的数量与空白组相比明显降低,差异极显著(P < 0.01);脆弱拟杆菌数量与空白组相比明显降低;肠杆菌及产气荚膜梭菌的数量与空白组相比明显升高,差异极显著(P < 0.01)。(2)给予高、中、低剂量参豉调节后,大鼠肠道内脆弱拟杆菌、乳酸菌及双歧杆菌数量明显增加,并随给药剂量的增高而增加;高、中剂量组的脆弱拟杆菌数量与空白组及模型组相比,差异显著(P < 0.05或P < 0.01);参豉高、中、低剂量组的乳酸菌及双歧杆菌数量与模型组相比,差异极显著(P < 0.01)。参豉高、中、低剂量组的肠球菌数量与模型组相比明显增加,差异极显著(P < 0.01);与空白组相接近,差异无统计学意义。参豉高、中、低剂量组的肠杆菌数目与模型组相比明显降低,差异极显著(P < 0.01),且高、中剂量组与空白组相接近,差异无统计学意义。参豉高、中、低剂量组产气荚膜梭菌的数量与模型组相比明显降低,差异极显著(P < 0.01),并且高剂量组明显低于空白组,差异极显著(P < 0.01)。(3)补阳还五汤治疗调节后大鼠肠道内脆弱拟杆菌数量高于模型组及空白组,但差异无统计学意义,低于参豉高、中剂量组,差异显著(P < 0.05或P < 0.01);乳酸菌、双歧杆菌数量与空白组、模型组、参豉高、中、低剂量组相比明显降低,差异极显著(P < 0.01);肠杆菌数量低于空白组及模型组,与模型组相比差异极显著(P < 0.01);肠球菌数量高于模型组,低于空白组、参豉高、中、低剂量组,差异极显著(P < 0.01);产气荚膜梭菌的数量低于模型组,但高于空白组、参豉高、中、低剂量组,差异极显著(P < 0.01)。结果显示,参豉对模型大鼠肠道中的有益菌如脆弱拟杆菌、乳酸菌、双歧杆菌有增殖作用;能够调节模型大鼠肠道中肠球菌及肠杆菌数量与空白组相接近;抑制模型大鼠肠道中有害菌产气荚膜梭菌的增殖。补阳还五汤对模型大鼠乳酸菌、双歧杆菌具有抑制作用,对脆弱拟杆菌、肠球菌、肠杆菌、产气荚膜梭菌的调节作用弱于参豉。
| Groups | 脆弱拟杆菌 B. fragilis (×104 CFU/g) |
乳酸菌 Lactobacillus (×106 CFU/g) |
双歧杆菌 Bifidobacterium (×106 CFU/g) |
肠杆菌 Enterobacter (×106 CFU/g) |
肠球菌 Enterococci (×106 CFU/g) |
产气荚膜梭菌 C. perfringens (×106 CFU/g) |
| 空白组 The normal group |
9.67±1.52Cd | 4.25±0.22BCDEF | 4.22±0.20BCDEF | 0.22±0.09BE | 0.97±0.14BF | 3.01±0.31BCEF |
| 模型组 The model group |
0.83±0.57CD | 3.03±0.19ACDEF | 2.06±0.17ACDEF | 0.94±0.09ACDEF | 0.15±0.03ACDEF | 7.43±0.20ACDEF |
| 参豉高剂量组 The Shenchi high dose group |
70.00±12.5ABDEF | 6.26±0.26ABDEF | 5.49±0.25ABDEF | 0.21±0.03BE | 0.99±0.13BdF | 0.97±0.09ABDEF |
| 参豉中剂量组 The Shenchi middle dose group |
36.00±6.87aBCf | 5.04±0.49ABCEF | 3.68±0.19ABCEF | 0.25±0.05BEf | 0.83±0.11BcEF | 3.32±0.11BCEF |
| 参豉低剂量组 The Shenchi low dose group |
17.00±1.77C | 3.73±0.14ABCDF | 3.11±0.23ABCDF | 0.38±0.04ABCDF | 1.07±0.07BDF | 4.27±0.26ABCDF |
| 补阳还五汤组 The Buyang huanwu decoction group |
12.17±3.18Cd | 1.8±0.11ABCDE | 1.12±0.04ABCDE | 0.15±0.01BdE | 0.43±0.08ABCDE | 5.32±0.34ABCDE |
| 注:与空白组相比:a:P < 0.05, A: P < 0.01;与模型组相比:b:P < 0.05, B:P < 0.01;与参豉高剂量组相比:c:P < 0.05, C:P < 0.01;与参豉中剂量组相比:d:P < 0.05, D:P < 0.01;与参豉低剂量组相比:e:P < 0.05, E:P < 0.01;与补阳还五汤组相比:f:P < 0.05, F:P < 0.01. Note: Compared with the normal group: a: P < 0.05, A: P < 0.01; Compared with the model group: b: P < 0.05, B: P < 0.01; Compared with the Shenchi high dose group: c: P < 0.05, C: P < 0.01; Compared with the Shenchi middle dose group: d: P < 0.05, D: P < 0.01; Compared with the Shenchi low dose group: e: P < 0.05, E: P < 0.01; The Buyang huanwu decoction group: f: P < 0.05, F: P < 0.01. | ||||||
平均颜色变化率(average well color development,AWCD)常用于衡量微生物群体中微生物利用不同碳源的能力[6, 23]。实验结果如图 2所示,厌氧培养的24−48 h内,各组AWCD值变化较大,在48 h之后,各组的AWCD值变化趋势不明显。气虚血瘀模型大鼠给予高剂量参豉后AWCD值接近于空白组;参豉低剂量组、补阳还五汤组与模型组AWCD值比较接近;而参豉中剂量组AWCD值介于两者之间。结果表明模型组与空白组相比,肠道微生物碳源代谢能力发生明显变化。参豉高剂量组能够调节气虚血瘀模型大鼠肠道微生物接近正常水平;补阳还五汤对于气虚血瘀模型大鼠肠道微生物的调节作用弱于参豉高、中剂量组。
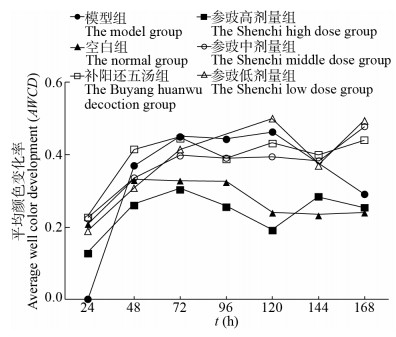
|
| 图 2 不同组大鼠肠道微生物AWCD随培养时间的变化 Figure 2 Changes of intestinal microorganism AWCD in rats at different groups with culturing times |
|
|
Shannon指数、Shannon均匀度、Simpson指数和Mclntosh指数常用于衡量微生物多样性。由2.3结果可知,AWCD值在厌氧培养的24−48 h内变化较大;在48 h之后各组的AWCD值变化趋势不明显,因此选择“拐点”处48 h的数据进行肠道微生物多样性分析,此时Biolog-ECO微孔板的培养时间可以最大限度满足肠道微生物的生长,在一定程度上可以更准确地反映不同组肠道微生物的差异性[24]。如表 3所示,Shannon指数、Shannon均匀度、Simpson指数以及Mclntosh指数模型组均高于空白组,且差异显著(P < 0.05或P < 0.01);参豉高剂量组Shannon指数、Shannon均匀度及Simpson指数与空白组相接近,差异无统计学意义,与模型组相比差异极显著(P < 0.01);参豉中剂量组Shannon均匀度、Mclntosh指数与模型组相比降低,并具有显著性差异(P < 0.05);参豉高、低剂量组的Mclntosh指数与模型组相比降低,并且低剂量组具有显著性差异(P < 0.05)。气虚血瘀模型大鼠肠道微生物的结构与数量发生明显变化,导致模型大鼠肠道微生物的Shannon指数、Shannon均匀度、Simpson指数以及Mclntosh指数与空白组相比明显升高且具有显著性差异。不同剂量的参豉对气虚血瘀模型大鼠肠道微生物有较好的调节作用,使其趋于正常水平。
| 组别 Groups |
Shannon指数 Shannon index (H′) |
Shannon均匀度 Shannon evenness (E) |
Simpson指数 Simpson index (D) |
Mclntosh指数 Mclntosh index (U) |
| 空白组 The normal group |
2.592±0.146BdeF | 0.777±0.041BDEF | 0.888±0.031BDEF | 2.561±0.113b |
| 模型组 The model group |
2.945±0.132AC | 0.960±0.015ACdf | 0.947±0.003AC | 3.237±0.124ace |
| 参豉高剂量组 The Shenchi high dose group |
2.630±0.103BdeF | 0.775±0.046BDEF | 0.901±0.011BDeF | 2.748±0.055 |
| 参豉中剂量组 The Shenchi middle dose group |
2.883±0.027ac | 0.907±0.004AbC | 0.939±0.002AC | 2.580±0.316b |
| 参豉低剂量组 The Shenchi low dose group |
2.854±0.189ac | 0.917±0.015AC | 0.936±0.012Ac | 2.529±0.454bf |
| 补阳还五汤组 The Buyang huanwu decoction group |
2.970±0.083AC | 0.895±0.025AbC | 0.942±0.007AC | 3.067±0.386 |
| 注:与空白组相比:a:P < 0.05, A:P < 0.01;与模型组相比:b:P < 0.05, B:P < 0.01;与参豉高剂量组相比:c:P < 0.05;C:P < 0.01;与参豉中剂量组相比:d:P < 0.05, D:P < 0.01;与参豉低剂量组相比:e:P < 0.05, E:P < 0.01;与补阳还五汤组相比:f:P < 0.05, F:P < 0.01. Note: Compared with the normal group: a: P < 0.05, A: P < 0.01; Compared with the model group: b: P < 0.05, B: P < 0.01; Compared with the Shenchi high dose group: c: P < 0.05, C: P < 0.01; Compared with the Shenchi middle dose group: d: P < 0.05, D: P < 0.01; Compared with the Shenchi low dose group: e: P < 0.05, E: P < 0.01; The Buyang huanwu decoction group: f: P < 0.05, F: P < 0.01. | ||||
Biolog-ECO微孔板含有31种碳源如表 4所示,主要由羧酸类、糖类、氨基酸类、大分子聚合物类、胺/酰胺类及其他类等6类碳源组成[1, 6]。由图 3可知,当聚类距离≤5时,空白组的碳源被聚为7类,模型组的碳源被聚为8类,参豉高剂量组的碳源被聚为5类,参豉中剂量组的碳源被聚为7类、低剂量组的碳源被聚为6类,补阳还五汤组的碳源被聚为7类,气虚血瘀模型大鼠肠道微生物对碳源的利用与空白组相比相对多样化。在各组中D-半乳糖醛酸、D-半乳糖内酯、D-木糖、葡萄糖-1-磷酸盐、丙酮酸甲酯、N-乙酰基-D-葡萄胺、L-天冬酰胺酸均聚为一类,空白组有丙酮酸甲酯、N-乙酰基-D-葡萄胺未聚在该类,补阳还五汤组有L-天冬酰胺酸未聚在该类。参豉高、中、低剂量组中葡萄糖-1-磷酸盐、D-半乳糖醛酸、D-木糖、L-天冬酰胺酸、丙酮酸甲酯、D-半乳糖内酯、N-乙酰基-D-葡萄胺聚为一类,参豉高、中剂量组中还有丝氨酸聚在该类,参豉中、低剂量组中还有肝糖、α-D-乳糖、甘氨酸-L-谷氨酸、α-环式糊精聚在该类。参豉不同剂量组肠道微生物对不同碳源的代谢和利用与模型组、空白组及补阳还五汤组有差异,可能与其对肠道微生物调节作用相关。
| 编号 No. |
碳源 Carbon source |
| A1 | 水Water |
| B1 | 丙酮酸甲酯Pyruvic acid methyl ester |
| C1 | 吐温-40 Tween-40 |
| D1 | 吐温-80 Tween-80 |
| E1 | Α-环式糊精α-cyclodextrin |
| F1 | G肝糖Lycogen |
| G1 | D-纤维二糖D-cellobiose |
| H1 | Α-D-乳糖α-D-lactose |
| A2 | Β-甲基-D-葡萄糖苷β-methyl-D-glucoside |
| B2 | D-木糖D-xylose |
| C2 | I-赤藻糖醇I-erythritol |
| D2 | D-甘露醇D-mannitol |
| E2 | N-乙酰基-D-葡萄胺N-acetyl-D-glucosamine |
| F2 | D-葡萄胺酸D-glucosaminic |
| G2 | 葡萄糖-1-磷酸盐Glucose-1-phosphate |
| H2 | D, L-α-甘油D, L-α-glycerol |
| A3 | D-半乳糖酸γ内酯D-galactonic acid γ-lactone |
| B3 | D-半乳糖醛酸D-galacturonic |
| C3 | 2-羟基苯甲酸2-hydroxy benzoic acid |
| D3 | 4-羟基苯甲酸4-hydroxy benzoic acid |
| E3 | γ-羟基丁酸γ-hydroxybutyric acid |
| F3 | 衣康酸Itaconic acid |
| G3 | α-丁酮酸α-ketobutyric acid |
| H3 | D-苹果酸D-malic acid |
| A4 | L-精氨酸L-arginine |
| B4 | L-天冬酰胺酸L-asparagine |
| C4 | L-苯基丙氨酸L-phenylalanine |
| D4 | L-丝氨酸L-serine |
| E4 | L-苏氨酸L-threonine |
| F4 | 甘氨酸-L-谷氨酸Glycyl-L-glutamic acid |
| G4 | 苯乙基胺Phenylethyl-amine |
| H4 | 腐胺Putrescine |

|
| 图 3 不同组大鼠肠道微生物碳源代谢聚类分析图 Figure 3 Cluster analysis of carbon source metabolism by intestinal microbiota in different groups of rats 注:A:空白组;B:模型组;C:参豉高剂量组;D:参豉中剂量组;E:参豉低剂量组;F:补阳还五汤组. Note: A: The normal group; B: The model group; C: The Shenchi high dose group; D: The Shenchi middle dose group; E: The Shenchi low dose group; F: The Buyang huanwu decoction group. |
|
|
由于不同组别大鼠肠道微生物对某些碳源的利用可能是相似的,因而导致Biolog-ECO获得的大量数据可能存在较多的信息重复。主成分分析(PCA)使变量简化降维,通过对吸光度相关性矩阵的变换,解释不同组别大鼠肠道微生物碳源利用的差异[22, 25-26]。PCA结果显示空白组、模型组、参豉高、中、低剂量组及补阳还五汤组中,成分1的方差贡献率分别为:62.387%、68.096%、78.194%、59.101%、73.815%及66.725%。
分析载荷图中6个组别大鼠肠道微生物对31种碳源的代谢特点,由图 4可知,空白组中PC1在β-甲基-D-葡萄糖苷、甘氨酸-L-谷氨酸、D-甘露醇、腐胺、D-半乳糖内酯、N-乙酰基-D-葡萄胺等碳源种类上有较高的载荷,表明空白组中这些碳源对PC1的贡献率比较大。模型组中PC1在N-乙酰基-D-葡萄胺、D-半乳糖醛酸、D-苹果酸、葡萄糖- 1-磷酸盐、L-丝氨酸、α-环式糊精等碳源上有较高的载荷。参豉高剂量组中PC1在β-甲基-D-葡萄糖苷、D-甘露醇、吐温-40、L-精氨酸、D, L-α-甘油等碳源上有较高的载荷。参豉中剂量组中PC1在L-天冬酰胺酸、D-木糖、D-半乳糖内酯、L-苯基丙氨酸、D-半乳糖醛酸等碳源上有较高的载荷。参豉低剂量组中PC1在L-苏氨酸、D-半乳糖内酯、I-赤藻糖醇、D-苹果酸、β-甲基-D-葡萄糖苷等碳源上有较高的载荷。补阳还五汤组中PC1在D-半乳糖醛酸、α-环式糊精、D-苹果酸、L-天冬酰胺酸、甘氨酸-L-谷氨酸等碳源上有较高的载荷。
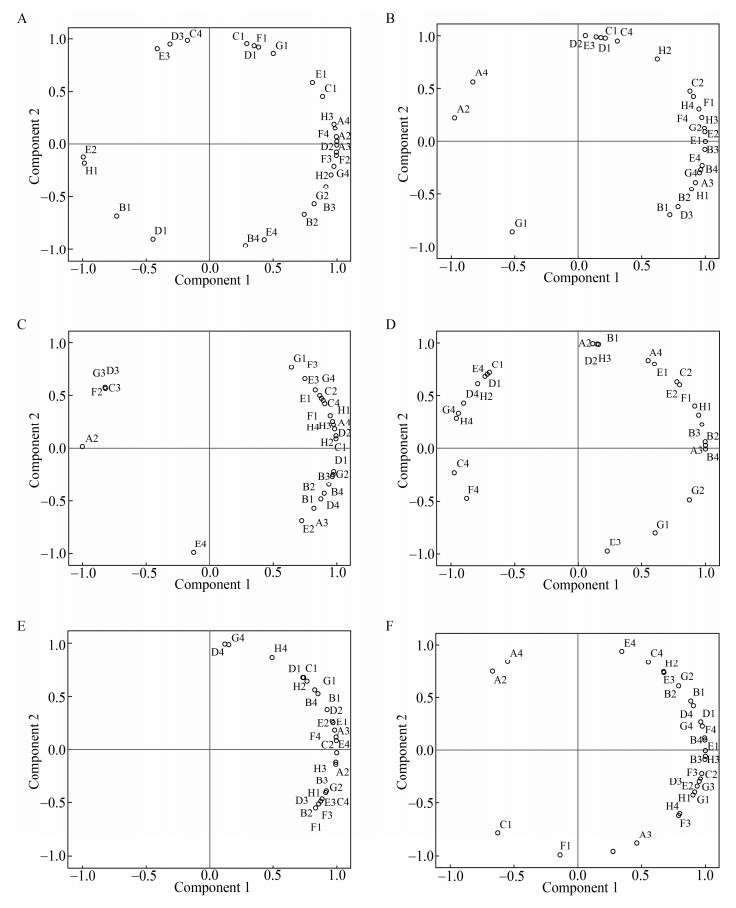
|
| 图 4 不同组别大鼠肠道微生物碳源代谢的主成分分析 Figure 4 Principal component analysis of carbon substrates metabolized by intestinal microbiota in rats of different groups 注:A:空白组;B:模型组;C:参豉高剂量组;D:参豉中剂量组;E:参豉低剂量组;F:补阳还五汤组. Note: A: The normal group; B: The model group; C: The Shenchi high dose group; D: The Shenchi middle dose group; E: The Shenchi low dose group; F: The Buyang huanwu decoction group. |
|
|
空白组中PC2在L-苯基丙氨酸、L-天冬酰胺酸、吐温-40、4-羟基苯甲酸、肝糖等碳源种类上有较高的载荷,表明空白组中这些碳源对PC2的贡献率比较大。模型组中PC2在D-甘露醇、γ-羟基丁酸、吐温-40、吐温-80、L-苯基丙氨酸等碳源种类上有较高的载荷。参豉高剂量组中PC2在L-苏氨酸等碳源种类上有较高的载荷。参豉中剂量组中PC2在β-甲基-D-葡萄糖苷、D-苹果酸、丙酮酸甲酯、D-甘露醇、γ-羟基丁酸等碳源种类上有较高的载荷。参豉低剂量组中PC2在L-丝氨酸、苯乙基胺等碳源种类上有较高的载荷。补阳还五汤组中PC2在肝糖、D-甘露醇、L-苏氨酸等碳源种类上有较高的载荷。
3 讨论与结论肠道微生物与宿主之间的相互调节及其对健康的重要影响逐渐被人们所重视,肠道微生物群落结构失调与许多疾病密切相关,如炎症性肠病、糖尿病、肥胖症、神经精神疾病、心血管疾病等[1, 7, 27]。肠道微生物可以产生活性物质或调节肠道中的内分泌细胞影响其合成代谢,从而发挥局部或全身效应[28]。本研究通过检测参豉对气虚血瘀模型大鼠肠道6种常驻菌的影响,及通过Biolog-ECO数据分析,明确参豉确实对肠道微生物具有调节作用。给予参豉后能够上调气虚血瘀模型大鼠肠道中乳酸菌、双歧杆菌、脆弱拟杆菌的数量,由于乳酸菌等有益菌的迅速增加变为优势菌种,能够争夺营养物质和定殖位点、影响微生物代谢途径和增强免疫功能来抑制大肠杆菌、产气荚膜梭菌的增殖[1, 29]。肠杆菌、产气荚膜梭菌均为条件致病菌,在健康人体内不产生副作用,但在疾病、营养不良、外伤及肠道菌群失衡的情况下可致病,肠杆菌与梭菌的增多与癌症和衰老密切相关[17, 30];参豉能够调节气虚血瘀模型大鼠肠杆菌的数量使其趋于正常水平,并抑制产气荚膜梭菌的增殖。肠球菌为人体肠道正常菌群之一,可以改善血脂代谢,参与肠道胆固醇吸收,加速粪便的排泄率,从而降低血中胆固醇的水平[31];参豉能够调节模型大鼠肠球菌的数量接近正常水平。
Biolog数据分析显示,培养48 h时大鼠肠道微生物多样性发生明显变化。Shannon指数是用于衡量相同情况下不同组大鼠肠道微生物利用碳源的丰富度和均匀度的综合指标,肠道微生物群落Shannon多样性指数值越大,表明肠道微生物群落功能多样性越高。Shannon均匀度指数则表示根据Shannon指数计算的均匀度,包含肠道微生物的种类数目(丰富度)及种类中肠道微生物分布的均匀性。肠道微生物种类数目越多,多样性越大;种类之间肠道微生物个体分配的均匀性增加也会使肠道微生物群落多样性提高。Simpson指数和Mclntosh指数是衡量不同组大鼠肠道微生物中某些最常见种的优势度和均匀度的指数[1, 6-7, 26, 32-33]。参豉不同剂量组大鼠肠道微生物其Shannon指数、Shannon均匀度、Simpson指数以及Mclntosh指数均低于模型组,差异显著,并与空白组相接近,表明不同剂量的参豉能够调节气虚血瘀模型大鼠肠道微生物趋于正常水平;AWCD值常用于衡量微生物群体中微生物利用不同碳源的能力,研究认为变化较大的样品具有较高的碳源代谢能力和微生物丰度[23],参豉高剂量组大鼠肠道微生物AWCD值与空白组接近。聚类分析与主成分分析结果显示参豉不同剂量组与空白组、模型组以及补阳还五组区别明显,可能与不同剂量参豉对气虚血瘀模型大鼠肠道微生物的调节相关。传统的化学分类无法反映微生物群落对不同碳源的利用情况,因此我们利用Biolog-ECO微孔板的31种碳源考察参豉对气虚血瘀模型大鼠肠道群落结构的影响。参豉高剂量组主成分分析显示其中L-精氨酸和L-苏氨酸具有较高的贡献率,L-精氨酸为人体半必需氨基酸,具有促进肝功能恢复、减缓血栓形成、减轻神经衰弱、促进伤口愈合等生理活性,其衍生物也广泛应用于多个领域[34];L-苏氨酸为人体必需氨基酸,是一种重要的营养强化剂,可以缓解人体疲劳,促进生长发育[35];由此推断参豉对不同碳源代谢和利用可能与其相应的药理作用相关。此外,本研究中人参与大豆共同发酵后实现了人参皂苷的体外生物转化,有利于提高其生物利用度。
采用长期“力竭游泳+饥饿”方法建立大鼠气虚血瘀模型,具有造模方法稳定、与临床病症结合度高等优点。造模后模型大鼠肠道微生物群落发生了复杂的变化,为检测肠道菌群与哺乳动物生理状况之间的相关性提供了可能。我们的研究证实,参豉能够调节气虚血瘀模型大鼠肠道中微生物菌群数量变化及肠道微生物代谢多样性,研究结果不仅可为参豉的应用提供依据,也为进一步深入研究哺乳动物肠道微生物的功能奠定了重要的方法学基础。
| [1] |
Wang CH, Zhang HL, Zhang QL, et al. Effects of ultra-micro powder Qiweibaizhusan on metabolism diversity of intestinal anaero-microbiotia in diarrheal mice with dysbacteriosis[J]. Acta Ecologica Sinica, 2015, 35(14): 4843-4851. (in Chinese) 王春晖, 张华玲, 张祺玲, 等. 超微七味白术散对肠道厌氧微生物代谢多样性的调控作用[J]. 生态学报, 2015, 35(14): 4843-4851. |
| [2] |
Chen XQ, Wang N, Jing ZC, et al. Research progress in gut microflora and cardiovascular diseases[J]. Chinese Journal of Practical Internal Medicine, 2018, 38(8): 766-769. (in Chinese) 陈晓晴, 王南, 荆志成, 等. 肠道菌群与心血管疾病研究进展[J]. 中国实用内科杂志, 2018, 38(8): 766-769. |
| [3] |
Wang J, Jiao JL, Yao LY. Research progress on the relationship between blood stasis and ulcerative colitis[J]. Hebei Journal of Traditional Chinese Medicine, 2008, 30(1): 95-97. (in Chinese) 王敬, 焦君良, 要丽英. 血瘀与溃疡性结肠炎关系的研究进展[J]. 河北中医, 2008, 30(1): 95-97. DOI:10.3969/j.issn.1002-2619.2008.01.068 |
| [4] |
Zhan XH, Wang W, Fu S. The research progress of treating senile constipation from blood stasis[J]. International Journal of Traditional Chinese Medicine, 2015, 37(2): 190-192. (in Chinese) 占新辉, 王微, 符思. 从血瘀论治老年便秘研究进展[J]. 国际中医中药杂志, 2015, 37(2): 190-192. DOI:10.3760/cma.j.issn.1673-4246.2015.02.025 |
| [5] |
Hu XQ, Chen LG. Talk of the relationship between constipation blood stasis[J]. Journal of Guiyang College of Traditional Chinese Medicine, 2004, 26(1): 34-36. (in Chinese) 胡小勤, 陈利国. 谈便秘与血瘀的关系[J]. 贵阳中医学院学报, 2004, 26(1): 34-36. DOI:10.3969/j.issn.1002-1108.2004.01.021 |
| [6] |
Ge ZW, Du HJ, Gao YL, et al. Analysis on metabolic functions of stored rice microbial communities by Biolog ECO microplates[J]. Frontiers in Microbiology, 2018, 9: 1375. DOI:10.3389/fmicb.2018.01375 |
| [7] |
Zhang HL, Cai Y, Tan ZJ, et al. Effects of ultra-micro powder Qiweibaizhusan on metabolism diversity of intestinal microflora in diarrhea mice with dysbacteriosis[J]. Chinese Journal of Applied & Environmental Biology, 2014, 20(1): 93-100. (in Chinese) 张华玲, 蔡莹, 谭周进, 等. 超微七味白术散对菌群失调腹泻小鼠肠道微生物代谢多样性的影响[J]. 应用与环境生物学报, 2014, 20(1): 93-100. |
| [8] |
中华人民共和国卫生部. 保健食品检验与评价技术规范[M]. 2003: 148-153.
|
| [9] |
Chen LY, Guan XL, Zhang L, et al. Regulatory effect of Sojae Semen Praeparatum on 6 common gut microbes[J]. Chinese Journal of Microecology, 2017, 29(10): 1122-1126. (in Chinese) 陈丽艳, 官雪莲, 张蕾, 等. 淡豆豉对人体肠道六种常驻菌的调节作用[J]. 中国微生态学杂志, 2017, 29(10): 1122-1126. |
| [10] |
Hu XG. Study on exterior signs and related biological foundation of Qi-deficiency and blood-stasis[D]. Beijing: Doctoral Dissertation of Beijing University of Chinese Medicine, 2007 (in Chinese) 扈新刚.气虚血瘀大鼠模型表征及生物学基础相关研究[D].北京: 北京中医药大学博士学位论文, 2007 |
| [11] |
Lou JL, Zhang YL, Zheng H, et al. Thinking train and method in research of animal model with syndrome of qi insufficiency and blood stasis[J]. Journal of Beijing University of Traditional Chinese Medicine, 2006, 29(2): 87-90. (in Chinese) 娄金丽, 张允岭, 郑宏, 等. 气虚血瘀证动物模型研究的思路与方法[J]. 北京中医药大学学报, 2006, 29(2): 87-90. DOI:10.3321/j.issn:1006-2157.2006.02.004 |
| [12] |
Pang SL, Gao JL. Study on simulation and mechanism of qi deficiency and blood stasis syndrome in middle-aged rats[J]. Journal of Tianjin College of Traditional Chinese Medicine, 1997, 16(3): 28-30. (in Chinese) 庞树玲, 高金亮. 中年大鼠气虚血瘀证的模拟及其机制探讨[J]. 天津中医学院学报, 1997, 16(3): 28-30. |
| [13] |
Piao SH, Hu YM, Guo J. A review on the method of establishing Qi deficiency and Blood stasis model[J]. Journal of Liaoning University of TCM, 2010, 12(11): 56-58. (in Chinese) 朴胜华, 胡因铭, 郭姣. 气虚血瘀证动物模型造模方法研究评述[J]. 辽宁中医药大学学报, 2010, 12(11): 56-58. |
| [14] |
Hu XG, Zhang YL, Liu HS, et al. Research on the external signs and Hemorheology in rats with qi deficiency and blood stasis[J]. Tianjin Journal of Traditional Chinese Medicine, 2007, 24(2): 138-141. (in Chinese) 扈新刚, 张允岭, 柳洪胜, 等. 气虚血瘀大鼠模型表征及血液流变学研究[J]. 天津中医药, 2007, 24(2): 138-141. DOI:10.3969/j.issn.1672-1519.2007.02.020 |
| [15] |
Zhang YL, Zhang J, Hu XG, et al. Establishment of rat model of ischemic stroke with qi deficiency and blood stasis syndrome and its evaluation system[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2009, 29(4): 343-346. (in Chinese) 张允岭, 张锦, 扈新刚, 等. 制作缺血性中风气虚血瘀证大鼠模型的实验研究[J]. 中国中西医结合杂志, 2009, 29(4): 343-346. DOI:10.3321/j.issn:1003-5370.2009.04.013 |
| [16] |
Zhang HY, Gao JZ, Zhang XH. Effect of Buyang Huanwu decoction on hemorheology in rats with qi deficiency and blood stasis syndrome[J]. Journal of Yunnan College of Traditional Chinese Medicine, 2000, 23(3): 10-11. (in Chinese) 张红宇, 高菊珍, 张晓华. 补阳还五汤对气虚血瘀证大鼠血液流变学的影响[J]. 云南中医学院学报, 2000, 23(3): 10-11. DOI:10.3969/j.issn.1000-2723.2000.03.004 |
| [17] |
Zhu CW, Peng K, Tong L. The effects of Bu Yang Huan Wu decoction on hemorheology and bloodroutine examination of ischemic stroke sequela model rats which lack of Qi and with blood silted[J]. Chinese Archives of Traditional Chinese Medicine, 2007, 25(4): 706-709. (in Chinese) 朱传武, 彭康, 佟丽. 补阳还五汤对中风后遗症气虚血瘀大鼠病证模型血常规及血液流变性的影响[J]. 中华中医药学刊, 2007, 25(4): 706-709. |
| [18] |
Tan ZJ, Wu H, Liu FL, et al. Effect of ultra-micro powder qiweibaishusan on the intestinal microbiota and enzyme activities in mice[J]. Acta Ecologica Sinica, 2012, 32(21): 6856-6863. (in Chinese) 谭周进, 吴海, 刘富林, 等. 超微七味白术散对肠道微生物及酶活性的影响[J]. 生态学报, 2012, 32(21): 6856-6863. |
| [19] |
Cao Q, Steinman AD, Su XM, et al. Effects of microcystins contamination on soil enzyme activities and microbial community in two typical lakeside soils[J]. Environmental Pollution, 2017, 231: 134-142. DOI:10.1016/j.envpol.2017.08.013 |
| [20] |
Zhang HY, Li YJ, Gu JG, et al. On carbon metabolism of fungi in chlortetracycline degradation based on Biolog-FF system[J]. Microbiology China, 2015, 42(7): 1241-1247. (in Chinese) 张惠艳, 李艳菊, 顾金刚, 等. 基于Biolog-FF技术的金霉素降解真菌的碳代谢特征研究[J]. 微生物学通报, 2015, 42(7): 1241-1247. |
| [21] |
Staddon WJ, Duchesne LC, Trevors JT. Microbial diversity and community structure of postdisturbance forest soils as determined by Sole-Carbon-Source utilization patterns[J]. Microbial Ecology, 1997, 34(2): 125-130. DOI:10.1007/s002489900042 |
| [22] |
Han DX, Wang N, Wang NN, et al. Soil microbial functional diversity of different altitude Pinus koraiensis forests[J]. Chinese Journal of Applied Ecology, 2015, 26(12): 3649-3656. (in Chinese) 韩冬雪, 王宁, 王楠楠, 等. 不同海拔红松林土壤微生物功能多样性[J]. 应用生态学报, 2015, 26(12): 3649-3656. |
| [23] |
Garland JL. Analysis and interpretation of community-level physiological profiles in microbial ecology[J]. FEMS Microbiology Ecology, 1997, 24(4): 289-300. DOI:10.1111/j.1574-6941.1997.tb00446.x |
| [24] |
Jia X, Dong SM, Zhou CJ. Effects of Biolog Eco-plates incubation time on analysis results in microbial ecology researches[J]. Journal of Basic Science and Engineering, 2013, 21(1): 10-19. (in Chinese) 贾夏, 董岁明, 周春娟. 微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响[J]. 应用基础与工程科学学报, 2013, 21(1): 10-19. DOI:10.3969/j.issn.1005-0930.2013.01.002 |
| [25] |
Jia LJ, Tang K, Lan HQ, et al. Diversity and structure of hypolithic bacteria community of Zhongyang Gobi[J]. Microbiology China, 2018, 45(12): 2603-2613. (in Chinese) 贾丽娟, 唐凯, 兰慧青, 等. 中央戈壁石下生物土壤结皮中细菌群落结构和多样性[J]. 微生物学通报, 2018, 45(12): 2603-2613. |
| [26] |
Meng QJ, Xu YL, Li CJ, et al. Effects of different vegetation coverage on microbial functional diversity in black soil[J]. Chinese Journal of Ecology, 2008, 27(7): 1134-1140. (in Chinese) 孟庆杰, 许艳丽, 李春杰, 等. 不同植被覆盖对黑土微生物功能多样性的影响[J]. 生态学杂志, 2008, 27(7): 1134-1140. |
| [27] |
Zhao L, Li LX, Chen FX, et al. Effect of Bacillus subtilis gavage on the intestinal microbiota of mice[J]. Journal of Shandong University (Health Sciences), 2017, 55(10): 28-35. (in Chinese) 赵力, 李理想, 陈飞雪, 等. 枯草芽孢杆菌灌胃对小鼠肠道菌群的影响[J]. 山东大学学报:医学版, 2017, 55(10): 28-35. |
| [28] |
Chen WH, Yu ZL, Shi L, et al. Relationship between intestinal flora and neuropsychiatric diseases[J]. National Medical Journal of China, 2018, 98(29): 2320-2322. (in Chinese) 陈文浩, 于周龙, 师乐, 等. 肠道菌群与神经精神疾病[J]. 中华医学杂志, 2018, 98(29): 2320-2322. DOI:10.3760/cma.j.issn.0376-2491.2018.29.008 |
| [29] |
Li HB, Wu SH, Zhang YY, et al. The research on interaction between traditional Chinese medicine and intestinal bacteria[J]. Chinese Traditional Patent Medicine, 2016, 38(1): 147-151. (in Chinese) 李寒冰, 吴宿慧, 张颜语, 等. 中药与肠道菌相互作用研究进展[J]. 中成药, 2016, 38(1): 147-151. |
| [30] |
Tang YK, Yin WZ. Ecological view of traditional Chinese medicine and modern ecological medicine[J]. Lishizhen Medicine and Materia Medica Research, 2008, 19(7): 1766-1768. (in Chinese) 唐由凯, 尹文仲. 中医学的生态观与现代生态医学[J]. 时珍国医国药, 2008, 19(7): 1766-1768. DOI:10.3969/j.issn.1008-0805.2008.07.115 |
| [31] |
Hu Y, Yang Q, Gan SL, et al. Fermentation characteristics of Enterococcus hirae and application in yogurt starter[J]. Journal of Dairy Science and Technology, 2012, 35(1): 15-19. (in Chinese) 胡颖, 杨琴, 甘盛力, 等. 海氏肠球菌(Enterococcus hirae)发酵特性及应用[J]. 乳业科学与技术, 2012, 35(1): 15-19. DOI:10.3969/j.issn.1671-5187.2012.01.005 |
| [32] |
Wang Q, Dai JL, Wu DQ, et al. Statistical analysis of data from Biolog method in the study of microbial ecology[J]. Acta Ecologica Sinica, 2010, 30(3): 817-823. (in Chinese) 王强, 戴九兰, 吴大千, 等. 微生物生态研究中基于Biolog方法的数据分析[J]. 生态学报, 2010, 30(3): 817-823. |
| [33] |
Shi P, Gao Q, Wang SP, et al. Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity[J]. Acta Ecologica Sinica, 2010, 30(22): 6173-6182. (in Chinese) 时鹏, 高强, 王淑平, 等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 2010, 30(22): 6173-6182. |
| [34] |
Sun AR, Song W, Liu J, et al. Enzymatic production of arginine derivatives: a review[J]. Chinese Journal of Biotechnology, 2018, 34(2): 165-176. (in Chinese) 孙安然, 宋伟, 刘佳, 等. 生物酶法合成L-精氨酸衍生物的研究进展[J]. 生物工程学报, 2018, 34(2): 165-176. |
| [35] |
Wei J, Wang ZZ, Yu HB, et al. Construction and fermentation of L-threonine-producing recombinant Escherichia coli[J]. Microbiology China, 2019, 46(4): 695-706. (in Chinese) 魏佳, 王壮壮, 于海波, 等. 产L-苏氨酸重组大肠杆菌的构建和发酵性能[J]. 微生物学通报, 2019, 46(4): 695-706. |
 2020, Vol. 47
2020, Vol. 47




