扩展功能
文章信息
- 谢凤行, 周可, 张峰峰, 赵琼, 孙海波, 王姝, 赵玉洁
- XIE Feng-Xing, ZHOU Ke, ZHANG Feng-Feng, ZHAO Qiong, SUN Hai-Bo, WANG Shu, ZHAO Yu-Jie
- 一株高蛋白含量小球藻TX的分离鉴定及其诱变育种
- Isolation, identification and mutation breeding of Chlorella sorokiniana TX with high protein content
- 微生物学通报, 2020, 47(3): 821-828
- Microbiology China, 2020, 47(3): 821-828
- DOI: 10.13344/j.microbiol.china.190626
-
文章历史
- 收稿日期: 2019-07-30
- 接受日期: 2019-11-20
- 网络首发日期: 2019-12-21
小球藻作为一种重要的微藻资源,广泛分布于湖泊、海洋等多种水体中。小球藻由于蛋白质含量高,含动物体所需的20种氨基酸[1],另外还富含不饱和脂肪酸、类胡萝卜素、虾青素和多种维生素等[2],被广泛应用于保健食品[3]、天然色素[4]、水产养殖饵料[5]、饲料添加剂[6]等多个领域。在水产养殖上,可直接作为鱼、虾、贝类的优质饵料[7],提高消化酶活性、促进养殖生物生长[8],还能降解养殖水体中亚硝酸盐、氨氮、硝酸盐和磷酸盐的含量[9-11],从而有效净化养殖水体。蛋白质是饵料中要考虑的首要营养元素,其特有的营养作用是其他营养素无法替代的[12],因此作为天然饵料,小球藻蛋白质含量高低直接关系到饵料质量。
微生物育种有自然选育、诱变、细胞融合、基因工程等手段。诱变育种具有操作简单、成本低等优点,被广泛用于动植物和微生物育种,研究者也一直致力于通过诱变手段选育高产藻株方面的研究工作。研究表明,小球藻经紫外诱变后,突变株的生长速率较对照提高6.23%,蛋白含量提高了2.5%[13];经等离子束、低能离子诱变藻细胞油脂含量得到提高[14-15];通过甲基磺酸乙脂(ethyl methyl sulfonate,EMS)诱变,突变株的二十碳五烯酸(eicosapentaenoic acid,EPA)产量提高了8.97%[16];60Coγ-射线辐照结合EMS诱变筛选到的高产多糖突变藻株,添加到南美白对虾日粮中,可显著提高对虾的免疫活性及相关的生化指标[17]。本研究首先对本室选育的具有高效脱氮能力且蛋白含量高达60.8%的小球藻TX进行分子鉴定,并采用紫外诱变、EMS诱变和复合诱变技术对该藻株进行了诱变处理,然后采用96孔板高通量筛选技术选育生长快、蛋白含量高的小球藻突变株,以期为水产养殖天然饵料的培养提供优良的藻种资源。
1 材料与方法 1.1 材料 1.1.1 试验用藻种所用的小球藻TX为本室从养殖池中分离保存,总蛋白含量为60.8%,生物量干重为0.57 g/L,前期试验证明该藻株能高效去除水体中氨氮和硝态氮[18]。
1.1.2 培养基小球藻富集及分离培养基BG11 (g/L):NaNO3 1.5,CaCl2·2H2O 0.036,Na2CO3 0.02,MgSO4·7H2O 0.075,K2HPO4 0.030 5,K2HPO4·3H2O 0.004,柠檬酸0.006,柠檬酸铁氨0.006,EDTANa2 0.000 1,A5溶液1 mL,土壤浸提液40 mL,固体培养基每升加18 g琼脂粉。
突变株初筛培养基M1 (g/L):(NH2)2CO 0.3,NH4Cl 0.3,NaHCO3 1.0,KH2PO4 0.05,MgSO4·7H2O 0.3,FeSO4·7H2O 0.008,固体培养基每升加18 g琼脂粉。
突变株复筛培养基M2 (g/L):(NH2)2CO 0.3,NH4Cl 0.3,NaHCO3 1.0,KH2PO4 0.05,MgSO4·7H2O 0.3,葡萄糖5.0,FeSO4·7H2O 0.008。
1.1.3 主要试剂和仪器Ezup柱式真菌DNA抽提试剂盒、PCR产物纯化试剂盒,生工生物工程(上海)股份有限公司;EMS为上海源叶生物科技有限公司生产的高纯,含量99%,其他化学试剂由国药集团生产的分析纯。智能光照培养箱,浙江托普仪器有限公司;酶标仪,BioTek公司;智能全自动凯氏定氮仪,山东海能科学仪器有限公司;PCR仪,Applied Biosystems公司;光学显微镜,奥林巴斯(中国)有限公司。
1.2 方法 1.2.1 小球藻的分离筛选分别取对虾精养池、鱼虾混养池、养鱼池的表层水500 mL,带回室内,取10 mL接种到100 mL灭菌的BG11液体培养基中,25 ℃光照培养箱中富集培养,光照强度为4 500−5 000 lx,1周后取富集液涂平板,从3种水体中分别挑选1株生长较好的藻株进行纯化。纯化4−5代后,接种到BG11液体培养基中静置培养,25 ℃光照培养1周后取样,测藻液OD600值,选取吸光度值高的用于后续试验。
1.2.2 藻株TX形态观察及分子鉴定将纯化的藻株在BG11固体培养基上划线后光照培养,观察藻落形态,并制片在光学显微镜下观察细胞形态。
通过18S rRNA基因序列分析对TX进行分子鉴定。DNA提取采用Ezup柱式真菌DNA抽提试剂盒,引物为NS1 (5′-GTAGTCATGCTTCTCTC-3′)和NS6 (5′-GCATCACAGACCTGTTATTGCCTC-3′)。PCR反应体系(25 μL):模板DNA (20−50 ng/μL) 0.5 μL,10×Buffer (with Mg2+) 2.5 μL,dNTPs (2.5 mmol/L) 1.0 μL,上、下游引物(10 μmol/L)各0.5 μL,双蒸水20.0 μL。PCR反应条件:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物回收纯化采用纯化试剂盒,纯化产物送生工生物工程(上海)股份有限公司测序。
1.2.3 小球藻TX诱变育种紫外诱变的方法参考文献[13]略有改动:取对数生长期的小球藻4 mL,调整浓度为(1−4)×106 CFU/mL,用20 W紫外灯管,辐射距离10 cm,诱变1、2、3、5、10 min,遮光5 h。
EMS方法参考文献[16]略有改动:取对数生长期的藻液10 mL,6 000 r/min离心10 min,弃上清,用0.8%的EMS (用pH 7.0浓度为0.06 mol/L的磷酸缓冲液配置) 10 mL分别处理10、20、30、40、50、60 min,用1%的硫代硫酸钠终止反应,8 000 r/min离心10 min,用双蒸水冲洗2次,遮光12 h,静置3 d。
复合诱变:用0.4% EMS诱变处理40 min,终止反应,用双蒸水冲洗后,20 W紫外灯照射,距离10 cm,辐射1 min。
将未经诱变和诱变处理的藻液10倍比梯度稀释,取100 μL涂布于M1固体培养基上,置于光照培养箱中25 ℃正置培养,光照强度为4 500− 5 000 lx,光暗比12 h:12 h。培养10 d后,计平板上藻细胞数,计算致死率T:

|
其中,未经诱变的为C1,诱变处理的为C2。挑选致死率T > 90%处理的突变株进行初步筛选。
初筛:将颜色较深的突变株用灭菌牙签挑接到96微孔板中,微孔板中装200 μL灭过菌的小球藻液体培养基M1,光照培养7 d,用酶标仪测590 nm处的吸光度值,以未诱变的为对照,对照藻株接6株,以吸光度值最高的作为对照。挑取吸光度值大于对照的藻株,转接到装有10 mL M1液体培养基的试管中,光照培养7 d,测吸光度值,选取吸光度值高的藻株转接到含50 mL M1培养基的100 mL三角瓶中,光照培养6 d后测藻液浓度和吸光度值,初筛生物量高的藻株,培养期间每天摇动瓶3次。
复筛:由初筛的突变株进行继代培养,继代10代后,接种到M2培养基中光照培养,培养条件同上,6 d后取样测OD600值、干重、可溶性蛋白含量和总蛋白含量,筛选生物量高、蛋白含量高的突变株。
1.2.4 测定方法小球藻干重测定:将50 mL离心管于105 ℃烘箱中烘干至恒重,干燥器中冷却后记重W1,分3次加入150 mL藻液进行离心(6 000 r/min,10 min),去除上清液,用蒸馏水40 mL洗涤3次,离心后去除上清液,藻泥105 ℃烘干至恒重,称重记为W2,干重W (g/L)计算公式为:
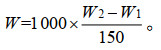
|
可溶性蛋白含量测定:取20 mL藻液6 000 r/min离心10 min,藻泥用去离子水洗涤2次后悬浮于20 mL 50 mmol/L pH 8.0的磷酸缓冲溶液中,用超声波细胞破碎仪进行细胞破碎(250 W,20 min,超声5 s,间歇1 s),细胞破碎液在50 ℃热水浴中提取1 h,提取液10 000 r/min离心20 min,取上清液10 μL,加入考马斯亮蓝G-250染色剂200 μL,利用96微孔板在黑暗条件下反应5 min,590 nm测定吸光度,换算可溶性蛋白浓度。
总蛋白质含量测定:藻细胞总蛋白质含量的测定采用凯氏定氮法,将离心烘干后的藻粉称重(约0.1 g),记录,放入消化管,加入催化片,加入10 mL浓硫酸,420 ℃消解1 h,晾至室温后,利用全自动凯氏定氮仪测定总蛋白质含量。
1.2.5 数据的处理与分析所有指标测定均进行3次重复实验,采用Origin 9.0软件进行数据统计分析和作图,显著性分析通过Duncan进行多重比较,系统发育树采用MEGA 7.0的Neighbor-Joining法构建。
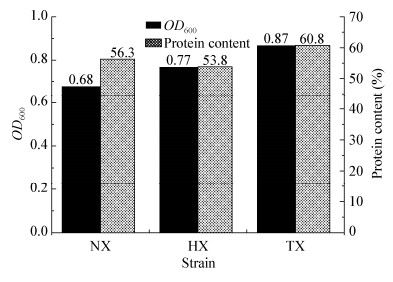
2 结果与分析 2.1 微藻藻株的分离与筛选从3个样品中共分离到60个分离株,经继代培养,从每个样品中挑选一个颜色较深、生长较快的藻株分别命名为NX、HX、TX。上述3株藻在液体培养基中培养1周后,OD600值分别为0.68、0.77、0.87 (图 1),蛋白含量分别为56.3%、53.8%和60.8%,TX的吸光度值和蛋白含量相对较高,选择TX用于后续试验。
|
| 图 1 分离筛选株的生长和蛋白含量 Figure 1 Growth and protein content of isolated and screened strain of Chlorella sp. |
|
|
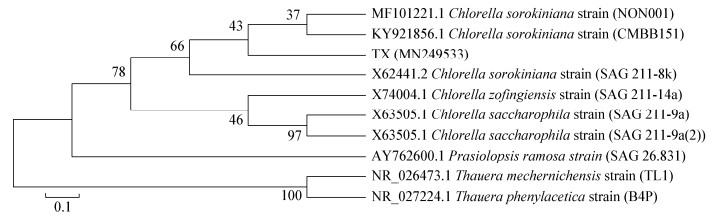
TX在BG11固体培养基上培养10 d后,可观察到直径为3−5 mm深绿色藻落,表面光滑,中间凸起。在光学显微镜下观察,细胞呈圆形,绿色,细胞直径4−8 μm。对TX的PCR产物进行测序,核酸序列长度为1 311 bp。序列提交至GenBank中获得登录号为MN249533,与数据库中已收录小球藻的18S rRNA基因进行BLAST分析,NCBI数据库BLAST搜索结果表明,TX与Chlorella sorokiniana的相似性为99%。将得到的序列采用MEGA 7.0的Neighbor-Joining法建立系统发育树,从图 2可知,TX与藻株MF101221.1 (GenBank登录号NON001)和KY921856.1 (GenBank登录号CMBB151)同处一个分支中,说明TX为Chlorella sorokiniana,与BLAST数据结果一致。
|
| 图 2 TX藻株基于18S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree based on 18S rRNA gene sequence of TX |
|
|
10 d后统计致死率,发现诱变1、2 min致死率分别为74.9%、98.9%,处理3、5、10 min的致死率均为100%,因此确定最佳的诱变剂量为20 W,距离10 cm,诱变处理2 min。从180个可能突变株中挑选21个OD600值高于对照且颜色较深的藻株,分别命名为Z1−Z21。在三角瓶中继代培养,发现21株中有3株基本不长,其中Z3、Z5、Z11、Z13、Z18、Z21的藻细胞浓度大于1.27×107 CFU/mL,其藻液的吸光度值也相对较高,均大于0.69 (表 1)。6株藻继代培养过程中,Z3和Z18发生回复突变,藻细胞生长较缓,颜色变浅,而Z5、Z11、Z13、Z21比较稳定,继代培养的颜色一直较深,选择此4个突变株用于后续生物量和蛋白含量筛选试验。
| Strains | Cell concentration (×107 CFU/mL) | OD600 |
| TX | 0.92±009 | 0.83±0.07 |
| Z3 | 2.97±0.12 | 1.20±0.11 |
| Z5 | 1.72±0.11 | 0.84±0.05 |
| Z11 | 1.27±0.11 | 0.69±0.02 |
| Z13 | 1.77±0.13 | 0.85±0.04 |
| Z18 | 1.52±0.15 | 0.90±0.03 |
| Z21 | 1.57±0.12 | 0.81±0.06 |
化学诱变10、20、30、40、50、60 min后的致死率分别为11.7%、33.6%、69.6%、91.3%、100%和100%。因此,化学诱变的最佳诱变剂量为0.8%的EMS诱变处理40 min。从180个可能突变株中挑选77个颜色较深且OD600值高于对照的突变株,分别命名为H1−H77,此77个突变株接种到试管中培养后筛选到16个突变株生长较好,将此16个突变株接种到三角瓶中筛选到6个生长较好的突变株(表 2)。6个突变株的细胞浓度均高于对照,OD值在0.79−0.98之间。6个突变株在继代培养中,H31发生了回复突变,H4、H10、H24、H27、H28比较稳定,用于后续蛋白含量筛选试验。
| Strains | Cell concentration (×107 CFU/mL) | OD600 |
| TX | 0.81±0.07 | 0.87±0.03 |
| H4 | 0.89±0.12 | 0.94±0.01 |
| H10 | 1.05±0.13 | 0.88±0.08 |
| H24 | 1.04±0.12 | 0.95±0.04 |
| H27 | 0.94±0.11 | 0.79±0.06 |
| H28 | 1.19±0.09 | 0.98±0.03 |
| H31 | 0.84±0.10 | 0.86±0.06 |
复合诱变从180个可能突变株中挑选到21株生长较好的藻株,经过两次继代培养筛选到8株较好的藻株编号为F1−F8。从表 3可知,F1、F2、F4、F5、F7的OD600值达到1.02以上,细胞浓度达到1.07×107 CUF/mL以上,高于其他突变株,此5个突变株的藻细胞浓度也相对较高。5个突变株在继代培养中,F7出现回复突变,F1、F2、F4、F5比较稳定,用于后续蛋白含量筛选试验。
| Strains | Cell concentration (×107 CFU/mL) | OD600 |
| TX | 0.87±0.07 | 0.81±0.03 |
| F1 | 1.45±0.11 | 1.16±0.03 |
| F2 | 1.22±0.10 | 1.03±0.07 |
| F3 | 0.98±0.12 | 0.85±0.04 |
| F4 | 1.07±0.09 | 1.03±0.04 |
| F5 | 1.22±0.11 | 1.07±0.05 |
| F6 | 1.00±0.13 | 0.96±0.08 |
| F7 | 1.12±0.10 | 1.02±0.05 |
| F8 | 0.93±0.09 | 0.94±0.06 |
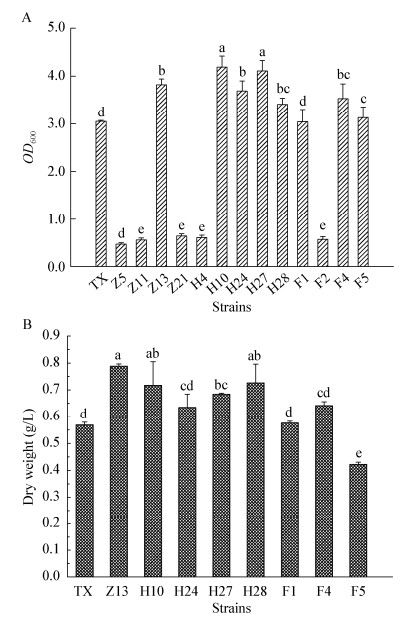
从图 3可知,所选的13个突变株中OD600值大于3.1的突变株有8株,其中Z13、H10、H24、H27、H28、F4这6个突变株的OD600值显著高于对照TX。大部分突变株的OD600值达到3.0以上,显著高于诱变初筛时的OD600值1.0左右,主要原因是初筛和复筛用的培养基不同,复筛用的培养基M2中含葡萄糖,是一种混养培养基,这说明部分诱变的突变株能进行混养生长,且混养生长显著优于自养生长。
|
| 图 3 突变株的OD600值(A)和干重(B) Figure 3 The OD600 value (A) and dry weight (B) of mutants Note: The different lowercase letters indicate significant difference (P < 0.05). |
|
|
从干重结果分析,Z13、H10、H27、H28的干重显著高于对照,分别达到0.79、0.72、0.68、0.73 g/L,较对照的0.57 g/L提高了38.7%、26.2%、20.3%和27.7%,其中Z13干重最高,达0.79 g/L。整体而言,OD600值高的藻株其干重相对也比较高。在培养条件、接种量和培养时间也一致的情况下,生物量高说明其生长相对较快,依此推断Z13、H10、H27、H28生长相对较快。
2.4.2 蛋白含量分析除反刍动物外,食物蛋白质几乎是唯一可用于动物蛋白质合成的氮来源,在动物的生命活动中具有重要的营养作用[12],因此饲料蛋白含量直接关系到饲料质量。从图 4可知,选育的小球藻可溶性蛋白含量在0.29−0.44 g/L之间,Z13、H10、H27和F10的可溶性蛋白高于对照,其中H10的可溶性蛋白含量较对照提高了15.8%,显著高于其他藻株。自然选育的藻株TX本身的总蛋白含量高达到60.8%,高于饲料常用的酵母蛋白含量,说明该藻株本身是一株优质的高蛋白饵料藻种资源。TX诱变的突变株H10、H24、H27、F4和F5的总蛋白含量高达64.2%、61.8%、63.3%、61.7%、61.5%,其中H10的总蛋白含量较原始藻株TX提高了3.4%。
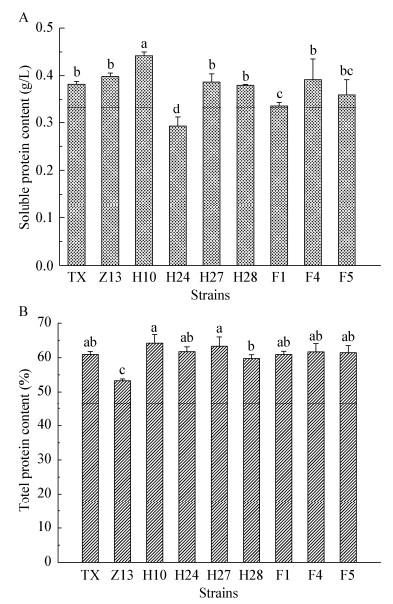
|
| 图 4 突变株的可溶性蛋白(A)和总蛋白含量(B) Figure 4 The soluble protein (A) and total protein (B) content of mutants Note: The different lowercase letters indicate significant difference (P < 0.05) |
|
|
H10的生物量干重、可溶性蛋白含量、总蛋白含量分别较对照提高26.2%、15.8%和3.4%,综合生长指标和蛋白指标,H10为较优异的突变株,且经过了10代继代培养,说明其优良性状得到了稳定遗传,该突变株可用于天然饵料生产。
3 讨论与结论诱变育种是微生物育种中常用和有效的方法之一,但诱变育种的后期筛选工作量大,因此选择高效的筛选方法至关重要[19]。96孔微孔板透光性高、加样量少(只需200 μL)、通量大(一个板可接96个藻株)。本研究采用96孔板对突变株进行高通量筛选,大大节省了工作量、节约了资源。小球藻自养生长需要光照,在相同培养条件下生物量、吸光度值和生长速率成正比,生长快,其生物量高,吸光度值也就高。因此本研究在初筛时选择96孔板测定590 nm处的吸光度值筛选生长快的藻株,方法科学可行。
小球藻在自养条件下的蛋白含量一般在50%左右,而异养培养的蛋白含量一般只有30%左右[20]。研究表明小球藻混养培养的蛋白产率可达500 g/kg干重,含量达到50%[21]。本研究自然选育的小球藻TX在混养条件下的蛋白含量高达60.8%,高于张学成等[13]报道的突变株Q7蛋白含量的58.73%,且在混养条件下生物量显著高于自养生长。
本研究540个可能突变株中筛选到4个突变株干重显著高于对照,5个突变株的总蛋白含量高于对照,其中H10的生物量干重达0.72 g/L,可溶性蛋白含量达0.44 g/L,总蛋白含量达64.2%,分别较出发藻株提高了26.2%、15.8%和3.4%,且能稳定遗传,说明该突变株可用于天然饵料生产。
本研究中虽然藻细胞浓度比较高,OD600值达到3.1以上,但生物量总体较低,可能是选育的藻株细胞比较小,也有可能取样点为培养的第6天,藻生长还未到达稳定期,生物量未达到最高。在后期的试验中可以做一个突变株H10的生长曲线,以确定最佳的收获时期。另外,可以将蛋白含量高的H10和生长快的Z13的原生质体进行融合,选育生长快且蛋白含量高的融合子。
| [1] |
Liu J, Chen F. Biology and industrial applications of Chlorella: advances and prospects[A]//Posten C, Chen SF. Microalgae Biotechnology[M]. Cham: Springer, 2014: 1-35
|
| [2] |
Peng AH, Gao S, Chen J, et al. Optimization of culture condition for high density of Chlorella sp.[J]. Journal of Jimei University (Natural Science),, 2016, 21(4): 247-254. (in Chinese) 彭爱红, 高爽, 陈俊, 等. 海洋小球藻(Chlorella sp.)高密度培养条件优化研究[J]. 集美大学学报:自然科学版, 2016, 21(4): 247-254. |
| [3] |
Xia S, Wan LL, Li AF, et al. Research and development of commercial biomass products and bioactive compounds of microalgae[J]. Natural Product Research and Development, 2014, 26(3): 463-469, 453. (in Chinese) 夏嵩, 万凌琳, 李爱芬, 等. 微藻生物质产品和生物活性物质的研究与开发[J]. 天然产物研究与开发, 2014, 26(3): 463-469, 453. |
| [4] |
Peng J, Wang Y, Xiang WZ, et al. Effects of different culture media on the growth and production of astaxanthin by Chlorella zofingiensis[J]. Journal of Tropical Oceanography, 2010, 29(3): 61-64. (in Chinese) 彭娟, 王艳, 向文洲, 等. 不同培养基对小球藻Chlorella zofingiensis生长和虾青素产量的影响[J]. 热带海洋学报, 2010, 29(3): 61-64. |
| [5] |
Luo LY, Li JY, Chen Z, et al. Research progress in the application of aquatic animal feed of Chlorella[J]. Cereal & Feed Industry, 2016(6): 55-57, 61. (in Chinese) 罗柳茵, 李家泳, 陈卓, 等. 小球藻在水产动物饲料中的应用研究进展[J]. 粮食与饲料工业, 2016(6): 55-57, 61. |
| [6] |
Kang JH, Cao AL. The practical discussion of Chlorella suspension and golden-brown algae feed on small tail cold sheep[J]. Gansu Animal and Veterinary Sciences, 2016, 46(5): 102-103. (in Chinese) 康金海, 曹爱玲. 小球藻悬浮液金藻液养殖小尾寒羊的实践探讨[J]. 甘肃畜牧兽医, 2016, 46(5): 102-103. |
| [7] |
Øie G, Makridis P, Reitan K, et al. Protein and carbon utilization of rotifers (Brachionus plicatilis) in first feeding of turbot larvae (Scophthalmus maximus L.)[J]. Aquaculture, 1997, 153(1/2): 103-122. |
| [8] |
Cai R, Hu Y, Sun YP, et al. Effects of ethanol extract from Chlorella vulgaris on growth, body composition, serum biochemical indices and digestive enzymes activities of Lateolabrax japonicas[J]. Feed Industry, 2017, 38(6): 23-29. (in Chinese) 蔡荣, 胡毅, 孙育平, 等. 饲料中添加小球藻醇提物对花鲈幼鱼生长、体组成、血清生化指标及消化酶活的影响[J]. 饲料工业, 2017, 38(6): 23-29. |
| [9] |
Zhang JP, Guo ZL. Reduction of the concentration of nitrite in cultivation water of Litopenaeus vannamei by Chlorella[J]. Fisheries Science, 2006, 25(4): 517-519. (in Chinese) 张继平, 郭照良. 小球藻对降低南美白对虾养殖水体中亚硝酸盐氮含量的研究[J]. 水产科学, 2006, 25(4): 517-519. |
| [10] |
Wang L, Min M, Li YC, et al. Cultivation of green algae Chlorella sp. in different wastewaters from municipal wastewater treatment plant[J]. Applied Biochemistry and Biotechnology, 2010, 162(4): 1174-1186. |
| [11] |
Zhou M, Tang HY, Jia XP, et al. Study on the treatment of ammonia nitrogen in aquacultural wastewater by the immobilized algal-bacterial system[J]. Industrial Water Treatment, 2016, 36(8): 20-23. (in Chinese) 周鸣, 汤红妍, 贾晓平, 等. 固化菌藻系统处理养殖废水中氨氮的研究[J]. 工业水处理, 2016, 36(8): 20-23. |
| [12] |
Mai KS. Nutrition and Feed of Aquatic Animals[M]. 2nd ed. Beijing: China Agriculture Press, 2011: 13. (in Chinese) 麦康森. 水产动物营养与饲料学[M]. 2版. 北京: 中国农业出版社, 2011: 13. |
| [13] |
Zhang XC, Shi YX, Meng Z. The UV-Irradiation of Chlorella. vulgaris Beijerinck and screening of productive strain[J]. Periodical of Ocean University of China, 2007, 37(5): 749-753. (in Chinese) 张学成, 时艳侠, 孟振. 小球藻紫外线诱变及高产藻株筛选[J]. 中国海洋大学学报, 2007, 37(5): 749-753. |
| [14] |
Tu RJ, Jin WB, Wang M, et al. Improving of lipid productivity of the biodiesel promising green microalga Chlorella pyrenoidosa via low-energy ion implantation[J]. Journal of Applied Phycology, 2016, 28(4): 2159-2166. |
| [15] |
Wei ZJ, Li X, Wang HN, et al. Screening of high oil-producing Chlorella vulgaris by low-temperature plasma mutation[J]. China Oils and Fats, 2019, 44(7): 117-121, 127. (in Chinese) 卫治金, 李晓, 王皓楠, 等. 高产油小球藻的低温等离子体诱变育种[J]. 中国油脂, 2019, 44(7): 117-121, 127. |
| [16] |
Liu HQ, Lin XY, Pan YH. EMS mutagenesis of Chlorella and the conditions of producing EPA research[J]. Guihaia, 2016, 36(3): 355-360. (in Chinese) 刘红全, 林小园, 潘艺华. 小球藻的甲基磺酸乙酯诱变及产EPA的条件研究[J]. 广西植物, 2016, 36(3): 355-360. |
| [17] |
Shao B, Wang ZP, Liu XY, et al. Breeding of a Chlorella strain with high yield of polysaccharide and its effect on growth and immunoregulation of Litopenaeus vannamei[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(2): 168-172. (in Chinese) 邵斌, 汪志平, 刘新颖, 等. 高产多糖小球藻新品系选育及其对南美白对虾的促生长和免疫调节作用[J]. 核农学报, 2013, 27(2): 168-172. |
| [18] |
Xie FX, Zhou K, Zhang FF, et al. Culture medium optimization and nitrogen removal effect of Chlorella sp.[J]. Journal of Tianjin Normal University (Natural Science Edition), 2019, 39(5): 51-66. (in Chinese) 谢凤行, 周可, 张峰峰, 等. 小球藻培养基优化及脱氮效果[J]. 天津师范大学学报:自然科学版, 2019, 39(5): 51-56. |
| [19] |
Zheng LX, Zhang DW. Isolation and identification of a heterotrophic nitrifying bacterium and its mutation breeding by UV-irradiation[J]. Biotechnology Bulletin, 2013(12): 184-188. (in Chinese) 郑丽侠, 张大伟. 一株异养硝化细菌的分离鉴定及紫外诱变育种[J]. 生物技术通报, 2013(12): 184-188. |
| [20] |
Li XR, Wang WR, Zhang YK, et al. Effect of nitrogen concentrations on growth and protein content of heterotrophic microalgae[J]. Science and Technology of Food Industry, 2012, 33(8): 222-224. (in Chinese) 李兴锐, 王文睿, 张永奎, 等. 氮浓度对异养小球藻生长及蛋白质含量的影响[J]. 食品工业科技, 2012, 33(8): 222-224. |
| [21] |
Silvia S, D'Imporzano G, Barbara M, et al. Mixotrophic cultivation of Chlorella for local protein production using agro-food by-products[J]. Bioresource Technology, 2017, 230: 82-89. |
 2020, Vol. 47
2020, Vol. 47




