扩展功能
文章信息
- 李浩然, 祁晶晶, 王宇, 尚原冰, 王桂军, 于圣青
- LI Hao-Ran, QI Jing-Jing, WANG Yu, SHANG Yuan-Bing, WANG Gui-Jun, YU Sheng-Qing
- 滑液支原体NADH氧化酶的酶学活性及亚细胞定位研究
- Enzymatic activity and subcellular localization analyses of the NADH oxidase in Mycoplasma synoviae
- 微生物学通报, 2020, 47(3): 801-812
- Microbiology China, 2020, 47(3): 801-812
- DOI: 10.13344/j.microbiol.china.190591
-
文章历史
- 收稿日期: 2019-08-06
- 接受日期: 2019-11-28
- 网络首发日期: 2019-12-13
2. 中国农业科学院上海兽医研究所 上海 200241;
3. 锦州医科大学畜牧兽医学院 辽宁 锦州 121000
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences (CAAS), Shanghai 200241, China;
3. College of Veterinary, Jinzhou Medical University, Jinzhou, Liaoning 121000, China
滑液支原体(Mycoplasma synoviae,MS)是感染禽类的一种重要的致病性支原体,目前已知对禽类致病的支原体约有28种,其中危害较为严重的主要有鸡毒支原体、滑液支原体、火鸡支原体等[1-2]。MS感染主要引起家禽关节炎、滑膜炎、气囊炎、生殖道炎[3-4],可导致病鸡明显的跛行,生长发育迟缓、产蛋量下降等[5],是造成全球肉鸡行业经济损失的主要原因之一。此外,MS感染可引起免疫抑制,并因此导致其他呼吸道病原(如新城疫病毒、传染性支气管炎病毒、传染性法氏囊病毒、大肠杆菌及葡萄球菌等)的混合或继发感染[6]。近年来,国内禽支原体流行态势加剧,尤其是MS感染对养殖业的威胁越来越大[7],而我国关于滑液囊支原体的防控基础相对薄弱,MS的致病机制也有待于进一步研究。
MS主要是通过黏附宿主细胞表面因子,再入侵到宿主细胞内部,从而导致宿主发病[8]。MS的一些糖酵解代谢酶类被证实不仅分布在胞浆中发挥生物酶学功能,也在MS膜表面有少量分布,发挥黏附宿主细胞的功能,如烯醇化酶(enolase,Eno)[9]、丙酮酸脱羧酶(pyruvate decarboxylase,PDC)的α亚基(PDCA)和β亚基(PDCB)[10]、乳酸脱氢酶(lactate dehydrogenase,LDH)[11]等。NADH氧化酶(NADH oxidase,NOX)是一种氧化还原酶,在O2存在下能催化NADH氧化为NAD+,同时O2还原为H2O或H2O2[12]。NOX来源菌可分为需氧菌和厌氧或兼性厌氧菌两类,前者的产物主要是H2O2,NOX在膜上或胞内均有分布;另一类中大部分是乳酸菌,产物主要为H2O,NOX在胞内分布[13]。有研究表明,牛支原体和无乳支原体均能在催化NADH生成NAD+的过程中产生H2O2[14]。Zhao等[15]研究发现牛支原体的NOX在膜和胞浆中均有分布,能产生H2O2,且能黏附宿主细胞,牛支原体NOX突变株对胚胎牛肺细胞的黏附能力显著下降。Berčič等[16]通过SDS-PAGE电泳结合N末端测序法鉴定出了包括NOX在内的一系列MS主要免疫原性蛋白。此后,包世俊等[17]通过将提取的MS膜蛋白进行二维电泳及免疫印迹分析,结合质谱鉴定,筛选到NOX是MS具有免疫原性的膜蛋白,但他们均未对筛选结果进一步验证。本研究将对MS WVU1853株NOX蛋白进行原核表达纯化,并分析其酶学活性、亚细胞定位及免疫反应性,为进一步研究MSNOX的生物学功能奠定研究基础。
1 材料与方法 1.1 材料MS WVU1853菌株购自中国兽医微生物菌种保藏中心(保藏编号:CVCC385);大肠杆菌(E. coli) DH5α和BL21(DE3)感受态细胞购自北京天根生化科技有限公司。
支原体基础培养基,青岛海博生物技术有限公司;烟酰胺腺嘌呤二核苷酸(NAD),Roche公司;猪血清,HyClone公司;胰蛋白胨、酵母提取物、琼脂,Oxoid公司;MS液体培养基:称取33.0 g支原体基础培养基溶解于1 000 mL去离子水中,1×105 Pa灭菌15 min,冷却至室温,无菌操作添加0.1% NAD和10%猪血清;LB液体培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 5.0;LB固体培养基:LB液体培养基在高压灭菌前再添加琼脂15.0 g/L,1×105 Pa灭菌15 min。
还原型辅酶I二钠盐(NADH)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒,上海碧云天生物技术公司;细菌基因组DNA提取试剂盒,北京天根生化科技有限公司;Prime STAR DNA聚合酶,TaKaRa公司;2×Taq Master Mix,北京康为世纪生物科技有限公司;表达载体pET-28a(+),Novagen公司;BeaverBeadsTM His-Tag蛋白纯化试剂盒,Selleck公司;膜蛋白和胞浆蛋白提取试剂盒,上海贝博生物公司;弗氏完全佐剂和弗氏不完全佐剂,Sigma-Aldrich公司;ECL化学发光试剂盒,上海圣尔生物科技有限公司;MS阳性鸡血清、SPF鸡阴性血清,中国兽医药品监察所;HRP标记羊抗兔IgG二抗,Thermo Fisher Scientific公司;HRP标记的羊抗鸡IgY二抗,Abcam公司;新西兰兔,上海松联实验动物场。
PCR仪,ABI公司;DNA电泳仪、凝胶成像系统、全自动化学发光测定仪,上海天能科技有限公司;微量电子天平,奥豪斯仪器有限公司;BioSpectrometer分光光度计、高速台式离心机,Eppendorf公司;恒温培养摇床,北京创新思成公司;NanoDrop微量分光光度计,Thermo Fisher Scientific公司;蛋白电泳仪、转印槽,Bio-Rad公司。
1.2 生物信息学分析登录GenBank数据库,从该数据库中查找MS WVU1853株NOX蛋白的氨基酸序列,将获取的NOX蛋白的氨基酸序列上传至在线分析软件SignalP 4.1 Sever (http://www.cbs.dtu.dk/services/SignalP/)、TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM/),分别预测NOX蛋白的信号肽以及该蛋白的跨膜区;用BLASTp检索non-redundant protein sequences (nr)数据库,分析MSNOX氨基酸序列与其他病原菌来源NOX的同源性,并用DNAStar中的MegAlign软件进行序列比对分析。将MSNOX蛋白与已解析晶体结构的肺炎链球菌(Streptococcus pneumonia,S. pneumonia) NOX蛋白(Protein Data Bank accession code: 2BC0)[18],已进行功能鉴定的牛支原体(Mycoplasma bovis,M. bovis) NOX蛋白[15],以及已解析序列特征的山羊支原体(Mycoplasma capricolum,M. capricolum) NOX蛋白[19]进行序列比对分析,预测MSNOX蛋白的活性位点。
1.3 MS全基因组提取从−80 ℃冰箱取出冻存的MS WVU1853菌株,按5%比例转接至MS液体培养基,于培养箱(37 ℃、5% CO2)中静置培养,待支原体培养基变黄后8 000 r/min离心10 min收集菌体,PBS清洗2遍后,用细菌基因组DNA提取试剂盒抽提MS WVU1853的基因组,然后用微量分光光度计测定基因组DNA浓度,并于−20 ℃保存备用。
1.4 Overlap PCR扩增MSnox基因根据MS WVU1853 (CP011096.1)的nox基因(VY93_02845)序列设计4对引物(表 1),以提取的MS WVU1853基因组DNA为模板,分别进行第一轮PCR扩增获得MSnox各个片段。将获得的各个片段回收后,混合作为模板,用两端引物(MSnox 1F和MSnox 4R)进行第二轮PCR扩增。PCR反应体系:2×Prime STAR MAX Premix 20 μL,上、下游引物各1 μL (0.4 μmol/L),MS WVU1853基因组DNA模板1 μL (100 ng),ddH2O补足至40 μL。PCR反应条件:98 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min;16 ℃ 10 min。将扩增得到的产物进行琼脂糖凝胶电泳检测,确认大小与预期相符后切胶回收,即为MSnox基因全长序列。
| 引物名称 Primer names |
引物序列 Primer sequences (5′→3′) |
产物长度 Product lengths (bp) |
| MS nox 1F | GGATCCATGGAAAACAATAAAATTATAG | 154 |
| MS nox 1R | AACATTCCTCCAACCCAAACAG | |
| MS nox 2F | GCTGTTTGGGTTGGAGGAATG | 226 |
| MS nox 2R | ATGGAGGAACTATAGGCCATGTTC | |
| MS nox 3F | GCTGGAGGAACATGGCCTATAG | 869 |
| MS nox 3R | AATCTTGTCCCCAAGAACCAAC | |
| MS nox 4F | CAAGTTGGTTCTTGGGGACAAG | 182 |
| MS nox 4R | CTCGAG TTAAGCTTTATATTTTAAACC | |
| 注:下划线为BamH I和Xho I酶切位点序列;加粗代表突变位点. Note: The restriction enzyme sites of BamH I and Xho I were underlined; the mutated nucleotides were in bold. | ||
将扩增获得的MSnox基因全长与表达载体pET-28a(+)经BamH I和Xho I双酶切后用T4 DNA连接酶连接,并将连接产物转化至E. coli DH5α感受态细胞中,将转化后的E. coli DH5α感受态细胞涂布于含50 μg/mL卡那霉素的LB平板上,37 ℃静置培养12 h后,挑取平板上单菌落至含100 μg/mL卡那霉素的LB液体培养基中进行扩大培养并进行菌液PCR鉴定。PCR体系:2×Taq Master Mix 10 μL,上、下游引物MSnox 1F、MSnox 4R各1 μL (0.4 μmol/L),菌液2 μL,ddH2O补足至20 μL。PCR反应条件:98 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 10 min;16 ℃ 10 min。鉴定正确的单菌落扩大培养后,使用高纯度质粒小提中量试剂盒提取质粒,经BamH I和Xho I双酶切鉴定后,送上海睿勉生物科技有限公司进行测序,测序结果无误后,将pET-28a-MSnox转化至E. coli BL21(DE3)感受态细胞中,PCR鉴定结果正确后,保存于−80 ℃冰箱中。
1.6 重组蛋白的表达与纯化将鉴定正确的重组菌株E. coli BL21(pET-28a- MSnox)按照1%比例转接于LB培养基中(含卡那霉素50 μg/mL),37 ℃、220 r/min振荡培养至菌液浓度OD600值为0.6−0.8,将IPTG (50 μg/mL)按0.1%接入菌液中,37 ℃、220 r/min诱导8 h。经IPTG诱导后的菌液用PBS洗涤2次后,用Binding buffer (20 mmol/L K3PO4,500 mmol/L NaCl,30 mmol/L咪唑)重悬。重悬的菌液经超声(功率60 W,工作3 s,间歇2 s) 30 min破碎后,即为全菌总蛋白。将全菌总蛋白4 ℃、8 000 r/min离心10 min后收集上清,即为上清蛋白。上清蛋白经BeaverBeadsTM His-Tag蛋白纯化试剂盒纯化后,获得纯化的重组MSNOX (rMSNOX)蛋白,用BCA蛋白浓度测定试剂盒检测蛋白浓度。
1.7 rMSNOX蛋白酶促活性与影响因素的测定 1.7.1 NADH紫外吸光值标准曲线的测定用微量电子天平称量0.764 g NADH粉末溶于10 mL去离子水,即成0.1 mol/L NADH标准液。用0.1 mol/L K3PO4缓冲液(pH 7.5)将NADH标准液稀释至100、200、300、400、500、600、700 μmol/L工作浓度,用BioSpectrometer分光光度计测量其在OD340的吸光值,以NADH溶液浓度(μmol/L)为横坐标、OD340吸光值为纵坐标,绘制标准曲线。
1.7.2 rMSNOX的酶活性测定酶活测定体系(200 μL):25 ℃条件下,在0.1 mol/L K3PO4缓冲液(pH 7.5)中加入底物NADH至终浓度为1 mmol/L,再加入新鲜制备的纯化rMSNOX蛋白(终浓度分别为0.3、0.6、1.2、1.8、2.4和3.0 μg/mL),每隔5 min测量OD340值。同时设置不加rMSNOX蛋白、不加NADH的对照组,其他反应条件不变。国际单位(IU)的酶活定义为最适条件下(温度25 ℃)每1 min转换1 μmol底物所需的酶活力[20],根据该定义,推导rMSNOX的酶比活力(IU/mg)计算公式:

|
在pH 7.5条件下,分别测定4、25、37、42、56 ℃时rMSNOX的酶学活性,每个温度重复3次。
1.7.4 pH对rMSNOX酶学活性的影响在25 ℃条件下,分别测定pH为4.0、6.0、6.5、7.0、7.5、8.0、9.0及10.0时rMSNOX的酶学活性,每个pH重复3次。
1.7.5 底物浓度对rMSNOX酶学活性的影响在上述试验确定的最适温度和pH条件下,分别测定1.8 μg/mL的rMSNOX在不同NADH底物浓度(100、200、300、400、500、600、700 μmol/L)下的反应速率。记录酶催化反应体系在不同NADH底物浓度(S)下,1 min内OD340值的变化数据,依据NADH紫外吸光值标准曲线中OD340值与NADH浓度(μmol/mL)之间线性关系,得到在相应时间内NADH浓度的变化值,进而计算出不同S时的反应速率v。根据Lineweaver-Burk双倒数作图法,米氏方程公式v=Vmax·S/(Km+S)双倒数法转化为1/v =Km/ Vmax·1/S+1/Vmax、1/v和1/S呈线性关系[16]。以1/S为横坐标,1/v为纵坐标作图,获得双倒数曲线,进而计算最大反应速度Vmax和米氏常数Km值。
1.8 NOX蛋白的免疫原性鉴定将纯化的rMSNOX蛋白按0.5 μg每孔上样,进行SDS-PAGE电泳,转印后的NC膜用5%脱脂乳4 ℃封闭过夜,经PBST (PBS溶液中添加0.05% Tween-20)洗涤3次后,分别与MS阳性鸡血清(1:1 000)或SPF鸡阴性血清(1:1 000)常温孵育1 h,PBST洗涤3次后,用HRP标记的羊抗鸡IgY抗体(1:5 000)常温孵育1 h,PBST洗涤3次后,加入ECL底物显色液进行显色反应。
1.9 抗rMSNOX兔多克隆抗体制备准备2月龄新西兰兔1只,在免疫前对其进行耳缘静脉采血,分离免疫前兔血清;然后取600 μg的rMSNOX纯化蛋白与等体积的弗氏完全佐剂乳化,对该兔进行背部皮下多点免疫;此后每隔2周加强免疫一次,加强免疫用的rMSNOX蛋白剂量为300 μg/只,与等体积弗氏不完全佐剂乳化。在第二次加强免疫后2周对兔子进行耳缘静脉采血,分离血清,即为抗rMSNOX兔血清,用基于rMSNOX包被的间接ELISA法[9]测定其抗体效价,达到1:20 480分装后保存于−20 ℃。
1.10 MS全菌蛋白、膜蛋白、胞浆蛋白的制备将MS WVU1853菌液培养至对数生长后期,8 000 r/min离心15 min收集菌体,弃去上清后PBS洗2遍,接着用膜蛋白和胞浆蛋白提取试剂盒分别提取MS的膜蛋白和胞浆蛋白。将洗涤后的MS菌体沉淀用PBS重悬,超声破碎(功率60 W,每次2 s,间隔1 s),制备MS全菌蛋白。用BCA试剂盒测出制备蛋白的浓度,−80 ℃分装保存。
1.11 NOX蛋白在MS中的亚细胞定位分析将制备的MS全菌蛋白、膜蛋白和胞浆蛋白按照10 μg每孔进行SDS-PAGE电泳,转印NC膜后,分别与抗rMSNOX兔血清(1:5 000)、抗rMSFBA兔血清(由本实验室制备的胞浆蛋白对照血清,1:5 000)[21]进行Western blotting反应,方法同1.8,用HRP标记的羊抗兔IgG抗体(1:20 000)作为二抗,最后用ECL显色液显色。
2 结果与分析 2.1 生物信息学分析经TMHMM Server V2.0和SignalP 4.1 Sever预测,MSNOX蛋白无跨膜区,无信号肽,包含了458个氨基酸。通过BLASTp将MSNOX蛋白序列比对nr数据库,结果显示NOX蛋白序列在MS种属内高度保守,在不同MS分离株之间相似性高达99%,而与其他支原体NOX蛋白序列相似性差异较大(48%−72%),与禽支原体(Mycoplasma gallinaceum,M. gallinaceum)的相似性最高达72%,与鸡毒支原体(Mycoplasma gallisepticum,M. gallisepticum)的NOX蛋白相似性仅为49%。用MegAlign将MS的NOX序列与S. pneumonia[18]、M. bovis[15]及M. capricolum[19]的NOX序列进行比对,同时与M. gallisepticum的NOX蛋白序列比较,发现它们均具有相同的催化位点(Cys46),两个FAD结合位点(Gly11−Gly16;Ile292−Asp302)和一个NADH结合位点(Gly174−Gly179) (图 1)。
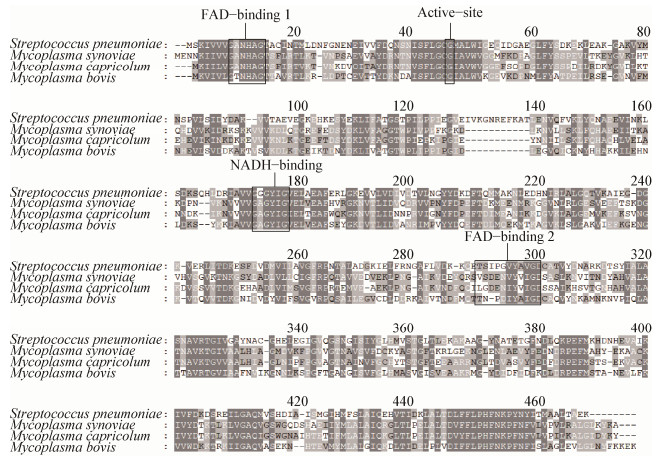
|
| 图 1 不同NOX蛋白的序列比对 Figure 1 Sequence alignment of different NOX proteins |
|
|
以MS WVU1853株的基因组DNA为模板,根据设计的4对引物进行第一轮PCR扩增,获得大小正确的4个片段(图 2A),将获得的4个片段混合作为模板,经第二轮Overlap PCR得到完整的MSnox基因片段,其大小为1 377 bp (图 2B)。
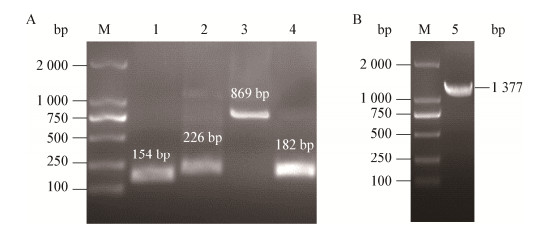
|
| 图 2 重叠延伸PCR扩增MSnox基因 Figure 2 Overlap PCR amplification of MSnox gene 注:M:DNA分子标准DL2000;1:MSnox 1F/1R扩增产物;2:MSnox 2F/2R扩增产物;3:MSnox 3F/3R扩增产物;4:MSnox 4F/4R扩增产物;5:MSnox基因全长. Note: M: DL2000 DNA Marker; 1: PCR product with primers MSnox 1F/1R; 2: PCR product with primers MSnox 2F/2R; 3: PCR product with primers MSnox 3F/3R; 4: PCR product with primers MSnox 4F/4R; 5: Full−length of MSnox gene. |
|
|
将获得的MSnox基因全长序列经双酶切后,连接至表达载体pET-28a(+),并转化E. coli DH5α感受态细胞。在抗性平板上挑取重组菌,将PCR鉴定为阳性的菌抽提重组质粒,双酶切鉴定结果见图 3A。测序结果显示重组质粒序列完全正确,表明成功获得重组表达载体pET-28a-MSnox。将重组载体转化至E. coli BL21 (DE3)感受态细胞中,菌液PCR鉴定正确(图 3B),所挑取的5株单克隆均鉴定为阳性。
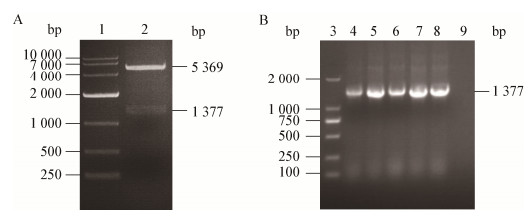
|
| 图 3 重组菌的双酶切鉴定及PCR鉴定 Figure 3 Identification of recombinant bacteria by double enzyme digestion and PCR amplification Note: 1: DL10000 DNA Marker; 2: Double enzyme digestion product of pET-28a-MSnox; 3: DL2000 DNA Marker; 4−8: PCR amplification of E. coli BL21(pET-28a-MSnox) samples; 9: Negative control (ddH2O). Note: 1: DL10000 DNA Marker; 2: Double enzyme digestion product of pET-28a-MSnox; 3: DL2000 DNA Marker; 4−8: PCR amplification of E. coli BL21(pET-28a-MSnox) samples; 9: Negative control (ddH2O). |
|
|
将重组表达菌株E. coli BL21(pET-28a-MSnox)经IPTG诱导前的全菌蛋白、诱导后的全菌蛋白、诱导后的上清蛋白以及经His-tag标记磁珠纯化的重组蛋白进行SDS-PAGE电泳分析,结果显示重组表达菌株经IPTG诱导后,在53 kD左右有明显的蛋白表达条带,经纯化后的rMSNOX蛋白条带较纯(图 4)。
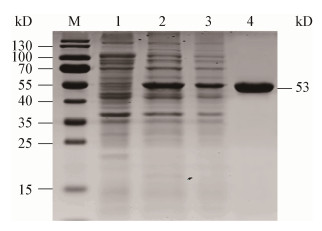
|
| 图 4 rMSNOX蛋白表达和纯化的SDS-PAGE分析 Figure 4 SDS-PAGE analysis of expression and purification of rMSNOX protein 注:M:蛋白质分子质量标准;1:重组表达菌株经IPTG诱导前全菌蛋白;2:经IPTG诱导后全菌蛋白;3:诱导后上清蛋白;4:纯化的rMSNOX蛋白. Note: M: Protein marker; 1: Whole cell lysates of E. coli BL21(pET-28a-MSnox) before IPTG induced; 2: Whole cell lysates of E. coli BL21(pET-28a-MSnox) after IPTG induced; 3: Supernatants from IPTG induced E. coli BL21(pET-28a-MSnox); 4: Purified rMSNOX protein. |
|
|
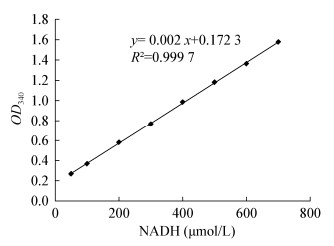
用底物反应液将NADH标准液稀释至不同工作浓度,并在OD340处测吸光值,以NADH浓度(μmol/L)为X轴,OD340值为Y轴,绘制标准曲线(图 5),二者之间的换算公式为:y=0.002x+0.172 3 (R2=0.999 7)。
|
| 图 5 NADH标准曲线图 Figure 5 The standard cure of NADH |
|
|
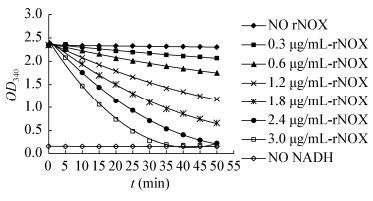
在K3PO4缓冲液pH 7.5、25 ℃条件下,加入rMSNOX后,OD340值随时间变化逐渐降低,随着rMSNOX浓度增大,OD340值降低越快,无rMSNOX对照组OD340值较稳定(图 6)。由此可见,rMSNOX蛋白能催化NADH生成NAD+,且在底物浓度不变的情况下,催化速度随着rMSNOX蛋白量的增加而加快。当rMSNOX蛋白在200 μL酶反应体系中的终浓度为1.8 μg/mL时,5 min内OD340变化值为0.255,根据图 5绘制的NADH标准曲线推得系数为0.002 L/μmol,将这些数据代入1.7.2中的酶比活计算公式,通过计算得知rMSNOX蛋白的酶比活力为14.17 IU/mg。
|
| 图 6 rMSNOX蛋白酶学活性检测 Figure 6 Analysis of enzyme activity of rMSNOX protein |
|
|
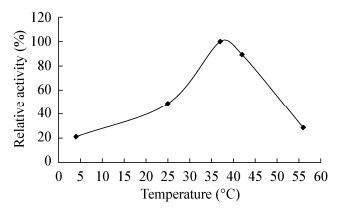
在磷酸钾缓冲液pH 7.5条件下,分别测定rMSNOX在4、25、37、42、56 ℃时,反应5 min内反应体系的OD340值变化。以最高酶活为100%,绘制温度对rMSNOX酶活的影响曲线(图 7),结果表明rMSNOX酶促反应最适温度为37 ℃,温度过高或过低都会降低rMSNOX酶活性。
|
| 图 7 温度对rMSNOX酶比活力的影响 Figure 7 Effect of temperature on rMSNOX specific activity |
|
|
在25 ℃条件下,分别测定pH为4.0、6.0、6.5、7.0、7.5、8.0、9.0及10.0时rMSNOX的酶学活性,以最高酶活为100%,绘制pH对rMSNOX酶活的影响曲线(图 8),结果表明:当磷酸钾缓冲液pH为7.5时,rMSNOX酶比活力最高,pH < 6.0或 > 9.0时酶比活力显著降低。

|
| 图 8 pH对rMSNOX酶比活力的影响 Figure 8 Effect of pH on rMSNOX specific activity |
|
|
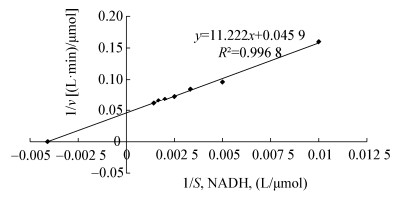
计算出rNOX酶在不同底物浓度(S)条件下的反应速率(v),以1/S为横坐标,1/v为纵坐标,通过Lineweaver-Burk双倒数作图法,得出双倒数曲线(图 9),公式为:y=11.22x+0.045 9 (R2=0.996 8),因而求得rNOX的最大反应速率Vmax为21.8 μmol/(L·min),米氏常数Km(NADH)为244.0 μmol/L。
|
| 图 9 双倒数曲线 Figure 9 The double reciprocal curve graph |
|
|
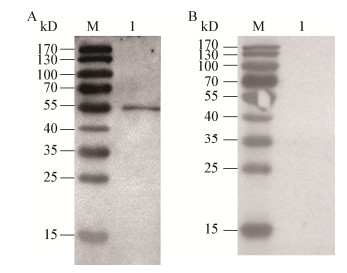
以MS阳性鸡血清作为一抗,以HRP标记的羊抗鸡IgY抗体作为二抗进行Western blotting分析,结果表明MS阳性鸡血清可与rMSNOX蛋白结合(图 10A),而SPF鸡阴性血清(阴性对照,图 10B)与rMSNOX蛋白未见反应条带,表明MSNOX蛋白具有良好的免疫原性。
|
| 图 10 rMSNOX蛋白免疫原性鉴定 Figure 10 Immunogenicity analysis of the rMSNOX protein 注:M:蛋白质分子质量标准;1:纯化的rMSNOX蛋白与MS阳性鸡血清反应;2:纯化的rMSNOX蛋白与SPF鸡阴性血清反应. Note: M: Protein marker; 1: Purified rMSNOX protein reacted with MS-positive chicken serum; 2: Purified rMSNOX protein reacted with negative serum of SPF chicken. |
|
|
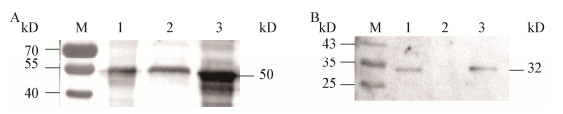
利用制备的抗rMSNOX兔血清与抗rMSFBA兔血清(胞浆蛋白抗血清对照)对MS WVU1853全菌蛋白、膜蛋白和胞浆蛋白进行Western blotting分析,结果显示:NOX蛋白在MS的细胞膜和细胞浆中均有分布,而FBA蛋白作为胞浆蛋白主要分布于MS胞浆中,细胞膜中未见分布,证明所制备的膜蛋白未被胞浆蛋白污染(图 11)。
|
| 图 11 Western blotting分析蛋白的亚细胞定位情况 Figure 11 Subcellular localization analysis by western blotting 注:A:MSNOX蛋白在MS中的亚细胞定位分析;B:MSFBA蛋白的亚细胞定位分析;M:蛋白分子质量标准;1:MS WVU1853全菌蛋白;2:MS WVU1853膜蛋白;3:MS WVU1853胞浆蛋白. Note: A: Subcellular localization analysis of the MSNOX; B: Subcellular localization analysis of the MSFBA; M: Protein marker; 1: Whole cell lysates of MS WVU1853; 2: Membrane proteins of MS WVU1853; 3: Cytoplasmic proteins of MS WVU1853. |
|
|
NOX位于多个调节途径交叉点上,本身也被多个途径调节,例如在细菌糖酵解过程中,NAD+转化为NADH,NOX将NADH转化为NAD+以维持NAD+/NADH的动态平衡,在糖酵解过程中起重要作用[22],因此通过对NOX酶学活性研究,有助于了解MS代谢机理。本研究对MS的NOX蛋白进行了原核表达纯化,并鉴定其酶学活性。结果表明,在初始底物(NADH)浓度一定时,rMSNOX的酶促反应速率随着酶浓度的增大而加快,随着催化反应的进行而逐渐减慢,这与一般酶的酶促反应动力学特征相一致。研究温度对rMSNOX酶活力的影响发现,随着温度升高,酶促反应逐渐加快,在37 ℃时,该酶的酶活力最高,随后随着温度继续升高,酶活力逐渐下降,造成这一结果的主要原因可能是温度影响了底物与辅基的结构或者是温度影响了酶的活性。在反应温度和反应体系不变的情况下,磷酸钾反应缓冲液pH对酶活性影响较大,试验发现磷酸钾缓冲液最适pH为7.5。在最适温度37 ℃和pH为7.5的条件下,通过双倒数作图法,求得rMSNOX酶促反应的最大反应速率Vmax为21.8 μmol/(L·min),即为当rMSNOX酶全部被底物饱和时的最大反应速率;求得米氏常数Km(NADH)为244.0 μmol/L,即为酶反应速率达到1/2 Vmax时的底物浓度。通过生物信息学分析发现,NOX在同种支原体内的保守性很高,氨基酸序列相似性高达99%,与其他支原体NOX蛋白相似性差异较大,在48%−72%之间,但它们均具有相对保守的活性位点、FAD结合位点以及NADH结合位点。由此可见,尽管NOX酶在不同种属的菌内序列差异较大,但其酶活相关的功能位点相对保守,是决定其催化NADH底物的关键位点。
有研究报道,牛支原体和无乳支原体不同分离株产H2O2的能力不同,体外连续传代的牛支原体其H2O2产量逐渐减少[15]。祁晶晶对牛支原体HB0801原代株和3株传代株(115、150和180代次)进行比较蛋白质组研究发现,至少从150代开始,M. bovis的NOX蛋白表达量显著降低[23]。另有研究报道,无胆淄原体培养物的细胞质膜催化NADH氧化的活性随培养时间而降低,进一步研究发现这是由于老化的支原体细胞质膜中酶的活性分子数量减少所致,并不是酶的性质发生了改变[24]。可见,支原体不同分离株的NOX活性不完全一致,同一支原体的NOX酶促活性会随着菌体的老化、传代次数的增大而逐渐降低,这些可能与支原体中NOX蛋白表达量的变化有关。
Muchnik等[18]研究发S. pneumoniae的NOX缺失菌株对肺上皮细胞的黏附能力显著下降,证明NOX可能作为黏附素介导S. pneumoniae对宿主细胞的黏附作用。Ge等[25-26]研究发现,NOX缺失影响血链球菌(Streptococcus sanguinis,S. sanguinis)的生物被膜形成能力,进一步研究发现NOX缺失引起S. sanguinis的口腔竞争能力以及致病力减弱。由此可见,NOX对细菌的氧化应激、菌膜形成、毒力调控及代谢产物生成等生理生化过程产生一系列影响[22]。Western blotting对MSNOX蛋白亚细胞定位分析表明MSNOX蛋白在细胞膜和细胞浆中均有分布,但大部分存在于MS胞浆中,可见其主要在胞浆中发挥代谢酶功能,在细胞膜上少量的存在预示其可能参与MS于宿主细胞的相互作用。
此外,Muchnik等[18]用S. pneumoniae的rNOX免疫小鼠发现其可诱发小鼠对肺炎链球菌产生免疫保护抗体,由于在无氧或有氧的环境下均可激发免疫保护反应,推测rNOX蛋白可作为肺炎链球菌亚单位疫苗的候选抗原。本研究初步证实rMSNOX可激发兔体对rMSNOX蛋白产生较好的免疫应答反应,且能与MS阳性血清反应,其是否能作为免疫保护性抗原或MS病诊断的靶标还有待进一步研究。
由于支原体无细胞壁,支原体的膜蛋白在支原体的粘附入侵宿主细胞以及逃避宿主免疫系统的识别方面扮演着重要角色。本研究对MS的NOX蛋白的酶学活性进行了研究,证实重组表达的MSNOX蛋白具有NADH氧化酶的活性,且免疫原性和亚细胞定位分析证实其不仅在MS胞浆中分布,也是MS膜表面分布的免疫原性蛋白。该研究为进一步探索NOX在MS致病过程中的作用提供了分子基础,为解析MS的致病分子机制提供了新的研究思路。
| [1] |
Liu T. Isolation, identification of Mycoplasma synoviae and development of multiplex PCR assay for detection of avian mycoplasma, Escherichia coli and Salmonella[D]. Taian: Master's Thesis of Shandong Agricultural University, 2016 (in Chinese) 刘婷.鸡滑液囊支原体JS1株的分离鉴定及禽支原体、大肠杆菌、沙门菌多重PCR检测方法的建立[D].泰安: 山东农业大学硕士论文, 2016 |
| [2] |
Marois C, Savoye C, Kobisch M, et al. A reverse transcription-PCR assay to detect viable Mycoplasma synoviae in poultry environmental samples[J]. Veterinary Microbiology, 2002, 89(1): 17-28. |
| [3] |
Shi XL. Isolation and identification of Mycoplasma synoviae and evaluation of the effect of live-vaccine[D]. Yangling: Master's Thesis of Northwest A & F University, 2018 (in Chinese) 石晓磊.鸡滑液囊支原体的分离鉴定及其活疫苗免疫效果的评价[D].杨凌: 西北农林科技大学硕士论文, 2018 |
| [4] |
Ding MJ. Isolation and identification of Mycoplasma synoviae and its partial biological characteristics[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2013 (in Chinese) 丁美娟.鸡滑液囊支原体的分离鉴定及部分生物学特性研究[D].南京: 南京农业大学硕士论文, 2013 |
| [5] |
Ding MJ, Yin XF, Huang XM, et al. Advances in research of Mycoplams synoviae[J]. China Poultry, 2013, 35(13): 39-41. (in Chinese) 丁美娟, 尹秀凤, 黄显明, 等. 鸡滑液囊支原体病研究进展[J]. 中国家禽, 2013, 35(13): 39-41. DOI:10.3969/j.issn.1004-6364.2013.13.012 |
| [6] |
Bolha L, Benčina D, Cizelj I, et al. Effect of Mycoplasma synoviae and lentogenic Newcastle disease virus coinfection on cytokine and chemokine gene expression in chicken embryos[J]. Poultry Science, 2013, 92(12): 3134-3143. DOI:10.3382/ps.2013-03332 |
| [7] |
Sun SK, Lin X, Chen F, et al. Epidemiological investigation of Mycoplasma synoviae in native chicken breeds in China[J]. BMC Veterinary Research, 2017, 13: 115. DOI:10.1186/s12917-017-1029-0 |
| [8] |
He SB, Tan L, Bao SJ, et al. Prokaryotic expression and membrane localization of aldolase of Mycoplasma gallisepticum[J]. Veterinary Science in China, 2013, 43(1): 42-46. (in Chinese) 何随彬, 谭磊, 包世俊, 等. 鸡毒支原体醛缩酶的原核表达及膜定位鉴定[J]. 中国兽医科学, 2013, 43(1): 42-46. |
| [9] |
Bao SJ, Guo XQ, Yu SQ, et al. Mycoplasma synoviae enolase is a plasminogen/fibronectin binding protein[J]. BMC Veterinary Research, 2014, 10: 223. DOI:10.1186/s12917-014-0223-6 |
| [10] |
Bao SJ. Study on biological characteristics of pyruvic decarboxylase on the surface of Mycoplasma synoviae[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2014 (in Chinese) 包世俊.滑液支原体膜表面丙酮酸脱羧酶的生物学特性研究[D].北京: 中国农业科学院博士论文, 2014 |
| [11] |
Ren F. Study on the biological functions of LDH from Mycoplasma synoviae[D]. Jinzhong: Master's Thesis of Shanxi Agricultural University, 2014 (in Chinese) 任峰.滑液支原体乳酸脱氢酶生物学功能的研究[D].晋中: 山西农业大学硕士论文, 2014 |
| [12] |
Qing SH, Fang BS. Recent progress in research of NADH oxidase[J]. Journal of Huaqiao University (Natural Science), 2011, 32(5): 554-559. (in Chinese) 卿三红, 方柏山. NADH氧化酶的研究进展[J]. 华侨大学学报:自然科学版, 2011, 32(5): 554-559. |
| [13] |
Li LB, Luo Y, Qu LB, et al. Research progress of NADH oxidase[J]. Journal of Henan University of Technology (Natural Science Edition), 2010, 31(4): 80-88. (in Chinese) 李林波, 罗宇, 屈凌波, 等. NADH氧化酶研究进展[J]. 河南工业大学学报:自然科学版, 2010, 31(4): 80-88. |
| [14] |
Khan LA, Miles RJ, Nicholas RAJ. Hydrogen peroxide production by Mycoplasma bovis and Mycoplasma agalactiae and effect of in vitro passage on a Mycoplasma bovis strain producing high levels of H2O2[J]. Veterinary Research Communications, 2005, 29(3): 181-188. DOI:10.1023/B:VERC.0000047506.04096.06 |
| [15] |
Zhao G, Zhang H, Chen X, et al. Mycoplasma bovis NADH oxidase functions as both a NADH oxidizing and O2 reducing enzyme and an adhesin[J]. Scientific Reports, 2017, 7(1): 44. DOI:10.1038/s41598-017-00121-y |
| [16] |
Berčič RL, Slavec B, Lavrič M, et al. Identification of major immunogenic proteins of Mycoplasma synoviae isolates[J]. Veterinary Microbiology, 2008, 127(1/2): 147-154. |
| [17] |
Bao SJ, Ding XQ, Xing XY, et al. Preliminarily analysis of immune-related membrane proteins from Mycoplasma synoviae WVU1853 strain[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(2): 316-323. (in Chinese) 包世俊, 丁小琴, 邢小勇, 等. 滑液支原体WVU1853株免疫相关膜蛋白的初步分析[J]. 畜牧兽医学报, 2017, 48(2): 316-323. |
| [18] |
Muchnik L, Adawi A, Ohayon A, et al. NADH oxidase functions as an adhesin in Streptococcus pneumoniae and elicits a protective immune response in mice[J]. PLoS One, 2013, 8(4): e61128. DOI:10.1371/journal.pone.0061128 |
| [19] |
Zhu PP, Peterkofsky A. Sequence and organization of genes encoding enzymes involved in pyruvate metabolism in Mycoplasma capricolum[J]. Protein Science, 1996, 5(8): 1719-1736. DOI:10.1002/pro.5560050825 |
| [20] |
Bisswanger H. Practical Enzymology[M]. Liu XQ, trans. Beijing: Chemical Industry Press, 2018: 50-52 (in Chinese) 比斯瓦根H.酶学实验手册[M].刘晓晴, 译.北京: 化学工业出版社, 2018: 50-52 |
| [21] |
Wang Y, Qi JJ, Liu T, et al. Subcellular localization and immunogenicity of Fructose-Bisphosphate Aldolase (FBAs) in Mycoplasma synoviae[J]. Microbiology China, 2019, 46(4): 780-789. (in Chinese) 王宇, 祁晶晶, 刘婷, 等. 滑液支原体醛缩酶的亚细胞定位及免疫原性[J]. 微生物学通报, 2019, 46(4): 780-789. |
| [22] |
Wang Y, Ding CC, Qiu JX, et al. Advances in bacterial nox gene[J]. Journal of Microbiology, 2018, 38(5): 112-120. (in Chinese) 王艳, 丁承超, 邱景旋, 等. 细菌nox基因研究进展[J]. 微生物学杂志, 2018, 38(5): 112-120. DOI:10.3969/j.issn.1005-7021.2018.05.018 |
| [23] |
Qi JJ. Comparative genomics and proteomics of Mycoplasma bovis HB0801 and three attenuated strains[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2013 (in Chinese) 祁晶晶.牛支原体HB0801株及其三株传代致弱株的比较基因组学及比较蛋白质组学研究[D].武汉: 华中农业大学博士论文, 2013 |
| [24] |
Aksenov M, Kapitanov AB, Archakov AI. Self-inactivation of NADH-oxidase from Mycoplasma cells during reaction[J]. Biokhimiia, 1988, 53(1): 113-117. |
| [25] |
Ge XC, Shi XL, Shi LM, et al. Involvement of NADH oxidase in biofilm formation in Streptococcus sanguinis[J]. PLoS One, 2016, 11(3): e0151142. DOI:10.1371/journal.pone.0151142 |
| [26] |
Ge XC, Yu Y, Zhang M, et al. Involvement of NADH oxidase in competition and endocarditis virulence in Streptococcus sanguinis[J]. Infection and Immunity, 2016, 84(5): 1470-1477. DOI:10.1128/IAI.01203-15 |
 2020, Vol. 47
2020, Vol. 47




