扩展功能
文章信息
- 裴芳樱, 赵威, 王涛, 王文魁, 齐永华
- PEI Fang-Ying, ZHAO Wei, WANG Tao, WANG Wen-Kui, QI Yong-Hua
- 鼠伤寒沙门氏菌ybiH基因缺失株的构建及其生物学特性
- Construction of a Salmonella typhimurium STΔybiH strain and its biological characteristics
- 微生物学通报, 2020, 47(3): 792-800
- Microbiology China, 2020, 47(3): 792-800
- DOI: 10.13344/j.microbiol.china.190649
-
文章历史
- 收稿日期: 2019-09-24
- 接受日期: 2019-12-27
- 网络首发日期: 2020-01-04
2. 新乡学院医学院 河南 新乡 453003
2. College of Medicine, Xinxiang University, Xinxiang, Henan 453003, China
鼠伤寒沙门氏菌是一种重要的人兽共患病病原菌,具有广泛的宿主谱,发病感染率位于沙门氏菌属的首位,可在多种家禽、家畜及人的肠道中存活,具有重要的公共卫生意义[1-2]。在沙门氏菌感染致病过程中,毒力因子在鞭毛、囊膜、质粒、黏附系统、由沙门氏菌毒力岛SPI-1和SPI-2及其他毒力岛编码的Ⅲ型分泌系统(T3SS)的调节等诸多方面发挥着重要作用[3-4]。
ybiH是一种在鼠伤寒沙门氏菌中尚未表征的独特调节因子,Yamanaka等研究表明[5],在大肠杆菌中,ybiH基因调节双向转录单元ybiH-abhGFSR操纵子和rhlE基因的转录,它们共同参与控制对头孢哌酮和氯霉素的敏感性[5]。目前,关于ybiH基因在鼠伤寒沙门氏菌中的作用研究尚未见报道。因此,本研究通过利用λ-Red同源重组系统敲除鼠伤寒沙门氏菌CVCC541的ybiH基因并构建相应回补株,旨在为进一步研究ybiH基因在鼠伤寒沙门氏菌中的生物学作用提供一定的参考。
1 材料与方法 1.1 菌株、细胞株、质粒及培养条件鼠伤寒沙门氏菌标准菌株CVCC541(ST)、CVCC541-pKD46,RAW 264.7巨噬细胞,质粒pKD4、pKD46、pCP20和表达质粒pGEX-6P-1等,均由本实验室保存。大鼠肠隐窝上皮细胞IEC-6细胞由中国农业大学朱奎教授惠赠。细菌培养时,挑取单菌落接种于LB培养基中,37 ℃、180 r/min条件下培养。DMEM培养基购自Hyclone公司,细胞培养时,使用DMEM培养基(含15%胎牛血清)在37 ℃、5% CO2培养箱中培养。
1.2 主要试剂和仪器总RNA纯化试剂盒购自GeneMark公司;质粒小提试剂盒和琼脂凝胶回收试剂盒购自天根生化科技(北京)有限公司;PCR试剂购自TaKaRa公司;培养基和生化鉴定管购自青岛海博生物技术有限公司;其余常规试剂均为国产或进口分析纯产品。电热恒温培养箱和全温培养振荡器购自上海精宏实验设备有限公司;小型台式高速离心机、梯度PCR仪和实时定量PCR仪购自赛默飞世尔科技公司。
1.3 引物的设计与合成根据GenBank中公布的鼠伤寒沙门氏菌株的基因组序列(NC_003197.2),利用软件Primer Premier 5.0设计特异性引物(表 1)。P1、P2分别由前后两部分组成,5′端为39 bp的ybiH目的基因两侧的同源臂,3′端是与质粒pKD4卡那霉素抗性基因的序列互补。P3、P4引物位于ybiH基因开放阅读框的外侧,用于缺失株的鉴定。P5、P6引物用于扩增ybiH基因完整开放阅读框,构建回补质粒。所有引物均由武汉金开瑞生物工程有限公司合成。
| 引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
扩增片段长度 Amplicon size (bp) |
| P1 | CACCAAGGGCGAGCAGGCGAAAAGTCAGCTCATTGCCGCGTGTAGGCTGGAGCTGCTTC | 1 555 |
| P2 | ACCGTCTGGTAAATCAGCTCCGCTTTTTCTTCATCAAACCATATGAATATCCTCCTTAG | |
| P3 | ACAAGTGCCATTATGAGTCA | 766/250 |
| P4 | ATTGCCAGTCCGATAACG | |
| P5 | CGCGGATCCATGAATATTCCCACCACGAC | 675 |
| P6 | CCGCTCGAGTCAGTCCAGACTCCTTTGC |
利用λ-Red同源重组方法,以质粒pKD4为模板,利用引物P1、P2扩增两侧带有ybiH基因上、下游同源臂的1 555 bp目的片段。PCR反应体系:2×Prime STAR Max Premix 25 μL,上、下游引物(10 μmol/L)各0.5 μL,pKD4质粒1 μL,ddH2O 23 μL。PCR反应条件:98 ℃ 10 s,58 ℃ 5 s,72 ℃ 30 s,30个循环;72 ℃ 10 min;4 ℃保存。在含有1% L-阿拉伯糖的LB培养基中,30 ℃、180 r/min诱导培养CVCC541-pKD46,OD600值达到0.4−0.6时,将其菌液制备成电转化感受态细胞。将打靶片段电转化至CVCC541-pKD46感受态细胞中,转化产物于LB平板(含50 μg/mL的卡那霉素)上37 ℃培养过夜。经PCR筛选出ybiH基因替换缺失株STΔybiH::Kan。将pCP20质粒转入STΔybiH::Kan缺失株中,42 ℃培养消除卡那霉素基因和pCP20质粒,最终获得的菌株为ybiH基因缺失株STΔybiH。
1.5 ybiH基因回补株的构建将提取的鼠伤寒沙门氏菌CVCC541基因组DNA作为模板,以P5、P6为引物扩增ybiH 基因片段。PCR反应体系:2×Prime STAR Max Premix 25 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA片段1 μL,ddH2O 23 μL。PCR反应条件:98 ℃ 10 s,58 ℃ 5 s,72 ℃ 30 s,30个循环;72 ℃ 10 min;4 ℃保存。经过双酶切后,将其连接至pGEX-6P-1表达质粒上,构建回补质粒pGEX-6P-1-ybiH。将获得的回补质粒转化至STΔybiH突变株中,构建回补菌株STΔybiH/pybiH。
1.6 STΔybiH生长特性的鉴定标准菌株ST、缺失菌株STΔybiH、回补株STΔybiH/pybiH接种于LB液体培养基中,37 ℃、180 r/min培养过夜。次日分别复接到新的LB液体培养基中,将细菌浓度调整至OD600为0.05,继续振荡培养,每隔2 h取样,检测其OD600值,连续测定12 h。绘制细菌的生长曲线,比较标准菌株、缺失株与回补株的生长速度差异性。
1.7 STΔybiH运动性的测定将ST、STΔybiH、STΔybiH/pybiH菌液培养至生长对数期,将OD600值调为1.0左右,吸取10 μL的菌液,垂直滴加在含0.5%琼脂的LB半固体平板(回补株含氨苄抗性)上,置于37 ℃培养箱中培养18 h,测量细菌生长圈的直径。
1.8 STΔybiH生化特性的鉴定分别挑取标准菌株ST、缺失菌株STΔybiH、回补株STΔybiH/pybiH单菌落,接种至赖氨酸脱羧酶培养基、靛基质(色氨酸肉汤)、尿素酶、氰化钾、山梨醇、甘露醇、水杨苷、丙二酸盐、枸橼酸盐、卫矛醇半固体和ONPG生化鉴定管,37 ℃培养24 h,观察生化鉴定结果。
1.9 STΔybiH黏附能力与侵袭能力的研究取新鲜培养的标准菌株ST、缺失株STΔybiH、回补株STΔybiH/pybiH,用PBS洗涤3次,去除培养基,调整细菌浓度为107 CFU/mL,备用。取各菌液1 mL加入到9 mL DMEM完全培养基(无抗性)中,37 ℃预热30 min。用PBS将IEC-6或RAW 264.7细胞洗涤3次后,将含有菌液的培养基加入细胞板中,37 ℃培养箱中孵育1 h。用PBS洗涤3次后,再用0.5% Triton X-100在37 ℃培养箱中裂解细胞10 min,将培养板中的细胞裂解液倍比稀释,均匀涂布于LB培养基平板上,37 ℃培养过夜,观察计数。
侵袭实验在菌液孵育1 h后,用PBS洗涤3次,加入添加高浓度抗生素(100 μg/mL庆大霉素)的培养基继续培养1 h后,用0.5% Triton X-100裂解,PBS稀释,涂布于LB培养基平板上,37 ℃培养过夜,观察计数。其中回补株始终使用含有相应抗性的培养基。3组平行实验。
1.10 qRT-PCR检测STΔybiH毒力基因的表达取上述3种菌株的过夜培养物,使用总RNA纯化试剂盒提取RNA,反转录得到cDNA。qRT-PCR检测毒力因子InvA、InvH和SpaP。反应体系为TB Green Premix ExTaq Ⅱ 10 μL,上、下游引物(10 μmol/L)各0.8 μL,ROX Reference Dye Ⅱ 0.4 μL,cDNA 2 μL,ddH2O 6 μL。qRT-PCR的反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.11 细胞内STΔybiH突变株的存活实验研究将24孔板内生长状态良好的RAW 264.7巨噬细胞用无菌PBS洗涤3次。取新鲜培养的标准菌株ST、缺失株STΔybiH、回补株STΔybiH/pybiH,PBS洗涤3次,去除培养基,调整细菌浓度为107 CFU/mL,备用。细菌数量按照100:1的比例感染细胞,在37 ℃、5% CO2的培养箱中培养1 h。使用预热的DMEM洗3次,将游离菌体洗去。加入含庆大霉素(100 μg/mL)的DMEM杀死黏附的细菌,此时计为0 h。在37 ℃、5% CO2的培养箱继续培养2 h,杀死胞外菌。用DMEM洗3次后,然后用含庆大霉素(20 μg/mL)的DMEM继续培养细胞,分别于0、2、4、8、12 h后收集细胞。收集细胞时,将细胞以无菌PBS洗涤,然后加入0.5% Triton X-100裂解细胞,倍比稀释后涂于LB平板,37 ℃培养后菌落计数。以0 h细胞内的菌数作为基数1,计算各菌的胞内存活率,分析3种鼠伤寒沙门氏菌在RAW 264.7巨噬细胞中的胞内存活情况。其中回补株始终使用含有相应抗性的培养基。
1.12 ybiH基因的遗传稳定性挑取STΔybiH缺失株的单菌落接种于LB液体培养基中,连续传代培养。选择第5、10、15、20、25、30代菌液进行PCR鉴定,研究ybiH缺失基因在STΔybiH缺失株中的遗传稳定性。
1.13 STΔybiH缺失株的耐药性检测根据微量肉汤稀释法,以大肠杆菌ATCC25922为质控菌,对标准菌株ST、缺失株STΔybiH的耐药情况进行分析。采用的抗生素为氯霉素、头孢噻肟钠、氟苯尼考、多西环素、阿莫西林、四环素。在37 ℃培养箱中培养12 h,观察各孔,以肉眼观察无菌生长的最低浓度孔为最小抑菌浓度(MIC,μg/mL)。
2 结果与分析 2.1 缺失株STΔybiH的构建利用P1、P2为引物,扩增含有ybiH基因同源序列的目的片段,长度约为1 555 bp,扩增结果与预期结果一致。纯化后将其导入到含有pKD46质粒的鼠伤寒沙门氏菌ST感受态细胞中,使卡那霉素的基因替换目的基因ybiH。经抗性与PCR检测筛选,得到阳性重组子ΔybiH::Kan,进一步将pCP20质粒转化到ΔybiH::Kan菌株中,42 ℃消除卡那霉素基因和pCP20质粒。利用P3、P4引物对所得菌株进行了PCR鉴定(图 1),经测序鉴定确定成功构建了缺失株STΔybiH。

|
| 图 1 STΔybiH缺失株的PCR鉴定 Figure 1 PCR identification of STΔybiH with P3 and P4 注:M:DL2000 DNA Marker;1:缺失株STΔybiH的PCR产物;2:标准株ST的PCR产物. Note:M:DL2000 DNA Marker; 1:Product for ybiH from ΔybiH: ST amplified by PCR; 2:Product for ybiH from standard strain ST amplified by PCR. |
|
|
如图 2所示,以提取的鼠伤寒沙门氏菌ST基因组DNA为模板,利用P5、P6引物扩增ybiH基因片段,并将其连接至表达质粒pGEX-6P-1上,将构建的回补质粒pGEX-6P-1-ybiH转化至STΔybiH突变株中,PCR鉴定结果显示成功构建出回补菌株STΔybiH/pybiH。

|
| 图 2 回补株STΔybiH/pybiH的PCR鉴定 Figure 2 PCR identification of STΔybiH/pybiH with P5 and P6 注:M:DL2000 DNA Marker;1:表达质粒pGEX-6P-1的PCR扩增产物;2:回补株STΔybiH/pybiH的PCR扩增产物. Note: M: DL2000 DNA Marker; 1: Product from pGEX-6P-1 amplified by PCR; 2: Product from STΔybiH/pybiH amplified by PCR. |
|
|
通过测定标准菌株ST、缺失菌株STΔybiH、回补株STΔybiH/pybiH在LB液体培养基中的生长情况,由图 3可知,ybiH缺失株的生长速度略微较快,但差别并不明显,说明ybiH基因的缺失对鼠伤寒沙门氏菌的生长速度稍微有所影响。

|
| 图 3 生长曲线测定 Figure 3 Growth curve determination |
|
|
在LB半固体平板上,标准菌株ST、缺失菌株STΔybiH、回补株STΔybiH/pybiH的运动性差别不大(图 4),由此可知,ybiH基因的缺失不会影响鼠伤寒沙门氏菌的运动性。

|
| 图 4 运动性的测定 Figure 4 Determination of athletic ability |
|
|
表 2结果显示,标准菌株ST、缺失菌株STΔybiH、回补株STΔybiH/pybiH的多个生化反应的结果均相同,表明ybiH基因与鼠伤寒沙门氏菌的代谢过程无关。
| 生化特性 Biochemical characterization |
ST | STΔ ybiH | STΔ ybiH/p ybiH |
| 色氨酸肉汤Tryptophan broth | - | - | - |
| 赖氨酸脱羧酶 Lysine decarboxylase |
+ | + | + |
| 尿素酶Urase | - | - | - |
| 氰化钾Potassium cyanide | - | - | - |
| 山梨醇Sorbic alcohol | + | + | + |
| 甘露醇Mannitol | + | + | + |
| 水杨苷Salicin | - | - | - |
| 卫矛醇半固体 Spear alcohol semisolid |
+ | + | + |
| ONPG | - | - | - |
| 丙二酸盐Malonate | - | - | - |
| 枸橼酸盐Citrate | + | + | + |
| 注:+:阳性;-:阴性. Note: +: Positive; –: Negative. | |||
为了分析ybiH基因对沙门氏菌标准菌黏附与侵袭能力的影响,利用IEC-6细胞和RAW 264.7细胞进行黏附与侵袭试验。由图 5可知,缺失株对IEC-6和RAW 264.7细胞的黏附和侵袭能力明显高于野生株(P < 0.01),互补株的黏附与侵袭能力仅部分恢复。

|
| 图 5 STΔybiH对IEC-6和RAW264.7细胞黏附及侵袭的试验结果 Figure 5 Results of adhesion and invasion of STΔybiH to IEC-6 and RAW 264.7 cells 注:A:对IEC-6细胞的黏附;B:对IEC-6细胞的侵袭;C:对RAW 264.7细胞的黏附;D:对RAW 264.7细胞的侵袭. Note: A: Adhesion to IEC-6 cells; B: Invasion to IEC-6 cells; C: Adhesion to RAW 264.7 cells; D: Invasion to RAW 264.7 cells. |
|
|
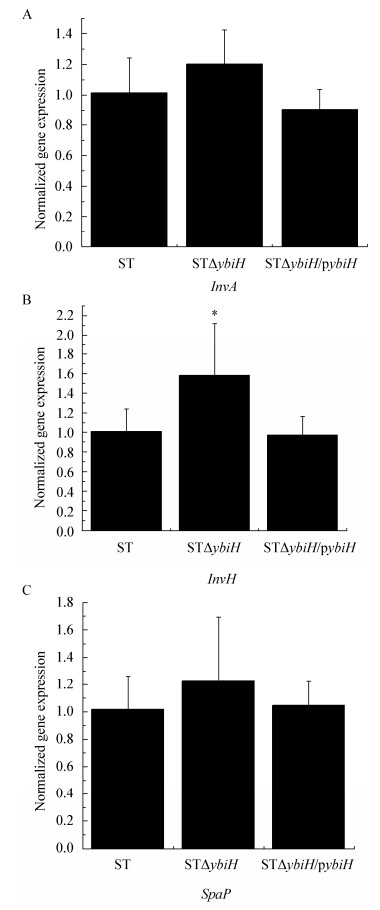
采用qRT-PCR技术对InvA、InvH、SpaP三个毒力基因的表达情况进行分析。如图 6所示,在STΔybiH缺失株中,3个毒力基因的表达均有所上调,其中InvH基因的相对表达量变化得最为明显(P < 0.01)。
|
| 图 6 毒力因子的基因表达情况 Figure 6 Gene expression of virulence factors 注:A:InvA基因的相对表达量;B:InvH基因的相对表达量;C:SpaP基因的相对表达量. *:P < 0.05. Note: A: Relative expression of InvA gene; B: Relative expression of InvH gene; C: Relative expression of SpaP gene. *: P < 0.05. |
|
|
胞内存活实验表明,在感染RAW 264.7细胞12 h后,标准株ST与缺失株STΔybiH的相对存活率差异不显著(图 7),ybiH基因对鼠伤寒沙门氏菌在巨噬细胞中的存活影响不大。

|
| 图 7 鼠伤寒沙门氏菌在RAW 264.7巨噬细胞中的相对存活率 Figure 7 Intracellular survival rate of S. typhimurium in macrophage RAW 264.7 cells |
|
|
缺失株STΔybiH的第5、10、15、20、25、30代菌液,利用引物进行PCR扩增鉴定,结果如图 8所示,表明ybiH基因的缺失在遗传过程中能够稳定遗传。

|
| 图 8 缺失株STΔybiH的PCR鉴定 Figure 8 PCR identification of STΔybiH with P3 and P4 注:M:DL2000 DNA Marker;1:标准株CVCC541的PCR扩增产物;2–8:缺失株STΔybiH的第1、5、10、15、20、25、30代的扩增产物. Note: M: DL2000 DNA Marker; 1: Product from CVCC541 amplified by PCR; 2–8: Product from STΔybiH amplified by PCR. |
|
|
标准株ST和缺失株STΔybiH对抗生素的抑菌效果如表 3所示,缺失株和标准株的最小抑菌浓度并无明显差别。
| 抗生素Antibiotic | ST | STΔ ybiH |
| 氯霉素Chloramphenicol | 1.00 | 1.00 |
| 头孢噻肟钠Cefotaxime Sodium | > 0.03 | > 0.03 |
| 氟苯尼考Florfenicol | > 0.50 | > 0.50 |
| 多西环素Doxycycline | > 2.00 | > 2.00 |
| 阿莫西林Amoxicillin | > 0.25 | > 0.25 |
| 四环素Tetracycline | 1.00 | 1.00 |
沙门氏菌属代表了最常见的食源性病原体,经常从食源性动物中分离出来,这是人类和动物物种(包括鸟类)人畜共患沙门氏菌病的主要原因。鼠伤寒沙门氏菌作为一种宿主泛嗜性菌,是各国分离率最高的菌种之一,其可以使各种动物发生副伤寒,也可以引起人类食物中毒[6]。鼠伤寒沙门氏菌的致病机理主要与其毒力因子有关,目前研究最多的是沙门氏菌致病性岛-1 (SPI-1)编码的第三类分泌系统(T3SS-1)[7],主要成分包括其调节子及分泌性效应蛋白,这些效应蛋白主要参与细胞支架肌动蛋白的重排,帮助细菌入侵上皮细胞[8]。
鼠伤寒沙门氏菌的基因ybiH是一种转录调节子,但其具体功能尚不十分清楚,因此本研究通过λ-Red同源重组技术构建了ybiH基因缺失株及回补株,并对其生物学特性进行了初步探讨。研究结果表明,ybiH基因的缺失不会改变鼠伤寒沙门氏菌的生长速度、运动性以及正常的代谢活动,而且ybiH基因的缺失在遗传过程中能够稳定遗传。在RAW 264.7巨噬细胞胞内存活试验的结果显示,标准株在RAW 264.7细胞中的相对存活率与ybiH基因缺失株的差异不显著,说明ybiH基因的存在对鼠伤寒沙门氏菌在RAW 264.7巨噬细胞中的存活和增殖影响不大。标准株和缺失株对于氯霉素、头孢噻肟钠、氟苯尼考、多西环素、阿莫西林、四环素的耐药性差别也并不明显。
在沙门氏菌对RAW 264.7细胞的侵袭和黏附试验中,STΔybiH缺失株的黏附率为19.9%,ST标准株的黏附率为11.3%,缺失株的黏附率大于标准株。STΔybiH缺失株的侵袭率为13.5%,ST标准株的侵袭率为5.3%,缺失株的侵袭率也明显大于标准株。利用qRT-PCR技术对InvA、InvH、SpaP毒力因子进行检测,STΔybiH缺失株中3种毒力因子的基因表达量都有所上升,尤其是InvH基因的增加更为明显。InvH基因是影响与细胞黏附的主要基因[9],直接反映沙门氏菌的黏附侵袭情况。Aiastui等[10]发现,InvH缺陷型沙门氏菌的入侵能力急剧下降,黏附在细胞表面的细菌数量也急剧减少,表明该基因作为一个重要的毒力因子,其缺失会造成侵袭力的骤降。ybiH基因与鼠伤寒沙门氏菌的黏附侵袭力有关,ybiH基因的缺失会引起InvH基因数量的增加,致使STΔybiH缺失株的黏附侵袭力增加。有数据表明,即使在没有T3SS-1的情况下,沙门氏菌仍然能够侵入上皮细胞和成纤维细胞[11-12],表明存在其他未知的侵袭因子,而ybiH基因是通过参与T3SS-1分泌系统还是调节其他未知的侵袭因子而最终影响细菌侵袭力,仍有待鉴定。
本文通过对ST标准株、STΔybiH缺失株和STΔybiH/pybiH回补株的生物学特性进行比较分析发现,ybiH基因显著影响鼠伤寒沙门氏菌的黏附和侵袭能力及部分毒力基因的表达情况,而该基因的缺失会不会影响鼠伤寒沙门氏菌的致病性,还有待进一步进行分析研究。
| [1] |
Alzwghaibi AB, Yahyaraeyat R, Fasaei BN, et al. Rapid molecular identification and differentiation of common Salmonella serovars isolated from poultry, domestic animals and foodstuff using multiplex PCR assay[J]. Archives of Microbiology, 2018, 200(7): 1009-1016. DOI:10.1007/s00203-018-1501-7 |
| [2] |
Jajere SM. A review of Salmonella enterica with particular focus on the pathogenicity and virulence factors, host specificity and antimicrobial resistance including multidrug resistance[J]. Veterinary World, 2019, 12(4): 504-521. DOI:10.14202/vetworld.2019.504-521 |
| [3] |
Daigle F. Typhi genes expressed during infection or involved in pathogenesis[J]. Journal of Infection in Developing Countries, 2008, 2(6): 431-437. |
| [4] |
Sabbagh SC, Forest CG, Lepage C, et al. So similar, yet so different: Uncovering distinctive features in the genomes of Salmonella enterica serovars Typhimurium and Typhi[J]. FEMS Microbiology Letters, 2010, 305(1): 1-13. DOI:10.1111/j.1574-6968.2010.01904.x |
| [5] |
Yamanaka Y, Shimada T, Yamamoto K, et al. Transcription factor CecR (YbiH) regulates a set of genes affecting the sensitivity of Escherichia coli against cefoperazone and chloramphenicol[J]. Microbiology, 2016, 162(7): 1253-1264. DOI:10.1099/mic.0.000292 |
| [6] |
Lu CP. Veterinary Microbiology[M]. 4th ed. Beijing: China Agricultural Press, 2007: 43. (in Chinese) 陆承平. 兽医微生物学[M]. 4版. 北京: 中国农业出版社, 2007: 43. |
| [7] |
Galán JE, Collmer A. Type Ⅲ secretion machines: bacterial devices for protein delivery into host cells[J]. Science, 1999, 284(5418): 1322-1328. DOI:10.1126/science.284.5418.1322 |
| [8] |
Zhao ZH, Li Q, He XL, et al. Advances in research on pathogenic mechanism of Salmonella typhimurium[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(3): 71-75. (in Chinese) 赵泽慧, 李强, 何小丽, 等. 鼠伤寒沙门氏菌致病机理的研究进展[J]. 黑龙江畜牧兽医, 2017(3): 71-75. |
| [9] |
Crago AM, Koronakis V. Salmonella InvG forms a ring-like multimer that requires the InvH lipoprotein for outer membrane localization[J]. Molecular Microbiology, 1998, 30(1): 47-56. DOI:10.1046/j.1365-2958.1998.01036.x |
| [10] |
Aiastui A, Pucciarelli MG, García-del Portillo F. Salmonella enterica serovar Typhimurium invades fibroblasts by multiple routes differing from the entry into epithelial cells[J]. Infection and Immunity, 2010, 78(6): 2700-2713. DOI:10.1128/IAI.01389-09 |
| [11] |
Radtke AL, Wilson JW, Sarker S, et al. Analysis of interactions of Salmonella type three secretion mutants with 3-D intestinal epithelial cells[J]. PLoS One, 2010, 5(12): e15750. DOI:10.1371/journal.pone.0015750 |
| [12] |
Rosselin M, Abed N, Virlogeux-Payant I, et al. Heterogeneity of type Ⅲ secretion system (T3SS)-1- independent entry mechanisms used by Salmonella Enteritidis to invade different cell types[J]. Microbiology, 2011, 157(3): 839-847. |
 2020, Vol. 47
2020, Vol. 47




