扩展功能
文章信息
- 张之为, 田永伟, 杨剑峰, 王超, 张键, 赵君, 王东, 郑红丽
- ZHANG Zhi-Wei, TIAN Yong-Wei, YANG Jian-Feng, WANG Chao, ZHANG Jian, ZHAO Jun, WANG Dong, ZHENG Hong-Li
- 内蒙古中部地区马铃薯根际和根系丛枝菌根真菌类群的多样性
- Arbuscular mycorrhizal fungi population diversity of rhizosphere soil and root system in potato field in central Inner Mongolia
- 微生物学通报, 2020, 47(3): 738-748
- Microbiology China, 2020, 47(3): 738-748
- DOI: 10.13344/j.microbiol.china.190565
-
文章历史
- 收稿日期: 2019-07-09
- 接受日期: 2019-11-04
- 网络首发日期: 2019-12-07
马铃薯(Solanum tuberosum L.)属于茄科茄属双子叶植物,起源于南美洲的秘鲁和玻利维亚的安第斯山区,因其耐寒、耐旱、耐贫瘠和适应性广的特点,在世界范围被广泛种植,是重要的粮食、饲料、蔬菜兼用作物。我国是世界马铃薯生产大国,其种植面积和总产量位居世界首位。2015年,我国农业部正式发布《关于推进马铃薯产业开发的指导意见》,将马铃薯作为主粮产品进行产业化开发。内蒙古由于其高海拔和夏季冷凉的气候条件成为我国最大的马铃薯种薯、商品薯和加工专用薯的生产基地[1-2]。然而,由于生产中过度地追求马铃薯的产量,导致化学肥料施用过度,从而造成了土壤养分不能被作物有效地吸收利用,氮、磷、钾等营养元素易被土壤固结,由此形成的各种化学盐分在土壤中大量的积累,造成了土壤养分结构的失调,土壤物理性状的恶化。同时,轮作倒茬的困难也使得马铃薯土传病害的发生日益加重,农药的大量施用又造成了土壤的严重污染,从而严重危害马铃薯的产量和品质。因此,提高马铃薯对肥料的利用效率以及利用复合微生物群体控制土传病害的发生,改善土壤结构对于保障马铃薯产业的发展至关重要。
菌根真菌(mycorrhizal fungus)是一类能够侵染植物并与植物形成共生关系的一类真菌[3],通过其发达的根外菌丝提高宿主植物获得土壤水分、矿质营养元素的能力[4]。丛枝菌根真菌(arbuscular mycorrhizal fungus,AMF)是菌根真菌中分布最广泛的一类真菌,能够与世界90%以上的植物形成菌根共生体,并通过调节宿主体内的代谢活动增强植物的抗逆性[5-8]。研究发现,经过AMF处理后,植株对于干旱和盐胁迫的抵抗能力显著增加[9-12]。同时AMF侵染后还能够诱导植物建立局部或者系统抗性,从而提高植物的抗病性[13]。除了在植物抵抗生物或非生物的胁迫具有重要作用,AMF还具有调节植物对于营养元素的吸收能力,经过AMF侵染后,植物对于矿质元素的吸收能力显著提高[14-15]。近些年研究者已经对马铃薯根际和根系内AMF群体多样性方面展开了相应的研究,也取得了一定的进展,如秦越等已经证明了马铃薯土壤中AMF的结构与类群的多样性会受土壤pH、全磷含量及碳水化合物、多聚化合物和胺类化合物的影响,尤其是土壤中速效磷的含量过高会抑制AMF的生长和发育[16]。研究还发现当马铃薯和AMF共生后,促进了马铃薯根系对土壤中磷的吸收和利用,提高了马铃薯的产量和品质[17-18]。彭有才等的研究结果表明,连作会导致土壤中细菌和真菌比例发生变化,进而影响AMF的组成[19]。马玲在马铃薯连作地块研究结果也表明了AMF类群数量会随着连作时间增加而降低[20]。
为了揭示内蒙古马铃薯主产区土壤中AMF的结构与组成,解析马铃薯不同发育阶段以及连作对AMF类群的影响,以内蒙古中部不同地区马铃薯地块中采集的马铃薯的根系及根际土为材料,采用巢式PCR (nested-PCR)技术构建马铃薯根际土壤和根系内AMF的基因文库,研究内蒙古中部地区不同的马铃薯地块、不同马铃薯生育期以及连作对马铃薯根际和根系内AMF类群多样性的影响。
1 材料与方法 1.1 主要试剂和仪器Peasy-Blunt Simple Cloning Kit,北京全式金生物技术有限公司;Power Soil DNA Isolation Kit,MOBIO公司。NanoDrop 2000,Thermo公司;显微镜Olympus CX23,Olympus公司。
1.2 样品采集及处理马铃薯根系及根际土样本于2015年在内蒙古中部不同地区马铃薯地块中进行采集。3个样本采集地点为包头市达茂旗大井村(N41°51′40″,E111°08′10″)、乌兰察布市凉城县徐麻夭村(N40°48′61″,E113°34′50″)和察哈尔右翼后旗红格尔图村(N41°64′20″,E113°13′01″),3个不同地点土壤样本的基本信息见表 1。其中徐麻夭村马铃薯土壤中磷、有效磷、有机质、速效氮、速效钾含量显著高于大井村和红格尔图村的土壤样本,但其氮含量显著低于大井村和红格尔图村,水溶性盐总量和酸碱性与大井村和红格尔图村没有显著性差异。
| 地点 Location |
大井村 Dajing village |
徐麻夭村 Xumayao village |
红格尔图村 Honggeertu village |
| 土壤类型 Soil type |
砂土 Sand |
砂土 Sand |
砂土 Sand |
| 磷Phosphorus (mg/100g) | 50.72 | 59.56 | 48.79 |
| 有效磷 Effective phosphorus (mg/100g) |
34.06 | 48.55 | 23.78 |
| 有机质 Organic matter (%) |
2.73 | 3.20 | 2.81 |
| 酸碱pH | 8.13 | 8.05 | 8.47 |
| 氮Nitrogen (mg/100g) | 138.69 | 85.33 | 173.53 |
| 速效氮 Available nitrogen (mg/kg) |
110.19 | 131.35 | 134.28 |
| 水溶性盐总量 Water-soluble salt (g/kg) |
0.72 | 0.66 | 0.79 |
| 速效钾 Available potassium (mg/kg) |
119.6 | 165.4 | 121.6 |
马铃薯不同生育期根系及根际土样本采自包头市达茂旗大井村,分别为苗期(出苗至顶端出现花蕾)、块茎形成期(现蕾至开始开花)、块茎彭大期(从始花至盛花末期) 3个时期。连作地块马铃薯根系及根际土样本于2015和2016年在察哈尔右翼后旗红格尔图村马铃薯地块中采集。
样本采集时选择马铃薯植株附近根系周围地表 5 cm以下的土壤作为根际土样本,而根系样本采自马铃薯植株的侧根。每个地块采用五点法进行取样,每个取样点设置3次重复。
将所采集的马铃薯根际土晾干后,称取0.5−1.0 g根际土装入50 mL离心管中,然后加入0.1 mol/L (pH 7.0)磷酸缓冲溶液25 mL,旋涡10−30 s。用孔径为100 μm的滤网过滤,12 000 r/min离心2 min后弃上清,加入700 μL磷酸缓冲溶液,混匀后转入2 mL离心管中,−80 ℃保存备用。
将马铃薯根系转入50 mL离心管中,用25 mL磷酸缓冲溶液(pH 7.0)旋涡清洗2次后,转入15 mL离心管,50 Hz超声波30 s间隔清洗10 min。将根系晾干后,挑拣出根中夹杂的杂质后放入2 mL离心管,−80 ℃保存备用。
1.3 染色观察马铃薯根系中定殖的AMF将采自包头市达茂旗大井村、乌兰察布市凉城县徐麻夭村和察哈尔右翼后旗红格尔图村的马铃薯土样,与灭菌的基质以1:2混合,装入花盆,将经过表面消毒的马铃薯种植到花盆中,置于光照培养箱培养3个月,培养条件为温度25 ℃,光周期为16 h光照,8 h黑暗。每个地点设置3个重复。
取培养3个月后的马铃薯须根,置于50%乙醇中保存。染色时将保存的马铃薯须根用自来水清洗干净,剪成1 cm小段,每个地区马铃薯根系样本剪取50个。先置于50 mL 10%的KOH溶液中,90 ℃水浴30 min;然后蒸馏水冲洗3次,滤纸吸干水分,用50 mL碱性H2O2 90 ℃脱色60 min;置于50 mL 5%乙酸中,室温酸化5 min;置于50 mL 5%苔盼兰溶液,90 ℃染色5 min;蒸馏水冲洗后,置于体积比为乳酸:甘油:水=1:1:1的溶液中,用摇床40 r/min脱色10 min,蒸馏水冲洗后置于显微镜下观察并照相。
1.4 土样中微生物DNA的提取与Nested-PCR采用CTAB法提取马铃薯根系中的微生物的总DNA;根际土中微生物DNA的提取采用试剂盒Power Soil DNA Isolation Kit。提取DNA在1.0%琼脂糖凝胶中通过电泳检测其质量,同时利用NanoDrop 2000测定其浓度。
Nested-PCR反应程序:第一次PCR反应条件:98 ℃ 5 min;98 ℃ 10 s,60 ℃ 15 s,72 ℃ 2 min,40个循环;72 ℃ 10 min,扩增片段1.8 kb (SSUmAf-LSUmAr);第二次PCR反应条件:98 ℃ 5 min;98 ℃ 10 s,63 ℃ 15 s,72 ℃ 2 min,30个循环;72 ℃ 10 min,扩增片段1.5 kb (SSUmCf- LSUmBr),引物信息[21]见表 2。
| 引物 Primers |
序列 Sequences (5′→3′) |
| SSUmAf1 | TGGGTAATCTTTTGAAACTTYA |
| SSUmAf2 | TGGGTAATCTTRTGAAACTTCA |
| SSUmCf1 | TCGCTCTTCAACGAGGAATC |
| SSUmCf2 | TATTGTTCTTCAACGAGGAATC |
| SSUmCf3 | TATTGCTCTTNAACGAGGAATC |
| LSUmAr1 | GCTCACACTCAAATCTATCAAA |
| LSUmAr2 | GCTCTAACTCAATTCTATCGAT |
| LSUmAr3 | TGCTCTTACTCAAATCTATCAAA |
| LSUmAr4 | GCTCTTACTCAAACCTATCGA |
| LSUmBr1 | DAACACTCGCATATATGTTAGA |
| LSUmBr2 | AACACTCGCACACATGTTAGA |
| LSUmBr3 | AACACTCGCATACATGTTAGA |
| LSUmBr4 | AAACACTCGCACATATGTTAGA |
| LSUmBr5 | AACACTCGCATATATGCTAGA |
经过第一次PCR反应,利用1%的琼脂糖凝胶电泳检测PCR产物,将片段大小为1.8 kb的PCR产物稀释50倍后,取2 μL用于第二次PCR反应的模板。利用1%的琼脂糖凝胶电泳进行检测,将片段大小为1.5 kb的PCR产物与平末端载体连接(Peasy-Blunt Simple Cloning Kit),构建AMF基因文库。经过蓝白斑筛选后,利用M13F/R引物进行PCR鉴定,然后随机挑取25个克隆进行测序。测序所得序列在NCBI数据库的BLAST程序中进行相似性比对,将与已知AMF类群Glomus (HQ857094,JF439126.1,JF439127.1,JF439125,JF439145,JF439144,AM713411,AM713414)、Entrophospora (FR865447,FR865446.1)、Archaeospora (KC515520.1,KF206453)、Diversispora (KJ850190,KT444714,KT444708,KT444709,KT444710)、Rhizophagus (FR750091,FR750088,HF968989,HF968987,HF968987,JN417514,JN417515,JN417516,JN417518,HE817882,HE817819,HE817822,HE817829,HE817898,HE817986)序列相似度达到97%以上的归为一类,然后统计该类群的AMF个数。
1.6 数据处理Shannon-Wiener指数H=−ΣPilnPi,Simpson指数D=1−ΣPi2;Pielou(si)均匀度指数E=H/Hmax,式中Pi=ni/N,Pi为种的个体数占群落中总个体数的比例,ni为种i的个体数,N为所在群落的所有物种的个体数之和;Hmax为最大的物种多样性指数,Hmax=lnS,S为群落中的总物种数)[22]。采用SAS 9.0进行显著性分析。
2 结果与分析 2.1 不同地点土壤中AMF菌群在马铃薯根系中定殖为了明确3个供试地点采集的土壤样本中是否存在AMF菌群,在温室条件下利用盆栽试验对生长在上述土样中的马铃薯根系进行了染色观察,结果表明在3个不同地点土样中种植的马铃薯根系里均观察到了AMF丛枝状菌丝以及囊泡的存在(图 1),说明这3个地点土壤样本中存在AMF菌群。
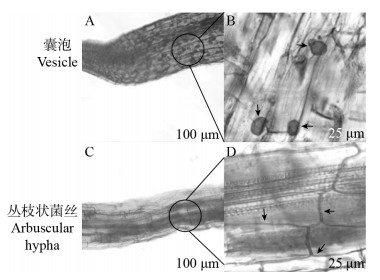
|
| 图 1 利用根系染色检测供试地点土壤样本中存在AMF菌群 Figure 1 Detection of AMF in soil samples from test sites via root dying 注:A、B:AMF在根尖内泡囊及其放大结构;C、D:AMF在根尖内从枝状菌丝及其放大结构. Note: A, B: The vesicles and enlarged structures of AMF in root tip; C, D: The arbuscular hyphae and enlarged structures of AMF in root tip. |
|
|
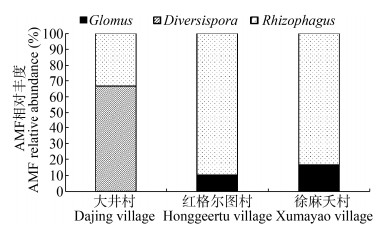
经过测序分析,3个地区根际土中获得53个有效序列,其中大井村17个(Glomus 7个、Entrophospora 5个、Archaeospora 1个、Diversispora 4个),红格尔图村23个(Glomus 5个、Entrophospora 5个、Archaeospora 3个、Diversispora 10个),徐麻夭村13个(Glomus 4个、Entrophospora 4个、Diversispora 5个)。大井村和红格尔图村采集的马铃薯根际土中AMF类群的种类多于徐麻夭村的样本,Glomus、Entrophospora、Archaeospora和Diversispora是大井村和红格尔图村根际土中AMF的主要组成类型,但是在上述两个不同地点的样本中AMF类群的相对丰度却不同,其中Glomus在大井村和红格尔图村的相对丰度分别为41%和22%,Entrophospora分别为29%和22%,Archaeospora分别为6%和13%,Diversispora分别为24%和43%;徐麻夭村根际土样本中AMF只包括Glomus、Entrophospora和Diversispora 3种类型,相对丰度分别为31%、31%和38% (图 2)。从上述结果来看,Glomus是大井村和红格尔图村根际土样中AMF的优势菌群,而徐麻夭村根际土样中的3种不同的AMF类群的分布频率基本相近。

|
| 图 2 不同采样地点马铃薯根际土中AMF类群的组成 Figure 2 The composition of AMF in potato rhizosphere soil at different sites |
|
|
根系中获得56个有效序列,其中大井村18个(Diversispora 12个、Rhizophagus 6个),红格尔图村20个(Glomus 2个、Rhizophagus 18个),徐麻夭村18个(Glomus 3个、Rhizophagus 15个)。3个不同地区马铃薯根系样本中的AMF类群的组成在数量上没有差异,大井村根系样本中的AMF群体主要为Diversispora和Rhizophagus,相对丰度分别为67%和33%;红格尔图村和徐麻夭村根系样本中的AMF类群主要为Glomus和Rhizophagus,两个不同地点根系样本中AMF主要类群的相对丰度分别为10%和17%以及90%和83% (图 3)。
|
| 图 3 不同采样地点马铃薯根系中AMF类群的组成 Figure 3 The composition of AMF in potato root at different sites |
|
|
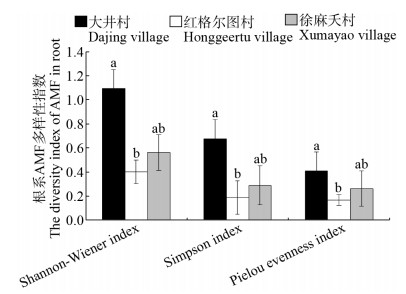
3个不同的采样地点马铃薯根际土和根系中AMF类群的Shannon-Wiener指数、Simpson指数和Pielou均匀度指数测定的结果表明,大井村、红格尔图村和徐麻夭村的根际土中AMF的Simpson指数和Pielou均匀度指数没有显著差异,而红格尔图村样本的Shannon-Wiener指数却显著高于大井村和徐麻夭村样本(图 4)。根系样本测定的结果表明,大井村的AMF类群的Shannon-Wiener指数、Simpson指数和Pielou均匀度指数分别为1.10,0.67和0.41,显著高于红格尔图村(0.40,0.19,0.17)和徐麻夭村(0.56,0.29,0.26)样本测定的结果,而红格尔图村和徐麻夭村供试样本AMF测定的Shannon-Wiener指数、Simpson指数和Pielou均匀度指数之间没有显著差异(图 5)。

|
| 图 4 不同地点马铃薯根际土中AMF多样性指数比较 Figure 4 The diversity index of AMF in potato rhizosphere soil at different place 注:不同字母代表差异显著(P < 0.05),下同. Note: Different letters represent significant differences (P < 0.05), the same below. |
|
|
|
| 图 5 不同地点马铃薯根系中AMF多样性指数比较 Figure 5 The diversity index of AMF in potato root at different place |
|
|
3个时期马铃薯根际土中获得有效序列60个,其中苗期18个(Glomus 12个、Entrophospora 1个、Archaeospora 1个、Diversispora 4个),块
茎形成期22个(Glomus 13个、Archaeospora 2个、Diversispora 7个),块茎膨大期20个(Glomus 13个、Entrophospora 1个、Archaeospora 2个、Diversispora 4个)。马铃薯苗期和块茎膨大期根际土样本中的AMF种类多于块茎形成期的样本,其中苗期和块茎膨大期的AMF类群主要包括Glomus、Entrophospora、Archaeospora和Diversispora 4种类型;其中苗期和块茎膨大期样本中Glomus相对丰度分别为69%和64%,Entrophospora为3%和4%,Archaeospora为6%和12%,而Diversispora为22%和20%。块茎形成期根际土样本中AMF类群只包括Glomus、Archaeospora和Diversispora三种类型,其相对丰度分别为59%、8%和33%。其中,Glomus是马铃薯苗期、块茎形成期和块茎膨大期根际土中AMF的优势菌群(图 6)。

|
| 图 6 马铃薯不同发育阶段根际土中AMF组成的变化 Figure 6 The composition of AMF in potato rhizosphere soil at different development stage |
|
|
3个时期马铃薯根系中获得有效序列57个,其中苗期18个(Glomus 8个、Rhizophagus 10个),块茎形成期18个(Glomus 6个、Rhizophagus 12个),块茎膨大期21个(Glomus 6个、Rhizophagus 15个)。马铃薯不同生育期根系中AMF的种类没有显著的差异,均由Glomus和Rhizophagus组成;苗期样本中的AMF类群的相对丰度分别为44%和56%;块茎形成期的上述AMF类群的相对丰度分别为33%和67%;块茎膨大期的相对丰度分别为29%和71%。Rhizophagus是3个马铃薯不同发育阶段根系中的优势AMF菌群,但是随着马铃薯的生长发育,Rhizophagus类群的相对丰度从苗期的56%增加到块茎膨大期的71%,相应的Glomus类群的相对丰度从苗期的44%下降到块茎膨大期的29% (图 7)。

|
| 图 7 马铃薯不同发育阶段根系中AMF组成的变化 Figure 7 The composition of AMF in potato root at different development stage |
|
|
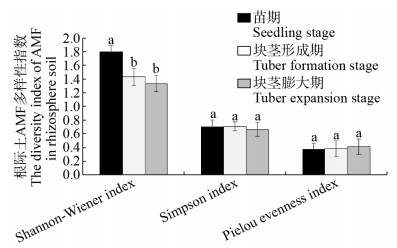
大井村马铃薯不同发育阶段AMF多样性指数的测定结果表明,苗期根际土样本中AMF的Shannon-Wiener指数显著高于块茎形成期和块茎膨大期;而Simpson指数和Pielou均匀度指数在马铃薯的3个不同的发育阶段没有显著差异(图 8)。3个不同发育阶段根系样本中AMF的Shannon- Wiener指数、Simpson指数和Pielou均匀度指数间均没有显著性差异(图 9)。
|
| 图 8 马铃薯不同发育阶段根际土中AMF多样性指数 Figure 8 The diversity index of AMF in potato rhizosphere soil at different development stage |
|
|
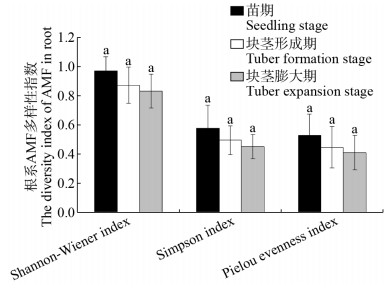
|
| 图 9 马铃薯不同发育阶段根系中AMF多样性指数 Figure 9 The diversity index of AMF in potato root at different development stage |
|
|
为了研究连作对马铃薯根际以及根系内AMF类群的影响,于2015和2016连续两年在大井村进行取样,并对所取样本的根际土和根系内的AMF组成进行研究,测序结果获得有效序列40个,其中2015年17个(Glomus 7个、Entrophospora 5个、Archaeospora 1个、Diversisporae 4个),2016年24个(Glomus 15个、Entrophospora 1个、Archaeospora 3个、Diversisporae 5个)。2015和2016年采集的马铃薯根际土中的AMF类群的组成均包括Glomus、Entrophospora、Archaeospora和Diversisporae个类群。2015年根际土中上述4种不同的AMF类群的组成比例分别为41%、29%、6%和24%;2016年的AMF的比例分别为64%、4%、12%和20%。Glomus和Archaeospora类群的比例随着连作分别增加了17%和6%;Entrophospora和Diversispora相对丰度随着连作相应的分别下降了25%和4% (图 10)。
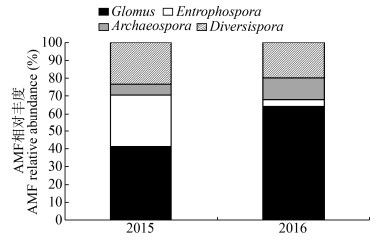
|
| 图 10 连作后马铃薯根际土中AMF组成的变化 Figure 10 The composition of AMF in potato rhizosphere soil after continuous cropping |
|
|
根系内获得有效序列39个,其中2015年21个(Glomus 14个、Rhizophagus 7个),2016年18个(Glomus 5个、Rhizophagus 13个)。连作条件下马铃薯根系内AMF类群只有2种类型,即Glomus和Rhizophagus,两种AMF类群在2015和2016年样本中的相对丰度分别为67%和29%以及33%和71%。随着马铃薯的连作,马铃薯根系中AMF的优势类群从Glomus转变为Rhizophagus (图 11)。由此可见,连作能够显著地影响马铃薯根际土和根系中的AMF类群的变化。

|
| 图 11 连作后马铃薯根系中AMF组成 Figure 11 The composition of AMF in potato root after continuous cropping |
|
|
2015和2016连续两年的连作对马铃薯根际土和根系中AMF的多样性指数测定结果表明,2015年马铃薯根际土中AMF的Shannon-Wiener指数显著高于2016年根际土样本,而Simpson指数和Pielou均匀度指数在2015和2016年之间没有显著差异(图 12)。根系样本中2015和2016两年AMF的Shannon-Wiener指数、Simpson指数和Pielou均匀度指数间均没有显著差异(图 13)。说明马铃薯连作后能够显著地影响根际土中AMF类群的多样性,对根系中AMF的多样性影响较小。
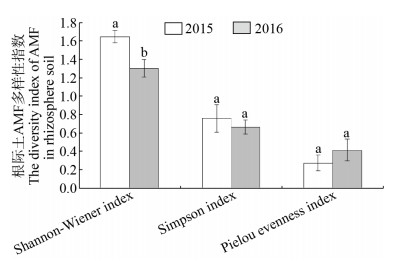
|
| 图 12 连作对马铃薯根际土中AMF群体多样性指数的影响 Figure 12 The diversity index of AMF in potato rhizosphere soil after continuous cropping |
|
|
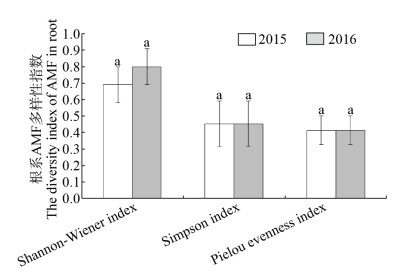
|
| 图 13 连作对马铃薯根系内AMF多样性指数 Figure 13 The diversity index of AMF in potato root after continuous cropping |
|
|
研究表明,土壤中营养成分的组成对土壤微生物的种类和群落影响很大[23]。目前已经证明了土壤中的有机质、氮肥、磷肥和钾肥的组成和含量不同,能够导致土壤中微生物类群的结构和功能发生改变[24-26]。AMF作为土壤中主要的微生物群体,其组成和丰度也会受到土壤中有机质、N、P和K含量的影响。已有的研究发现土壤中N和P的增加会降低大麦和小麦土壤中AMF的丰度[27-28];相反,有机质含量的增加会增加AMF的丰度[29]。本研究的结果表明,内蒙古中部地区的3个不同供试地点马铃薯根际土中AMF的多样性存在一定的差异,其中大井村和红格尔图村根际土中的AMF类群的丰富度要高于徐麻夭村采集的样本(图 2)。3个供试地点土样营养成分测定的结果表明,大井村和红格尔图村马铃薯根际土中的P和K元素的含量高于徐麻夭村,相应的N和有机质含量低于徐麻夭村的样本(表 1),说明根际土中AMF多样性与土壤中P和K元素以及有机质的含量具有一定的相关性,其中P元素含量的增加会降低AMF丰度的报道[27]和本研究得到的结果相一致,即本研究中徐麻夭村样本中的AMF类群数量的减少可能和徐麻夭村马铃薯地块土壤样本中P含量较高有关。本研究中得到的不同地点马铃薯根系中AMF群体多样性没有显著差异的研究结果(图 3),说明土壤中营养元素含量的高低对定殖于马铃薯根系中AMF的多样性没有显著的影响。
在马铃薯的不同发育阶段,其所需营养物质的种类和数量也不同。马铃薯整个生育期内对N的吸收呈现出递减的趋势,对P的吸收高峰出现在出苗后95 d内,K的吸收在块茎膨大初期达到最大值[30]。本研究的结果发现大井村马铃薯苗期和块茎膨大期根际土中AMF类群的类型多于块茎形成期的样本(图 6),可能是由于马铃薯苗期对土壤中的P的吸收利用率较大,从而导致土壤中P含量的大量减少,导致土壤中的AMF类群的丰富度增加;块茎膨大期马铃薯对K的吸收量增加,降低了土壤中K的含量,所以促使AMF类群呈现上升的趋势。通过对比苗期、块茎形成期和块茎膨大期根际土样本中的AMF种类,发现在块茎形成期缺少了Entrophospora类群,而这个时期马铃薯对于P和K的吸收能力都大大降低,导致土壤中积累了更多的P和K,说明Entrophospora类群对于P和K积累的量更为敏感。而苗期、块茎形成期和块茎膨大期根系内AMF的多样性没有显著区别的结果表明(图 7),马铃薯的不同生育期内对土壤中营养元素的吸收能力对定殖在根系内的AMF类群没有显著影响。
马铃薯连作是目前内蒙古马铃薯种植区普遍存在的问题。连作不仅导致马铃薯土传病害发病程度的增加,还会影响土壤中AMF类群的数量和多样性,使得不同的AMF类群所占的比例呈现出明显的变化[19]。本研究结果显示,经过2015和2016连续两年马铃薯连作后,根际土中Glomus和Archaeospora类群的比例随着连作有所增加,而Entrophospora和Diversispora类群的相对丰度相应的有所降低(图 10),Glomus类群在根际土中仍然是优势菌种,这与马玲的研究结果一致[20]。由于连作会导致土壤的pH值改变,相比Entrophospora和Diversispora类群,Glomus类群更能够适应这种土壤酸碱度的变化。但是,在马铃薯根系中连作使得根系中Glomus类群比例下降,同时促使Rhizophagus类群比例增加(图 11)。由于连作后马铃薯根系的分泌物发生变化,使根系中的碳水化合物和氨基酸含量降低[20],相比Rhizophagus类群,Glomus类群中微生物更加依赖碳水化合物和氨基酸,因此影响了Glomus类群中微生物在马铃薯根系的定殖。总之,马铃薯连作会导致其根际土和根系中的AMF类群的数量和多样性均会发生相应的改变,从而影响马铃薯生长和发育,最终影响马铃薯的品质和产量。
| [1] |
Zhao H, Qiao GH, Qi XH, et al. The regional comparative advantages of potato production in Inner Mongolia[J]. Journal of Arid Land Resources and Environment, 2016, 30(2): 128-132. (in Chinese) 赵辉, 乔光华, 祁晓慧, 等. 内蒙古马铃薯生产的比较优势研究[J]. 干旱区资源与环境, 2016, 30(2): 128-132. |
| [2] |
Li ZP. The current situation of potato industry in Inner Mongolia and its restricting factors[J]. Inner Mongolia Agricultural Science and Technology, 2010(6): 7-9. (in Chinese) 李志平. 内蒙古马铃薯产业发展现状及制约因素分析[J]. 内蒙古农业科技, 2010(6): 7-9. DOI:10.3969/j.jssn.1007-0907.2010.06.004 |
| [3] |
Liu RJ, Chen YL. Mycorrhizology[M]. Beijing: Science and Technology Press, 2007. (in Chinese) 刘润进, 陈应龙. 菌根学[M]. 北京: 科技出版社, 2007. |
| [4] |
Smith SE, Read DJ. Mycorrhizal Symbiosis[M]. Cambridge, UK: Academic Press, 2008.
|
| [5] |
Bothe H, Turnau K, Regvar M. The potential role of arbuscular mycorrhizal fungi in protecting endangered plants and habitats[J]. Mycorrhiza, 2010, 20(7): 445-457. DOI:10.1007/s00572-010-0332-4 |
| [6] |
Luo X. Diversity of arbuscular mycorrhizal fungi associated with common wild plants in the drawdown zone of Three Gorges Reservoir[D]. Chongqing: Master's Thesis of Southwest University, 2015 罗协.三峡库区消落带常见野生植物AM真菌多样性研究[D].重庆: 西南大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10635-1015337464.htm |
| [7] |
Xu LJ, Hao ZP, Xie W, et al. Transmembrane H+ and Ca2+ fluxes through extraradical hyphae of arbuscular mycorrhizal fungi in response to drought stress[J]. Chinese Journal of Plant Ecology, 2018, 42(7): 764-773. (in Chinese) 徐丽娇, 郝志鹏, 谢伟, 等. 丛枝菌根真菌根外菌丝跨膜H+和Ca2+流对干旱胁迫的响应[J]. 植物生态学报, 2018, 42(7): 764-773. |
| [8] |
Liu Q, Gao YN, Liu X, et al. Effects of inoculation with arbuscular mycorrhizal fungi and rhizobia on growth of Medicago sativa under saline-alkaline stress[J]. Acta Ecologica Sinica, 2018, 38(17): 6143-6155. (in Chinese) 刘倩, 高娅妮, 柳旭, 等. 混合盐碱胁迫下接种丛枝菌根真菌和根瘤菌对紫花苜蓿生长的影响[J]. 生态学报, 2018, 38(17): 6143-6155. |
| [9] |
Harris-Valle C, Esqueda M, Gutiérrez A, et al. Physiological response of Cucurbita pepo var. pepo mycorrhized by Sonoran desert native arbuscular fungi to drought and salinity stresses[J]. Brazilian Journal of Microbiology, 2018, 49(1): 45-53. DOI:10.1016/j.bjm.2017.04.005 |
| [10] |
Hashem A, Abd_Allah EF, Alqarawi AA, et al. Induction of osmoregulation and modulation of salt stress in Acacia gerrardii Benth. by arbuscular mycorrhizal fungi and Bacillus subtilis (BERA 71)[J]. BioMed Research International, 2016, 2016: 6294098. |
| [11] |
Abd_Allah EF, Hashem A, Alqarawi AA, et al. Enhancing growth performance and systemic acquired resistance of medicinal plant Sesbania sesban (L.) Merr using arbuscular mycorrhizal fungi under salt stress[J]. Saudi Journal of Biological Sciences, 2015, 22(3): 274-283. DOI:10.1016/j.sjbs.2015.03.004 |
| [12] |
Liu ZL, Li YJ, Ma LN, et al. Coordinated regulation of arbuscular mycorrhizal fungi and soybean MAPK pathway genes improved mycorrhizal soybean drought tolerance[J]. Molecular Plant-Microbe Interactions, 2015, 28(4): 408-419. DOI:10.1094/MPMI-09-14-0251-R |
| [13] |
Pozo MJ, Cordier C, Dumas-Gaudot E, et al. Localized versus systemic effect of arbuscular mycorrhizal fungi on defence responses to Phytophthora infection in tomato plants[J]. Journal of Experimental Botany, 2002, 53(368): 525-534. DOI:10.1093/jexbot/53.368.525 |
| [14] |
He ZQ, He CX, Zhang ZB, et al. Physiological study of tomato growth effects induced by different arbuscular mycorihizal fangus (AMF) strains[J]. Journal of Shenyang Agricultural University, 2006, 37(3): 308-312. (in Chinese) 贺忠群, 贺超兴, 张志斌, 等. 不同丛枝菌根真菌对番茄生长及相关生理因素的影响[J]. 沈阳农业大学学报, 2006, 37(3): 308-312. DOI:10.3969/j.issn.1000-1700.2006.03.012 |
| [15] |
Zhang Y, Zeng M, Xiong BQ, et al. Ecological significance of arbuscular mycorrhiza biotechnology in modern agricultural system[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 613-617. (in Chinese) 张勇, 曾明, 熊丙全, 等. 丛枝菌根(AM)生物技术在现代农业体系中的生态意义[J]. 应用生态学报, 2003, 14(4): 613-617. DOI:10.3321/j.issn:1001-9332.2003.04.031 |
| [16] |
Qin Y, Ma K, Liu P. Effect of potato continuous cropping on genetic diversity of soil microorganisms[J]. Chinese Journal of Eco-Agriculture, 2015, 23(2): 225-232. (in Chinese) 秦越, 马琨, 刘萍. 马铃薯连作栽培对土壤微生物多样性的影响[J]. 中国生态农业学报, 2015, 23(2): 225-232. |
| [17] |
Bai DS, Zhang SM, Sun LB. Effect of inoculation of arbuscular mycorrhizal fungi on growth and yield of micro propagated potato[J]. Soil and Fertilizer Sciences in China, 2011(1): 80-82. (in Chinese) 白灯莎·买买提艾力, 张少民, 孙良斌. 接种丛枝菌根真菌对脱毒马铃薯微型薯生长及产量的影响[J]. 中国土壤与肥料, 2011(1): 80-82. DOI:10.3969/j.issn.1673-6257.2011.01.018 |
| [18] |
Kaya C, Higgs D, Kirnak H, et al. Mycorrhizal colonisation improves fruit yield and water use efficiency in watermelon (Citrullus lanatus Thunb.) grown under well-watered and water-stressed conditions[J]. Plant and Soil, 2003, 253(2): 287-292. DOI:10.1023/A:1024843419670 |
| [19] |
Peng YC, Liu T, Zhao JJ, et al. Research advances in effect of continuous cropping on soil characteristics[J]. Acta Agriculturae Jiangxi, 2009, 21(9): 100-103. (in Chinese) 彭有才, 刘挺, 赵俊杰, 等. 连作对土壤性状影响的研究进展[J]. 江西农业学报, 2009, 21(9): 100-103. DOI:10.3969/j.issn.1001-8581.2009.09.033 |
| [20] |
Ma L. Effect of potato's continuous cropping and diversity regulation on soil microorganisms[D]. Yinchuan: Master's Thesis of Ningxia University, 2014 马玲.马铃薯连作栽培及多样性调控对土壤微生物的影响[D].银川: 宁夏大学硕士学位论文, 2014 |
| [21] |
Krüger M, Stockinger H, Krüger C, et al. DNA-based species level detection of Glomeromycota: one PCR primer set for all arbuscular mycorrhizal fungi[J]. New Phytologist, 2009, 183(1): 212-223. DOI:10.1111/j.1469-8137.2009.02835.x |
| [22] |
Xu Q, Zhang F, Xu ZQ, et al. Some characteristics of Simpson index and the Shannon-Wiener index and their dilution effect[J]. Pratacultural Science, 2011, 28(4): 527-531. (in Chinese) 许晴, 张放, 许中旗, 等. Simpson指数和Shannon-Wiener指数若干特征的分析及"稀释效应"[J]. 草业科学, 2011, 28(4): 527-531. |
| [23] |
Enwall K, Nyberg K, Bertilsson S, et al. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil[J]. Soil Biology and Biochemistry, 2007, 39(1): 106-115. DOI:10.1016/j.soilbio.2006.06.015 |
| [24] |
Crecchio C, Gelsomino A, Ambrosoli R, et al. Functional and molecular responses of soil microbial communities under differing soil management practices[J]. Soil Biology and Biochemistry, 2004, 36(11): 1873-1883. DOI:10.1016/j.soilbio.2004.05.008 |
| [25] |
Clegg CD, Lovell RDL, Hobbs PJ. The impact of grassland management regime on the community structure of selected bacterial groups in soils[J]. FEMS Microbiology Ecology, 2003, 43(2): 263-270. DOI:10.1111/j.1574-6941.2003.tb01066.x |
| [26] |
Cruz AF, Hamel C, Hanson K, et al. Thirty-seven years of soil nitrogen and phosphorus fertility management shapes the structure and function of the soil microbial community in a Brown Chernozem[J]. Plant and Soil, 2009, 315(1/2): 173-184. |
| [27] |
Jense A, Jakobsen I. The occurrence of vesicular-arbuscular mycorrhiza in barley and wheat grown in some Danish soils with different fertilizer treatment[J]. Plant and Soil, 1980, 55(3): 403-414. DOI:10.1007/BF02182701 |
| [28] |
Oehl F, Sieverding E, Mäder P, et al. Impact of long-term conventional and organic farming on the diversity of arbuscular mycorrhizal fungi[J]. Oecologia, 2004, 138(4): 574-583. DOI:10.1007/s00442-003-1458-2 |
| [29] |
Gryndler M, Larsen J, Hršelová H, et al. Organic and mineral fertilization, respectively, increase and decrease the development of external mycelium of arbuscular mycorrhizal fungi in a long-term field experiment[J]. Mycorrhiza, 2006, 16(3): 159-166. DOI:10.1007/s00572-005-0027-4 |
| [30] |
Feng Y, Meng ML, Ma H, et al. Absorption and distribution of N, P, K and S in various varieties of potato[J]. Chinese Potato Journal, 2008, 22(4): 205-209. (in Chinese) 冯琰, 蒙美莲, 马恢, 等. 马铃薯不同品种氮、磷、钾与硫素吸收规律的研究[J]. 中国马铃薯, 2008, 22(4): 205-209. DOI:10.3969/j.issn.1672-3635.2008.04.004 |
 2020, Vol. 47
2020, Vol. 47




