扩展功能
文章信息
- 林标声, 陈小红, 何玉琴, 罗茂春
- LIN Biao-Sheng, CHEN Xiao-Hong, HE Yu-Qin, LUO Mao-Chun
- 固氮菌Klebsiella variicola GN02基因序列及其分泌胞外多糖的相关特性
- Gene sequence of nitrogen-fixing bacteria Klebsiella variicola GN02 and its association with exopolysaccharide secretion
- 微生物学通报, 2020, 47(3): 727-737
- Microbiology China, 2020, 47(3): 727-737
- DOI: 10.13344/j.microbiol.china.190534
-
文章历史
- 收稿日期: 2019-06-28
- 接受日期: 2019-09-23
- 网络首发日期: 2019-11-04
2. 预防兽医学与生物技术福建省高等学校重点实验室 福建 龙岩 364012;
3. 福建农林大学生命科学学院 福建 福州 350002;
1. College of Life Sciences, Longyan University, Longyan, Fujian 364012, China
2. Key Laboratory of Fujian University Preventive Veterinary Medicine and Biotechnology, Longyan;
3. Fujian 364012, China;
1. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
植物内生固氮菌(endophytic diazotroph)是指能在健康植物体内定殖,并与宿主植物行联合固氮的一类微生物[1-2],Klebsiella variicola GN02菌株为本实验室从禾本科植物巨菌草(Pennisetum giganteum z.x.lin)成熟期根部中分离得到的一株具有较高固氮酶活性和良好促生性能的内生固氮菌,属于克雷伯氏菌属(Klebsiella)细菌;实验室前期小鼠经口毒性和大鼠经皮毒性试验证明[3],该菌株安全、无毒、不是临床上流行肺炎克雷伯氏菌(Klebsiella pneumoniae)已有分型的强毒力菌株,可在农业上使用。多年的研究表明,K. variicola是一种常见的与植物联合的固氮菌,普遍分布于甘蔗、玉米、水稻等禾本科植物的根部及土壤中,其与植物在长期进化和系统发育过程中建立了一种联合的关系,是一种丰富的联合固氮微生物资源[4-5]。虽然克雷伯氏菌属的几种菌株是重要的条件致病菌和医源性感染菌,但在农业微生物和工业污染治理等方面的研究表明,克雷伯氏菌对植物本身不表现致病性,而且还是一种绿色菌肥和高效净化剂[6-7]。植物内生固氮菌在植物联合固氮体系中发挥了重要的作用,研究表明一些内生固氮菌不仅能分泌氮相关化合物(如铵态氮)为植物生长提供充足的氮素,还能分泌出一些胞外多糖参与了植物促生过程的调控[8];但一直以来人们更多关注的是这些内生固氮菌主要固氮相关基因nifH的表达[9-10]、泌氨量多少等[11],对其所分泌的胞外多糖特性、相关基因及表达蛋白的研究较少。克雷伯氏菌属细菌的胞外多糖中包含荚膜多糖和分泌到细胞外的粘液多糖[12-13],这些胞外多糖对于细菌养分集聚、提高抗逆性、趋化性和表面粘附等均具有良好的促进作用。在植物促生长方面,微生物胞外多糖可通过影响土壤物理、化学和生物学性质从而实现提高宿主植物钾肥的利用效率[14];胞外多糖还具有粘合作用,胞外多糖在土壤环境中可将菌体与土壤颗粒或其它物质粘接起来,有利于协调作物生长的微环境[15];此外,胞外多糖还能充当微生物菌株与宿主植物之间信号分子识别的桥梁作用[16]。克雷伯氏菌属细菌虽然在医学临床上属于致病菌,但研究表明,克雷伯氏菌属细菌的胞外多糖对人体却是安全的,1988年Cross等就报道了可用克雷伯氏菌特异性荚膜多糖制备人类疫苗[17]。
因此,本文以K. variicola GN02菌株为材料,运用基于Illumina MiSeq测序平台的第二代测序技术和基于PacBioRS Ⅱ测序平台的第三代单分子测序技术相结合的方法对其进行全基因组测序分析和注释,寻找K. variicola GN02菌株中与多糖合成、分泌相关的基因及蛋白,并对其所分泌的胞外多糖进行理化性质、结构特性分析,对固氮菌胞外多糖的特性进行深入分析,以期能为进一步深入探究克雷伯氏菌属固氮菌胞外多糖与宿主植物的相关性研究奠定理论基础。
1 材料与方法 1.1 菌株K. variicola GN02,本实验室从巨菌草成熟期根部分离,经本实验室对其进行菌落形态、16S rRNA基因测序和促生性能鉴定后在中国(北京)普通微生物菌种保藏管理中心保藏(编号:CGMCC 1.13619)。
1.2 培养基Ashby无氮培养基(g/L):甘露醇10.0,KH2PO4 0.2,MgSO4·7H2O 0.2,NaCl 0.2,CaSO4·2H2O 0.1,CaCO3 5.0,琼脂20.0,pH 7.0−7.2。
糖发酵培养基(g/L):葡萄糖10.0,酵母浸粉0.2,MgSO4·7H2O 0.2,(NH4)2HPO4 1.0,KCl 0.2,0.04%溴甲酚紫15 mL,pH 7.0−7.2。
1.3 主要试剂和仪器溴化十六烷基三甲铵(hexadecyl trimethyl ammonium bromide,CTAB),北京索莱宝科技有限公司;DNA marker、聚合酶等,宝生物工程(大连)有限公司;引物合成,上海派森诺生物科技股份有限公司。
PCR仪、测序仪,Applied Biosystems公司;红外光谱仪,岛津(中国)有限公司;紫外光谱仪,尤尼柯(上海)仪器有限公司;全自动旋光仪,上海佳航仪器仪表有限公司;数字式粘度计,上海平轩科学仪器有限公司。
1.4 K. variicola GN02全基因组测序将GN02菌株经Ashby无氮培养基活化、30 ℃、180–200 r/min培养24 h后,4 000 r/min离心10 min收集菌体,经PBS缓冲溶液(pH 7.2)清洗3次后备用。采用CTAB法提取细菌基因组总DNA,以满足全基因组测序DNA量,提取方法参照杨琦玥等[18]的方法进行。引物为F (5′-AG AGTTTGATCCTGGCTCAG-3′)和R(5′-CTACGGC TACCTTGTTAC GA-3′)。PCR反应体系(25 μL):基因组DNA (5 ng/μL) 1.0 μL,5×Q5反应缓冲液5.0 μL,Q5聚合酶(5 U/μL) 0.25 μL,5×Q5 High GC Enhance 5.0 μL,dNTPs (10 mmol/L) 2.0 mL,引物F (10 μmol/L) 1.5 μL,引物R (10 μmol/L) 1.5 μL,ddH2O 8.75 μL。PCR反应条件:98 ℃ 3 min;98 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,24个循环;72 ℃ 5 min。GN02菌株全基因组测序采用了WGS (whole genome shotgun)策略,首先构建出具有不同插入片段的文库,再运用基于Illumina MiSeq测序平台的第二代测序技术和基于PacBioRS Ⅱ测序平台的第三代单分子测序技术相结合的方法对其进行全基因测序分析。测序工作由上海派森诺生物科技股份有限公司完成。对所获得的高通量测序数据采用SPAdes genome assembler V3.11.1软件对经过Kmer校正的数据进行拼接、组装,构建GN02菌株全基因组信息,进行基因组分析和功能注释。具体参照Liu等[19]的方法进行,寻找K. GN02菌株中与多糖合成、分泌相关的基因及蛋白。
1.5 K. GN02菌株胞外多糖提取及理化性质、结构的解析 1.5.1 胞外多糖的提取将GN02菌株在Ashby无氮培养基上活化后,取对数生长期的菌液按1%接种量接种到糖发酵培养基中进行摇床培养产糖,30 ℃、180 r/min培养48 h。培养结束后,4 000 r/min离心10 min取菌液100 mL,随后浓缩至30 mL左右,加3倍体积95%乙醇沉淀多糖,4 ℃冰箱静置过夜、4 000 r/min离心15 min,收藏沉淀,依次用无水乙醇、丙酮、乙醚洗涤后进行低温干燥。对低温干燥的GN02菌株分泌的胞外多糖称重,计量多糖提取率。
1.5.2 胞外多糖的理化性质鉴定观察所提取胞外多糖的形状、颜色、气味等;取多糖样品溶解于水、乙醇、乙醚、丙酮等有机溶剂中,分析其溶解性能;将提取的多糖分别进行AgNO3、茚三酮反应、碘一碘化钾、硫酸甲萘酚、硫酸蒽酮溶液反应,判定其多糖的反应特性。
配制0.167 mg/mL的多糖水溶液,采用紫外光谱仪对配制的多糖溶液进行紫外光谱分析,扫描范围200−400 nm,检测提取多糖的纯度。
配置10 mg/mL多糖溶液,经SephadesG-200层析柱层析,与已知分子量多糖标准品洗脱体积比较计算所提取的GN02菌株多糖分子量。
配置1% GN02胞外多糖溶液,采用自动指示旋光仪和数字黏度计测定该多糖溶液的比旋度和特性黏度。其中,比旋度的计算公式:
[α]=α/(C×L)
其中:α表示溶液测得的旋光度,C表示溶液的浓度(单位:g/100 mL),L表示测定管长度(dm),20 cm的样品管。
1.5.3 胞外多糖的结构鉴定多糖的组分采用薄层层析法[20];糖苷键分析采用高碘酸氧化法及Smith降解法[21];多糖结构的解析采用红外光谱仪扫描[22]。
2 结果与分析 2.1 K. variicola GN02菌株测序基本信息GN02菌株经Illumina MiSeq测序平台二代、PacBioRS Ⅱ测序平台三代测序,去除冗余序列后,拼接的序列总长度为5 599 366 bp,(G+C)mol%含量为57.41%;共有开放阅读框(open reading frame,ORF)数5 261个,ORF总长度4 867 812 bp,(G+C)mol%含量58.70%;蛋白质编码基因功能注释:在不同的数据库比对,NR数据库有5 173条蛋白编码基因,eggNOG数据库4 908条、KEGG数据库3 226条、Swiss-Prot数据库4 491条、GO数据库4 189条。经上述基因功能注释后,将测序原始数据上传至NCBI数据库,获得NCBI GenBank BioProject ID:CP31061。
将所获得的GN02菌株序列信息与NCBI上已同样完成基因序列分析的具有固氮作用的K. pneumonia 34菌株比较(表 1),两者在基因组大小、(G+C)mol%含量、蛋白编码序列、平均蛋白质编码区(sequence coding for aminoacids in protein,CDS)大小和RNA基因数目等方面均较为相似,表明GN02菌株具有Klebsiella属细菌的典型基因组特征。但在GN02菌株未发现质粒,表明GN02菌株在巨菌草宿主体内,其在进化过程中可能丢失或新获得了一些不同的基因,导致了GN02菌株特有的遗传特性[23]。
| 项目Item | GN02 | K. pneumoniae 34 |
| 来源Source | 巨菌草Pennisetum giganteum z.x.lin | 玉米Corn |
| 质粒数量Number of plasmid | 0 | 2 |
| 基因组大小Genome size (Mb) | 5.60 | 5.64 |
| (G+C)mol% content (%) | 57.41 | 57.29 |
| 蛋白编码序列Protein-coding sequences (bp) | 5 261 | 5 425 |
| 平均CDS大小Average CDS size (bp) | 925.2 | 962.73 |
| 编码区占比Percent of coding region (%) | 86.90 | 88.2 |
| 核糖体RNA操纵子数Number of ribosomal RNA operons | 25 | 25 |
| tRNA数量Number of tRNA | 87 | 88 |
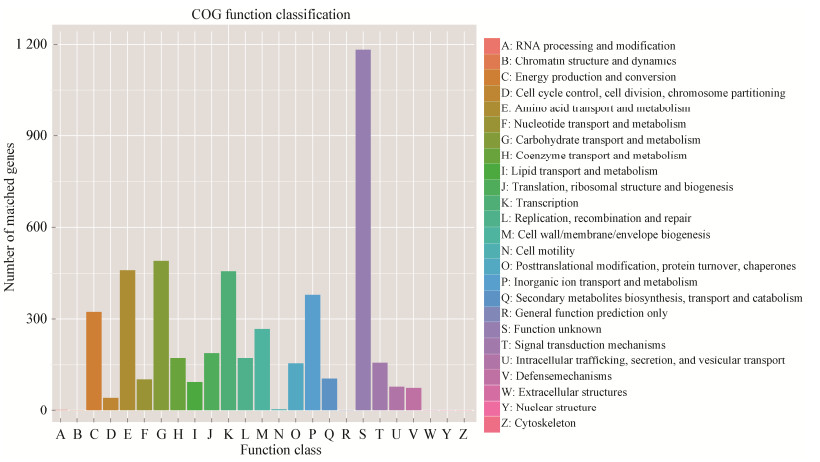
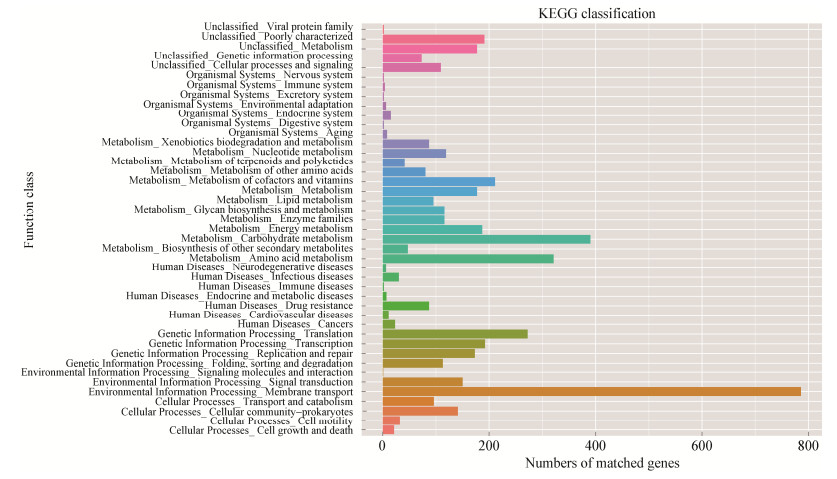
eggNOG分类注释表明,93.29%蛋白编码基因可注释到eggNOG上,其中未知功能(function unknown)基因数量最多,高达1 183条,占全部编码蛋白基因的22.49%;在已知功能基因中,碳水化合物转运和代谢(carbohydrate transport and metabolism)数量最多为490条,占9.31%;其次为氨基酸转运和代谢(amino acid transport and metabolism),460条,占8.74% (图 1)。KEGG注释表明,从代谢通路角度,膜转运(membrane transport)、碳水化合物代谢(carbohydrate metabolism)和氨基酸代谢(amino acid metabolism)相关的基因丰度最高(图 2)。不同数据库的蛋白基因功能注释均表明,GN02菌株广泛参与了碳水化合物代谢(carbohydrate metabolism)和氨基酸代谢(amino acid metabolism)。
|
| 图 1 GN02菌株的eggNOG功能分类 Figure 1 eggNOG functional classification of GN02 strain |
|
|
|
| 图 2 GN02菌株的KEGG分析统计 Figure 2 KEGG analysis and statistics of GN02 strain |
|
|
通过对GN02菌株的全基因组扫描,其多糖代谢相关基因表达蛋白的统计分析如下:共匹配(hit)到21个与多糖相关的基因蛋白,如表 2所示。结果表明,这些多糖相关的基因表达的蛋白大部分是属于菌体结构多糖,如脂多糖合成及代谢相关的蛋白;还发现了与菌体荚膜多糖相关的蛋白CCI74471.1,验证了GN02菌株确实具有荚膜;另外,还发现了与胞外多糖合成及分泌有关的蛋白WP_000727299.1、WP_053065605.1、WP_071582567.1等,表明GN02菌株不仅能起到固氮的作用(其基因组中包含nifHDK等完整的固氮基因群),还能合成分泌胞外多糖,其相关蛋白的分析可为将来植物促生作用的相关性研究提供理论基础依据。
| 匹配蛋白名称 Hit_name |
匹配蛋白描述 Hit_description |
匹配蛋白的长度 Hit_length (bp) |
一致性 Identity (%) |
| WP_064180600.1 | 脂多糖生物合成蛋白双结构域糖基转移酶 Lipopolysaccharide biosynthesis protein, two-domain glycosyltransferase |
256 | 99.61 |
| WP_042947939.1 | 脂多糖庚糖基转移酶Ⅲ Putative lipopolysaccharide heptosyltransferase Ⅲ |
358 | 99.72 |
| ACI07827.1 | 脂多糖1, 2-N-乙酰氨基葡萄糖转移酶 Putative lipopolysaccharide 1, 2-N-acetylglucosaminetransferase |
359 | 100 |
| CCZ99657.1 | 脂多糖生物合成核心蛋白 Putative lipopolysaccharide core biosynthesis protein |
302 | 99.67 |
| WP_064144419.1 | 脂多糖庚糖基转移酶 Lipopolysaccharide heptosyltransferase |
323 | 99.69 |
| WP_072121771.1 | 多糖脱乙酰酶 Putative polysaccharide deacetylase |
318 | 98.11 |
| WP_087833476.1 | 脂多糖ABC转运蛋白底物结合蛋白 Lipopolysaccharide ABC transporter substrate-binding protein |
181 | 100 |
| WP_080897330.1 | 脂多糖质膜分泌蛋白 Lipopolysaccharide exporter periplasmic protein |
191 | 98.95 |
| WP_000727299.1 | 多糖分泌蛋白 Polysaccharide export protein |
378 | 98.41 |
| WP_032420268.1 | 脂多糖生物合成蛋白 Lipopolysaccharide biosynthesis protein |
483 | 96.48 |
| WP_053065605.1 | 胞外多糖生物合成蛋白 Exopolysaccharide biosynthesis protein |
316 | 98.41 |
| BAU58953.1 | ABC-型多糖/多元醇磷酸分泌渗透酶 ABC-type polysaccharide/polyol phosphate export permease |
234 | 100 |
| WP_061154904.1 | 脂多糖组装蛋白 Lipopolysaccharide assembly protein |
389 | 99.74 |
| WP_071582567.1 | 糖蛋白-多糖代谢蛋白 Glycoprotein-polysaccharide metabolism protein |
163 | 99.39 |
| WP_064171244.1 | 多糖脱乙酰酶蛋白家族 Polysaccharide deacetylase familiy protein |
417 | 99.46 |
| WP_049164667.1 | 脂多糖ABC转运蛋白水解酶 Lipopolysaccharide ABC transporter permease |
360 | 99.72 |
| CEL87612.1 | 与生物膜形成相关的假定多糖脱氢酶 Putative polysaccharide deacetylase associated with biofilm formation |
673 | 99.85 |
| WP_046878950.1 | 脂多糖N-乙酰甘露糖尿苷转移酶 Lipopolysaccharide N-acetylmannosaminouronosyl transferase |
246 | 99.59 |
| WP_012969198.1 | 多糖生物合成蛋白 Polysaccharide biosynthesis protein |
416 | 99.76 |
| WP_064169628.1 | 脂多糖生物合成蛋白 Lipopolysaccharide biosynthesis protein |
224 | 99.44 |
| CCI74471.1 | 荚膜多糖的生物合成 Capsular polysaccharide biosynthesis |
349 | 100 |
提取率:100 mL GN02菌株的发酵液中最终获得干燥产品0.69 g,即多糖得率为6.90 g/L。
一般理化性质鉴定:所提取的GN02菌株胞外多糖的理化性质鉴定见表 3,结果表明所提出的产物符合多糖为粉末状样品,易溶解于水,AgNO3反应、硫酸甲萘酚反应、硫酸蒽酮反应阳性,茚三酮反应阴性,符合多糖的基本理化性质特征。GN02菌株胞外多糖与β-葡萄糖苷酶水解反应呈阳性、与α-葡萄糖苷酶水解反应呈阴性,表明该多糖可能是β构型的多糖,而不是α构型。
| GN02菌株胞外多糖 Extracellular polysaccharide of GN02 strain |
反应的结果及现象 Results and phenomena of reaction |
结果判定 Result determination |
| 基本特征Basic feature | 乳白色粉末状、无味、易被空气氧化、氧化后颜色呈棕土色 Milky white powder, tasteless, easy to be oxidized by air, brown soil color after oxidation |
|
| 溶解性Solubility | 易溶于水、不溶于乙醇、乙醚、丙酮 Easy soluble in water, but insoluble in ethanol, ether and acetone |
|
| AgNO3反应AgNO3 reaction | 阳性Positive | 多糖特征性反应 Characteristic reaction of polysaccharide |
| 茚三酮反应Ninhydrin reaction | 阴性Negative | 不含蛋白质成分 Contain no protein components |
| 葡萄糖苷酶水解反应Glycosidase hydrolysis reaction | α-葡萄糖苷酶阴性;β-葡萄糖苷酶阳性 α-glucosidase negative; β-glucosidase posies |
可能是β结构型多糖 Maybe β-structured polysaccharide |
| 硫酸甲萘酚反应Cresol sulfate reaction | 阳性Positive | 多糖特征性反应 Characteristic reaction of polysaccharide |
| 硫酸蒽酮反应Anthranone sulfate reaction | 阳性Positive | 多糖特征性反应 Characteristic reaction of polysaccharide |
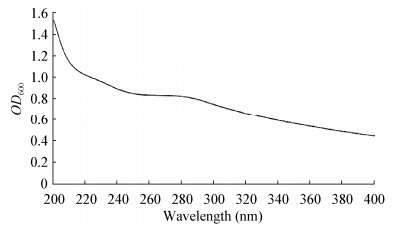
纯度鉴定:GN02菌株胞外多糖紫外光谱分析见图 3,该多糖最大吸收峰位于200 nm处,但未发现有蛋白质(280 nm)和核酸(260 nm)的吸收峰,表明GN02胞外多糖所含的其他杂质较少、多糖的纯度较高。
|
| 图 3 GN02菌株胞外多糖紫外光谱扫描图谱 Figure 3 The ultraviolet spectrum of extracellular polysaccharides extracellular from GN02 strain |
|
|
分子量测定:经SephadesG-200层析柱层析,测定GN02菌株胞外多糖分子量约为1.8×103 Da。
比旋度和特性黏度的测定:GN02菌株胞外多糖比旋度为[α]D25为75°,粘度[η]为80.28。
2.4.2 结构解析多糖组分鉴定:薄层层析色谱分析表明,GN02菌株胞外多糖可能由葡萄糖、半乳糖和甘露糖组成(图 4)。

|
| 图 4 GN02菌株胞外多糖薄层层析色谱图 Figure 4 Thin-layer chromatogram of polysaccharides from GN02 strain 注:1:GN02菌株胞外多糖;2:葡萄糖;3:半乳糖;4:阿拉伯糖;5:甘露糖;6:鼠李糖. Note: 1: Extracellular polysaccharide of GN02 strain; 2: Glucose; 3: Galactose; 4: Arabinose; 5: Mannose; 6: Rhamnose. |
|
|
糖苷键分析:GN02菌株胞外多糖高碘酸氧化法及Smith降解测定结果如表 4所示,多糖样品中检测出甘油和葡萄糖,高碘酸的消耗是甲酸生成量的1.5倍,按Smith降解产物与糖苷键关系判断[15],GN02菌株胞外多糖具有的糖苷键连接可能是(1→3)及(1→6)。
| 样品 Sample |
消耗高碘酸 Consumption of periodate (mL) |
甲酸生产量 Formic acid production (mL) |
高碘酸︰甲酸(平均每摩尔比值) Periodate︰Formic acid (average molar ratio) |
Smith降解产物 Smith degradation products |
| 空白Blank | − | − | − | − |
| GN02菌株胞外多糖 Extracellular polysaccharide of GN02 strain |
25.50 | 0.15 | 3︰2 | 甘油、葡萄糖 Glycerol, glucose |
| 注:−:不能发生反应,无测定数值. Note: −: No reaction can occur and that there was no measured value. |
||||
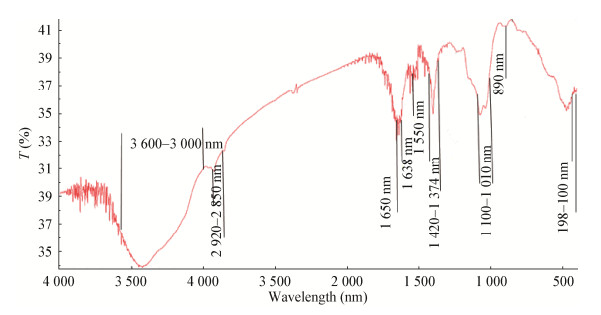
多糖结构解析:GN02菌株胞外多糖红外光谱仪扫描结果如图 5所示,该多糖在波长890 nm处有β多糖的特征吸收峰,结合葡萄糖苷酶水解反应,验证了该多糖为β构型;此外,还发现该多糖在198−100 nm处有氢键振动的吸收频率特征吸收峰;1 100−1 010 nm处有呋喃糖苷特征吸收峰;1 421−1 374 nm有−CH2的变形吸收峰;1 550 nm、1 650 nm处有酯胺特征吸收峰;1 638 nm处有−OH的弯曲振动吸收峰;2 920−2 850 nm处有C−H的伸缩振动峰;3 600−3 000 nm处有−OH、−S振动峰[24]。
|
| 图 5 GN02菌株胞外多糖红外光谱分析图 Figure 5 The infrared spectrum of extracellular polysaccharides from GN02 strain |
|
|
本研究报道了禾本科植物巨菌草内生固氮菌K. variicola GN02菌株的基因序列注释和经典固氮菌K. pneumoniae 34基因注释的比对,表明两者间在基因组大小、(G+C)mol%含量、蛋白编码序列、平均大小和RNA基因数目等方面均较为相似,但是K. variicola GN02内没有质粒。重点分析了K. variicola GN02菌株基因组中许多与氮代谢和多糖合成、分泌相关的基因及其蛋白和胞外多糖的特性。
蛋白质、氨基酸、碳水化合物合成和其代谢活动是菌体细胞的最基本的生命活动。eggNOG和KEGG分类注释表明,K. variicola GN02菌株中有大量的基因广泛参与了C、N代谢的过程。固氮菌所含的固氮酶对氧极其敏感,在一切氧条件下固氮菌的固氮酶均会失活从而丧失了固氮催化反应的能力。因此,某些植物内生固氮菌通过自身演化生成了多种机制来解决其固氮催化反应过程中既需氧又防氧的矛盾[25],如在低氧条件下,有些植物内生固氮菌通过分泌胞外多糖来控制进入固氮菌菌体细胞的氧浓度[8, 26];胞外多糖还能有助固氮菌抵抗干燥、寡营养等不良环境,因此,能高产胞外多糖也成为了固氮菌筛选的一种指标[27]。有研究表明,不同血清型克雷伯氏菌属细菌其胞外多糖的结构和单糖组成不同,其组成的单糖有葡萄糖、半乳糖、岩藻糖、甘露醇等,各单糖链接的糖苷键也不一致,有些多糖的糖链上还携带了乙酰基、丙酮酸、糖醛酸等不同类型的化学基团。
植物内生菌不仅停留在根部,还可以向植物的茎、叶迁移[28-29]。最近研究表明,一旦菌进入植物内部就会使数千个植物基因得到表达,产生多种代谢活动的物质促进植物生长[30]。本研究仅对K. variicola GN02菌株分泌胞外多糖的相关蛋白、理化性质和结构特性进行解析,特别是多糖分泌蛋白WP_000727299.1、WP_053065605.1、WP_071582567.1的发现,有助于进一步了解固氮菌分泌多糖的机理。除此之外,还有很多相关基础研究需要深入,为该菌制作固氮菌肥促进作物生长、提高作物产量奠定坚实基础。
| [1] |
Prakamhang J, Minamisawa K, Teamtaisong K, et al. The communities of endophytic diazotrophic bacteria in cultivated rice (Oryza sativa L.)[J]. Applied Soil Ecology, 2009, 42(2): 141-149. |
| [2] |
Huang SF, Gao C, Liu LH, et al. Research methods and trend of phylogenetic evolution of endophytic diazotrophs[J]. Microbiology China, 2018, 45(1): 181-190. (in Chinese) 黄淑芬, 郜晨, 刘丽辉, 等. 植物内生固氮菌系统发育进化新进展[J]. 微生物学通报, 2018, 45(1): 181-190. |
| [3] |
Lin BS, Chen Y, Luo MC, et al. Research on the toxicity and nitrogen fixation capacity of endophytic nitrogen-fixing bacteria Klebsiella variicola GN02 from Pennisetum sinense Roxb[J]. Jiangsu Agricultural Sciences, 47(24): 258-261. (in Chinese) 林标声, 陈意, 罗茂春, 等. 巨菌草内生固氮菌Klebsiella variicola GN02毒理性与固氮能力[J]. 江苏农业科学, 47(24): 258-261. |
| [4] |
Zhang KK, Xing YX, Shao M, et al. Cloning, prokaryotic expression and proteinpurification of sugarcane endogenous azotobacter klebsiella variicola DX120 Enifk gene[J]. International Research Journal of Natural and Applied Sciences, 2015, 2(6): 69-85. |
| [5] |
Rodríguez-Blanco A, Sicardi M, Frioni L. Plant genotype and nitrogen fertilization effects on abundance and diversity of diazotrophic bacteria associated with maize (Zea mays L.)[J]. Biology and Fertility of Soils, 2015, 51(3): 391-402. DOI:10.1007/s00374-014-0986-8 |
| [6] |
Li MJ, Peng S, Xu SZ, et al. Application of Klebsiella spp. in agriculture and environmental management[J]. Current Biotechnology, 2014, 4(6): 415-420. (in Chinese) 李梦娇, 彭晟, 徐绍忠, 等. 克雷伯氏菌在农业与环境治理上的应用[J]. 生物技术进展, 2014, 4(6): 415-420. DOI:10.3969/j.issn.2095-2341.2014.06.07 |
| [7] |
Lin BS, Wang LF, Zhang KL, et al. Study on effect of interaction between endophytic diazotrophs from Pennisetum sp. and P-releasing bacteria and manufacture of their compound bacterial fertilizer[J]. Jiangsu Agricultural Sciences, 2018, 46(13): 281-283. (in Chinese) 林标声, 汪丽芳, 张凯丽, 等. 巨菌草内生固氮菌与解磷菌互作效应及其混合菌肥制备[J]. 江苏农业科学, 2018, 46(13): 281-283. |
| [8] |
Xu YJ, Zhao LF. The research on rhizobia exopolysaccharides' structure and function[J]. Journal of Shangqiu Vocational and Technical College, 2009, 8(2): 96-98. (in Chinese) 徐亚军, 赵龙飞. 根瘤菌胞外多糖的结构与功能性研究[J]. 商丘职业技术学院学报, 2009, 8(2): 96-98. DOI:10.3969/j.issn.1671-8127.2009.02.033 |
| [9] |
Li JH, Yuan D, Lu JM, et al. Effects of nitrogen fertilizer on the expression of nifH gene of endophytic azotobacter in sugarcane leaves[J]. Biotechnology Bulletin, 2017, 33(7): 100-106. (in Chinese) 李佳慧, 袁丹, 陆建明, 等. 氮肥对甘蔗叶片内生固氮菌nifH基因表达的影响[J]. 生物技术通报, 2017, 33(7): 100-106. |
| [10] |
Sharma S, Singh DK. Temporal variations in diazotrophic communities and nifH transcripts level across the agricultural and fallow land at Jaipur, Rajasthan, India[J]. Indian Journal of Microbiology, 2017, 57(1): 92-99. DOI:10.1007/s12088-016-0634-0 |
| [11] |
Li QJ, Cheng JJ, Sun SX, et al. Isolation, identification and characterization of associative nitrogen-fixing endophytic bacterium Kosakonia radicincitans GXGL-4A in maize[J]. Microbiology China, 2016, 43(11): 2456-2463. (in Chinese) 李琼洁, 程杰杰, 孙帅欣, 等. 玉米联合固氮菌Kosakonia radicincitans GXGL-4A的分离鉴定与固氮特性研究[J]. 微生物学通报, 2016, 43(11): 2456-2463. |
| [12] |
Dou C, Du J, Ji XJ, et al. Research progress in the fermentative production of exopolysaccharides by Klebsiella sp.[J]. China Biotechnology, 2010, 30(12): 123-127. (in Chinese) 窦畅, 杜军, 纪晓俊, 等. 克雷伯氏菌生产胞外多糖的研究进展[J]. 中国生物工程杂志, 2010, 30(12): 123-127. |
| [13] |
Cui NN, Zhao M, Li N, et al. Medium Qptimization and emulsifying property of exopolysaccharide produced by Klebsiella sp. PHRC1.001[J]. Journal of Anhui Agricultural Sciences, 2015, 43(21): 38-42. (in Chinese) 崔娜娜, 赵萌, 李娜, 等. 克雷伯氏菌胞外多糖的发酵培养基优化及乳化性质[J]. 安徽农业科学, 2015, 43(21): 38-42. DOI:10.3969/j.issn.0517-6611.2015.21.015 |
| [14] |
Yan YN. Effect of polysaccharide-producing plant growth-promoting bacteria on potassium unitization of wheat and the mechanism[D]. Nanjing: Master's thesis of Nanjing Agricultural University, 2012 (in Chinese) 闫亚南.产胞外多糖植物促生菌对小麦高效利用钾肥的影响及机制研究[D].南京: 南京农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284495.htm |
| [15] |
Li J. Study and application of a high polysaccharide-producing strain[D]. Guiyang: Master's thesis of Guizhou University, 2006 (in Chinese) 李静.一株多糖高产菌株的研究与应用[D].贵阳: 贵州大学硕士论文, 2006 http://cdmd.cnki.com.cn/Article/CDMD-10657-2006148069.htm |
| [16] |
Wang P. Functional analysis of exopolysaccharide biosynthesis in Mesorhizobium tianshanense-plant host interaction[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2010 (in Chinese) 王鹏.中慢生天山根瘤菌胞外多糖在共生过程中的功能研究[D].南京: 南京农业大学博士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10307-1012271362.htm |
| [17] |
Cross AS, Sadoff JC, Kaufman B, et al. Use of monoclonal antibody combinations in the prevention of bacteremia caused by Escherichia coli O18:K1:H7[J]. Serodiagnosis and Immunotherapy in Infectious Disease, 1988, 2(2): 127-136. DOI:10.1016/0888-0786(88)90046-7 |
| [18] |
Yang QY, Huang Y, Chen YB, et al. Screening of optimal DNA extraction methods and the bacterial community composition of yak rumen revealed by high 16S rRNA throughput sequencing[J]. Scientia Agricultura Sinica, 2017, 50(5): 932-941. (in Chinese) 杨琦玥, 黄勇, 陈亚冰, 等. 16S rRNA高通量测序技术筛选牦牛瘤胃细菌基因组DNA提取方法及菌群结构[J]. 中国农业科学, 2017, 50(5): 932-941. |
| [19] |
Liu JX, Zhao Z, Deng YP, et al. Complete genome sequence of Vibrio campbellii LMB 29 isolated from red drum with four native megaplasmids[J]. Frontiers in Microbiology, 2017, 8: 2035. DOI:10.3389/fmicb.2017.02035 |
| [20] |
Huang SH, Chen QM, Chen RH, et al. Purification and identification of polysaccharide from loquat leaf[J]. Food Research and Development, 2017, 38(4): 42-48. (in Chinese) 黄素华, 陈秋妹, 陈瑞红, 等. 枇杷叶多糖的分离纯化及组分鉴定[J]. 食品研究与开发, 2017, 38(4): 42-48. DOI:10.3969/j.issn.1005-6521.2017.04.010 |
| [21] |
Lin BS. Studies on the fermentation, isolated and determination for physical, chemical and structure characteristics of pachyman[D]. Kaifeng: Master's Thesis of Henan University, 2008 (in Chinese) 林标声.茯苓多糖的发酵、提取及其理化、结构性质鉴定的研究[D].开封: 河南大学硕士学位论文, 2008 http://cdmd.cnki.com.cn/Article/CDMD-10475-2008096635.htm |
| [22] |
Zhu NN, Sun ZR, Qu JX, et al. Analysis and identification of integral structure of Dendrobium officinale Kimura et Migo, Dendrobium nobile Lindl. and Dendrobium chrysotoxum Lindl. and their extracts by infrared spectroscopy[J]. Spectroscopy and Spectral Analysis, 2018, 38(11): 3407-3413. (in Chinese) 朱南南, 孙志蓉, 曲继旭, 等. 三种石斛及其提取物的红外光谱法整体结构解析与鉴定[J]. 光谱学与光谱分析, 2018, 38(11): 3407-3413. |
| [23] |
Fouts DE, Tyler HL, Deboy RT, et al. Complete genome sequence of the N2-fixing broad host range endophyte Klebsiella pneumoniae 342 and virulence predictions verified in mice[J]. PLoS Genetics, 2008, 4(7): e1000141. DOI:10.1371/journal.pgen.1000141 |
| [24] |
Xia CH, Dai Q, Fang W, et al. Research on the IR spectrscopy of kinds of polysaccharide[J]. Journal of Wuhan University of Technology, 2007, 29(1): 45-47. (in Chinese) 夏朝红, 戴奇, 房韦, 等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报, 2007, 29(1): 45-47. |
| [25] |
Zhao YF, Yang F, Zheng YG, et al. The injury of nitrogenase MoFe protein by activated oxygen radicals[J]. Acta Scientiarum Naturalium Universitatis Jilinensis, 1994(4): 78-82. (in Chinese) 赵云峰, 杨峰, 郑莹光, 等. 活性氧自由基对固氮酶(钼铁蛋白)的损伤[J]. 吉林大学自然科学学报, 1994(4): 78-82. DOI:10.3321/j.issn:1671-5489.1994.04.012 |
| [26] |
Fang XJ, You CB. Gene regulation of biosynthesies of acidic exoploysaccharides in diazotrophs[J]. Journal of Agricultural Biotechnology, 1995, 3(1): 21-27. (in Chinese) 方宣钧, 尤崇杓. 固氮菌酸性胞外多糖生物合成的基因调控(综述)[J]. 农业生物技术学报, 1995, 3(1): 21-27. |
| [27] |
Deng C, Du XJ, Huang T, et al. The promotion of proper carbon nitrogen ratio in the synthesis of extracellular polysaccharide by nitrogen-fixing strains WN-F[J]. Biotechnology Bulletin, 2018, 34(3): 194-199. (in Chinese) 邓超, 杜秀娟, 黄涛, 等. 碳氮比对固氮菌株WN-F合成胞外多糖的影响[J]. 生物技术通报, 2018, 34(3): 194-199. |
| [28] |
Chi F, Shen SH, Cheng HP, et al. Ascending migration of endophytic rhizobia, from roots to leaves, inside rice plants and assessment of benefits to rice growth physiology[J]. Applied and Environmental Microbiology, 2005, 71(11): 7271-7278. DOI:10.1128/AEM.71.11.7271-7278.2005 |
| [29] |
Ji KX, Chi F, Yang MF, et al. Movement of rhizobia inside tobacco and lifestyle alternation from endophytes to free-living rhizobia on leaves[J]. Journal of Microbiology and Biotechnology, 2010, 20(2): 238-244. DOI:10.4014/jmb.0906.06042 |
| [30] |
Wu QQ, Peng XJ, Yang MF, et al. Rhizobia promote the growth of rice shoots by targeting cell signaling, division and expansion[J]. Plant Molecular Biology, 2018, 97(6): 507-523. DOI:10.1007/s11103-018-0756-3 |
 2020, Vol. 47
2020, Vol. 47




