扩展功能
文章信息
- 任付平, 王瑶, 林涛, 刘丽敏, 宾枚, 杜慧丽
- REN Fu-Ping, WANG Yao, LIN Tao, LIU Li-Min, BIN Mei, DU Hui-Li
- 一株可乳化降解原油的Compostibacillus的分离及特性
- Isolation and characterization of a hydrocarbon-degrading strain of Compostibacillus
- 微生物学通报, 2020, 47(3): 691-698
- Microbiology China, 2020, 47(3): 691-698
- DOI: 10.13344/j.microbiol.china.190546
-
文章历史
- 收稿日期: 2019-07-03
- 接受日期: 2019-10-29
- 网络首发日期: 2019-11-29
随着人们对石油污染生物修复和微生物提高采油的日益关注,有关各种来源和类型的降解原油菌株的报道层见迭出[1-2]。通过乳化原油改善原油的流动性来提高原油采收率是微生物采油研究的重要内容之一[3-4],对于中高温油藏应用微生物增加采油,需要筛选能在高温条件下乳化降解原油效果好的耐热菌种。目前已报道的可降解原油的耐热菌属有嗜热嗜油杆菌属(Thermoleophilum)、热微菌属(Thermomicrobium)、芽孢杆菌属(Bacillus)、地芽孢杆菌属(Geobacillus)和栖热菌属(Thermus)[5-9]等。堆肥芽孢杆菌属(Compostibacillus)是由Yu等[10]于2015年首次提出并描述,属于厚壁菌门中一个耐热菌属。堆肥芽孢杆菌属现仅包含土壤堆肥芽孢杆菌(Compostibacillus humi)一个种,分离自中国广东堆肥场的淤泥堆肥。本文从华北油田地层水样品中分离得到一株耐热土壤堆肥芽孢杆菌(Compostibacillus humi) BLG74,该菌对原油有良好的乳化降解功能,其特性不同于已报道的土壤堆肥芽孢杆菌菌株,提供了乳化降解原油的新资源。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器氯仿,分析纯AR,佛山予华仪器科技有限公司;甲醇,分析纯AR,上海垒固仪器有限公司;API ZYM、API 50CH,梅里埃公司;石油醚,分析纯,南京化学试剂股份有限公司;TSA培养基,北京奥博星生物技术有限责任公司。
恒温振荡器,江苏太仓精密仪器有限公司;相差显微镜,北京测维光电仪器厂;透射电镜,FEI公司;紫外可见分光光度计,赛默飞世尔科技(中国)有限公司;气相色谱仪,安捷伦公司;表面张力仪,河北承德市鼎盛试验机公司。
1.1.2 培养基富集培养基(g/L):NH4Cl 1.0,NaNO3 2.0,K2HPO4 0.5,Na2SO4 2.0,MgSO4 0.2,Na2CO3 0.5,NaAc 0.2,酵母粉0.5,玉米浆1.0,原油50.0,pH 7.5,固体培养基中加入1.5%的琼脂。
原油降解培养基(g/L):NH4Cl 1.0,NaNO3 2.0,K2HPO4 0.5,MgSO4 0.1,NaCl 10.0,酵母粉2.5,玉米浆5.0,原油50.0,pH 7.5。
玉米浆培养基(g/L):NH4Cl 1.0,NaNO3 2.0,K2HPO4 0.5,MgSO4 0.1,NaCl 10.0,酵母粉2.5,玉米浆5.0,pH 7.5。
1.1.3 菌株来源菌株BLG74分离自华北油田宝力格油区地层水样品。
1.1.4 菌株分离将来自于华北油田的油水样品50 mL接种到装有50 mL富集培养基的摇瓶中,55 ℃、200 r/min振荡培养富集乳化原油的细菌,以此摇瓶中的培养菌液作为菌种,在同样条件下进行多次转接培养。将富集菌液适当稀释,在不含原油的固体富集培养基上进行平板涂布分离,用接种针挑取单菌落接种于富集培养基中确定菌株乳化原油的能力,乳化原油好的菌株保留做进一步研究。
1.2 菌株多相分类鉴定 1.2.1 形态学特征将菌株BLG74在TSA平板上划线培养,获得单菌落,观察其菌落形态,并利用相差显微镜和透射电镜(transmission electron microscope,TEM)观察菌体形态特征。
1.2.2 生长特征在30−65 ℃范围内测定菌株在各个温度下的生长量;在最适生长温度下,测定菌株在不同pH培养基中的生长量;在最适生长温度和最适pH条件下,测定不同NaCl浓度下菌株的生长量,菌株的生长量以OD600表征。
1.2.3 生理生化特征酶活性、碳源利用、糖发酵产酸和部分生化试验分别使用API ZYM、API 50CH鉴定试剂条,按照使用说明进行操作。参照东秀珠等[11]方法测定菌株BLG74的氧化酶、酪蛋白水解、吲哚产生以及硝酸盐还原性质。
1.2.4 化学组成与遗传特征分析(1) 脂肪酸的测定
脂肪酸的测定方法参照Sasser[12]的方法,由中国普通微生物保藏中心(北京,中国)分析测试。
(2) 极性脂的测定
采用氯仿-甲醇抽滤法抽提总脂成分,参考Minnikin等[13]方法使用薄板双相层析方法鉴定极性脂成分。
(3) 遗传特征测定
热变性法测定DNA的(G+C)mol%含量与复性速率法测定DNA/DNA同源性,参照东秀珠等[11]方法进行。参考菌株为土壤堆肥芽孢杆菌菌株(Compostibacillus humi) DX-3。
1.2.5 16S rRNA基因序列分析使用细菌16S rRNA基因通用引物进行菌落PCR,引物序列如下:27f:5′-AGAGTTTGATCCTG GCTCAG-3′;1492r:5′-GGTTACCTTGTTACGAC TT-3′。PCR反应体系及反应条件参照张如等[14]的方法进行,PCR产物送北京擎科公司测序,将得到的序列用GenBank中的BLASTn进行数据库比对,用MEGA 5.2软件包[15]中的Kimura 2-parameter法计算遗传距离,用Maximum-likelihood法构建系统发育树,重复抽样1 000次分析系统树各分支的置信度。
1.3 乳化降解原油特性分析 1.3.1 原油降解率测定用重量法测试菌株对石油的降解率。将筛选出的菌株按1%接种量接到含0.5%原油的培养基中,45 ℃、200 r/min条件下培养,以不接种培养基作对照,各3组平行样。培养一定时间后,向培养液中加入20 mL石油醚,充分振荡后转移到分液漏斗中,静置后将上层溶液收集到已称重的50 mL离心管中。再取10 mL石油醚冲洗三角瓶,将冲洗液转移到分液漏斗中,收集上层溶液于已称重的50 mL离心管中。再取10 mL石油醚冲洗分液漏斗,将冲洗液与前两次的萃取液合并。将收集液置于68 ℃的条件下蒸发掉石油醚,直至残留的石油组分干燥至恒重,称重。石油的降解率计算公式如下:H=(m1−m2)/m1×100%,式中:H为菌株对石油的降解率(%);m1为对照培养基中的残油质量(g);m2为接菌的培养液中的残油质量(g)。
1.3.2 微生物作用前后原油碳组分分析用气相色谱法分析微生物作用前后原油碳组分变化。将筛选出的菌株按1%接种量接到含0.5%原油的培养基中,45 ℃、200 r/min条件下培养,不接种培养基作对照,各3组平行样。培养20 d后,向培养液中加入20 mL二氯甲烷,充分振荡后,转移到分液漏斗中。再取10 mL二氯甲烷冲洗三角瓶也转移至分液漏斗中,摇匀、静置,收集上层溶液至三角瓶中。再取10 mL石油醚冲洗分液漏斗,将冲洗液与前两次的萃取液合并,将3个平行样混合并用无水硫酸钠进行干燥。用气相色谱仪进行原油组分分析。色谱柱:HP-PONA 50 m×0.20 mm×0.5 μm;柱箱温度:初温60 ℃,升温速率6 ℃/min,终温300 ℃,恒温至无峰显示;汽化室温度:300 ℃;检测室(FID)温度:310 ℃;柱内载气(He)流速:1 mL/min;燃气(H2)流量:30 mL/min;助燃气(Air)流量:300 mL/min;尾吹:30 mL/min;氦气纯度:99.99%;氢气纯度:99.9%。
1.3.3 液蜡乳化力的测定取5 mL去除菌体的发酵液上清置于10 mL试管中,再向试管中加入1 mL液体石蜡,剧烈振荡,在室温中静置24 h后观察乳化结果,并测定乳化层高度。乳化力计算方法:E=h2/h1×100%,E为发酵液对液蜡的乳化力(%);h1为液蜡层高度(cm);h2为乳化层高度(cm)。
1.3.4 表面张力值的测定采用环法测定表面张力,发酵液在4 000 r/min离心5 min去除菌体,取适量上清液利用表面张力仪测定表面张力。
2 结果与分析 2.1 菌株分离与形态学特征将华北油田宝力格油区采出水样品用富集培养基进行富集培养,55 ℃、200 r/min振荡培养5−7 d,取富集培养物在固体培养基上进行稀释涂布获得单菌落,将各单菌落接入液体原油降解培养基,55 ℃振荡培养48 h,比较原油乳化效果,得到具有良好乳化原油能力的菌株BLG74。
菌株BLG74在不含原油的玉米浆固体培养基上生长良好,45 ℃培养48 h后菌落呈土黄色圆形,直径2−4 mm,表面湿润,边缘平整。菌株BLG74个体形态如图 1所示,细胞杆状,大小(0.4−0.5)× (2−5) μm,端生膨胀芽孢,周生鞭毛运动,革兰氏染色阳性,兼性厌氧生长。
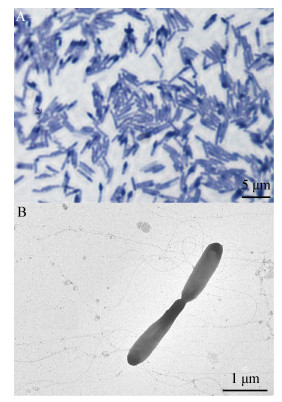
|
| 图 1 菌株BLG74的形态 Figure 1 The morphological of BLG74 注:A:相差显微镜;B:电子显微镜. Note: A: Phase contrast micrograph; B: Electron micrograph. |
|
|
测序得到菌株BLG74的16S rRNA基因序列,含有1 387 bp,其GenBank登录号为KT246122。菌株BLG74的16S rRNA基因序列与GenBank中的序列进行比对,发现与堆肥芽孢杆菌属(Compostibacillus)成员具有较高的序列相似性,用Maximum- likelihood方法构建的系统发育树(图 2)表明与土壤堆肥芽孢杆菌(Compostibacillus humi) DX-3T亲缘关系密切,序列相似性达到了99.6%。

|
| 图 2 菌株BLG74基于16S rRNA基因序列构建的系统发育树 Figure 2 Maximum-likelihood phylogenetic tree based on 16S rRNA gene sequences showing the relationships between strain BLG74 and related species 注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;进化树节点上的数据为Bootstrap值;标尺0.005代表序列间分歧度. Note: Numbers in parentheses represent the accession numbers in the GenBank for the 16S rRNA gene sequences of the strain; Number at notes present bootstrap percentages (based on 1 000 sampling); Bar 0.005 represents sequence divergence. |
|
|
菌株BLG74能在pH 6.5−9.5的条件下生长,最适生长pH 7.0;生长的温度范围为30−60 ℃,最适生长温度45 ℃;最高能耐受7% (质量体积比) NaCl,在含有3% NaCl条件下生长量最高。该菌株不同于已报道[10]的土壤堆肥芽孢杆菌(Compostibacillus humi) DX-3T和GIESS002,这两株菌的最适生长温度为50 ℃,生长pH范围7.0−10.0,最适生长pH 8.0,生长需要NaCl,可在10% (质量体积比) NaCl下生长。
菌株BLG74不能分解淀粉和液化明胶,乙酰甲基甲醇试验(Voges-Prokauer test,V-P)和甲基红实验(methyl red test,MR)、酯酶、脲酶、硫化氢产生、硝酸盐还原为阴性,触媒、氧化酶、吲哚产生、七叶灵水解为阳性;菌株BLG74能够利用D-果糖、D-甘露糖、D-麦芽糖、D-纤维二糖、蔗糖、D-海藻糖、L-阿拉伯糖、甘油、D-核糖、肌醇和D-山梨醇产酸,不能利用D-葡萄糖、D-乳糖、D-半乳糖、D-阿拉伯糖、L-木糖、L-山梨糖、L-鼠李糖、D-棉籽糖、赤藓醇和阿拉伯糖醇。其中明胶液化、吲哚产生、七叶灵水解和部分糖醇产酸特性不同于已报道[10]的土壤堆肥芽孢杆菌(Compostibacillus humi) DX-3T和GIESS002菌株。
菌株BLG74的细胞脂肪酸成分如表 1所示,其主要成分为iso-C15:0 (42.03%),iso-C17:0 (15.00%),iso-C16:0 (9.41%),anteiso-C17:0 (7.96%)和anteiso-C15:0 (7.67%)。极性脂包括二磷脂酰甘油(diphosphatidylglycerol,DPG)、磷脂酰甘油(phosphatidylglycerol,PG)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)和两个未知的氨基磷脂(图 3),显示与已报道的2株土壤堆肥芽孢杆菌(Compostibacillus humi) DX-3T和GIESS002的组成相似。菌株BLG74总DNA的(G+C)mol%为41.1%,与模式菌DX-3T的DNA杂交率为83%±4%,说明菌株BLG74不是堆肥芽孢杆菌属的新种,是属于土壤堆肥芽孢杆菌(Compostibacillus humi)的不同菌株。
| 脂肪酸 Fatty acids |
含量 Content (%) |
| 异式十四碳饱和脂肪酸iso-C14:0 | 1.73 |
| 异式十五碳饱和脂肪酸iso-C15:0 | 42.03 |
| 反异式十五碳饱和脂肪酸anteiso-C15:0 | 7.67 |
| 异式十六碳饱和脂肪酸iso-C16:0 | 9.41 |
| w7c-十六碳单不饱和脂肪酸/w6c-十六碳单不饱和脂肪酸C16:1 w7c/16:1 w6c | 1.88 |
| 十六碳饱和脂肪酸C16:0 | 5.04 |
| 异式十七碳饱和脂肪酸iso-C17:0 | 15.00 |
| 反异式十七碳饱和脂肪酸anteiso-C17:0 | 7.96 |
| 反异式饱和十八碳脂肪酸/w6, 9c-十八碳双不饱和脂肪酸antei-C18:0/C18:2 w6, 9c | 1.22 |
| C-十八碳单不饱和脂肪酸C18:1 w9c W7 | 1.14 |
| C-十八碳单不饱和脂肪酸C18:1 w7c W7 | 2.07 |

|
| 图 3 菌株BLG74极性脂图谱 Figure 3 Polar lipid profile of strain BLG74 by two-dimensional thin layer chromatography 注:DPG:二磷脂酰甘油;PG:磷脂酰甘油;PE:磷脂酰乙醇胺;APL:未知. Note: DPG: Diphosphatidylglycerol; PG: Phosphatidylglycerol; PE: Phosphatidyl ethanolamine; APL: Unknown. |
|
|
菌株BLG74接种于加有原油的TSA培养基和玉米浆培养基中,于45 ℃条件下培养2 d,原油明显被乳化,原油以微滴状态存在,摇动后易于分散在培养基中,而未接菌的对照培养基中原油未见乳化(图 4)。

|
| 图 4 菌株BLG74在TSA培养基(A)和原油降解培养基(B)中培养后原油乳化情况 Figure 4 Emulsification of crude oil by strain BLG74 on TSA medium (A) and corn steep medium (B) 注:A:TSA培养基;B:原油降解培养基. Note: A: TSA medium; B: Corn steep medium. |
|
|
菌株BLG74在含0.5%原油的TSA培养基培养20 d后,原油降解率为61.2%,在含0.5%原油的玉米浆培养基培养20 d后,原油降解率为40.8%。降解效果类似于已有的报道,如王君等[16]从油藏水样中分离出3株高温解烃菌,分别属于Bacillus、Geobacillus和Petrobacter,它们能够在55 ℃兼性厌氧生长,对原油的降解率分别为56.5%、70.01%和31.87%;夏文杰等[17]报道了一株地芽孢杆菌(Geobacillus)在65 ℃培养降解原油达58.5%。虽然菌株BLG74在玉米浆培养基中的生长优于在TSA培养基中,但对原油的降解率却是在TSA中更优,说明该菌对原油的降解效果不仅仅与菌株的生长相关。Rahman等[18]的研究表明,菌株的降解特性会受到原油组成、初始浓度、降解环境条件(温度、pH等)及菌株自身特性等的影响,从而带来降解率方面的差异。气相色谱分析结果表明(图 5),微生物作用后nC13−nC26的含量相对降低,nC10−nC12、nC27−nC32和异构烷烃的含量相对升高,说明菌株BLG74主要降解C26以下的正构烷烃,对异构烷烃无明显降解作用。

|
| 图 5 菌株BLG74作用前后正/异构烷烃分布 Figure 5 Distribution of the n-and iso-alkane before and after the degradation effect of BLG74 |
|
|
考察了菌株BLG74产表面活性剂情况,发酵液离心除菌后表面张力为56.3 mN/m,而空白培养基为60.1 mN/m,表明培养过程中该菌产生表面活性剂特性不明显。菌株BLG74降解原油主要是通过乳化作用实现。
3 讨论与结论本研究自华北油田地层水样品中分离得到一株原油降解菌BLG74,该菌株虽然产表面活性剂特性不明显,但能够很好乳化降解原油。经形态观察、生理生化特性测定及其16S rRNA基因序列和系统发育学分析,鉴定为土壤堆肥芽孢杆菌(Compostibacillus humi),但其一些生理生化特征却与土壤堆肥芽孢杆菌菌株有差异,包括生长条件、明胶液化、吲哚产生、糖醇利用和(G+C)mol%含量等,表明菌株BLG74是不同于已报道[7]的模式菌株DX-3T和菌株GIESS002的Compostibacillus humi中的新菌株(表 2)。目前关于堆肥芽孢杆菌报道仅限于从堆肥中分离鉴定的一个新种[10],该属菌株乳化降解原油的能力未见有报道。菌株BLG74是首次报道分离自油藏环境的堆肥芽孢杆菌属成员,可以在热盐环境下乳化降解原油,增加原油的流动性,展示了在微生物采油过程中的应用潜力,其在原油开采领域的生物学功能及其机制,具有进一步研究的价值。
| 特性 Characteristics |
菌株 Stains |
||
| 1 | 2 | 3 | |
| 温度范围Temperature range for growth (℃) | 30-60 | 30-60 | 30-57 |
| pH范围pH range for growth | 6.5-9.5 | 7.0-10.0 | 7.0-10.0 |
| 最适生长温度Optimal temperature for growth (℃) | 45 | 50 | 50 |
| 最适生长盐度Optimal salinity for growth | 3.0 | 6.0 | 5.5 |
| 最适生长pH值Optimal pH for growth | 7.5 | 8.0 | 8.0-8.5 |
| 60 ℃ | + | + | - |
| 10% NaCl | - | + | - |
| pH 10.0 | - | + | + |
| pH 6.5 | + | - | - |
| 吲哚产生Indole production | + | - | - |
| 明胶液化Hydrolysis of gelatin | - | + | + |
| 七叶灵水解Hydrolysis of esculin | + | - | - |
| 甘油Glycerol | + | - | - |
| D-甘露糖D-mannose | + | - | - |
| D-纤维二塘D-cellobiose | + | - | - |
| D-麦芽糖D-maltose | + | - | - |
| 蔗糖Sucrose | + | - | - |
| D-海藻糖D-trehalose | + | - | - |
| DNA (G+C)mol%含量DNA (G+C)mol% content | 41.1 | 43.7 | 43.2 |
| 注:1:Strain BLG74;2:Compostibacillus humi DX-3T[7];3:C. humi GIESS002[7]. -:阴性;+:阳性. Note: 1: Strain BLG74; 2:Compostibacillus humi DX-3T[7]; 3: C. humi GIESS002[7]. -: Negative; +: Positive. |
|||
| [1] |
van Hamme JD, Singh A, Ward OP. Recent advances in petroleum microbiology[J]. Microbiology and Molecular Biology Reviews, 2003, 67(4): 503-549. DOI:10.1128/MMBR.67.4.503-549.2003 |
| [2] |
Margesin R, Schinner F. Biodegradation and bioremediation of hydrocarbons in extreme environments[J]. Applied Microbiology and Biotechnology, 2001, 56(5/6): 650-663. |
| [3] |
Sen R. Biotechnology in petroleum recovery: the microbial EOR[J]. Progress in Energy and Combustion Science, 2008, 34(6): 714-724. DOI:10.1016/j.pecs.2008.05.001 |
| [4] |
Al-Sayegh A, Al-Wahaibi Y, Al-Bahry S, et al. Microbial enhanced heavy crude oil recovery through biodegradation using bacterial isolates from an Omani oil field[J]. Microbial Cell Factories, 2015, 14: 141. DOI:10.1186/s12934-015-0330-5 |
| [5] |
Zarilla KA, Perry JJ. Thermoleophilum album gen. nov. and sp. nov., a bacterium obligate for thermophily and n-alkane substrates[J]. Archives of Microbiology, 1984, 137(4): 286-290. DOI:10.1007/BF00410723 |
| [6] |
Phillips Jr WE, Perry JJ. Thermomicrobium fosteri sp. nov., a hydrocarbon-utilizing obligate thermophile[J]. International Journal of Systematic Bacteriology, 1976, 26(2): 220-225. DOI:10.1099/00207713-26-2-220 |
| [7] |
Kato T, Haruki M, Imanaka T, et al. Isolation and characterization of long-chain-alkane degrading Bacillus thermoleovorans from deep subterranean petroleum reservoirs[J]. Journal of Bioscience and Bioengineering, 2001, 91(1): 64-70. DOI:10.1016/S1389-1723(01)80113-4 |
| [8] |
Feitkenhauer H, Müller R, Märkl H. Degradation of polycyclic aromatic hydrocarbons and long chain alkanes at 6070 ℃ by Thermus and Bacillus spp.[J]. Biodegradation, 2003, 14(6): 367-372. DOI:10.1023/A:1027357615649 |
| [9] |
Shibulal B, Al-Bahry SN, Al-Wahaibi YM, et al. Microbial enhanced heavy oil recovery by the aid of inhabitant spore-forming bacteria: an insight review[J]. The Scientific World Journal, 2014, 2014: 309159. |
| [10] |
Yu Z, Wen J L, Yang GQ, et al. Compostibacillus humi gen. nov., sp. nov., a member of the family Bacillaceae, isolated from sludge compost[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(2): 346-352. |
| [11] |
Dong XZ, Cai MY. Bacterial Systematic Identification Manual[M]. Beijing: Science Press, 2001: 349-413. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-413. |
| [12] |
Sasser M. Identification of bacteria by gas chromatography of cellular fatty acids[R]. Newark: MIDI Inc, 1990
|
| [13] |
Minnikin DE, O'Donnell AG, Goodfellow M, et al. An integrated procedure for the extraction of bacterial isoprenoid quinones and polar lipids[J]. Journal of Microbiological Methods, 1984, 2(5): 233-241. DOI:10.1016/0167-7012(84)90018-6 |
| [14] |
Zhang R, Fan T, Li M, et al. Isolation, identification and selenite metabolism of a selenium-tolerant endophyte from Cardamine hupingshanensis[J]. Microbiology China, 2018, 45(2): 314-321. (in Chinese) 张如, 樊霆, 李淼, 等. 一株耐硒壶瓶碎米荠内生菌分离、鉴定及其体外硒代谢研究[J]. 微生物学通报, 2018, 45(2): 314-321. |
| [15] |
Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [16] |
Wang J, Ma T, Liu J, et al. Isolation of functional bacteria guided by PCR-DGGE technology from high temperature petroleum reservoirs[J]. Environmental Science, 2008, 29(2): 462-468. (in Chinese) 王君, 马挺, 刘静, 等. 利用PCR-DGGE技术指导高温油藏中功能微生物的分离[J]. 环境科学, 2008, 29(2): 462-468. |
| [17] |
Xia WJ, Dong HP, Yu L. Oil-degrading characterization of thermophilic and halotolerant strain Geobacillus sp. WJ-2[J]. Journal of Central South University (Science and Technology), 2012, 43(1): 8-16. (in Chinese) 夏文杰, 董汉平, 俞理. 嗜热耐盐烃降解菌Geobacillus sp. WJ-2降解原油性能研究[J]. 中南大学学报:自然科学版, 2012, 43(1): 8-16. |
| [18] |
Rahman KSM, Thahira-Rahman J, Lakshmanaperumalsamy P, et al. Towards efficient crude oil degradation by a mixed bacterial consortium[J]. Bioresource Technology, 2002, 85(3): 257-261. DOI:10.1016/S0960-8524(02)00119-0 |
 2020, Vol. 47
2020, Vol. 47




